肠道是人体重要的免疫器官,而肠道中的微生物因其对宿主产生的重要生理功能,例如提供营养,肠黏膜屏障保护作用及免疫抗炎等重要的生理功能,因而对宿主健康也起到关键性作用,从而被称为人体重要的“消化器官”[1]。健康宿主体内的肠道菌群保持动态平衡,但是在内部和外部因素的影响下,这种动态平衡可能会被打破,造成肠道菌群的紊乱。例如,临床上大多抗生素具有广谱杀菌作用,在杀灭病原体的同时还可能会伤害有益菌,这种无差别“攻击”也使得宿主体内的有益菌被抑制或杀灭,从而导致肠道菌群紊乱现象的出现,引发一系列健康问题。如抗生素相关性腹泻(antibiotic-associated diarrhea, AAD)[2]、肥胖、糖尿病及免疫功能降低等[3-5]。
目前应用抗生素构建肠道菌群失调模型被广泛使用,而抗生素的级别、抗菌谱也会影响其效果,例如,YARANDI等[6]使用抑制G+细菌的氨苄青霉素后,发现成年小鼠除了肠道菌群的结构有变化外,其肠神经也受到了损伤。同时VICENTINI等[7]的研究表明广谱抗生素对于小鼠肠神经及肠道结构和功能也具有不同影响。这些结果表明,不同抗菌谱的抗生素服用后,除对宿主肠道菌群有影响外,对宿主的肠神经也具有不同程度的损伤。YARANDI等[6]的研究也发现补充G+细菌后,受损的肠神经可恢复。基于此,本研究拟利用不用抗菌谱的抗生素构建肠动力及肠道菌群失调模型,检测经不同抗生素处理后小鼠肠道结构、功能及肠神经的变化情况,最终通过补充不同来源的益生菌(革兰氏阳性菌),深入研究益生菌在恢复肠道生物屏障、修复肠神经及调节抗生素处理小鼠肠道功能方面的潜力,为开发提升国民健康的新型功能食品提供新的思路。
1 材料与方法
1.1 实验材料与仪器
1.1.1 实验材料
氨苄青霉素、万古霉素、硫酸新霉素、甲硝唑、庆大霉素、PCR扩增引物以及序列合成,生工生物工程(上海)股份有限公司;活性炭粉、阿拉伯树胶、乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸,国药集团化学试剂公司;反转录试剂盒、SYBR Green qPCR Mix、HiScript III RTSuperMix for qPCR试剂盒,南京诺唯赞生物科技有限公司;TRIzol,美国Invitrogen 公司;MP DNA Spin for Faces试剂盒,美国MP Biomedicals公司;Qubit dsDNA BR胶回收试剂盒,美国Biomiga公司。
1.1.2 仪器与设备
真空冷冻干燥机,美国LABCONCO公司;SCIENTZ-48高通量组织破碎仪,宁波新芝生物科技股份有限公司;CFX384荧光定量PCR扩增仪,美国BioRad公司;1300-ISQ GC-MS、RC-BIOS-10落地式离心机,美国Thermo公司;MiSeq高通量测序平台,美国Illumina公司。
1.2 菌株培养活化
本实验所使用的3株两歧双歧杆菌FGSYC45M3(CCFM1163)、FBJCP1M7、FGZ30MM3,均来自并保存于江南大学食品生物技术中心菌种保藏库。
从菌种库中取得菌液,通过接种环蘸取原始菌液,在添加有半胱氨酸的MRS培养基上进行划线纯化,在37 ℃下厌氧培养箱中培养48 h,接种环挑取单菌落接种至添加有半胱氨酸的MRS液体培养基中,37 ℃厌氧培养20 h,再以2.5%接种量进行传代活化并扩大培养,所得培养液于4 ℃,6 000 r/min离心15 min收集菌泥,无菌生理盐水清洗重复收集2次后用10%脱脂乳重悬至5×109 CFU/mL,于-80 ℃条件下保存备用。
1.3 动物实验设计
8周龄的SPF级雄性C57BL/6 J小鼠42只,北京维通利华实验动物技术有限公司,动物伦理审查编号:JN.No20211115c1320130[448]。饲养环境温度(23±2) ℃,相对湿度(50±10)%,12 h光照12 h黑夜。小鼠随机分为7组:空白组、广谱抗生素组(Abx组)、氨苄青霉素组(Amp组)、庆大霉素组(Gen组)、两歧双歧杆菌FGSYC45M3组(45M3组)、两歧双歧杆菌FBJCP1M7组(M7组)、两歧双歧杆菌FGZ30MM3组(M3组),每组6只。适应性饲养1周后开始灌胃,前2周空白组每天灌胃0.2 mL无菌水;Abx组、45M3组、M7组、M3组灌胃0.2 mL广谱抗生素混合物(50 mg/kg万古霉素、100 mg/kg硫酸新霉素、100 mg/kg甲硝唑和100 mg/kg氨苄青霉素);Amp组灌胃0.2 mL氨苄青霉素溶液(200 mg/kg);Gen组灌胃0.2 mL庆大霉素溶液(200 mg/kg);经2周造模后,应用不同来源的两歧双歧杆菌进行干预,其中Abx组、Amp组、Gen组继续按上述方法干预1周,空白组每天灌胃0.2 mL脱脂乳(10%),45M3组、M7组、M3组分别灌胃0.2 mL脱脂乳(10%)重悬的45M3、M7、M3菌液(5×109 CFU/mL)。
1.4 实验方法
1.4.1 小鼠肠道结构功能测定
所有干预结束后1 d,每只小鼠灌胃0.2 mL墨汁,墨汁的制备方法参照文献[8]的方法,将灌胃开始时间到排出首粒黑便时间计为肠道总转运时间。
将每只小鼠放入空的笼盒并收集5~6颗粪便,称重后冻干,粪便含水率的计算如公式(1)所示:
粪便含水率![]()
(1)
在小鼠处死前,每只小鼠灌胃0.2 mL墨汁,并于30 min后处死小鼠,通过解剖,取小鼠胃至回肠末端,以幽门至回肠末端作为“小肠总长度”,以幽门至墨汁推进前端作为“墨汁推进距离”,小肠推进率的计算如公式(2)所示:
小肠推进率![]()
(2)
解剖后取小鼠小肠、结肠进行长度测定,取盲肠进行质量测定,得到小肠长度、结肠长度及盲肠质量。
1.4.2 小鼠结肠组织PGP9.5、S100B基因转录水平测定
通过实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction, RT-qPCR)来测定结肠组织中特定基因的转录水平。取小鼠结肠组织,以TRIzol法按照说明书提取小鼠结肠组织中的总RNA,按照反转录试剂盒说明书方法进行操作,最终获得cDNA,在PrimerBank上查找小鼠PGP9.5、S100B及β-actin基因的引物序列,由生工生物工程(上海)股份有限公司进行引物合成,引物序列如表1所示。
表1 基因引物
Table 1 Gene primer sequence

目的基因引物序列(5′-3′)PGP9.5F:5′- CAAGTGTTTCGAGAAGAACGAG -3′R:5′- AAATTCACTTTGTCGTCTACCC-3′S100BF:5′- TGCCCTCATTGATGTCTT -3′R:5′- TGCTCTTGATTTCCTCC-3′β-actinF:5′- CCTTCCAGCAGATGTGGATCA-3′R:5′- CTCAGTAACAGTCCGCCTAGAA-3′
以cDNA为模板,β-actin基因为内参,使用荧光定量PCR扩增仪来进行荧光定量,通过CFX96Manager软件分析结果,通过Graphpad作图分析。
1.4.3 小鼠粪便菌群测定
按照MP DNA Spin kit for Faces试剂盒说明书方法提取小鼠粪便中的DNA,通过细菌DNA模板,利用PCR扩增16S rDNA的V3、V4区(上游引物341F:5′-CCTAYGGGRBGCASCAG-3′,下游引物806R:5′-GGACTACNNGGGTATCTAAT-3′)。PCR体系为50 μL,反应条件为:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min;12 ℃ 10 min。反应结束后通过1.5%琼脂糖凝胶电泳对PCR产物进行纯化,切取250 bp的条带,使用Qubit dsDNA BR胶回收试剂盒进行回收。按照Qubit Assay Tubes试剂盒说明书建立文库,通过Miseq Reagent Kit v3进行上机测序,获得文库数据。其中菌群下机数据通过微生物微生态定量研究(QIIME 2)平台进行测序分析,结合MetaboAnalyst进行肠道菌群数据的综合分析。
1.4.4 小鼠盲肠内容物中短链脂肪酸测定
收集到的盲肠内容物按照参考文献[9]中的方法进行浸泡、酸化,通过无水乙醚萃取后使用GC-MS测定粪便中的短链脂肪酸(short-chain fatty acids, SCFAs)含量。使用软件Xcalibur分析结果。
2 结果与分析
2.1 抑制G-细菌的抗生素对小鼠肠道结构和肠神经的影响更严重
2.1.1 不同抗生素对小鼠肠道结构功能的影响
应用抑制G+细菌的抗生素(氨苄青霉素),抑制G-细菌的抗生素(庆大霉素)以及广谱抗生素处理小鼠21 d,研究不同抗菌谱的抗生素对小鼠肠道结构和功能的影响。如图1所示,不同抗生素处理后,对小鼠小肠长度、小肠推进率无显著影响(图1-b、图1-e),但对小鼠结肠长度和整个肠道转运时间的影响具有显著性差异。其中抑制G-细菌的抗生素处理组及广谱抗生素处理组极显著的增加了小鼠结肠的长度(P<0.001),相应的也显著延长了小鼠的整个肠道转运时间(P<0.05)。而抑制G+细菌的氨苄青霉素处理组则对结肠长度及整个肠道转运时间几乎无影响(图1-c、图1-f)。不同抗生素处理后,会造成盲肠不同程度的肿大,其中抑制G-细菌的庆大霉素处理组盲肠极显著增大(图1-a,P<0.001),其次是抑制G+细菌的氨苄青霉素处理组和广谱抗生素处理组。这些结果与他人的研究结果一致[10],可能是因为抗生素导致肠道菌群失调,尤其是对维持肠道水分传输功能的细菌的丰度影响很大,从而造成大量水分滞留于盲肠,最终导致盲肠肿大[11]。同时研究还发现抑制G+细菌的氨苄青霉素处理组和广谱抗生素处理组显著提高了小鼠的粪便含水量,而抑制G-细菌的庆大霉素处理组粪便含水量与正常组无显著差异(图1-d)。根据此前的报道推测肠道微生物群改变可能会影响小鼠粪便含水率[12]。众所周知,人体、动物体内有益的细菌主要有益生芽孢菌、丁酸梭菌、乳杆菌、双歧杆菌、放线菌等。这些具有益生作用的菌几乎均为G+细菌,其中乳酸菌作为最常见的益生菌,是一类能发酵糖类产乳酸的G+细菌的总称。这些菌的丰度在抑制G+细菌的氨苄青霉素处理组急剧下降,引起糖类代谢降低致使吸收不良,肠道内糖类聚集,从而导致渗透性腹泻。这可能就是氨苄青霉素处理组粪便含水量显著上升的原因。综合上述结果可知:抑制G-细菌的抗生素对肠道结构(结肠长度、盲肠肿大情况)和功能(整个肠道传输时间)的影响显著大于广谱抗生素组及抑制G+细菌的抗生素组。
2.1.2 不同抗生素对小鼠肠神经的影响
研究进一步评估了不同抗生素对小鼠肠神经细胞和肠神经胶质细胞数量的影响,通过测定结肠中神经元细胞及神经纤维特异性标记物PGP9.5和神经胶质细胞及神经纤维特异性标记物S100B的基因表达情况,发现3组抗生素处理组均显著降低了PGP9.5和S100B表达(图2,P<0.05),和抗生素对肠道结构的影响相同,抑制G-细菌的抗生素处理组对肠神经系统的影响显著大于广谱抗生素组及抑制G+细菌的抗生素组。结合不同抗生素对小鼠肠道结构、功能和肠神经系统的影响情况可知:抑制G-细菌的抗生素对宿主肠道生理和功能具有深远的影响。此结果与YARANDI等[6]的研究结果相一致。
2.2 两歧双歧杆菌45M3可修复由广谱抗生素所引起的肠道结构和功能的损伤
2.2.1 两歧双歧杆菌45M3对广谱抗生素处理小鼠肠道结构功能的影响
据有关调查结果显示,婴幼儿呼吸道感染及肠道感染临床抗生素使用率分别为100%及90.01%。除此之外,最让研究人员担忧的是广谱抗生素消费的急
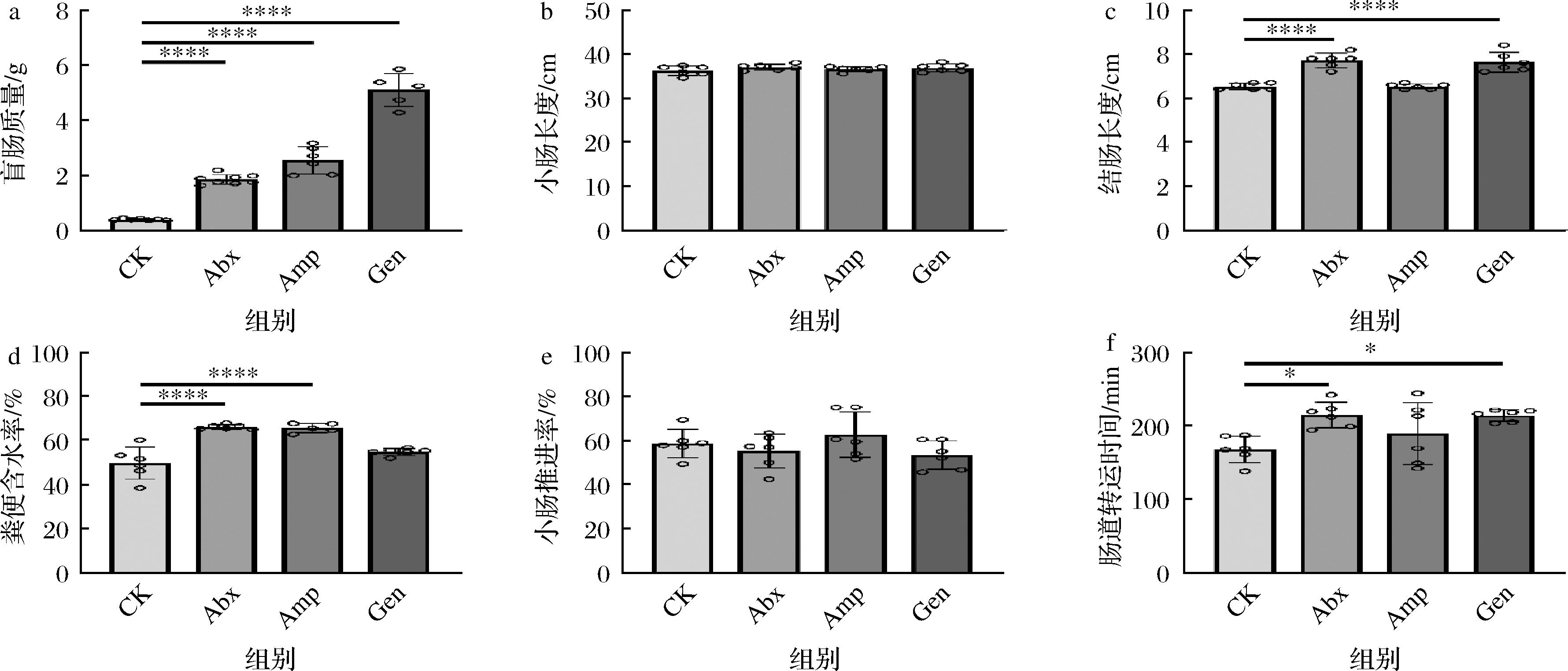
a-盲肠质量;b-小肠长度;c-结肠长度;d-粪便含水率;e-小肠推进率;f-肠道转运时间
图1 不同抗生素对小鼠肠道结构功能的影响
Fig.1 Effects of different antibiotics on intestinal structure and function in mice
注:*表示干预前后对比差异有显著性,其中*代表P<0.05,**代表P<0.01,***代表P<0.005,****代表P<0.001(下同)。

a-PGP9.5基因相对表达量;b-S100B基因相对表达量
图2 不同抗生素对小鼠肠神经的影响
Fig.2 Effects of different antibiotics on intestinal nerves in mice
剧增长。研究发现,抗生素全球消费量在20年间增长了46%。我国目前抗生素使用情况,2019年抗生素产量达21.8万t,同比增长6.34%;需求量达到13.1万t,同比增长5.39%,更让人触目惊心的是,我国每年有8万多人间接或直接死于抗生素的滥用[13]。基于此,本文的又一研究目的是拟通过补充益生菌,修复由抗生素造成的肠道菌群紊乱、帮助肠道功能正常运行及修复由抗生素所引起的肠神经损伤,最终弥补抗生素所引起的毒副作用。研究应用广谱抗生素处理小鼠14 d用于构建肠道功能和肠神经损伤模型,通过灌胃3株对肠神经具有不同修复作用的两歧双歧杆菌7 d,检测不同两歧双歧杆菌对小鼠肠道结构、功能和肠神经系统的影响情况。结果如图3所示,模型组(Model)的盲肠重量、粪便含水量、整个肠道转运时间及结肠长度与正常组(CK)相比具有显著性差异(图3-a,图3-c,图3-f)。3株不同来源的两歧双歧杆菌干预后,不同程度的修复了由于抗生素所引起的肠道结构和功能的变化。但仅有两歧双歧杆菌45M3处理组盲肠重量、整个肠道转运时间及结肠长度恢复至正常水平(图3-a、图3-c、图3-f,P<0.05)。这就说明应用两歧双歧杆菌45M3可修复由广谱抗生素所引起的肠道结构和功能的损伤。
2.2.2 两歧双歧杆菌45M3对广谱抗生素处理小鼠肠神经的影响
研究进一步评估了3株不同来源的两歧双歧杆菌对广谱抗生素所引起的小鼠肠神经损伤的影响,通过测定结肠中神经元细胞及神经纤维特异性标记物PGP9.5和神经胶质细胞及神经纤维特异性标记物S100B的基因表达情况,发现3株两歧双歧杆菌对由抗生素所引起的肠神经损伤无修复作用(图4)。这可能是由于两歧双歧杆菌干预时间较短(7 d),仅修复了由广谱抗生素所引起的肠道结构和功能的损伤,还未达到修复肠神经的作用。下一步可通过延长两歧双歧杆菌干预时间,聚焦肠神经修复相关指标研究益生菌对肠神经细胞和肠神经胶质细胞数量的影响。

a-盲肠重量;b-粪便含水率;c-首粒黑便时间;d-小肠长度;e-小肠推进率;f-结肠长度
图3 不同两歧双歧杆菌对抗生素处理小鼠肠道结构功能的影响
Fig.3 Effects of different probiotics on intestinal structure and function in Abx-treated mice

a-PGP9.5基因相对表达量;b-S100β基因相对表达量
图4 不同益生菌对抗生素小鼠肠神经的影响
Fig.4 Effects of different probiotics on intestinal nerves in Abx-treated mice
2.3 两歧双歧杆菌对抗生素处理小鼠生物屏障的影响
小鼠粪便肠道菌群的变化如图5所示,广谱抗生素处理后,小鼠肠道菌群的结构发生了显著变化,主要表现在:观察到的物种数和Shannon指数显著下降(图5-a、图5-b,P<0.05),这说明抗生素处理后,无差别“攻击”了小鼠肠道内的菌群,造成小鼠肠道内微生物物种数的降低。菌群β多样性也显著区别于正常组和益生菌处理组(图5-c),这也进一步说明了抗生素对宿主肠道菌群的影响。具体表现如下:抗生素处理后,门水平上,拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)及疣微菌门(Verrucomicrobia)的相对丰度显著下调,而变形菌门(Proteobacteria)的相对丰度则显著上调(图5-d~图5-g)。已知变形菌门为革兰氏阴性菌,是细菌中最大的一门,包括很多病原菌,如大肠杆菌、沙门氏菌、霍乱弧菌、幽门螺杆菌等。而抗生素处理后变形菌门丰度的显著上调也侧面反映了抗生素的弊端。经不同的两歧双歧杆菌干预后,小鼠肠道菌群物种数呈现上调的趋势,其肠道菌群结构也趋向于正常组(图5-c),这说明用不同的两歧双歧杆菌干预后,由抗生素所引起的肠道菌群的改变都会不同程度的修复至正常水平。具体表现如下:属水平上,空白组小鼠的特征菌群为Alloprevotella,Eubacterium_nodatumgroup,PrevotellaceaeUCG_001,Eubacterium_fissicatenagroup,Ruminiclostridium9,Negativibacillus,GCA_900066575,Alistipes,Mucispirillum,Oscillibacter,Eubacterium_coprostanoligenesgroup,Roseburia,Tyzzerella,Eubacterium_xylanophilumgroup,LachnospiraceaeUCG_006,RuminococcaceaeUCG_009,RuminococcaceaeUCG_014,RuminococcaceaeUCG_010,RikenellaceaeRC9 gutgroup,LachnospiraceaeNK4A136 group,Bilophila,Muribaculum;抗生素处理组特征菌群为:Citrobacter,Enterobacter,Proteus,Stenotrophomonas,而经不同益生菌处理后,其特征菌群也不尽相同,其中45M3处理组特征菌群为Bacteroides,Parabacteroides,Erysipelatoclostridium;M7处理组特性菌群为Parasutterella,Enterococcus,Escherichia_Shigella,Clostridium_innocuumgroup,而M3处理组特征菌群为Clostridioides,Flavonifractor,Blautia(图6-a);结合不同益生菌对抗生素小鼠肠道结构和功能的影响情况,猜测可能是45M3和M7处理组的特定菌群相对丰度的变化修复了由于抗生素所引起的小鼠肠道功能和结构的损伤。
此外,基于PICRUST levle 2水平前20种预测功能的相关性分析可知,模型组在碳水化合物代谢、膜运输、其他氨基酸代谢、信号传导及异种生物降解和代谢等信号通路上与空白组成正相关,而在能量代谢、多糖合成和代谢、翻译等信号通路上与空白组成负相关(图6-b,图6-c),而模型组小鼠经双歧杆菌45M3干预后,几乎扭转了上述所有由于抗生素所引起的代谢通路的变化,除碳水化合物代谢通路未发生变化外。基于此,结合上述不同两歧双歧杆菌对抗生素小鼠肠道结构和功能的影响情况,猜测可能是45M3处理组的特定菌群相对丰度的变化改变了由抗生素所引起的小鼠代谢通路的变化,最终修复了由抗生素所引起的小鼠肠道功能和结构的损伤。
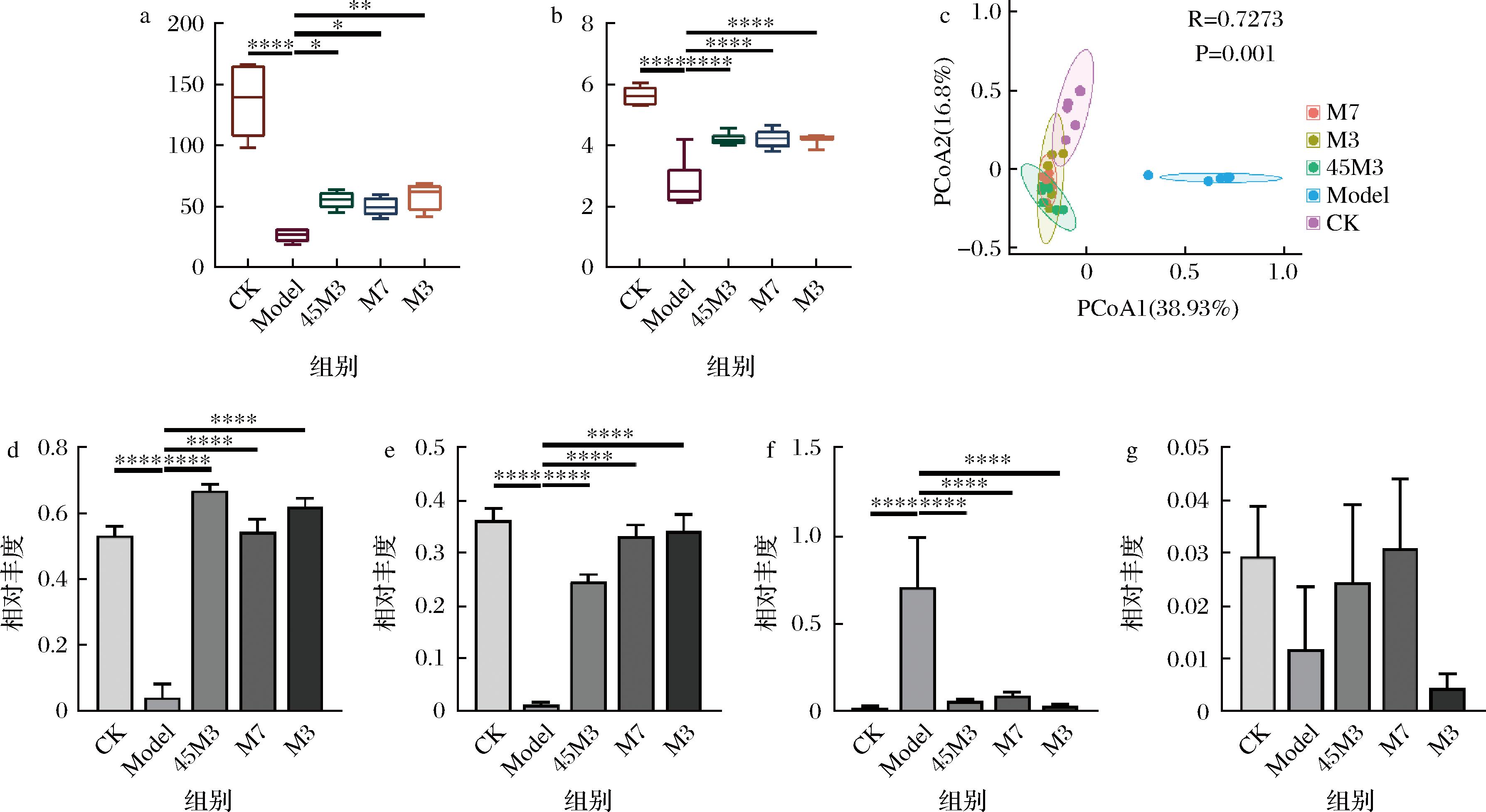
a-观测的菌落总数;b-香农指数;c-β多样性;d-拟杆菌门相对丰度;e-厚壁菌门相对丰度;f-变形菌门相对丰度;g-疣微菌门相对丰度
图5 小鼠粪便肠道菌群α和β分析
Fig.5 The alpha and beta analysis of fecal intestinal flora in mice

a-肠道菌群Lefse分析;b-功能预测(空白组和模型组);c-功能预测(45M3组和模型组)
图6 小鼠肠道菌群Lefse分析及功能预测
Fig.6 Lefse analysis and functional prediction of intestinal flora in mice
2.4 两歧双歧杆菌对抗生素处理小鼠SCFAs的影响
如图7所示,用不同抗生素处理后,盲肠内容物中SCFAs(乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸)的浓度显著降低(P<0.001)。由于抗生素处理后,小鼠肠道菌群物种数显著下降,导致肠道菌群紊乱,部分与碳水化合物分解代谢相关的菌丢失,无法正常发酵膳食来源的复杂碳水化合物并产生SCFAs。在用不同的两歧双歧杆菌治疗或恢复7 d 时,除戊酸外,所有SCFAs都可以恢复到接近空白组的水平,这些结果表明,抗生素处理后补充两歧双歧杆菌,可以达到修复肠道生物屏障的作用,但结合不同两歧双歧杆菌对抗生素处理后小鼠肠道功能及结构的影响情况可知两歧双歧杆菌45M3的效果更优。
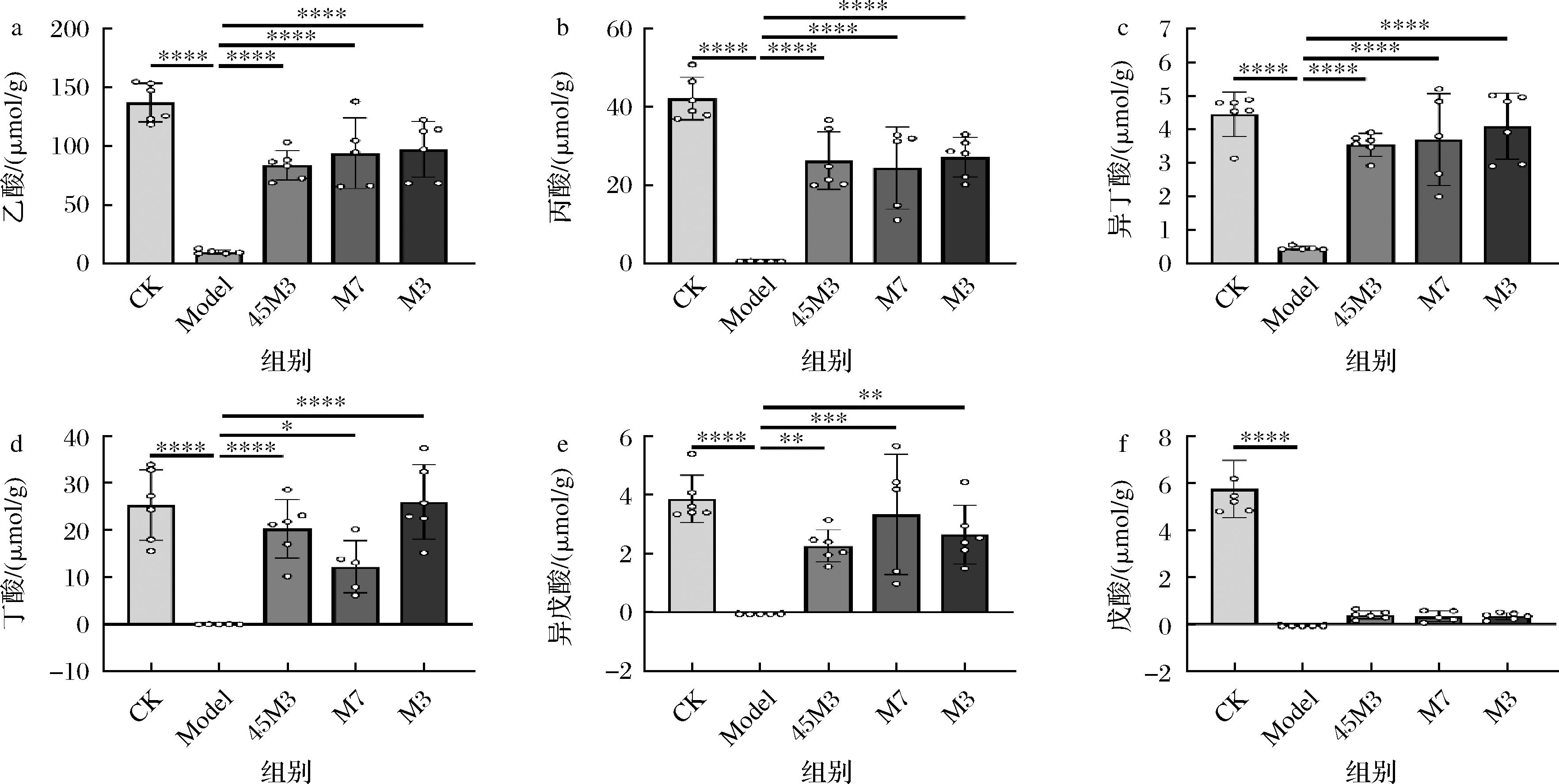
a-乙酸;b-丙酸;c-异丁酸;d-丁酸;e-异戊酸;f-戊酸
图7 不同两歧双歧杆菌对抗生素处理小鼠盲肠内容物中短链脂肪酸水平的影响
Fig.7 Effect of different probiotics on the level of short-chain fatty acids in the cecum contents of Abx-treated mice
3 结论
本研究针对不同抗菌谱的抗生素对小鼠肠道结构、功能及肠神经的影响展开研究,研究发现,抑制G-细菌的抗生素对小鼠肠道结构和肠神经的影响更严重。我们进一步应用不同来源的两歧双歧杆菌干预广谱抗生素处理鼠,通过测定两歧双歧杆菌干预后肠道结构、功能和肠神经相关指标及肠道菌群及其代谢物SCFAs来研究两歧双歧杆菌对肠道结构、功能及肠神经的影响,结果表明两歧双歧杆菌45M3可通过调节肠道生物屏障修复由广谱抗生素所引起的肠道结构和功能的损伤。上述结果表明应用抗生素会造成宿主肠道结构、功能及肠神经不同程度的损伤,而服用两歧双歧杆菌则可修复由抗生素所引起的损伤,为服用抗生素后补充益生菌提供了理论依据,也为开发提升国民健康的新型功能食品提供新的思路。
[1] EVANS J M, MORRIS L S, MARCHESI J R.The gut microbiome:The role of a virtual organ in the endocrinology of the host[J].The Journal of Endocrinology, 2013, 218(3):37-47.
[2] MCFARLAND L V.Epidemiology, risk factors and treatments for antibiotic-associated diarrhea[J].Digestive Diseases, 1998, 16(5):292-307.
[3] 邹琴, 王博龙.早期抗生素暴露与儿童肥胖风险的Meta分析[J].中国抗生素杂志, 2019, 44(5):613-620. ZOU Q, WANG B L.Meta-analysis on antibiotic exposure in early life with the risk of childhood obesity[J].Chinese Journal of Antibiotics, 2019, 44(5):613-620.
[4] GOMEZ D E AGÜERO M, GANAL-VONARBURG S C, FUHRER T, et al.The maternal microbiota drives early postnatal innate immune development[J].Science, 2016, 351(6279):1296-1302.
[5] LI Y, LIU H T, XU Q S, et al.Chitosan oligosaccharides block LPS-induced O-GlcNAcylation of NF-κB and endothelial inflammatory response[J].Carbohydrate Polymers, 2014, 99:568-578.
[6] YARANDI S S, KULKARNI S, SAHA M, et al.Intestinal bacteria maintain adult enteric nervous system and nitrergic neurons via toll-like receptor 2-induced neurogenesis in mice[J].Gastroenterology, 2020, 159(1):200-213.
[7] VICENTINI F A, KEENAN C M, WALLACE L E, et al.Intestinal microbiota shapes gut physiology and regulates enteric neurons and glia[J].Microbiome, 2021, 9(1):210.
[8] 王琳琳. 双歧杆菌对便秘的影响及其作用机理研究[D].无锡:江南大学, 2017. WANG L L, Study of the effects and mechanisms of bifidobacteria on constipation alleviation[D].Wuxi:Jiangnan University, 2017.
[9] 毛丙永. 功能性低聚糖对肠道细菌的影响及机制[D].无锡:江南大学, 2015. MAO B Y.Effect of functional oligosaccharides on the gut bacteria and mechanism[D].Wuxi:Jiangnan University, 2015. [10] GRASA L, ABECIA L, FORCÉN R, et al.Antibiotic-induced depletion of murine microbiota induces mild inflammation and changes in toll-like receptor patterns and intestinal motility[J].Microbial Ecology, 2015, 70(3):835-848.
[11] 朱思逸, 李先平, 宋利琼, 等.耐万古霉素肠球菌小鼠感染模型的优化[J].疾病监测, 2018, 33(12):979-984. ZHU S Y, LI X P, SONG L Q, et al.Optimization of vancomycin resistant Enterococcus infection model in mice[J].Disease Surveillance, 2018, 33(12):979-984.
[12] VIEIRA-SILVA S, SABINO J, VALLES-COLOMER M, et al.Quantitative microbiome profiling disentangles inflammation- and bile duct obstruction-associated microbiota alterations across PSC/IBD diagnoses[J].Nature Microbiology, 2019, 4(11):1826-1831.
[13] 刘丹华, 张晓伟, 张翀.抗生素滥用与超级细菌[J].国外医药(抗生素分册),2019.40(1):1-4. LIU D H, ZHANG X W, ZHANG C.The abuse of antibiotics and super bacteria[J].World Notes on Antibiotics, 2019, 40(1):1-4.