肉及肉制品富含蛋白质、矿物质和维生素,是人们摄取营养物质的主要来源。单增李斯特菌因其在自然界中广泛存在且对苛刻环境的耐受力强的特性,对肉及肉制品的食用安全造成严重威胁。单增李斯特菌是全球范围内严重威胁公众健康安全的食源性致病菌,导致的食品安全问题不仅给消费者安全带来极大的危害,也造成了巨大的社会经济损失,因此采取有效措施控制食品中单增李斯特菌的污染迫在眉睫[1-2]。
气调包装是猪肉常用的包装方式之一,包装材料的存在可避免猪肉被二次污染[3]。另外,包装内的CO2气体溶解于食品后,进入细菌内部,通过降低细菌的胞内pH值、延缓新陈代谢速率及改变细菌的生理状态抑制多种有害菌的生长[4]。研究表明10%~20%的CO2即可抑制有害菌生长,40%~60%的CO2具有更好的抑制效果,100%的CO2能够完全抑制需氧微生物的生长[5]。但是CO2浓度太高,会导致肉的多汁性降低,颜色发暗,常在包装内充入O2以维持猪肉的色泽[6]。
目前,国内外的研究常常基于致病菌浓度的减少评估食品安全控制措施的有效性。先前的研究也多集中于探讨CO2对单增李斯特菌最大污染浓度(Nmax)的影响[7-8]。致病菌在食品中能够达到的Nmax由致病菌的生长特性决定,迟滞时间(λ)、最大比生长速率(μmax)和Nmax等生长动力学参数是描述致病菌生长特性的重要指标。通过对致病菌的生长动态进行数学建模可以获得致病菌的生长动力学参数。另外,数学模型的正确选择对准确预测微生物的生长动态至关重要。构建正确的生长模型可向食品安全决策者提供更为精确的微生物生长信息,对于保障食品质量和食品安全具有十分重要的意义。
本试验的目的是基于预测模型研究CO2气体对猪肉中单增李斯特菌生长特性的影响。首先分别应用Baranyi模型、Logistic模型和修正的Gompertz模型拟合不同CO2浓度条件下单增李斯特菌的生长曲线。根据用池信息准则(Akaike′s information criteria,AIC)和贝叶斯信息准则(Bayesian information criteria,BIC)模型评价参数,选取拟合优度最好的一级模型。基于一级模型获得的单增李斯特菌的生长动力学参数,用Ratkowsky-type拟合CO2抑菌的二级模型,探讨CO2气体对单增李斯特菌生长动力学参数λ、μmax和Nmax的影响,为CO2气体应用于猪肉安全控制作出准确、科学的评估和预测。
1 材料与方法
1.1 菌种
试验所用单增李斯特菌(ATCC 13932,血清型4b)由本实验室保藏。单增李斯特菌血清型4b为主要导致消费者食物中毒和孕妇流产的血清型[9]。血清型的选取考虑了猪肉被单增李斯特菌污染最严重的场景。
1.2 培养基与耗材
含0.6%酵母膏的胰酪胨大豆肉汤(trypticase soy-yeast extract broth, TSB-YE)、PALCAM琼脂(PALCAM Agar)、PALCAM添加剂、无菌均质袋、试管、封口膜,青岛海博生物技术有限公司;气调保鲜盒、气调保鲜膜,苏州市凯康机械设备有限公司。
1.3 仪器与设备
YXQ-LS-S2型灭菌锅,上海博讯实业有限公司;HLQ-8型斩拌机,安徽华菱西厨装备有限公司;SW-CJ-IFD型生物安全柜,江苏苏州安泰空气技术有限公司;THZ-103B型恒温培养摇床,上海一恒科学仪器有限公司;HWS-250型恒温恒湿培养箱,上海比朗仪器有限公司;XW-80A型漩涡仪器,上海精科实业有限公司;均质机,浙江新芝生物科技有限公司;高速冷冻离心机,赛默飞世尔科技(中国)有限公司;气调包装机,苏州凯康包装机有限公司。
1.4 试验方法
1.4.1 细菌培养和接种液制备
单增李斯特菌的工作菌株划线保存在TSA-YE培养基上,放在4 ℃的冰箱中保存,每个月活化1次。试验前1 d,用灭菌的接种环从TSA-YE培养基上挑取一株菌苔,接种于100 mL TSB-YE培养基中,并在37 ℃、110 r/min的摇床上培养18 h,使细菌生长到稳定期(大约108 CFU/mL)。取10 mL菌悬液在冷冻离心机中离心收集菌体(4 ℃,8 000 r/min,5 min)。菌体用10 mL无菌生理盐水重悬,重复2次。最后用无菌生理盐水将单增李斯特菌菌液稀释到104~105 CFU/mL左右备用。
1.4.2 肉样处理与接种
试验前1 d从超市购买猪后腿瘦肉,快速运回实验室冷藏。试验前将整块的猪后腿瘦肉切成小块,放在用75%酒精擦拭灭菌过的斩拌机中斩拌3 min,将制得的肉糜放在预先紫外杀菌的托盘中,转移到无菌操作台,紫外辐照1 h,期间每隔15 min翻动肉糜,使得肉糜的外部和里面都能被紫外辐射灭菌。
在生物安全柜中,称取已灭菌的肉样25 g/份,分装在无菌均质袋中,每份肉样接种1 mL单增李斯特菌接种液。将接种了菌液的肉样用无菌均质机正反面各拍打2 min,使得菌液在肉样中均匀分布。肉样中单增李斯特菌的浓度约为103 CFU/g。精确接种浓度用PALCAM平板计数测定。取两份肉样接种1 mL无菌生理盐水作为阴性对照组。
1.4.3 气调包装、贮藏及微生物计数
在生物安全柜中,将接种了单增李斯特菌的猪肉从无菌均质袋中转移到已经紫外辐照杀菌的气调保鲜盒中。将气调保鲜盒分成5组(每组40份样品),按表1进行气调包装。其中,对照组(TC)近似于无菌空气包装。将每组包装好的猪肉分成两个亚组(每组20份样品),一组放置在13 ℃恒温培养箱中培养,模拟“温度滥用(abuse temperature)”条件下猪肉中单增李斯特菌的生长情况;另一组放置在25 ℃恒温培养箱中培养,模拟室温条件下猪肉中单增李斯特菌的生长情况。
表1 气调包装中的气体配比 单位:%
Table 1 Gas compositions within packages
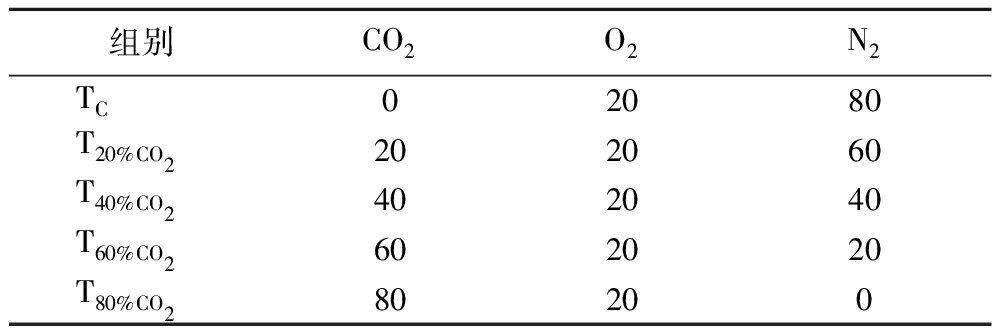
组别CO2O2N2TC02080T20%CO2202060T40%CO2402040T60%CO2602020T80%CO280200
在肉样储存过程中,每隔适宜时间取样对单增李斯特菌浓度进行计数,取样时间间隔由预试验结果确定。总的来说,CO2浓度越高,取样间隔时间越长。
1.5 一级生长模型的构建
分别使用Baranyi模型、修正的Gompertz模型(M-Gompertz模型)和Logistic模型对单增李斯特菌在不同条件下的生长曲线进行拟合,并对单增李斯特菌生长曲线的动力学参数λ、μmax和Nmax进行估计。
所用Baranyi模型的表达式如公式(1)所示:
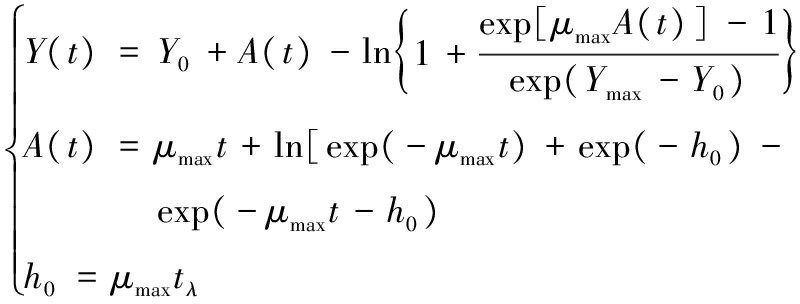
(1)
Gompertz模型的表达式如公式(2)所示:
Y(t)=Y0+(Ymax-Y0)exp
(2)
Logistic模型的表达式如公式(3)所示:

(3)
式中:Y0、Yt和Ymax,在初始时刻、t时刻和达到稳定期时的单增李斯特菌浓度,ln CFU/g;μmax,最大比生长速率,ln CFU/(g·h);λ,细菌生长的迟滞时间,h。
1.6 一级生长模型的优选
用AIC和BIC对建立的一级模型进行数学评价。AIC和BIC是评价模型性能的拟合优度指标,可以权衡模型的复杂性和准确性,可以在多个相互竞争的模型中将最佳模型选择出来[10]。AIC和BIC的值越小,所建立的模型的拟合优度越好。AIC和BIC的数学表达式如公式(4)、公式(5)所示:
(4)
(5)
式中:n,观察到的数据点个数;SSE,残差平方和;k,模型参数的个数。
1.7 二级模型的构建
基于最优的一级模型获得的生长动力学参数,用平方根模型拟合CO2抑菌的二级模型。平方根模型的形式如公式(6)、公式(7)所示[11]:
(6)
(7)
式中:a和b是回归系数;CO2 max和CO2 min分别是对方程进行外推,得出单增李斯特菌生长速率为零时的最高和最低CO2浓度值,即回归线和CO2轴的截距所得数据,也就是说CO2 max和CO2 min不是真实的单增李斯特菌生长的最大CO2浓度和最小CO2浓度,而是理论上的最大CO2和最小CO2值。
1.8 数据处理与统计分析
应用Microsoft Excel 2010将单增李斯特菌菌落数“CFU/g”转换为“lg CFU/g”。应用Microrisk Lab软件(https://www.microrisklab.top/)拟合单增李斯特菌的一级生长模型,并且获得AIC和BIC参数。应用Origin 8.0软件(美国OriginLab公司)构建CO2对单增李斯特菌的二级抑制模型。每个试验至少做3次独立重复试验。应用SPSS 17.0软件(美国IBM公司)对数据进行显著性分析。
2 结果与分析
2.1 CO2对单增李斯特菌的抑制作用
CO2气体对13、25 ℃贮存猪肉中单增李斯特菌的抑制情况见图1。由图1可知,两种温度条件下,均是TC组单增李斯特菌的λ最短,μmax最大,到达稳定期的时间最短。随着CO2浓度的增加,单增李斯特菌的λ延长,μmax减小,到达稳定期的时间延长。CO2浓度越高,对单增李斯特菌的抑制作用越强。在13 ℃(25 ℃)贮存时,TC组、T20%CO2组、T40%CO2组、T60%CO2组和T80%CO2组中单增李斯特菌的Nmax最终能够达到7.20 lg CFU/g(8.40 lg CFU/g)左右。

a-13 ℃;b-25 ℃
图1 CO2对猪肉中单增李斯特菌的抑制作用
Fig.1 The inhibition effect of CO2 on L.monocytogenes in pork meat
叶可萍[12]及LEE等[13]的研究表明,在15、25 ℃贮存猪肉中,单增李斯特菌分别在50、20 h左右生长到稳定期,Nmax分别约为6.30 lg CFU/g、7.30 lg CFU/g。本试验得到的单增李斯特菌Nmax比上述研究稍高,可能是因为使用了无菌猪肉,单增李斯特菌生长不受其他微生物影响。
研究结果显示,CO2浓度越高,对单增李斯特菌的抑制作用越强。这与CO2在食品中的溶解特性有关。气调包装中,溶解于猪肉中水相和脂肪的CO2起到抑菌作用[14]。CO2在食品中的溶解量和CO2在气调包装气体中所占的体积成正比,CO2占的比例越大,在食品中的溶解量越多,从而进入细菌细胞内部的CO2量越多,对单增李斯特菌的抑制作用越强。
CO2对单增李斯特菌生长动力学参数的具体影响,需要进一步对一级生长模型拟合得到的λ、μmax和Nmax值进行统计学分析。
2.2 CO2对单增李斯特菌λ的影响
分别用Baranyi模型、M-Gompertz模型和Logistic模型对不同CO2浓度下单增李斯特菌的生长曲线进行拟合,获得的λ见表2。
13 ℃贮存时,单增李斯特菌的λ随着CO2浓度的增加而延长,CO2浓度越高,对单增李斯特菌的抑制作用越强。由Baranyi模型拟合得到的TC组单增李斯特菌λ是10.68 h,和TC组相比,T20%CO2组、T40%CO2组、T60%CO2组和T80%CO2组中单增李斯特菌的λ分别延长了0.18、0.65、0.83、1.06倍。由统计分析结果可知,CO2体积分数达到40%时,才能显著延长单增李斯特菌的λ(P<0.05)。在5种试验条件下,Logistic模型和Baranyi模型对单增李斯特菌λ的拟合无显著差异(P≥0.05);在T60%CO2组,Gompertz模型拟合的单增李斯特菌λ大于Logistic模型拟合的λ。
25 ℃贮存时,同样地,随着CO2浓度的增加单增李斯特菌的λ延长。由Baranyi模型拟合得到TC组单增李斯特菌的λ是3.43 h,和TC组相比,T20%CO2组、T40%CO2组、T60%CO2组和T80%CO2组中单增李斯特菌的λ分别延长了0.19、0.90、1.9、2.04倍。在5组试验条件下,Gompertz模型拟合的单增李斯特菌λ大于Baranyi模型和Logistic模型拟合的λ。
研究结果表明在13、25 ℃贮存条件下,CO2都能延长单增李斯特菌的λ,说明CO2在单增李斯特菌的迟滞期就能作用于细菌细胞。我们的研究结果和GEYSEN等[15]与DEVLIEGHERE等[16]的研究一致。GEYSEN等[15]应用Baranyi模型构建了7 ℃时单增李斯特菌在不同CO2浓度下的生长模型,结果发现,25% CO2条件下单增李斯特菌的λ比13.5% CO2条件下长4 h。DEVLIEGHERE等[16]的研究也表明CO2浓度越高,单增李斯特菌的λ越长。但是BENNIK等[17]却指出CO2气体对单增李斯特菌的λ无影响。
先前的研究得到不一致的结果,可能是因为单增李斯特菌的λ长短不仅和试验时所处的生长条件有关,还和单增李斯特菌细胞先前所处的“历史环境”有关[8,18]。有研究表明单增李斯特菌的历史环境能够影响细胞的生理状态,进而影响细胞在进入一个新环境时对该环境的适应能力(λ)[19-20]。
表2 CO2对单增李斯特菌λ的影响 单位:h
Table 2 The λ of L.monocytogenes under different CO2 concentrations
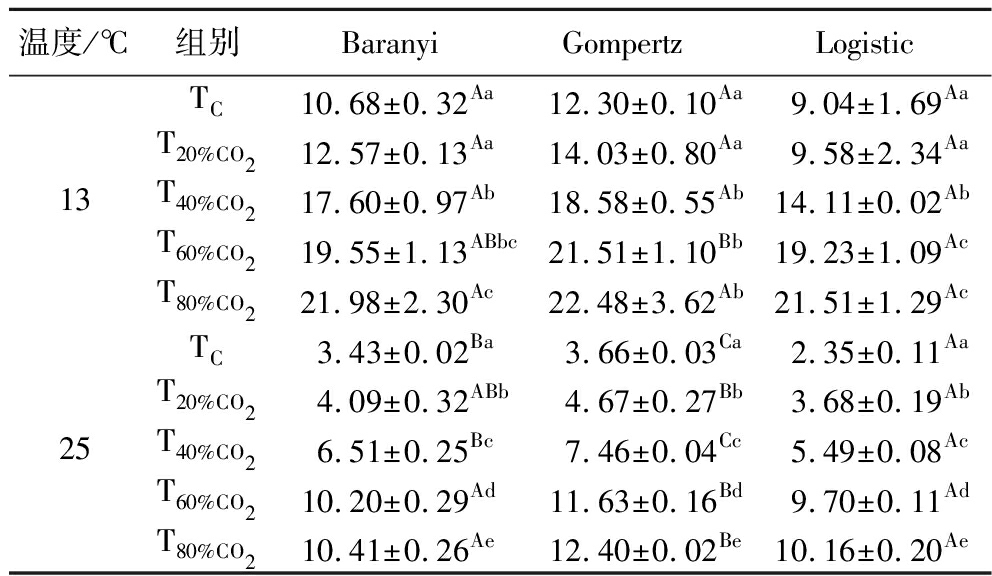
温度/℃组别BaranyiGompertzLogistic13TC10.68±0.32Aa12.30±0.10Aa9.04±1.69AaT20%CO212.57±0.13Aa14.03±0.80Aa9.58±2.34AaT40%CO217.60±0.97Ab18.58±0.55Ab14.11±0.02AbT60%CO219.55±1.13ABbc21.51±1.10Bb19.23±1.09AcT80%CO221.98±2.30Ac22.48±3.62Ab21.51±1.29Ac25TC 3.43±0.02Ba 3.66±0.03Ca2.35±0.11AaT20%CO24.09±0.32ABb4.67±0.27Bb3.68±0.19AbT40%CO26.51±0.25Bc7.46±0.04Cc5.49±0.08AcT60%CO210.20±0.29Ad11.63±0.16Bd9.70±0.11AdT80%CO210.41±0.26Ae12.40±0.02Be10.16±0.20Ae
注:数值为平均值±标准偏差;不同小写字母表示同一温度下,同列的数据有显著性差异(P<0.05);不同大写字母表示同一温度下,同行的数据有显著性差异(P<0.05)(下同)。
2.3 CO2对单增李斯特菌μmax的影响
分别用Baranyi模型、M-Gompertz模型和Logistic模型对不同CO2浓度下单增李斯特菌的生长曲线进行拟合,获得的μmax见表3。
13 ℃贮存时,随着CO2浓度的增加,单增李斯特菌的μmax降低。由Baranyi模型拟合得到TC组单增李斯特菌的μmax是0.089 lg CFU/(g·h),和TC组相比,T20%CO2组、T40%CO2组、T60%CO2组和T80%CO2组中单增李斯特菌的μmax分别降低了21%、36%、44%和47%。由统计分析结果可知,CO2体积分数达到60%时,才能显著降低单增李斯特菌的μmax(P<0.05)。在T60%CO2组,Gompertz模型拟合得到的μmax大于Logistic模型拟合的μmax;其余4组中,3种一级模型拟合的μmax无显著差异(P≥0.05)。
25 ℃贮存时,同样地,随着CO2浓度的增加,单增李斯特菌的μmax降低。由Baranyi模型拟合的TC组单增李斯特菌的μmax是0.320 lg CFU/(g·h)。和TC组相比,T20%CO2组、T40%CO2组、T60%CO2组和T80%CO2组中单增李斯特菌的μmax分别降低了26%、40%、57%和69%。由统计分析结果可知,CO2体积分数达到20%时,即能显著降低单增李斯特菌的μmax(P<0.05)。在5种试验条件下,Logistic模型拟合的μmax均小于Baranyi模型拟合得到的μmax。
研究结果表明,在2种温度贮存时,CO2都能降低单增李斯特菌的μmax值。说明CO2在整个指数生长阶段都可以抑制单增李斯特菌的生长。CO2溶解于猪肉中的水相和脂肪中,然后进入单增李斯特菌细胞内部,影响异柠檬酸脱氢酶活性、脂肪酸的合成代谢及改变细胞膜结构,进而改变细菌细胞的新陈代谢速率,使细菌生长变慢[21]。另外,CO2溶解于猪肉中产生的![]() 可以进入单增李斯特菌细胞内部,降低细菌胞内pH值,打破细胞的内部酸碱平衡。先前关于CO2气体对单增李斯特菌μmax值影响的研究较为一致,即CO2气体能够降低单增李斯特菌的μmax值[15-16]。
可以进入单增李斯特菌细胞内部,降低细菌胞内pH值,打破细胞的内部酸碱平衡。先前关于CO2气体对单增李斯特菌μmax值影响的研究较为一致,即CO2气体能够降低单增李斯特菌的μmax值[15-16]。
表3 CO2对单增李斯特菌的μmax值的影响
Table 3 The μmaxof L.monocytogenes under different CO2 concentrations

温度/℃组别μmax[lg CFU/(g·h)]BaranyiGompertzLogistic13TC0.089±0.008Ac0.100±0.01Ac0.083±0.013AcT20%CO20.070±0.007Ac0.078±0.011bAc0.063±0.009AbcT40%CO20.057±0.007Abc0.06±0.010Abc0.052±0.006AbcT60%CO20.050±0.002ABb0.056±0.002Bb0.048±0.005AabT80%CO20.047±0.002Aa0.043±0.007Aa0.039±0.01Aa25TC0.318±0.01Ce 0.284±0.003Be0.243±0.004AeT20%CO20.236±0.001Bd0.266±0.003Cd0.225±0.003AdT40%CO20.192±0.005Ac0.218±0.006Bc0.176±0.006AcT60%CO20.138±0.001Bb0.160±0.001Bb0.133±0.001AbT80%CO20.100±0.001Ba0.116±0.005Ba0.097±0.002Aa
2.4 CO2对单增李斯特菌Nmax的影响
13 ℃贮存时,由Baranyi模型拟合得到的TC组单增李斯特菌的Nmax为7.23 lg CFU/g。在5组试验中,单增李斯特菌的Nmax没有显著性差异(P≥0.05),3种一级模型拟合得到的Nmax也无显著性(P≥0.05)差异。25 ℃贮存时,由Baranyi模型拟合得到的TC组单增李斯特菌的Nmax为8.40 lg CFU/g。在5组试验中,单增李斯特菌的Nmax没有显著性变化(P≥0.05)。在TC组、T20%CO2组和T80%CO2组,Gompertz模型拟合得到的单增李斯特菌Nmax显著(P<0.05)高于Baranyi模型和Logistic模型拟合得到的Nmax。
由致病菌导致消费者患病的剂量-效应模型可知[22],消费者患李斯特菌病的概率由摄入该菌的剂量及毒性大小共同决定。消费者摄入单增李斯特菌的剂量由该菌在食品中的最终Nmax与和摄入食物的份量共同决定。因此,摄入食物份量一定时,在食品中的Nmax是影响消费者摄入单增李斯特菌剂量的主要影响因素。由单增李斯特菌导致的食品安全问题不仅给消费者带来极大的食用风险,也给食品加工业造成了巨大的经济损失。不同的抑菌技术可从不同方面控制单增李斯特菌的生长,因此可将CO2与其他抑菌措施联合起来应用到食品中,以更好的提高食品食物微生物安全[23]。
表4 CO2对单增李斯特菌的Nmax值的影响
Table 4 The Nmaxof L.monocytogenes under different CO2 concentrations

温度/℃组别Nmax(lg CFU/g)BaranyiGompertzLogistic13TC7.23±0.15Aa7.37±0.14Aa7.25±0.14AaT20%CO27.23±0.07Aa7.41±0.15Aa7.25±0.08AaT40%CO27.15±0.13Aa7.42±0.25Aa7.17±0.13AaT60%CO27.15±0.09Aa7.35±0.10Aa7.17±0.09AaT80%CO27.20±0.02Aa7.80±0.38Aa7.24±0.06Aa25TC8.40±0.01Ab9.06±0.03Bb8.61±0.02AbT20%CO28.20±0..08Aa8.58±0.08Bb8.21±0.08AaT40%CO28.06±0.07Aa8.35±0.07Ab8.09±0.07AaT60%CO28.20±0.07Aa8.45±0.08Ab8.20±0.07AaT80%CO28.22±0.06Aa8.48±0.02Ba8.22±0.06Aa
综合分析3种模型拟合得到的单增李斯特菌的生长动力学参数发现,Logistic模型会低估μmax,M-Gompertz模型会高估λ,低估μmax和高估λ在风险评估中会低估单增李斯特菌的风险。3种一级模型对不同温度与CO2浓度下单增李斯特菌生长曲线的拟合优度还需要通过数学评价参数进行科学的评价。
2.5 一级模型的优选
由图2可知,13 ℃贮存时,建立的TC组、T20%CO2组、T40%CO2组、T60%CO2组和T80%CO2组单增李斯特菌的生长曲线中,有4组是Baranyi模型的AIC和BIC数值最小(除去T60%CO2组);在25 ℃贮存时建立的5组单增李斯特菌的生长曲线中,有4组是Baranyi模型的AIC和BIC数值最小(除去T40%CO2组)。综上所述,在建立的10条单增李斯特菌生长曲线中,有8条是Baranyi模型的AIC和BIC数值最小。因此,Baranyi模型、Gompertz模型和Logistic模型中,Baranyi模型比较适宜于描述不同CO2条件下单增李斯特菌的生长曲线。
M-Gompertz模型和Logistic模型是经验模型,二者的模型涵义容易理解,模型结构也和简单,因此常被预测微生物学家应用于描述细菌的生长。但是由本试验和前人的研究结果可知[13],M-Gompertz和Logistic模型通常会低估细菌的生长能力,这在风险评估中属于“低估风险”。Baranyi模型从细胞生长过程中的参数进行考虑,既描述了微生物随时间的变化规律,又考虑了微生物的生理学阶段即生长迟滞期。另外,理论上模型中参数越多对细菌生长的情况会描述的越准确,但是参数过多会导致模型使用不方便且建模者的工作量增加,还会造成过模型拟合的现象。Baranyi模型则很好的协调了模型的参数和模型准确性之间的关系,使用了最少的并且具有生理学意义的参数对细菌的生长状况做了最准确的描述。
2.6 二级模型的建立
将Baranyi模型拟合的λ和μmax代入Ratkowsky-type模型,分别得到CO2与单增李斯特菌λ和μmax的关系(图3)。

a-13 ℃时AIC;b-13 ℃时BIC;c-25 ℃时AIC;d-25 ℃下BIC
图2 用AIC和BIC评价三个一级生长模型的拟合优度
Fig.2 Comparison of AIC and BIC of three primary models
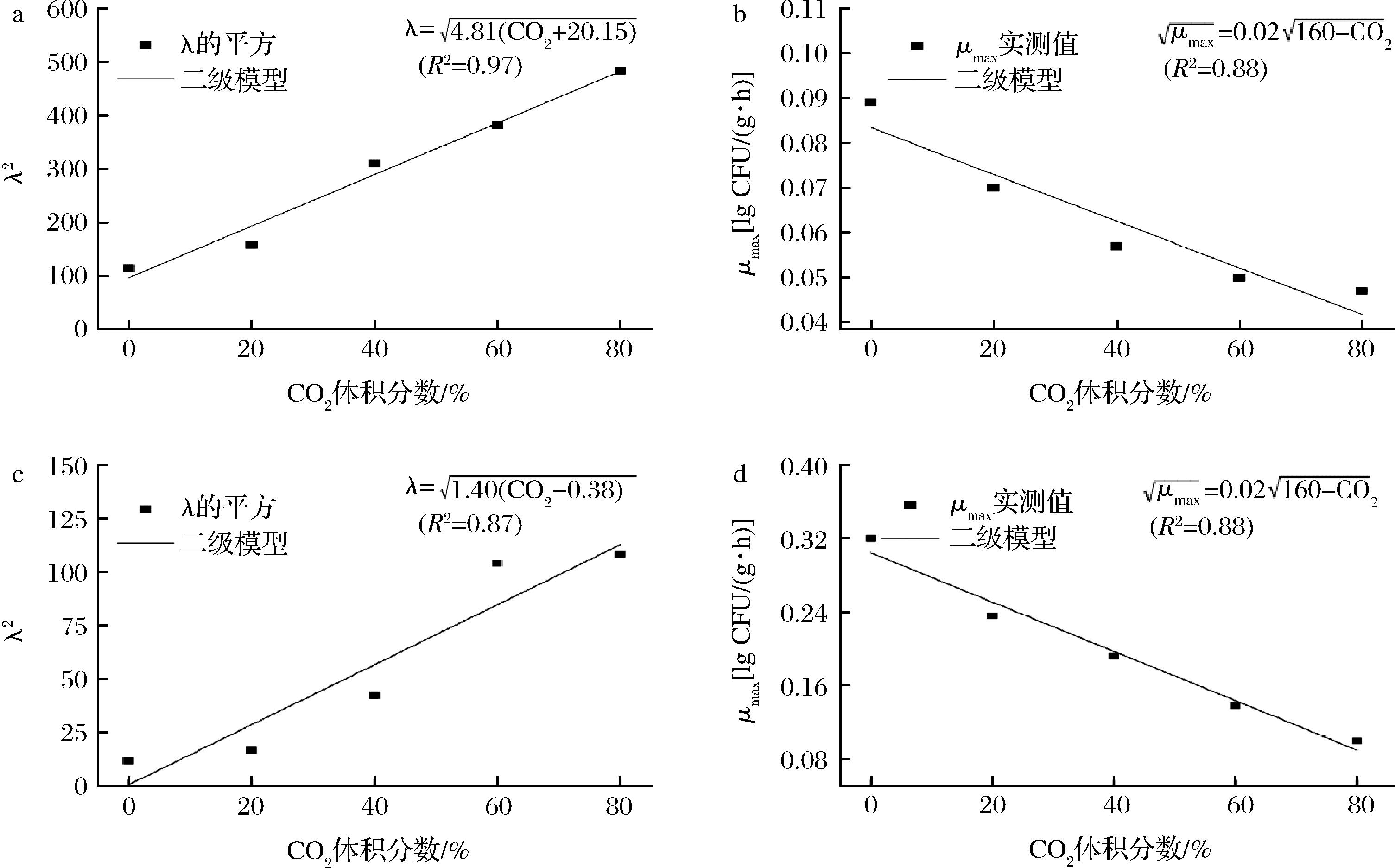
a-13 ℃时λ值;b-13 ℃时μmax值;c-25 ℃时λ值;b-25 ℃下μmax值
图3 CO2抑制单增李斯特菌生长的二级模型
Fig.3 Secondary models of L.monocytogenes inhibited by CO2 atmosphere
从构建的二级模型看出,13 ℃贮存时CO2 min和CO2 max体积分数分别为-20.15%和160%,表明在13 ℃时,理论上在CO2体积分数为-20.15%和160%时,单增李斯特菌依然可以生长。25 ℃贮存时,CO2 min和CO2 max体积分数分别为0.38%和100%,表明在25 ℃时,理论上在CO2体积分数为0.38%和100%时,单增李斯特菌依然可以生长。另外,图3的结果还表明,在同一温度下,CO2的浓度与单增李斯特菌λ2成正比,与μmax成反比。
模型的数学评价结果表明,Ratkowsky-type模型能够很好的拟合CO2对单增李斯特菌的抑制作用(R2≥0.87),可以用来描述CO2对单增李斯特菌生长特性的影响。从建立的模型可以计算任意CO2浓度条件下单增李斯特菌的λ和μmax,不需要进行传统的微生物计数就可以监控单增李斯特菌的生长动态。
3 结论
Baranyi模型、Gompertz模型和Logistic模型3种一级模型中,Baranyi模型对不同CO2气调包装猪肉中单增李斯特菌生长的拟合性优于其他两种一级模型。CO2体积分数为20%时就可以抑制单增李斯特菌生长,并且CO2浓度越高,抑制作用越强。和TC组相比,13 ℃(25 ℃)贮存时,20% CO2、40% CO2、60% CO2和80% CO2可将单增李斯特菌的λ分别延长0.18(0.19)、0.65(0.90)、0.83(1.97)、1.06(2.04)倍,可将μmax分别降低21%(26%)、36%(40%)、44%(57%)和47%(69%)。CO2对单增李斯特菌的Nmax无显著影响(P≥0.05),可将CO2与其他抑菌技术联用以更好地提高食品的微生物安全。另外,Ratkowsky-type模型能够很好的拟合CO2与单增李斯特菌λ及μmax的关系(R2≥0.87),可以用来描述CO2对单增李斯特菌生长特性的影响。
[1] YU T, JIANG X J.Prevalence and characterization of Listeria monocytogenes isolated from retail food in Henan, China[J].Food Control, 2014, 37(1):228-231.
[2] WU S, WU Q P, ZHANG J M, et al.Listeria monocytogenes prevalence and characteristics in retail raw foods in China[J].PLoS One, 2015, 10(8):e0136682.
[3] AL-ATI T, HOTCHKISS J H.The role of packaging film permselectivity in modified atmosphere packaging[J].Journal of Agricultural and Food Chemistry, 2003, 51(14):4133-4138.
[4] MIRANDA R O, CAMPOS-GALV O M E M, NERO L A.Expression of genes associated with stress conditions by Listeria monocytogenes in interaction with nisin producer Lactococcus lactis[J].Food Research International, 2018, 105:897-904.
O M E M, NERO L A.Expression of genes associated with stress conditions by Listeria monocytogenes in interaction with nisin producer Lactococcus lactis[J].Food Research International, 2018, 105:897-904.
[5] BELAY Z A, CALEB O J, OPARA U L.Modelling approaches for designing and evaluating the performance of modified atmosphere packaging (MAP) systems for fresh produce:A review[J].Food Packaging and Shelf Life, 2016, 10:1-15.
[6] 付丽, 胡小波, 马微.气调包装对冷却猪肉保鲜护色效果的研究[J].食品科技, 2009,34(5):143-148. FU L, HU X B, MA W.Shelf-life extension and colour stabilization of pork packaged in modified atmosphere packaging[J].Food Science and Technology, 2009,34(5):143-148.
[7] 刘柳, 孔保华.温度及气调包装对冷却猪肉中单核细胞增生性李斯特菌生长的影响[J].食品科学, 2008, 29(1):334-337. LIU L, KONG B H.Optimized effects of temperature and modified atmosphere packaging on Listeria monocytogenes of chilled pork[J].Food Science, 2008, 29(1):334-337.
[8] DE ![]() A J, WHITING R C.Modeling the physiological state of the inoculum and CO2 atmosphere on the lag phase and growth rate of Listeria monocytogenes[J].Journal of Food Protection, 2008, 71(9):1915-1918.
A J, WHITING R C.Modeling the physiological state of the inoculum and CO2 atmosphere on the lag phase and growth rate of Listeria monocytogenes[J].Journal of Food Protection, 2008, 71(9):1915-1918.
[9] PIFFARETTI J C, KRESSEBUCH H, AESCHBACHER M, et al.Genetic characterization of clones of the bacterium Listeria monocytogenes causing epidemic disease[J].Proceedings of the National Academy of Sciences of the United States of America, 1989, 86(10):3818-3822. [10] WAGENMAKERS E J, FARRELL S.AIC model selection using Akaike weights[J].Psychonomic Bulletin &Review, 2004, 11(1):192-196.
[11] KOUTSOUMANIS K P, KENDALL P A, SOFOS J N.A comparative study on growth limits of Listeria monocytogenes as affected by temperature, pH and aw when grown in suspension or on a solid surface[J].Food Microbiology, 2004, 21(4):415-422.
[12] 叶可萍. 真空包装冷却猪肉中单增李斯特菌的生长预测模型研究[D].南京:南京农业大学, 2013. YE K P. Study on growth prediction model of Listeria monocytogenes in vacuum packaging chilled pork[D].Nanjing: Nanjing Agricultural University, 2013.
[13] LEE Y J, JUNG B S, YOON H J, et al.Predictive model for the growth kinetics of Listeria monocytogenes in raw pork meat as a function of temperature[J].Food Control, 2014, 44:16-21.
[14] SCHIRMER B C, LANGSRUD S.A dissolving CO2 headspace combined with organic acids prolongs the shelf-life of fresh pork[J].Meat Science, 2010, 85(2):280-284.
[15] GEYSEN S, VERLINDEN, B E, GEERAERD A H, et al.Predictive modelling and validation of Listeria innocua growth at superatmospheric oxygen and carbon dioxide concentrations[J].International Journal of Food Microbiology, 2005, 105 (3):333-345.
[16] DEVLIEGHERE F, GEERAERD A H, VERSYCK K J, et al.Growth of Listeria monocytogenes in modified atmosphere packed cooked meat products:A predictive model[J].Food Microbiology, 2001, 18(1):53-66.
[17] BENNIK M H J, SMID E J, ROMBOUTS F M, et al.Growth of psychrotrophic foodborne pathogens in a solid surface model system under the influence of carbon dioxide and oxygen[J].Food Microbiology, 1995, 12:509-519.
[18] SWINNEN I A M, BERNAERTS K, DENS E J J, et al.Predictive modelling of the microbial lag phase:A review[J].International Journal of Food Microbiology, 2004, 94(2):137-159.
[19] NORIEGA E, LACA A, D AZ M.Modelling of diffusion-limited growth to predict Listeria distribution in structured model foods[J].Journal of Food Engineering, 2008, 87(2):247-256.
AZ M.Modelling of diffusion-limited growth to predict Listeria distribution in structured model foods[J].Journal of Food Engineering, 2008, 87(2):247-256.
[20] BEGOT C, LEBERT I, LEBERT A.Variability of the response of 66 Listeria monocytogenes and Listeria innocua strains to different growth conditions[J].Food Microbiology, 1997, 14(5):403-412.
[21] JAKOBSEN M, BERTELSEN G.Solubility of carbon dioxide in fat and muscle tissue[J].Journal of Muscle Foods, 2006, 17(1):9-19.
[22] BUCHANAN R L, GORRIS L G M, HAYMAN M M, et al.A review of Listeria monocytogenes:An update on outbreaks, virulence, dose-response, ecology, and risk assessments[J].Food Control, 2017, 75:1-13.
[23] 张文敏, 董庆利, 辛宝, 等.猪肉制品中单增李斯特菌污染现状及致病力控制分析[J].食品与发酵工业, 2023,49(17):299-307. ZHANG W M, DONG Q L, XIN B, et al.Contamination status and pathogenicity control of Listeria monocytogenes in pork products[J].Food and Fermentation Industries, 2023,49(17):299-307.