透明质酸(hyaluronic acid, HA)是由N-乙酰氨基葡萄糖(N-acetylglucosamine, GlcNAc)和D-葡萄糖醛酸(D-glucuronic acid, GlcA)重复二糖组成的一种线性糖胺聚糖,与HA特定蛋白质TSG6或细胞膜受体CD44、RHAMM、HARE和TLR4/2相互作用,调节机体生长发育、细胞存活和炎症反应[1],主要存在于皮肤真皮层、眼玻璃体液、滑膜关节液、关节软骨和中枢神经系统等,具有高黏弹性,能维持皮肤弹性和保持皮肤水分、减少关节摩擦、调节眼压和参与神经元网的形成的作用[2]。在健康个体中,HA的合成和降解处于一种动态平衡中。随着机体的衰老,体内HA的合成减少,降解增加,导致体内HA总含量下降[3-4],随之带来一系列年龄相关问题,如眼花、皮肤老化、关节功能退化及僵硬、大脑记忆功能衰退等。因此增加相关部位HA的含量,可延缓机体的衰老症状。
口服外源性HA是目前增加组织部位HA含量的常用手段,但口服HA吸收利用率较低。一项研究发现大鼠口服99mTc-HA后粪便HA的排泄量达到92.3%[4]。口服125I-HA的动物实验表明在2 h内胃和小肠的放射性降低,而大肠的放射性升高,同时组织的放射性也较低,说明HA较难从胃肠道吸收[5]。此外,HA的半衰期约为1~1.5 d,外源性HA进入体内迅速经HA酶降解后多数被排泄,难以持续有效地在组织部位发挥功效[6]。针对上述问题,有研究者将注意力从外源摄入HA转移到促进内源HA合成上,以实现体内HA含量增加。后生元是一种由灭活益生菌制备的新型微生态制剂,比益生菌更具安全性和稳定性,也更易生产和贮存[7],其成分主要有肽聚糖、胞外多糖、磷壁酸、细菌素和有机酸等[8],研究发现一些由植物乳植杆菌制备的后生元具备促进HA合成的能力,例如,热灭活的植物乳植杆菌L-137处理BALB/3T3成纤维细胞可提高HA含量和透明质酸合成酶2(hyaluronic acid synthase, HAS2)mRNA表达[9],由植物乳植杆菌K8制备的后生元促进了HaCaT细胞的HA含量和并上调了HAS2 mRNA表达[10]。但是植物乳植杆菌对HA合成研究多数仅限于细胞实验,缺乏体内HA的合成数据,本研究通过向小鼠注射D-半乳糖建立衰老模型,探讨植物乳植杆菌CCFM1296及其制备的后生元对小鼠组织中HA合成的影响,并进一步分析了其对抗衰老的效果,为开发调控宿主HA含量和抗衰老的益生菌产品提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂
植物乳植杆菌CCFM1295、植物乳植杆菌CCFM1296、植物乳植杆菌CCFM1297均来自江南大学食品生物技术保藏中心(江苏无锡)。
实时荧光质量PCR相关引物,上海生工公司;透明质酸试剂盒,上海酶联公司;RNA提取试剂盒、逆转录试剂盒、荧光定量试剂盒,南京诺维赞公司;谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒、总抗氧化能力(total antioxidant capacity, T-AOC)活性试剂盒、过氧化氢酶(catalase,CAT)活性试剂盒,南京建成公司;D-半乳糖,上海阿拉丁公司。
1.1.2 仪器与设备
隔水式恒温生物培养箱,上海森信实验仪器有限公司;实时荧光定量PCR仪,美国Bio-Rad公司;酶标仪,美国Thermo公司;高通量组织研磨器,宁波新芝生物科技股份有限公司;皮肤水分仪、皮肤弹性仪,德国CK公司;生化分析仪,深圳迈瑞公司。
1.2 菌悬液的制备
待植物乳植杆菌CCFM1295、CCFM1296、CCFM1297活化后将其接种于液体MRS培养基中37 ℃扩培24 h,于4 ℃、8 000 r/min离心20 min,无菌生理盐水清洗菌泥2次,4 ℃备用。
1.3 后生元的制备
后生元的制备参照ALMADA等[11]的总结,采用了热处理与高压均质联合的方式,并对具体条件稍作改动。过夜培养的植物乳植杆菌CCFM1295、CCFM1296、CCFM1297,倾注法计算总活菌数,并在制备前稀释至与灌胃所需的活菌数一致,热处理(65 ℃,30 min)并进行高压均质(800~1 200 MPa,3次)后,得到后生元并冻干备用。
1.4 动物实验设计
雄性BALB/c实验小鼠(8周龄,SPF级,体重20~22 g)购于维通利华。动物实验方案获得江南大学实验动物实验伦理委员会批准(伦理编号为:JN.No20211215b2050601)。将40只实验小鼠随机分为空白组(Control)、模型组(Model)、植物乳植杆菌CCFM1295活菌组(CCFM1295-L)、植物乳植杆菌CCFM1295后生元组(CCFM1295-D)、植物乳植杆菌CCFM1296活菌组(CCFM1296-L)、植物乳植杆菌CCFM1296后生元组(CCFM1296-D)、植物乳植杆菌CCFM1297活菌组(CCFM1297-L)、植物乳植杆菌CCFM1297后生元组(CCFM1297-D),每组5只。适应性饲养1周后,除空白组(Control)外,其余各组小鼠每天皮下注射生理盐水配制的D-半乳糖(500 mg/kg)[12],造模9周。造模期间,CCFM1295-L组、CCFM1296-L组、CCFM1297-L组小鼠每只每天灌胃5×109 CFU/kg体重的菌悬液[13],CCFM1295-D组、CCFM1296-D组、CCFM1297-D组小鼠每天灌胃500 mg/kg体重的后生元溶液。空白组和模型组小鼠每天灌胃等体积生理盐水。最后一次干预造模24 h后,称记小鼠体重,处死小鼠,立即取样。
1.5 皮肤水分、弹性测定
造模9周后,用无菌剃毛刀剃净小鼠颈背部毛发,用皮肤水分和弹性测定仪[14]检测每只小鼠的下背部至臀部区域的左侧和右侧皮肤水分,交替测量10次,分别剔除2个最低值和最高值后,以剩余6个值的平均数为小鼠皮肤水分和皮肤弹性,测量时固定小鼠,保证仪器表面与待测皮肤垂直接触。
1.6 HA含量测定
取小鼠背部皮肤、关节组织、脑和眼球加入预冷的PBS于高通量组织研磨仪制成10%、16%、33%和20%匀浆后,4 ℃、3 000 r/min条件下离心10 min,取上清液,按照HA ELISA试剂盒说明书检测各组织中HA含量。
1.7 实时荧光定量PCR检测小鼠组织的mRNA表达
采用提RNA试剂盒按说明书提取小鼠皮肤、关节、眼、脑组织总RNA,用Nanodrop检测OD260/OD280的数值,将1 μg总RNA通过逆转录试剂盒反转录成20 μL cDNA,以SYBR Green qPCR Master Mix用于实时荧光定量PCR反应体系配制。以GAPDH作为内参基因,基于2-ΔΔCt方法计算目的基因相对表达量。引物序列见表1。
1.8 血清指标测定
采用眼眶静脉丛采集小鼠血液,静置2 h,3 000 r/min 低温离心10 min,取上清液。采用生化分析仪测定与衰老相关的血清生化指标,包括C反应蛋白(C-reactive protein,CRP)、谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、胆碱酯酶(cholinesterase,CHE)、肌酸激酶(creatine kinase,CK)。
表1 小鼠用引物序列
Table 1 Primer sequences of mice
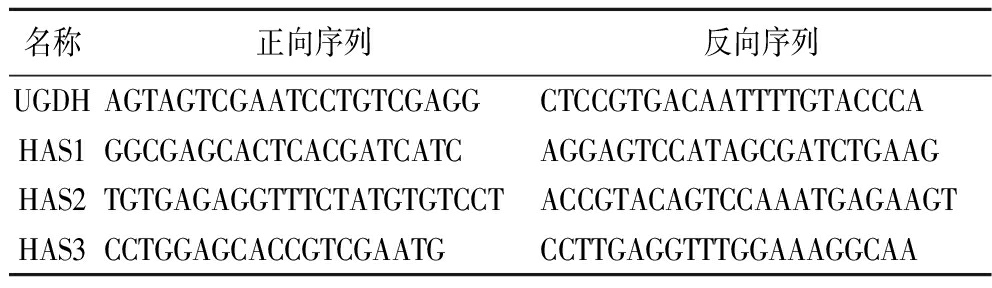
名称正向序列反向序列UGDHAGTAGTCGAATCCTGTCGAGGCTCCGTGACAATTTTGTACCCAHAS1GGCGAGCACTCACGATCATCAGGAGTCCATAGCGATCTGAAGHAS2TGTGAGAGGTTTCTATGTGTCCTACCGTACAGTCCAAATGAGAAGTHAS3CCTGGAGCACCGTCGAATGCCTTGAGGTTTGGAAAGGCAA
1.9 皮肤组织CAT活力、GSH-Px和T-AOC测定
取小鼠背部皮肤加入预冷的PBS于高通量组织研磨仪制成10%匀浆后,于4 ℃、3 000 r/min条件下离心10 min,取上清液,按照试剂盒说明测定小鼠皮肤CAT活力、GSH-Px和T-AOC。
1.10 数据统计分析
采用SPSS 26.0统计软件来对显著性差异进行统计学分析,实验结果以平均值±标准误差(Mean±SE)表示,组间比较使用单因素方差分析(One-Way ANOVA)。P<0.05表示差异显著。
2 结果与分析
2.1 不同植物乳植杆菌及后生元对小鼠体重的影响
实验过程中,空白组小鼠皮毛顺滑光亮,行动比较灵活;模型组小鼠毛色黯淡疏松,行动迟缓;而CCFM1296-L和CCFM1296-D组的小鼠毛色和活力相比较模型组有一定程度改善。各组小鼠在实验期间体重均出现缓慢增长,组间无明显差异(图1),表明灌胃植物乳植杆菌和后生元对小鼠无副作用。
2.2 不同植物乳植杆菌及后生元对小鼠皮肤水分、弹性的影响
D-半乳糖的过量积累可引起皮肤发生氧化应激,其产生的自由基可攻击HA聚合物导致HA降解[15],同时攻击真皮层纤维细胞,导致屏障功能受损,发生皮肤水分和弹性均下降的衰老迹象[16]。由图2-a和图2-b所示,模型组小鼠皮肤水分和弹性相比于空白组组显著降低(P<0.001),CCFM1296-L组显著增加了D-半乳糖诱导小鼠的皮肤水分和弹性(P<0.001),而CCFM1296-D虽然也提高了皮肤水分与弹性,但皮肤水分与模型组相比无显著性差异(P>0.05),其他植物乳植杆菌以及制备的后生元对注射D-半乳糖后的皮肤水分和皮肤弹性无显著影响(P>0.05)。皮肤微生物组成具有年龄相关性,年轻女性的皮肤微生物多样性高于年老女性[17],一些研究表示口服益生菌或后生元能够改善皮肤微生物多样性,减少皮肤衰老迹象[18],其次,肠道微生物群失衡导致的肠道微生态失调,与皮肤不良反应有关。肠道微生态失衡后分泌的游离苯酚和对甲酚进入循环并蓄积在皮肤中,导致角质细胞尺寸减小和水分流失[19]。口服益生菌和后生元可减少苯酚和对甲酚水平,并增强角质层水合作用[20-21],这表明益生菌可能通过调节肠道或皮肤微生物群平衡来恢复皮肤稳态。
图1 实验期间小鼠体重变化
Fig.1 Body weight changes in different groups of mice

a-皮肤水分;b-皮肤弹性
图2 不同植物乳植杆菌及后生元对小鼠皮肤水分、弹性的影响
Fig.2 Effects of different Lactiplantibacillus planturum and postbiotics on skin moisture and elasticity in mice
注:与对照组比较,#P<0.05,##P<0.01,###P<0.001; 与模型组比较,*P<0.05,**P<0.01,***P<0.001(下同)。
2.3 不同植物乳植杆菌及后生元对小鼠组织HA含量的影响
HA在皮肤组织中含量最高,并因为其极端的亲水性和黏弹性保持着皮肤中的水分含量和弹性[22]。作为机体的天然润滑剂,HA对眼睛和关节健康也至关重要[23],此外,HA构成的神经元网还涉及神经元的成熟[24]。灌胃不同植物乳植杆菌和后生元对小鼠皮肤、眼球、关节、脑的HA含量影响如图3所示。相较于空白组,模型组的HA含量显著降低(P<0.001),说明在衰老过程中,HA的流失增加。向小鼠给予CCFM1296-L和CCFM1296-D均显著地增加了皮肤、眼球和关节组织的HA含量(P<0.05)。但是,CCFM1296-L干预并未对脑组织的HA含量产生显著影响(P>0.05),只有CCFM1296-D相比模型组增加了HA含量(P<0.05),其他植物乳植杆菌及其制备的后生元对小鼠皮肤、眼、脑、关节等组织的HA含量无显著影响(P>0.05)。上述结果表明CCFM1296-L显著地提高了皮肤、眼球、关节的HA水平,而CCFM1296-D不但显著增加了皮肤、眼球、关节组织的HA含量,也增加了脑组织的HA含量。CCFM1296-L和CCFM1296-D对脑HA含量影响的差异可能与活菌与后生元不同的免疫活性有关。在一项研究中发现植物乳植杆菌 L-137制备的后生元在激活IFN-γ或TNF-α后诱导了细胞HA的产生,若抑制IFN-γ或TNF-α则可限制HA的产生[9],这说明植物乳植杆菌活菌可能限制了IFN-γ或TNF-α的释放抑制了脑中HA产生。

a-皮肤;b-眼球;c-关节;d-脑
图3 不同植物乳植杆菌及后生元对小鼠皮肤、眼球、关节、脑的HA含量影响
Fig.3 Effects of different Lactiplantibacillus planturum and postbiotics on HA content in skin, eye, joint, and brain of mice
2.4 植物乳植杆菌CCFM1296及后生元对小鼠组织HA合成酶基因表达的影响
在HA合成过程中有4种重要的合成酶类,其活性直接调控着HA的含量,分别为UDP-葡萄糖脱氢酶(UDP-glucose dehydrogenase, UGDH)、HAS1、HAS2、HAS3。其中,UGDH是催化UDP-葡萄糖向UDP-GlcA转化的限速酶,产生UDP-GlcA后,由HAS在细胞膜上通过β-1,3和β-1,4糖苷键交替连接UDP-GlcA和UDP-GlcNAc,生成长链HA,而HAS的3种同工酶都能参与催化不同分子质量HA的合成[25]。为了探讨影响机体HA合成的机制,进一步检测了CCFM1296-L和CCFM1296-D干预后小鼠组织HA合成酶的表达情况(图4)。在皮肤、关节、眼、脑组织中,与空白组比较,模型组UGDH、HAS1、HAS2、HAS3的mRNA相对表达量均显著性降低(P<0.01),CCFM1296-L的干预显著上调了关节中UGDH mRNA和HAS1 mRNA的表达(P<0.05),而CCFM1296-D显著上调了脑UGDH mRNA和眼HAS1 mRNA的表达(P<0.05);对于皮肤、关节、眼组织的HAS2 mRNA表达,CCFM1296-L和CCFM1296-D口服均显著上调(P<0.05),且CCFM1296-D还显著上调了脑HAS2 mRNA的表达(P<0.01);另外,口服CCFM1296-L也显著增加了皮肤HAS3 mRNA的表达(P<0.05)。HAS2是HA合成过程中最重要的一类合成酶,对哺乳动物的生存影响最大,HAS2在胚胎心脏形态发生的上皮间充质转化和血管生成中起重要作用,其缺失导致机体严重畸形和死亡[26],研究表明促进细胞中的HAS2 mRNA过表达可使HA水平增加3倍以上[27],这说明CCFM1296-L和CCFM1296-D可能通过促进HAS2 mRNA表达水平来增加组织部位HA含量。
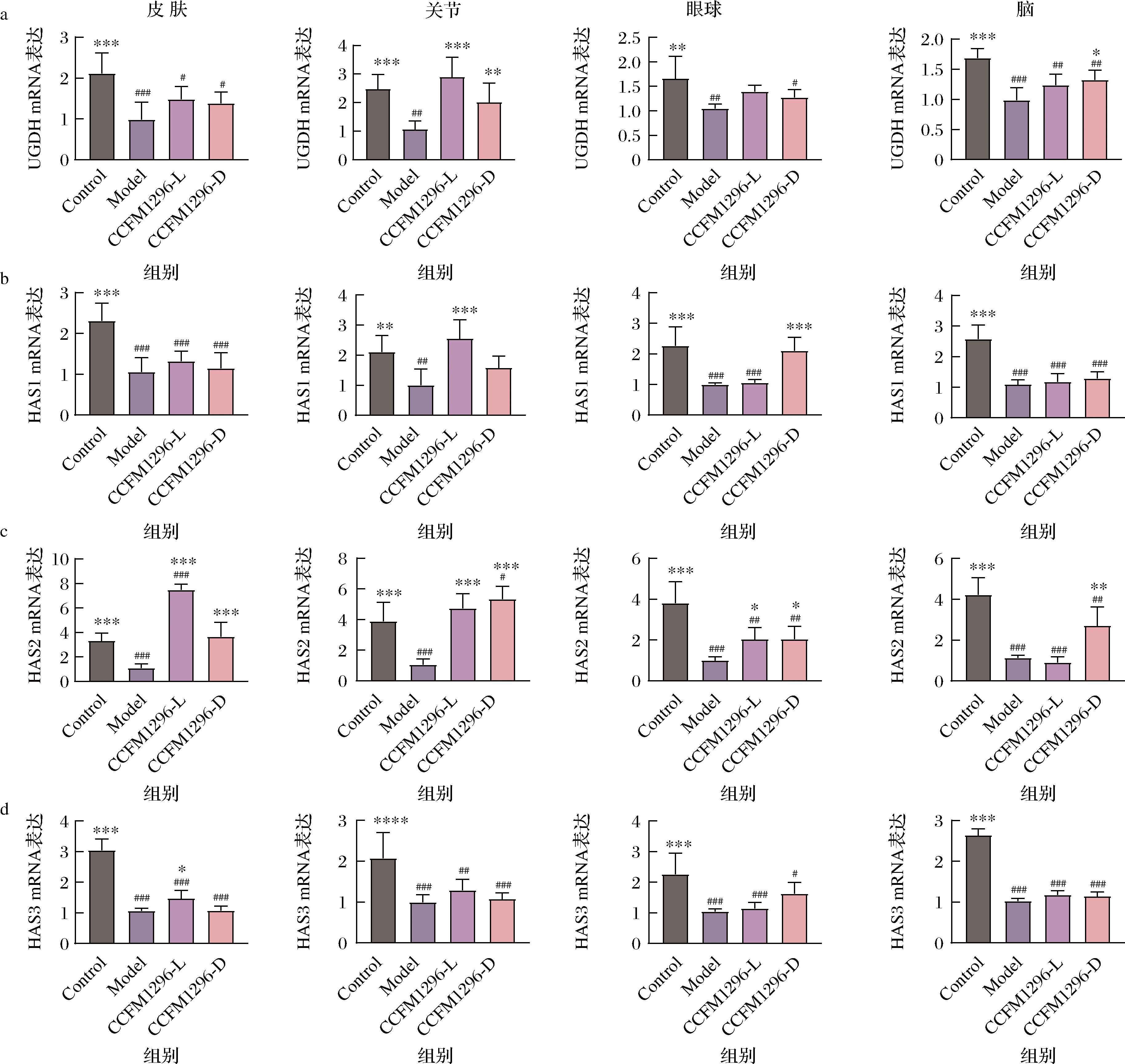
a-UGDH mRNA;b-HAS1 mRNA;c-HAS2 mRNA;d-HAS3 mRNA
图4 CCFM1296-L和CCFM1296-D对小鼠皮肤、眼球、关节、脑的HA合成酶基因表达的影响
Fig.4 Effects of CCFM1296-L and CCFM1296-D on the expression of HA synthase gene in skin, eye, joint and brain of mice
注:a~d图中从左至右依次为皮肤、关节、眼球、脑。
2.5 植物乳植杆菌CCFM1296及后生元对小鼠血清指标的影响
为了进一步评估具有促进HA合成能力的CCFM1296-L和CCFM1296-D对小鼠衰老的影响,我们检测了血清中CRP的含量和ALT、AST、ALP、CHE、CK的活力状况。由图5-a~图5-f可知,与空白组相比,模型组的CRP含量、ALT、AST、ALP、CK水平显著增加(P<0.001),CHE水平显著降低(P<0.05)。给予小鼠CCFM1296-L和CCFM1296-D则显著地降低了血清中CRP、ALT、AST、ALP、CK水平,并上调了CHE活性(P<0.05)。综合以上结果表明,植物乳植杆菌CCFM1296及其制备的后生元均具有缓解小鼠衰老的作用。
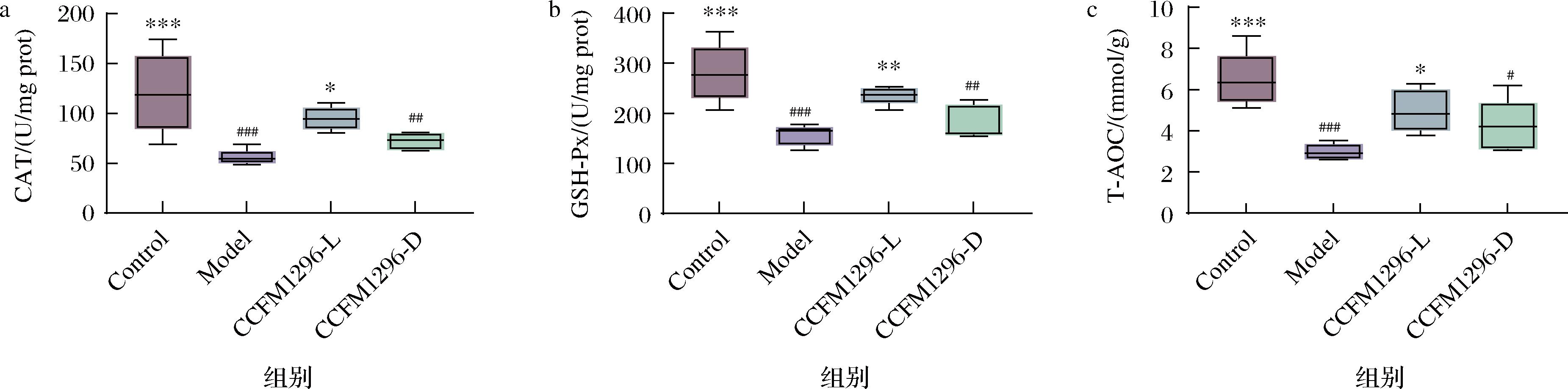
2.6 植物乳植杆菌CCFM1296及后生元对小鼠皮肤CAT、GSH-Px、T-AOC活力的影响
HA在体内具有良好的抗氧化能力,能够提高机体抗氧化酶活性实现抗衰老作用[28],故对能够促进HA合成的CCFM1296-L和CCFM1296-D的抗氧化能力进行检测。图6展示了皮肤的抗氧化水平,D-半乳糖诱导的模型组与空白组相比,显著降低了CAT、GSH-Px和T-AOC活力(P<0.001),这意味着D-半乳糖引发了皮肤氧化应激。利用CCFM1296-L和CCFM1296-D对小鼠进行干预后,结果CCFM1296-L组表现出了抑制氧化应激的行为,显著提高了CAT、GSH-Px和T-AOC活力(P<0.05),增强了皮肤的抗氧化能力,而CCFM1296-D虽也增强了抗氧化能力,却未与模型组表现出显著性差异(P>0.05),这可能与CCFM1296-L比CCFM1296-D调控皮肤HA合成能力更强有关。一项研究表明裸鼹鼠体内分泌高水平的HA,使裸鼹鼠具有更强抵抗衰老和疾病的能力,降低HA含量后裸鼹鼠的抵抗能力也随之下降[29],本研究中CCFM1296-L在皮肤中产生的HA水平高于CCFM1296-D,说明促进HA合成的益生菌能够增强皮肤防御,且促HA合成能力越强,效果越强。
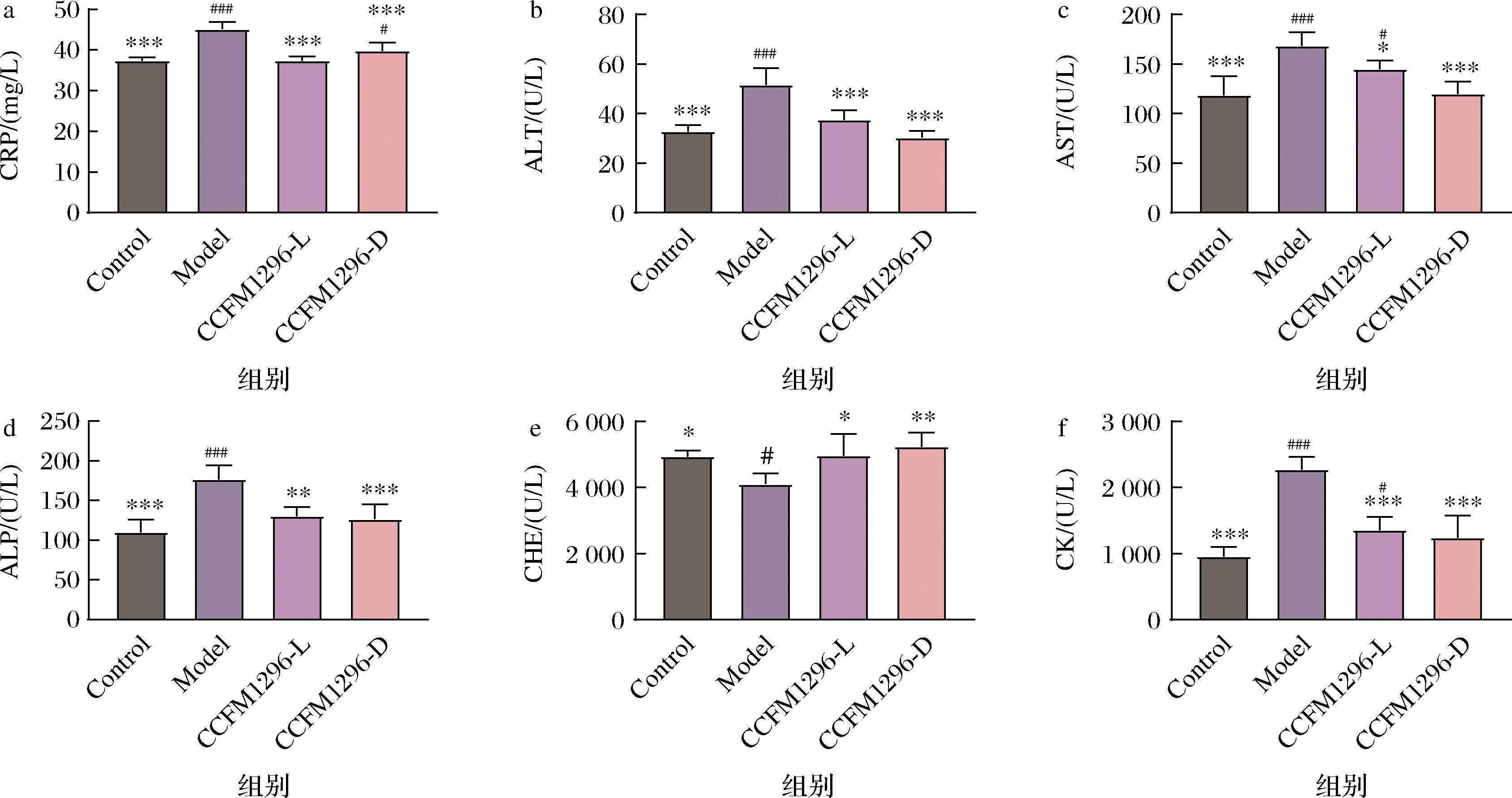
a-CRP;b-ALT;c-AST;d-ALP;e-CHE;f-CK
图5 CCFM1296-L和CCFM1296-D对小鼠血清生化指标的影响
Fig.5 Effects of CCFM1296-L and CCFM1296-D on serum biochemical indexes in mice
a-CRP;b-ALT;c-AST;d-ALP;e-CHE;f-CK
图6 CCFM1296-L和CCFM1296-D对小鼠皮肤CAT、GSH-Px、T-AOC活力的影响
Fig.6 Effects of CCFM1296-L and CCFM1296-D on the activities of CAT, GSH-Px and T-AOC in mice skin
3 结论
本研究利用D-半乳糖构建动物衰老模型,研究了植物乳植杆菌CCFM1295、CCFM1296、CCFM1297活菌和制备的后生元对内源性HA合成和衰老的影响,结果表明植物乳植杆菌CCFM1296活菌和制备的后生元能够增加衰老小鼠的内源性HA含量,并通过增加CHE水平和降低血清AST、ALT、ALP、CK、CRP水平来抑制衰老的不健康状态,同时增加小鼠皮肤含水量、皮肤弹性、CAT、GSH-Px和T-AOC活力,具有一定的体内抗衰老作用,为通过口服益生菌增加内源性HA含量并改善机体衰老提供了一种新的思路,然而植物乳植杆菌CCFM1296活菌及后生元调控宿主HA合成的关键功能成分和具体作用机制还需要进一步通过代组学技术和菌群分析进行确定。
[1] VIGETTI D, KAROUSOU E, VIOLA M, et al.Hyaluronan:Biosynthesis and signaling[J].Biochimica Et Biophysica Acta, 2014, 1840(8):2452-2459.
[2] KHAING Z Z, SEIDLITS S K.Hyaluronic acid and neural stem cells:implications for biomaterial design[J].Journal of Materials Chemistry B, 2015, 3(40):7850-7866.
[3] 熊慧, 戢丹菊, 杨家林, 等.九龙虫对衰老小鼠皮肤的影响[J].鄂州大学学报, 2021, 28(5):108-110. XIONG H, JI D J, YANG J L, et al.The effect of Jiulong worms on the skin of aged mice[J].Journal of Ezhou University, 2021, 28(5):108-110.
[4] BALOGH L, POLYAK A, MATHE D, et al.Absorption, uptake and tissue affinity of high-molecular-weight hyaluronan after oral administration in rats and dogs[J].Journal of Agricultural and Food Chemistry, 2008, 56(22):10582-10593.
[5] MA S Y, NAM Y R, JEON J, et al.Simple and efficient radiolabeling of hyaluronic acid and its in vivo evaluation via oral administration[J].Journal of Radioanalytical and Nuclear Chemistry, 2015, 305(1):139-145.
[6] YAMAGUCHI Y, YAMAMOTO H, TOBISAWA Y, et al.TMEM2:A missing link in hyaluronan catabolism identified?[J].Matrix Biology, 2019, 78-79:139-146.
[7] CUEVAS-GONZ LEZ P F, LICEAGA A M, AGUILAR-TOAL
LEZ P F, LICEAGA A M, AGUILAR-TOAL J E.Postbiotics and paraprobiotics:From concepts to applications[J].Food Research International, 2020, 136:109502.
J E.Postbiotics and paraprobiotics:From concepts to applications[J].Food Research International, 2020, 136:109502.
[8] MARCO M L, HEENEY D, BINDA S, et al.Health benefits of fermented foods:Microbiota and beyond[J].Current Opinion in Biotechnology, 2017, 44:94-102.
[9] NAKAI H, HIROSE Y, MUROSAKI S, et al.Lactobacillus plantarum L-137 upregulates hyaluronic acid production in epidermal cells and fibroblasts in mice[J].Microbiology and Immunology, 2019, 63(9):367-378. [10] BLACKBURN M R, HUBBARD C, KIESSLING V, et al.Distinct reaction mechanisms for hyaluronan biosynthesis in different Kingdoms of life[J].Glycobiology, 2018, 28(2):108-121.
[11] DE ALMADA C N, ALMADA C N, MARTINEZ R C R, et al.Paraprobiotics:Evidences on their ability to modify biological responses, inactivation methods and perspectives on their application in foods[J].Trends in Food Science &Technology, 2016, 58:96-114.
[12] SHENG K L, YANG J, XU Y F, et al.Alleviation effects of grape seed proanthocyanidin extract on inflammation and oxidative stress in a D-galactose-induced aging mouse model by modulating the gut microbiota[J].Food &Function, 2022, 13(3):1348-1359.
[13] LI F, HUANG G B, TAN F, et al.Lactobacillus plantarum KSFY06 on d-galactose-induced oxidation and aging in Kunming mice[J].Food Science &Nutrition, 2020, 8(1):379-389.
[14] YAN Z, LIU S A, LIU A Q, et al.The oral administration of elastin peptide reduces ultraviolet light-induced photoaging in hairless mice[J].Pakistan Journal of Zoology, 2021, 54(1):153-160.
[15] SOLTÉS L, MENDICHI R, KOGAN G, et al.Degradative action of reactive oxygen species on hyaluronan[J].Biomacromolecules, 2006, 7(3):659-668.
[16] 张松, 党学良, 石磊, 等.复合藻对D-半乳糖诱导小鼠衰老模型皮肤屏障功能的改善作用[J].中国美容医学, 2022, 31(7):110-114. ZHANG S, DANG X L, SHI L, et al.Effect of compound algae on skin barrier function of D-galactose-induced mouse aging model[J].Chinese Journal of Aesthetic Medicine, 2022, 31(7):110-114.
[17] SHIBAGAKI N, SUDA W, CLAVAUD C, et al.Aging-related changes in the diversity of women′s skin microbiomes associated with oral bacteria[J].Scientific Reports, 2017, 7(1):10567.
[18] WOOLERY-LLOYD H, ANDRIESSEN A, DAY D, et al.Review of the microbiome in skin aging and the effect of a topical prebiotic containing thermal spring water[J].Journal of Cosmetic Dermatology, 2023, 22(1):96-102.
[19] IIZUKA R, KAWAKAMI K, CHIBA K.Gut bacteria producing phenols disturb keratinocyte differentiation in human skin[J].Microbial Ecology in Health and Disease, 2009, 21(3-4):221-227.
[20] MIYAZAKI K, MASUOKA N, KANO M, et al.Bifidobacterium fermented milk and galacto-oligosaccharides lead to improved skin health by decreasing phenols production by gut microbiota[J].Beneficial Microbes, 2014, 5(2):121-128.
[21] LEE D E, HUH C S, RA J, et al.Clinical evidence of effects of Lactobacillus plantarum HY7714 on skin aging:A randomized, double blind, placebo-controlled study[J].Journal of Microbiology and Biotechnology, 2015, 25(12):2160-2168.
[22] HSU T F, SU Z R, HSIEH Y H, et al.Oral hyaluronan relieves wrinkles and improves dry skin:A 12-week double-blinded, placebo-controlled study[J].Nutrients, 2021, 13(7):2220.
[23] GUTER M, BREUNIG M.Hyaluronan as a promising excipient for ocular drug delivery[J].European Journal of Pharmaceutics and Biopharmaceutics, 2017, 113:34-49.
[24] MIRZADEH Z, ALONGE K M, CABRALES E, et al.Perineuronal net formation during the critical period for neuronal maturation in the hypothalamic arcuate nucleus[J].Nature Metabolism, 2019, 1(2):212-221.
[25] HELDIN P, LIN C Y, KOLLIOPOULOS C, et al.Regulation of hyaluronan biosynthesis and clinical impact of excessive hyaluronan production[J].Matrix Biology, 2019, 78-79:100-117.
[26] CAMENISCH T D, SPICER A P, BREHM-GIBSON T, et al.Disruption of hyaluronan synthase-2 abrogates normal cardiac morphogenesis and hyaluronan-mediated transformation of epithelium to mesenchyme[J].The Journal of Clinical Investigation, 2000, 106(3):349-360.
[27] ZHU Y, LI N, HUANG M Y, et al.Adipose tissue hyaluronan production improves systemic glucose homeostasis and primes adipocytes for CL 316,243-stimulated lipolysis[J].Nature Communications, 2021, 12:4829.
[28] KE C L, SUN L P, QIAO D L, et al.Antioxidant acitivity of low molecular weight hyaluronic acid[J].Food and Chemical Toxicology, 2011, 49(10):2670-2675.
[29] TIAN X, AZPURUA J, HINE C, et al.High-molecular-mass hyaluronan mediates the cancer resistance of the naked mole rat[J].Nature, 2013, 499(7 458):346-349.