山奈酚(kaempferol)是常见的典型天然多羟基黄酮类化合物,呈现出黄色粉末状态,广泛存在于各种水果、蔬菜及中草药等天然植物中。具有抗癌[1]、抗氧化、抗炎、防治糖尿病[2]、保护神经、肝脏和心肌、抑制蛋白激酶等多方面的营养保健作用。但山奈酚水溶性差[3],导致其在食品营养及医药领域的生物利用率低,因此提高其水溶性和稳定性是解决应用受限的关键问题。目前,已有学者将山奈酚包裹成白蛋白纳米粒[4]以及负载于壳聚糖内[3],有效提高了山奈酚的生物利用率。
铁蛋白(ferritin)是一类广泛存在于动物、植物及微生物中的储铁蛋白,主要由蛋白质外壳和铁核两部分组成[5],铁蛋白外壳分子结构保守,内外径分别为8 nm和12 nm,由24个亚基组成的中空笼状结构[6]。因此铁蛋白是一类天然的纳米载体,刚性的蛋白质外壳使其在纳米材料的应用研究中具有优势。并且铁蛋白分布广泛、来源丰富、含量高、便于分离纯化、无毒无害、生物相容性好,还是一类很好的营养物质。对于大肠杆菌诱导产生日本囊对虾铁蛋白(Marsupenaeus japonicus ferritin, MjF)具有无需脱铁和可大批量生产的特点。目前,将食品生物活性小分子物质装载进铁蛋白腔内主要依赖于pH调控的可逆组装特性,例如铁蛋白分子装载β-胡萝卜素[7]、花色苷[8]、芦丁[9]及姜黄素[10]等。然而,有学者研究表明,铁蛋白在极酸性或极碱性条件下发生解离重组并非完全可逆[11],极酸极碱处理后的铁蛋白的二级结构将遭到破坏。为避免此类情况发生,通过对铁蛋白进行改性后再装载的方法不断涌现,超声处理[12]、大气冷离子体处理[13]、高静压处理[14]、脉冲电场处理[15]、高浓度尿素诱导[16]、热处理[17]等改性方法,都使得铁蛋白能在温和的条件下进行解离。
超声波技术已经广泛应用于制备纳米材料,例如乳液和含β-胡萝卜素的酪蛋白纳米颗粒[18]。并且张晨曦等[12]研究了超声辅助法制备铁蛋白-虾青素复合物,采用超声处理扩大铁蛋白通道对虾青素进行装载。本文旨在对比超声辅助法、高浓度尿素诱导法以及pH调控法3种不同装载法制备的重组虾铁蛋白-山奈酚(recombinant Marsupenaeus japonicus ferritin kaempferol, rMjFK)复合物的各方面性质,探究出更温和的装载方法。
1 材料与方法
1.1 材料与试剂
含虾重组铁蛋白质粒(pET-3a)的大肠杆菌BL21(DE-3),中国农业大学;山奈酚(纯度≥98%)、胰蛋白胨、酵母浸出粉、甘氨酸、考马斯亮蓝R-250、巯基还原剂、氢氧化钠、尿素、硫酸铵、氯化钠、十二烷基硫酸钠、冰乙酸、甲醇、二甲基亚砜,北京索莱宝科技有限公司。
1.2 仪器与设备
蛋白纯化系统、凝胶成像系统、电泳仪,美国Bio-Rad公司;透射电子显微镜,日本电子株式会社;纳米粒度及Zeta电位仪,美国Malvern公司;静音超声波清洗器,昆山超声仪器有限公司;傅里叶变换红外光谱仪,美国Thermo公司。
1.3 实验方法
1.3.1 重组虾铁蛋白(rMjF)的诱导表达与纯化
本实验对铁蛋白纯度要求较高,所以纯化方法在马贵红等[19]的基础上稍作修改。将含转入日本囊对虾重组铁蛋白(rMjF)质粒(pET-3a)的大肠杆菌BL21(DE-3)接种于LB培养基[含50.0 μg/mL氨苄青霉素(ampicillin, AMP)]中,37 ℃,180 r/min条件下进行活化12 h。再扩培于含AMP(含50.0 μg/mL)的LB培养基中,37 ℃,180 r/min条件下进行培养至OD600达到0.6左右时,加入异丙基β-D-1-硫半乳糖苷(isopropyl β-D-1-thiogalactoside, IPTG)诱导表达8 h。
诱导后的菌液采用10 000 r/min离心5 min,弃去上清液,收集菌体并称重。菌体重悬于25 mmol/L Tris-HCl(pH 7.5)缓冲液中,在经过冻融裂解后按料液比1∶500(g∶mL)加入溶菌酶(母液100 mg/mL)。超声细胞破碎(功率300 W,超声破碎20 min,开2 s,关4 s)20 min,将破碎后的菌液进行热处理,于65 ℃水浴锅内加热15 min后离心(10 000 r/min,15 min)收集上清液。上清液提前放于4 ℃冰箱中降温,再进行体积分数为20%~40%(先采用20%饱和硫酸铵处理,收集上清液后将硫酸铵的饱和度提升至40%,收集沉淀复溶)饱和硫酸铵复合处理。再将样液置于300 kDa透析袋中于25 mmol/L Tris-HCl(pH 7.5)缓冲液中透析24 h,每8 h更换一次透析液,共3次,以便除去硫酸铵,超滤浓缩后4 ℃贮存备用。
将处理后的纤维素DE-52填料装入弱阴离子交换柱(1.6 cm×20 cm)后,用25 mmol/L Tris-HCl(pH 7.5)缓冲液平衡柱子(1 mL/min)。将透析浓缩后的样品上柱,按照设定的洗脱程序进行纯化,蛋白纯化系统的滤光片为280 nm。洗脱程序如下:
a)杂蛋白洗脱:Buffer A(25 mmol/L Tris-HCl,pH 7.5)100%,洗脱体积80 mL,流速1 mL/min;
b)梯度洗脱:Buffer A 90%,Buffer B(含NaCl的25 mmol/L Tris-HCl,pH 7.5)10%,洗脱体积80 mL,流速1 mL/min;Buffer A 85%,Buffer B 15%,洗脱体积80 mL,流速1 mL/min;Buffer A 70%,Buffer B 30%,洗脱体积80 mL,流速1 mL/min;
c)线性洗脱:Buffer A 70%~0%,Buffer B 30%~100%,洗脱体积80 mL,流速1 mL/min;
d)梯度洗脱:Buffer B 100%,洗脱体积80 mL,流速1 mL/min。将出峰部分收集,超滤浓缩后于-20 ℃贮存。用Bradford法(考马斯亮蓝试剂盒)测定蛋白浓度[20]。
1.3.2 rMjF的聚丙烯酰胺凝胶电泳分析
1.3.2.1 Native-PAGE电泳
将纯化的蛋白溶液和天然样品上样缓冲液以体积比2∶1混匀,参照LAEMMLI[21]的方法进行Native-PAGE电泳,根据电泳后条带判断相应蛋白样品的表观分子质量。Native-PAGE浓缩胶和分离胶分别为6%GEL和5%GEL,凝胶板为80 mm×73 mm×1 mm,每个泳道点样12 μL,Marker 10 μL。Native-PAGE电泳在4 ℃,恒流5 mA的条件下进行,待溴酚蓝迁移线距离分离胶底部2 mm处电泳结束(约4 h)。电泳结束后,采用考马斯亮蓝R-250进行染色1 h并于脱色液中脱色。
1.3.2.2 SDS-PAGE电泳
SDS-PAGE电泳浓缩胶和分离胶分别为12%GEL和5%GEL。将纯化的蛋白溶液和SDS-样品上样缓冲液以2∶1(体积比)的比例混匀,然后沸水浴煮7 min,接着每个泳道点样12 μL,Marker 10 μL。SDS-PAGE电泳在室温下进行,浓缩胶电压80 V,分离胶电压120 V,电泳完成后使用考马斯亮蓝R-250进行染色1 h,并于脱色液中脱色。
1.3.3 rMjF装载山奈酚的制备
1.3.3.1 超声辅助法制备rMjFK复合物
将山奈酚溶解于二甲基亚砜(dimethyl sulfoxide,DMSO)中,配制成1.0 μmol/L的山奈酚溶液。参考张晨曦等[12]的方法制备,将5 mL 0.1 μmol/L的rMjF样品于35 ℃,100 W条件下预处理30 min后以摩尔比为1∶500加入1.0 μmol/L山奈酚溶液进行超声60 min制备得到复合物。处理后的复合物样液置于超滤离心管中除去游离的山奈酚,并在365 nm的吸收波长下测定游离山奈酚的吸光度,代入山奈酚标准曲线公式(y=0.072 4x+0.040 7, R2=0.999 2),计算出游离山奈酚的含量,从而确定山奈酚的装载量,每个实验重复3次。
1.3.3.2 尿素诱导法制备rMjFK复合物
参考YANG等[16]的方法制备,并稍作修改。用8 mol/L的尿素溶液诱导0.1 μmol/L的rMjF变性解离为单亚基,于恒温磁力搅拌器下室温搅拌25 min后,以1∶500的摩尔比缓慢加入1.0 μmol/L山奈酚溶液,继续搅拌20 min。再用Tris-HCl缓冲液透析3次除去尿素以及游离山奈酚后制得复合物溶液,测定山奈酚的含量,从而确定山奈酚的装载量,计算方法同1.3.3.1节,每个实验重复3次。
1.3.3.3 pH调控法制备rMjFK复合物
将0.1 μmol/L的rMjF样品调pH至2.0,于恒温磁力搅拌器下搅拌30 min,后以1∶500的摩尔比缓慢加入1.0 μmol/L山奈酚溶液,继续搅拌5 min,最后将pH调节至7.0。处理后的复合物样液置于超滤离心管中除去游离的山奈酚,并测定游离山奈酚的含量,从而确定山奈酚的装载量,计算方法同1.3.3.1节,每个实验重复3次。
1.3.4 rMjFK复合物的表征
1.3.4.1 rMjFK复合物的聚丙烯酰胺凝胶电泳分析
参考1.3.2节的方法进行分析。
1.3.4.2 不同装载方法对rMjFK复合物的装载率影响
针对3种不同装载方法所制备的复合物分别为超声辅助法制备的rMjF-山奈酚复合物(rMjFK1)、尿素诱导法制备的rMjF-山奈酚复合物(rMjFK2)、pH过渡法制备的rMjF-山奈酚复合物(rMjFK3)。采用超滤杯离心出游离山奈酚,并在365 nm的吸收波长下测定游离山奈酚的吸光度,代入山奈酚标准曲线公式(y=0.072 4x+0.040 7, R2=0.999 2),经计算得出游离山奈酚的含量,推出装载的山奈酚含量,从而计算出复合物中山奈酚的装载率,计算如公式(1)所示:
装载率/%=装载后山奈酚的含量/总rMjF的含量
(1)
1.3.4.3 rMjFK复合物的透射电子显微镜(transmission electron microscope, TEM)分析
TEM制样过程参考JI等[22]的方法。首先,取10 μL的样品溶液(1 mg/mL)置于干净的封口膜上,将碳膜包被的铜网倒扣在液滴上10 min,再用滤纸吸去多余的液体,然后用2%磷钨酸进行静置负染色10 min,最后用滤纸吸去多余染色液。等干燥后使用JEM-2000透射电镜以100 kV在50 nm比例尺下观察并拍摄结构成像。
1.3.4.4 rMjFK复合物的粒径与电势分析
采用Zetasizer Nano ZS纳米粒度仪对样品溶液进行测定,测试参考LI等[23]的方法并稍作修改。具体操作如下:将样品液过0.45 μm的水系滤膜(减少大颗粒和气泡的干扰),测定温度为25 ℃,散射光角度为90°,测量时间为120 s,进行重复3次测量后取平均值进行分析,粒径和电势数据导出后采用Origin作图。
1.3.4.5 rMjFK复合物的傅里叶红外光谱分析
利用傅立叶红外光谱仪测定rMjF以及复合物的二级结构,样品溶液经透析后进行冷冻干燥,取1 mg与充分干燥的KBr颗粒放入研钵中,充分混合。将研磨好的混合粉末放入模具内制成的样品薄片。将充分干燥后的KBr用同样方法处理后作空白对照。红外光谱仪分辨率4 cm-1,扫描次数为32次。
2 结果与分析
2.1 rMjF的纯化与表征
2.1.1 rMjF的诱导表达
将含rMjF的大肠杆菌培养至细菌细胞浓度达到OD600为0.6时,添加IPTG进行诱导表达,通过变性电泳SDS-PAGE对含有rMjF诱导前后的菌体进行检测。结果如图1所示,泳道1为诱导表达前的菌液,泳道2为诱导表达后的菌液。观察发现泳道2在20 kDa处出现一条特异性蛋白条带,诱导后该蛋白条带浓度明显增加,且分子质量大小符合铁蛋白亚基分子质量,证明目的蛋白诱导成功。

泳道M-标准蛋白Marker(14.4~94.0 kDa);泳道1-诱导前的菌体; 泳道2-诱导后的菌体
图1 重组菌诱导前后的SDS-PAGE电泳图
Fig.1 SDS-PAGE electrophoresis of recombinant bacteria before and after induction
2.1.2 rMjF的分离纯化
对诱导后的菌体进行分离纯化,根据铁蛋白具有良好的热稳定性及蛋白盐析的特性,对诱导表达后的菌体进行65 ℃热变性和20%~40%硫酸铵分级盐析进行初步分离。再采用DE-52弱阴离子交换柱层析进一步纯化。由图2-a可知,层析过程有4个蛋白峰,分别为峰Ⅰ、Ⅱ、Ⅲ、Ⅳ。经鉴定峰Ⅰ为杂蛋白峰,峰Ⅱ中含有少量杂蛋白,而峰Ⅲ几乎不含杂蛋白,峰Ⅳ中含有大量杂蛋白。故取峰Ⅲ的蛋白做后续实验。图2-b是rMjF初步分离及层析纯化过程的SDS-PAGE电泳图,泳道1为菌液,可以看出其含有大量杂蛋白;泳道2对应的是65 ℃热变性后的上清液,可以看出大量热敏性杂蛋白被除去;泳道3和泳道4是经20%~40%分级盐析处理后的条带,可看出样品还含有少量的杂蛋白;泳道5为经交换柱层析后的峰Ⅲ,此时样品已经达到分析纯,条带中几乎不含杂蛋白。

a-rMjF纯化层析图谱;b-rMjF纯化过程SDS-PAGE电泳图 泳道M-标准蛋白Marker(14.4~94.0 kDa);泳道1-菌液; 泳道2-经65 ℃水浴处理后的上清液;泳道3~4-硫酸铵分级 处理后的样品;泳道5-层析纯化后的峰Ⅲ
图2 rMjF分离纯化过程中的层析图谱与SDS-PAGE电泳图
Fig.2 Chromatographic and SDS-PAGE electrophoresis of rMjF during its purification process
2.1.3 rMjF的纯度与亚基鉴定
对层析后的蛋白进行Native-PAGE电泳分析,结果如图3-a,泳道1为rMjF,可明显看出在440~232 kDa出现了一条较明显的条带,分子质量大小与WANG等[24]的研究结果一致。但在该条带上方还有一条浅浅的条带,这是由于蛋白浓度较高时会产生二聚体条带于669 kDa处,与夏小雨等[25]的研究结果一致,由此可说明该蛋白已经达到电泳纯。图3-b为rMjF的SDS-PAGE电泳图,泳道1同样为纯化后的rMjF,该泳道可明显看出只有一个条带,说明rMjF由单一亚基M亚基构成。经Quantity One软件分析结果如图3-c、图3-D所示,得到rMjF的M亚基分子质量为18.4 kDa,该结果与ELVITIGALA等[26]所描述的M亚基分子质量一致。
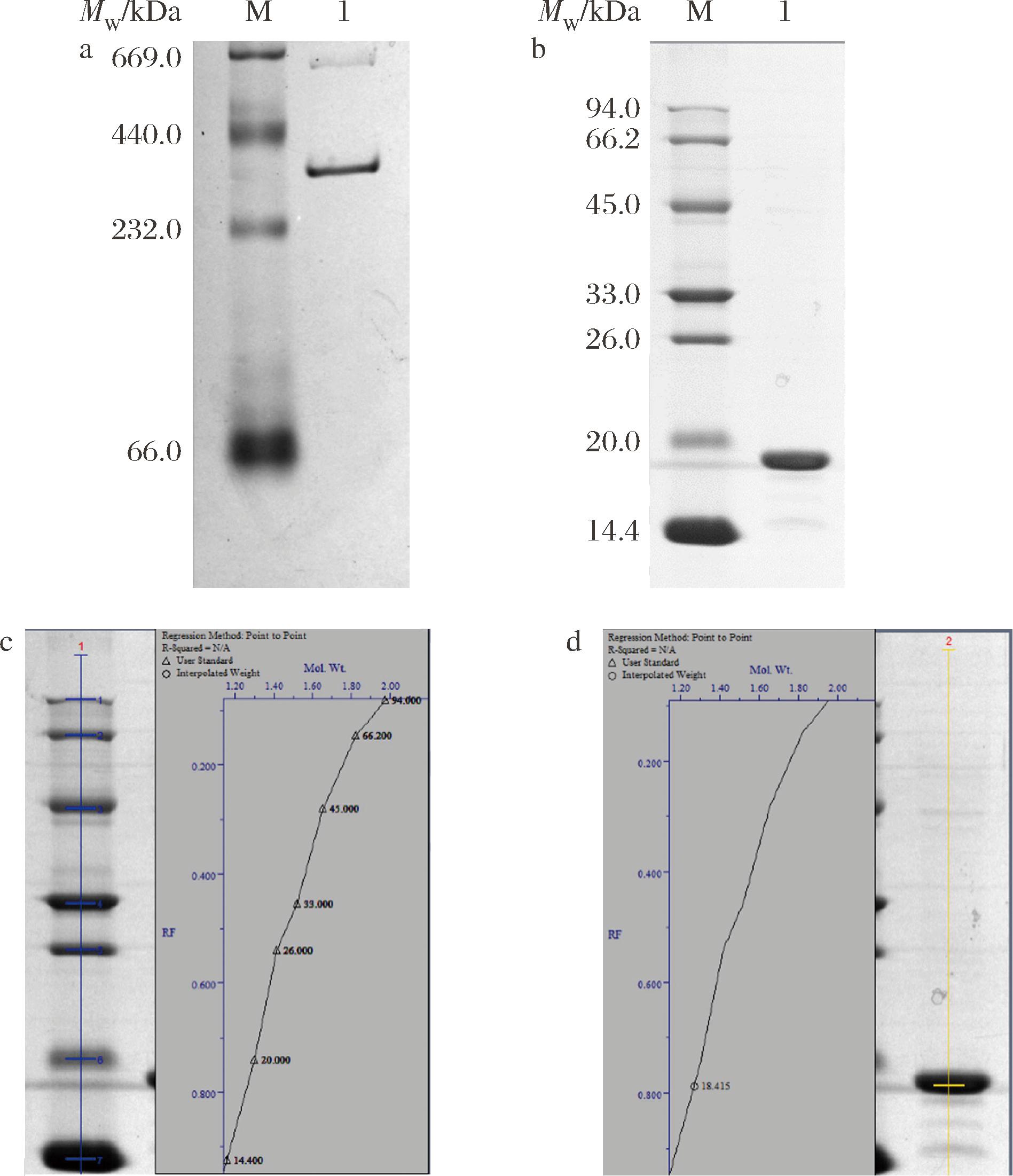
a-rMjF的Native-PAGE电泳图;b-rMjF的SDS-PAGE电泳图; c-Marker分子质量参考图;d- rMjF分子质量定量图
图3 rMjF的Native-PAGE和SDS-PAGE电泳图
Fig.3 Native-PAGE and SDS PAGE electrophoretic diagrams of rMjF
注:a中的泳道M-标准蛋白Marker(669.0~66.0 kDa),泳道1-rMjF; b中的泳道M-标准蛋白Marker(14.4~94.0 kDa),泳道1-rMjF。
2.2 三种不同装载方法制备的rMjFK复合物的表征
2.2.1 rMjFK复合物的聚丙烯酰胺凝胶电泳分析
采用3种不同装载方式制备的复合物经透析除掉游离山奈酚后进行Native-PAGE以及SDS-PAGE电泳检测,结果如图4所示。泳道1~4分别为rMjF以及rMjF1、rMjF2、rMjF3,其亚基分子质量与蛋白分子质量与装载前的rMjF一致,表明超声处理、高浓度尿素诱导以及强酸性环境对亚基以及蛋白总分子质量影响不大。
2.2.2 不同装载方法对复合物装载率的影响
利用rMjF经超声以及高浓度尿素处理后通道尺寸变大的特性和在pH 2.0~7.0转变下的可逆自组装特性,制备了3种复合物,分别为rMjFK1、rMjFK2和rMjFK3。复合物经超滤杯除掉游离山奈酚后,检测游离山奈酚的含量,从而得出复合物的装载率。结果如图5所示,超声辅助法所制备的复合物的装载率最高,达到了20%;而尿素诱导法制备的复合物装载率为18.5%;pH调控制备的复合物装载率为16.7%,显著低于超声辅助法所制备的复合物装载率。这是因为超声结束后铁蛋白通道会自动缩小,而尿素诱导铁蛋白后需进行透析除去尿素,铁蛋白通道才会慢慢缩小,这一过程是降低装载率的主要因素。而pH调控铁蛋白自组装,这一过程具有随机性,装载率大小与摩尔比有关。

泳道M-标准蛋白Marker;泳道1-rMjF;泳道2-超声辅助法制备的rMjFK1;泳道3-尿素诱导法制备的rMjFK2;泳道4-pH调控法制备的rMjFK3 a-rMjF与3种复合物的Native-PAGE电泳图;b-rMjF与3种复合物的SDS-PAGE电泳图
图4 rMjF与3种复合物的Native-PAGE和SDS-PAGE电泳图
Fig.4 Native-PAGE and SDS PAGE electrophoretic diagrams of rMjF and three compounds
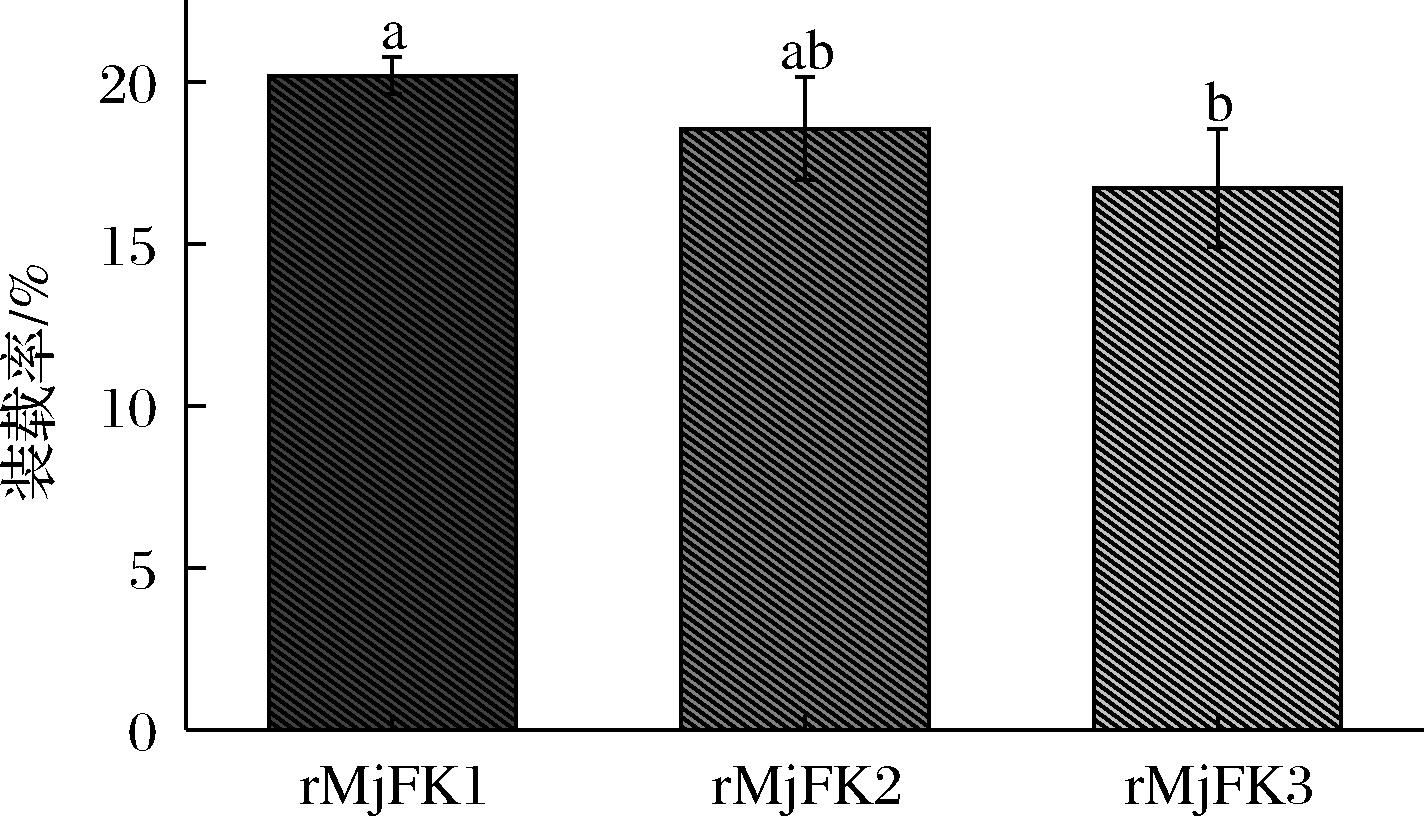
图5 三种复合物装载率的比较
Fig.5 Comparison of loading rates of three compounds
注:不同字母表示差异显著(P<0.05)(下同)。
2.2.3 rMjFK复合物的TEM分析
图6为rMjF与3种复合物的TEM图,图6-a为装载前的rMjF,其中蛋白腔内有黑色的铀核,这是由于在对铁蛋白进行负染时铀离子进入到了蛋白质内腔形成的[27]。而图6-b~图6-d分别为3种复合物的TEM图,其中大部分蛋白腔内的黑色铀核消失了。这是因为当化合物被装载进铁蛋白内部空腔,会限制乙酸铀酰的进入与成核。所以山奈酚进入铁蛋白内腔中占据内部空间,从而阻止了铀离子进入腔内。图6-b~图6-d 3张电镜图中的部分铁蛋白内部空腔呈现白色,证明山奈酚成功装载进了rMjF的内部空腔[28]。其次由电镜图也可看出铁蛋白在高浓度尿素以及强酸性环境中的聚集情况更为严重,而在超声处理后的铁蛋白只有较少的聚集,这是因为超声波具有空化作用,能使较大的聚集体分散[29-30]。同时透射电镜结果也可说明装载后的铁蛋白均保持了与装载前的铁蛋白一致的球型结构。
2.2.4 rMjFK复合物的粒径与电势分析
粒径结果同样可证明,采用马尔文粒度仪测定了3种复合物的粒径。粒径分布结果如图7所示,装载前的铁蛋白粒径分布于13.54 nm左右,并且具有单一峰,说明溶液中不含有杂蛋白且粒径较为分散。这与前人所描述的典型铁蛋白尺寸大小相符[6]。pH调控法制备的复合物粒径与其一致,而超声辅助法和尿素诱导法制备的复合物粒径大于装载前的铁蛋白粒径。这是因为超声和尿素处理都会导致铁蛋白通道扩大,一旦停止,铁蛋白通道会慢慢缩小,并不会完全恢复。同时与电镜结果一致的是装载后的虾重组铁蛋白具有不同程度的聚集情况,由图7可知,装载前的铁蛋白具有单一峰,而3种复合物具有2~3个峰。如表1所示,超声处理后的聚集体仅占29.1%,而尿素诱导和pH调控所产生的聚集体分别高达55.7%和66.2%。超声辅助制备的物具有使粒径统一的特点。

a-rMjF的TEM图;b-rMjF1的TEM图;c-rMjF2的TEM图;d-rMjF3的TEM图
图6 rMjF与3种复合物的TEM图
Fig.6 TEM images of rMjF and three compounds
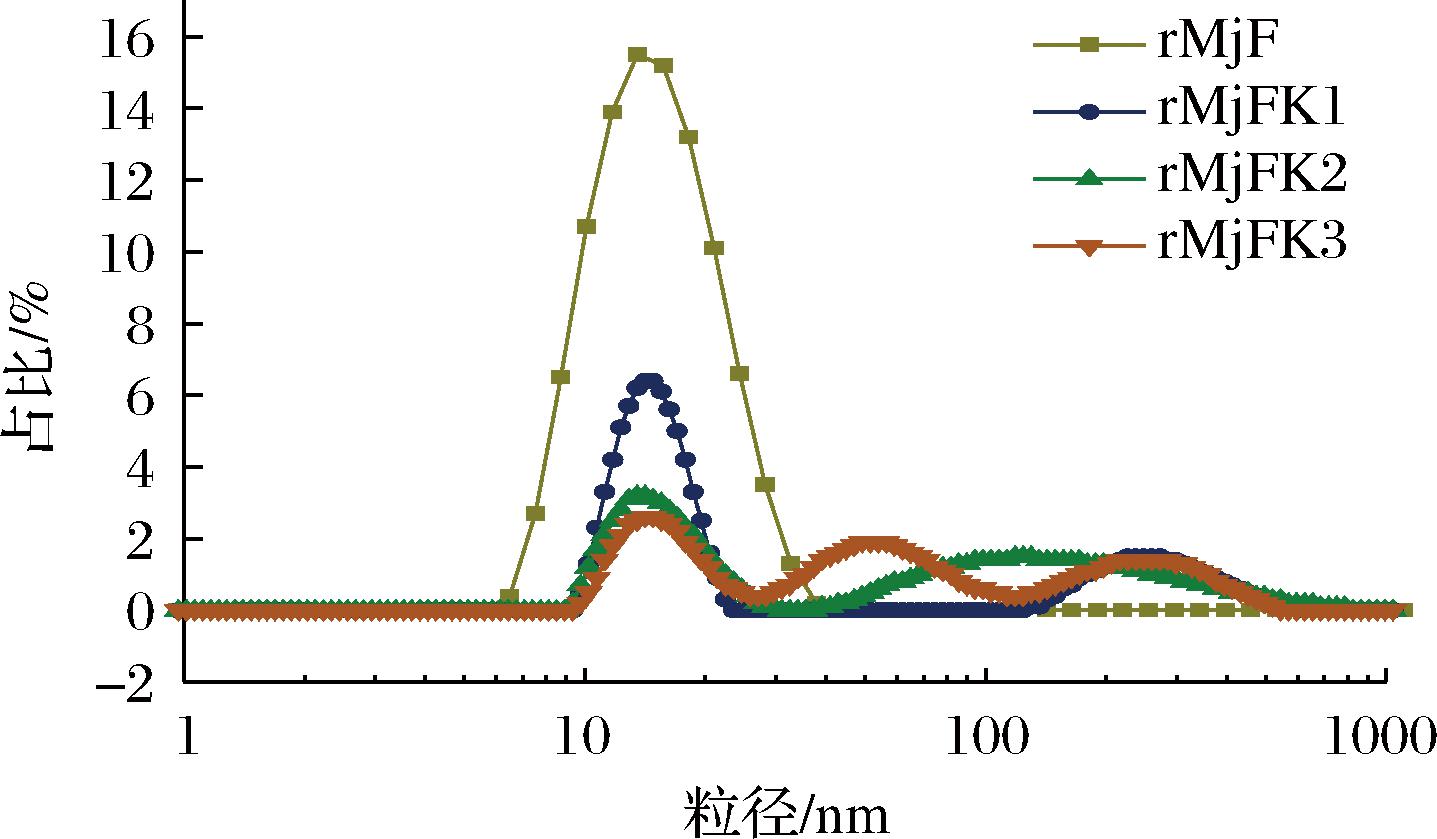
图7 rMjF与3种复合物的粒径分布图
Fig.7 Particle size distribution of rMjF and three compounds
表1 rMjF与3种复合物的粒径分布表
Table 1 Particle size distribution table of rMjF and three compounds
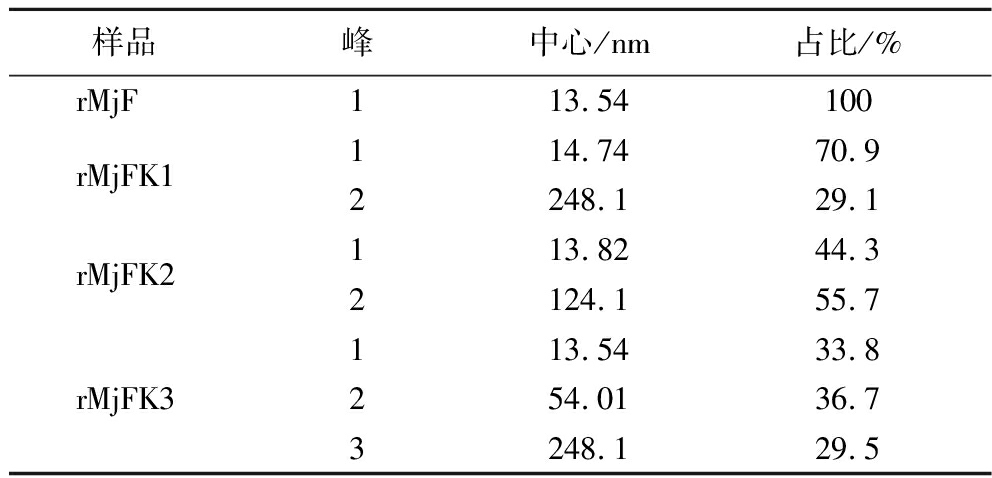
样品峰中心/nm占比/%rMjF113.54100rMjFK1114.7470.92248.129.1rMjFK2113.8244.32124.155.7113.5433.8rMjFK3254.0136.73248.129.5
注:表中数据为3次实验平均值。
Zeta电位一般用于评价或预测微粒分散体系的物理稳定性,一般Zeta电位绝对值越高,其粒子间的静电斥力也越大,物理稳定性也就越好[31]。结果如图8所示,其中超声辅助法制备的复合物电位与处理前铁蛋白电位结果没有显著差异,而尿素诱导法和pH调控法制备的复合物的电位结果与处理前铁蛋白电位结果具有显著差异。该结果与粒径结果一致,超声处理对蛋白质聚集有抑制作用。

图8 rMjF与3种复合物的Zeta电位柱形图
Fig.8 Zeta potential histogram of rMjF and three compounds
2.2.5 rMjFK复合物的傅里叶红外光谱分析
蛋白质的二级结构主要是基于圆二色谱和红外光谱来表征。而蛋白质的红外光谱具有4组特征吸收谱带,分别为波长3 300~3 500的酰胺A带、1 600~1 700的酰胺Ⅰ带、1 530~1 550的酰胺Ⅱ带、1 260~1 300的酰胺Ⅲ带。其中酰胺Ⅰ带是由C![]() O伸缩振动引起的[32],蛋白质的二级结构主要位于该波长范围。图9为装载前的铁蛋白以及装载后的3种物质的红外图谱。1 650~1 660为α-螺旋结构,1 600~1 640为β-折叠结构[33],由图9可知,pH调控制备的物的α-螺旋占比有所降低,β-折叠占比增加,对此造成二级结构稳定性降低。
O伸缩振动引起的[32],蛋白质的二级结构主要位于该波长范围。图9为装载前的铁蛋白以及装载后的3种物质的红外图谱。1 650~1 660为α-螺旋结构,1 600~1 640为β-折叠结构[33],由图9可知,pH调控制备的物的α-螺旋占比有所降低,β-折叠占比增加,对此造成二级结构稳定性降低。

图9 rMjF与3种复合物的傅里叶红外光谱图
Fig.9 Fourier infrared spectra of rMjF and three compounds
3 结论与讨论
本文采用超声辅助、尿素诱导以及pH调控3种不同的装载方法制备了rMjFK复合物。与传统的通过pH调控使铁蛋白在极酸极碱环境中自组装装载活性小分子物质所对比,超声辅助法装载活性小分子物质具有以下优点:相同摩尔比条件下,所制备的复合物装载率更高;能有效抑制铁蛋白的聚集情况,制备的复合物具有较好的分散性;可使铁蛋白在温和的环境中进行装载,避免二级结构遭到破坏。而尿素诱导虽然不对铁蛋白二级结构产生严重破坏,但其装载过程耗时长,成本高,且装载率低于超声辅助法。所以超声辅助法制备铁蛋白与水溶性差的活性小分子的复合物具有良好的应用前景。
[1] CHOI E J, AHN W S.Kaempferol induced the apoptosis via cell cycle arrest in human breast cancer MDA-MB-453 cells[J].Nutrition Research &Practice, 2008, 2(4):322-325.
[2] YANG L, GAO Y C, BAJPAI V K, et al.Advance toward isolation, extraction, metabolism and health benefits of kaempferol, a major dietary flavonoid with future perspectives[J].Critical Reviews in Food Science and Nutrition, 2023,63(16):2773-2789.
[3] ILK S, ![]() N, ÖZGEN M, et al.Chitosan nanoparticles enhances the anti-quorum sensing activity of kaempferol[J].International Journal of Biological Macromolecules, 2017, 94:653-662.
N, ÖZGEN M, et al.Chitosan nanoparticles enhances the anti-quorum sensing activity of kaempferol[J].International Journal of Biological Macromolecules, 2017, 94:653-662.
[4] GUPTA N, KAMATH S M, RAO S K, et al.Kaempferol loaded albumin nanoparticles and dexamethasone encapsulation into electrospun polycaprolactone fibrous mat-Concurrent release for cartilage regeneration[J].Journal of Drug Delivery Science and Technology, 2021, 64:102666.
[5] HARRISON P M, AROSIO P.The ferritins:Molecular properties, iron storage function and cellular regulation[J].Biochimica et Biophysica Acta, 1996, 1275(3):161-203.
[6] HARRISON P M, HOY T G, MACARA I G, et al.Ferritin iron uptake and release.Structure-function relationships[J].The Biochemical Journal, 1974, 143(2):445-451.
[7] CHEN L L, BAI G L, YANG R, et al.Encapsulation of β-carotene within ferritin nanocages greatly increases its water-solubility and thermal stability[J].Food Chemistry, 2014, 149:307-312.
[8] LI M L, ZHANG T, YANG H X, et al.A novel calcium supplement prepared by phytoferritin nanocages protects against absorption inhibitors through a unique pathway[J].Bone, 2014, 64:115-123.
[9] 孙国玉. 铁蛋白-芦丁包埋物的制备与理化性质的研究[D].天津:天津科技大学, 2017. SUN G Y.Preparation and physicochemical property analysis of ferritin-rutin composites[D].Tianjin:Tianjin University of Science and Technology, 2017. [10] PANDOLFI L, BELLINI M, VANNA R, et al.H-ferritin enriches the curcumin uptake and improves the therapeutic efficacy in triple negative breast cancer cells[J].Biomacromolecules, 2017, 18(10):3318-3330.
[11] KIM M, RHO Y, JIN K S, et al.pH-dependent structures of ferritin and apoferritin in solution:Disassembly and reassembly[J].Biomacromolecules, 2011, 12(5):1629-1640.
[12] 张晨曦, 张晓荣, 吕晨艳, 等.超声辅助法制备铁蛋白-虾青素包埋物[J].食品科学, 2021, 42(11):94-101. ZHANG C X, ZHANG X R, LYU C Y, et al.Ultrasound-assisted encapsulation of astaxanthin within ferritin nanocages with enhanced efficiency[J].Food Science, 2021, 42(11):94-101.
[13] YANG R, LIU Y Q, MENG D M, et al.Effect of atmospheric cold plasma on structure, activity, and reversible assembly of the phytoferritin[J].Food Chemistry, 2018, 264:41-48.
[14] WANG Q, ZHANG C, LIU L P, et al.High hydrostatic pressure encapsulation of doxorubicin in ferritin nanocages with enhanced efficiency[J].Journal of Biotechnology, 2017, 254:34-42.
[15] MENG D M, WANG B W, ZHEN T Y, et al.Pulsed electric fields-modified ferritin realizes loading of rutin by a moderate pH transition[J].Journal of Agricultural and Food Chemistry, 2018, 66(46):12404-12411.
[16] YANG R, LIU Y Q, MENG D M, et al.Urea-driven epigallocatechin gallate (EGCG) permeation into the ferritin cage, an innovative method for fabrication of protein-polyphenol co-assemblies[J].Journal of Agricultural and Food Chemistry, 2017, 65(7):1410-1419.
[17] YANG R, TIAN J, LIU Y Q, et al.Thermally induced encapsulation of food nutrients into phytoferritin through the flexible channels without additives[J].Journal of Agricultural &Food Chemistry, 2017, 65(46):9950-9955.
[18] SILVA E K, MEIRELES M A A.Influence of the degree of inulin polymerization on the ultrasound-assisted encapsulation of annatto seed oil[J].Carbohydrate Polymers, 2015, 133:578-586.
[19] 马贵红, 赖龙昕, 李蝶, 等.饱和硫酸铵纯化重组日本囊对虾铁蛋白[J].食品与发酵工业, 2022, 48(16):138-143. MA G H, LAI L X, LI D, et al.Purification of recombinant Marsupenaeus japonicus ferritin by saturated ammonium sulfate[J].Food and Fermentation Industries, 2022, 48(16):138-143.
[20] DENG Y, WANG W, YU P F, et al.Comparison of taurine, GABA, glu, and asp as scavengers of malondialdehyde in vitro and in vivo[J].Nanoscale Research Letters, 2013, 8(1):190.
[21] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227(5259):680-685.
[22] JI X T, HUANG L, HUANG H Q.Construction of nanometer cisplatin core-ferritin (NCC-F) and proteomic analysis of gastric cancer cell apoptosis induced with cisplatin released from the NCC-F[J].Journal of Proteomics, 2012, 75(11):3145-3157.
[23] LI H, TAN X Y, XIA X Y, et al.Thermal treatment modified the physicochemical properties of recombinant oyster (Crassostrea gigas) ferritin[J].Food Chemistry, 2020, 314:126210.
[24] WANG Y J, ZANG J C, WANG C T, et al.Structural insights for the stronger ability of shrimp ferritin to coordinate with heavy metal ions as compared to human H-chain ferritin[J].International Journal of Molecular Sciences, 2021, 22(15):7859.
[25] 夏小雨, 李晗, 王震宇, 等.人源重链铁蛋白纯化及其纳米粒制备[J].食品科学, 2020, 41(12):91-98. XIA X Y, LI H, WANG Z Y, et al.Purification and preparation of nanoparticles of human H-chain ferritin[J].Food Science, 2020, 41(12):91-98.
[26] ELVITIGALA D A S, PREMACHANDRA H K A, WHANG I, et al.A teleostean counterpart of ferritin M subunit from rock bream (Oplegnathus fasciatus):An active constituent in iron chelation and DNA protection against oxidative damage, with a modulated expression upon pathogen stress[J].Fish &Shellfish Immunology, 2013, 35(5):1455-1465.
[27] 林青. 纳米顺铂核-铁蛋白的构建及释放顺铂诱导人宫颈癌(Hela)细胞凋亡的差异蛋白质研究[D].厦门:厦门大学, 2011. LIN Q.Construction of nanometer cisplatin nucleoprotein and differential protein study on apoptosis of human cervical cancer (hela) cells induced by cisplatin release[D].Xiamen:Xiamen University, 2011.
[28] GUO X X, MEI J, JING Y, et al.Curcumin-loaded nanoparticles with low-intensity focused ultrasound-induced phase transformation as tumor-targeted and pH-sensitive theranostic nanoplatform of ovarian cancer[J].Nanoscale Research Letters, 2020, 15(1):73.
[29] 王广阔.超声波对纳米材料分散性能影响的研究[C].第五届功能性纺织品及纳米技术应用研讨会论文集.北京,2005:284-289.
[30] HOO D Y, LOW Z L, LOW D Y S, et al.Ultrasonic cavitation:An effective cleaner and greener intensification technology in the extraction and surface modification of nanocellulose[J].Ultrasonics Sonochemistry, 2022, 90:106176.
[31] 邱健. 纳米颗粒Zeta电位的高精度与高稳定性测量方法研究[D].广东:华南师范大学, 2020. QIU J.Study on high precision and high stability measurement method of Zeta potential of nanoparticles[D].Guangdong:South China Normal University, 2020.
[32] KONG J L, YU S N.Fourier transform infrared spectroscopic analysis of protein secondary structures[J].Acta Biochimica et Biophysica Sinica, 2007, 39(8):549-559.
[33] LONG G H, JI Y, PAN H B, et al.Characterization of thermal denaturation structure and morphology of soy glycinin by FTIR and SEM[J].International Journal of Food Properties, 2015, 18(4):763-774.