水产养殖是一个不断增长的全球性行业,预计2030年以后全球产量将达到2.02亿t。虽然针对水产养殖、运输中兽药的合理利用有相关的管控和监管措施,但依然存在一些影响水产品质量安全的外源性风险因子[1-3],例如在水产运输中苯二氮卓类镇静催眠药的违法使用。苯二氮卓类镇静催眠药具有抑制中枢神经系统功能,主要用于焦虑、镇静催眠,在水产运输过程中可以降低新鲜活鱼对外界的感知能力,减轻鱼体的环境压力,降低新陈代谢,保证其经过运输后仍然鲜活,但是镇静催眠药在鱼体内的残留可通过食物链传递给人类,人类食用超过一定剂量,会引起嗜睡疲乏、动作失调等,严重者还可能出现心律失常、昏迷等症状[4-5]。苯二氮卓类大多为1,4-苯并二氮卓的衍生物,包括咪达唑仑、艾司唑仑、硝西泮、阿普唑仑、氯硝西泮、三唑仑、地西泮等20余种物质,其中最常见的是地西泮,为兽药典明确禁止在饲料和动物饮水中使用的兽药,GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》中将其列入不得在动物性源食品中检出的兽药,国家市场监管部门也将地西泮纳入风险监测项目或者监督抽查项目。
有关苯二氮卓类镇静催眠药检测的相关国家标准有SN/T 2113—2008《进出口动物源性食品中镇静剂类药物残留量的检测方法》、GB 29697—2013《食品安全国家标准 动物性食品中地西泮和安眠酮多残留的测定 气相色谱-质谱法》、SN/T 3235—2012《出口动物源食品中多类禁用药物残留量检测方法 液相色谱-质谱/质谱法》等。其中,前2项标准分别适用于肉类、肾脏中氯丙嗪和地西泮药物残留量的测定和猪的肌肉组织中地西泮和安眠酮残留量的检测,没有涵盖水产品中镇静催眠药的检测。依据国家市场监管部门发布的《食品安全监督抽检实施细则(2023年版)》,国家水产品兽药残留监控计划中的地西泮检测选用SN/T 3235—2012标准。目前尚未见水产品中除地西泮外的其他苯二氮卓类镇静剂检测的国家法定标准,文献报道的水产品中苯二氮卓类镇静剂检测方法[6-14],其样品前处理方法都比较繁琐,不利于大样本量的快速检测。
超滤型高脂基质净化柱(multiplug filtration clean-up-QuEChERS,MPFC-QuEChERS)是一种基于传统QuEChERS方法发展起来的操作更简单、更有效、更经济的前处理方法,其采用多壁碳纳米管和硫酸镁为净化材料,并且在净化过程中不与目标物发生作用,尤其改善部分平面结构药物的吸附问题,直接滤过净化液就能够很好去除基质中蛋白质、脂肪等,其结合了QuEChERS方法和固相萃取(solid phase extraction,SPE)方法的优点,相比传统SPE和固相萃取,简化了萃取净化步骤,避免因溶剂转移所带来的结果损失,其净化使用步骤是:在MPFC-QuEChERS柱下端套上有机滤头,然后吸取1 mL提取液于净化柱中,慢慢推送推杆,使净化液一滴一滴流入进样瓶,其使用过程见图1。为了克服了水产品中苯二氮卓类镇静剂检测传统QuEChERS前处理方法的缺点,本研究的样品采用乙腈和兽药残留专用萃取盐包(内含1 g 氯化钠和4 g 硫酸钠)提取,提取液通过MPFC-QuEChERS净化,采用超高效液相色谱-三重四极杆液质联用法(ultra-performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)建立了同时测定鱼肉中7种苯二氮卓类镇静催眠药(咪达唑仑、艾司唑仑、硝西泮、阿普唑仑、氯硝西泮、三唑仑、地西泮)的分析方法,希冀为水产品中苯二氮卓类镇静剂的检测提供参考。
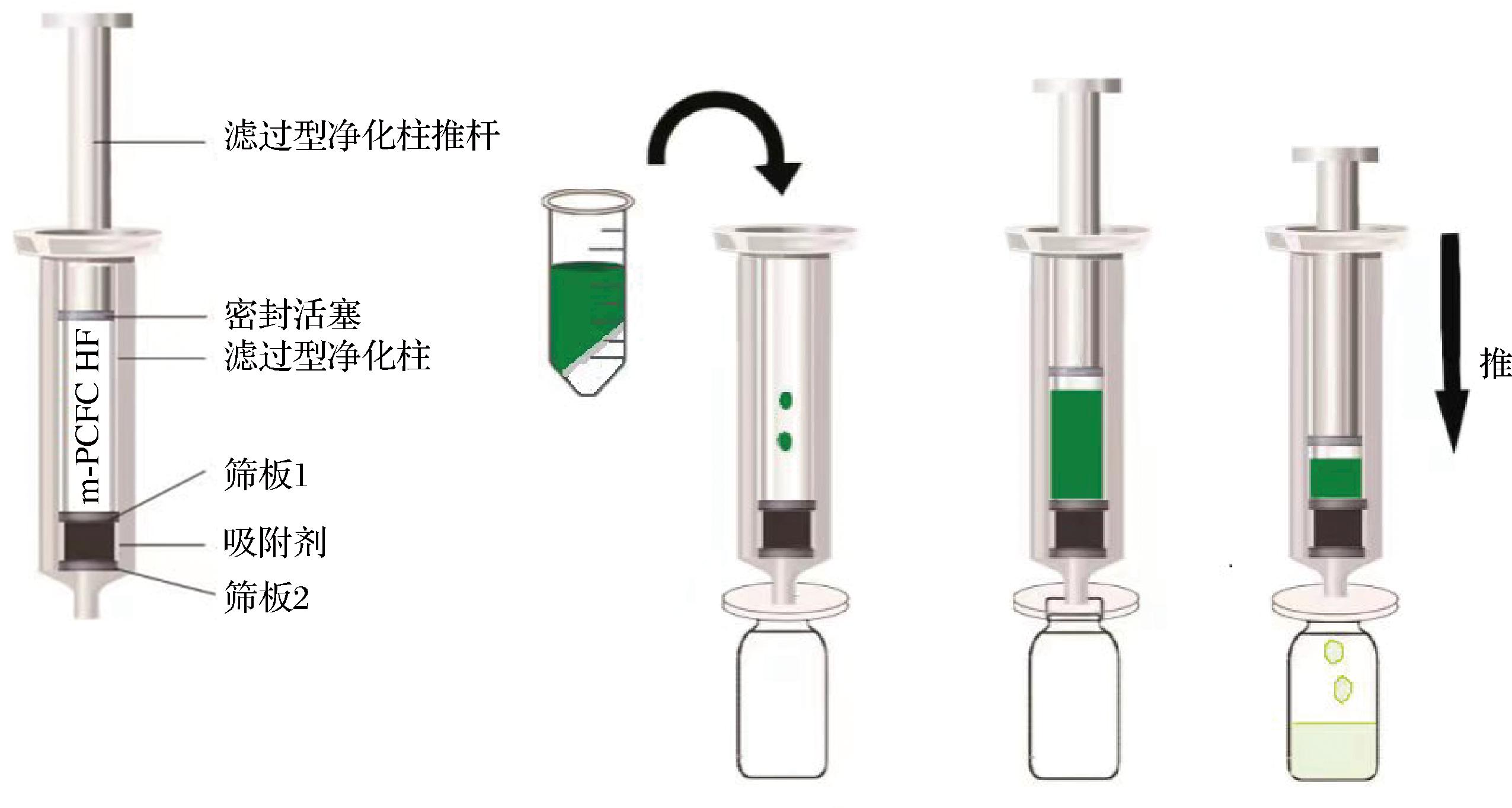
图1 MPFC-QuEChERS净化流程
Fig.1 Purification of MPFC-QuEChERS
1 材料与方法
1.1 材料与试剂
供试样品鲫鱼、鲈鱼为市售产品,阳性供试样品为自制。
标准品咪达唑仑、艾司唑仑、硝西泮、阿普唑仑、氯硝西泮、三唑仑、地西泮均购自中国食品药品检定研究院,具体信息见表1。甲醇、乙腈,色谱纯,德国默克公司;乙酸铵、甲酸,色谱纯,东京化成工业株式会社;柠檬酸·一水、磷酸氢二钠·十二水、乙二胺四乙酸二钠(Na2EDTA)·二水、氢氧化钠均为分析纯,国药集团化学试剂有限公司;蒸馏水,屈臣氏有限公司。MPFC-QuEChERS高脂基质净化柱(货号:LM806-FC-723),北京绿绵科技有限公司;Agilent Bond Elut QuEChERS兽药残留专用萃取盐包(内含1 g 氯化钠和4 g 硫酸钠),美国安捷伦有限公司;尼龙微孔滤膜(13 mm,0.22 μm),杭州Anow Microfiltration有限公司。
1.2 仪器与设备
Agilent 1290 Infinity液相色谱-6460C三重四极杆液质联用仪(配备安捷伦喷射流电喷雾离子源),美国安捷伦有限公司;MS105DU型电子天平,瑞士Mettler Toled有限公司;IKA振荡器,艾卡(广州)仪器设备有限公司;Vortex-genie2涡旋仪,美国Scientific公司;5810R离心机,德国艾本德公司;SB-800 DT超声波清洗机,宁波新芝股份有限公司。
表1 标准品信息
Table 1 Information of standard substances
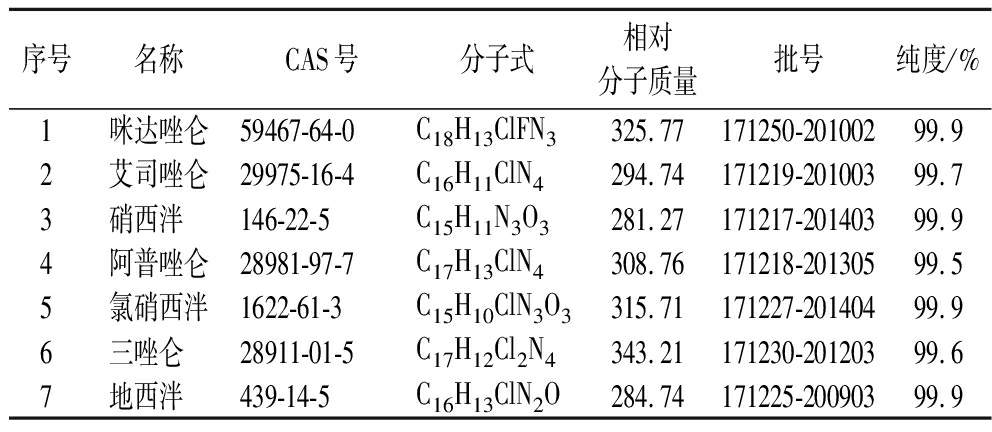
序号名称CAS号分子式相对分子质量批号纯度/%1咪达唑仑59467-64-0C18H13ClFN3325.77171250-20100299.92艾司唑仑29975-16-4C16H11ClN4294.74171219-20100399.73硝西泮 146-22-5C15H11N3O3281.27171217-20140399.94阿普唑仑28981-97-7C17H13ClN4308.76171218-20130599.55氯硝西泮1622-61-3C15H10ClN3O3315.71171227-20140499.96三唑仑 28911-01-5C17H12Cl2N4343.21171230-20120399.67地西泮 439-14-5C16H13ClN2O284.74171225-20090399.9
1.3 实验方法
1.3.1 Mcllvaine-Na2EDTA缓冲液的配制
取柠檬酸·一水12.9 g、磷酸氢二钠·十二水10.9 g、乙二胺四乙酸二钠·二水39.2 g,加水900 mL搅拌溶解,用1 mol/L的氢氧化钠溶液调pH值至5.06,加水补足1 000 mL。
1.3.2 标准溶液的配制
标准品储备溶液:取咪达唑仑、艾司唑仑、硝西泮、阿普唑仑、氯硝西泮、三唑仑、地西泮标准品各适量(约10 mg),精密称定,于10 mL棕色容量瓶中,加乙腈溶解并稀释至刻度,配制成质量浓度均约为1 mg/mL的各标准品储备液,置 4 ℃冷藏备用。混合标准品中间液:准确量取上述各标准储备溶液0.025 mL,于25 mL棕色容量瓶中,用乙腈稀释至刻度,配制成浓度均约为 1 μg/mL的混合标准品中间液,置 4 ℃冷藏备用。混合标准品使用液:精密量取上述混合标准品中间液1.00 mL置于10 mL棕色容量瓶,用乙腈稀释至刻度,配制成浓度均约为 100 ng/mL的混合标准品使用液,置 4 ℃冷藏备用。标准曲线溶液的配制:分别精密量取混合标准品使用液适量,用空白基质溶液稀释,配制成质量浓度为0、0.5、1、2、5、10、20 ng/mL的系列溶液。
1.3.3 供试品溶液的制备
取鱼肉适量,绞碎,均质后,精确称取5 g,置50 mL 具塞离心管中,加2 mL Mcllvaine-Na2EDTA缓冲液,充分涡旋,静置20 min,加入乙腈10 mL,充分涡旋,再加入Agilent Bond Elut QuEChERS兽药残留专用萃取盐包(含1 g 氯化钠和4 g 硫酸钠),涡旋振荡4 min,在4 ℃、3 900 r/min 条件下离心15 min,移取上清液于MPFC-QuEChERS高脂基质净化柱(下端安装0.22 μm有机滤膜的滤头)里面,用推杆慢慢推入,过滤至进样小瓶中,即得供试品溶液。同法制备空白基质溶液。
1.3.4 色谱条件
色谱柱:Brownlee SPP C18柱(2.1 mm×100 mm,2.7 μm);流动相:含0.1%(体积分数)甲酸-2 mmol/L乙酸铵的水溶液(A)和含0.1%甲酸的乙腈溶液(B),梯度洗脱,程序见表2;流速:0.4 mL/min;柱温:35 ℃;进样量:2 μL。
表2 梯度洗脱程序
Table 2 The procedure of gradient elution

时间/min流动相A/%流动相B/%0.0065351.0065354.5040607.005958.005959.00653510.006535
1.3.5 质谱条件
离子源:安捷伦喷射流电喷雾离子源(AJS ESI);离子极性:正离子;检测模式:多反应监测模式(multiple reaction monitoring, MRM);干燥气流速:6 L/min;干燥气温度:325 ℃;毛细管电压:4 000 V;鞘气流速:10 L/min;鞘气温度:350 ℃;雾化器压力:45 psi;7种镇静催眠药的质谱参数见表3。
表3 7种镇静催眠药的质谱参数
Table 3 MRM parameters of seven kinds of sedative drugs
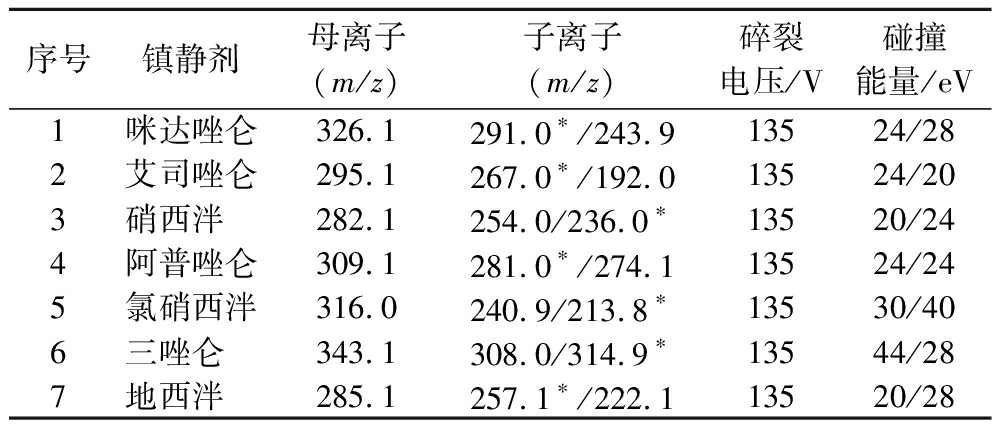
序号镇静剂母离子(m/z)子离子(m/z)碎裂电压/V碰撞能量/eV1咪达唑仑326.1291.0∗/243.913524/282艾司唑仑295.1267.0∗/192.013524/203硝西泮 282.1254.0/236.0∗13520/244阿普唑仑309.1281.0∗/274.113524/245氯硝西泮316.0240.9/213.8∗13530/406三唑仑 343.1308.0/314.9∗13544/287地西泮 285.1257.1∗/222.113520/28
注:“*”为定量离子。
2 结果与分析
2.1 前处理条件选择
本研究测试的7种苯二氮卓类镇静催眠药(咪达唑仑、艾司唑仑、硝西泮、阿普唑仑、氯硝西泮、三唑仑、地西泮),化学性质偏有机弱碱性,属于中等极性化合物。本文选取空白鱼肉样品,采取加标回收的方法,按1.3.3节方法前处理,分别考察了乙腈和甲醇为提取溶剂时的提取效果,结果显示,乙腈为提取溶剂时,乙腈和水在盐包作用下,出现分层,有机层溶液澄清(图2-A);甲醇为提取溶剂时,甲醇和水在盐包作用下,未出现分层,有机层溶液略显浑浊(图2-B),且乙腈为提取溶剂的回收率高于甲醇,因此选乙腈为提取溶剂。在萃取过程中,加入适量Mcllvaine-Na2EDTA缓冲液分散样品,后续通过加入Agilent Bond Elut QuEChERS兽药残留专用萃取盐包,在低温高速离心的条件下,水层和有机层有效分层,目标化合物富集在有机层乙腈中。目前,对于净化方法的选择上,最传统的是QuEChERS法和固相萃取柱法,其净化填料几乎都是乙二胺-N-丙基硅烷、C18、硫酸镁等,只是填料比例上有差别,而且传统的QuEChERS净化,只适用于基质简单的样品,过程繁琐,无法适应短时间内快速前处理大量检品的需求,而MPFC-QuEChERS高脂基质净化柱的填料为多壁碳纳米管和硫酸镁,可有效去除水溶性和脂溶性杂质,适用于高脂基质样品的滤过式净化,与传统的QuEChERS和固相萃取柱净化相比,MPFC-QuEChERS可以在1 min 内完成净化,无需涡旋、离心、淋洗、洗脱和浓缩步骤,极大简化了前处理过程,提高了检测效率,而且能够保证净化效果。同时,本实验采用的鱼肉样品就属于高脂类样品,因此,选择以MPFC-QuEChERS净化柱对提取液进行净化。
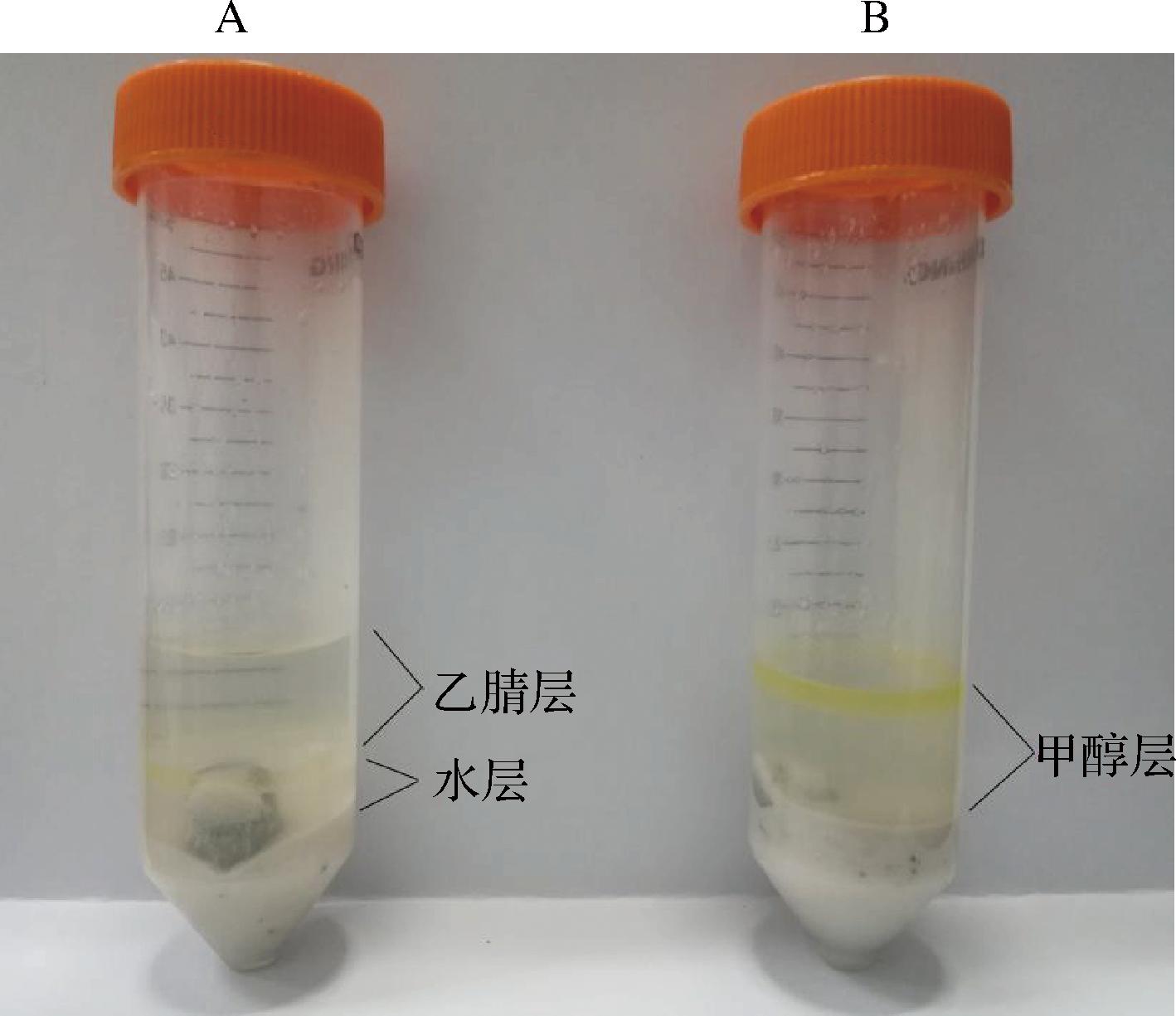
图2 乙腈和甲醇对目标物的提取效果
Fig.2 Extraction effect to target substance of acetonitrile and methanol
2.2 色谱条件优化
本实验选择乙腈作为流动相的有机相,分别考察了乙腈-水、乙腈-含0.1%甲酸的水溶液、含0.1%甲酸的乙腈-含0.1%甲酸的水、含0.1%甲酸的乙腈-含0.1%甲酸-2 mmol/L乙酸铵的水溶液等不同组合的流动相体系,以各目标检测物的峰形、分离度及质谱响应为判断指标,优选最佳流动相体系。结果发现,当流动相体系为含0.1%甲酸的乙腈-含0.1%甲酸-2 mmol/L乙酸铵的水溶液时,各目标检测物的峰形、分离效果及质谱响应较好,故以其为样品分析的流动相体系。7种苯二氮卓类镇静催眠药的总离子流图及色谱图见图3。
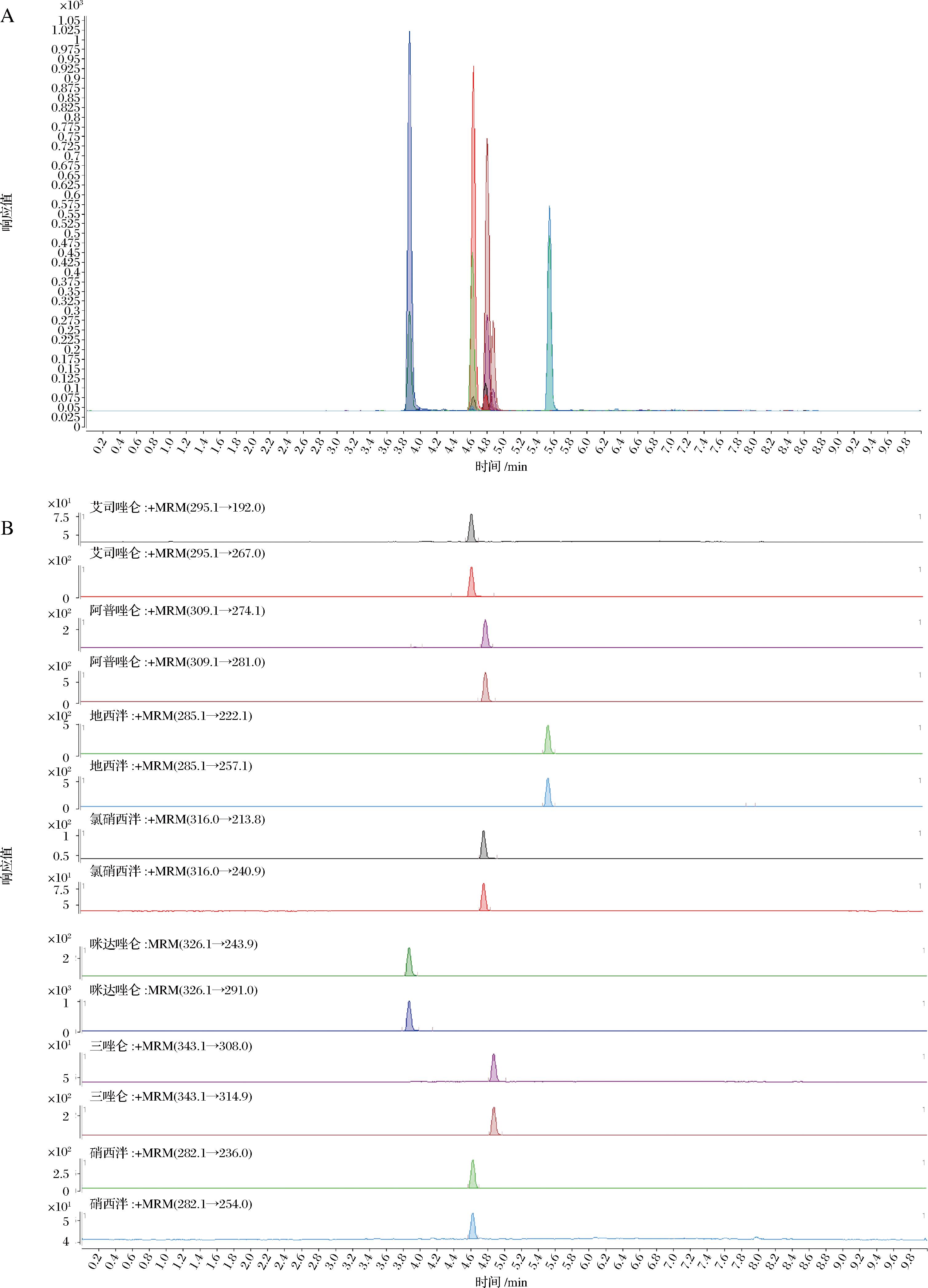
A-总离子流图;B-色谱图
图3 七种镇静催眠药的总离子流图及色谱图
Fig.3 Total ion chromatogram and extraction chromatogram of seven kinds of sedative drugs
2.3 质谱条件优化
在不安装色谱柱的状态运行UPLC-MS/MS联用仪,在连接色谱仪与质谱仪的二通阀部分,分别进样质量浓度均为50 ng/mL的各单一标准品溶液,在正离子模式下采用一级质谱扫描Scan,确定化合物的母离子,均得到稳定的[M+H]+离子,然后设置不同的碎裂电压,采用SIM扫描模式检测,比较各个碎裂电压下目标峰的响应值,以响应值最高的碎裂电压为最佳碎裂电压;在优化的最佳碎裂电压下,对母离子进行二级Product Ion质谱扫描,以离子丰度最高的2个碎片离子分别作为定性与定量离子,其中离子丰度较高的离子为定量离子;最后在最佳碎裂电压下,分别给定性离子和定量离子设置不同的碰撞能量,以MRM扫描模式扫描,以离子峰的响应值最高的为最佳碰撞能量,建立MRM采集方法,获得的最佳质谱参数见表3,获得的二级定性定量碎片离子见图4。

图4 二级定性定量碎片离子图
Fig.4 Secondary fragment ion of qualitative and quantitative
2.4 线性关系、检出限及定量限
建立基质匹配校准曲线,外标法定量,以测得的定量离子响应值的峰面积为纵坐标,各单一标准品系列浓度溶液的质量浓度为横坐标(x,ng/mL),绘制标准曲线。结果显示,7种苯二氮卓类镇静催眠药浓度在0~20 ng/mL内线性关系良好,相关系数R2均大于0.99,空白样品加标溶液进样测定,以3倍和10倍信噪比时的浓度作为检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ),分别为0.25~2.0 μg/kg和1.0~4.0 μg/kg,见表4。
表4 七种镇静剂的线性关系、检出限及定量限
Table 4 Linear relationship, LOD and LOQ of seven kinds of sedative drugs
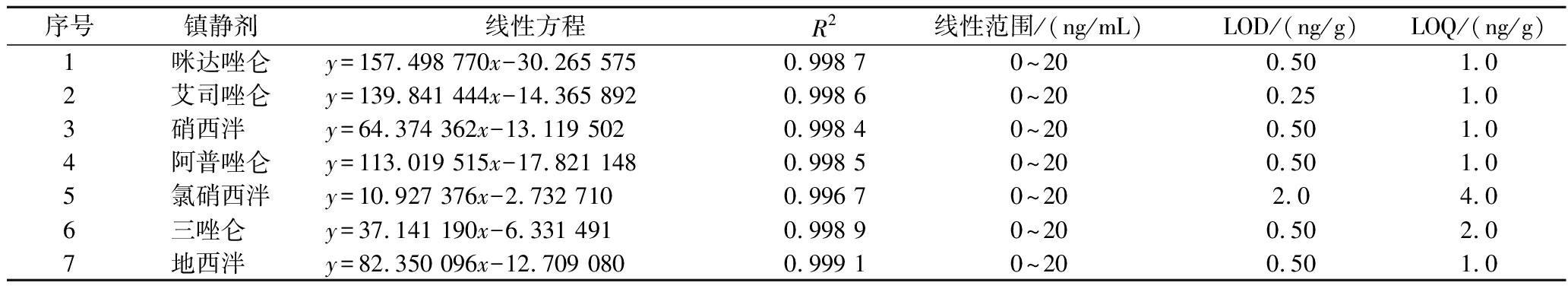
序号镇静剂线性方程R2线性范围/(ng/mL)LOD/(ng/g)LOQ/(ng/g)1咪达唑仑y=157.498 770x-30.265 5750.998 70~200.501.02艾司唑仑y=139.841 444x-14.365 8920.998 60~200.251.03硝西泮 y=64.374 362x-13.119 5020.998 40~200.501.04阿普唑仑y=113.019 515x-17.821 1480.998 50~200.501.05氯硝西泮y=10.927 376x-2.732 7100.996 70~202.04.06三唑仑 y=37.141 190x-6.331 4910.998 90~200.502.07地西泮 y=82.350 096x-12.709 0800.999 10~200.501.0
2.5 回收率及相对标准偏差
对空白样品进行加标回收实验,分别添加低(2.0 μg/kg)、中(4.0 μg/kg)、高(20 μg/kg)3个浓度水平的混合标准中间液,每个加标浓度设3个平行样,照供试品溶液制备方法处理,按1.3.4节和1.3.5节色谱和质谱条件进样2 μL测定其质量浓度,计算回收率。得到7种苯二氮卓类镇静催眠药的加标回收率和相对标准偏差(relative standard deviation,RSD)分别为83.8%~114.2%和1.1%~8.7%,见表5。
表5 七种镇静剂的回收率及相对标准偏差(n=3)
Table 5 Recovery and RSD of seven kinds of sedative drugs (n=3)
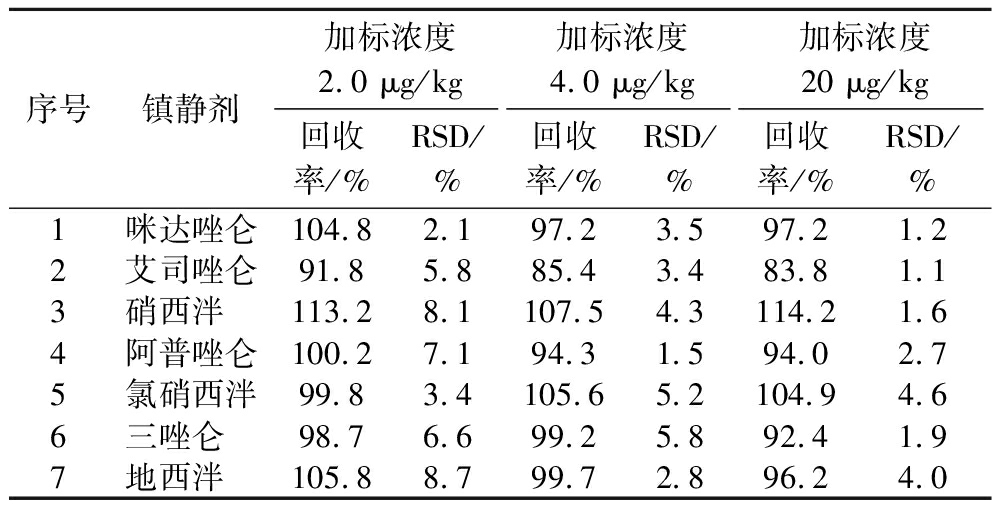
序号镇静剂加标浓度2.0 μg/kg加标浓度4.0 μg/kg加标浓度20 μg/kg回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%1咪达唑仑104.82.197.23.597.21.22艾司唑仑91.85.885.43.483.81.13硝西泮 113.28.1107.54.3114.21.64阿普唑仑100.27.194.31.594.02.75氯硝西泮99.83.4105.65.2104.94.66三唑仑 98.76.699.25.892.41.97地西泮 105.88.799.72.896.24.0
2.6 基质效应
液相色谱质联用适用于复杂样品中微量组分的测定,往往样品基质中非挥发性组分会影响到待测物的离子化效率,干扰和影响结果的准确性。本实验采用空白基质溶液与乙腈配制质量浓度均为10 ng/mL的标准品溶液,在相同的色谱质谱条件下进样分析以两者的质谱响应的峰面积比值的百分数来表示基质效应(matrix effect,ME),若ME>100%,则存在基质增强效应;若ME<80%,则为抑制效应;若ME为80%~100%,则不存在基质效应[15-16]。结果见图5,结果显示,咪达唑仑、艾司唑仑、阿普唑仑、三唑仑表现为基质弱效应,硝西泮、氯硝西泮、地西泮存在基质抑制效应;为了消除基质效应,采用基质标准溶液校正。
2.7 与现有国家标准比较
我国食品安全标准SN/T 3235—2012《出口动物源食品中多类禁用药物残留量检测方法 液相色谱-质谱/质谱法》中,测定水产品中镇静剂地西泮的前处理方法所用提取溶剂为1%氨水-乙腈,萃取盐包为无水硫酸钠,分散固相萃取的吸附剂为100 mg乙二胺-N-丙基硅烷、40 mg C18和600 mg 无水硫酸镁,经过净化的提取液需要进一步浓缩,测定低限为0.5 μg/kg。而本研究采用乙腈作为提取溶剂,没有使用刺激性强的氨水,萃取盐包为氯化钠和硫酸钠组合,采用MPFC-QuEChERS高脂基质净化柱一步净化,无繁琐的前处理步骤,提高了检测效率,测定的7种苯二氮卓类镇静催眠药LOD为0.25~2.0 μg/kg,其中地西泮LOD为0.50 μg/kg,与国标一致。相比国标本方法涵盖了除地西泮以外的6种常见苯二氮卓类镇静催眠药,可以有效防范钻国标检测项目的空白。
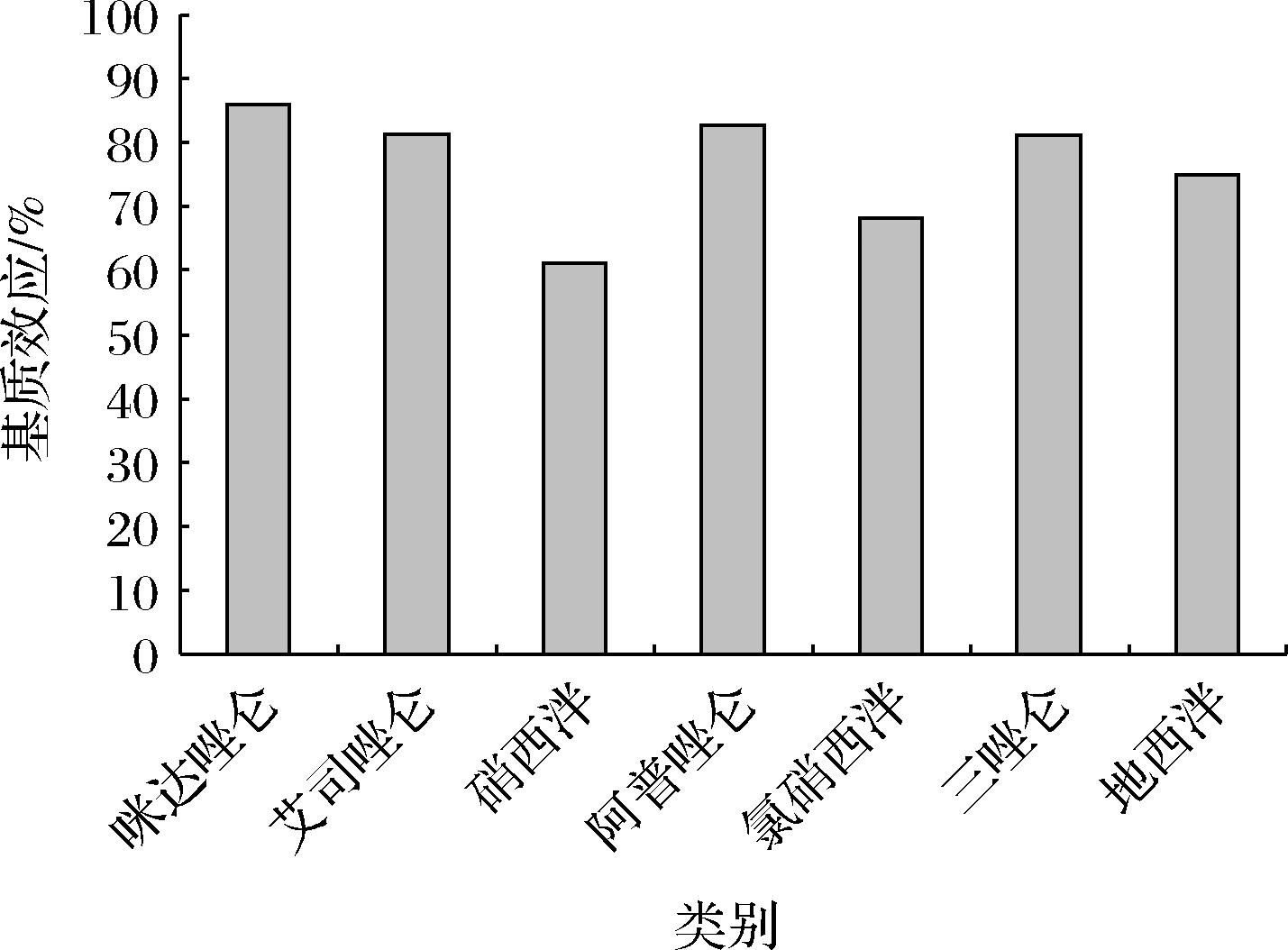
图5 七种镇静剂的基质效应
Fig.5 Matrix effect of seven kinds of sedative drugs
2.8 实际样品测定
在水产品流通环节,根据概率分布论,检出阳性样品存在一定概率,而且要保证足够的样本量。本研究采用自养鱼饲喂加入含地西泮标准物质的饲料,经过一定时间的吸收、代谢之后,应用本方法测定鱼肉中残留的地西泮,与应用国家标准方法SN/T 3235—2012 《出口动物源食品中多类禁用药物残留量检测方法 液相色谱-质谱/质谱法》的测定值几乎相近,其总离子流图见图6。
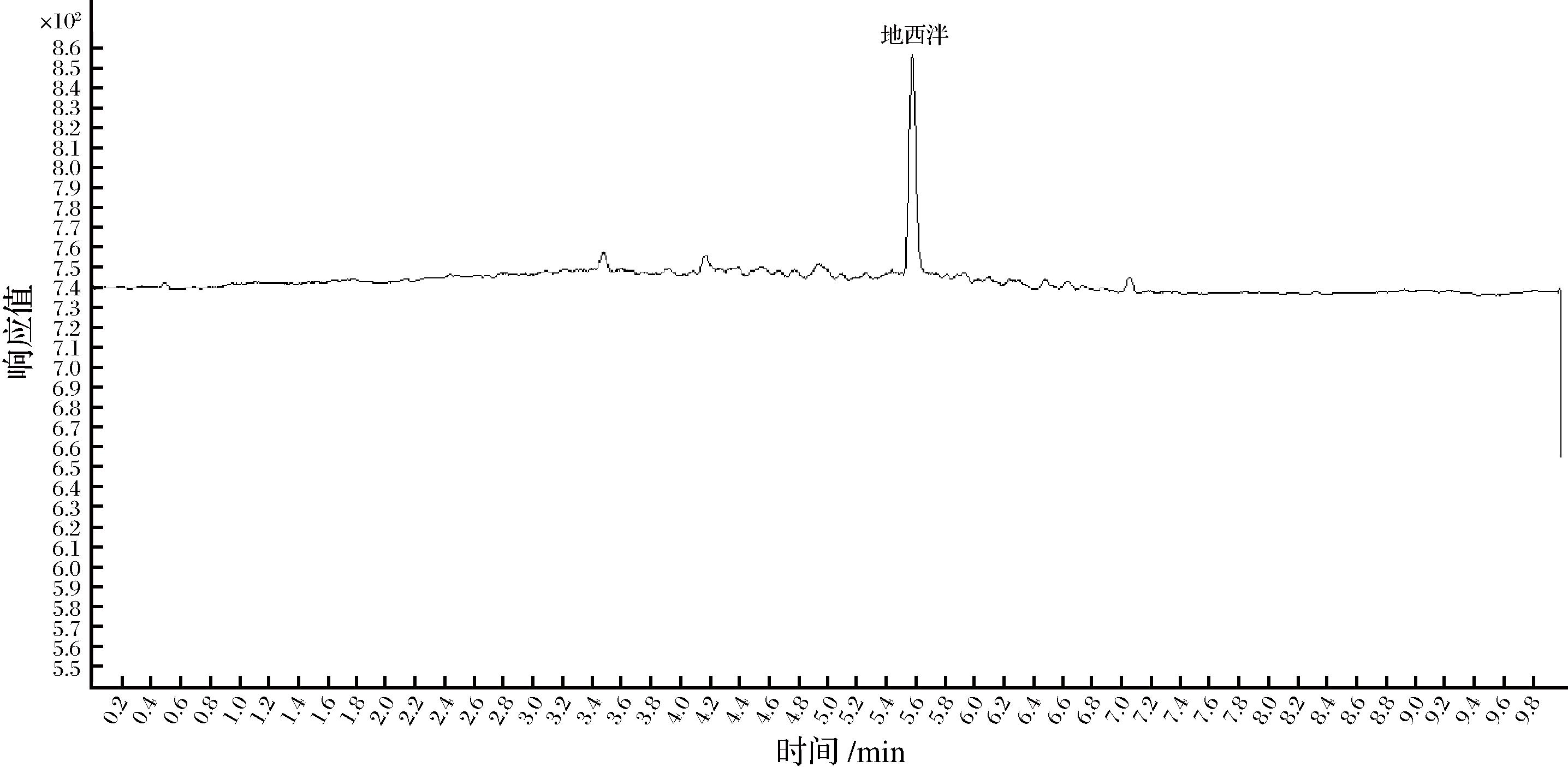
图6 实际样品的总离子流图
Fig.6 Total ion chromatogram of practical sample
3 结论
本研究以鱼肉为样品基质,采用超滤型高脂基质净化柱(MPFC-QuEChERS)结合UPLC-MS/MS建立了一种同时测定7种苯二氮卓类镇静催眠药的方法。该方法以乙腈为提取溶剂,提取液经Agilent Bond Elut QuEChERS兽药残留专用萃取盐包萃取和MPFC-QuEChERS净化柱净化,相较以固相萃取小柱或者分散固相萃取净化的传统的QuEChERS技术,操作更简便、更节省时间,有效提高了检测效率,适用于鱼肉中常见苯二氮卓类镇静催眠药的检测。
[1] 张微,肖曼,吴丹,等.固相萃取/超高效液相色谱-串联质谱法同时测定水产养殖“非药品”投入品中37种禁限兽药[J].分析测试学报,2022,41(12):1751-1757. ZHANG W, XIAO M, WU D, et al. Simultaneous determination of 37 prohibited veterinary drugs in aquaculture “non-pharmaceutical” inputs by solid phase extraction/ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis, 2022, 41(12):1751-1757.
[2] 任源远,韩刚,曾昊,等.我国水产养殖用兽药及其他投入品安全隐患排查概况及思考[J].中国渔业质量与标准,2020,10(5):7-11. REN Y Y, HAN G, ZENG H, et al. General situation and thinking on the investigation of potential safety hazards of veterinary drugs and other inputs for aquaculture in China[J]. Chinese Fishery Quality and Standards, 2020, 10(5):7-11.
[3] 陈博豪,王立坤,张威,等.鱼用镇静剂的种类及检测方法[J].食品工业,2022,43(12):211-214. CHEN B H, WANG L K, ZHANG W, et al.Types and detection methods of fish sedatives for fish[J].The Food Industry, 2022, 43(12):211-214.
[4] 柯浩堃,吕赛男,郝红霞,等.苯二氮卓类化合物的检测方法研究进展[J].分析试验室,2020,39(9):1110-1116. KE H K, LV S N, HAO H X, et al.Advances in the detection of benzodiazepines[J].Chinese Journal of Analysis Laboratory, 2020, 39(9):1110-1116.
[5] 芮茗,韩娜.近代安眠药的研究与开发简史[J].中国药物化学杂志,2021,31(6):460-469. RUI M, HAN N.A brief history of hypnotics′ research and discovery[J].Chinese Journal of Medicinal Chemistry, 2021, 31(6):460-469.
[6] 刘洋锋,孔聪,张海燕,等.基于高分辨质谱法筛查养殖水体中地西泮含量[J].食品安全质量检测学报,2021,12(8):3300-3305. LIU Y F, KONG C, ZHANG H Y, et al.Screening of diazepam content in aquaculture water based on high resolution mass spectrometry[J].Journal of Food Safety &Quality, 2021, 12(8):3 300-3 305.
[7] 张璇,杨光昕,孔聪,等.高效液相色谱-串联质谱法测定水产品中镇静剂及其代谢物残留[J].分析化学,2021,49(3):460-469. ZHANG X, YANG G X, KONG C, et al.Determination of tranquilizer and their metabolites residues in aquatic products by high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2021, 49(3):460-469.
[8] 邹游,邵琳智,陈思敏,等.QuEChERS-高效液相色谱-串联质谱法测定动物源性食品中3种镇静剂残留[J].色谱,2017,35(8):801-807. ZOU Y, SHAO L Z, CHEN S M, et al.Determination of three tranquillizer residues in animal foods by QuEChERS-high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography, 2017, 35(8):801-807.
[9] 胡海山,张云伟,赵淑娥,等.液相色谱-串联质谱法测定动物源性食品中5种镇静剂药物残留量[J].食品安全质量检测学报,2018,9(20):5319-5323. HU H S, ZHANG Y W, ZHAO S E, et al.Determination of 5 kinds of sedative drug residues in animal-derived foods by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety &Quality, 2018, 9(20):5319-5323. [10] 王守英, 孔聪, 杨光昕, 等. 上海市售水产品地西泮及去甲地西泮残留调查分析[J]. 农产品质量与安全, 2020(3):31-35;67. WANG S Y, KONG C, YANG G X, et al. Diazepam and nordazepam residue in the aquatic product from market in Shanghai[J]. Quality and Safety of Agro-Products, 2020(3):31-35;67.
[11] 张秋云,杨洪生,谭秀慧,等.液相色谱-串联质谱测定水产品中15种苯二氮卓类镇静剂的药物残留[J].食品与机械,2022,38(11):60-67;94. ZHANG Q Y, YANG H S, TAN X H, et al. Determination of drug residues of 15 benzodiazepines in aquatic products by liquid chromatography-tandem mass spectrometry[J]. Food &Machinery, 2022, 38(11):60-67;94.
[12] 杨洪生,张秋云,谭秀慧,等.同位素稀释-液相色谱-串联质谱法同时测定水产品中13种镇静剂残留[J].食品安全质量检测学报,2021,12(15):6017-6025. YANG H S, ZHANG Q Y, TAN X H, et al.Simultaneous determination of 13 kinds of sedative residues in aquatic products by isotope dilution-liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety &Quality, 2021, 12(15):6017-6025.
[13] 李芹,穆树荷,韩刚,等.水产品中镇静剂残留检测技术研究进展[J].中国农学通报,2021,37(12):86-91. LI Q, MU S H, HAN G, et al.Research progress on detection technology of sedative residues in aquatic products:Research progress[J].Chinese Agricultural Science Bulletin, 2021, 37(12):86-91.
[14] 何晓明,余鹏飞,刘强欣,等.改良QuEChERS-高效液相色谱-串联质谱法同时测定水产品中的13种镇静剂[J].食品工业科技,2020,41(24):203-209. HE X M, YU P F, LIU Q X, et al.Simultaneous determination of 13 sedative residues in aquatic products by modified QuEChERS combined with high-performance liquid chromatography-tandem mass spectrometry[J].Science and Technology of Food Industry, 2020, 41(24):203-209.
[15] 戴唯,李巧,朱明,等.QuEChERS-同位素内标-高效液相色谱-串联质谱法测定动物源性食品中植物生长调节剂类农药残留[J].色谱,2021,39(11):1213-1221. DAI W, LI Q, ZHU M, et al.Determination of plant growth regulators in animal-derived foods using QuEChERS-isotope-labeled internal standards with high performance liquid chromatography- tandem mass spectrometry[J].Chinese Journal of Chromatography, 2021,39(11):1213-1221.
[16] 颜春荣,张晓强,林慧,等.超高压液相色谱-串联质谱法(LC-MS-MS)测定鱼肉中磺胺类兽药残留的基质效应[J].肉类研究,2013,27(10):17-20. YAN C R, ZHANG X Q, LIN H, et al.Matrix effects in the determination of sulfonamide residues in fish meats by ultra performance liquid chromatography-tandem mass spectrometry (LC-MS-MS)[J].Meat Research, 2013, 27(10):17-20.