对人体而言,有些重金属元素,如锰、铜、锌等微量元素对生命活动是至关重要的,但绝大部分的重金属都不是人体生命活动所必需[1]。不同于有机污染物,重金属不能被生物而降解[2],而且会在食物链的生物放大作用下[3],成几百倍地累积下来,最终通过食物链而进入人体。重金属在人体内会与蛋白质、酶等发生作用,使它们的活性丧失。也可能逐渐累聚在人体的某些器官中,引起人体慢性中毒。重金属离子的检测方法可分为三大类[4-5]:光谱检测技术、色谱检测技术和电化学检测技术。光谱方法包括原子吸收光谱法、原子荧光光谱法等,这些方法非常灵敏,但价格昂贵且需要费力的预处理过程因此无法得到普及。原子吸收光谱法[6-7]是一种能够通过测定气化的基态原子的外层电子对紫外光及可见光的吸收强度,来定量被测元素含量的分析方法。该方法的优点是具有较低的检测限,较高的准确度(火焰法相对误差小于1%),其不足之处在于不能多种元素同时检测[8]。原子荧光光谱法[9-10]通过测定被测元素的原子蒸汽在辐射能激发下所产生荧光的发射强度来对待测元素进行分析。其检出限低于原子吸收光谱法,具有较高的灵敏度、标准曲线的线性范围大、能够多种元素同时测定等优点。但是通过原子荧光光谱法能测定的金属元素种类有限。色谱检测技术[11]利用某一特定的色谱系统(薄层色谱、高效液相色谱或气相色谱等系统)进行混合物中各组分的分离分析,主要用于分析多组分样品。高效液相色谱法[12]以液体作为流动相,通过高压输液系统使流动相进入装有固定相的色谱柱中,在色谱柱内流动相中的各成分分离之后进入检测器内进行检测,从而对试样进行分析。该法是应用最为广泛的重金属离子检测方法,具有“四高一广”的特点,即:高压、高速、高效、高灵敏度及应用范围广,此外,在该方法中色谱柱可以反复使用、样品也不会被破坏,易于回收。但是该方法的操作较为繁琐,得不到广泛应用。与光谱检测技术、色谱检测技术相比,电化学检测技术因其具有良好的选择性、便携性、低成本、分析速度快和出色的灵敏度而被广泛用于痕量重金属离子的分析。PARNSUBSAKUL等[13]利用多肽EKEKEKPPPPC制备传感器检测Ni2+,15 min内检测到低至34 nmol/L的Ni2+,线性范围为60~160 nmol/L,并且在土壤、尿液和水样中稳定。NISAR 等[14]通过制备电极实现对Zn2+、Cd2+、Cu2+和Hg2+的电化学检测,其检测限均低于世界卫生组织建议的阈值。LI等[15]借助多肽制备了一种选择性检测Pb2+的电化学传感器。多肽的合成方法比较成熟,可通过固相多肽合成法来合成不同序列的多肽;多肽可与金属离子快速键合从而形成非常稳定的螯合物,以保证对金属离子检测的高灵敏性;其次不同序列的多肽与不同金属离子的结合能力不同,这决定了多肽对金属离子检测的高选择性[15];多肽的氨基酸序列可进行优化以提高其选择性和灵敏度;多肽具有良好的生物相容性和细胞穿透能力。因此,基于多肽的化学传感器成为当今检测环境重金属离子的有效方法之一。
多肽作为生物体内的活性物质[16],对其进行研究既有重要的理论意义,又有重要的应用价值。由于多肽对重金属离子具有亲和力[17]以及多肽本身对人体具有诸多好处,故而选择以多肽作为电极修饰材料来制备多肽修饰电极,以已有的对重金属离子的检测方法以及对多肽的研究为基础,对利用多肽修饰电极检测重金属离子这一方法进行探索和研究。
1 材料与方法
1.1 材料与试剂
冰醋酸、醋酸钠、氯化钾、铁氰化钾、亚铁氰化钾、盐酸、硫酸镉,均为分析纯,国学集团化学试剂有限公司;食品级壳聚糖,南通兴成生物制品厂;多肽His-Trp-His (HWH)[≥95%(HPLC)],杭州中肽生化有限公司。
1.2 仪器与设备
CHI660E电化学工作站,北京华科普天科技有限公司;232型甘汞电极,上海仪电科学仪器股份有限公司;10 mm铂片电极、3 mm玻碳电极,盐城骄远分析仪器有限公司;FA2004电子天平,上海越平科学仪器有限公司。
1.3 实验方法
1.3.1 计算多肽与金属Cd2+的相互作用
在本研究中采用分子对接构建各金属离子(Cd2+、Cr2+、Cu2+、Pb2+、Ni2+、Zn2+)与短肽HWH的结合模式。Schrödinger2021-3软件包中的Maestro软件用于该分子对接工作。金属离子以及HWH皆通过Maestro构建。
在对接之前,通过LigPrep模块计算短肽HWH在生理环境下的电荷状态以及能量最低构象。金属离子与短肽HWH分子准备好后,进一步地,定义对接口袋的格点文件通过Maestro中受体格点准备模块(Receptor Grid Generation)生成,金属离子的质心被选作为活性口袋的中心,计算生成体积为30×30×30 Å3的格点文件。最后,准备好的文件通过Glide对接模块的SP精度的算法进行分子对接。
1.3.2 溶液的配制
1.3.2.1 铁氰化钾溶液的配制
用精密天平分别称取铁氰化钾0.823 2 g,亚铁氰化钾1.056 0 g,氯化钾3.727 6 g,加入500 mL的蒸馏水,摇匀,装入试剂瓶存于-4 ℃冰箱中待用。
1.3.2.2 缓冲溶液的配制
配制pH 5.0缓冲液,称取8.20 g醋酸钠与 5.72 mL醋酸,加入1 000 mL蒸馏水,摇匀。
1.3.2.3 Cd2+离子标准溶液的配制
所需的Cd2+离子溶液的质量浓度分别为0.01、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50 mg/L,按硫酸镉与缓冲液的比例分别进行配制,待检测。
以质量浓度为0.25 mg/L,pH=5的Cd2+离子溶液的配制为例,用精密天平称取0.05 g的硫酸镉于100 mL烧杯中,加入适量已经配制好的pH为5的醋酸-醋酸钠缓冲溶液,不断搅拌,直至硫酸镉固体完全溶解,然后将该溶液转移至100 mL的容量瓶中,用pH为5的缓冲液对其进行定容,定容完成即得到了pH为5,质量浓度为500 mg/L的Cd2+离子溶液。其他浓度的不同pH的Cd2+离子溶液的配制方法与该法相同。
1.3.3 电极的处理与表征
电极的表征采用循环伏安法在铁氰化钾溶液中扫描的方法。设置实验技术为循环伏安法,起始电位和转向电位分别为-0.2 V和0.6 V,扫描速率为0.1 V/s,记录在-0.2~0.6 V扫描的循环伏安图。
1.3.4 多肽电极的制备
在电极打磨干净的条件下,进行多肽修饰电极的制备,多肽电极的制备可采用两种方法。
方法一:电化学沉积法[18]。先配制5.0 mg/mL的多肽-水溶液,将三电极体系放入装有该溶液的烧杯中,并注意使3个电极的导电端处于溶液中同一高度,打开电化学工作站,设置实验技术为“时间-电流曲线”,富集电位设置为1.0 V,富集时间设为150 s,运行实验。
方法二:滴涂法[19]。准确称取0.10 g多肽溶于5.0 mL蒸馏水,配制20 mg/mL多肽-水溶液,用移液枪移取50 μL该多肽溶液,将其滴到玻碳电极导电端表面,然后使其自然晾干;为使多肽尽可能多地存在于电极表面,可在电极表面先富集一层壳聚糖,由于壳聚糖具有很好的生物相容性,其分子中存在的氨基易与多肽结合并使多肽不受金属离子的抑制,故可利用壳聚糖与多肽分子之间存在的氢键作用力,使得更多的多肽富集于电极表面。
分别使用上述2种方法来制备多肽电极,根据最终的表征结果,确定最利于实验的制备方法。
1.3.5 最佳实验条件的确定
影响检测的因素可能有:溶液的pH、Cd2+离子在电极上的富集电位、富集时间。对这些因素逐个进行考察,能够得出以上因素对实验的影响情况,与此同时也能确定出实验的最佳条件。
1.3.5.1 溶液最佳pH[20]的确定
分别配制pH为3、4、5、6、7、8的醋酸-醋酸钠缓冲溶液,并分别用这些pH的缓冲液配制质量浓度为0.25 mg/L的Cd2+离子溶液。富集电位设置为-1.0 V,采样间隔0.1 s,富集时间150 s。
1.3.5.2 最佳富集时间[21]的确定
根据上一步的实验可得到最佳pH为6。以质量浓度为0.25 mg/L,pH为6的Cd2+离子标准溶液作为检测对象。设置实验技术为“电流-时间曲线”,富集电位为-1.0 V,采样间隔为0.1 s,富集时间依次设置为25、50、75、100、125、150、175 s。
1.3.5.3 最佳富集电位[22]的确定
选与上一步实验中相同浓度、相同pH的Cd2+离子溶液作为实验对象。先设置实验技术为“电流-时间曲线”,设置富集时间为表2中所得到的最佳富集时间(150 s),富集电位设置为-0.9、-1.0、-1.1、-1.2、-1.3 V,设置好参数后打开搅拌,并运行实验。
以上实验考察了pH、富集电位、富集时间对于多肽电极检测重金属Cd2+离子的影响,由这一系列的考察也可以最终得出用多肽电极检测重金属离子的最佳实验条件。
1.3.6 标准曲线的测定
上述实验确定出了检测的最佳条件。根据对pH考察实验的结果,配制出pH为6的缓冲液,并用该缓冲液配制质量浓度分别为0.001、0.005、0.01、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50 mg/L的Cd2+离子标准溶液。按浓度由小到大的顺序,在最佳条件下逐一对这些浓度的Cd2+离子溶液进行检测。
设置实验技术为“方波伏安法”,设置初始电位为-1.0 V,终止电位为-0.2 V,运行实验。依次检测各个浓度的Cd2+离子溶液,以Cd2+离子浓度为横坐标,对应的溶出峰电流值为纵坐标,绘制出Cd2+离子浓度与电流峰值的关系曲线,对曲线进行拟合,可得到Cd2+离子溶液的标准曲线。
1.3.7 电极的重复性检测
在最佳实验条件下,对同一浓度、同pH的Cd2+离子溶液重复检测9~10次,比较几次重复检测所得的方波伏安曲线中的溶出峰电流值,计算其相对标准偏差,由相对标准偏差值的大小可以判断在该实验条件下多肽电极的稳定性。先按照公式(1)可计算出标准偏差值,通过公式(2)可计算出相对标准偏差值:
(1)
式中:S为标准偏差;Xi分别为各次检测所得方波伏安曲线中的峰电流值;X为i次检测得到的溶出峰电流的平均值;i为检测次数。
RSD=S/X
(2)
式中:RSD,相对标准偏差(relative standard deviation,RSD)。
1.3.8 检测限的计算
根据所得出的标准曲线,结合3倍信噪比公式(3)可计算出检测限:
D=3S/k
(3)
式中:D为检测限;S为n次检测结果的标准偏差;k为标准曲线的斜率。
1.3.9 回收率实验
为验证多肽电极检测Cd2+离子这一方法的实用性,使用该电极对饮用水、大学城内采集到的湖水以及某饮料(无明显颜色)分别进行检测。首先,检验水样中是否含有Cd2+离子:分别量取3种水样1 mL,并分别加入9 mL确定为最佳pH的缓冲溶液,先对这2种体系的溶液在最佳条件下进行检测,若检测发现水样含Cd2+离子,则需结合标准曲线的方程计算出其中Cd2+离子的浓度值;若未检出Cd2+离子,则标注为未检出。再分别量取1 mL 3种水样两份,每种水样里分别加入0.5、1.0、1.5、2.0 mL最佳pH、质量浓度为0.30 mg/L的Cd2+离子标准溶液,之后加入8.5、8.0、7.5、7.0 mL最佳pH的缓冲液,使体系总体积为10 mL,在最优实验条件下分别进行检测,每组平行检测6次。根据检测结果进行回收率的计算,回收率越接近100%,分析方法和过程的准确度就越高,根据计算结果可判断出该方法的实用性以及准确度。同时与原子光谱法[9]以及电感藕合等离子体质谱法(inductively coupled plasma mass, ICP-MS)对照,电感耦合等离子体质谱法参照GB 5009.268—2016《食品安全国家标准 食品中多元素的测定》。
回收率的计算如公式(4)所示:
(4)
式中:P代表回收率;C1代表加样后测定得到的总浓度;C2代表未加标使得测定值;C标表示加表浓度。
1.4 数据统计与作图
实验数据使用Origin 9.0处理及结果分析,静电势计算使用Discovery Studio。
2 结果与分析
2.1 多肽与金属Cd2+的相互作用
为研究不同金属离子(Cd2+、Cr2+、Cu2+、Pb2+、Ni2+、Zn2+)与HWH的相互作用,采用量子化学的方法,将HWH与不同金属离子(Cd2+、Cr2+、Cu2+、Pb2+、Ni2+、Zn2+)进行结合。结果如图1所示,黄色虚线表示螯合作用,数字表示作用距离,通常距离越短表示螯合作用越强。结果显示,金属离子Cd2+结合在HWH之间,和2个酰胺键上的碳基发生螯合作用,此外还和C-terminal His上的羧基发生螯合作用。螯合作用的距离分别为2.0、2.1、2.4 Å,相较于Cr2+、Cu2+、Pb2+、Ni2+、Zn2+结合距离较近,意味着Cd2+结合在HWH上的螯合作用比较强。对接过程中还获取了金属离子和HWH短肽的结合能打分。软件显示Cd2+、Cr2+、Cu2+、Pb2+、Ni2+、Zn2+与HWH的结合能分别为-6.4、-4.4、-5.0、-4.2、-3.4、-4.2 kcal/mol。从结合能上看,Cd2+与HWH的结合能略强于其余的金属离子。

a-HWH-Cd2+; b-HWH-Cr2+; c-HWH-Cu2+; d-HWH-Pb2+; e-HWH-Ni2+; f-HWH-Zn2+
图1 不同金属离子与HWH的螯合作用
Fig.1 Chelation of different metal ions with HWH
2.2 电极的处理与表征
在使用所有的固体电极之前都必须要对其表面进行清洁,以除去电极表面因为玷污或吸附杂质而造成的污染。大部分金属电极的表面都很容易生成氧化层。玻碳电极的表面发生氧化后,就会产生各种含氧基团(如酚类、醇类、羧基、酮醌及酸酐等)。这些物质的存在会使电极的重现性、稳定性变差,灵敏度下降,使电极失去原有的选择性。
对于玻碳电极而言,如果选择以电极在铁氰化钾溶液中扫描得到的循环伏安曲线来测试其性能的话,就要求所得到的循环伏安曲线中2个峰的峰电位之差要小于100 mV,满足此要求的电极方可使用,否则就需要对其重新进行处理,直到符合要求为止。
该循环伏安曲线是在电极上施加-0.2~0.6 V的线性电压,在铁氰化钾溶液中扫描得到的。从-0.2 V开始扫描,达到终止电位0.6 V后,再负向扫描回-0.2 V。正向扫描的过程中,电极上发生还原反应,负向扫描的过程中,电极上存在的被还原的物质又会被氧化,如此循环。由图2可获得氧化峰电流与还原峰电流以及氧化峰电位与还原峰电位。根据循环伏安曲线中的信息可以判断电极是否可逆。该循环伏安曲线中的电位峰值之间的差值大小满足实验电位差的条件,故可说明电极已被打磨干净,可以使用该电极来进行下一步的实验。
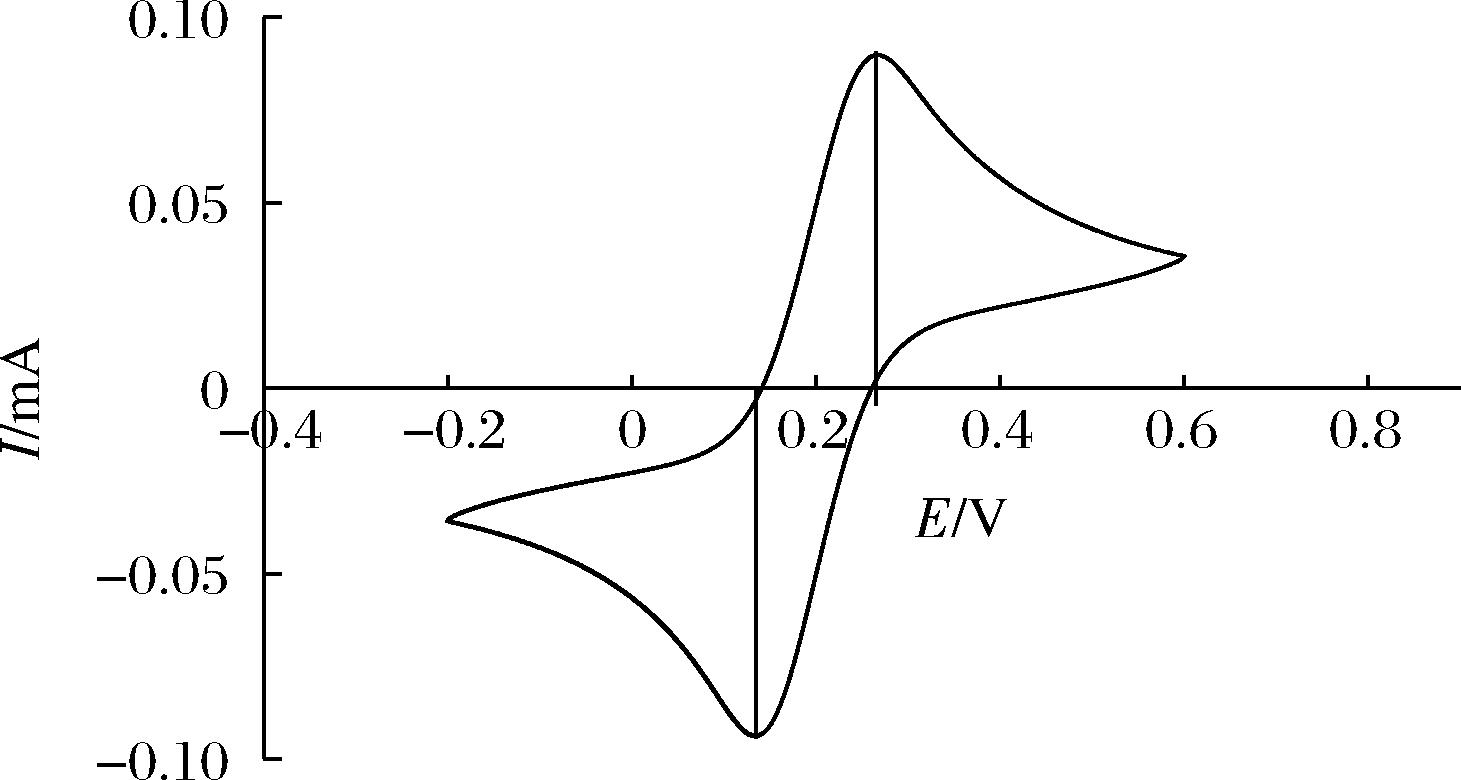
图2 裸玻碳电极循环伏安图
Fig.2 Cyclic voltammogram of bare glassy carbon electrode
2.3 多肽电极的制备
分别尝试了采用电化学沉积法和滴涂法来制备多肽电极。并分别对2种方法制备出来的复合电极通过循环伏安曲线来进行表征,扫描速率设置为0.1 V/s,记录-0.2~-0.6 V的扫描曲线并将得到的曲线与裸电极在铁氰化钾溶液中表征所得的循环伏安曲线进行对比(图3)。
由图3看出,采用不同的方法富集多肽之后,电极在铁氰化钾溶液中进行扫描所得到的循环伏安曲线的电流峰值都有所增加,这就说明用2种方法都可以成功地制备出多肽电极。比较2张图中的曲线,对应各个曲线的标签,可以看出电化学沉积法制备的多肽电极以及用滴涂法直接滴加多肽所得到的复合电极的循环伏安曲线与裸玻碳电极的循环伏安曲线之间的差异并不明显。滴涂法直接滴加多肽和电化学沉积法2种方法制备出的多肽电极效果差异并不是很大。与此同时,能够明显地看出图3-b中富集了壳聚糖之后又滴加多肽的电极的循环伏安曲线相较于其他复合电极的循环伏安曲线的变化更为明显,其电流峰值的增大更为显著。这也就说明,壳聚糖与多肽分子之间的氢键作用力能够使多肽分子更好地富集在电极表面,这对于多肽修饰电极的制备起到了很好的辅助作用。综上所述,在接下来的研究中实验应采用滴涂法,先富集壳聚糖,再滴涂多肽的方法制备多肽电极。
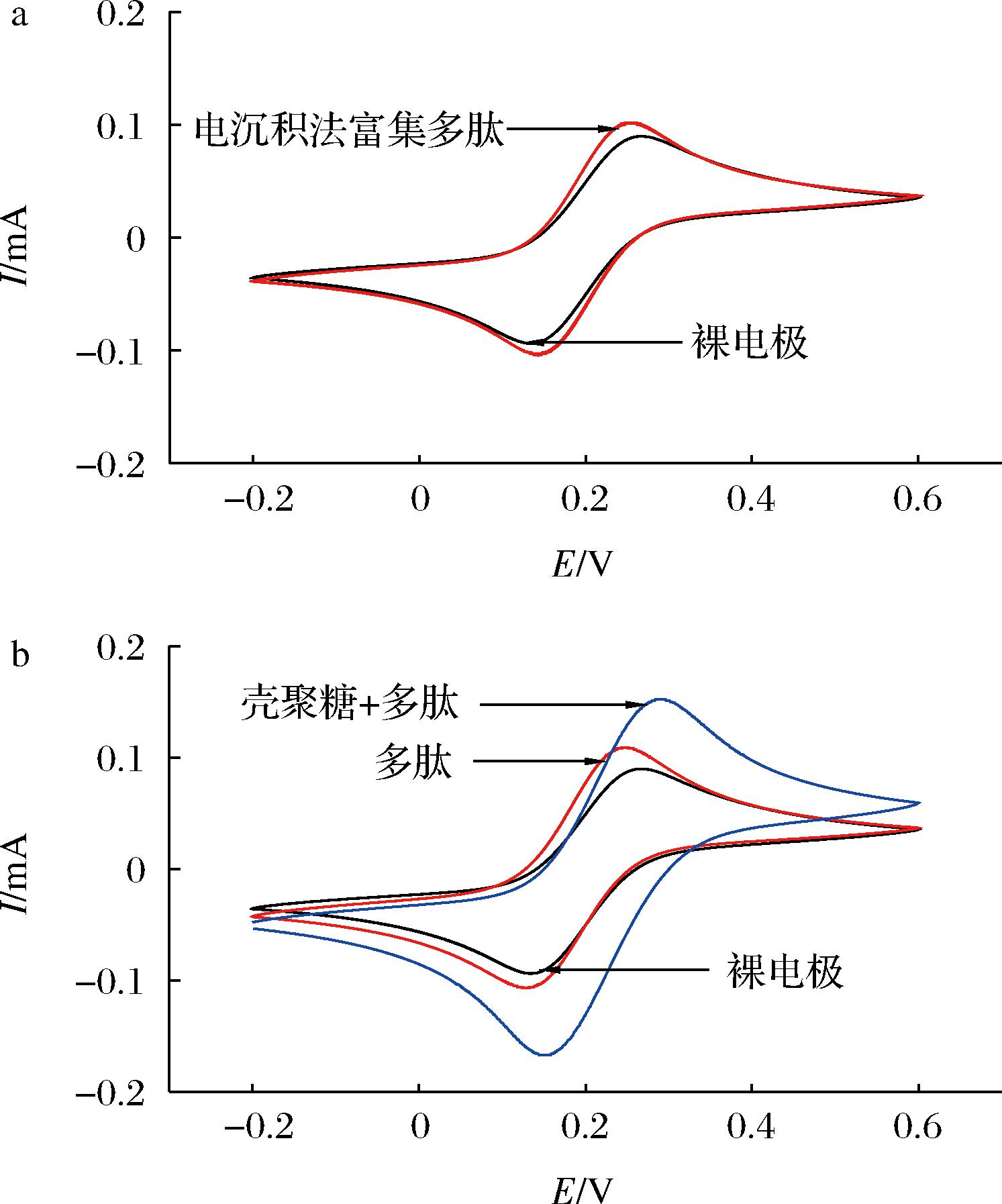
a-电化学沉积法制备出来的多肽电极的循环伏安曲线与裸电极 循环伏安曲线的对比图;b-采用滴涂法分别直接滴加多肽以及 先富集壳聚糖再滴加多肽后制备出的多肽电极的循环伏安 曲线与裸电极循环伏安曲线的对比图
图3 不同方法制备的多肽电极与裸玻碳电极循环伏安图
Fig.3 Cyclic voltammetry of polypeptide electrode and bare glass carbon electrode prepared by different methods
2.4 优化实验
由图4-a可以很直观地看出Cd2+离子溶液的pH值对检测的影响情况。pH<6时,随着电解质pH的增长,Cd2+离子的氧化峰电流值也不断增长。出现这一现象的原因可能是,在pH较低的情况下,多肽结构中的氮元素与氢离子之间通过氢键作用力结合,这就导致了多肽中氮的活性位点数目减少,从而减弱了对Cd2+离子的吸附络合作用,也可能是因为与氮元素氢键结合的氢离子对Cd2+离子产生了排斥力,从而使得Cd2+离子溶出峰电流值降低。所以,如图4-a所示,pH较小时,Cd2+离子溶出峰电流值也比较小。当pH一直上升到6以后,溶出峰电流值呈现减弱的趋势,这可能是因为Cd2+离子出现了水解的缘故。所以该部分实验可证明在该方法中最佳的pH为6,对于实验最佳条件的进一步探索应该以pH为6、质量浓度为0.25 mg/L的Cd2+离子溶液作为对象继续进行。
在确定实验最佳pH为6的情况下,在检测过程中分别设置金属离子的富集时间为25、50、75、100、125、150、175、200 s,对质量浓度为0.250 mg/L、pH为6的Cd2+离子溶液进行检测,以检测过程中所设置的富集时间值为横坐标,各个时间对应的方波伏安曲线中的溶出峰电流值为纵坐标,绘制出富集时间与峰电流值的关系曲线,如图4-b所示,该关系曲线表明了Cd2+离子富集时间对检测结果的影响情况,由图4-b可以看出,在富集时间≤150 s时,随着富集时间的延长,沉积到修饰电极表面的重金属Cd2+也逐渐增多,溶出峰电流值也随之逐步增大;但继续延长Cd2+离子的富集时间,直至大于150 s之后,Cd2+离子溶出峰电流值呈缓慢下降趋势。这就说明,电流溶出峰的值并不会随着富集时间的延长而无限制地增大,可能还与被测溶液中Cd2+离子的浓度、电极材料以及电极面积的大小等因素相关。因此,该部分实验可以确定,在用多肽电极检测Cd2+的方法中,Cd2+离子的最佳富集时间为150 s,接下来的实验应当以pH为6、质量浓度为0.25 mg/L的Cd2+标准溶液作为实验对象,在Cd2+离子富集过程中应设置富集时间为150 s,以此来考察其他因素对实验的影响情况。
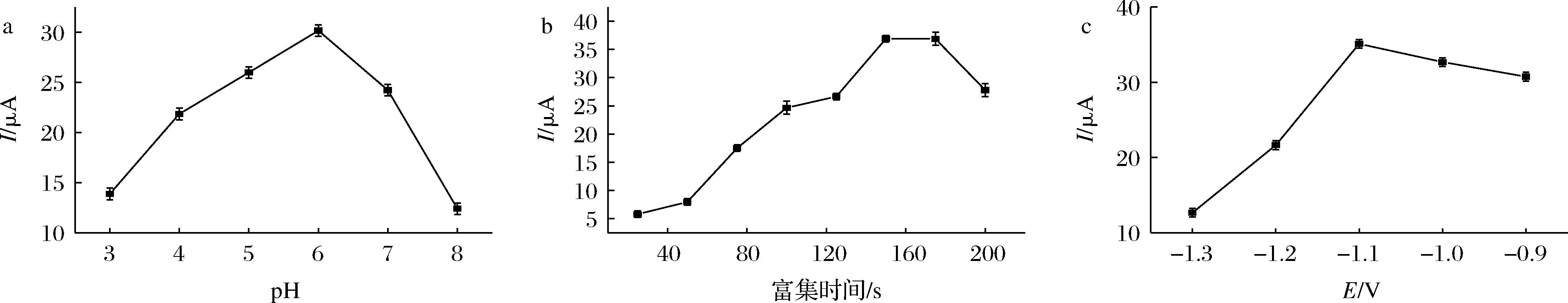
a-pH值;b-富集时间;c-富集电位
图4 不同因素对溶出峰电流值的影响
Fig.4 Influence of different factors on stripping peak current value
富集电位是在离子富集过程中所施加的电压,该电压值的大小与溶液中发生的化学反应以及体系的内环境密切相关。在伏安分析法中,富集电位对方法灵敏度的影响很大,在此过程中仍然以pH为6、质量浓度为0.250 mg/L的Cd2+离子溶液作为实验对象,检测过程中设置Cd2+的富集时间为150 s,分别设置富集电位为-0.9、-1.0、-1.1、-1.2、-1.3 V,记录在各个富集电位下进行检测所得的方波伏安曲线,并以实验过程中所设置的电位值为横坐标,对应的溶出峰电流值为纵坐标,绘制出相应的关系曲线,如图4-c即为富集电位与溶出峰电流值的关系曲线,由图中关系曲线可以看出,随着实验设置的富集电位值逐渐小于Cd2+的溶出电位(-0.8 V),Cd2+溶出峰电流值也就越大,Cd2+的响应电流逐渐增高。造成该现象的原因可能是,随着富集电位的减小,Cd2+离子还原成镉单质的驱动力在不断地增大,工作电极表面产生的还原金属就会越来越多,直到富集电位减小至-1.1 V 时,溶出峰电流值达到最大。继续减小富集电位,溶出峰电流值便会开始下降,出现该现象的原因可能是,富集电位值的负向增大会使得溶液中的其他物质发生还原反应而析出。例如,氢气的产生。这就会对检测产生很大的干扰,从而会使溶出峰电流值开始下降,故而Cd2+的响应电流也会下降,所以根据该实验结果可以确定实验最佳的富集电位值为-1.1 V。
2.5 标准曲线的检测与绘制
设置各个实验条件为优化实验部分所得到的最佳条件,分别对质量浓度为0.01、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45 L、0.50 mg/L的Cd2+标准溶液(pH=6)进行检测。由此标准曲线可看出在0.001~0.30 mg/L的浓度内,Cd2+标准溶液的浓度与溶出峰电流值的线性方程为I (μA)=86.78×C(mg/L)+0.171 0,相关系数R2=0.998 9。
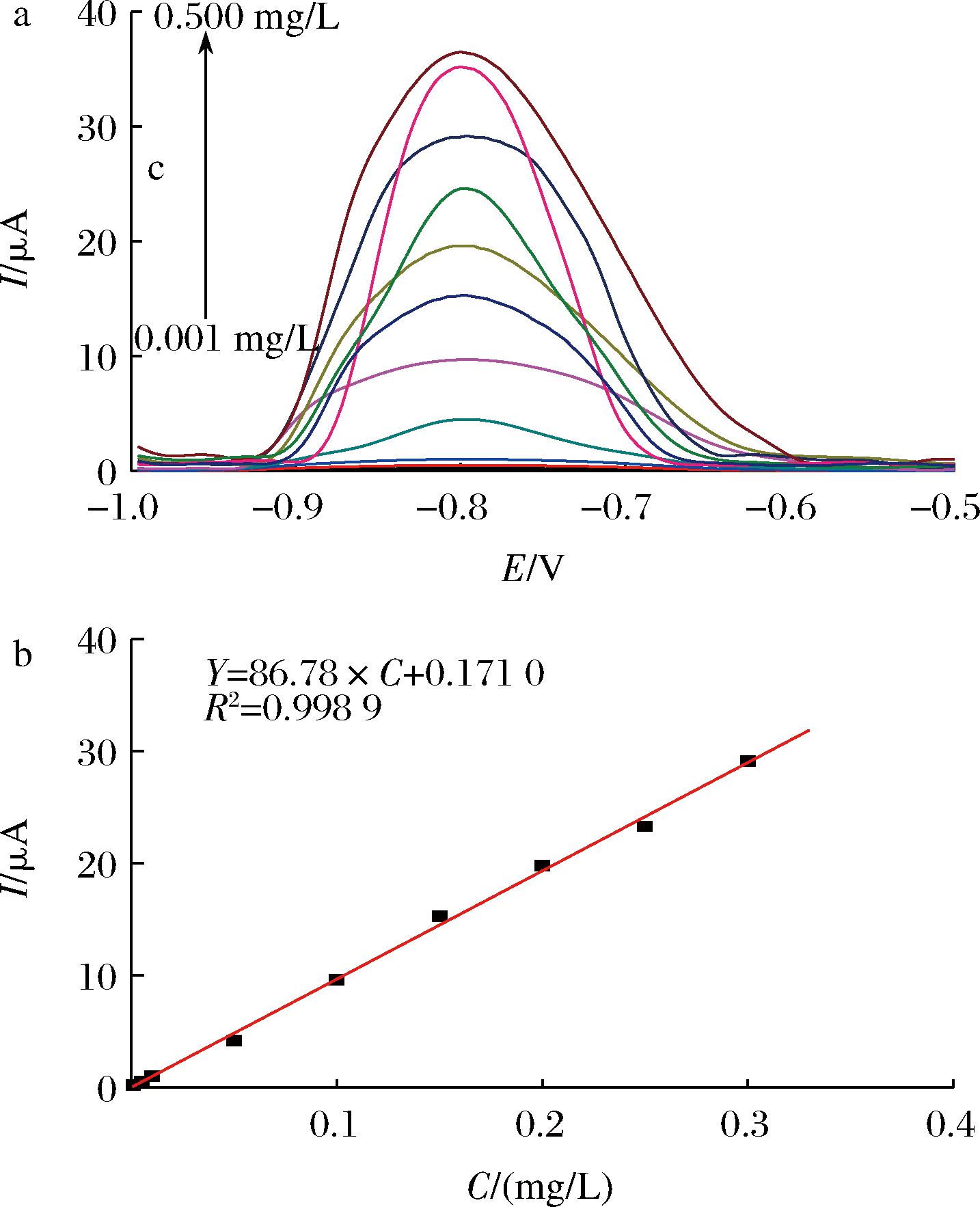
图5 标准曲线的检测与绘制
Fig.5 Standard curve detection and drawing
多肽HWH制备电极检测不同重金属离子(Cd2+、Cr2+、Cu2+、Pb2+、Ni2+、Zn2+),发现其对于Cd2+的检测能力较为显著,这可能是量子化学筛选出了金属结合肽HWH与Cd2+的最佳结合力场,同时由于金属结合肽的高选择性[15],导致其对不同金属离子的检测能力有所差异。
2.6 电极的重复性检测
在已知的最佳条件下对质量浓度为0.25 mg/L、pH=6的Cd2+标准溶液进行检测,重复检测9次,9次检测所得到的方波伏安曲线图中溶出峰电流值如表1所示,根据这些实验数据就可以计算出该方法的标准偏差值和相对标准偏差值。由相对偏差值得大小即可以判断在当前条件下该方法的准确度及检测结果的稳定性。
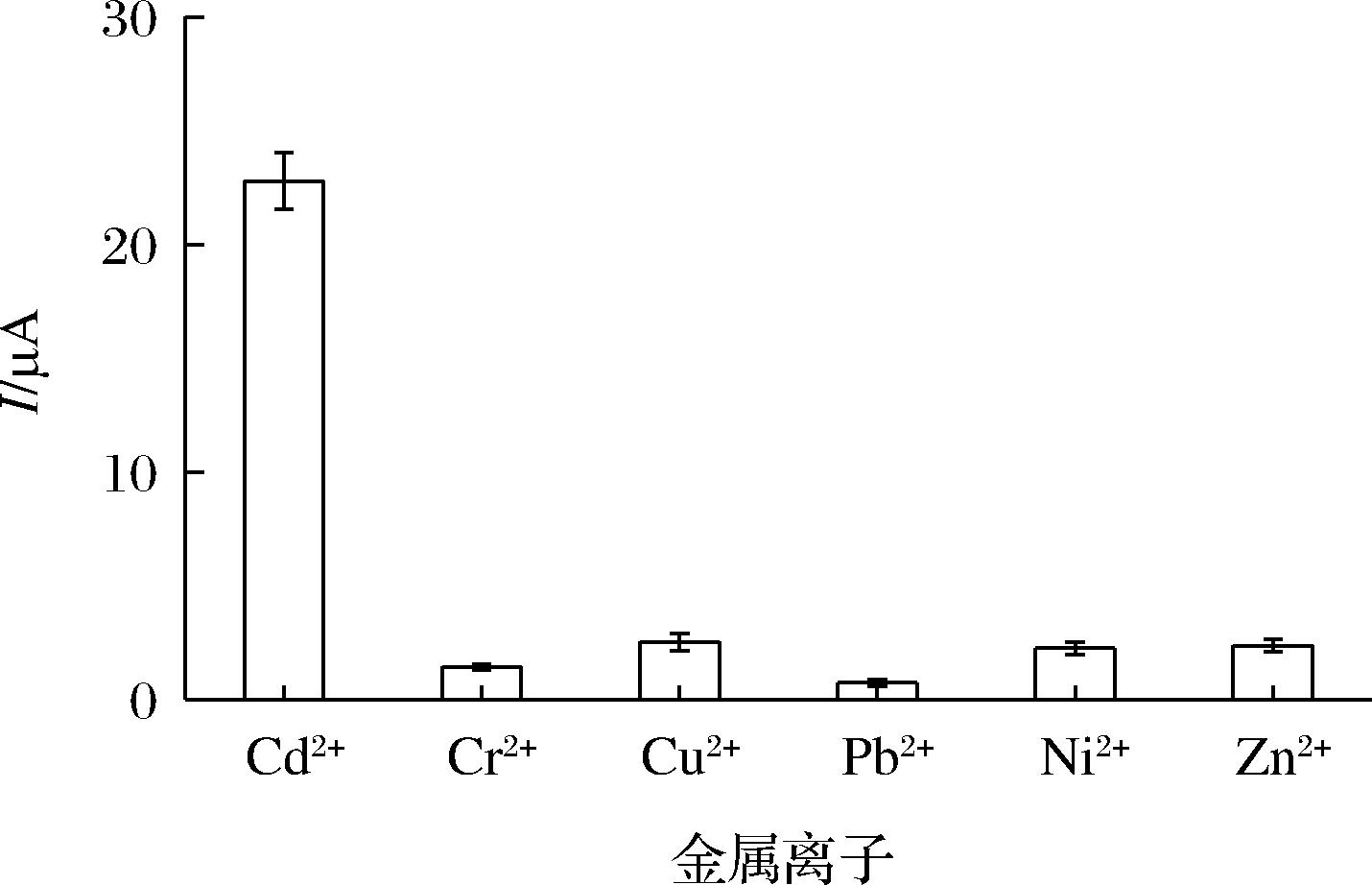
图6 不同金属离子的检测
Fig.6 Detection of different metal ions
表1 0.25 mg/L Cd2+标准溶液的检测(n=9)
Table 1 Detection of 0.25 mg/L cadmium ion standard solution (n=9)
次数123456789I/μA0.2750.3000.2890.2720.2690.2750.2630.2770.295
将9次检测实验所得到的溶出电流峰值计算得到标准偏差S=0.012 4,RSD=4.45%。根据标准曲线的方程以及标准偏差的计算结果,根据3倍信噪比的公式可计算出该方法的检测限:计算可以得到D=4.301×10-4 mg/L,即该方法的检测限可以达到0.430 1 μg/L。
2.7 回收率实验
为考察多肽电极检测Cd2+这一方法的应用性,应用该修饰电极对饮用水、大学城湖水以及某饮料(无明显颜色)进行检测,分别量取3种水样1.0 mL,并加入9.0 mL缓冲溶液(pH=6),先对该体系在最佳条件下进行检测。接下来再分别量取1 mL 3种水样,2种水样中都分别加入0.5、1.0、1.5、2.0 mL pH为6质量浓度为0.30 mg/L的Cd2+标准溶液,再加入8.5、8.0、7.5、7.0 mL的pH为6的缓冲液,在最优实验条件下分别进行检测。进行实验方法回收率的测定,每组平行检测6次,测定结果如表2所示。
先对3种水样品进行检测,检测发现,饮用水以及某饮料中未检出Cd2+,湖水中Cd2+质量浓度约为0.88 μg/L。在水样中加入不同量的Cd2+标准溶液后进行检测,根据检测所得到的方波伏安曲线中的溶出峰电流值结合标准曲线的方程I (μA) = 86.78×C (mg/L)+0.171 0进行计算,即可得到被检样品中Cd2+的浓度。根据回收率的计算公式进行计算,即可得到回收率。计算结果表明,3种加入了不同Cd2+的回收率均为97.4%~103.5%,原子光谱回收率为98.3%~100.1%,ICP-MS的回收率为97.9%~99.6%,变异系数均低于10%。这就说明使用多肽复合电极来检测Cd2+这一方法的准确度相对还是比较高的,这也就进一步证明了该方法的可行性。
表2 不同水中Cd2+的检测(n=6)
Table 2 Detection of cadmium ions in tap water (n=6)

样品测定值C/(μg/L)加标质量浓度C/(μg/L)检测总质量浓度C/(μg/L)回收率R/%原子光谱回收率R/%ICP-MS回收率R/%变异系数/%饮用水ND1514.8599.099.099.15.93029.5798.699.198.18.54544.6299.299.199.07.16058.4597.498.599.58.9湖水0.881515.8499.898.699.14.73031.92103.599.399.69.84545.2398.6100.198.77.86059.9798.599.698.77.9某饮料ND1514.9499.698.599.15.53029.3297.898.398.38.44544.0397.998.498.17.86059.6799.598.797.97.5
注:ND表示未检出。
3 结论
本文研究了使用多肽修饰的玻碳电极,在醋酸-醋酸钠的缓冲液中,通过方波伏安法来检测重金属Cd2+,实验逐一优化了修饰电极的制备方法、缓冲液的pH、富集Cd2+的时间以及富集电位等影响检测的因素,最终证明在缓冲溶液pH= 6,富集时间为150 s,富集电位为-1.1 V的实验条件下检测达到最优。实验证明,在最优的检测条件下,此多肽电极对于Cd2+有着很好的响应,当Cd2+质量浓度为0.001~0.30 mg/L时,Cd2+溶液的浓度与Cd2+溶出峰电流值之间存在着良好的线性关系,经拟合后得到其线性方程为I (μA)=86.78×C (mg/L)+0.171 0,R2为0.998 9,通过三倍信噪比公式进行计算,得到该方法的检出限D=4.301×10-4mg/L。在对其稳定性考察的过程中,发现平行检测实验所得到的结果相对标准偏差RSD=4.45%,相对于其他方法较高,这可能是由于实验过程中未对被测体系的温度进行控制而导致的。此外,用该方法对饮用水、大学城湖水以及某饮料进行检测,结果显示其加标回收率达到97.4%~103.5%。一系列的实验都能证明该方法能够实际用于Cd2+的检测,但是各方面的条件仍然有待于进一步的优化。例如,需要对制备多肽电极时富集的多肽的量以及实验进行的温度进行更加精确的考察,以使检测效果达到最佳。
[1] FU Z S, XI S H. The effects of heavy metals on human metabolism[J]. Toxicology Mechanisms and Methods, 2020, 30(3):167-176.
[2] THOMAS C C, NSONWU-ANYANWU A C, USORO C A O, et al. Hepato-renal toxicities associated with heavy metal contamination of water sources among residents of an oil contaminated area in Nigeria[J]. Ecotoxicology and Environmental Safety, 2021, 212:111988.
[3] DING Q, LI C, WANG H J, et al. Electrochemical detection of heavy metal ions in water[J]. Chemical Communications, 2021, 57(59):7215-7231.
[4] AHMAD MALIK L, BASHIR A, QUREASHI A, et al. Detection and removal of heavy metal ions: A review[J]. Environmental Chemistry Letters, 2019, 17(4):1495-1521.
[5] KARTHIK V, SELVAKUMAR P, SENTHIL K P, et al. Biosensor for heavy metals detection in wastewater: A review [J]. Food and chemical toxicology: An international journal published for the British Industrial Biological Research Association, 2022, 168.
[6] EVANS E H, DAY J A, PALMER C, et al. Advances in atomic spectrometry and related techniques[J]. Journal of Analytical Atomic Spectrometry, 2010, 25(6):760-784.
[7] EVANS E H, PISONERO J, SMITH C M M, et al. Atomic spectrometry update: Review of advances in atomic spectrometry and related techniques[J]. Journal of Analytical Atomic Spectrometry, 2017, 32(5):869-889.
[8] BACON J R, BUTLER O T, CAIRNS W R L, et al. Atomic spectrometry update—A review of advances in environmental analysis[J]. Journal of Analytical Atomic Spectrometry, 2020, 35(1):9-53.
[9] AKBABA T N, AACAR O. Determination of cadmium and selenium in food samples by electrothermal atomic absorption spectrometry using Ni + Pt modifier mixture[J]. Journal of Analytical Chemistry, 2022, 77(5):555-562.
[10] LIU Y C, ZOU J, LUO B, et al. Ivy extract-assisted photochemical vapor generation for sensitive determination of mercury by atomic fluorescence spectrometry[J]. Microchemical Journal, 2021, 169:106547.
[11] CHONG H S, SIM S, YAMAGUCHI T, et al. Simultaneous determination of sodium iron chlorophyllin and sodium copper chlorophyllin in food using high-performance liquid chromatography and ultra-performance liquid chromatography-mass spectrometry[J]. Food Chemistry, 2019, 276:390-396.
[12] ZOU H M, ZHOU C, LI Y X, et al. Speciation analysis of arsenic in edible mushrooms by high-performance liquid chromatography hyphenated to inductively coupled plasma mass spectrometry[J]. Food Chemistry, 2020, 327:127033.
[13] PARNSUBSAKUL A, OAEW S, SURAREUNGCHAI W. Zwitterionic peptide-capped gold nanoparticles for colorimetric detection of Ni2+[J]. Nanoscale, 2018, 10(12):5466-5473.
[14] NISAR A, SHAH A, ZAHID A, et al. Sensitive and selective detection of multiple metal ions using amino acids modified glassy carbon electrodes[J]. Journal of the Electrochemical Society, 2018, 165(3): B67-B73.
[15] LI X, QIU S, SHI J Y, et al. A new function of copper zinc superoxide dismutase: As a regulatory DNA-binding protein in gene expression in response to intracellular hydrogen peroxide[J]. Nucleic Acids Research, 2019, 47(10):5074-5085.
[16] JIA L T, WANG L, LIU C, et al. Bioactive peptides from foods: Production, function, and application[J]. Food &Function, 2021, 12(16):7108-7125.
[17] LEI Z, ZHANG H, WANG Y Q, et al. Peptide microarray-based metal enhanced fluorescence assay for multiple profiling of matrix metalloproteinases activities[J]. Analytical Chemistry, 2017, 89(12):6749-6757.
[18] LAIDOUDI S, KHELLADI M R, LAMIRI L, et al. Non-enzymatic glucose detection based on cuprous oxide thin film synthesized via electrochemical deposition[J]. Applied Physics A, 2021, 127(3):1-10.
[19] CHANG Y Y, VENTON B J. Optimization of graphene oxide-modified carbon-fiber microelectrode for dopamine detection[J]. Analytical Methods: Advancing Methods and Applications, 2020, 12(22):2893-2902.
[20] BRUNNER J, KRAEMER R. Copper(II)-quenched oligonucleotide probes for fluorescent DNA sensing[J]. Journal of the American Chemical Society, 2004, 126(42):13626-13627.
[21] NDOKOYE P, KE J, LIU J, et al. L-cysteine-modified gold nanostars for SERS-based copper ions detection in aqueous media[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2014, 30(44):13491-13497.
[22] CHAN Y H, CHEN J X, LIU Q S, et al. Ultrasensitive copper(II) detection using plasmon-enhanced and photo-brightened luminescence of CdSe quantum dots[J]. Analytical Chemistry, 2010, 82(9):3671-3678.