胆碱(choline),在自然界存在游离态和结合态2种形式,其中结合态有如乙酰胆碱、与磷脂结合成的磷脂酰胆碱、鞘磷脂等。胆碱具有保障神经信息传递、促进脑发育和脂肪代谢等作用[1-3],最新研究表明,胆碱能够保护和补偿细胞因子、与药物组合帮助治疗肌萎缩性侧索硬化症、与丁酸盐组合有益地调节肠道微生物组等[4-5]。左旋肉碱(L-carnitine)也存在游离态和结合态的形式,具有促进代谢、保护神经细胞、清除自由基等作用[6-8],最新研究表明,左旋肉碱在治疗新生儿难治性线粒体心肌病、与其他药物协同抗骨质疏松并改善药物毒性等方面作用巨大[9-10]。成人所需的胆碱和左旋肉碱可以自身合成,而婴幼儿由于身体发育未全,合成有限,所以在婴配奶粉中普遍将胆碱和左旋肉碱作为可选择性营养强化剂进行添加,保障婴幼儿生长发育所需[11-12],故婴配奶粉中胆碱和左旋肉碱的准确测定具有重要意义。目前,国内胆碱的最新标准为GB 5413.20—2022,该标准中第一、二、三法分别为酶比色法、离子色谱法和LC-MS/MS;左旋肉碱的标准为GB 29989—2013,标准中方法为酶比色法;即国内并无色谱类标准方法检测左旋肉碱,也无标准方法可同时检测胆碱与左旋肉碱。故如若能建立同时检测该2种物质的方法,将显著提升检测效率并降低成本。
仪器法是大多数检测方法的发展趋势,特别是LC-MS/MS法,因其具有灵敏度高、抗干扰能力强和样品定性不依赖保留时间的特点,在诸多文献方法中研究广泛。王艳等[7]、刘玲君等[13]、刘艳明等[14]采用LC-MS/MS法测定了奶粉中的左旋肉碱,但未对胆碱进行监测;詹越城等[11]、唐吉旺等[15]的方法虽然能同时检测胆碱、左旋肉碱,但方法采用外标法定量,对于基质效应等可能引起的损失暂未提及;李丽萍等[12]、李秀英等[1]、黄金凤等[16]、黄焘等[17]的方法虽然都采用了同位素内标法,但李丽萍等[12]、李秀英等[1]的方法中内标的加入在水解之后,且前者还需要用到超滤管进行冷冻离心净化、后者需用微波消解仪消解,处理过程较为繁琐的同时也可能造成目标物质的损失;黄金凤等[16]的方法则称样量过小(0.2 g),其前处理采用亚铁氰化钾/乙酸锌进行净化沉淀,但詹越城等[11]在研究中表明亚铁氰化钾/乙酸锌进行沉淀会导致回收率损失;黄焘等[17]的方法则在净化上虽然考虑全面,但前处理无水解、消解等过程,这可能会导致结合态胆碱、左旋肉碱损失,最终使得测定结果偏低。因此,在现有研究基础上,充分考察前处理过程及色谱、质谱条件,以期建立一个完善的超高效液相色谱-串联质谱法(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)来同时测定婴配奶粉中胆碱和左旋肉碱。
1 材料与方法
1.1 材料与试剂
乙腈、甲酸铵、甲酸(MS级),德国CNW公司;盐酸(优级纯),国药试剂;氢氧化钠(优级纯),恒兴试剂。标准品:胆碱酒石酸氢盐(纯度99.1%),上海安谱;左旋肉碱(纯度98.2%),上海安谱;胆碱-D4(纯度98.6%),加拿大TRC公司;左旋肉碱-D3(纯度98.5%),加拿大CDN公司。质控样:婴幼配方乳粉胆碱左旋肉碱牛磺酸肌醇质控样(QC-IP-707),中国检验检疫科学研究院。
1.2 仪器与设备
Thermo Endura高效液相色谱-串联质谱仪(ESI源),美国Thermo Fisher公司;Milli-Q超纯水仪,美国Millipore公司;HWS-28电热恒温水浴锅,上海一恒公司;ME204E电子天平、FE28 pH计,梅特勒托利多公司;舒美牌KQ-500DE超声波恒温水浴振荡器,昆山市超声仪器有限公司;ACQUITY UPLC HSS C18 SB柱(1.8 μm,2.1 mm×100 mm)、ACQUITY UPLC BEH Amide(1.7 μm,2.1 mm×100 mm)、ACQUITY UPLC BEH HILIC(1.7 μm,2.1 mm×100 mm),美国Waters公司;0.22 μm尼龙滤膜,上海安谱公司;2.5 mL聚丙烯注射器,湖南平安医械科技有限公司;聚乙烯巴斯德塑料吸管(3 mL,160 mm),德国CNW公司。
1.3 分析条件
1.3.1 色谱条件
流动相:A:甲酸铵水溶液[10 mmol/L,甲酸调pH值至(5.0±0.1)];B:乙腈;流速:0.5 mL/min,进样量:10 μL;梯度洗脱程序见表1。
表1 梯度洗脱程序
Table 1 Gradient elution procedure

时间/min流动相A/%流动相B/%0.010901.010903.040604.040605.010908.01090
1.3.2 质谱条件
离子源:ESI+;鞘气:50 Arb;辅助气:5 Arb;吹扫气:0 Arb;碰撞气:氩气(1.5 mtor);喷雾电压:4 500 V;脱溶剂温度:350 ℃;离子传输管温度:300 ℃;扫描模式:多反应监测(multi reaction monitoring,MRM)。
1.3.3 标准工作溶液配制
a)胆碱、胆碱-D4、左旋肉碱及左旋肉碱-D3储备溶液:质量浓度均为1 000 μg/mL,均用10 mmol/L甲酸铵水溶液配制;b)胆碱、左旋肉碱标准混合中间液:胆碱、左旋肉碱标准混合中间液质量浓度分别为10 μg/mL;胆碱-D4、左旋肉碱-D3内标混合中间液质量浓度分别为20 μg/mL,均用10 mmol/L甲酸铵水溶液配制;c)胆碱、左旋肉碱工作溶液:用乙腈将中间液逐级稀释、混合,配成的工作液中胆碱左旋肉碱质量浓度为0.8、5.0、10.0、20.0、50.0、100.0、150.0、200.0 ng/mL,其中内标质量浓度均为50 ng/mL。临用现配。
1.3.4 前处理方法
准确称取1~5 g(精确至0.001 g)试样,用温水溶解后,转移至100 mL容量瓶中,冷却至室温后用水定容,混匀。吸取1 mL样液于100 mL烧杯中,备用。在上述烧杯中,加1 000 μg/mL的胆碱-D4、左旋肉碱-D3内标储备液各50 μL后,加入1 mol/L的盐酸溶液10 mL,小心摇晃均匀,用保鲜膜盖住烧杯超声振荡5 min。样液在(70±2) ℃水浴中加热2 h(每隔30 min摇匀一次)冷却至室温后用1 mol/L的氢氧化钠溶液调节pH值至5.0~5.3,转移至100 mL容量瓶,用水定容,混匀。然后用乙腈将定容后的样液稀释10倍,经0.22 μm有机相滤膜过滤至进样瓶中,待测。
2 结果与分析
2.1 质谱参数的优化
质谱参数优化采用蠕动泵注射质量浓度为1 μg/mL 左右的标准溶液分别对目标化合物进行参数优化。电喷雾正离子模式下,通过MRM模式优化各个碎片离子的去簇电压和碰撞电压。具体的化合物碎片二级质谱参数见表2。
2.2 流动相的选择
流动相参照GB 5413.20—2022标准中第三法进行配制,即水相为10 mmol/L甲酸铵水溶液[甲酸调pH值至(5.0±0.1)],有机相为乙腈。水相中加入一定量的甲酸可促进目标化合物的电离,起到提高离子化效率的作用;乙腈与水的体系对目标化合物的响应效果好于甲醇与水的体系,这在一些相关文献方法中有应用[11,15]。
表2 胆碱、左旋肉碱及其内标的质谱参数
Table 2 Mass spectrometry parameters of choline, L-carnitine, and their internal standards
化合物母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV胆碱104.2 60.3∗69 16.42 104.2 45.4 6920.06 胆碱-D4108.2 60.3∗75 17.03108.2 49.4 7519.71左旋肉碱162.2 103.1∗92 15.36162.260.3 9215.41左旋肉碱-D3165.2 103.1∗95 15.66165.263.3 9515.71
注:*为定量离子。
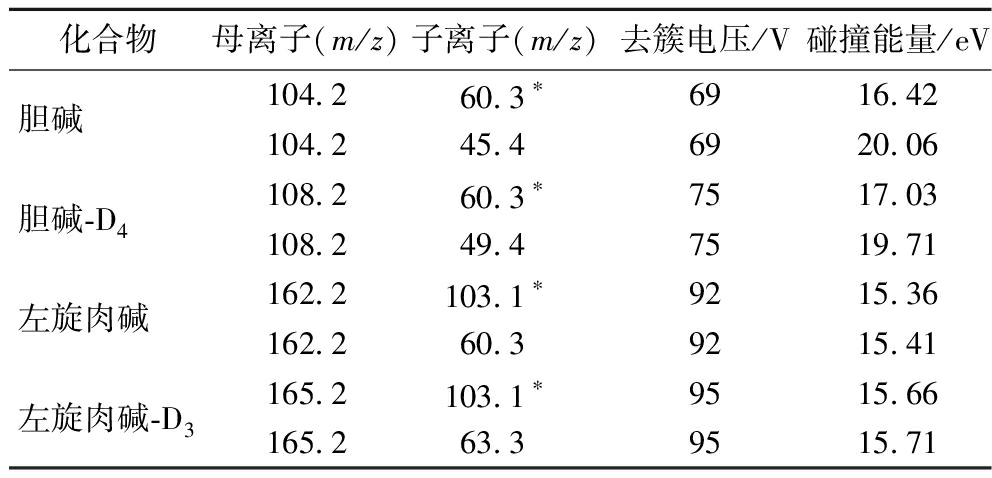
2.3 色谱柱的选择
胆碱、左旋肉碱化学结构中都含有强极性的碱性季铵基团,故选择亲水性强的色谱柱有助于二者的保留。HILIC色谱柱在刘玲君等[13]、刘艳明等[14]、詹越城等[11]的研究中有采用,Amide色谱柱在李丽萍等[12]、黄焘等[17]的研究中有采用,而亲水性的C18色谱柱在唐吉旺等[15]、潘拾朝等[18]、高进等[19]的研究中有采用,故本次研究选择了这3种应用相对较多的色谱柱进行对比。由图1可知,键合相为三键键合的酰胺柱对于胆碱和左旋肉碱的响应最高、峰形最好;无键合的BEH颗粒的HILIC色谱柱保留较酰胺柱稍强,但响应次之,且胆碱色谱峰存在拖尾,峰形也不对称,故该柱仅合适分离左旋肉碱;无封端的HSS C18色谱柱保留最强,对胆碱的分离峰形也较佳,只是响应稍差,但左旋肉碱出现了峰展极宽的情形,故该柱单独分离胆碱较合适。综合对比下,同时分离胆碱、左旋肉碱采用Amide柱最佳。
a-胆碱;b-胆碱-D4;c-左旋肉碱;d-左旋肉碱-D3
图1 不同色谱柱对胆碱、左旋肉碱的分离效果
Fig.1 Separation effect of different columns on choline and L-carnitine
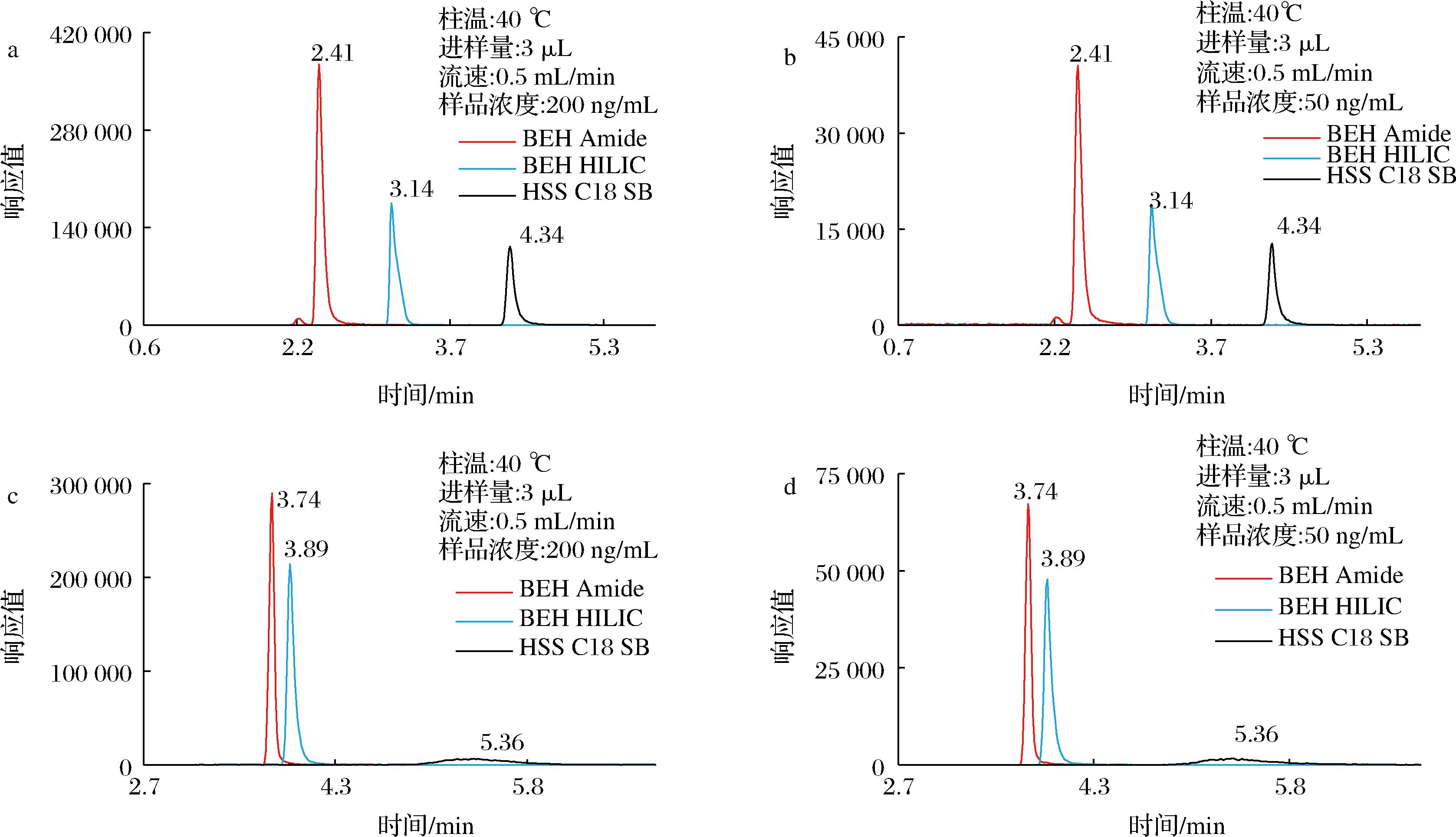
2.4 柱温的选择
柱温不仅影响各化合物的分配系数同时也影响传质速率。本次研究预设了30、35、40 ℃ 3个不同水平以考察柱温对色谱柱分离的影响。如图2所示,柱温升高,胆碱和左旋肉碱的保留均减弱,胆碱出峰提前更明显,响应和峰形上各化合物在不同柱温下均相差不大,但柱温的升高能显著降低系统背压,故选择40 ℃作为色谱柱柱温。
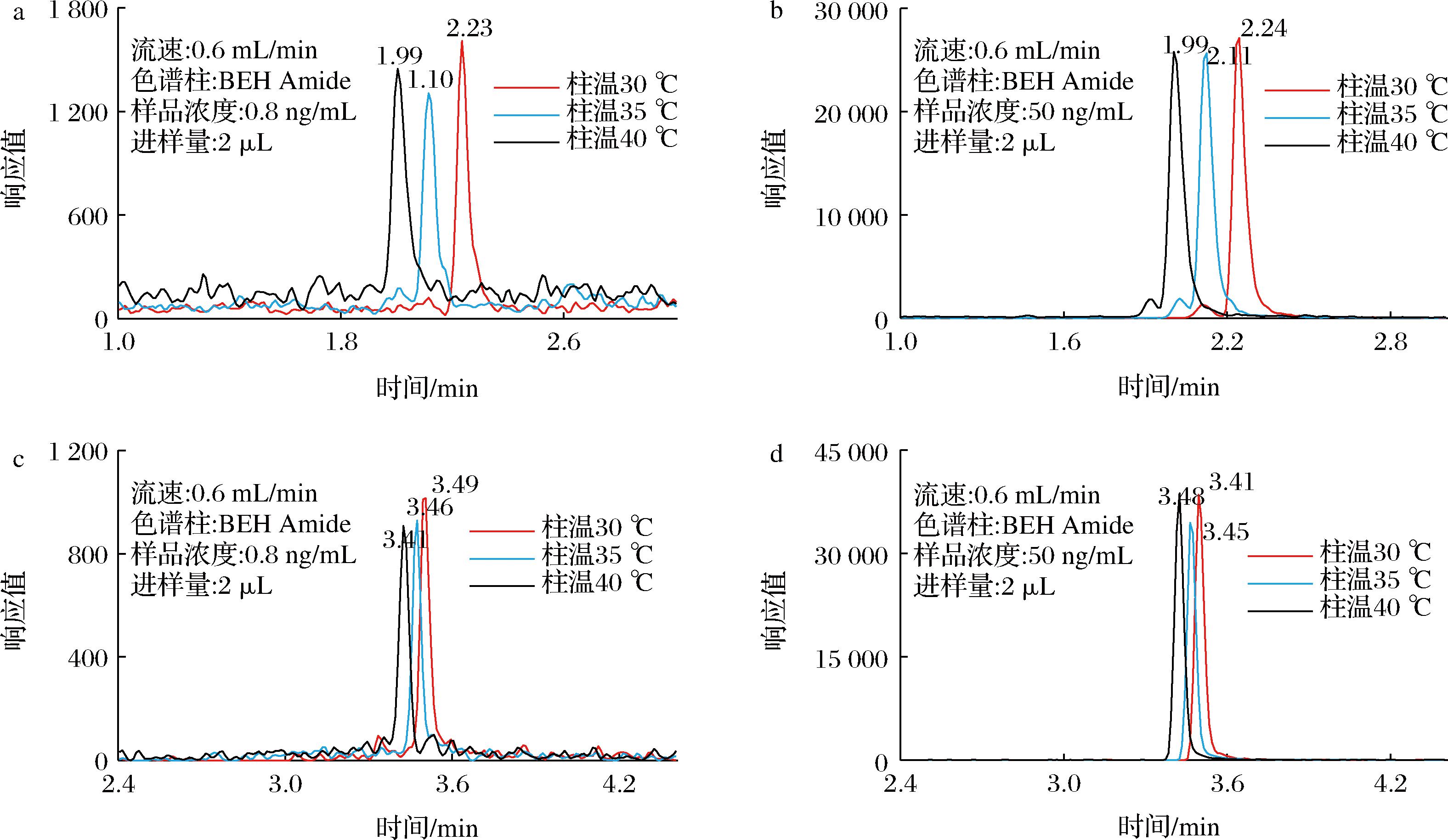
2.5 流速的选择
流速与化合物的保留、峰形、响应以及柱压大小密切相关。胆碱国标方法(GB 5413.20—2022)中液质法的梯度条件参考流速为0.3 mL/min,本次研究预设了0.4~0.7 mL/min 4个不同的流速与其对比。如图3所示,流速增加,胆碱和胆碱-D4色谱峰出峰提前、响应明显增强;左旋肉碱和左旋肉碱-D3色谱峰出峰同样提前,但响应上基本无区别。考虑到胆碱的响应应选择高流速,而考虑系统背压和溶剂节省等因素应选择低流速。因本研究中化合物响应均较好,故折中选择0.5 mL/min流速即可。
a-胆碱;b-胆碱-D4;c-左旋肉碱;d-左旋肉碱-D3
图2 柱温对色谱柱分离的影响
Fig.2 Effect of temperature on column separation
a-胆碱;b-胆碱-D4;c-左旋肉碱;d-左旋肉碱-D3
图3 流速对分离的影响
Fig.3 Effect of flow rate on separation
2.6 溶剂效应
2.6.1 溶剂效应的影响
在前述色谱柱、柱温、流速的选择研究中,有注意到胆碱色谱峰底部存在肩峰或紧临的干扰峰,而左旋肉碱容易过载,即在进样量稍微增加时左旋肉碱色谱峰易变形(无样品基质情况)。如图4-a和图4-b所示,对于胆碱,主要的溶剂效应是导致色谱峰出现肩峰或分叉峰。在进样量0.5 μL增加至1.75 μL过程中,胆碱色谱峰从肩峰变成明显的分叉峰且2个分叉峰分离度逐渐增加,主峰位置从左侧转换至右侧,在进样量从1.75 μL继续增加至7 μL过程中,胆碱左侧小的分叉峰逐渐减小直至消失,且与右侧主峰的分离度逐渐增加。对于左旋肉碱,由图4-c和图4-d可知主要的溶剂效应是色谱峰发生变形或导致肩峰,在进样量从0.5 μL增加至3.0 μL过程中左旋肉碱色谱峰峰形和响应均较好,而进样量增加到4.0 μL时色谱峰左侧开始变宽,在5.0、7.0 μL时已经出现明显肩峰,且底部峰展宽峰形极差。由此可见,溶剂效应与进样体积因素密切相关,同时会因存在样品基质而影响加重,对于胆碱,只有当进样量大于至7 μL时溶剂效应才会消除,而对于左旋肉碱只有当进样量小于4 μL时溶剂效应才不会对峰形造成影响,而这存在矛盾,故需要在最终样液稀释过程中选择合适比例的稀释溶剂消除溶剂效应,并确定合适的进样量。

a-胆碱(0.5~1.75 μL);b-胆碱(1.75~7.0 μL);c-左旋肉碱(0.5~1.75 μL);d-左旋肉碱(1.75~7.0 μL)
图4 不同进样体积下溶剂效应的影响
Fig.4 Influence of different injection volumes on solvent effects
2.6.2 溶剂效应的消除
由于溶剂效应受进样量影响,故本次研究设置1 μL和10 μL以分别考察不同进样体积下稀释溶剂对溶剂效应的消除作用,试验方法为用不同体积比的乙腈/甲酸铵水溶液(10 mmol/L)将水解定容后的样液统一稀释10倍。如图5-a和图5-b所示,对于胆碱,当进样量为1 μL时,胆碱存在右侧肩峰或分叉峰,随着乙腈体积分数从0%增加至30%,右侧分叉峰逐渐缩小变成肩峰,在乙腈体积分数继续增加直至100%时,肩峰逐渐变小直至消失;当进样量为10 μL时,随着乙腈体积比增加,胆碱峰型从矮胖的肩峰逐渐变为瘦高峰(在30%处峰形有一次变化),即在乙腈体积分数分别为0%、10%、50%时峰形为肩峰,且主峰从左侧转换至右侧,保留时间也出现先缩短后延长的明显变化,直至乙腈体积分数为70%后峰形趋于稳定。对左旋肉碱,由图5-c和图5-d可知,在进样为1 μL时,所试验的乙腈体积比的变化对峰形均未造成影响,而在进样量为10 μL时,乙腈体积比的增加使得峰形从明显的前伸峰变成瘦高峰,且峰高增加并在100%处达到最大。综上,故选择纯乙腈作为水解样液的稀释液,在稀释10倍这一情况下,稀释后的样液体系与初始流动相正好一致。
2.6.3 进样量的确定
消除溶剂效应影响后,对同一样液进样不同体积以考察进样量,如图6所示,除胆碱和胆碱内标在进样0.5~3 μL过程中保留时间变化外,大于3 μL进样体积后的保留时间均稳定,且胆碱和左旋肉碱及内标的峰高均随进样体积增加而增加,进样至30 μL时峰形仍对称良好,故考虑响应和色谱柱载量预留等因素折中选择10 μL为进样体积。
2.7 水解时间对结果测定的影响
水解时间的长短主要影响结合态的胆碱和左旋肉碱的测定。在同一样液中均加入1 mol/L的盐酸溶液10 mL,70 ℃下分别水解不同的时间[15],测定结果如图7所示,相对于水解时间为0 h,在水解0.5、1 h时测定结果明显随水解时间延长而增加,而在1 h之后测定结果没有明显增加,说明样品中存在结合态的胆碱和左旋肉碱,且在水解1 h时结合态部分的胆碱和左旋肉碱已基本水解完毕并全部游离出来。为保证样品充分水解,可适当延长水解时间,可选择2 h。

a-胆碱(进样1 μL);b-胆碱(进样10 μL);c-左旋肉碱(进样1 μL);d-左旋肉碱(进样10 μL)
图5 不同稀释溶剂对胆碱、左旋肉碱溶剂效应的影响
Fig.5 Effect of different diluted solvents on solvent effects of choline and L-carnitine

a-不同进样量下胆碱的响应和保留;b-不同进样量下胆碱-D4的响应和保留;c-不同进样量下左旋肉碱的响应和保留; d-不同进样量下左旋肉碱-D3的响应和保留
图6 进样量的确定
Fig.6 Determination of injection volume
2.8 pH调节对测定结果的影响
根据胆碱国标方法(GB 5413.20—2022)中的液质法,前处理水解后需要将pH值调节至5.0~5.3,因为水解后溶液pH值依旧小于2,而酰胺柱pH值耐受范围为2~11,故需要对样液进行pH调节。如图8所示,对同一水解后的样液用氢氧化钠溶液进行pH调节,结果发现pH值在2~9内对测定结果基本无影响,故pH值的调节大致调至5.0左右即可。
2.9 基质效应与过程回收率
采用提取后添加法对基质效应和过程回收率进行评估[20]。由于未寻得绝对空白的胆碱、左旋肉碱婴配奶粉样品,故采用添加胆碱、左旋肉碱同位素内标的方式进行考察。在空白试剂中进行水解前和水解后的内标加标,分别测定加标后的响应值,通过t检验可判断水解过程是否存在回收率的损失;在样品水解后的基质中加内标并与试剂空白水解后加内标对比,通过t检验可判断是否存在基质效应。由表3和表4可知,参与比较的所有数据均方差同质,过程回收率均差异不显著,但基质效应检验上发现胆碱差异极显著,在有基质存在的情况下胆碱的测定结果较空白中低,存在基质抑制,故对于胆碱的测定需采用同位素内标法来进行校正。
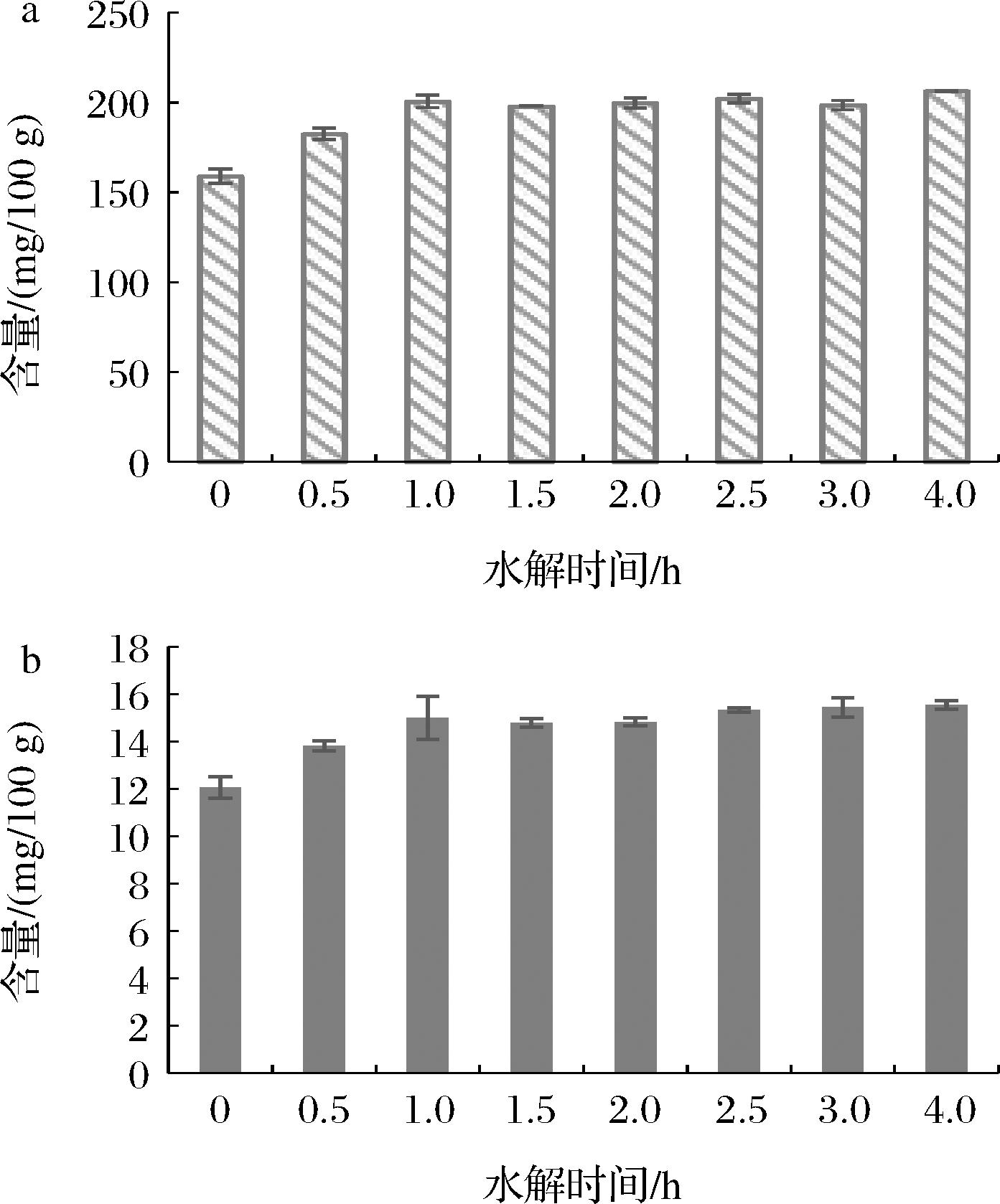
a-胆碱;b-左旋肉碱
图7 水解时间对结果测定的影响(n=2)
Fig.7 Effect of hydrolysis time on result determination (n=2)
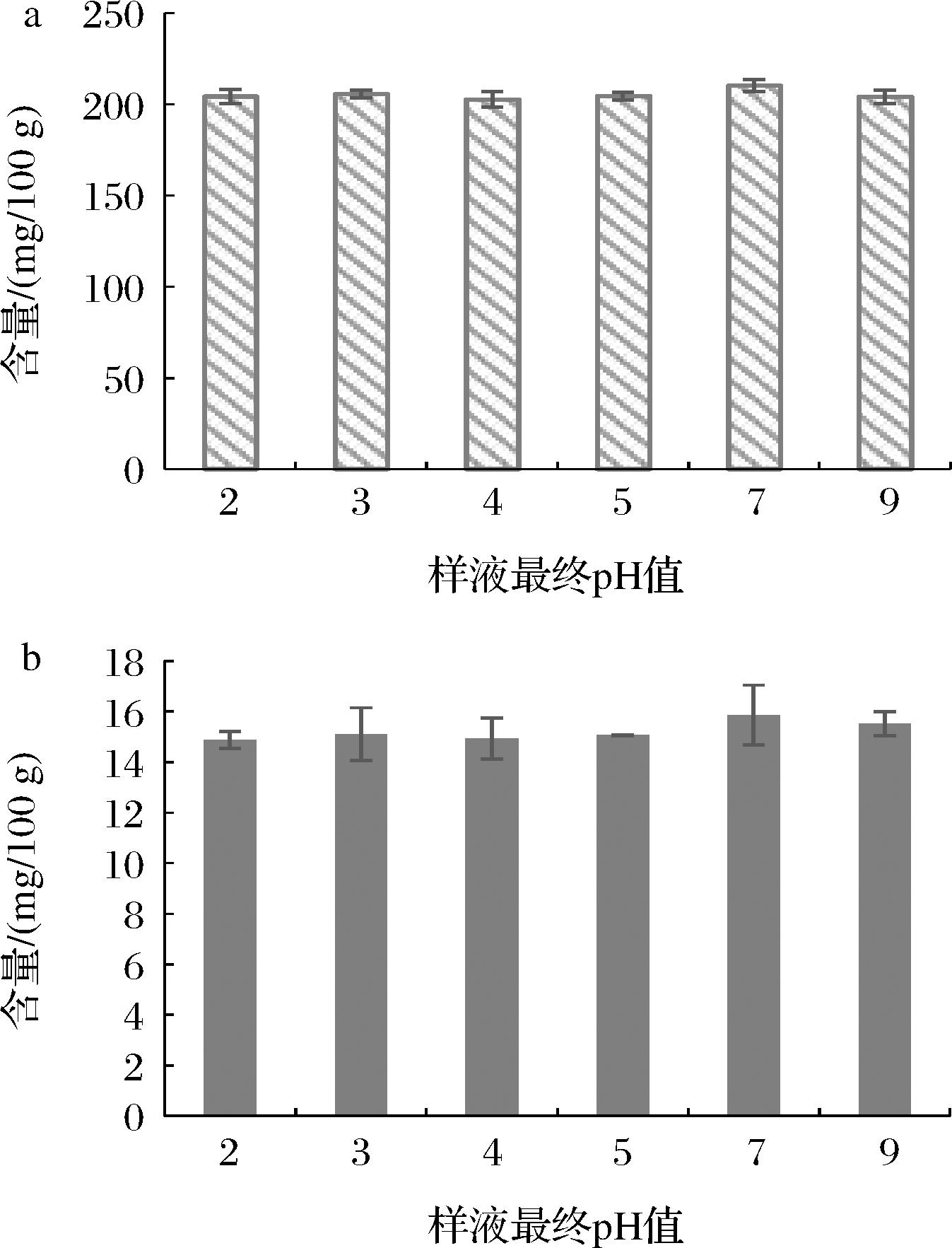
a-胆碱;b-左旋肉碱
图8 pH调节对测定结果的影响(n=2)
Fig.8 Effect of pH regulation on assay results (n=2)
2.10 质控样和回收率的测定
通过测定胆碱、左旋肉碱的质控样QC-IP-707和在含有本底的牛乳基质样品中进行低、中、高三水平的胆碱、左旋肉碱加标(n=3),以验证方法的正确性。由表5可知,胆碱、左旋肉碱的3平行测定结果均在质控样特性值范围内,且均接近特性值;由表6可知,胆碱平均回收率为96.9%,左旋肉碱平均回收率为98.0%,且胆碱、左旋肉碱各重复水平的回收率均为95%~105%,均符合GB/T 27417—2017《合格评定 化学分析方法确认和验证指南》的要求,说明方法正确性均良好。
表3 胆碱、左旋肉碱的加标测试结果
Table 3 Spike test results of choline and L-carnitine
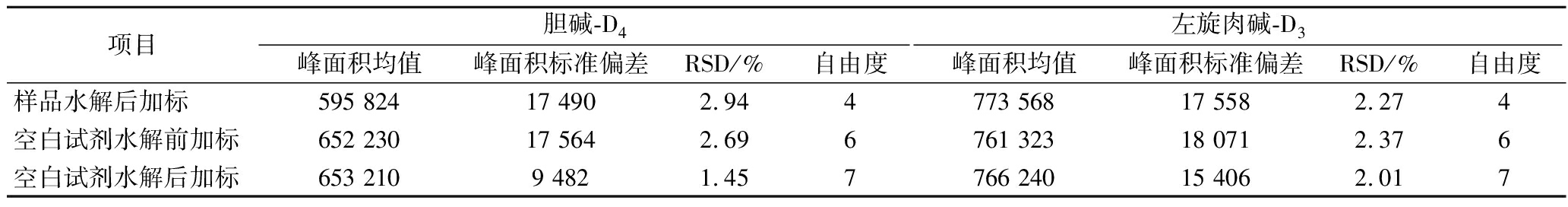
项目胆碱-D4左旋肉碱-D3峰面积均值峰面积标准偏差RSD/%自由度峰面积均值峰面积标准偏差RSD/%自由度样品水解后加标595 824 17 490 2.944773 568 17 558 2.274空白试剂水解前加标652 230 17 564 2.696761 323 18 071 2.376空白试剂水解后加标653 210 9 482 1.457766 240 15 406 2.017
注:RSD为相对标准偏差(relative standard deviation)。
表4 胆碱、左旋肉碱的基质效应与过程回收率的t检验
Table 4 T-test for matrix effects and process recovery of choline and L-carnitine

项目胆碱-D4左旋肉碱-D3F检验(F值)方差同质性t检验(概率P)差异显著性F检验(F值)方差同质性t检验(概率P)差异显著性基质效应F0.05(4,7)=3.40<5.52同质P=0.000 008 8<0.01极显著F0.05(4,7)=1.30<5.52同质P=0.44>0.05不显著过程回收率F0.05(6,7)=3.43<5.12同质P=0.89>0.05不显著F0.05(6,7)=1.38<5.12同质P=0.58>0.05不显著
注:P>0.05时差异不显著,0.01<P<0.05时差异显著,P<0.01时差异极显著。
表5 胆碱、左旋肉碱外部质控样测试结果
Table 5 Choline and L-carnitine external quality control sample test results

化合物测定含量/[mg/(100 g)]变异系数/%均值/[mg/(100 g)]均值与特性值相对偏差/%特性值/[mg/(100 g)]特性值区间/[mg/(100 g)]胆碱 183.0、185.5、180.81.28183.10.49184174~194左旋肉碱18.39、18.53、17.233.9518.055.0019.016.4~21.6
表6 胆碱、左旋肉碱样品加标结果
Table 6 Sample spike results of choline and L-carnitine
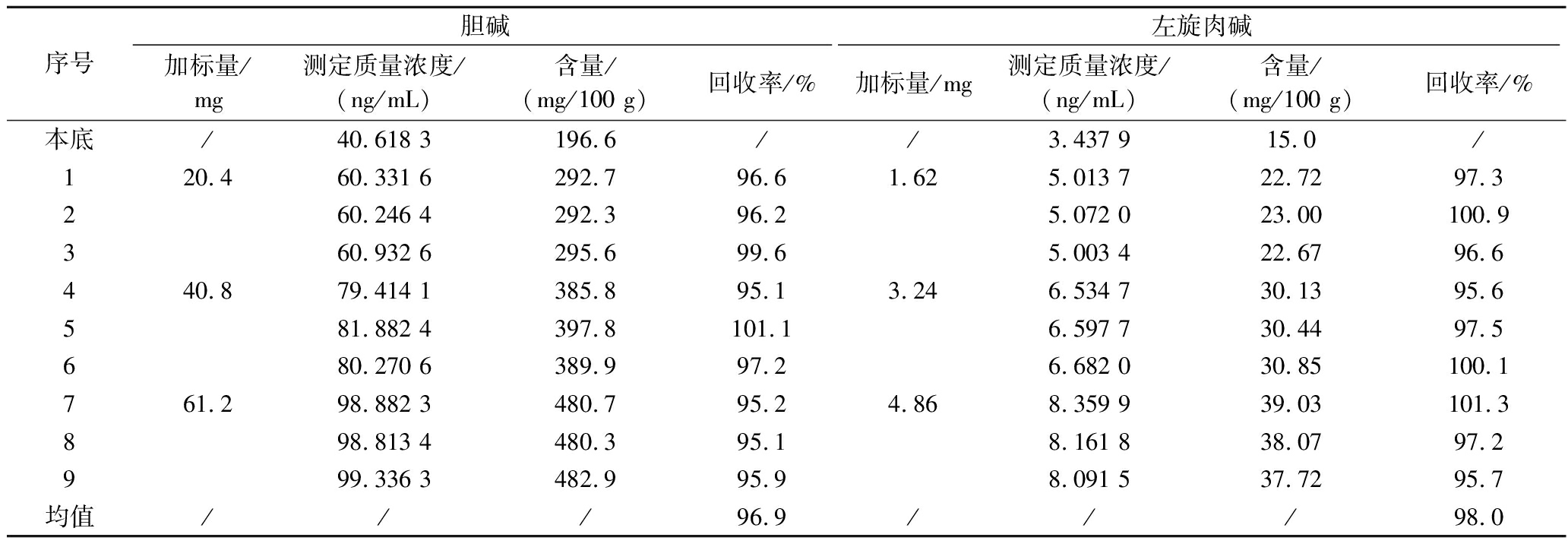
序号胆碱左旋肉碱加标量/mg测定质量浓度/(ng/mL)含量/(mg/100 g)回收率/%加标量/mg测定质量浓度/(ng/mL)含量/(mg/100 g)回收率/%本底/40.618 3196.6//3.437 915.0/120.460.331 6292.7 96.61.62 5.013 722.72 97.3260.246 4292.3 96.25.072 023.00 100.9360.932 6295.6 99.65.003 422.67 96.6440.879.414 1385.8 95.13.24 6.534 730.13 95.6581.882 4397.8 101.16.597 730.44 97.5680.270 6389.9 97.26.682 030.85 100.1761.298.882 3480.7 95.24.86 8.359 939.03 101.3898.813 4480.3 95.18.161 838.07 97.2999.336 3482.9 95.98.091 537.72 95.7均值///96.9///98.0
注:/表示无数据。
2.11 线性范围
以待测物的浓度为横坐标、待测物信号强度与其内标的比值为纵坐标,并以1/X为权重的加权最小二乘法对各坐标点进行线性回归拟合。结果表明,胆碱和左旋肉碱均在0.8~200 ng/mL呈良好的线性关系,线性方程分别为,胆碱:Y=0.045 58X-0.007 751,相关系数R=0.999 7;左旋肉碱:Y=0.019 95X-0.010 51,相关系数R=0.999 8。
2.12 检出限和定量限
采用信噪比法评估检出限和定量限。当称样量为2 g时,以3倍信噪比定为检出限、10倍信噪比定为定量限,通过对胆碱、左旋肉碱样品的不断稀释,在低含量水平(0.3 ng/mL)下上机分析得到信噪比数据,经计算得到胆碱、左旋肉碱定量限分别为3、0.3 mg/kg,检出限分别为1、0.1 mg/kg。
2.13 精密度
仪器精密度:通过对一质量浓度为0.8 ng/mL的标准溶液进行连续测定(n=8),结果表明,胆碱的均值为(0.921 6±0.016 27) ng/mL,RSD为1.77%,左旋肉碱的均值为(0.955 1±0.041 68) ng/mL,RSD为4.36%。方法精密度:通过对一婴配奶粉样品进行平行测定(n=9),测定结果中胆碱均值为(209.7±5.0) mg/100 g,RSD为2.37%,左旋肉碱均值为(16.2±0.4) mg/100 g,RSD为2.71%。根据GB/T 27417—2017《合格评定 化学分析方法确认和验证指南》的要求,胆碱方法精密度≤2.7%、左旋肉碱方法精密度≤3.8%,仪器精密度需均≤5.3%,由以上数据可知均满足标准要求。
3 结论
通过对色谱柱进行比较研究,发现Amide柱同时分析胆碱和左旋肉碱的效果较HILIC色谱柱和亲水性的C18色谱柱好,故选择键合相为酰胺基的色谱柱为分析柱,同时优化确定了最佳柱温、流速参数;在溶剂效应考察中发现在样液的溶剂比例与初始流动相不一致时会导致严重的溶剂效应,通过试验不同稀释溶剂对溶剂效应的消除作用,发现在稀释10倍的情形下用纯乙腈作为水解样液的稀释溶剂效果最好;溶剂效应消除后,确定10 μL体积为进样量。在前处理条件优化过程中,对水解时长的考察发现,水解1 h后结合态的胆碱和左旋肉碱已基本游离释放,对pH调节的考察发现,pH值在2~9内对测定结果基本无影响,回收率试验发现过程无回收率损失,基质效应考察发现胆碱存在基质抑制,故采用同位素内标法来进行基质效应的校正。本次研究建立了以同位素为标记、酸水解法为前处理、酰胺柱为分析柱的UPLC-MS/MS法,方法限值低、前处理简单、准确性高,方法验证各项参数均满足国标要求,适用于婴配奶粉中胆碱和左旋肉碱的同时测定。
[1] 李秀英, 黄嘉乐, 邱志超, 等.微波水解/超高效液相色谱-串联质谱法快速测定乳粉中的胆碱和左旋肉碱[J].食品安全质量检测学报, 2016, 7(5):1876-1881. LI X Y, HUANG J L, QIU Z C, et al.Rapid determination of choline and L-carnitine in milk powder by ultra-high performance liquid chromatography tandem mass spectrometry using microwave digestion for sample preparation[J].Journal of Food Safety and Quality, 2016, 7(5):1876-1881.
[2] 刘金梅, 谢普, 周钧, 等.婴幼儿配方食品中胆碱的检测方法研究进展[J].食品安全质量检测学报, 2020, 11(17):5856-5863. LIU J M, XIE P, ZHOU J, et al.Research progress on the detection methods for choline in infant formula[J].Journal of Food Safety and Quality, 2020, 11(17):5856-5863.
[3] 汪辉, 刘江, 李晰晖, 等.固相萃取-超高效液相色谱-串联质谱法测定乳粉和果冻中的氯化胆碱[J].色谱, 2017, 35(5):558-562. WANG H, LIU J, LI X H, et al.Determination of choline chloride in milk powder and jelly by solid phase extraction-ultra high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography, 2017, 35(5):558-562.
[4] LATIF S, KANG Y S.Protective effects of choline against inflammatory cytokines and characterization of transport in motor neuron-like cell lines (NSC-34)[J].Pharmaceutics, 2022, 14(11):2374.
[5] LIU C, LI Z, SONG Z K, et al.Choline and butyrate beneficially modulate the gut microbiome without affecting atherosclerosis in APOE* 3-Leiden.CETP mice[J].Atherosclerosis, 2022, 362:47-55.
[6] 杨月英, 黄娇芳, 顾金杰, 等.L-肉碱的生理功能、生物学制备及检测方法研究进展[J].食品科学, 2015, 36(5):205-211. YANG Y Y, HUANG J F, GU J J, et al.Advances in physiological functions, biotransformation and detection of L-carnitine[J].Food Science, 2015, 36(5):205-211.
[7] 王艳, 刘芸, 姜珊, 等.高效液相色谱-高分辨质谱法测定奶粉及保健品食品中的左旋肉碱[J].食品安全质量检测学报, 2020, 11(17):5920-5926. WANG Y, LIU Y, JIANG S, et al.Determination of L-carnitine in milk powder and healthy food by high performance liquid chromatography coupled with high resolution mass spectrometry[J].Journal of Food Safety and Quality, 2020, 11(17):5920-5926.
[8] 王新, 王秋举, 刘洪健, 等.食物中L-肉碱含量及其测定方法的研究进展[J].食品工业科技, 2021, 42(9):358-364. WANG X, WANG Q J, LIU H J, et al.Research progress of L-carnitine content in food and its determination method[J].Science and Technology of Food Industry, 2021, 42(9):358-364.
[9] TOYAMA Y, FUJII Y, HORI S I, et al.L-carnitine rescue for neonatal intractable mitochondrial cardiomyopathy[J].Pediatrics International, 2022, 64(1):e15143. [10] AHMED S A, ABD EL REHEEM M H, ELBAHY D A. L-Carnitine ameliorates the osteoporotic changes and protects against simvastatin induced myotoxicity and hepatotoxicity in glucocorticoid-induced osteoporosis in rats[J]. Biomedicine &Pharmacotherapy, 2022, 152: 113221.
[11] 詹越城, 何斌, 刘梦婷, 等.高效液相色谱-串联质谱法同时测定婴幼儿配方食品中胆碱L-肉碱含量方法研究[J].农产品加工, 2019(12):68-70;73. ZHAN Y C, HE B, LIU M T, et al.Simultaneous determination of choline and L-carnitine in infant formula food by high performance liquid chromatography-tandem mass spectrometry[J].Farm Products Processing, 2019(12):68-70;73.
[12] 李丽萍, 赵榕, 范赛, 等.超滤管净化/超高效液相色谱-串联质谱法测定婴幼儿配方奶粉中胆碱、肉碱和牛磺酸[J].卫生研究, 2019, 48(6):988-992. LI L P, ZHAO R, FAN S, et al.Determination of L-carnitine,choline,taurine in infant formula milk powder by ultrafiltration tube cleaning and ultra-performance liquid chromatography-tandem mass spectrometry[J].Journal of Hygiene Research, 2019, 48(6):988-992.
[13] 刘玲君, 何香婷, 翟红梅, 等.UPLC-MS/MS法快速测定婴幼儿配方奶粉中的L-肉碱[J].食品工业, 2021, 42(4):460-463. LIU L J, HE X T, ZHAI H M, et al.Determination of L-carnitine in infant formula milk powder by UPLC-MS/MS[J].The Food Industry, 2021, 42(4):460-463.
[14] 刘艳明, 薛霞, 刘国强, 等.亲水作用色谱-串联质谱法测定乳及乳制品中左旋肉碱[J].色谱, 2015,33(9):943-945. LIU Y M, XUE X, LIU G Q.et al.Determination of L-carnitine in milk and dairy products by hydrophilic liquid chromatography tandem mass spectrometry[J].Chinese Journal of Chromatography, 2015,33(9):943-945.
[15] 唐吉旺, 袁列江, 肖泳, 等.高效液相亲水作用色谱-串联质谱法同时测定婴幼儿配方乳粉中胆碱和左旋肉碱的含量[J].理化检验-化学分册, 2019, 55(6):621-626. TANG J W, YUAN L J, XIAO Y, et al.Simultaneous determination of choline and L-carnitine in infant formula milk powder by hydrophilic interaction high performance liquid chromatography-tandem mass spectrometry[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2019, 55(6):621-626.
[16] 黄金凤, 寻知庆, 汪晨霞, 等.HPLC-MS/MS法测定婴幼儿配方乳粉中胆碱、左旋肉碱、牛磺酸与肌醇[J].分析测试学报, 2018, 37(6):702-707. HUANG J F, XUN Z Q, WANG C X, et al.Simultaneous determination of choline, L-carnitine, taurine and inositol in infant formula milk powder by HPLC-MS/MS[J].Journal of Instrumental Analysis, 2018, 37(6):702-707.
[17] 黄焘, 陶保华, 陈启, 等.超高效液相色谱-串联质谱法同时测定人乳中的胆碱、L-肉碱、乙酰基-L-肉碱和牛磺酸[J].食品安全质量检测学报, 2014, 5(7):2059-2065. HUANG T, TAO B H, CHEN Q, et al.Determination of choline, L-carnitine, acetyl-L-carnitine and taurine in human milk using UPLC-MS/MS[J].Journal of Food Safety and Quality, 2014, 5(7):2059-2065.
[18] 潘拾朝, 黎小兰, 陈宏壁.超高效液相色谱-串联质谱法测定特殊医学用途配方食品中胆碱含量[J].食品安全质量检测学报, 2019, 10(21):7412-7417. PAN S C, LI X L, CHEN H B.Determination of choline in food for special medical purpose by ultra-high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety and Quality, 2019, 10(21):7412-7417.
[19] 高进, 赵静, 唐澈, 等.高效液相色谱-高分辨质谱-同位素内标法测定乳粉中的胆碱[J].食品安全质量检测学报, 2018, 9(20):5370-5375. GAO J, ZHAO J, TANG C, et al.Determination of choline in milk powder by high performance liquid chromatography-high resolution mass spectrometry-isotope internal standard method[J].Journal of Food Safety and Quality, 2018, 9(20):5370-5375.
[20] 陈鹏. 气质联用和液质联用中基质效应研究进展[J].天津药学, 2020, 32(4):67-72. CHEN P.Study on matrix effect in GC-MS and LC-MS[J].Tianjin Pharmacy, 2020, 32(4):67-72.