羊肚菌(Morchella esculenta)隶属于子囊菌门盘菌目羊肚菌属。羊肚菌主要分布于低海拔平原地区至海拔3 200 m的高海拔地区,多生长在阔叶林或针阔混交林的腐殖质层上。羊肚菌属一共有28个种,主要分布于中国、法国、德国、印度等地[1]。2020年,我国的羊肚菌产量为13.71万t,其中贵州(7.97万t)、四川(2.25万t)、云南(1.01万t)、河南(0.70万t)、河北(0.38万t)产量位居全国前五。
羊肚菌以其独特的风味和食用及药用价值而闻名[1],羊肚菌能产生许多初级和次生代谢产物,如多糖、蛋白质、多酚类化合物,以及甾醇、黄酮类、生物碱和脂肪酸等小分子物质[1],具有抗菌、抗氧化[2]、免疫调节[3]和抗癌[4]、抗炎症、抗肿瘤[5]、降血糖、预防动脉粥样硬化[1]、抗病毒[6]的功能。但是,羊肚菌质地脆嫩,含水量高,容易褐变,这是影响其采收后货架期及品质的关键因素[7-8]。目前羊肚菌相关的采后保鲜方法研究表明,减压预冷、自发气调等保鲜技术可保持其质地和营养成分,延长贮藏期;臭氧熏蒸、包装材料、辐照等物理方法能有效减缓贮藏保鲜期间的质量损失,降低其呼吸强度,但是对营养成分的研究暂且未知;微酸性电解水、涂膜保鲜等化学方法能一定程度上延缓羊肚菌子实体水分流失、软化,抑制其呼吸速率,从而达到贮藏保鲜的效果,但其安全性和可接受度仍需要进一步的研究和讨论(图1、表1)。
近年来,关于羊肚菌保鲜的综述并未对羊肚菌保鲜方法的机制进行表述[9-10]。因此,本文通过介绍羊肚菌品质劣变的主要表现,总结其相关的保鲜技术及其作用机理,为开发低成本、绿色安全的保鲜技术提供参考并补充对羊肚菌保鲜机制的探讨。

图1 羊肚菌采后品质劣变与其影响因素的相互关系
Fig.1 Factors affecting postharvest quality deterioration of Morchella esculenta
1 羊肚菌品质退化
1.1 水分流失
研究表明,15 ℃时,羊肚菌贮藏2 d下的失重率为2.4%,4 ℃时,羊肚菌贮藏8 d下的失重率为2.0%[11-12]。羊肚菌失重是其水分流失所导致的,而水分流失的主要原因是由于细胞表面的蒸腾作用,这会造成羊肚菌不同程度的萎蔫,从而失去商品价值。同时,水分流失也是羊肚菌产生褐变的一大原因,从而导致贮藏后的羊肚菌品质不佳,影响其商品价值。因此,减轻羊肚菌表面的蒸腾作用,减缓其贮藏保鲜期间的呼吸速率,延缓其水分流失,以最大程度上延长其保鲜期与货架期[13]。
1.2 采后形态变化
羊肚菌含水量高,组织非常细嫩,菌盖表面没有坚实的保护外层,通常而言,在常温下采后1~2 d内菌体内部的水分就会大量蒸发损失,羊肚菌的菌褶处逐渐出现破膜、开伞、萎缩、褐变甚至腐烂现象,菌柄伸长,货架期明显缩短,导致其商品价值下降甚至丧失[13-14]。
1.3 质构特性改变
在采后贮藏过程中,食用菌的过度软化可能导致缩水、生理生化指标及酶学指标发生显著变化,明显降低新鲜羊肚菌的品质,进而影响其食用价值[15]。羊肚菌的软化主要与子实体细胞壁的降解密切相关,主要涉及细胞壁多糖成分(如葡聚糖、几丁质、纤维素、半纤维素、果胶等)的明显降解[16]。其中涉及到诸多多糖水解酶,如几丁质酶(10个几丁质酶、2个内切壳聚糖酶、1个几丁质脱乙酰酶和1个β-N-乙酰葡萄糖胺糖苷酶)、葡聚糖酶(6个β-1,3-葡聚糖酶和1个β-1,6-葡聚糖酶)、果胶酶(3个多聚半乳糖醛酸酶、2个果胶甲酯酶、12个果胶裂解酶、6个鼠李半乳糖醛酸聚糖酶、2个不饱和鼠李半乳糖醛酸聚糖水解酶和1个鼠李半乳糖醛酸聚糖乙酰酯酶)、纤维素酶(33个纤维素酶和5个纤维二糖水解酶)活性的改变[17]。
1.4 营养和风味的损失
据报道,羊肚菌的营养成分约为7.8%~10.5%的蛋白质、2.7%~2.8%的脂肪、6.7%~14.6%的灰分、10.0%的干物质和75.0%~80.5%的碳水化合物[18]。同时,还含有一些多元醇、游离氨基酸、可溶性糖、有机酸等非挥发性水溶性成分。就多元醇而言,甘露醇具有令人愉悦的甜味,羊肚菌的天然甜味就来自于多元醇和可溶性糖[19]。羊肚菌子实体中含有麦角甾醇衍生物、微囊素、多糖等药理活性成分,这使得其成为一种有价值和有益的功能食品。D-松醇(D-Pinitol)是其中的一种功能因子,由于其生理作用包括抗肿瘤、抗炎、降血糖和免疫调节,它也存在于重要分枝杆菌中[20]。同时,还含有葡萄糖、果糖和半乳糖等可溶性糖,以提高羊肚菌的营养价值。像丙氨酸这样的游离甜味氨基酸是可食用羊肚菌中重要的味觉激活剂[1,19],而感官特性则表现为各种有机酸的存在,如苹果酸、草酸、琥珀酸和富马酸等[1]。
2 影响羊肚菌贮藏品质的因素
2.1 水分活度
新鲜羊肚菌水分含量高,无角质层保护,且子实体组织较为脆嫩,极易受到微生物侵染而发生品质下降现象,而其所含的酶类、酚类化合物和活性氧是导致其发生褐变衰老的关键,也是造成羊肚菌品质劣变的原因[9]。羊肚菌在常温下采后放置1~2 d,菌体就会散失大量水分,发生褐变甚至子实体腐烂,导致其商品价值下降甚至丧失[15]。在羊肚菌栽培中起重要作用的关键环境因素是土壤水分和空气中的湿度。必须在堵塞期间及时排水、微喷灌,以及在干旱导致水分不足时进行补水,因为土壤湿度的最佳范围是低于50%才能正常生长[9]。羊肚菌贮藏期间的质量损失(包括干物质和水分的损失)与采后羊肚菌的呼吸作用、蒸腾作用、微生物生长情况有关,其中,蒸腾作用引起的水分损失是最主要的原因[15]。
2.2 呼吸速率
采后处理会导致食用菌的应激反应,促进新陈代谢,引起呼吸速率增加和质量减轻。因高含水量(约90%)和呼吸速率(参照CASTELL 等[21]的方法计算,以单位时间内CO2含量的增加为计算依据)、以及缺乏避免水分流失和抵挡微生物侵染的表皮保护组织[22]。因此,可通过被动自发气调、涂膜处理、O2/CO2气调等方式降低呼吸速率,从而达到维持较好的羊肚菌感官品质,延长食品贮藏期的目的。
等[21]的方法计算,以单位时间内CO2含量的增加为计算依据)、以及缺乏避免水分流失和抵挡微生物侵染的表皮保护组织[22]。因此,可通过被动自发气调、涂膜处理、O2/CO2气调等方式降低呼吸速率,从而达到维持较好的羊肚菌感官品质,延长食品贮藏期的目的。
2.3 微生物侵染情况
新鲜羊肚菌水分含量高,无角质层保护,菌盖比较脆嫩,受机械损伤后易被微生物侵染而发生品质下降现象,也是造成羊肚菌品质劣变的原因[9]。羊肚菌生产过程中易被镰刀菌(Fusarium)、链孢霉(Neurosporacrasa)侵染。镰刀菌主要在出菇阶段侵染羊肚菌,此时丰收在握,一旦爆发,羊肚菌的商品性状和经济价值大打折扣,且有大面积爆发蔓延特征,危害相当严重。链孢霉对菌种生产和栽培环节危害极大,也是普遍发生的主要杂菌之一,一旦侵入,立即生长,且其生长速度极快。
2.4 温度和相对湿度
温度和相对湿度对微生物的生长起着重要的作用,同时也是影响菌菇褐变的主要因素[1]。新鲜羊肚菌保质期比较短,一般在常温下能保存2~3 d左右,在3~5 ℃的冷库中能保鲜12~15 d,在-18 ℃的环境下,至少可以保存10~12个月,为了控制羊肚菌的生理、生化等因素的变化,能使羊肚菌生命活动处于食用安全的休眠状态,冷库的相对湿度须控制在85%~90%。干燥羊肚菌保质期相对来说较长,只要保存过程中没有受潮,那么一般可以保存6~12个月左右。羊肚菌在烘干过程中因温度适宜和羊肚菌鲜品水分充足,给细菌提供了理想的繁殖发酵条件,温度控制不当或烘干时间长会影响干品的色、味、营养等质量问题。在干燥过程中温度、湿度是重要的工艺参数,探究羊肚菌失水规律,优化干燥过程中品质、干燥时间和能耗的参数,以获取最大的经济效益[23]。一般羊肚菌采用的贮藏温度为3~5 ℃,相对湿度为80%~95%。
2.5 采摘机械损伤
如今,为消费者提供高质量、安全和有保障的食用菌已成为食品供应链的一个重要问题。延长收获后供应链的长度和复杂性会使新鲜食用菌容易受到机械破坏。羊肚菌代谢旺盛,菌盖脆嫩,含水量高,在采摘和运输期间易受到挤压碰撞等机械损伤,出现褐变、变质现象,使其价值遭受严重损失[24]。采摘处理过程本身会导致羊肚菌的应激反应,加速羊肚菌采后的呼吸作用,进而导致品质的衰败[24]。因此,在采摘过程中应尽量避免机械损伤,防止细胞结构被破坏。
表1 物理和化学方法在羊肚菌贮藏保鲜中的应用
Table 1 Application of physical and chemical methods in the storage and preservation of Morchella esculenta

处理方式羊肚菌产地处理条件贮存时间及保鲜效果时间保鲜效果参考文献普通预冷、减压预冷、臭氧处理、(原态和整理态处理)云南昆明温度:(2±0.5) ℃实验组别:①去泥脚,减压预冷,(800±50) Pa,1 ℃,2.5 h;②不去泥脚,减压预冷,(800±50) Pa,1 ℃,2.5 h;③不去泥脚,3 g/h臭氧处理15 min后密封;④去泥脚,3 g/h 臭氧处理15 min后密封;⑤不去泥脚,1 ℃预冷8 h21 d最优处理方式:去泥脚,减压预冷,(800±50) Pa,1 ℃,2.5 h最优处理贮藏效果:(1)呼吸速率:在贮藏第1天较低,呈先上升后下降,后期再上升的趋势(2)可溶性固形物:含量呈先上升后下降的趋势;相对电导率:22.31%[25]微酸性电解水(slightly acidic electrolyzed wa-ter, SAEW)和紫外光(ultraviolet light, UV)处理,反渗透水处理陕西宝鸡温度:(20±2) ℃相对湿度:(70±5)%实验组别:①SAW-1组:4 L微酸性电解水浸泡1 min结合UV处理;②SAW-3组:4 L微酸性电解水浸泡3 min结合UV处理;③SAW-5组:4 L微酸性电解水浸泡5 min结合UV处理;④对照组:无任何处理;⑤ROW组:反渗透水中浸泡5 min9 d最优处理方式:4 L微酸性电解水浸泡3 min结合UV处理最优处理贮藏效果:(1)多酚氧化酶(polyphenol oxidase,PPO)活性:45.96 U/g(2)过氧化物酶(peroxidase, POD)活性:1.86 U/mg(3)细菌菌落数量:3.70 lg CFU/g(4)真菌菌落数量:1.67 lg CFU/g(5)呼吸速率:127.00 nmol/(kg·s)(6)失重率:8.62;硬度:6.28 N(7)颜色:菌盖:L∗ 74.70、a∗ 9.20、b∗ -1.78、ΔE 75.34;菌柄:L∗ 69.98、a∗ 12.46、b∗ 5.04、ΔE 70.55[26]主动自发气调山东淄博温度:(15±0.5) ℃实验组别:250 g羊肚菌、6 g干燥剂、8 g乙烯脱除剂①100% O2;②90% O2+10% CO2;③80% O2+20% CO2;④70% O2+30% CO2⑤空气(CK)3 d最优处理方式:90% O2+10% CO2处理最优处理贮藏效果:(1)菌盖色度L∗值:从20.63增长到21.75(2)呼吸速率:处于较低水平,抑制呼吸;(3)可溶性蛋白质和游离氨基酸含量:蛋白质上升了64.54%、游离氨基酸平均含量为276.49 mg/100 g显著高于CK(239.08 mg/100 g)(4)抑制PPO活性:贮藏期内PPO活性增加了9.85%,显著低于CK(42.83%)[11]山东淄博温度:(4.0±0.5) ℃实验组别:羊肚菌2.7 kg、干燥剂90 g、乙烯脱除剂30 g①100% O2;②90% O2+10% CO2;③80% O2+20% CO2;④70% O2+30% CO2⑤空气(CK)8 d最优处理方式:90% O2+10% CO2处理最优处理贮藏效果:(1)呼吸速率:O2含量28.1%、平均呼吸速率22.33 mg/(kg·h)(2)蛋白质含量:比CK组的高出17.7%(3)色度L∗:上升了26.9%(4)PPO活性:21.22 U/g(5)丙二醛(malondialdehyde, MDA)含量:较CK组降低了19.1%[12]不同浓度臭氧天津蓟州温度:1 ℃实验组别:①3 μg/mL臭氧熏蒸30 min,300 g/框(乙烯膜)扎口后贮藏,重复处理3次②5 μg/mL臭氧熏蒸30 min,300 g/框[乙烯膜]扎口后贮藏,重复处理3次③10 μg/mL臭氧熏蒸30 min,300 g/框[乙烯膜]扎口后贮藏,重复处理3次35 d最优处理方式:5 μg/mL臭氧(1)失质量率:1.30%(2)多酚含量:1.46 mg/g(3)PPO活性:1.05 U/(min·g)(4)POD活性:0.059 U/(min·g)[27]
续表1

处理方式羊肚菌产地处理条件贮存时间及保鲜效果时间保鲜效果参考文献分段式变温热风干燥成都简阳温度:18~23 ℃湿度:60%~70%热风风速:0.8 m/s实验组别:①35 ℃干燥2 h,40 ℃、45 ℃分别干燥1.5 h,50 ℃、55 ℃分别干燥8 h,60 ℃烘干至安全含水率12%②35 ℃、40 ℃、45 ℃分别干燥1 h,50 ℃、55 ℃分别干燥8 h,烘干条件同上③35 ℃、40 ℃、45 ℃分别干燥1 h,50 ℃、55 ℃分别干燥1 h后间歇1 h干燥2 h,烘干条件同上④35 ℃、40 ℃、45 ℃分别干燥1 h,50 ℃、55 ℃分别间歇1 h后干燥1 h再间歇1 h再干燥1 h,烘干条件同上最优处理方式:35 ℃、40 ℃、45 ℃分别干燥1 h,50 ℃、55 ℃分别间歇1 h后干燥1 h再间歇1 h再干燥1 h,60 ℃烘干至安全含水率12%(1)复水性:复水比为3.70(2)蛋白质含量:39.44 g/100 g(3)总糖含量:26.59 g/100 g(4)脂肪含量:3.70 g/100 g(5)能耗:64.1 MJ(6)干燥时间:9 h(7)净干燥时间:6 h[28]60Co-γ辐照处理四川金堂温度:(4±1) ℃实验组别:采用Ag2Cr2O7剂量计进行剂量追踪,①辐照剂量1.64 kGy, 2.18 kGy, 2.43 kGy, 2.93 kGy;未辐照处理(CK)9 d最优处理措施:实际辐照吸收剂量1.64 kGy最优处理贮藏效果:(1)失重率:比对照组低 24.9%(2)过氧化氢酶(catalase, CAT)酶活性:比对照组高 61.5%[29-30]电子束辐照河北平泉温度:4 ℃实验组别:①自封袋包装鲜菇;②鲜菇浆;③干菇;④未包装鲜菇;⑤自封袋包装不经辐照处理鲜菇(CK)辐照剂量:0、1、2、4、6、8、10 kGy14 d最优处理措施:自封袋包装鲜菇,辐照剂量≤2 kGy最优处理贮藏效果:(1)粗蛋白含量:31.48%;粗多糖含量:5.56%;粗纤维含量:16.60%(2)9种必需氨基酸含量的变化范围:5%~7%[31]3种包装(微孔膜、PE膜和透湿袋)天津蓟州温度:1 ℃实验组别:①0.02 mm微孔膜衬入塑料筐内,O2渗透系数248 000 mL/(m2·d),CO2渗透系数256 000 mL/(m2·d),透湿性13.4 g/(m2·d);②0.02 mm PE膜衬入塑料筐内,O2渗透系数7 150 mL/(m2·d),CO2渗透系数23 500 mL/(m2·d),透湿性5.51 g/(m2·d);③0.02 mm透湿袋衬入塑料筐内,O2渗透系数 17 mL/(m2·d),CO2渗透系数51 mL/(m2·d),透湿性62 g/(m2·d);④未包装的羊肚菌直接放入塑料筐(CK)35 d最优处理措施:0.02 mm微孔膜衬入塑料筐内最优处理贮藏效果:(1)失重率:0.24%(2)呼吸强度:为83.39 mgCO2/(kg·h)[7 d](3)可溶性固形物:比初值下降8.89%(4)多酚含量:损失率为31.83 %(CK组为36.21 %),含量为0.996 mg/g(5)PPO活性:0.868 U/(min·g)(6)POD活性:0.048 U/(min·g)[32]高压静电对菌丝生长的影响:温度:20 ℃实验组别:①~⑥电场电压为5, 10, 15, 20, 25, 30 kV;⑦未处理(CK)对菌种萌发时间的影响:温度:20 ℃;电场电压:15 kV实验组别:①~⑥处理时间60、65、70~180 s121 d(1)对羊肚菌子实体形成周期的影响:最优处理措施:15 kV组:52 d(2)对细菌性病害的影响:最优处理措施:10 kV组:菌丝染菌率为0.03%,子实体染病率为0.05%;(3)对羊肚菌保鲜效果的影响:最优处理措施:15 kV组:保鲜期为20 d,质量损失率最小,为4.3%。[33]壳聚糖涂膜四川成都PH:6.0贮藏温度:3 ℃实验组别:①不经任何处理;②0.5%的壳聚糖浸泡③0.75%的壳聚糖浸泡 ④1.0%的壳聚糖浸泡⑤1.25%的壳聚糖浸泡6 d最优处理方式:0.75%壳聚糖最优处理贮藏效果:(1)失重率:0.58%(2)粗多糖含量:15%(3)粗蛋白含量:26%,空白组16%[34]棘托竹荪菌丝体提取液涂膜云南昆明2%、4%、6%以及8%竹荪菌丝体提取液浸泡,未经任何处理的羊肚菌作为空白对照组25 d最优处理方式:6%棘托竹荪菌丝体提取液最优处理贮藏效果:(1)失重率:4.40%,对照组为7.37%(2)褐变度:0.3 (3)硬度:7.8×106 Pa[15]
3 羊肚菌贮藏保鲜方法
3.1 物理方法
3.1.1 气调处理
活性气调包装(active modified atmosphere package,AMAP)是一种使用密封材料进行包装,与外界没有气体交换的保鲜方法[35]。O2/CO2气调是用于食用菌保鲜常用的方法[36],该方法的机制是可利用CO2抑制羊肚菌的呼吸速率,延缓呼吸高峰的出现,同时利用高O2缓解CO2产生的伤害[37](图2)。自发气调包装是一种绿色天然的保鲜技术,水果和蔬菜通过呼吸渗透包装材料,创造一种气体环境,并通过抑制水果和蔬菜的呼吸来减缓其老化,从而延长贮藏期[32]。适当的初始O2/CO2值可以快速达到整个体系内的气体平衡,延迟呼吸高峰的到来,降低羊肚菌的失重率、PPO活性和丙二醛含量,增加可溶性固形物、蛋白质和游离氨基酸的含量,并保持较高的感官质量。过高或过低的初始CO2比例,会易引起羊肚菌无氧呼吸或加快呼吸代谢,均不利于羊肚菌保鲜。采用O2/CO2AMAP的方式作为羊肚菌采后的保鲜手段,将对羊肚菌的物流保鲜具有重要意义[12]。

图2 羊肚菌气调保鲜研究及作用机制
Fig.2 Activity modified atmosphere packaging preservation studies and mechanism of Morchella esculenta
黄雪等[11]在此基础上的进一步研究表明,90% O2+10% CO2的主动自发气调处理可有效抑制羊肚菌失重率上升,维持可溶性蛋白质和氨基酸含量,保持较好羊肚菌色泽和感官品质,使得在15 ℃下延长羊肚菌保鲜期至3 d。这种方式使得羊肚菌既可利用CO2抑制果蔬呼吸速率,又能利用高O2缓解CO2产生的负面影响[36-38]。但是目前缺乏对于羊肚菌气调过程中代谢物质所导致的风味及营养物质变化的研究,这对居民可接受度的影响至关重要,同时,由于气调包装对于包装材料的要求是不同的,需要进一步探讨其材质和透气性能。也应加强对于羊肚菌气调处理后转录组、蛋白组及代谢组,多组学的进一步机制研究,以期为羊肚菌气调保鲜机制提供理论基础。
3.1.2 臭氧处理
臭氧被认为是一种广谱高效的杀菌剂,可以灭活微生物,减缓或防止微生物与食物发生生化反应引起的食物变质,安全无残留,属于绿色物理保鲜技术[39]。臭氧强烈地直接氧化细菌的细胞膜和细胞壁,臭氧辐射有助于减少微生物和病原体;因此,可以延长食品的保质期[39]。于晋泽等[27]研究表明,贮藏前用5 μg/mL臭氧进行熏蒸处理,聚乙烯包装贮藏,于1 ℃冷藏,对降低羊肚菌失重率、降低呼吸强度、保持多酚含量和POD活性、抑制PPO活性、抑制羊肚菌成熟衰老具有积极作用。现有研究综述表明臭氧对果蔬保鲜作用的机制是明确的[39],但是目前缺乏对于羊肚菌臭氧保鲜过程中代谢物质所导致的风味研究,结合信号分子的表达情况,探究羊肚菌臭氧保鲜过程中初级、次级代谢产物及代谢途径的研究,对羊肚菌臭氧保鲜机制的研究提供理论基础至关重要,同时需要加强臭氧处理对贮藏期内羊肚菌褐变及软化相关基因表达的研究,以期阐明臭氧对羊肚菌保鲜的作用机制(图3)。
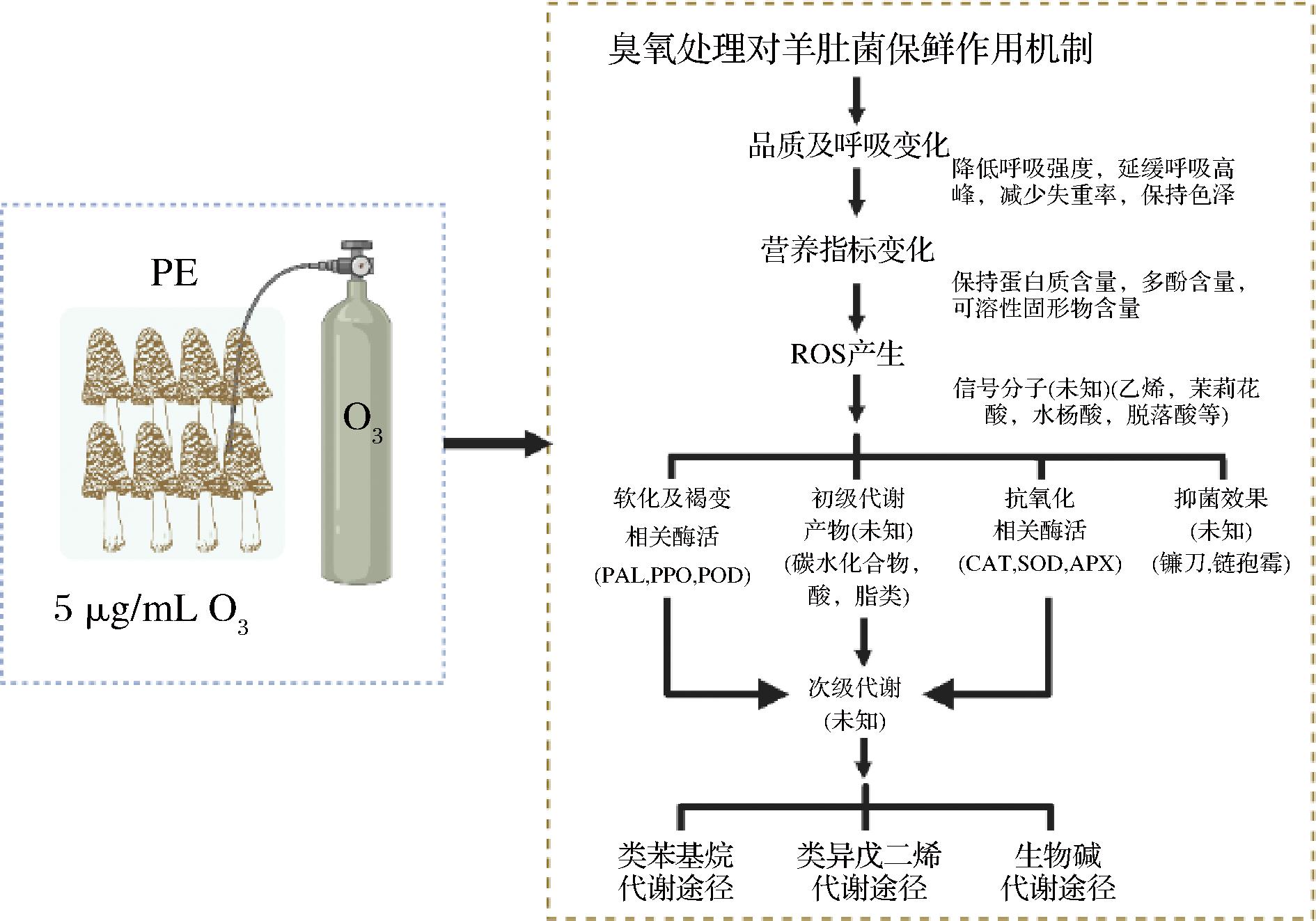
图3 羊肚菌臭氧保鲜研究及作用机制
Fig.3 Ozone preservation studies and mechanism of Morchella esculenta
3.1.3 分段式变温热风干燥
目前,干燥是延长羊肚菌货架期的主要途径。变温干燥通过控制不同干燥阶段的温度、升温速率、湿度、风速等工艺参数来调节物料的失水规律,达到干燥质量、干燥时间和能耗的平衡,从而获得最大的经济效益[23]。据卢营蓬等[28]研究表明,其最优处理措施为湿度60%~70%、温度35 ℃,提升干燥速率,设置间歇干燥,其复水性为3.70,在营养成分表现方面,只是蛋白质含量略有降低、总糖含量略有增加、脂肪含量大幅降低。对干品品质、干燥时间、能耗三方面表现进行综合对比,缓速升温的分段式变温干燥工艺的品质最佳,但干燥周期较长,能耗偏高。而通过提升干燥速率,干燥3 h后每隔1 h设置1 h的干燥间歇,可以缩短净干燥时间1.3 h,降低能耗13.4 mJ。
3.1.4 辐照处理
60Co-γ辐照作为一种非热加工的物理杀菌技术,通过高能量电离辐射达到灭菌并抑制后熟等效果,具有安全、环保、节能的特点[30]。辐照处理在延缓羊肚菌的褐变,延长货架期、增强抗氧化性等方面具有广阔的应用前景[40](图4)。根据郭佳等[29]的研究成果,其最优处理措施为1.64 kGy处理,该组子实体质量损失率上升幅度最缓慢,第5天仍维持一定硬度,羊肚菌L*值变化幅度最小,总酚和类黄酮含量最高且显著高于对照组(P<0.05),CAT酶活性第7天时达到峰值,比对照组高61.5%;PPO活性在第7天到达峰值,差异明显(P<0.05);丙二醛含量上升较缓慢,与对照组积累量存在显著差异(P<0.05),抑制效果最好[29-30]。但是缺少对于风味影响的研究,一般通过辐射处理会改变食用菌子实体内部的DNA,对其基因组会有较大的影响,因而对于褐变及软化相关基因表达情况及辐射的作用机理仍需要进一步探究。
电子束辐照保鲜是利用电子加速器产生的电子与物质相互作用产生的物理效应,对农产品进行加工处理,实现杀虫、杀菌、抑制发芽等效果。高能电子束作用于食用菌及包装食用菌子实体可产生活性自由基,通过射线的直接作用和自由基的间接作用,抑制PPO,抑制膜脂过氧化,从而达到控制微生物感染和虫害,延缓褐变,同时可抑制菌伞开张及菌柄延长[41],有效延长食用菌货架期。研究表明,电子束辐照最优处理辐照剂量为小于等于2 kGy,与60Co-γ辐照处理的辐照强度接近。辐照剂量≤2 kGy组的形态变化,第14天发生脱水现象,但未发生霉变及腐烂,而辐照剂量>2 kGy组:第5~7天时,菌菇变软,严重脱水。≤2 kGy组,其必需氨基酸含量变化不大,辐照剂量为2 kGy[31]。电子束辐照探索羊肚菌辐照保鲜技术为羊肚菌营养成分及氨基酸营养价值保持提供了参考。但是辐射处理对于操作人员的技术要求很高,同时仍需要对其成本问题进行重点考虑。

图4 羊肚菌辐射保鲜研究及作用机制
Fig.4 Research on radiation preservation and mechanism of Morchella esculenta
3.1.5 减压预冷
减压预冷可以降低羊肚菌子实体的呼吸速率,推迟呼吸高峰的出现,能够更好保持细胞膜的完整性,减少膜脂过氧化,并且整理态的保鲜效果优于原态(表1)。采后进行适当整理,即去泥脚后用流动的自来水轻轻冲洗,再自然晾干或用冷风机吹干后采用800 Pa的压力于1 ℃下减压预冷,有助于羊肚菌的保鲜贮藏[25],因此,减压预冷预处理后与其他保鲜方法相结合,以最大限度地提高羊肚菌的采后品质。
3.2 化学方法
3.2.1 微酸性电解水和紫外光结合处理
联合使用微酸性电解水和紫外光处理食品是一种延长食用菌货架期的有效方法。微酸性电解水由于具有极强的抗菌活性,对人体健康无不良影响。微酸性电解水的有效氯素浓度为10~30 mg/L,pH 5.0~6.5,在维持整个体系高效抑菌活性的同时,能避免氯气脱气引发安全问题的可能性,且成本较低,具有延长食用菌货架期的巨大潜力[42]。紫外光是波长为100~400 nm的非电离辐射,UV-C(100~280 nm)已推广应用于抑制果蔬表面的微生物腐败。在波长254 nm处,紫外线辐射表现出最大杀菌作用,并且应用成本低、操作便捷[43],其最优处理措为4 L微酸性电解水结合紫外光处理3 min,在抑制PPO和POD产生最有效,能有效抑制褐变,同时对六妹羊肚菌风味影响最小且能抑制附着菌落,提高抗氧化应激能力,保持组织硬度[26]。SAEW+UV处理可能是通过抑制酪氨酸酶和POD的合成来抑制黑色素生成,有待进一步验证,但这2种方法的配合使用,为羊肚菌的采后货架期的延长提供了一种易操作、成本低、绿色环保的有效方法,便于推广。
3.2.2 可食用涂膜
可食性生物保鲜膜在果蔬保鲜方面的研究与应用愈来愈多,其中,壳聚糖是由甲壳质脱乙酰水解而成的高分子多糖,单一使用效果也较好[44]。壳聚糖具有良好的生物相容性和成膜能力,是公认的安全的抗菌药物载体,已被广泛应用。壳聚糖基涂膜的保鲜效果可能部分是由于其减缓呼吸速率和控制水果腐烂的特性,部分是由于其防止食品异味的形成和延缓水果中的脂肪氧化[45]。羊肚菌随着贮藏时间的延长,羊肚菌的主要营养成分呈逐渐减少趋势。在经过使用壳聚糖保鲜液的涂膜后,减少了羊肚菌呼吸作用所消耗的能量,也抑制了其自身对营养物质的消耗速率[46]。结果显示,涂膜浓度为0.75%壳聚糖组具有更明显的保鲜效果,0.75%的壳聚糖保鲜液能明显地减缓羊肚菌细胞膜的脂质氧化速率,且涂抹了壳聚糖保鲜液的羊肚菌在贮藏期间其水分、蛋白质和多糖的含量均明显高于空白组(图5)。实验表明,壳聚糖保鲜液能够有效地抑制羊肚菌的呼吸作用,减少其在贮藏期间营养成分的损失[34]。此方法操作简便,可实现大规模操作。
除壳聚糖保鲜外,棘托竹荪(Dictyophoraechino-volvata)菌丝体提取液对羊肚菌亦有较好的保鲜效果。竹荪子实体含有丰富的营养成分,含有21种氨基酸,其中赖氨酸、谷氨酸、天冬氨酸、亮氨酸含量都较高。通过棘托竹荪菌丝体提取液有效抑制了松茸和羊肚菌的蒸腾作用、呼吸作用以及营养成分的过度损失,达到了延长保鲜期的效果。对羊肚菌于4 ℃进行涂膜保鲜,研究不同浓度提取液对羊肚菌的失重率、褐变度、硬度、呼吸强度、可溶性固形物等生理生化指标的影响,到第25天,对照组羊肚菌的失重率达到7.37%,而6%、8%两个处理组,羊肚菌失重率分别为4.40%和4.23%,且经过6%和8%提取液涂膜处理的羊肚菌呼吸强度基本与新鲜羊肚菌呼吸强度持平,棘托竹荪菌丝体提取液涂膜处理的羊肚菌在贮藏期间其硬度下降得到缓解,8%浓度提取液的其可溶性固形物含量变化最小。6%和8%棘托竹荪菌丝体提取液涂膜处理对羊肚菌保鲜效果均很好羊肚菌的保鲜效果最好,但该方法操作成本较高[15]。

图5 羊肚菌涂膜保鲜研究及作用机制
Fig.5 Research on coating preservation and mechanism of Morchella esculenta
4 展望
目前羊肚菌保鲜方法多种多样,但大多停留在研究阶段,远远不能满足产业化的需要。因此,研究羊肚菌品质变质机理及保鲜新技术延长保质期具有重要意义。基于羊肚菌品质劣化的机理,未来的研究应重点关注以下几个方面:
a)进一步研发产地短期贮运保鲜适用技术,羊肚菌贮藏保鲜过程中褐变、软化、木质化等品质裂变机制。羊肚菌通过多组学技术,探讨基因调控不同保鲜方式的潜在分子机制,从分子水平上解决羊肚菌采后品质劣化问题。
b)加强羊肚菌贮藏保鲜过程中营养物质保留和风味转移机制的研究,针对羊肚菌多个功能组分,开展提取、纯化、重组技术研究,以及不同保鲜方式对其生物活性的影响,从而提高羊肚菌保鲜后的可接受性,同时延长其保质期。
c)在羊肚菌的保存方法中,对包装材料、低温和化学方法保鲜的研究相对较少,这些传统食用保鲜方法对羊肚菌的效果和保鲜机理的研究仍有待探索,以及开发基于天然生物活性物质的新型绿色保鲜剂。
d)未来可采用新技术与传统技术相结合,提高羊肚菌采后品质,如微孔膜包装与辐照处理相结合,开发冷杀菌设备,打造安全高效的杀菌工艺(如辐照、微波、低压静电场和低温等离子杀菌设备及工艺等),减缓羊肚菌在贮藏和流通过程中品质下降。
[1] TIETEL Z, MASAPHY S. True morels (Morchella)-nutritional and phytochemical composition, health benefits and flavor: A review[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(11):1888-1901.
[2] CAI Z N, LI W, MEHMOOD S, et al. Structural characterization, in vitro and in vivo antioxidant activities of a heteropolysaccharide from the fruiting bodies of Morchella esculenta[J]. Carbohydrate Polymers, 2018, 195:29-38.
[3] WEN Y, BI S X, HU X J, et al. Structural characterization and immunomodulatory mechanisms of two novel glucans from Morchella importuna fruiting bodies[J]. International Journal of Biological Macromolecules, 2021, 183:145-157.
[4] LEI J, LI B J, ZHANG N, et al. Effects of UV-C treatment on browning and the expression of polyphenol oxidase (PPO) genes in different tissues of Agaricus bisporus during cold storage[J]. Postharvest Biology and Technology, 2018, 139:99-105.
[5] LI F H, ZHENG S J, ZHAO J C, et al. Phenolic extract of Morchella angusticeps peck inhibited the proliferation of HepG2 cells in vitro by inducing the signal transduction pathway of p38/MAPK[J]. Journal of Integrative Agriculture, 2020, 19(11):2829-2838.
[6] GUO Y X, CHEN X F, GONG P. Classification, structure and mechanism of antiviral polysaccharides derived from edible and medicinal fungus[J]. International Journal of Biological Macromolecules, 2021, 183:1753-1773.
[7] WANG J Q, XIAO J, GENG F, et al. Metabolic and proteomic analysis of morel fruiting body (Morchella importuna)[J]. Journal of Food Composition and Analysis, 2019, 76:51-57.
[8] ZHANG K X, PU Y Y, SUN D W. Recent advances in quality preservation of postharvest mushrooms (Agaricus bisporus): A review[J]. Trends in Food Science &Technology, 2018, 78:72-82.
[9] 史宇, 孙飞龙, 王淑君, 等. 羊肚菌保鲜技术研究进展[J]. 包装与食品机械, 2022, 40(2):102-106. SHI Y, SUN F L, WANG S J, et al. Research progress in preservation technology of Morchella esculenta[J]. Packaging and Food Machinery, 2022, 40(2):102-106.
[10] 曾小峰, 高伦江, 曾顺德, 等. 羊肚菌保鲜与加工研究进展[J]. 南方农业, 2022, 16(9):224-227. ZENG X F, GAO L J, ZENG S D, et al. Research progress in the preservation and processing of Morel mushroom[J]. South China Agriculture, 2022, 16(9):224-227.
[11] 黄雪, 员丽苹, 谢瑶, 等. 15℃下O2/CO2主动自发气调对羊肚菌保鲜效果的影响[J]. 中国果菜, 2019, 39(12):1-6. HUANG X, YUN L P, XIE Y, et al. Effects of O2/CO2 active modified atmospheres packaging on preservation quality of Morchella sextelata under 15 ℃[J]. China Fruit &Vegetable, 2019, 39(12):1-6.
[12] 黄雪, 刘莎莎, 谢瑶, 等. O2/CO2主动自发气调对羊肚菌4℃下贮藏品质的影响[J]. 中国食用菌, 2020, 39(3):56-62. HUANG X, LIU S S, XIE Y, et al. Effects of O2/CO2 active modified atmosphere packaging on storage quality of Morehella sextelata under 4℃[J]. Edible Fungi of China, 2020, 39(3):56-62.
[13] GAO F H, XIE W Y, ZHANG H, et al. Metabolomic analysis of browning mechanisms of morels (Morchella sextelata) during storage[J]. Postharvest Biology and Technology, 2022, 185:111801.
[14] 杨威. 棘托竹荪菌丝体提取液对松茸、羊肚菌保鲜的研究[D]. 昆明: 昆明理工大学, 2010. YANG W. Study on preservation of Tricholoma matsutake and Morchella esculenta by mycelium extract of Dictyophora spinosa[D].Kunming: Kunming University of Science and Technology, 2010.
[15] 杨威, 樊建, 赵天瑞. 棘托竹荪菌丝体提取液对羊肚菌保鲜的研究[J]. 中国食用菌, 2017, 36(4):53-57. YANG W, FAN J, ZHAO T R. Study on preservation of Dictyophora echino-volvata Mycelium on Morchella esculenta[J]. Edible Fungi of China, 2017, 36(4):53-57.
[16] GUO Y X, CHEN X F, GONG P, et al. Effect of shiitake mushrooms polysaccharide and chitosan coating on softening and browning of shiitake mushrooms (Lentinus edodes) during postharvest storage[J]. International Journal of Biological Macromolecules, 2022, 218:816-827.
[17] 王金秋, 叶鸿亮, 梁道崴, 等. 梯棱羊肚菌子实体转录组测序及解析[J]. 食品科学, 2018, 39(18):81-87. WANG J Q, YE H L, LIANG D W, et al. De novo sequencing and transcriptome analysis of Morchella importuna fruiting body[J]. Food Science, 2018, 39(18):81-87.
[18] VIEIRA V, FERNANDES  , BARROS L, et al. Wild Morchella conica Pers. from different origins: A comparative study of nutritional and bioactive properties[J]. Journal of the Science of Food and Agriculture, 2016, 96(1):90-98.
, BARROS L, et al. Wild Morchella conica Pers. from different origins: A comparative study of nutritional and bioactive properties[J]. Journal of the Science of Food and Agriculture, 2016, 96(1):90-98.
[19] ROTZOLL N, DUNKEL A, HOFMANN T. Quantitative studies, taste reconstitution, and omission experiments on the key taste compounds in morel mushrooms (Morchella deliciosa Fr.)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(7):2705-2711.
[20] YU S K, ANDREASSEN M, LUNDT| I. Enzymatic production of microthecin by aldos-2-ulose dehydratase from 1, 5-anhydro-D-fructose and stability studies of microthecin[J]. Biocatalysis and Biotransformation, 2008, 26:169-176.
[21] CASTELL M L, FITO P J, CHIRALT A. Effect of osmotic dehydration and vacuum impregnation on respiration rate of cut strawberries[J]. LWT-Food Science and Technology, 2006, 39(10):1171-1179.
M L, FITO P J, CHIRALT A. Effect of osmotic dehydration and vacuum impregnation on respiration rate of cut strawberries[J]. LWT-Food Science and Technology, 2006, 39(10):1171-1179.
[22] JACINTO-AZEVEDO B, VALDERRAMA N, HENR QUEZ K, et al. Nutritional value and biological properties of Chilean wild and commercial edible mushrooms[J]. Food Chemistry, 2021, 356:129651.
QUEZ K, et al. Nutritional value and biological properties of Chilean wild and commercial edible mushrooms[J]. Food Chemistry, 2021, 356:129651.
[23] 吴中华, 李文丽, 赵丽娟, 等. 枸杞分段式变温热风干燥特性及干燥品质[J]. 农业工程学报, 2015, 31(11):287-293. WU Z H, LI W L, ZHAO L J, et al. Drying characteristics and product quality of Lycium barbarum under stages-varying temperatures drying process[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(11):287-293.
[24] AL-DAIRI M, PATHARE P B, AL-YAHYAI R, et al. Mechanical damage of fresh produce in postharvest transportation: Current status and future prospects[J]. Trends in Food Science &Technology, 2022, 124:195-207.
[25] 张沙沙, 朱立, 曹晶晶, 等. 采后预处理对羊肚菌保鲜效果的影响[J]. 食品工业科技, 2016, 37(13):319-322. ZHANG S S, ZHU L, CAO J J, et al. Effect of the pretreatment on quality maintenance of morels[J]. Science and Technology of Food Industry, 2016, 37(13):319-322.
[26] 许瀛引, 谢丽源, 张志远, 等. 微酸性电解水和紫外光结合对采后六妹羊肚菌的保鲜作用[J]. 菌物学报, 2021, 40(12):3332-3346. XU Y Y, XIE L Y, ZHANG Z Y, et al. Combined effects of slightly-acidic electrolyzed water and ultraviolet light on the postharvest quality of Morchella sextelata[J]. Mycosystema, 2021, 40(12):3332-3346.
[27] 于晋泽, 李萍, 张娜, 等. 不同浓度臭氧对羊肚菌的保鲜作用[J]. 江苏农业学报, 2020, 36(2):494-499. YU J Z, LI P, ZHANG N, et al. Preservation effect of different concentrations of ozone on Morchella[J]. Jiangsu Journal of Agricultural Sciences, 2020, 36(2):494-499.
[28] 卢营蓬, 王春霞, 易文裕, 等. 羊肚菌分段式变温热风干燥试验研究[J]. 中国农机化学报, 2020, 41(4):111-116. LU Y P, WANG C X, YI W Y, et al. Experimental study on hot-air drying of Morchella under stages-varying temperatures process[J]. Journal of Chinese Agricultural Mechanization, 2020, 41(4):111-116.
[29] 郭佳, 陈谦, 徐攀, 等. 基于正交偏最小二乘判别分析探究60Co-γ辐照对羊肚菌采后低温贮藏品质的影响[J]. 食品科学, 2022, 43(21):315-323. GUO J, CHEN Q, XU P, et al. Effect of 60Co-γ irradiation on the postharvest quality of Morchella angusticeps during cold storage investigated using orthogonal partial least square discriminant analysis[J]. Food Science, 2022, 43(21):315-323.
[30] 陈谦, 傅舒, 杨敏, 等. 60Co-γ辐照对美味牛肝菌挥发性成分的影响[J]. 食品工业科技, 2018, 39(21):212-217. CHEN Q, FU S, YANG M, et al. Effect of 60Co-γ irradiation on volatile components of Boletus edulis[J]. Science and Technology of Food Industry, 2018, 39(21):212-217.
[31] 顾可飞, 刘海燕, 杨海峰, 等. 电子束辐照对羊肚菌营养成分影响分析[J]. 食品工业科技, 2018, 39(12):55-62. GU K F, LIU H Y, YANG H F, et al. Effection analysis of electron beam irradiation on morels nutrient composition[J]. Science and Technology of Food Industry, 2018, 39(12):55-62.
[32] 李萍, 于晋泽, 张娜, 等. 不同包装材料对羊肚菌保鲜效果的影响[J]. 食品与发酵工业, 2019, 45(23):163-169. LI P, YU J Z, ZHANG N, et al. Effects of different packaging materials on the preservation of Morchella[J]. Food and Fermentation Industries, 2019, 45(23):163-169.
[33] 管俊林, 刘云云, 张国平, 等. 高压静电在羊肚菌生产加工中的应用效果研究[J]. 现代农业科技, 2019(22):33-35. GUAN J L, LIU Y Y, ZHANG G P, et al. Study on application effect of high voltage static electricity in Morchella production and processing[J]. Modern Agricultural Science and Technology, 2019(22):33-35.
[34] 李翔, 肖星星, 邓杰, 等. 壳聚糖涂膜保鲜羊肚菌研究[J]. 成都大学学报(自然科学版), 2018, 37(4):366-369. LI X, XIAO X X, DENG J, et al. Study on preservation of Morchella by chitosan coating[J]. Journal of Chengdu University (Natural Science Edition), 2018, 37(4):366-369.
[35] QU P, ZHANG M, FAN K, et al. Microporous modified atmosphere packaging to extend shelf life of fresh foods: A review[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(1):51-65.
[36] GUO Y Y, GAO Z Y, LI L, et al. Effect of controlled atmospheres with varying O2/CO2 levels on the postharvest senescence and quality of broccoli (Brassica oleracea L. var. italica) florets[J]. European Food Research and Technology, 2013, 237(6):943-950.
[37] 吕凤艳, 郭衍银, 王兆全. 西兰花气调保鲜过程中O2缓解CO2伤害的研究[J]. 北方园艺, 2016(13):132-136. LYU F Y, GUO Y Y, WANG Z Q. Study on the alleviation of O2 to CO2 injury during broccoli storage under controlled atmospheres[J]. Northern Horticulture, 2016(13):132-136.
[38] 郭衍银, 李玲, 陈东, 等. O2联合CO2气调对西兰花活性氧代谢及保鲜效果的影响[J]. 食品科学, 2013, 34(24):304-308. GUO Y Y, LI L, CHEN D, et al. Effects of O2 combined with CO2 controlled atmospheres on reactive oxygen species metabolism and quality preservation of broccoli(Brassica oleracea L.)[J]. Food Science, 2013, 34(24):304-308.
[39] FAN X T. Gaseous ozone to preserve quality and enhance microbial safety of fresh produce: Recent developments and research needs[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(5):4993-5014.
[40] ALMASI H, JAHANBAKHSH OSKOUIE M, SALEH A. A review on techniques utilized for design of controlled release food active packaging[J]. Critical Reviews in Food Science and Nutrition, 2021, 61(15):2601-2621.
[41] 张娟琴. 双孢菇和白灵菇采后品质及贮藏保鲜技术研究[D]. 南京: 南京林业大学, 2010. ZHANG J Q. Studies on the quality characteristics and fresh keeping technologies of post-harvest Pleurotus nebrodensis and Agaricus bisporus[D]. Nanjing: Nanjing Forestry University, 2010.
[42] RAHMAN S, KHAN I, OH D H. Electrolyzed water as a novel sanitizer in the food industry: Current trends and future perspectives[J]. Comprehensive Reviews in Food Science and Food Safety, 2016, 15(3):471-490.
[43] GAY N E, COND
N E, COND N S,
N S,  LVAREZ I. Biological aspects in food preservation by ultraviolet light: A review[J]. Food and Bioprocess Technology, 2014, 7(1):1-20.
LVAREZ I. Biological aspects in food preservation by ultraviolet light: A review[J]. Food and Bioprocess Technology, 2014, 7(1):1-20.
[44] NASTASI J R, KONTOGIORGOS V, DAYGON V D, et al. Pectin-based films and coatings with plant extracts as natural preservatives: A systematic review[J]. Trends in Food Science &Technology, 2022, 120:193-211.
[45] PÉREZ-SANTAESCOL STICA C, MUNEKATA P E S, FENG X, et al. Active edible coatings and films with Mediterranean herbs to improve food shelf-life[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(9):2391-2403.
STICA C, MUNEKATA P E S, FENG X, et al. Active edible coatings and films with Mediterranean herbs to improve food shelf-life[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(9):2391-2403.
[46] YONG H M, LIU J. Active packaging films and edible coatings based on polyphenol-rich propolis extract: A review[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(2):2106-2145.