运动的强度和持续时间是免疫反应产生积极或消极影响的关键因素。规律性的短时间中低强度运动有利于增强机体免疫力,改善免疫反应[1]。而短时间或长时间的剧烈运动则会使免疫细胞功能暂时性下降,各种细菌、微生物、病毒等趁机而入,称为运动性免疫抑制[2]。此外,剧烈的运动可能增加运动员上呼吸道感染(upper respiratory tract infection,URTI)的发生率,损伤黏膜屏障,进而对运动表现产生负面影响[3]。唾液中的分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)作为一个预测因子,其水平下降与运动员发生URTI的风险相关[4]。一些细胞因子,如白细胞介素4(interleukin-4,IL-4)和IL-10的升高也是体力活动个体发生URTI的危险因素[5]。研究发现,提高对URTI的抵抗力为运动员进行高水平训练和在比赛中正常发挥提供了重要保障[6]。因此,提高运动员的机体免疫功能成为运动营养专家关注的重点[7]。
多项研究证明,运动、肠道微生物群和饮食之间存在密切关系[8],适当的饮食可以改善剧烈运动后的免疫抑制[9]。研究发现补充矿物质(锌和铁)和维生素(脂溶性维生素A和水溶性维生素C)对免疫功能具有调节作用,但过量使用反而会损伤免疫功能或对机体造成其他危害[10]。因此,找到安全有效的补剂至关重要。近年来益生菌、益生元和合生元受到广泛关注。合生元被定义为由活微生物和底物组成的混合物[11],包含益生菌和益生元2种成分。益生菌是严格挑选的微生物活菌株,以足够数量使用时,会给宿主带来健康益处[12]。双歧杆菌属和乳杆菌属是两类常见的益生菌。益生元可被微生物用作食物,同时对宿主的健康产生有益的影响[13]。常见的益生元成分是菊粉、低聚果糖(fructo oligosaccharide,FOS)、低聚半乳糖(galactooligosaccharides,GOS)、低聚木糖(xylooligosaccharides,XOS)和β-葡聚糖。益生菌通过选择性地将有益微生物定植到胃肠道直接影响肠道微生物组成,而益生元的添加可以促进益生菌的定植和生长,延长其在体内的存活[14]。研究发现,合生元可以通过调节肠道微生物及其代谢产物改善黏膜免疫,或直接与免疫细胞上的Toll样受体相互作用,调节树突状细胞来增强机体免疫功能[15]。近年已有一些合生元作为重要的营养补剂应用于运动领域,其对运动员的免疫功能具有一定改善作用[16]。但由于实验对象、补剂种类和补剂时间等因素的差异,合生元增强免疫功能的结论并不一致(表1)。本文综述了运动性免疫抑制的原因、合生元改善此现象的效果及可能机制,旨在为运动训练中补充合生元提供理论依据。
表1 合生元对免疫功能的影响
Table 1 Effect of synbiotics on immune function

参考文献年份补剂成分时间参与者影响[16]2021合生元(乳双歧杆菌CBP-001010、鼠李糖乳杆菌CNCMI-4036、长双歧杆菌ES1和FOS);安慰剂(麦芽糊精)1个月13名职业男性足球运动员和14名久坐不动的学生IL-1β浓度显著上升,IgA水平没有显著提升[40]2022合生元(副干酪乳杆菌HII01、动物双歧杆菌乳酸亚种、FOS和GOS)12周32名志愿者血清IgA和TNF-α、粪便SCFAs、乙酸盐和丙酸盐显着增加,血清LPS显著减少[41]2014合生元(动物双歧杆菌Bi-07和XOS);益生菌(动物双歧杆菌Bi-07);益生元(XOS)21 d44名健康成年人唾液IgA含量显著增加,可以促进Th1反应并降低Th2活性[42]2018合生元(嗜酸乳杆菌W37和长链菊粉);益生菌(嗜酸乳杆菌W37);益生元(长链菊粉)TNF-α显著增加[43]2022合生元(乳双歧杆菌CBP-001010、鼠李糖乳杆菌CNCMI-4036、长双歧杆菌ES1和FOS);安慰剂(麦芽糊精)1个月13名职业男性足球运动员和14名久坐不动的学生机体IL-6、IL-8和TNF-α没有显著影响[44]2018合生元(枯草杆菌和XOS)42 d540只公鸭免疫球蛋白(SIgA和IgG)和免疫细胞因子(IL-1β和TNF-α)含量没有显著变化[45]2017合生元(鼠李糖乳杆菌GG、鼠李糖乳杆菌GG-PB12和可溶性玉米纤维);益生元(可溶性玉米纤维);安慰剂(麦芽糊精)3周40名健康志愿者促炎细胞因子IL-6产生减少[46]2017合生元(鼠李糖乳酸杆菌IMC501®和副干酪乳杆菌IMC502®及燕麦麸纤维);安慰剂(发酵乳)4周10名高强度健身专业人士URTI症状显著改善,SIgA明显增加,黏膜免疫增强,胃肠道症状发生率和严重程度均显著降低,乳酸菌和双歧杆菌属含量明显增加[47]2008合生元(植物乳杆菌、鼠李糖乳杆菌、乳酸双歧杆菌和FOS);安慰剂(葡萄糖和麦芽糊精)3个月237名健康志愿者URTI持续时间和严重程度显著降低[48]2010合生元(瑞士乳杆菌R0052、婴儿双歧杆菌R0033、两歧双歧杆菌R0071和FOS);安慰剂(淀粉和香草香精)3个月135名儿童RTI的发生数量减少[49]2017合生元(植物乳杆菌ATCC-202195和FOS)7 d4 556名婴儿下呼吸道感染显著减少[50]2008合生元(鼠李糖乳杆菌GG、鼠李糖乳杆菌LC705、短双歧杆菌Bb99、费氏丙酸杆菌ssp shermanii和GOS);安慰剂(微晶纤维素加糖浆)6个月925名婴儿RTI发生率降低[51]2010合生元(长双歧杆菌、嗜热链球菌和FOS);安慰剂组(标准配方奶粉)3个月771名健康婴儿URTI发生率显著低于安慰剂组[58]2022合生元(嗜酸乳杆菌PBS066、植物乳杆菌PBS067、双歧杆菌BL050、菊粉和FOS);益生元(菊粉和FOS);28 d75名健康老年人唾液IgA增加,有助于增强肠道微生物群落内的乳酸杆菌和双歧杆菌丰度[59]2016合生元(嗜酸乳杆菌CUL-60、嗜酸乳杆菌CUL-21、双歧杆菌CUL-20、动物双歧杆菌CUL-34和FOS);安慰剂(玉米粉)12周30名长跑铁人三项运动员LPS显著减少,胃肠道症状发生率和严重程度均显著降低[60]2007合生元(双歧杆菌BL999、GOS和FOS)112 d138名婴儿显著降低胃肠道症状发生率[61]2007合生元(嗜酸乳杆菌La5、保加利亚乳杆菌、乳双歧杆菌BB-12、嗜热链球菌和FOS)术前服用补剂92名需要进行结肠切除术的手术患者肠道菌群异位发生率显著下降,减少了粪肠杆菌科细菌的丰度和细菌移位,肠道屏障完整性得到增强[62]2018MTX/GWT组(CE-2、米曲霉菌株NK、乳酸菌、屎肠球菌、酿酒酵母);MTX组(CE-2);对照组(CE-2)3周88只雄性SD大鼠减少肠道损伤,增强肠道完整性[64]2020合生元(植物乳杆菌G1和β-葡聚糖);益生菌(植物乳杆菌G1);益生元(β-葡聚糖)14 d240条鱼血清中总免疫球蛋白水平显著升高[65]2020合生元(淀粉芽孢杆菌CECT5940、屎肠球菌CECT4515、甘露寡糖和β-葡聚糖)7 d64 400只鸡IgA水平显著高于对照组[66]2009合生元(瑞士乳杆菌M92、菊粉、乳果糖和棉子糖)8 d4只小鼠粪便SIgA浓度和总血清IgA均高于对照组[70]2012合生元(嗜酸乳杆菌NCFM和异麦芽酮糖);合生元(嗜酸乳杆菌NCFM和纤维二糖);合生元(嗜酸乳杆菌NCFM和棉子糖);合生元(嗜酸乳杆菌NCFM和燕麦β-葡聚糖水解产物);合生元(双歧杆菌Bl-04和蜜二糖);合生元(双歧杆菌Bl-04和木二糖);合生元(双歧杆菌Bl-04和棉子糖);合生元(双歧杆菌Bl-04和麦芽三糖)1名志愿者增加健康受试者SCFAs水平,特别是乙酸和丁酸,减少健康受试者粪便中葡萄球菌的丰度,增加乳酸杆菌和双歧杆菌等有益菌丰度[71]2012合生元(副干酪乳杆菌431,动物双歧杆菌亚种BB-12,嗜酸乳杆菌LA-5,鼠李糖乳杆菌LGG和益生元筏状碱、筏状糖);益生元(金合欢粉、微晶纤维素、巧克力香料、磷酸氢钙、卵磷脂和硬脂酸镁BP)21 d22名自行车协会身体活跃的健康男性有益菌副干酪乳杆菌是对照组的9倍
续表1

参考文献年份补剂成分时间参与者影响[15]2020合生元(嗜酸乳杆菌DDS-1、乳酸双歧杆菌UABla-12、长双歧杆菌UABl-14、双歧杆菌UABb-10和GOS)3个月20名健康成年人改变了肠道微生物的相对丰度,其中一些健康有益(特别是双歧杆菌和乳酸菌)的丰度显著增加[77]2020合生元(加氏乳杆菌505和新益生元柘木叶提取物);益生菌(加氏乳杆菌505);益生元(新益生元柘木叶提取物)10周结肠炎相关性结肠直肠癌模型的小鼠上调结肠屏障标志物TJ蛋白,并且增加了SCFAs含量
1 运动性免疫抑制及其原因
1.1 高强度运动后免疫细胞功能下降及炎症因子变化
T淋巴细胞(T细胞)在协调运动性免疫抑制中发挥重要作用,其可以根据极化导致的表型特征分为3个亚组,即1型(T helper 1 cell,Th1)、2型(Th2)和调节性T细胞(regulatory T cells,Tregs)。每个T细胞亚群具有独特的功能作用,Th1产生促炎因子、Th2和Tregs产生抗炎细胞因子以应对免疫挑战。Th1和Th2是相互抑制的,任何一种的上调或下调都可能导致免疫反应失衡[17]。长时间的剧烈运动通常会降低外周血Th1细胞,升高Th2和Tregs细胞数量,增强机体抗炎作用,但同时也抑制了精英运动员的免疫力,使其更容易受到感染[18]。另外,运动导致激素的变化也会影响T细胞。研究发现,儿茶酚胺会显著影响外周血T细胞的数量,糖皮质激素和前列腺素E2可以促进T细胞产生抗炎细胞因子[19]。综上所述,剧烈的运动使免疫细胞功能减弱,降低免疫系统对病原体的防御能力,增加感染和病毒再激活的风险。
长时间的剧烈运动通常会降低外周血Th1细胞数量及其产生促炎细胞因子干扰素γ、IL-1β、IL-6、IL-8和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的能力[20]。大负荷运动与静息外周血Th2和Tregs细胞数量升高有关,抗炎细胞因子IL-4、IL-10和转化生长因子-β(transforming growth factor-β,TGF-β)产生增多[21]。IL-10是一种免疫调节细胞因子,对炎症反应具有抑制作用,是影响炎症功能的核心因子。急性运动对T细胞产生IL-10的影响仍存在争议。在全血和外周血单核细胞培养物中,IL-10增加、减少或不变的结果均有报道,而且由于运动方案和分析技术的不同很难得到一致的结论。此外,研究发现与低训练负荷相比,高训练负荷使全血IL-4和IL-10产生增多[22]。IL-10水平上升与IL-4的产生、Tregs细胞增多、唾液IgA分泌率和浓度降低有关[23]。因此,IL-4、IL-10和TGF-β的增多可能下调了细胞介导的免疫力,从而增加了URTI的风险[24]。总而言之,当进行高负荷训练时Th1被抑制,免疫分子水平呈负性变化,进而削弱对感染(尤其是病毒)和病毒再激活的防御能力,导致机体产生运动性免疫抑制。
1.2 高强度运动影响黏膜免疫稳态
1.2.1 高强度运动影响呼吸道黏膜免疫
支气管黏膜表面不断暴露于各种抗原或过敏原,包括致病细菌或病毒,其相关淋巴组织属于共同黏膜免疫系统的免疫结构网络,是免疫系统的重要组成部分。唾液中含有黏液、SIgA和体液先天免疫蛋白,如乳铁蛋白、溶菌酶和防御素[25]。唾液及其各种成分与上皮细胞一起形成了物理和化学屏障,以防止呼吸道的持续暴露引发免疫抑制。
运动强度与URTI之间存在“J形”曲线关系。规律的中等强度运动可以使免疫系统发生积极的变化,与URTI发生率降低相关[26]。而长时间高强度运动会抑制免疫系统的反应,导致感染的易感性增加,特别是URTI,容易出现咳嗽、打喷嚏、流鼻涕和喉咙痛等症状[27]。研究发现高训练负荷的马拉松运动员患呼吸道感染(respiratory tract illness,RTI)的风险几乎是低训练负荷的2倍。URTI多见于耐力运动员(如自行车、长跑、游泳和铁人三项运动员),约占运动员非损伤相关症状的35%~65%[28]。在运动训练和比赛期间频繁出现URTI可能会对运动员运动表现产生不利影响,研究发现奥林匹克[29]和国际比赛[30]期间URTI干扰了高达10%的运动员的训练和比赛能力[31]。研究结果表明高强度运动降低了机体呼吸道黏膜免疫功能。
1.2.2 高强度运动影响肠道黏膜免疫
体育锻炼是调节肠道微生物群的重要因素。运动对肠道微生物的影响取决于运动强度和持续时间。定期锻炼可增加有益菌的丰度,降低热休克蛋白对热应激的反应,防止肠上皮细胞之间紧密连接蛋白(tight junction,TJ)的破坏[32]。而且上皮细胞构成的胃肠道屏障可以显著影响黏膜免疫系统的发育和功能。因此,定期规律性的运动可以促进运动员适应,改善肠道屏障,增强免疫功能。
但长时间(≥2 h)或剧烈(>60%最大摄氧量)的运动可使流向胃肠道的血流减少,引起缺氧和机体氧化应激,从而损伤肠道屏障,导致肠黏膜通透性增加甚至内毒素血症,抑制免疫功能,阻碍运动表现的发挥[33]。这些生理效应与运动的强度、持续时间和运动频率成比例。胃肠道问题在马拉松[34]、铁人三项[35]、长跑[36]和自行车[37]等耐力运动员中常见。研究报道30%~50%的运动员会出现胃肠道不适症状[38],或伴有肠道通透性增加和黏膜屏障损伤[39]。然而肠道通透性不能仅用主观感受的指标来确切评估。例如,一项对参加越野滑雪行军的士兵进行的研究虽然没有报告胃肠道症状,但肠道通透性升高了。因此在评价肠道通透性时需要更多指标信息来相互印证。
2 合生元对免疫细胞功能的影响
研究发现运动可以降低慢性代谢和心肺疾病的风险,部分原因是运动具有抗炎作用。但这些影响也可能是抑制免疫力的原因,使得精英运动员更容易受到感染。细胞因子是免疫系统中重要的效应分子和信使分子。Th2和Tregs细胞过多的产生IL-4、IL-10和TGF-β等炎症因子导致机体易感性增加,这可能影响与Th1相关的RTI[24]。
研究证明补充合生元可以通过增强Th1、降低Th2和Tregs活性改善免疫细胞功能。QUERO等[16]发现男性足球运动员和普通大学生在服用由益生菌(乳酸双歧杆菌CBP-001010、鼠李糖乳杆菌CNCMI-4036和长双歧杆菌ES1)以及益生元FOS组成的合生元后IL-1β水平显著上升。另外,LALITSURADEJ等[40]观察到健康成年人服用合生元(副干酪乳杆菌HII01、动物双歧杆菌乳酸亚种、FOS和GOS)后血清TNF-α水平显著增加。此外,CHILDS等[41]发现健康成年人补充益生元XOS和益生菌动物双歧杆菌Bi-07组合的合生元可以提高机体免疫功能,主要是通过促进Th1反应并降低Th2活性。值得注意的是,LÉPINE等[42]同样观察到合生元(嗜酸乳杆菌W37和长链菊粉)可以使TNF-α的浓度显著增加。上述研究证明合生元可以改善免疫细胞功能。然而,研究也报道了不一致的结果。QUERO等[16]和QUERO-CALERO等[43]发现补充合生元对足球运动员和久坐不动个体的IL-6、IL-8、TNF-α水平没有显著影响。此外,CHEN等[44]给受试者补充含有枯草杆菌和XOS的合生元后免疫细胞因子IL-1β和TNF-α含量并没有显著变化。另外,COSTABILE等[45]给健康受试者补充含有鼠李糖乳杆菌GG、鼠李糖乳杆菌GG-PB12和可溶性玉米纤维后,促炎细胞因子IL-6产生减少。研究结果表明免疫效果可能因合生元种类和受试人群的不同、实验方案和评价指标的不一致而存在差异。
3 合生元对运动引起的黏膜免疫抑制的影响
3.1 合生元缓解运动引起的呼吸道粘膜免疫抑制
3.1.1 合生元降低运动员URTI的发生率及症状程度
多项研究证实补充合生元可以减少运动员URTI的发生率,并降低其症状的严重程度。COMAN等[46]给高强度健身专业人士补充包含鼠李糖乳酸杆菌IMC501®、副干酪乳杆菌IMC502®和燕麦麸纤维的合生元后,其URTI症状显著改善。另外,PREGLIASCO等[47]给健康成人服用合生元(植物乳杆菌、鼠李糖乳杆菌、乳酸双歧杆菌和益生元FOS)后,显著缩短了URTI的持续时间,并降低了URTI发生次数和症状的严重程度。此外,研究发现补充合生元可以降低健康受试者(婴儿和儿童)RTI和URTI的发生次数[48-49]与发生率[50-51]。以上结果均表明,合生元对改善URTI发生率、持续时间和症状严重程度起到积极作用,可能有助于减轻运动引起的URTI。
3.1.2 合生元改善运动员呼吸道黏膜免疫功能的机制
免疫球蛋白不仅是抵抗黏膜表面病原体、过敏原和抗原的第一道防线,也是黏膜免疫系统的重要指标[52]。免疫球蛋白包含IgG、IgA、IgM、IgD和IgE五大类,其中IgA在限制抗原通过黏膜上皮起主要作用,在黏膜免疫中发挥重要作用[53]。唾液中存在的IgA和SIgA(由唾液管和腺体附近的B细胞形成)由于易于收集而成为首选的黏膜免疫标志物。研究表明长时间的剧烈运动会导致唾液IgA和SIgA水平下降,呼吸道黏膜免疫功能降低。精英足球运动员在比赛后IgA下降了74.5%[54],马拉松运动员比赛后即刻IgA和IgM分泌率显著减少[55],篮球和越野滑雪运动员的SIgA分泌率和绝对浓度同样显著下降[56]。研究证实,低水平的IgA与发生URTI的风险相关。因此唾液中IgA和SIgA浓度有助于确定运动员是否过度训练以及是否易患URTI[57]。
由于合生元包含益生菌和益生元,与单独补充两者之一相比,合生元可能对受试者的健康产生不同或额外的影响。目前几项研究强调了合生元可通过提升唾液IgA和SIgA水平来改善运动员URTI的发生率和严重程度、增强黏膜免疫和呼吸道黏膜屏障完整性。COMAN等[46]发现高强度健身专业人士补充合生元可显著增加唾液SIgA水平和增强黏膜免疫功能。此外,DE GIANI等[58]发现服用合生元(嗜酸乳杆菌PBS066、植物乳杆菌PBS067、双歧杆菌BL050、菊粉和FOS)可以增加健康老年人唾液IgA的含量。值得注意的是,CHILDS等[41]给健康成年人服用合生元后,发现唾液IgA含量显著增加。基于此,合生元可能对免疫受抑制的运动员有益。但QUERO等[16]发现补充合生元后,足球运动员和久坐不动个体的唾液IgA水平没有显著变化。研究结果表明可能由于不同的研究选取的合生元种类和受试对象的不一致使实验结果存在差异。
3.2 合生元缓解运动引起的肠道黏膜免疫抑制
3.2.1 合生元改善胃肠道症状并增强肠黏膜屏障完整性
合生元被证明可以改善胃肠道症状。ROBERTS等[59]通过给长跑铁人三项运动员补充合生元(嗜酸乳杆菌CUL-60、嗜酸乳杆菌CUL-21、双歧杆菌CUL-20、动物双歧杆菌CUL-34和FOS),发现相比于安慰剂组,胃肠道症状发生率和严重程度均显著降低。此外,COMAN等[46]发现高强度健身专业人士补充合生元可以显著改善胃肠道症状严重程度和发生率。另外,PUCCIO等[60]给健康人群服用双歧杆菌BL999和益生元(GOS和FOS)后,发现胃肠道症状发生率显著降低。
研究发现合生元可以增强肠黏膜屏障完整性。REDDY等[61]给受试者补充含有益生菌嗜酸乳杆菌La5、保加利亚乳杆菌、乳双歧杆菌BB-12、嗜热链球菌和益生元FOS的合生元后,发现肠道屏障完整性得到增强。动物实验的结论也印证了这一作用,TAKAHASHI等[62]发现雄性大鼠补充合生元可以增强肠道屏障完整性。以上结果均表明补充合生元可以改善受试者胃肠道症状和增强肠黏膜屏障完整性。
3.2.2 合生元改善运动员肠黏膜免疫功能的机制
3.2.2.1 合生元可以提高SIgA水平
SIgA在肠道免疫中至关重要,可以反映肠道黏膜屏障的免疫功能。SIgA主要由胃肠道中的杯状细胞产生,在黏膜分泌物中大量存在[63]。其可以将毒素、病毒和致病细菌等包裹在黏液中,保护肠道上皮免受侵害,并通过蠕动和黏膜纤毛活动促使它们从肠腔排泄。所以SIgA是评价肠道黏膜屏障功能的重要指标。
增加肠道菌群中产生IgA细胞的数量,促进SIgA分泌是合生元改善肠道免疫功能的重要途径。LALITSURADEJ等[40]发现健康成年人服用合生元后血清IgA显著增加。动物实验发现了相似的结果,![]() 等[64]给受试者补充含有植物乳杆菌G1和β-葡聚糖的合生元后,血清中总免疫球蛋白水平显著升高。此外,LEVKUT等[65]给受试者服用合生元(淀粉芽孢杆菌CECT5940、屎肠球菌CECT4515、甘露寡糖和β-葡聚糖)后IgA水平显著高于对照组。另外,FRECE等[66]观察到雌性小鼠在服用合生元(瑞士乳杆菌M92、菊粉、乳果糖和棉子糖)后粪便SIgA和血清IgA浓度升高。综上所述,补充合生元可以提高宿主肠道SIgA水平,增强肠黏膜屏障完整性。但是,CHEN等[44]给受试者补充合生元后,机体SIgA和IgG含量并没有显著变化。研究结果表明不同受试人群服用合生元后补剂效果可能存在差异,但大多数研究仍可证明补充合生元可以提高IgA和SIgA水平,增强肠黏膜屏障完整性。
等[64]给受试者补充含有植物乳杆菌G1和β-葡聚糖的合生元后,血清中总免疫球蛋白水平显著升高。此外,LEVKUT等[65]给受试者服用合生元(淀粉芽孢杆菌CECT5940、屎肠球菌CECT4515、甘露寡糖和β-葡聚糖)后IgA水平显著高于对照组。另外,FRECE等[66]观察到雌性小鼠在服用合生元(瑞士乳杆菌M92、菊粉、乳果糖和棉子糖)后粪便SIgA和血清IgA浓度升高。综上所述,补充合生元可以提高宿主肠道SIgA水平,增强肠黏膜屏障完整性。但是,CHEN等[44]给受试者补充合生元后,机体SIgA和IgG含量并没有显著变化。研究结果表明不同受试人群服用合生元后补剂效果可能存在差异,但大多数研究仍可证明补充合生元可以提高IgA和SIgA水平,增强肠黏膜屏障完整性。
3.2.2.2 合生元可以改善肠道菌群
研究发现肠道微生物可以通过调节代谢物短链脂肪酸(short-chain fatty acids,SCFAs)和作用于T细胞影响免疫系统功能[67]。此外,微生物组成和多样性的改变与运动员胃肠道不适的发生率有关。研究发现剧烈运动可能会导致肠道细菌易位[68],肠道微生物群紊乱,肠黏膜屏障损伤,黏膜通透性增加,并诱发免疫抑制[69]。因此,维持肠道微生物群的稳态在增强宿主免疫方面起积极作用。
多项研究发现补充合生元可以改善肠道菌群。REDDY等[61]给受试者补充合生元后,发现肠道菌群异位发生率显著下降。COMAN等[46]在给健身专业人士补充合生元后,乳酸菌和双歧杆菌属含量显著增加。此外,VAN ZANTEN等[70]发现补充合生元还可以减少健康受试者粪便中葡萄球菌的丰度,增加乳酸杆菌、双歧杆菌等有益菌丰度。另外,WEST等[71]给自行车受试者服用合生元(含有益生菌副干酪乳杆菌431,动物双歧杆菌亚种BB-12,嗜酸乳杆菌LA-5,鼠李糖乳杆菌LGG和益生元筏状碱、筏状糖)后,发现粪便中有益菌副干酪乳杆菌是对照组的9倍。SERGEEV等[15]也同样发现健康成年人补充含有益生菌嗜酸乳杆菌DDS-1、乳酸双歧杆菌UABla-12、长双歧杆菌UABl-14、双歧杆菌UABb-10和益生元GOS的合生元后,改变了肠道微生物的相对丰度,其中一些有益菌(特别是双歧杆菌和乳酸菌)的丰度显著增加。值得注意的是,DE GIANI等[58]发现服用合生元有助于增加健康老年人肠道微生物乳酸杆菌和双歧杆菌的丰度。以上结果均表明补充合生元可以维持肠道微生物群的稳态,改善肠道菌群。
3.2.2.3 合生元可以提高SCFAs水平
适度的运动会增加微生物多样性和代谢产物,如SCFAs。SCFAs是由胃肠道膳食纤维的细菌发酵产生的主要代谢物[72],主要包含乙酸盐、丙酸盐和丁酸盐。SCFAs可以通过细胞表面G蛋白偶联受体(G protein-coupled receptors,GPCR),如GPR41、GPR43和GPR109A发出信号,以激活控制免疫功能的级联信号[73]。此外,微生物代谢物丁酸盐和丙酸盐作为肠上皮细胞的重要能量来源,可以减少黏膜降解,增强胃肠道黏膜屏障[74]。因此,适度运动有助于增强机体免疫力。但单次剧烈运动会使SCFAs水平下降(如丙酸)[75]。研究表明,只需10 min高强度运动即可发生肠缺血,导致TJ蛋白的组织分解和破坏,脂多糖(lipopolysaccharide,LPS)浓度升高诱导肠道通透性增大,抑制免疫功能[76]。
合生元可以通过增加SCFAs水平、降低LPS浓度、上调TJ蛋白表达等途径来改善肠黏膜屏障,增强机体免疫功能。ROBERTS等[59]给长跑铁人三项运动员补充合生元后,发现LPS浓度显著减少。同样,VAN ZANTEN等[70]发现补充合生元可以增加健康受试者SCFAs水平,特别是乙酸和丁酸。此外,LALITSURADEJ等[40]发现健康成年人服用合生元后粪便SCFAs(乙酸盐和丙酸盐)明显增加,血清LPS显著减少。动物实验同样发现了相似的结果,OH等[77]发现小鼠补充含有益生菌加氏乳杆菌505和新益生元柘木叶提取物的合生元可以上调肠黏膜屏障标志物TJ蛋白的表达,并且增加了SCFAs的含量。以上研究均表明补充合生元可以提高SCFAs水平,进而增强肠黏膜屏障。
4 总结与展望
剧烈的运动会使运动员出现运动性免疫抑制,增加受感染的风险,进而可能影响运动表现的正常发挥。迄今为止,合生元已被证明可以通过提升IgA、SIgA和SCFAs水平,减少URTI和胃肠道症状发生率,上调TJ蛋白表达,促进Th1反应并降低Th2活性,维持肠道菌群稳态,增强肠黏膜屏障完整性(图1)而有助于运动员运动性免疫抑制的改善和免疫功能的提高(图2)。虽然合生元已被证明在运动领域有很大潜力,但截至目前以运动员为实验对象的研究数量仍然有限,并且多为男性耐力运动员,女性运动员的补剂效果尚需验证。此外,最优化补充计量(服用补剂时间、补充剂量和服用周期)还未明确。探索更多益生菌和益生元联合作用的补剂方案,更好地促进运动员免疫功能的提高可能是未来的研究方向。

图1 合生元对肠黏膜免疫影响示意图
Fig.1 Effects of synbiotics on intestinal mucosal immunity
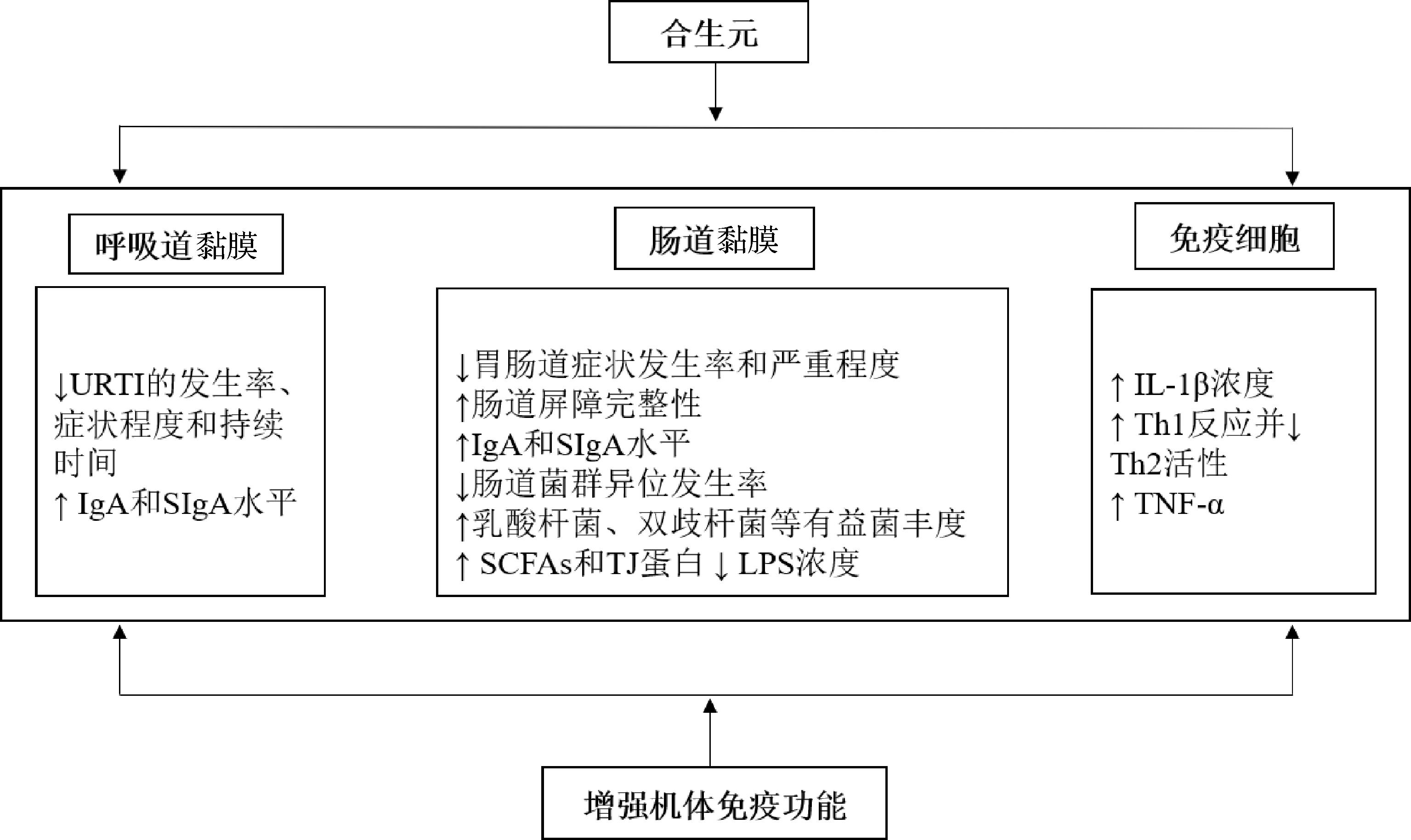
图2 合生元改善运动员免疫功能
Fig.2 Improvement of immune function of athletes by synbiotics
[1] CHASTIN S, ABARAOGU U, BOURGOIS J, et al. Physical activity, immune function and risk of community acquired infectious disease in the general population: Systematic review and meta-analysis[J]. SSRN Electronic Journal, 2020:1673-1686.
[2] SIMPSON R J, CAMPBELL J P, GLEESON M, et al. Can exercise affect immune function to increase susceptibility to infection?[J]. Exercise Immunology Review, 2020, 26:8-22.
[3] WALSH N P. Recommendations to maintain immune health in athletes[J]. European Journal of Sport Science, 2018, 18(6):820-831.
[4] TIERNAN C, LYONS M, COMYNS T, et al. Salivary IgA as a predictor of upper respiratory tract infections and relationship to training load in elite rugby union players[J]. Journal of Strength and Conditioning Research, 2020, 34(3):782-790.
[5] GLEESON M, BISHOP N, OLIVEIRA M, et al. Respiratory infection risk in athletes: Association with antigen-stimulated IL-10 production and salivary IgA secretion[J]. Scandinavian Journal of Medicine &Science in Sports, 2012, 22(3):410-417.
[6] WALSH N P. Nutrition and athlete immune health: New perspectives on an old paradigm[J]. Sports Medicine, 2019, 49(2):153-168.
[7] COLLINS J, MAUGHAN R J, GLEESON M, et al. UEFA expert group statement on nutrition in elite football. Current evidence to inform practical recommendations and guide future research[J]. British Journal of Sports Medicine, 2021, 55(8):416.
[8] LOSNO E A, SIEFERLE K, PEREZ-CUETO F J A, et al. Vegan diet and the gut microbiota composition in healthy adults[J]. Nutrients, 2021, 13(7):2402.
[9] SUZUKI K. Recent progress in applicability of exercise immunology and inflammation research to sports nutrition[J]. Nutrients, 2021, 13(12):4299.
[10] GLEESON M. Can nutrition limit exercise-induced immunodepression?[J]. Nutrition Reviews, 2006, 64(3):119-131.
[11] MARCO M L, SANDERS M E, G NZLE M, et al. The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on fermented foods[J]. Nature Reviews Gastroenterology &Hepatology, 2021, 18(3):196-208.
NZLE M, et al. The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on fermented foods[J]. Nature Reviews Gastroenterology &Hepatology, 2021, 18(3):196-208.
[12] SUEZ J, ZMORA N, SEGAL E, et al. The pros, cons, and many unknowns of probiotics[J]. Nature Medicine, 2019, 25(5):716-729.
[13] ![]() M, et al. Postbiotics-a step beyond pre- and probiotics[J]. Nutrients, 2020, 12(8):2189.
M, et al. Postbiotics-a step beyond pre- and probiotics[J]. Nutrients, 2020, 12(8):2189.
[14] GUO X Y, LAN Z X, WEN Y L, et al. Synbiotics supplements lower the risk of hand, foot, and mouth disease in children, potentially by providing resistance to gut microbiota dysbiosis[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11:729756.
[15] SERGEEV I N, ALJUTAILY T, WALTON G, et al. Effects of synbiotic supplement on human gut microbiota, body composition and weight loss in obesity[J]. Nutrients, 2020, 12(1):222.
[16] QUERO C D, MANONELLES P, FERN NDEZ M, et al. Differential health effects on inflammatory, immunological and stress parameters in professional soccer players and sedentary individuals after consuming a synbiotic. A triple-blinded, randomized, placebo-controlled pilot study[J]. Nutrients, 2021, 13(4):1321.
NDEZ M, et al. Differential health effects on inflammatory, immunological and stress parameters in professional soccer players and sedentary individuals after consuming a synbiotic. A triple-blinded, randomized, placebo-controlled pilot study[J]. Nutrients, 2021, 13(4):1321.
[17] SHARIF K, WATAD A, BRAGAZZI N L, et al. Physical activity and autoimmune diseases: Get moving and manage the disease[J]. Autoimmunity Reviews, 2018, 17(1):53-72.
[18] SHAW D M, MERIEN F, BRAAKHUIS A, et al. T-cells and their cytokine production: The anti-inflammatory and immunosuppressive effects of strenuous exercise[J]. Cytokine, 2018, 104:136-142.
[19] BISHOP E L, GUDGEON N, DIMELOE S. Control of T cell metabolism by cytokines and hormones[J]. Frontiers in Immunology, 2021, 12:653605.
[20] ZHAO G G, ZHOU S, DAVIE A, et al. Effects of moderate and high intensity exercise on T1/T2 balance[J]. Exercise Immunology Review, 2012, 18:98-114.
[21] MART NEZ-CAMPOS C, TORRES-POVEDA K, CAMORLINGA-PONCE M, et al. Polymorphisms in IL-10 and TGF-β gene promoter are associated with lower risk to gastric cancer in a Mexican population[J]. BMC Cancer, 2019, 19(1):453.
NEZ-CAMPOS C, TORRES-POVEDA K, CAMORLINGA-PONCE M, et al. Polymorphisms in IL-10 and TGF-β gene promoter are associated with lower risk to gastric cancer in a Mexican population[J]. BMC Cancer, 2019, 19(1):453.
[22] GLEESON M, BISHOP N, OLIVEIRA M, et al. Influence of training load on upper respiratory tract infection incidence and antigen-stimulated cytokine production[J]. Scandinavian Journal of Medicine &Science in Sports, 2013, 23(4):451-457.
[23] HANDZLIK M K, SHAW A J, DUNGEY M, et al. The influence of exercise training status on antigen-stimulated IL-10 production in whole blood culture and numbers of circulating regulatory T cells[J]. European Journal of Applied Physiology, 2013, 113(7):1839-1848.
[24] GLEESON M, BISHOP N C, STENSEL D J, et al. The anti-inflammatory effects of exercise: Mechanisms and implications for the prevention and treatment of disease[J]. Nature Reviews Immunology, 2011, 11(9):607-615.
[25] WEITNAUER M, MIJO EK V, DALPKE A H. Control of local immunity by airway epithelial cells[J]. Mucosal Immunology, 2016, 9(2):287-298.
EK V, DALPKE A H. Control of local immunity by airway epithelial cells[J]. Mucosal Immunology, 2016, 9(2):287-298.
[26] NIEMAN D C, HENSON D A, AUSTIN M D, et al. Upper respiratory tract infection is reduced in physically fit and active adults[J]. British Journal of Sports Medicine, 2011, 45(12):987-992.
[27] TAVARES-SILVA E, CARIS A V, SANTOS S A, et al. Effect of multi-strain probiotic supplementation on URTI symptoms and cytokine production by monocytes after a marathon race: A randomized, double-blind, placebo study[J]. Nutrients, 2021, 13(5):1478.
[28] KOMANO Y, SHIMADA K, NAITO H, et al. Efficacy of heat-killed Lactococcus lactis JCM 5805 on immunity and fatigue during consecutive high intensity exercise in male athletes: A randomized, placebo-controlled, double-blinded trial[J]. Journal of the International Society of Sports Nutrition, 2018, 15(1):39.
[29] GRIM C, HOTFIEL T, ENGELHARDT M, et al. Verletzungen und erkrankungen der deutschen mannschaft Bei den olympischen sommerspielen 2016 inRio de Janeiro[J]. Sportverletzung·Sportschaden, 2017, 31(1):25-30.
[30] MOUNTJOY M, JUNGE A, ALONSO J M, et al. Sports injuries and illnesses in the 2009 FINA World Championships (Aquatics)[J]. British Journal of Sports Medicine, 2010, 44(7):522-527.
[31] GLEESON M, PYNE D B. Respiratory inflammation and infections in high-performance athletes[J]. Immunology &Cell Biology, 2016, 94(2):124-131.
[32] MAILING L J, ALLEN J M, BUFORD T W, et al. Exercise and the gut microbiome: A review of the evidence, potential mechanisms, and implications for human health[J]. Exercise and Sport Sciences Reviews, 2019, 47(2):75-85.
[33] WALTER E, GIBSON O R, STACEY M, et al. Changes in gastrointestinal cell integrity after marathon running and exercise-associated collapse[J]. European Journal of Applied Physiology, 2021, 121(4):1179-1187.
[34] PFEIFFER B, STELLINGWERFF T, HODGSON A B, et al. Nutritional intake and gastrointestinal problems during competitive endurance events[J]. Medicine &Science in Sports &Exercise, 2012, 44(2):344-351.
[35] JEUKENDRUP A E, VET-JOOP K, STURK A, et al. Relationship between gastro-intestinal complaints and endotoxaemia, cytokine release and the acute-phase reaction during and after a long-distance triathlon in highly trained men[J]. Clinical Science, 2000, 98(1):47.
[36] PARNELL J A, WAGNER-JONES K, MADDEN R F, et al. Dietary restrictions in endurance runners to mitigate exercise-induced gastrointestinal symptoms[J]. Journal of the International Society of Sports Nutrition, 2020, 17(1):32.
[37] VAN WIJCK K, LENAERTS K, VAN BIJNEN A A, et al. Aggravation of exercise-induced intestinal injury by Ibuprofen in athletes[J]. Medicine and Science in Sports and Exercise, 2012, 44(12):2257-2262.
[38] COSTA R J S, SNIPE R, CAM ES-COSTA V, et al. The impact of gastrointestinal symptoms and dermatological injuries on nutritional intake and hydration status during ultramarathon events[J]. Sports Medicine-Open, 2016, 2:16.
ES-COSTA V, et al. The impact of gastrointestinal symptoms and dermatological injuries on nutritional intake and hydration status during ultramarathon events[J]. Sports Medicine-Open, 2016, 2:16.
[39] SZYMANSKI M C, GILLUM T L, GOULD L M, et al. Short-term dietary curcumin supplementation reduces gastrointestinal barrier damage and physiological strain responses during exertional heat stress[J]. Journal of Applied Physiology, 2018, 124(2):330-340.
[40] LALITSURADEJ E, SIRILUN S, SITTIPRAPAPORN P, et al. The effects of synbiotics administration on stress-related parameters in Thai subjects-a preliminary study[J]. Foods, 2022, 11(5):759.
[41] CHILDS C E, RÖYTIÖ H, ALHONIEMI E, et al. Xylo-oligosaccharides alone or in synbiotic combination with Bifidobacterium animalis subsp. lactis induce bifidogenesis and modulate markers of immune function in healthy adults: A double-blind, placebo-controlled, randomised, factorial cross-over study[J]. British Journal of Nutrition, 2014, 111(11):1945-1956.
[42] LÉPINE A, DE VOS P. Synbiotic effects of the dietary fiber long-chain inulin and probiotic Lactobacillus acidophilus W37 can be caused by direct, synergistic stimulation of immune toll-like receptors and dendritic cells[J]. Molecular Nutrition &Food Research, 2018, 62(15): e1800251.
[43] QUERO-CALERO C D, ABELL N-AYNÉS O, MANONELLES P, et al. The consumption of a synbiotic does not affect the immune, inflammatory, and sympathovagal parameters in athletes and sedentary individuals: A triple-blinded, randomized, place-bo-controlled pilot study[J]. International Journal of Environmental Research and Public Health, 2022, 19(6):3421.
N-AYNÉS O, MANONELLES P, et al. The consumption of a synbiotic does not affect the immune, inflammatory, and sympathovagal parameters in athletes and sedentary individuals: A triple-blinded, randomized, place-bo-controlled pilot study[J]. International Journal of Environmental Research and Public Health, 2022, 19(6):3421.
[44] CHEN Y P, CHENG Y F, WEN C, et al. Effects of dietary synbiotic supplementation as an alternative to antibiotic on the growth performance, carcass characteristics, meat quality, immunity, and oxidative status of cherry valley ducks[J]. The Journal of Poultry Science, 2018, 55(3):182-189.
[45] COSTABILE A, BERGILLOS-MECA T, RASINKANGAS P, et al. Effects of soluble corn fiber alone or in synbiotic combination with Lactobacillus rhamnosus GG and the Pilus-deficient derivative GG-PB12 on fecal microbiota, metabolism, and markers of immune function: A randomized, double-blind, placebo-controlled, crossover study in healthy elderly (saimes study)[J]. Frontiers in Immunology, 2017, 8:1443.
[46] COMAN M, VERDENELLI M, SILVI S, et al. Knowledge and acceptance of functional foods: A preliminary study on influence of a synbiotic fermented milk on athlete health[J]. International Journal of Probiotics and Prebiotics, 2017, 12: 33-34.
[47] PREGLIASCO F, ANSELMI G, FONTE L, et al. A new chance of preventing winter diseases by the administration of synbiotic formulations[J]. Journal of Clinical Gastroenterology, 2008, 42(Suppl 3 Pt 2): S224-S233.
[48] CAZZOLA M, PHAM-THI N, KERIHUEL J C, et al. Efficacy of a synbiotic supplementation in the prevention of common winter diseases in children: A randomized, double-blind, placebo-controlled pilot study[J]. Therapeutic Advances in Respiratory Disease, 2010, 4(5):271-278.
[49] PANIGRAHI P, PARIDA S, NANDA N C, et al. A randomized synbiotic trial to prevent sepsis among infants in rural India[J]. Nature, 2017, 548(7668):407-412.
[50] KUKKONEN K, SAVILAHTI E, HAAHTELA T, et al. Long-term safety and impact on infection rates of postnatal probiotic and prebiotic (synbiotic) treatment: Randomized, double-blind, placebo-controlled trial[J]. Pediatrics, 2008, 122(1):8-12.
[51] PICAUD J C, CHAPALAIN V, PAINEAU D, et al. Incidence of infectious diseases in infants fed follow-on formula containing synbiotics: An observational study[J]. Acta Paediatrica, 2010, 99(11):1695-1700.
[52] GLEESON M. Mucosal immune responses and risk of respiratory illness in elite athletes[J]. Exercise Immunology Review, 2000, 6:5-42.
[53] CHEN K, MAGRI G, GRASSET E K, et al. Rethinking mucosal antibody responses: IgM, IgG and IgD join IgA[J]. Nature Reviews Immunology, 2020, 20(7):427-441.
[54] PE AILILLO L, MAYA L, NI
AILILLO L, MAYA L, NI O G, et al. Salivary hormones and IgA in relation to physical performance in football[J]. Journal of Sports Sciences, 2015, 33(20):2080-2087.
O G, et al. Salivary hormones and IgA in relation to physical performance in football[J]. Journal of Sports Sciences, 2015, 33(20):2080-2087.
[55] SHEPHARD R J. Upper respiratory tract infection symptoms in ultramarathon runners not related to immunoglobulin status[J]. Yearbook of Sports Medicine, 2010, 2010:258-260.
[56] HE C S, TSAI M L, KO M H, et al. Relationships among salivary immunoglobulin A, lactoferrin and cortisol in basketball players during a basketball season[J]. European Journal of Applied Physiology, 2010, 110(5):989-995.
[57] RICO-GONZ LEZ M, CLEMENTE F M, OLIVEIRA R, et al. Part I: Relationship among training load management, salivary immunoglobulin A, and upper respiratory tract infection in team sport: A systematic review[J]. Healthcare, 2021, 9(4):366.
LEZ M, CLEMENTE F M, OLIVEIRA R, et al. Part I: Relationship among training load management, salivary immunoglobulin A, and upper respiratory tract infection in team sport: A systematic review[J]. Healthcare, 2021, 9(4):366.
[58] DE GIANI A, SANDIONIGI A, ZAMPOLLI J, et al. Effects of inulin-based prebiotics alone or in combination with probiotics on human gut microbiota and markers of immune system: A randomized, double-blind, placebo-controlled study in healthy subjects[J]. Microorganisms, 2022, 10(6):1256.
[59] ROBERTS J D, SUCKLING C A, PEEDLE G Y, et al. An exploratory investigation of endotoxin levels in novice long distance triathletes, and the effects of a multi-strain probiotic/prebiotic, antioxidant intervention[J]. Nutrients, 2016, 8(11):733.
[60] PUCCIO G, CAJOZZO C, MELI F, et al. Clinical evaluation of a new starter formula for infants containing live Bifidobacterium longum BL999 and prebiotics[J]. Nutrition, 2007, 23(1):1-8.
[61] REDDY B S, MACFIE J, GATT M, et al. Randomized clinical trial of effect of synbiotics, neomycin and mechanical bowel preparation on intestinal barrier function in patients undergoing colectomy[J]. The British Journal of Surgery, 2007, 94(5):546-554.
[62] TAKAHASHI R, NOGUCHI T, MIZOGUCHI Y, et al. A synbiotic with tumor necrosis factor-α Inhibitory activity ameliorates experimental jejunoileal mucosal injury[J]. BioMed Research International, 2018, 2018:1-12.
[63] LIAO L Y, LI J, LI J, et al. Effects of Astragalus polysaccharides on intestinal morphology and intestinal immune cells of Muscovy ducklings infected with Muscovy duck reovirus[J]. Poultry Science, 2021, 100(1):64-72.
[64] KAZUN B, MALACZEWSKA J, KAZUN K, et al. Dietary administration of beta-1,3/1,6-glucan and Lactobacillus plantarum improves innate immune response and increases the number of intestine immune cells in roach (Rutilus rutilus) [J]. BMC Veterinary Research, 2020, 16(1): 216.
[65] LEVKUT M, KARAFFOV V, LEVKUTOV
V, LEVKUTOV M, et al. Influence of Lacto-Immuno-Vital on growth performance and gene expression of IgA, MUC-2, and growth factor IGF-2 in the jejunum of broiler chickens[J]. Poultry Science, 2020, 99(12):6569-6575.
M, et al. Influence of Lacto-Immuno-Vital on growth performance and gene expression of IgA, MUC-2, and growth factor IGF-2 in the jejunum of broiler chickens[J]. Poultry Science, 2020, 99(12):6569-6575.
[66] FRECE J, KOS B, SVETEC I K, et al. Synbiotic effect of Lactobacillus helveticus M92 and prebiotics on the intestinal microflora and immune system of mice[J]. Journal of Dairy Research, 2009, 76(1):98-104.
[67] KABAT A M, SRINIVASAN N, MALOY K J. Modulation of immune development and function by intestinal microbiota[J]. Trends in Immunology, 2014, 35(11):507-517.
[68] PATEL B K, PATEL K H, BHATIA M, et al. Gut microbiome in acute pancreatitis: A review based on current literature[J]. World Journal of Gastroenterology, 2021, 27(30):5019-5036.
[69] SHIMIZU K, OJIMA M, OGURA H. Gut microbiota and probiotics/synbiotics for modulation of immunity in critically ill patients[J]. Nutrients, 2021, 13(7):2439.
[70] VAN ZANTEN G C, KNUDSEN A, RÖYTIÖ H, et al. The effect of selected synbiotics on microbial composition and short-chain fatty acid production in a model system of the human colon[J]. PLoS One, 2012, 7(10): e47212.
[71] WEST N P, PYNE D B, CRIPPS A W, et al. Gut Balance, a synbiotic supplement, increases fecal Lactobacillus paracasei but has little effect on immunity in healthy physically active individuals[J]. Gut Microbes, 2012, 3(3):221-227.
[72] DALILE B, VAN OUDENHOVE L, VERVLIET B, et al. The role of short-chain fatty acids in microbiota-gut-brain communication[J]. Nature Reviews. Gastroenterology &Hepatology, 2019, 16(8):461-478.
[73] PARADA VENEGAS D, DE LA FUENTE M K, LANDSKRON G, et al. Short chain fatty acids (SCFAs)-mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases[J]. Frontiers in Immunology, 2019, 10:277.
[74] ZHAO J B, HU J H, MA X. Sodium caprylate improves intestinal mucosal barrier function and antioxidant capacity by altering gut microbial metabolism[J]. Food &Function, 2021, 12(20):9750-9762.
[75] PATRICIA R I, MALÉN M C, RODR GUEZ LAGUNAS MARIA J, et al. A cocoa diet can partially attenuate the alterations in microbiota and mucosal immunity induced by a single session of intensive exercise in rats[J]. Frontiers in Nutrition, 2022, 9:861533.
GUEZ LAGUNAS MARIA J, et al. A cocoa diet can partially attenuate the alterations in microbiota and mucosal immunity induced by a single session of intensive exercise in rats[J]. Frontiers in Nutrition, 2022, 9:861533.
[76] ZUHL M, SCHNEIDER S, LANPHERE K, et al. Exercise regulation of intestinal tight junction proteins[J]. British Journal of Sports Medicine, 2014, 48(12):980-986.
[77] OH N S, LEE J Y, KIM Y T, et al. Cancer-protective effect of a synbiotic combination between Lactobacillus gasseri 505 and a Cudrania tricuspidata leaf extract on colitis-associated colorectal cancer[J]. Gut Microbes, 2020, 12(1):1785803.