芽孢杆菌可形成内生芽孢,芽孢的形成是菌体对环境中营养物质的消耗产生的细胞反应,通常在细胞密度较高、营养匮乏的情况下触发。营养体出于自我保护的目的发生休眠,形成不具有代谢活力的芽孢,从而获得了对热、辐射、干燥、极端pH值及毒性化学物质的高抗性[1]。休眠状态下的芽孢依然能够监测周围环境,并在环境条件适宜时萌发,最终恢复到具有正常代谢能力的营养体状态,继续生长。芽孢杆菌属(Bacillus spp.)常于粮油制品与乳制品中检出,罐头制品也是受到芽孢污染的主要食品种类[2]。例如,在乳制品生产中,耐热芽孢杆菌在热交换器与浓缩器上附着并形成芽孢[3],能在超高温灭菌工艺后残存,并最终进入产品中。可见在食品的生产过程中,芽孢有较大可能抵抗加工工艺中的杀菌处理,并在合适的环境条件中萌发生长,产生腐败酶或毒素等,导致食品腐败甚至食源性疾病的发生[4-5]。
自然界中的芽孢杆菌进入食品生产链后会面对复杂多样的环境,所处环境条件与基质成分的不同不仅会在杀菌处理时阻碍或促进杀菌效果,还会对残存芽孢杆菌的修复与生长产生影响。嗜热脂肪芽孢杆菌在培养基中的热抗性较在蒸馏水中明显更高[6],不同食品中同一菌株对超高压协同热处理的失活率也存在差异[7]。因此可能导致芽孢残存,其在适宜温度下可以在营养丰富的乳制品中获得修复并萌发增殖,而在部分pH值较低的食品中,则可能发生进一步的衰亡。
环境基质不仅影响着芽孢杆菌的消长趋势,还影响着芽孢杆菌菌体的生理状态演变。芽孢的形成伴随Spo0A蛋白的磷酸化启动,至形成具有复杂且织密膜结构的芽孢体结束。此时芽孢内膜的渗透性低、核内水分含量低且吡啶二羧酸(dipicolinic acid,DPA)含量高,使其核内酶与DNA对热及化学物质具有较强的抗性[8]。而在芽孢萌发时,细胞会发生核内物质泄漏、膜结构通透性增加等一系列变化,营养体恢复代谢与增殖能力,抗性降低。然而,因芽孢形成与萌发时所处基质与环境条件不同,芽孢的形成速度[9]与抗逆性[10],萌发的速度所形成营养体的代谢能力等也都会受到影响。了解不同因素对芽孢杆菌状态演变的影响,才能更好地根据其抗性的变化在生产中进行控制。
现有工作中对影响芽孢热杀菌效果的因素研究较多,环境pH和水分活度(water activity, Aw)对不同细菌生理状态与热抗性的影响是本领域研究经常考虑的因素,近年来也不乏关于常见食品组分与芽孢杆菌热失活表现的探讨,国内亦有对应的文献综述[11];对于芽孢的形成,除环境条件外,二价阳离子对芽孢形成的影响研究较多;而对于芽孢的萌发过程,现有报道更多集中在不同萌发手段的作用效果与作用通路上,少有关于形成条件影响芽孢性质的定量研究。本文整合了现有研究中芽孢在形成、萌发与热失活3个阶段中所处环境基质的不同影响,将环境条件如温度、pH、Aw与基质中主要的几种成分(蛋白质、糖类、脂肪、金属阳离子、磷酸盐)的作用进行分类讨论,旨在补充阐明各环境因素对芽孢杆菌状态演变及热抗性的综合性作用,为芽孢杆菌在食品基质中的进一步研究提供理论参考。
1 环境条件对芽孢杆菌状态演变及热抗性的影响
众所周知,温度是影响细菌生理状态的重要因素,但当芽孢杆菌处于同样的温度下时,环境pH值与Aw则对芽孢杆菌的状态演变进程与菌体抗逆性影响显著。
1.1 温度
温度对芽孢的形成与后续抗性都有至关重要的作用。在一定的范围内,提高芽孢形成温度可使芽孢核内水分含量降低,从而提高芽孢的热抗性[12],而在超过一定温度后,所形成的芽孢的抗性逐渐降低。如在一项针对蜡样芽孢杆菌的研究中,最适温度下的成孢速率虽然更快,但芽孢的质量与抗性则不如次优温度下形成的芽孢[13]。然而,在一项关于不同成孢温度对热失活影响的建模研究中[14],成孢温度虽然影响了热失活速率,但对菌株热失活的z值并无显著影响,因此可以推测成孢温度的影响与芽孢热失活的机制无关。
前热处理与萌发时的温度对萌发能力也有很大的影响。总体来说,芽孢能够萌发的温度范围与菌株的最适生长温度范围近似。对于前热处理而言,适当的热激活处理能够极大地刺激营养因子诱导芽孢萌发的效率[15],但同时一项针对梭菌芽孢的研究表明,在亚致死热处理后,芽孢萌发生长的条件将受到限制,能够允许芽孢萌发的pH与NaCl浓度范围会缩小[16]。
1.2 pH
芽孢形成时的基质pH对芽孢形成速度、芽孢终产量与形成芽孢的热抗性有着显著性影响。许多研究表明基质酸度的增加阻碍了芽孢的形成,MTIMET等[17]研究显示,嗜热脂肪地芽孢杆菌在pH 6.34的液体培养基中形成的芽孢终产量显著高于在pH 5.83与pH 7.94中的形成的终产量,通过对比D115℃,发现在pH 5.83~7.10环境下形成芽孢的热抗性显著高于在pH 7.95下所形成芽孢的热抗性。BARIL等[9]的研究与上述结论相符,随基质pH降低,韦氏芽孢杆菌与地衣芽孢杆菌的芽孢终产量显著减少,且形成最高热抗性芽孢的产孢pH近于该菌的最适生长pH。基质酸度的增加使形成芽孢抗性下降的现象在其他研究中得到了佐证,对耐热芽孢杆菌来说,当基质pH上升时,所形成芽孢对Nisin结合热处理的抗性显著提高[18]。成孢pH对芽孢热抗性的影响很有可能是由酸性环境中的质子置换出了与DPA结合的二价阳离子,使得质子化的蛋白质更容易受热变性而导致的[19],同时,原生质体再水化、芽孢皮层体积减小等形态变化也促使低pH下芽孢抗性降低[20]。值得注意的是,虽然芽孢形成时的基质pH影响了其对热及其他处理的抗性,但目前所有研究均表明芽孢的热敏感性独立于芽孢形成条件的影响。
基质pH还能够影响芽孢萌发能力以及萌发后菌体的代谢活力及抗性。对于在食品加工中受到热处理的芽孢来说,基质pH作用于菌体,并能影响其修复萌发能力。TRUNET等[21]使用双重染色的方法观察不同萌发阶段的芽孢,发现热处理后的芽孢在pH 7.4环境中的萌发比例比在pH 5.5中更高,说明酸性条件降低了该菌芽孢的修复萌发能力。类似地,MTIMET等[17]对嗜热脂肪地芽孢杆菌在不同pH与温度下的修复进行动力学研究,结果表明最适pH值为7.75,且在最适范围外,随pH降低,菌体热抗性下降。基质中有机酸或高浓度盐的存在,以协同作用的方式加强了芽孢的热失活效果,对热损伤芽孢的生存有显著影响[22]。对多株芽孢杆菌进行研究发现,若热处理后的残余芽孢处于亚致死pH环境中,长期来看,其数量几乎全部出现明显下降,但失活速率受到菌株性质与亚致死条件影响[23]。另一项研究也印证了这一点:嗜热脂肪地芽孢杆菌芽孢在不同pH与温度组合下进行热处理并在非最适条件下保存,随保存时间延长,样品均发生后续失活,逐渐丧失在琼脂平板上修复生长的能力,其间在中性条件下进行热处理的芽孢对不利保存条件的抗性更强[24]。利用流式细胞仪及核酸染色技术,可以发现在酸性条件下进行热处理后,芽孢中敏感亚群的比例更高,导致后续对不利保存条件的抗性降低[25]。与温度的作用类似,低pH也对芽孢萌发的其他条件造成了限制,缩小了芽孢杆菌能够生长的温度范围[26]。关于低pH影响芽孢萌发的原因,CIARCIAGLINI等[27]提出,酸性环境可以改变氨基酸侧链的电离状态从而改变电荷分布、氢键与蛋白质结构,许多蛋白质在pH<5时展开,从而显著降低了芽孢的萌发能力。
1.3 Aw
所处基质的Aw对芽孢的形成、萌发及其抗逆性均有作用。芽孢形成的时间与终产量受到Aw的影响,对于枯草芽孢杆菌来说,在Aw为0.993的培养条件下,4 d内芽孢浓度即可达到9×109 spore/mL,而在Aw 0.950下,经17天培养后芽孢浓度也仅有3×107 spore/mL[28];韦氏芽孢杆菌与地衣芽孢杆菌芽孢浓度也在培养基质Aw上升至0.996后,出现了多个数量级的增加[9]。而Aw对芽孢萌发的作用则体现在,造成Aw变化的保湿剂分子与芽孢内膜间的作用能够阻碍芽孢核内DPA的泄漏,从而使其对激活萌发与失活的热与高压处理具有了更高的抗性,抑制了此情况下的萌发[29]。SAMAPUNDO[30]测定了芽孢在不同Aw、pH与温度组合下的失活与萌发生长情况,证明当Aw降低时,热激活诱导的芽孢萌发延滞期总体增长,所需萌发温度要求变高。降低Aw也阻碍了芽孢的热失活效果,当Aw由0.99降至0.92时,热与高压协同诱导的蜡样芽孢杆菌芽孢萌发与失活数量均降低几个数量级[31];LEGUERIAL等[32]报道了使用蔗糖作为保湿剂降低Aw时,随蔗糖含量增加,蜡样芽孢杆菌芽孢热抗性提高,相似的结果在对嗜热脂肪地芽孢杆菌、解淀粉芽孢杆菌,以及芽孢杆菌营养体的研究中也被证明;在生物膜中的芽孢热抗性往往也高于浮游芽孢[33],且湿法培养的生物膜中芽孢虽生成速率不如在干法生物膜中快,但由于培养环境Aw更高,其热抗性也更强[34]。而对于射频加热处理,由于Aw越高介电损耗系数就越高,样品所吸收的射频能量也增多,但温度的上升与样品的热性能也有关,因此随所处基质Aw的升高,射频加热灭菌效果先增后减[35]。
Aw对芽孢杆菌状态演变及抗性的作用效果还受不同保湿剂间差异的影响。对耐热芽孢杆菌来说,在添加NaCl的培养基中形成的芽孢,在热处理后所降低的数量更少,而添加甘油虽然同样降低了Aw,却未对热失活效果造成显著影响[18];然而,JACOBSEN等[36]的研究结果与上述不同,无论使用甘油、山梨醇还是NaCl作为保湿剂,Aw的变化都不对芽孢的热抗性造成影响。不同保湿剂对芽孢萌发的抑制效果也有所差异,一项对枯草芽孢杆菌、蜡样芽孢杆菌与巨大芽孢杆菌的萌发动力学研究[37]发现,几种保湿剂按对萌发的抑制与对热失活的阻碍效果由强到弱排序都为蔗糖>海藻糖>甘油,但对巨大芽孢杆菌来说,或由于蔗糖被糖苷酶分解为大量葡萄糖,添加蔗糖反而刺激并加速了其芽孢的萌发。
保湿剂抑制芽孢萌发的作用机理因刺激芽孢萌发的方式不同而存在差异(图1)[1]。有研究表明,低Aw对营养萌发的影响主要作用于早期萌发启动(commitment)阶段,保湿剂的加入延后了芽孢开始泄漏DPA的时间,其中,蔗糖的加入还增加了此段过程的DPA泄漏量,但甘油却未引起该现象的发生,这可能是由于芽孢内膜对二者的渗透性不同造成的[38]。通常来说,营养萌发中萌发受体与萌发剂的结合需要水分的参与,而蔗糖的加入使芽孢膜结构对水分的渗透性变弱,使萌发受体不易结合,进而阻碍了芽孢的萌发。而对于外源2,6吡啶二羧酸钙(Ca2+-DPA)与十二烷胺等萌发剂诱导的非营养萌发来说,当环境中保湿剂浓度较高,则萌发剂的溶解度降低,因此不利于芽孢的萌发。此外,某些萌发因子与保湿剂间的相互作用也会影响萌发进程。高压对芽孢萌发的诱导作用分为两种,在相对较低压下,压力处理促进营养萌发受体结合,而较高压下则促进Ca2+-DPA泄漏通道的开启[39-40]。其中,蔗糖对高压诱导萌发的抑制作用比甘油显著,但在较低压(150 MPa)下其对压力诱导的营养萌发作用不显著。
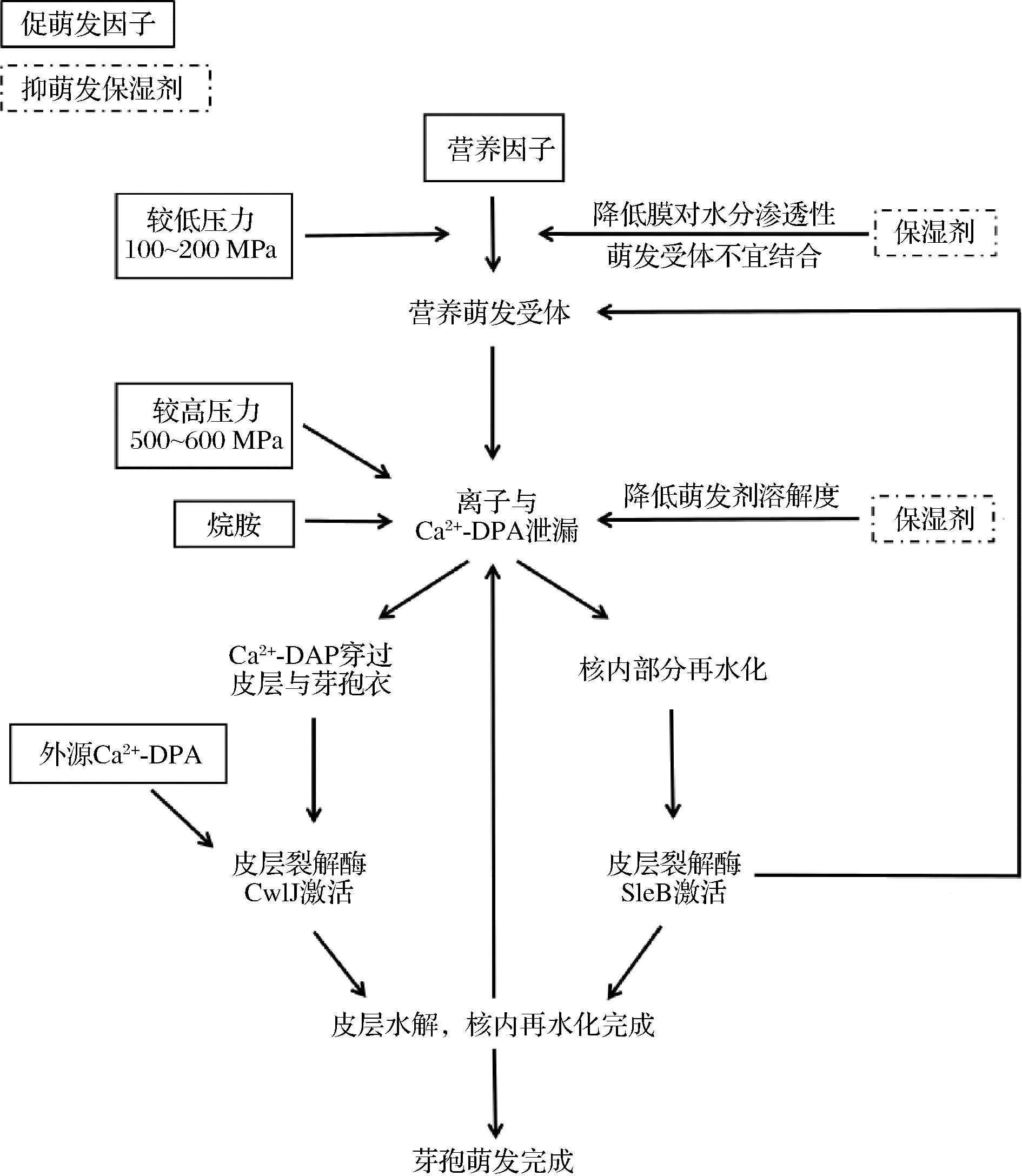
图1 萌发过程中触发因素与保湿剂作用示意图[1]
Fig.1 The role of germination trigger factors and humectants during germination
对影响芽孢杆菌生理性质的环境基质进行了总结,如表1所示。
表1 环境基质对芽孢杆菌生理性质的影响
Table 1 The effects of ambient matrix on the physiological properties of Bacillus spp.
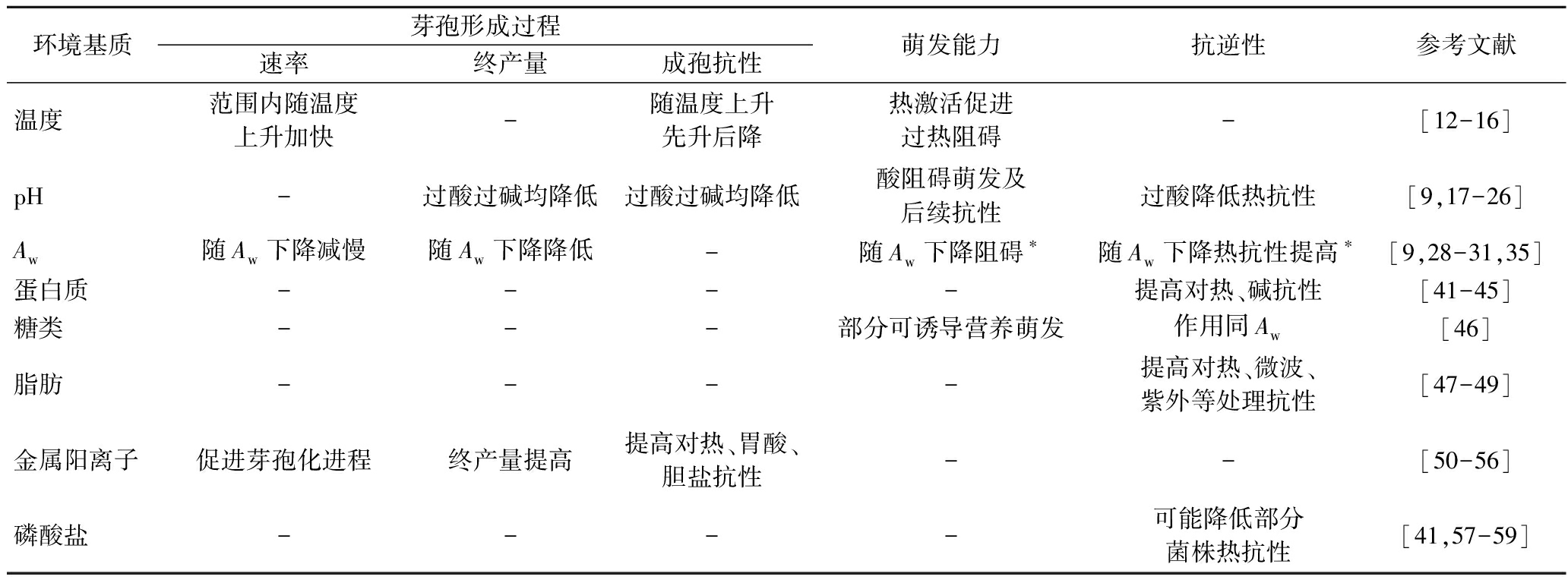
环境基质芽孢形成过程速率终产量成孢抗性萌发能力抗逆性参考文献温度范围内随温度上升加快-随温度上升先升后降热激活促进过热阻碍-[12-16]pH-过酸过碱均降低过酸过碱均降低酸阻碍萌发及后续抗性过酸降低热抗性[9,17-26]Aw随Aw下降减慢随Aw下降降低-随Aw下降阻碍∗随Aw下降热抗性提高∗[9,28-31,35]蛋白质----提高对热、碱抗性[41-45]糖类---部分可诱导营养萌发作用同Aw[46]脂肪----提高对热、微波、紫外等处理抗性[47-49]金属阳离子促进芽孢化进程终产量提高提高对热、胃酸、胆盐抗性--[50-56]磷酸盐----可能降低部分菌株热抗性[41,57-59]
注:“-”代表现有研究未有确切结论;“*”代表此过程还受到保湿剂种类影响。
2 基质成分对芽孢杆菌状态演变及热抗性的影响
关于不同基质成分对芽孢杆菌生理状态的影响,已有研究各有侧重。蛋白质、脂肪、糖类等分别对芽孢对热等因素的抗逆性有影响,而芽孢的形成则在营养匮乏的条件下发生,因此少见基质营养成分对芽孢形成影响的研究。部分二价金属阳离子能显著促进芽孢的形成,并增强所形成芽孢的抗性。磷酸盐的存在能影响芽孢结构的稳定性,从而影响热失活效果。
2.1 营养成分
基质蛋白质含量影响着芽孢对热及碱处理的抗性。STOECKEL等[41]等将16株芽孢杆菌产生的芽孢在牛奶与磷酸盐缓冲液中于不同温度下进行处理,结果显示牛奶对芽孢的失活具有阻碍作用。另有研究显示脱脂牛奶浓缩物与脱脂牛奶间的芽孢热抗性具有明显差异,当干物质含量上升至30%时,芽孢在脱脂牛奶浓缩物中的湿热抗性显著增加[42]。乳清蛋白对此的作用机理仍需进一步研究,目前可能的推测为蛋白质受到高温加热时变性凝固,高浓度蛋白形成凝胶,紧密包裹在芽孢周围,一方面减缓了热的传递速度,另一方面蛋白质变性后与芽孢壁紧密结合,增加了芽孢壁层的厚度,使其热抗性进一步增强[43],还有研究表明随干物质浓度升高,而带来的Aw降低也可能是芽孢热抗性增加的原因[44]。基质蛋白质含量对碱处理造成的芽孢失活也有显著影响,这是因为碱性物质通过溶解芽孢壁上的蛋白质造成菌体结构破坏与失活,但这种使蛋白质变性的行为是不定向的,因此当基质中蛋白质含量增加时,菌体所受到的碱性物质攻击相对减少,因此抗性有所增加。在WEDEL等[45]的研究中,牛奶残留物质的存在显著阻碍了其中六株芽孢杆菌的NaOH失活效果。然而,基质中蛋白质含量的增加对酸造成的芽孢失活并无明显影响。
糖类与芽孢的萌发和热抗性有关。其对萌发的作用主要是因为糖类物质可作为碳源被微生物利用,同时部分糖类能够作为萌发因子诱导营养萌发[46]。而糖类对芽孢热抗性的影响多是通过改变Aw与细胞内外渗透压来进行的,已在1.3节中进行叙述,此处不另加讨论。
关于脂肪在热处理时对细菌的保护作用,现有研究存在争议。部分研究提出,基质中的脂肪能够降低联合热处理对非产芽孢细菌的损伤[47-48],并且,牛奶的脂肪含量越高,其中的蜡样芽孢杆菌对微波热处理及紫外杀菌处理的抗性就越强[49]。但除确认电阻加热中基质脂肪通过改变电导率使杀菌效果下降外,脂肪在热处理中保护菌体的机制尚不明确。脂肪是否除干扰Aw之外,还通过别的途径对芽孢起到保护作用,这一问题仍需进行深入研究。
2.2 金属阳离子
金属阳离子对芽孢的形成与形成芽孢的热抗性作用显著。芽孢的高热抗性来源于芽孢核内的低水分含量、金属阳离子与DPA累积导致的矿化作用以及小分子可溶性酸蛋白的高含量,在芽孢的形成过程中,需要环境基质提供Ca2+与核内DPA进行螯合,形成Ca2+-DPA储存在芽孢核内,以使芽孢核内的生命大分子物质形成稳定凝胶,提高其热抗性[50],且Ca2+也是芽孢形成中相关蛋白酶与蛋白水解酶重要的辅因子。在田晶晶等[51]的研究中,在凝结芽孢杆菌芽孢形成过程中添加碳酸钙,发现芽孢终产量显著增加,且形成芽孢对热、胃酸及胆盐的耐受能力均提高,同时碳酸钙对pH的调整作用还大幅提前了芽孢化启动的时间。Mn2+等离子作用于芽孢,能够使芽孢发生矿化作用,从而促进芽孢化进程并提高所产芽孢的热抗性[52],但Mn2+含量过高也会导致芽孢的热抗性降低[53]。另有研究表明,在培养基中加入Mg2+使菌体生长的营养体数量增加[54],也在一定程度上使形成的芽孢数量上升。WELLS-BENNIK等[55]研究8种培养基质(分别添加了Ca2+、K+、Mg2+与Mn2+)对18株嗜热脂肪地芽孢杆菌芽孢形成与热抗性的影响,发现在添加全部4种离子的琼脂上形成的芽孢热抗性最强,早前对枯草芽孢杆菌的研究结果与其一致[56]。这些研究都说明了不同的金属阳离子对芽孢形成具有促进作用。
2.3 磷酸盐
关于磷酸盐对芽孢热抗性的影响,现有研究结果各不相同。STOECKEL等[41]对比16株芽孢杆菌芽孢在磷酸盐缓冲液与牛奶中的热抗性,其中嗜热脂肪地芽孢杆菌在牛奶中的热抗性更高;但在其另一项研究中[57],一株蜡样芽孢杆菌芽孢在磷酸盐缓冲液与婴幼儿配方奶粉中对95 ℃热处理抗性表现相同,与此一致的还有DONG等[58]的研究,解淀粉芽孢杆菌芽孢在磷酸盐缓冲液、低脂与全脂牛奶中,在110 ℃热处理下热抗性无显著差异。许多研究都提及了磷酸盐对热抗性与菌体修复的不利影响,如KUMAR等[59]探究了磷酸盐对芽孢热抗性影响的作用机理:在中性条件下,芽孢热抗性随基质中磷酸盐含量的增加而降低,对芽孢失活过程中泄漏的Ca2+进行检测,以判断芽孢核内Ca2+-DPA的泄漏程度,发现随磷酸盐含量增加,Ca2+泄漏比例上升,说明磷酸盐是通过螯合并带离芽孢核内二价阳离子使芽孢热抗性降低的。
3 结论与展望
本文综述了部分环境条件与基质成分对芽孢杆菌状态演变及热抗性的影响。在菌体面临的环境条件中,温度、pH与Aw是最具有代表性的,也是对芽孢形成、萌发以及其热抗性都具有显著影响的因素。随pH与Aw降低,或在不适宜的温度下,芽孢形成速度减缓、产量降低、抗性变弱,萌发能力也受到影响。在食品基质的常见成分中,蛋白质、糖类与脂肪含量经常被进行组合研究,探究它们对菌体热失活时的保护作用,蛋白质还能够在碱性环境下保护菌体。基质中的金属离子通过加强芽孢核的矿化及合成Ca2+-DPA以促进芽孢的形成,并使产生的芽孢对热抗性增加;相反的,磷酸盐则使Ca2+-DPA发生泄漏,降低了芽孢的抗性。
关于环境基质对产芽孢细菌消长的影响,现有研究多集中在其对热失活的作用,还未系统建立产芽孢细菌在不同食品加工与贮存过程中的数量与状态连续变化的理解。基于此,本文从以下方面做出展望:其一,需要进一步研究环境基质因素在杀菌处理时对芽孢产生作用的细胞与分子机制,明确各因素在不同杀菌处理方式中是通过何种通路、在何种程度上对芽孢起到保护作用的;其二,应该针对残存芽孢在不同食品基质及保存条件下的状态分化,推进针对不同食品的热杀菌参数及货架期研究;其三,将芽孢诱导萌发后再杀灭是当前的研究热点,不同环境基质中芽孢的萌发能力与后续抗性有差异,可以根据这一点进行适当的萌发诱导,更高效地对细菌进行杀灭;其四,建议建立不同培养条件与基质中描述芽孢杆菌状态及菌数变化的动态模型,以更好地理解其消长趋势和对食品质量进行控制。
[1] SETLOW P.Spore germination[J].Current Opinion in Microbiology, 2003, 6(6):550-556.
[2] BURGESS S A, LINDSAY D, FLINT S H.Thermophilic bacilli and their importance in dairy processing[J].International Journal of Food Microbiology, 2010, 144(2):215-225.
[3] SCOTT S A, BROOKS J D, RAKONJAC J, et al.The formation of thermophilic spores during the manufacture of whole milk powder[J].International Journal of Dairy Technology, 2007, 60(2):109-117.
[4] KALOGRIDOU-VASSILIADOU D.Biochemical activities of Bacillus species isolated from flat sour evaporated milk[J].Journal of Dairy Science, 1992, 75(10):2681-2686.
[5] STENFORS ARNESEN L P, FAGERLUND A, GRANUM P E.From soil to gut:Bacillus cereus and its food poisoning toxins[J].FEMS Microbiology Reviews, 2008, 32(4):579-606.
[6] ETOA F X, MICHIELS L.Heat-induced resistance of Bacillus stearothermophilus spores[J].Letters in Applied Microbiology, 1988, 6(3):43-45.
[7] 武玉艳, 李汴生, 阮征, 等.热协同超高压对不同介质中嗜热脂肪芽孢杆菌芽孢的灭活作用[J].食品与发酵工业, 2009, 35(4):5-9. WU Y Y, LI B S, RUAN Z, et al.Inactivation effect of high pressure combined heating on Bacillus stearothermophilus spores in different medium[J].Food and Fermentation Industries, 2009, 35(4):5-9.
[8] STORZ G, HENGGE R.Bacterial Stress Responses[M].2nd ed.Washington:ASM press, 2011:319-332.
[9] BARIL E, COROLLER L, COUVERT O, et al.Sporulation boundaries and spore formation kinetics of Bacillus spp.as a function of temperature, pH and Aw[J].Food Microbiology, 2012, 32(1):79-86. [10] MOELLER R, WASSMANN M, REITZ G, et al.Effect of radioprotective agents in sporulation medium on Bacillus subtilis spore resistance to hydrogen peroxide, wet heat and germicidal and environmentally relevant UV radiation[J].Journal of Applied Microbiology, 2011, 110(6):1485-1494.
[11] 马相杰, 宋莲军, 黄现青, 等.肉制品主要组分对嗜热脂肪芽孢杆菌耐热性影响研究进展[J].食品安全质量检测学报, 2020, 11(24):9275-9280. MA X J, SONG L J, HUANG X Q, et al.Research progress on the influence of main components of meat products on the heat resistance of Bacillus stearothermophilus[J].Journal of Food Safety &Quality, 2020, 11(24):9275-9280.
[12] MELLY E, GENEST P C, GILMORE M E, et al.Analysis of the properties of spores of Bacillus subtilis prepared at different temperatures[J].Journal of Applied Microbiology, 2020, 92(6):1105-1115.
[13] MARIA V, ANELLA S, GIOVANNI D G B, et al. Sporulation efficiency and spore quality in a human intestinal isolate of Bacillus cereus[J]. Research in Microbiology, 2023, 174(6):104030.
[14] RUIZ V, ALONSO R, MA AS P, et al.Geobacillus stearothermophilus STCC4517 spore suspensions showed survival curves with shoulder phenomena independent of sporulation temperature and pH, whose duration was an exponential function of treatment temperature[J].Food Microbiology, 2022, 104: 103969.
AS P, et al.Geobacillus stearothermophilus STCC4517 spore suspensions showed survival curves with shoulder phenomena independent of sporulation temperature and pH, whose duration was an exponential function of treatment temperature[J].Food Microbiology, 2022, 104: 103969.
[15] 梁栋, 陈芳, 胡小松.芽孢萌发研究进展[J].中国食品学报, 2018, 18(6):221-228. LIANG D, CHEN F, HU X S.Research progress on the spore germination[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(6):221-228.
[16] BOIX E, COUVERT O, ANDRÉ S, et al.The synergic interaction between environmental factors (pH and NaCl) and the physiological state (vegetative cells and spores) provides new possibilities for optimizing processes to manage risk of C.sporogenes spoilage[J].Food Microbiology, 2021, 100: 103832.
[17] MTIMET N, TRUNET C, MATHOT A G, et al.Modeling the behavior of Geobacillus stearothermophilus ATCC 12980 throughout its life cycle as vegetative cells or spores using growth boundaries[J].Food Microbiology, 2015, 48:153-162.
[18] AOUADHI C, ROUISSI Z, KMIHA S, et al.Effect of sporulation conditions on the resistance of Bacillus sporothermodurans spores to nisin and heat[J].Food Microbiology, 2016, 54:6-10.
[19] BENDER G R, MARQUIS R E.Spore heat resistance and specific mineralization[J].Applied and Environmental Microbiology, 1985, 50(6):1414-1421.
[20] OKEREKE A, BEELMAN R B, DOORES S, et al.Elucidation of the mechanism of the acid-blanch and EDTA process inhibition of Clostridium sporogenes PA 3679 spores[J].Journal of Food Science, 2010, 55(4):1137-1142.
[21] TRUNET C, NGO H, COROLLER L.Quantifying permeabilization and activity recovery of Bacillus spores in adverse conditions for growth[J].Food Microbiology, 2019, 81:115-120.
[22] SUN R X, VERMEULEN A, DEVLIEGHERE F.Modeling the combined effect of temperature, pH, acetic and lactic acid concentrations on the growth/no growth interface of acid-tolerant Bacillus spores[J].International Journal of Food Microbiology, 2021, 360: 109419.
[23] ANDRÉ S, CHARTON A, PONS A, et al.Viability of bacterial spores surviving heat-treatment is lost by further incubation at temperature and pH not suitable for growth[J].Food Microbiology, 2021, 95: 103690.
[24] MTIMET N, TRUNET C, MATHOT A G, et al.Die another day:Fate of heat-treated Geobacillus stearothermophilus ATCC 12980 spores during storage under growth-preventing conditions[J].Food Microbiology, 2016, 56:87-95.
[25] MTIMET N, TRUNET C, MATHOT A G, et al.Walking dead:Permeabilization of heat-treated Geobacillus stearothermophilus ATCC 12980 spores under growth-preventing conditions[J].Food Microbiology, 2017, 64:126-134.
[26] DURAND L, PLANCHON S, GUINEBRETIERE M-H, et al.Genotypic and phenotypic characterization of foodborne Geobacillus stearothermophilus[J].Food Microbiology, 2015, 45:103-110.
[27] CIARCIAGLINI G, HILL P J, DAVIES K, et al.Germination-Induced bioluminescence, a route to determine the inhibitory effect of a combination preservation treatment on bacterial spores[J].Applied and Environmental Microbiology, 2000, 66(9):3735-3742.
[28] MINH H N T, PERRIER-CORNET J M, GERVAIS P, et al.Effect of the osmotic conditions during sporulation on the subsequent resistance of bacterial spores[J].Applied Microbiology and Biotechnology, 2008, 80(1):107-114.
[29] SEVENICH R, REINEKE K, HECHT P, et al.Impact of different water activities adjusted by solutes on high pressure high temperature inactivation of Bacillus amyloliquefaciens spores[J].Frontiers in Microbiology, 2015, 6:689.
[30] SAMAPUNDO S, HEYNDRICKX M, XHAFERI R, et al.The combined effect of pasteurization intensity, water activity, pH and incubation temperature on the survival and outgrowth of spores of Bacillus cereus and Bacillus pumilus in artificial media and food products[J].International Journal of Food Microbiology, 2014, 181:10-18.
[31] RASO J, G NGORA-NIETO M M, BARBOSA-C
NGORA-NIETO M M, BARBOSA-C NOVAS G V, et al.Influence of several environmental factors on the initiation of germination and inactivation of Bacillus cereus by high hydrostatic pressure[J].International Journal of Food Microbiology, 1998, 44(1-2):125-132.
NOVAS G V, et al.Influence of several environmental factors on the initiation of germination and inactivation of Bacillus cereus by high hydrostatic pressure[J].International Journal of Food Microbiology, 1998, 44(1-2):125-132.
[32] LEGUERINEL I, SPEGAGNE I, COUVERT O, et al.Validation of an overall model describing the effect of three environmental factors on the apparent D-value of Bacillus cereus spores[J].International Journal of Food Microbiology, 2005, 100(1-3):223-229.
[33] PAWLUK A M, KIM D, JIN Y H, et al.Biofilm-associated heat resistance of Bacillus cereus spores in vitro and in a food model, Cheonggukjang jjigae[J].International Journal of Food Microbiology, 2022, 363: 109505.
[34] HAYRAPETYAN H, ABEE T, NIEROP GROOT M.Sporulation dynamics and spore heat resistance in wet and dry biofilms of Bacillus cereus[J].Food Control, 2016, 60:493-499.
[35] JIAO S S, ZHANG H J, HU S Z, et al.Radio frequency inactivation kinetics of Bacillus cereus spores in red pepper powder with different initial water activity[J].Food Control, 2019, 105:174-179.
[36] JAKOBSEN T M, MURRELL W G.The effect of water activity and Aw-controlling solute on sporulation of Bacillus cereus T[J].The Journal of Applied Bacteriology, 1977, 43(2):239-245.
[37] RAO L, FEEHERRY F E, GHOSH S, et al.Effects of lowering water activity by various humectants on germination of spores of Bacillus species with different germinants[J].Food Microbiology, 2018, 72:112-127.
[38] KNUDSEN S M, CERMAK N, DELGADO F F, et al.Water and small-molecule permeation of dormant Bacillus subtilis spores[J].Journal of Bacteriology, 2015, 198(1):168-177.
[39] KNORR D, FROEHLING A, JAEGER H, et al.Emerging technologies in food processing[J].Annual Review of Food Science and Technology, 2011, 2(1):203-235.
[40] SETLOW P.Summer meeting 201:When the sleepers wake:The germination of spores of Bacillus species[J].Journal of Applied Microbiology, 2013, 115(6):1251-1268.
[41] STOECKEL M, LÜCKING G, EHLING-SCHULZ M, et al.Bacterial spores isolated from ingredients, intermediate and final products obtained from dairies:Thermal resistance in milk[J].Dairy Science &Technology, 2016, 96(4):569-577.
[42] BEHRINGER R, KESSLER H G.Death rate of the indigenous mixed spore flora in skimmilk and skimmilk concentrates[J].International Dairy Journal, 1992, 2(2):83-93.
[43] 王涛. 食品组分与抑菌剂对嗜热脂肪芽孢杆菌芽孢耐热性的影响[D].无锡:江南大学, 2011. WANG T.The effects of food constituents and natural preservatives on the thermal resistance of spores of Bacillus stearothermophilus[D].Wuxi:Jiangnan University, 2011.
[44] MARX M, KULOZIK U.Spore inactivation in differently composed whey concentrates[J].International Dairy Journal, 2018, 76:1-9.
[45] WEDEL C, WENNING M, DETTLING A, et al.Resistance of thermophilic spore formers isolated from milk and whey products towards cleaning-in-place conditions:Influence of pH, temperature and milk residues[J].Food Microbiology, 2019, 83:150-158.
[46] 张天宇, 吕风至, 桂萌, 等. 细菌芽孢萌发分子机制研究进展[J/OL]. 食品科学, 2023. http://kns.cnki.net/kcms/detail/11.2206.TS.20221230.0831.006.html. ZHANG T Y, LYU F Z, GUI M, et al. Research progress in molecular mechanism of bacterial spore germination[J/OL]. Food Science, 2023. http://kns.cnki.net/kcms/detail/11.2206.TS.20221230.0831.006.html.
[47] KIM S, JO Y, KANG D.Combined inhibitory effect of milk fat and lactose for inactivation of foodborne pathogens by ohmic heating[J].LWT- Food Science and Technology, 2017, 86:159-165.
[48] BERM DEZ-AGUIRRE D, BARBOSA-C
DEZ-AGUIRRE D, BARBOSA-C NOVAS G V.Study of butter fat content in milk on the inactivation of Listeria innocua ATCC 51742 by thermo-sonication[J].Innovative Food Science &Emerging Technologies, 2008, 9(2):176-185.
NOVAS G V.Study of butter fat content in milk on the inactivation of Listeria innocua ATCC 51742 by thermo-sonication[J].Innovative Food Science &Emerging Technologies, 2008, 9(2):176-185.
[49] KWON S W, KWON E A, HONG Y G, et al.Germination of Bacillus cereus ATCC 14579 spore at various conditions and inactivation of the germinated cells with microwave heating and UVC treatment in milk samples[J].LWT- Food Science and Technology, 2022, 154: 112702.
[50] SETLOW B, ATLURI S, KITCHEL R, et al.Role of dipicolinic acid in resistance and stability of spores of Bacillus subtilis with or without DNA-protective α/β-type small acid-soluble proteins[J].Journal of Bacteriology, 2006, 188(11):3740-3747.
[51] 田晶晶, 吴影, 李长福, 等.碳酸钙对凝结芽孢杆菌CGMCC 9951芽孢形成的影响[J].食品科学, 2020, 41(12):113-119. TIAN J J, WU Y, LI C F, et al.Effect of CaCO3on sporulation of Bacillus coagulans CGMCC 9951[J].Food Science, 2020, 41(12):113-119.
[52] MOLVA C, BAYSAL A H.Effect of sporulation medium on wet-heat resistance and structure of Alicyclobacillus acidoterrestris DSM 3922-type strain spores and modeling of the inactivation kinetics in apple juice[J].International Journal of Food Microbiology, 2014, 189: 82-88.
[53] 徐茜茜. 酸土脂环酸芽孢杆菌(Alicyclobacillus acidoterrestris)芽孢形成及低pH条件下芽孢萌发的蛋白组学研究[D]. 新乡: 河南科技学院, 2017. XU X X. Study on spore formation andproteomics of spore germination atlow pH in Alicyclobacillus acidoterrestris[D]. Xinxiang: Henan Institute of Science and Technology, 2017.
[54] 姚露燕, 张水华, 曹昱, 等.金属离子浓度对枯草芽孢杆菌芽孢率的影响[J].现代食品科技, 2008,24(8):770-772. YAO L Y, ZHANG S H, CAO Y, et al.Effect of metal ion concentration on sporulation efficiency of Bacillus subtilis[J].Modern Food Science and Technology, 2008,24(8):770-772.
[55] WELLS-BENNIK M H J, JANSSEN P W M, KLAUS V, et al.Heat resistance of spores of 18 strains of Geobacillus stearothermophilus and impact of culturing conditions[J].International Journal of Food Microbiology, 2019, 291:161-172.
[56] OOMES S J C M, BRUL S.The effect of metal ions commonly present in food on gene expression of sporulating Bacillus subtilis cells in relation to spore wet heat resistance[J].Innovative Food Science &Emerging Technologies, 2004, 5(3):307-316.
[57] STOECKEL M, WESTERMANN A C, ATAMER Z, et al.Thermal inactivation of Bacillus cereus spores in infant formula under shear conditions[J].Dairy Science &Technology, 2013, 93(2):163-175.
[58] DONG P, GEORGET E S, AGANOVIC K, et al.Ultra high pressure homogenization (UHPH) inactivation of Bacillus amyloliquefaciens spores in phosphate buffered saline (PBS) and milk[J].Frontiers in Microbiology, 2015, 6:712.
[59] KUMAR M, FLINT S, PALMER J, et al.The effect of phosphate on the heat resistance of spores of dairy isolates of Geobacillus stearothermophilus[J].International Journal of Food Microbiology, 2019, 309:108334.