芋头(Colocasiaesculenta(L).Schott)是天南星科的块茎作物,主要种植在热带和亚热带地区,是碳水化合物的重要来源,它也是非洲和亚洲部分地区居民的主食[1]。我国芋头资源十分丰富,种植范围广,在全球芋头出口市场中占据主导地位[2]。此外,芋头还是一种很好的功能性食品资源,因为它含有丰富的淀粉、多糖、膳食纤维、矿物质以及多种维生素,具有很高的营养价值和保健功能[3]。芋头淀粉颗粒较小,不同品种的粒径大小约为0.5~5.0 μm。因此,它易在胃肠道内消化吸收,尤其适用于幼儿和病人食用[4]。同时,芋头淀粉可作为饮料的乳化剂、稳定剂、增稠剂,提高饮料的口感[5]。芋头含有多种维生素,与其他块茎(马铃薯和红薯)相比,含有更高的维生素A;它还含有人体所需的矿物质,如钙、钾、钠、镁等[6]。据《新修本草》中的记载,芋味甘、辛、平,有消痰、软坚、生肌的功能,可治疗多种疾病。现代医学研究表明芋头中的活性成分主要包括多糖和多酚,具有抗炎、抗癌、降血糖、降血脂等药理活性[7-8]。
多糖是生物体的重要组成部分,广泛存在于植物、动物和微生物中,对生命活动至关重要。芋头多糖主要存在于芋头球茎和芋头皮中,其中芋头球茎中多糖含量最高。许多研究表明芋头非淀粉多糖主要是一种果胶型多糖,具有免疫调节、抗氧化、降血糖和降血脂活性[9-11]。因此,本文对芋头多糖的提取、纯化、结构表征及生物活性进行归纳总结,为芋头多糖在食品工业和生物医药领域的研究与发展提供新的思路与理论依据。
1 提取与纯化
1.1 芋头多糖的提取
多糖是细胞壁的重要组成成分,根据“相似相溶”的原理,破坏细胞壁,可使多糖从细胞壁中溶出[12]。因此,多糖的提取、分离和纯化必须根据多糖的理化性质和分子质量来选择合适的方法。芋头多糖提取方法有很多,主要包括水提法、微波辅助提取法、酶辅助提取法、脉冲电场辅助提取法和超声波辅助提取法等[9,13-18]。见表1。
刘萍等[13]以龙香芋为原料优化芋头多糖提取工艺,在料液比1∶6(g∶mL)、提取温度80 ℃、提取时间6 h,乙醇体积分数85%条件下,芋头多糖提取率为(4.92±0.18)%。PARK等[19]为降低芋头多糖中淀粉杂质的含量采用低温萃取芋头多糖,在4 ℃条件下通过冷水萃取,芋头多糖的产量为1.4%。为提高芋头多糖提取率通常采用多种方法辅助提取,如微波辅助提取法、超声波辅助提取法、脉冲电场辅助提取法等。姜绍通等[14]采用响应面优化微波辅助提取芋头多糖工艺,最佳条件为:提取温度82 ℃、时间3 h、微波功率395 W、微波时间77 s,多糖提取率为5.57%。刘楠楠[8]采用超声波辅助酶法提取芋头多糖,当纤维素酶添加量为0.3%、酶解温度50 ℃、酶解时间2.5 h、超声时间25 min时芋头多糖得率为23.24%。ANWAR等[16]对比3种不同提取方法对芋头皮非淀粉多糖提取率的影响。研究表明,与传统水提法相比超声辅助提取法和脉冲电场辅助提取法的提取率更高分别为3.65%和2.25%。除此之外,ANWAR等[18]还采用冻融提取法提取芋头水溶性非淀粉多糖,与常规方法相比多糖提取率增加了227.8%,且多糖纯度更、高颜色更浅。综上所述,不同的原料、生理阶段和提取方法都会导致芋头多糖的提取率、理化性质和功能活性不同。因此,在提取芋头多糖时应考虑多种因素。
表1 多糖提取方法评价
Table 1 Evaluation of extraction methods of polysaccharides

方法原理优点缺点参考文献热水提取法高温破坏细胞壁、使多糖溶解并扩散出细胞操作方便,设备简单时间长,效率低,高温下可能破坏多糖结构[13]微波辅助提取法细胞内极性物质吸收微波并产生大量热量,导致细胞膨胀和破裂,使多糖从细胞中释放出来萃取时间短,溶剂消耗少,效率高高温会破坏多糖结构,加热不均匀[9,14]超声波辅助提取法超声波产生强烈的空化效应和机械振动,破坏细胞壁,从而加速多糖在细胞外的扩散萃取温度低,操作方便,节能高效应注意控制超声时间,长时间处理会破坏多糖的结构;萃取过程中很难控制温度[15-16]酶辅助提取法通过选用合适的酶破坏细胞壁的致密结构,使胞内有效成分向提取介质扩散专一性好,得率高,不破坏多糖结构提取成本高,反应条件需严格控制[17]脉冲电场辅助提取法电场使细胞壁的孔隙率增加,提高细胞膜的渗透性,增强胞内物质的扩散提取时间短,温度低,不需要加热,避免多糖热降解需要控制电场强度、处理时间和温度[15-16]冻融提取法在冻融过程中形成的冰晶通过机械压缩破坏细胞壁,从而释放多糖多糖在低温下不易降解,淀粉的影响在低温下可以最小化冷冻温度和解冻时间不宜过长,否则提取物会变色,提取效果不理想[18]
1.2 芋头多糖的纯化
通过上述方法提取的芋头粗多糖通常含有多种杂质,特别是蛋白质、色素、小分子化合物等[20]。因此,在研究芋头纯多糖结构与活性之前,须对粗多糖进行纯化,去除多糖粗提物中非多糖成分,从而富集多糖成分。目前粗多糖除蛋白质常用的方法有Sevag法、三氯乙酸、酶法等。多糖除蛋白后通常还含有色素,因此需对其做进一步脱色处理,目前常用的脱色方法有氧化法和吸附法等[12,17,20-21],如表2所示。
表2 芋头多糖提纯
Table 2 Refinement of polysaccharides from taro

目的方法原理优点缺点除蛋白Sevag法蛋白质在有机溶剂中易变性条件简单、反应温和,不改变多糖的结构和性质效率低且易造成多糖损失三氯乙酸有机溶剂使蛋白质变性效率高,操作方便反应剧烈,不适用于含呋喃糖残基的多糖,过量易导致多糖的降解三氟三氯乙烷法有机溶剂使蛋白质变性效率高三氟三氯乙烷沸点低,易挥发,有毒,不适合大量使用酶法酶会破坏特定的蛋白质肽键反应温和,效率高,绿色环保需严格控制反应条件防止酶失活;价格昂贵脱色 过氧化氢氧化法氧化脱色剂脱色能力强,适用于去除与多糖分子紧密结合的色素需要控制反应温度和溶液的pH值,过高的温度和pH会导致多糖的降解,从而破坏多糖的结构活性炭吸附法由于范德华力和静电力的作用,颜料分子被吸附在活性炭松散多孔的结构中吸附能力强,价格便宜,对多糖结构无影响需考虑脱色温度、时间、活性炭用量等因素对脱色效果的影响,活性炭的强吸附能力会导致部分多糖损失
芋头多糖常见的纯化方法包括分级醇沉法、离子交换柱层析法和凝胶渗透柱层析法。其中分级醇沉法简单方便,但得到的多糖分子质量分布较广且仍是混合多糖,还需进一步纯化[22]。比如离子交换柱层析法和凝胶层析法是纯化芋头多糖最常见的方法,PARK等[19]结合DEAE-Sepharose Fast Flow离子交换柱分离和Sephadex G-100凝胶层析柱纯化,得到均一的芋头多糖组分(Taro-4-Ⅰ)。姜绍通等[14]采用DEAE-52离子交换柱和SephadexG-75凝胶层析柱从芋头粗多糖中分离纯化得到3种均一的芋头多糖组分(TPS1p、TPS2p1和TPS3p2)。此外,LI等[23]经DEAE-Sepharose Fast Flow离子交换柱分离、Sephacryl S-200凝胶层析柱纯化从芋头粗多糖中得到2种均一组分(TPS-1和TPS-2),其纯度分别为94.3%和95.4%。
2 芋头多糖结构表征
多糖的结构表征对于挖掘其构效关系至关重要。单糖组成、分子质量和化学结构会影响多糖的基本理化性质,从而影响其活性机制[24]。为了解芋头多糖的结构与功能关系,有必要对其结构进行深入研究。多糖是一种结构复杂的生物大分子,结构表征不仅包括单糖组成和分子质量,还包括糖苷键的类型、糖残基的组成、连接位点和顺序。通常采用甲基化分析、Smith降解、高碘酸盐氧化、核磁共振、高效液相色谱法、气相色谱-质谱法、扫描电子显微镜、原子力显微镜等方法解析多糖结构[20,22,25]。不同品种、提取方法和纯化方法都可能会导致多糖结构的不同,表3总结了近年来芋头多糖的结构特征。
表3 芋头多糖结构表征
Table 3 Structural characterization of polysaccharide from taro

序号组分名称分子质量/kDa单糖组成化学结构生物活性参考文献1YT-1-a-木糖、鼠李糖、甘露糖、半乳糖、葡萄糖、半乳糖醛酸摩尔比为30.79∶17.77∶10.92∶10.25∶10.2∶7.03-抗氧化[8]2Taro-4-Ⅰ200半乳糖、甘露糖、葡萄糖、糖醛酸摩尔比为38.9∶19.2∶4.2∶35.6-免疫调节[19]3TPS-110.502鼠李糖、木糖、葡萄糖、半乳糖摩尔比为8.5∶0.73∶88.57∶2.56(1→3)-β-L-Rha,(1→4)-β-D-Xyl,(1→)-α-D-Glc,(1→6)-α-D-Glc,(1→2,6)-α-D-Glc,(1→2)-β-D-Gal免疫调节[23]4TPS-210.191鼠李糖、阿拉伯糖、葡萄糖、半乳糖摩尔比为3.54∶1.6∶87.92∶6.94(1→2)-α-L-Rha,(1→3)-α-L-Arf,(1→)-β-D-Glc,(1→4)-β-D-Glc,(1→4,6)-β-D-Glc,(1→3)-α-D-Gal免疫调节[23]5CE-4a182.4半乳糖、甘露糖、阿拉伯糖、半乳糖醛酸摩尔比为43.5∶18.2∶2.7∶35.54-Manp3-Galp2,4,6-Manp免疫调节[26]6TPS111.1甘露糖、鼠李糖、葡萄糖摩尔比为21.79∶4.9∶73.31-免疫调节[27]7TPS24 900;65甘露糖、鼠李糖、半乳糖醛酸、葡萄糖摩尔比为7.15∶25.86∶56.93∶10.03-免疫调节[27]8TSP63.244甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖摩尔比为0.62∶0.61∶3.72:90.64∶3.66∶0.74-抗氧化,降血糖[28]9Tc-WS-NSP-CE-阿拉伯糖、半乳糖、葡萄糖、甘露糖、鼠李糖-免疫调节[18,29]10Tc-WS-NSP-ICE-阿拉伯糖、半乳糖、葡萄糖、甘露糖-免疫调节[18,29]
注:-表示无数据。
从近年来芋头多糖的研究可以发现,芋头多糖主要由鼠李糖、阿拉伯糖、葡萄糖、半乳糖、木糖以及糖醛酸组成,且多糖分子质量分布较广,为104~106 Da。PARK等[19]从芋头粗多糖中分离得到Taro-4-Ⅰ组分,分子质量为200 kDa,其单糖组成由半乳糖、甘露糖、葡萄糖、糖醛酸以摩尔比38.9∶19.2∶4.2∶35.6组成。此外,康庆等[27]从芋头水溶性多糖分离出2种组分(TPS1和TPS2)。其中TPS1中的多糖为α构型吡喃多糖,主要由D-甘露糖(21.79%)、L-鼠李糖(4.90%)和D-葡萄糖(73.31%)组成;TPS2中的多糖为β构型呋喃多糖,主要由D-甘露糖(7.15%)、L-鼠李糖(25.86%)、D-半乳糖醛酸(56.93%)和D-葡萄糖(10.03%)组成。NGUIMBOU等[30]发现芋头多糖中还含部分糖蛋白,主要为阿拉伯半乳糖蛋白,除此之外还有大量的鼠李糖、木糖、甘露糖以及葡萄糖醛酸。
LI等[23]从芋头粗多糖中分离出中性多糖TPS-1和酸性多糖TPS-2两种组分,分子质量分别为10.502 kDa和10.191 kDa,其中TPS-1主要由鼠李糖(8.5%)、木糖(0.73%)、葡萄糖(88.57%)、半乳糖(2.56%)组成,TPS-2主要由鼠李糖(3.54%)、阿拉伯糖(1.6%)、葡萄糖(87.92%)、半乳糖(6.94%)组成。两种组分经过甲基化、NMR一维图谱解析,结果表明,TPS-1由(1→3)-β-L-Rha、(1→4)-β-D-Xyl、(1→)-α-D-Glc、(1→6)-α-D-Glc、(1→2,6)-α-D-Glc、(1→2)-β-D-Gal组成,其摩尔比8.62∶1.31∶9.24∶60.58∶17.99∶2.27;TPS-2由(1→2)-α-L-Rha、(1→3)-α-L-Arf、(1→)-β-D-Glc、(1→4)-β-D-Glc、(1→4,6)-β-D-Glc、(1→3)-α-D-Gal以摩尔比3.67∶2.13∶12.25∶54.98∶19.54∶7.44组成。此外,从芋头球茎中分离出多糖CE-4a,经过化学分析和多种仪器检测后发现,CE-4a主要由半乳糖(43.5%)和甘露糖(18.2%)组成;结合甲基化和酶解结果表明,CE-4a是一种具有(1→4)-Man骨架和低聚半乳糖侧链的高度支链半乳甘露聚糖[26]。
3 芋头多糖结构修饰
许多研究表明,多糖是一种具有生物活性的大分子,但一些多糖本身不具有生物活性或生物活性很低,而多糖的生物活性受其结构的影响。多糖的化学修饰可以改变其取代基的类型、大小、位置、分子质量和空间结构从而提高其生物活性[31]。化学修饰可以增强芋头多糖的生物活性,提高多糖的利用率和溶解度等。多糖结构修饰方法很多,如硫酸化、羧甲基化和磷酸化,其中硫酸化修饰最常用如表4所示[32]。
表4 多糖硫酸化修饰
Table 4 Polysaccharide sulfation modification

方法优点缺点氯磺酸-吡啶法取代度高,产量大酸性强、反应剧烈、难以控制、易导致降解多糖;必须严格控制无水环境,否则氯磺酸会分解,释放大量热量,加速多糖的降解;有毒浓硫酸法反应温和、易于控制,毒性低,产品纯度高浓硫酸的脱水会导致多糖碳化,导致产量下降三氧化硫-吡啶法操作简单,毒性低,几乎没有副作用试剂昂贵
GAMAL-ELDEEN等[33]使用发烟硫酸和甲酰胺形成的硫酸化试剂制备芋头硫酸化多糖。研究发现,经过硫酸盐处理后,芋头多糖硫酸盐取代率为48%,硫酸化度为2.3。经过改性后,多糖对自由基(羟自由基和过氧化自由基)的强清除能力、免疫调节能力和抗肿瘤特性,从而提高了芋头多糖的生物活性。
4 芋头多糖生物活性
近年来,芋头多糖因其丰富的生物学特性和药理作用而受到生物和医学领域的广泛关注。在体内外的实验中表现出良好的生物活性,包括免疫调节、抗氧化、抗肿瘤、降血糖、降血脂等[10,15,34]。
4.1 免疫调节
多糖是一类具有免疫调节活性的非特异性免疫调节剂,它可以通过与免疫细胞表面的受体结合,激活不同的信号通路来调节免疫系统[22]。芋头多糖通过调节免疫细胞(T细胞、B淋巴细胞、巨噬细胞和自然杀伤细胞)的比例和分化状态来发挥作用[10,27]。巨噬细胞在免疫过程中表现出多种功能,是评价生物活性和免疫调节的重要指标。此外,多糖可以刺激巨噬细胞分泌一氧化氮和某些细胞因子,如白细胞介素(interleukin-2, IL-2、interleukin-6, IL-6)、干扰素(interferon-γ, IFN-γ)和肿瘤坏死因子(tumor necrosis factor-α, TNF-α)清除病原体,提高机体抵抗微生物感染和抗肿瘤细胞的能力[35]。
LI等[23]从芋头中分离出2种非淀粉多糖组分(TPS-1和TPS-2),研究表明TPS-2在诱导巨噬细胞分泌NO、TNF-α和IL-6水平方面比TPS-1表现出更强的免疫调节活性,且TPS-2的受体为TLR2、TLR4、GR和SR(图1)。当TPS-1的浓度为250~1 000 μg/mL时,芋头多糖才能诱导巨噬细胞释放NO和细胞因子。然而,当TPS-2质量浓度为62.5~1 000 μg/mL时,巨噬细胞产生的NO、TNF-α和IL-6的作用更为显著。从芋头球茎中分离出2种水溶性多糖TPS1和TPS2在25~400 μg/mL质量浓度范围内对巨噬细胞无毒害作用。其中TPS1可提高RAW264.7细胞的中性红吞噬能力,TPS2则表现出更强的免疫活性,能促进NO、TNF-α、IL-1β的分泌[27]。ANWAR等[36]以HT-29细胞为研究对象,探讨水溶性非淀粉多糖(taro corm water-soluble non-starch polysaccharide,Tc-WS-NSP)的免疫调节作用。结果表明,Tc-WS-NSP可下调IL-8,促进机体免疫反应,并有可能成为治疗或缓解免疫功能低下和免疫缺陷疾病的免疫调节剂。此外,芋头还含有糖蛋白,它类似于多糖的免疫调节,具有增强免疫系统的作用。纯化的糖蛋白能抵抗环磷酰胺引起的小鼠白细胞数量减少,使白细胞能否迅速恢复[30,37]。
然而,多糖还通过增强机体免疫调节能力破坏肿瘤细胞以及影响癌基因的表达而发挥抗肿瘤作用。PARK等[19]研究发现芋头多糖组分Taro-4-Ⅰ能促进巨噬细胞分泌IL-6、TNF-α,且呈剂量依赖性;且Taro-4-Ⅰ可以通过诱导巨噬细胞分泌IL-12,从而激活自然杀伤细胞抑制黑色素瘤细胞的肺转移(图2)。
4.2 抗氧化
由于外界的影响和人体自身的新陈代谢,人体会不断产生自由基。在正常情况下,体内自由基的产生和消耗处于动态平衡。过多自由基的存在会打破动态平衡破坏机体免疫系统,从而导致多种疾病,如高血压、心脑血管疾病、糖尿病、神经退行性疾病[21]。大多数植物多糖具有清除自由基、提高氧化酶活性、抑制脂质过氧化和延缓衰老的功能[38-39]。
芋头多糖抗氧化能力通常通过各种自由基检测来评价,如DPPH自由基、羟自由基、ABTS阳离子自由基、超氧阴离子自由基清除能力。SHEHATA等[40]通过抗氧化能力测试发现,芋头皮多糖(taro scalp polysaccharides,TP)对DPPH自由基和ABTS阳离子自由基的清除率分别为(50.30±2.26%)和(55.91±1.54%),表明TP具有良好的抗氧化活性。刘楠楠[8]研究粗多糖和纯化多糖抗氧化活性;结果表明,粗多糖和纯化多糖均具有较强的自由基清除能力,且呈浓度依赖性。其中纯化多糖对羟自由基和超氧阴离子自由基最大清除能力分别为93.04%和70.64%。
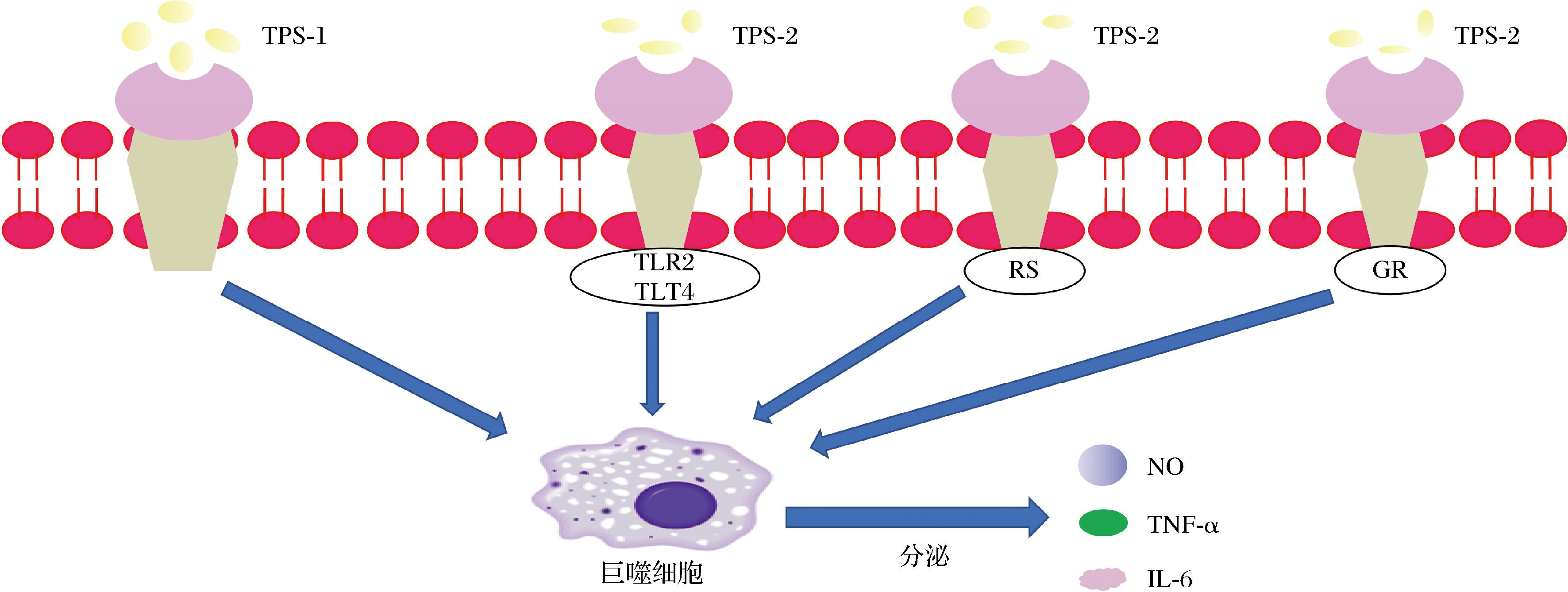
图1 TPS-1和TPS-2的免疫调节
Fig.1 Immunoregulation of TPS-1 and TPS-2
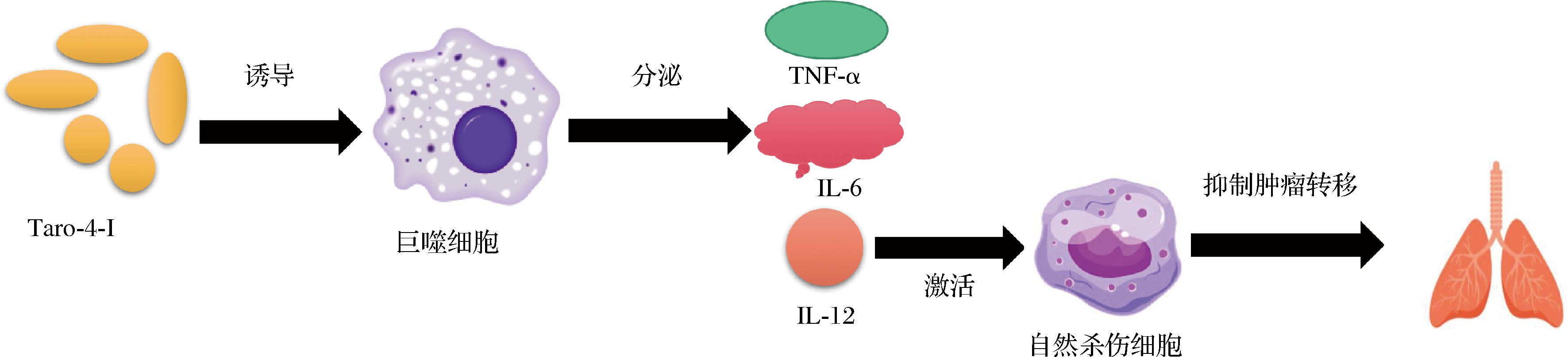
图2 Taro-4-I的免疫调节
Fig.2 Immunoregulation of Taro-4-I
4.3 降血糖、降血脂
高血糖、高血脂是引起糖尿病的重要因素,若不及时治疗会引起多种并发症。芋头多糖可以改善糖尿病患者的糖代谢和脂质代谢异常,同时还可以缓解其他并发症的发生[41]。苏颖杰[28]研究芋头多糖对α-淀粉酶和α-葡萄糖苷酶的抑制作用,同时使用HepG2细胞探索芋头多糖对糖代谢的影响。研究表明,芋头多糖对α-淀粉酶和α-葡萄糖苷酶均有一定的抑制作用,对2种酶的半数抑制浓度IC50分别为4.02和3.1 mg/mL;同时,芋头多糖也表现出良好的胆酸盐结合能力,具有一定的降脂功能;同时促进HepG2细胞摄取葡萄糖,调节糖代谢酶活性。此外,BOBAN等[29]探究芋头多糖对大鼠脂质代谢的影响,发现芋头多糖能够降低血清和组织中的脂质水平,减少肝细胞分泌含有载脂蛋白的脂蛋白,从而改善机体脂代谢异常。
5 构效关系
目前关于芋头多糖构效关系的研究较少,主要集中在多糖一级结构上。而芋头多糖的完整结构和活性机制尚不清楚,构效关系有待进一步探讨。根据已有的研究发现可能存在的构效关系。在LI等[23]的研究中,TPS-2具有更强的免疫活性,可能是由于阿拉伯糖、(1→4)-β-D-Glc支链和(1→6)-β-D-Glc残基的存在,从而增强了多糖的免疫效果。LEE等[26]研究表明,CE-4a是由(1→4)-Man主链和低聚半乳糖侧链组成的高度支化半乳甘露聚糖,这种结构可以增加芋头多糖的黏度并提高其免疫活性。
6 芋头多糖的应用
多糖具有良好的生物相容性、无毒性和廉价易得的特性,广泛应用于食品、医疗、环境等领域[11]。由于生活水平的提高,越来越多的人正在追求绿色健康的生活方式,特别是在饮食和医药方面,消费者更喜欢含有天然添加剂的食品和药品。
芋头多糖可用作食品增稠剂[9]。HUSSEIN等[42]使用添加量为0.3%的芋头多糖来制备酸奶。发现酸奶的酸度、黏度和风味增加,这些结果表明,芋头多糖可以改善酸奶的外观、质地和风味,可用作食品工业中的添加剂。同时,芋头多糖也具有良好的膨胀性,可作为药物领域的载体。如添加到口腔崩解片中,从而使功能成分迅速溶解,在患处发挥作用[43]。此外,芋头多糖还可作为吸附剂使用。MIJINYAWA等[44]探索芋头多糖对水中亚甲基蓝的吸附性能。研究表明,在一定条件下,芋头多糖的去除率可达72.35%,表明有芋头多糖可以作为一种绿色、经济的吸附剂。
7 结论与展望
芋头作为一种块茎作物而被广泛种植,除本身具有较高的营养价值,其药理作用也备受关注。多糖是芋头的主要成分,由于其无毒副作用以及具有优异的免疫调节、抗肿瘤和降血脂等活性功能,使芋头非淀粉多糖在功能性食品和医药领域有巨大开发潜力。近年来,芋头多糖的研究结果不断更新,但就目前的研究结果而言,仍有许多问题亟待解决。首先,芋头多糖现有的提取、纯化方法复杂且产率低。在功能性食品和医药领域需要简单、有效的方法大规模生产高质量芋头多糖。因此,应探索更加高效的多糖提取纯化方法。其次,芋头多糖的结构分析主要集中在单糖组成、分子质量、糖苷键类型、位置等初级结构上,而高级结构需要运用更加先进的分析工具进一步阐明。第三,由于芋头多糖结构复杂多样,多糖结构与生物活性之间的构效关系尚未完全阐明。可运用“组学”技术,如代谢组学、微生物组学、蛋白质组学、基因组学、转录组学和生物信息学研究多糖生物活性机制,阐明芋头多糖的构效关系。第四,由于芋头多糖广泛应用于功能性食品和医药领域,因此对芋头多糖相关产品的功效、质量控制和安全性评价必不可少。第五,运用新兴技术对芋头多糖结构进行修饰,能进一步提高其生物活性。然而,衍生物官能团的衍生化程度及其安全性需要进一步深入研究。
[1] MITHARWAL S, KUMAR A, CHAUHAN K, et al.Nutritional, phytochemical composition and potential health benefits of taro (Colocasia esculenta L.) leaves:A review[J].Food Chemistry, 2022, 383:132406.
[2] OTEKUNRIN O A, SAWICKA B, ADEYONU A G, et al.Cocoyam[Colocasia esculenta (L.) Schott]:Exploring the production, health and trade potentials in sub-saharan Africa[J].Sustainability, 2021, 13(8):4483.
[3] RASHMI D R, RAGHU N, GOPENATH T S, et al.Taro (Colocasia esculenta):An overview[J].Journal of Medicinal Plants Studies, 2018, 6(4):156-161.
[4] ALAM F, NAWAB A, LUTFI Z, et al.Effect of non-starch polysaccharides on the pasting, gel, and gelation properties of taro (Colocasia esculenta) starch[J].Starch-Stärke, 2021, 73(1-2):2000063.
[5] 施帅, 李志方, 瞿桂香, 等.泰州芋头营养成分及其淀粉性质的研究[J].食品工业科技, 2016, 37(5):82-85;90. SHI S, LI Z F, QU G X, et al.Analysis of nutriental contents and properties of Taizhou taro starch[J].Science and Technology of Food Industry, 2016, 37(5):82-85;90.
[6] KAUSHAL P, KUMAR V, SHARMA H K.Utilization of taro (Colocasia esculenta):A review[J].Journal of Food Science and Technology, 2015, 52(1):27-40.
[7] SHAH Y A, SAEED F, AFZAAL M, et al.Industrial applications of taro (Colocasia esculenta) as a novel food ingredient:A review[J].Journal of Food Processing and Preservation, 2022,46(11):e16951.
[8] 刘楠楠. 芋头多糖提取、纯化与抗氧化活性研究[D].长春:吉林农业大学, 2019. LIU N N.Study on extraction, purification and antioxidant activity of polysaccharides from taro[D].Changchun:Jilin Agricultural University, 2019.
[9] MIJINYAWA A H, DURGA G, MISHRA A.Isolation, characterization, and microwave assisted surface modification of Colocasia esculenta (L.) Schott mucilage by grafting polylactide[J].International Journal of Biological Macromolecules, 2018, 119:1090-1097. [10] RIBEIRO PEREIRA P, BERTOZZI DE AQUINO MATTOS É, NITZSCHE TEIXEIRA FERNANDES CORR A A C, et al.Anticancer and immunomodulatory benefits of taro (Colocasia esculenta) corms, an underexploited tuber crop[J].International Journal of Molecular Sciences, 2020, 22(1):265.
A A C, et al.Anticancer and immunomodulatory benefits of taro (Colocasia esculenta) corms, an underexploited tuber crop[J].International Journal of Molecular Sciences, 2020, 22(1):265.
[11] ZHANG W T, HUANG G L.Preparation, structural characteristics and application of taro polysaccharides in food[J].Journal of the Science of Food and Agriculture, 2022, 102(14):6 193-6 201.
[12] 张晓晓, 柴智, 冯进, 等.牛蒡多糖的提取及生物活性研究进展[J].食品与发酵工业, 2021, 47(6):280-288. ZHANG X X, CHAI Z, FENG J, et al.Extraction and biological activity of Arctium lappa L.polysaccharides[J].Food and Fermentation Industries, 2021, 47(6):280-288.
[13] 刘萍, 祁兴普, 刘靖, 等.芋头多糖提取工艺优化及其体外结合脂类和胆酸盐能力研究[J].食品与机械, 2016, 32(10):132-136;199. LIU P, QI X P, LIU J, et al.Optimization of polysaccharide extraction from taro and its binding capacities of lipid and bile salts in vitro[J].Food &Machinery, 2016, 32(10):132-136;199.
[14] 姜绍通, 汪洪普, 潘丽军.响应面法优化微波辅助提取芋头多糖工艺研究[J].食品工业科技, 2013, 34(3):215-219. JIANG S T, WANG H P, PAN L J.Study on the optimization of microwave-assisted extraction of polysaccharides from taro by response surface methodology[J].Science and Technology of Food Industry, 2013, 34(3):215-219.
[15] ANWAR M, BIRCH E J, DING Y, et al.Water-soluble non-starch polysaccharides of root and tuber crops:Extraction, characteristics, properties, bioactivities, and applications[J].Critical Reviews in Food Science and Nutrition, 2022, 62(9):2309-2341.
[16] ANWAR M, BABU G, BEKHIT A E D.Utilization of ultrasound and pulse electric field for the extraction of water-soluble non-starch polysaccharide from taro (Colocasia esculenta) peel[J].Innovative Food Science &Emerging Technologies, 2021, 70:102691.
[17] 冀晓龙, 尹明松, 侯春彦, 等.红枣多糖提取、分离纯化及生物活性研究进展[J].食品工业科技, 2020, 41(23):346-353;358. JI X L, YIN M S, HOU C Y, et al.Recent advances in jujube (Zizyphus jujuba Mill.) polysaccharides:Extraction, isolation and purification and bioactivities[J].Science and Technology of Food Industry, 2020, 41(23):346-353;358.
[18] ANWAR M, MCCONNELL M, BEKHIT A E D.New freeze-thaw method for improved extraction of water-soluble non-starch polysaccharide from taro (Colocasia esculenta):Optimization and comprehensive characterization of physico-chemical and structural properties[J].Food Chemistry, 2021, 349:129210.
[19] PARK H R, LEE H S, CHO S Y, et al.Anti-metastatic effect of polysaccharide isolated from Colocasia esculenta is exerted through immunostimulation[J].International Journal of Molecular Medicine, 2013, 31(2):361-368.
[20] YUN D W, YAN Y M, LIU J.Isolation, structure and biological activity of polysaccharides from the fruits of Lycium ruthenicum Murr:A review[J].Carbohydrate Polymers, 2022, 291:119618.
[21] 郭建行,贾颂华,李博润,等.红海藻多糖提取、分离纯化及生物活性研究进展[J].食品研究与开发,2022,43(16):216-224. GUO J H, JIA S H, LI B R, et al.Research progress on extraction, purification, and bioactivity of polysaccharides from red seaweed[J].Food Research and Development, 2022, 43(16):216-224.
[22] HE Y, LI L, CHANG H, et al.Research progress on extraction, purification, structure and biological activity of Dendrobium officinale polysaccharides[J].Frontiers in Nutrition, 2022, 9:965073.
[23] LI H X, DONG Z, LIU X J, et al.Structure characterization of two novel polysaccharides from Colocasia esculenta (taro) and a comparative study of their immunomodulatory activities[J].Journal of Functional Foods, 2018, 42:47-57.
[24] SHENG K J, WANG C L, CHEN B T, et al.Recent advances in polysaccharides from Lentinus edodes (Berk.):Isolation, structures and bioactivities[J].Food Chemistry, 2021, 358:129883.
[25] JI X L, HOU C Y, GUO X D.Physicochemical properties, structures, bioactivities and future prospective for polysaccharides from Plantago L. (Plantaginaceae):A review[J].International Journal of Biological Macromolecules, 2019, 135:637-646.
[26] LEE H W, SHIN K S.Structural elucidation of immuno-stimulating polysaccharide, galactomannan isolated from Colocasia esculenta[J].Korean Journal of Food Science and Technology, 2020, 52(6):595-603.
[27] 康庆,林莹,苏颖杰,等.芋头水溶性多糖的分离纯化及其对巨噬细胞免疫活性功能的影响[J].食品工业科技,2020,41(19):13-19. KANG Q, LIN Y, SU Y J, et al.Isolation and purification of water-soluble polysaccharide from taro and its effect on immune activity of macrophages[J].Science and Technology of Food Industry, 2020, 41(19):13-19.
[28] 苏颖杰. 槟榔芋水溶性多糖的提取、抗氧化活性及对糖代谢的影响[D].南宁:广西大学, 2019. SU Y J.Extraction, antioxidant activity and effect on sugar metabolism of water soluble polysaccharides from taro[D].Nanning:Guangxi University, 2019.
[29] BOBAN P T, NAMBISAN B, SUDHAKARAN P R.Hypolipidaemic effect of chemically different mucilages in rats:A comparative study[J].British Journal of Nutrition, 2006, 96(6):1021-1029.
[30] NGUIMBOU R M, BOUDJEKO T, NJINTANG N Y, et al.Mucilage chemical profile and antioxidant properties of giant swamp taro tubers[J].Journal of Food Science and Technology, 2014, 51(12):3 559-3 567.
[31] LIN B B, HUANG G L.Extraction, isolation, purification, derivatization, bioactivity, structure-activity relationship, and application of polysaccharides from White jellyfungus[J].Biotechnology and Bioengineering, 2022, 119(6):1359-1379.
[32] WANG Z J, XIE J H, SHEN M Y, et al.Sulfated modification of polysaccharides:Synthesis, characterization and bioactivities[J].Trends in Food Science &Technology, 2018, 74:147-157.
[33] GAMAL-ELDEEN A, AMER H, FAHMY C A, et al.Tumor anti-initiation and anti-progression properties of sulphated-extract of Colocasia esculenta[J].Polish Journal of Food and Nutrition Sciences, 2021, 71(4):393-401.
[34] TOSIF M M, NAJDA A, KLEPACKA J, et al.A concise review on taro mucilage:Extraction techniques, chemical composition, characterization, applications, and health attributes[J].Polymers, 2022, 14(6):1163.
[35] XU J Q, ZHANG J L, SANG Y M, et al.Polysaccharides from medicine and food homology materials:A review on their extraction, purification, structure, and biological activities[J].Molecules, 2022, 27(10):3215.
[36] ANWAR M, MROS S, MCCONNELL M, et al.Effects of extraction methods on the digestibility, cytotoxicity, prebiotic potential and immunomodulatory activity of taro (Colocasia esculenta) water-soluble non-starch polysaccharide[J].Food Hydrocolloids, 2021, 121:107068.
[37] PEREIRA P R, WINTER H C, VER CIMO M A, et al.Structural analysis and binding properties of isoforms of tarin, the GNA-related lectin from Colocasia esculenta[J].Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2015, 1854(1):20-30.
CIMO M A, et al.Structural analysis and binding properties of isoforms of tarin, the GNA-related lectin from Colocasia esculenta[J].Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2015, 1854(1):20-30.
[38] 黄少杰, 黎攀, 杜冰.山药多糖的纯化、结构及生物活性研究进展[J].食品研究与开发, 2022, 43(16):209-215. HUANG S J, LI P, DU B.Progress in purification, structure and bioactivity of Chinese yam polysaccharide[J].Food Research and Development, 2022, 43(16):209-215.
[39] 陈春华, 唐炜, 殷军艺, 等.桑葚多糖结构特征和生物活性研究进展[J].中国食品学报, 2022, 22(5):367-382. CHEN C H, TANG W, YIN J Y, et al.Research progress on structure characteristics and biological activity of polysaccharide from fructus Mori[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(5):367-382.
[40] SHEHATA M G, DARWISH A M G, EL-SOHAIMY S A.Physicochemical, structural and functional properties of water-soluble polysaccharides extracted from Egyptian agricultural by-products[J].Annals of Agricultural Sciences, 2020, 65(1):21-27.
[41] CHUKWUMA C I, ISLAM M S, AMONSOU E O.A comparative study on the physicochemical, anti-oxidative, anti-hyperglycemic and anti-lipidemic properties of amadumbe (Colocasia esculenta) and okra (Abelmoschus esculentus) mucilage[J].Journal of Food Biochemistry, 2018, 42(5):e12601.
[42] HUSSEIN M M, HASSAN F A M, ABDEL DAYM H H, et al.Utilization of some plant polysaccharides for improving yoghurt consistency[J].Annals of Agricultural Sciences, 2011, 56(2):97-103.
[43] PAWAR H A, CHOUDHARY P D, GAVASANE A J.Orally disintegrating tablet using Colocasia esculenta tuber polysaccharide as a disintegrant and its comparision with commercially available super disintegrants[J].Current Drug Therapy, 2016, 11(2):115-128.
[44] MIJINYAWA A H, DURGA G, MISHRA A.A sustainable process for adsorptive removal of methylene blue onto a food grade mucilage:Kinetics, thermodynamics, and equilibrium evaluation[J].International Journal of Phytoremediation, 2019, 21(11):1122-1129.