桑椹是桑科(Moraceae)、桑属(Morus L.)多年生木本植物桑树的聚花果[1]。我国桑种资源十分丰富,据资料显示,目前我国野生和栽培的主要桑种含15个种和4个亚种[2]。桑椹经济价值高,是原国家卫生部认定的首批药食同源植物[1],除鲜食外,还可加工成果干、果汁、浓缩汁、果酱、果冻、果酒等产品。桑椹具有累积花青素的特性。在花青素累积阶段,桑椹由浅红色逐渐变为成熟时的黑紫色。据报道,黑桑(Morus nigra L.)的一些品种的桑椹鲜果中矢车菊素-3-葡萄糖苷(cyanidin-3-glucoside,C3G)含量达704.1 mg/100 g干基[3];其他如白桑(Morus alba L.)、山桑(Morus bombycis Koidz.)、广东桑(Morus atropupurea Roxb.)、红桑(Morus rubra L.)、蒙桑(Morus mongolica Schneid.)等品种,也是花青素的良好来源[4-6]。
以桑椹果实或果渣提取的桑椹红(CNS 08.129),允许在果糕、果酒、果冻、糖果、风味饮料及固体饮料中使用,具有合成色素无可比拟的安全性,桑椹红已成为水溶性红色系着色剂家族的重要成员,可赋予食品红色、粉色、紫色等颜色。体外、体内及临床试验结果表明[7-8],花青素作为桑椹中的主要生物活性成分之一,具有抗氧化、抗癌、降血糖、减少脂肪生成等多种生理活性,是极具应用前景的功能性食品配料。
众所周知,花青素具有天然的不稳定性,特别是在中碱性环境以及氧、光、热等因素的作用下,花青素的分子结构极易被破坏,导致其褪色或失去生物活性。桑椹鲜果采收期集中、容易腐烂,不耐运输,即对桑椹鲜果及花青素资源的加工利用就十分迫切[9]。现有文献综述主要关注桑椹花青素的提取纯化、分离鉴定和生理活性等方面,而对桑椹花青素加工稳定性研究尚缺乏总结。因此,本文在论述桑椹花青素的化学结构以及影响花青素稳定性的结构、环境及加工因素的基础上,总结提高桑椹花青素稳定性的方法和技术,同时介绍桑椹花青素在食品中的应用进展,以期为桑椹花青素的深入研究与应用提供参考。
1 桑椹花青素的化学组成和结构
食品原料中常见花青素为天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、锦葵色素、矮牵牛色素等六类,其化学结构差异主要是B环上连接的基团R1和R2不同(表1)。通过紫外-可见光谱、高效液相色谱、超高效液相色谱、质谱、一维和二维核磁共振等技术[5, 10-11],现已从不同品种桑椹果实及其制品中鉴定出至少48种花青素(表2),这些花青素分属于食品原料中常见的六类(图1):其中矢车菊色素22种、飞燕草色素10种、天竺葵色素5种、芍药色素4种、矮牵牛色素4种、锦葵色素3种。桑椹花青素主要以糖苷形式存在,糖基主要包括葡萄糖、半乳糖鼠李糖、木糖等单糖以及芸香糖、槐糖等双糖。当母环上仅连接一个糖苷键时一般位于C-3上,个别位于C-7上[11],当连接2个糖苷键时,一般位于C-3和C-5上[12]。糖基化使桑椹花青素具有较好的水溶性和稳定性。在大多数桑椹品种中,矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷是主要的花青素组成成分(图2)。此外,桑椹花青素的糖基还会被芳香族或者脂肪族有机酸酰化,目前鉴定的参与酰基化反应的有没食子酸[5]和丙二酸[13]。少数品种桑椹果实中还存在母环酰基化的花青素。WU等[14]报道,桑椹(Morus atropurpurea Roxb.)花青素的母环羟基与丙二酸共价结合。
桑椹果实中花青素含量与成熟度、基因、颜色、品种等因素有关,甚至还与提取工艺和定量方法有关。YANG等[6]研究显示,桑椹(Morus atropurpurea Roxb.)聚花果不同成熟阶段花青素的累积速度存在差异,起初总花青素含量较低且增加缓慢(14.68 mg/g FW→19.70 mg/g FW;以C3G计,鲜重),在果实发育中后期其含量增长速度明显加快,9 d内其含量从19.70 mg/g FW增加到906.54 mg/g FW,随后5 d花青素的累积速度放缓,其含量最终达到1 177 mg/g FW。![]() 等[5]考察11个基因型桑椹(Morus alba L.)的聚花果(黑色5种、白色4种、粉红色2种),研究发现花青素仅出现在黑色聚花果中(含量45.42~208.74 mg/100 g)。ESPADA-BELLIDO等[15]报道桑椹(Morus nigra)果浆中总花青素含量为194.17 mg/g(以C3G计)。ZOU等[12]报道,在最佳条件下,桑椹(Morus atropurpurea Roxb.)冻干粉经微波辅助提取得到的提取物总花青素含量可高达54.72 mg/g(以C3G计),是传统溶剂提取法的1.49倍。WU等[14]通过pH示差法,在矢车菊素-3-葡萄糖苷最大吸收波长513 nm和无特征吸收的700 nm处测定吸光值,计算得到桑椹(Morus atropurpurea Roxb.)花青素含量为(203.3±25.5) mg/mL桑椹汁。KIM等[13]通过高效液相色谱法研究了12个品种桑椹的花青素组成,检测器波长设置为520 nm,分别得到矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷和天竺葵素-3-葡萄糖苷等单体的标准曲线用于定量,该法仅能得到3种主要花青素单体含量之和,而其他花青素单体的含量则未计入。桑椹花青素的提取溶剂、鉴定方法、定量方法、总花青素含量及花青素单体类型总结见表3。
等[5]考察11个基因型桑椹(Morus alba L.)的聚花果(黑色5种、白色4种、粉红色2种),研究发现花青素仅出现在黑色聚花果中(含量45.42~208.74 mg/100 g)。ESPADA-BELLIDO等[15]报道桑椹(Morus nigra)果浆中总花青素含量为194.17 mg/g(以C3G计)。ZOU等[12]报道,在最佳条件下,桑椹(Morus atropurpurea Roxb.)冻干粉经微波辅助提取得到的提取物总花青素含量可高达54.72 mg/g(以C3G计),是传统溶剂提取法的1.49倍。WU等[14]通过pH示差法,在矢车菊素-3-葡萄糖苷最大吸收波长513 nm和无特征吸收的700 nm处测定吸光值,计算得到桑椹(Morus atropurpurea Roxb.)花青素含量为(203.3±25.5) mg/mL桑椹汁。KIM等[13]通过高效液相色谱法研究了12个品种桑椹的花青素组成,检测器波长设置为520 nm,分别得到矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷和天竺葵素-3-葡萄糖苷等单体的标准曲线用于定量,该法仅能得到3种主要花青素单体含量之和,而其他花青素单体的含量则未计入。桑椹花青素的提取溶剂、鉴定方法、定量方法、总花青素含量及花青素单体类型总结见表3。
表1 食品原料中六类常见的花青素苷元
Table 1 Six common anthocyanin aglycones in food raw materials

花青素R1R2花青素的基本结构图天竺葵色素HH矢车菊色素OHH飞燕草色素OHOH芍药色素OCH3H锦葵色素OCH3OCH3矮牵牛色素OCH3OH
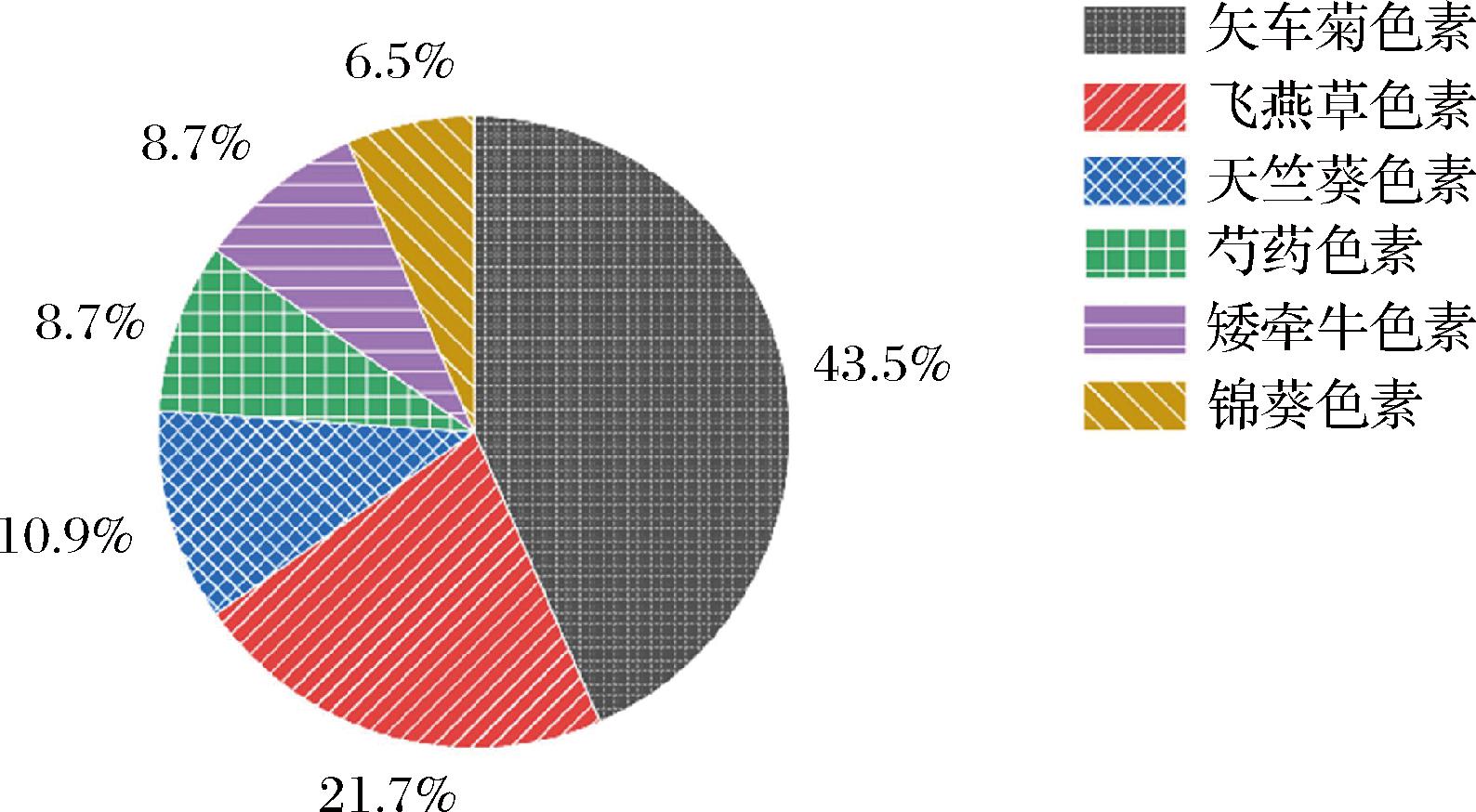
图1 桑椹花青素单体在6种常见花青素苷元中的占比
Fig.1 Proportion of mulberry anthocyanin monomers in six common anthocyanin aglycones
表2 桑椹花青素单体分布
Table 2 Monomer distribution of mulberry anthocyanin

花青素花青素单体参考文献天竺葵色素天竺葵素-3-葡萄糖苷、天竺葵素-3-芸香糖苷、天竺葵素己糖苷、天竺葵素鼠李糖己糖苷、天竺葵素脱氧己糖己糖苷[5,12-13]矢车菊色素矢车菊色素、矢车菊素-3-槐糖苷、矢车菊素-3-(6”-α-吡喃鼠李糖基-β-吡喃葡萄糖苷)、矢车菊素-3-(6”-α-吡喃鼠李糖基-β-吡喃半乳糖苷)、矢车菊素-3-半乳糖苷、矢车菊素-7-葡萄糖苷、矢车菊素-3-(2G-葡糖芸香糖苷)、矢车菊素-3, 5-二葡萄糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷、矢车菊素没食子酰己糖苷、矢车菊素己糖苷、矢车菊素鼠李糖己糖苷、矢车菊素戊糖苷、矢车菊素己糖基己糖苷、矢车菊素己糖脱氧己糖己糖苷、矢车菊素二己糖苷、矢车菊素丙二酰己糖己糖苷、矢车菊素丙二酰己糖苷、矢车菊素脱氧己糖苷、矢车菊素-3-(6”-丙二酰-葡萄糖苷)、矢车菊素-3-(6”-二草基-葡萄糖苷)[5,11-13,15-17]飞燕草色素飞燕草素-3-(6′丙二酰)葡萄糖苷、飞燕草素-3-葡萄糖苷、飞燕草色素、飞燕草素-3-芸香糖苷-5-葡萄糖苷、飞燕草素-3-芸香糖苷、飞燕草素鼠李糖己糖苷、飞燕草素己糖苷、飞燕草素乙酰己糖苷、飞燕草二己糖苷、飞燕草素脱氧己糖己糖苷[5, 7, 12-14, 16]芍药色素芍药素-3-木糖基鼠李糖苷、芍药色素、芍药素己糖苷、芍药素脱氧己糖己糖苷[13-14, 16]锦葵色素锦葵素-3-葡萄糖苷、锦葵色素、锦葵素己糖苷[13, 16, 18]矮牵牛色素矮牵牛色素、矮牵牛素鼠李糖己糖苷、矮牵牛素脱氧己糖己糖苷、矮牵牛素-3-葡萄糖苷[1, 5, 13, 16]
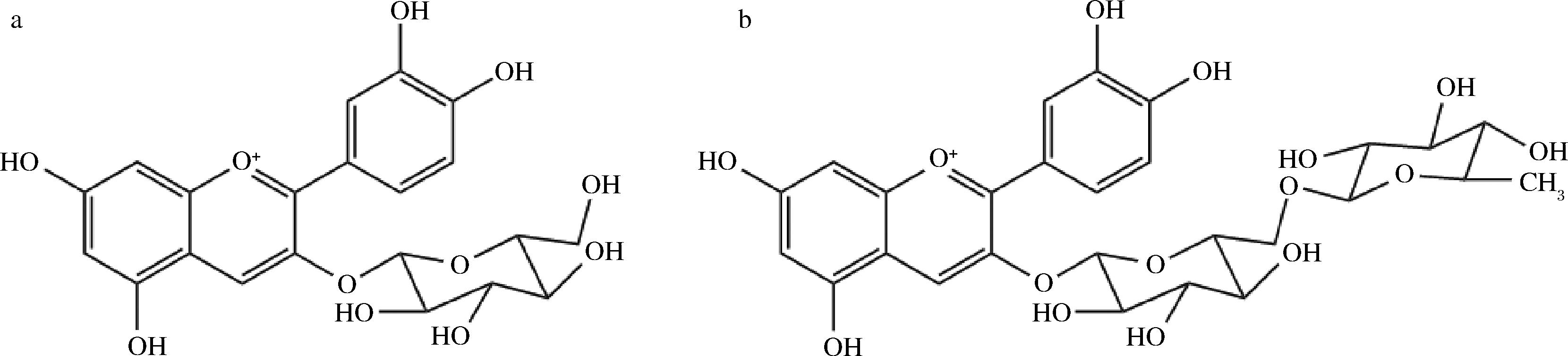
a-矢车菊素-3-葡萄糖苷;b-矢车菊素-3-芸香糖苷
图2 桑椹花青素的主要成分
Fig.2 The main components of mulberry anthocyanins
注:矢车菊素-3-葡萄糖苷的摩尔消光系数为26 900 L/(cm·mol),分子质量为449.2 g/mol;矢车菊素-3-芸香糖苷的摩尔消光系数为 28 800 L/(cm·mol),分子质量为595.2 g/mol;L为光程,值为1 cm[5]。
表3 桑椹花青素的化学组成及结构
Table 3 Chemical composition and structure of mulberry anthocyanins

品种数提取溶剂鉴定/定量方法检出数目总花青素含量花青素单体类型e参考文献11甲醇-0.1%盐酸UHPLC-LTQ-OrbiTrap-MS/MS;pH示差法1445.42~208.74 mg/100 g冷冻果实aCy、Pt、Pg、Dp[5]Morus alba L.6甲醇-0.1%盐酸UHPLC-(ESI)-qTOF;HPLC160.95~28.61 mg/g冻干果粉bCy、Dp、Pg、Mv、Pn、Pt[13]1无水甲醇-盐酸(99∶1)HPLC;HPLC51 612.087 1 mg/mL果浆cDp、Cy、Pt、Pn、Mv[16]1甲醇-1 mol/L盐酸(85∶15,体积比)HPLC;HPLC2399.713 mg/g冷冻果实bCy、Pg[2]Morus lhou(Ser.) Koidz.4甲醇-0.1%盐酸UHPLC-(ESI)-qTOF;HPLC160.15~16.81 mg/g冻干果粉bCy、Dp、Pg、Mv、Pn、Pt[13]Morus microphylla Buckl.1甲醇-0.1%盐酸UHPLC-(ESI)-qTOF;HPLC1628.05 mg/g冻干果粉bCy、Dp、Pg、Mv、Pn、Pt[13]1甲醇-0.1%盐酸UHPLC-(ESI)-qTOF;UHPLC-(ESI)-QqQ323.44 mg/g冷冻果粉bCy、Pg[19]Morus spp.1甲醇-0.1%盐酸UHPLC-(ESI)-qTOF;HPLC1417.92 mg/g冻干果粉bCy、Dp、Pg、Mv、Pt[13]1乙醇-硫酸铵-水(30∶20∶40,质量比)HPLC-ESI-MS/MS;pH示差法5(203.3±25.5) mg/mL桑椹汁aCy、Dp、Pn[14]Morus atropurpurea Roxb.159.6%酸化甲醇(含1%三氟乙酸)HPLC-ESI-MS;HPLC-ESI854.72 mg/g冻干果粉aCy、Dp、Pg[12]1甲醇-1 mol/L盐酸(85∶15,体积比)HPLC;HPLC110.957 mg/g冷冻果实bCy[2]Morus macroura1无水甲醇-盐酸(99∶1)HPLC;HPLC5220.708 6 mg/mL果浆cDp、Cy、Pg、Pt、Mv[16]Morus nigra176%甲醇UHPLC-qTOF-MS;UHPLC4194.17 mg/g果浆aCy[15]
注:UHPLC-LTQ-OrbiTrap-MS/MS:超高效液相色谱-线性离子阱-轨道阱串联质谱联用技术、HPLC-MS:高效液相色谱-质谱联用技术、UHPLC-(ESI)-qTOF:超高效液相色谱-(电喷雾)-四极杆飞行时间-质谱联用技术、UHPLC-(ESI)-QqQ:超高效液相色谱-电喷雾三重四极杆技术;Dp、Cy、Pg、Pt、Mv、Pn分别为飞燕草色素、矢车菊色素、天竺葵色素、矮牵牛色素、锦葵色素、芍药色素;a:总花青素含量以矢车菊素-3-葡萄糖苷计;b:总花青素含量以各单体花青素含量之和计;c:总花青素含量以矢车菊色素计;e:根据花青素苷元对桑椹花青素单体进行分类。
2 影响桑椹花青素稳定性的结构因素
研究显示,花青素的稳定性与B环上的羟基和甲氧基有关,羟基化会使其稳定性降低,而甲基化使其稳定性增加[20]。ZHANG等[21]以碘甲烷作为甲基供体制备甲基化桑椹花青素,桑椹花青素的甲基化转化率可达84.6%,将样品溶液在70、80、90 ℃避光保温10 h,甲基化修饰花青素的保留率分别为98.33%、91.56%和63.48%,而未修饰花青素的保留率分别为87.49%、72.15%和27.44%。桑椹花青素的酰基化也可以增加花青素的稳定性。蒋希芝等[22]通过脂肪酶催化制备酰基化桑椹花青素,研究发现,以苯甲酸甲酯作为酰基供体,桑椹花青素的酰基转化率最高为13.5%,酰基化修饰使其热稳定性、光稳定性和酸碱稳定性显著提高。糖基化有利于桑椹花青素稳定。糖基化花青素通过分子内氢键形成有效的空间位阻,可阻止黄烊盐阳离子水解[23]。桑椹花青素糖单元上的羟基可被酰化,从而阻止黄烊盐阳离子向醌式碱或无色假碱以及假碱向无色查尔酮的转化,不仅使桑椹花青素对热、光、氧化剂的稳定性增强,而且使对消化酶及胃肠环境的稳定性得到提升[24]。
3 影响桑椹花青素稳定性的环境因素
3.1 pH
桑椹花青素对酸碱变化敏感。LI等[25]报道,pH值2~12时,随着pH值升高,桑椹花青素溶液颜色由亮红色(pH值2.0~3.0)逐渐转变为粉红色(pH值4.0~6.0)、紫色(pH值8.0~9.0)至蓝紫色(pH值10.0~12.0)。在此过程中,桑椹花青素从黄烊盐阳离子形式逐渐转化为查尔酮、醇型假碱、醌式碱等形式;黄烊盐阳离子是相对稳定的结构,而其他形态的结构不稳定,这使花青素在酸性条件下更加稳定;pH>8时,桑椹花青素溶液在25 ℃贮藏4 h,其颜色由蓝紫色逐渐变为浅黄色。AKKARACHANEEYAKORN等[26]研究发现,桑椹汁在不同pH条件下70 ℃加热5 min,花青素保留量pH值2.5时为541.39 mg/L(以C3G计)、pH值4.0时为434.15 mg/L,显著高于pH值6.0时的1.76 mg/L和pH值8.0时的59.82 mg/L。因此,桑椹花青素应避免在中性或碱性条件下加工和贮藏,以防发生降解。
3.2 热
温度对桑椹花青素的影响较大。花青素的黄烊盐阳离子形态转化为醌式碱的过程为放热反应,而黄烊盐阳离子水解转化为甲醇假碱以及甲醇假碱开环转化为查尔酮均为吸热反应[27]。升高温度时,花青素结构会向无色的甲醇假碱和查尔酮转化;冷却和酸化时,醌式碱和甲醇假碱可转变为黄烊盐阳离子,而查尔酮很难转化为黄烊盐阳离子[27]。BORANBAYEVA等[28]研究发现,在5 ℃贮藏8个月,桑椹汁及桑椹浓缩液中花青素保留率均可达98%以上。张国栋等[29]研究发现,桑椹红色素浓缩液在4、20、60 ℃水浴72 h,花青素损失率分别为3%、13%、100%,在100 ℃水浴24 h其损失率即达到97%。因此,在加工制作桑椹花青素食品时,应尽量在低温下操作并缩短处理时间,以避免或减少花青素的热降解。
3.3 光照
光照加速花青素降解,从C-4位羟基产生中间产物,该中间产物在C-2位水解开环,生成查尔酮,查尔酮继续降解为苯甲酸、三羟基苯甲醛等小分子产物[23]。唐榕等[30]报道桑椹花色苷溶液在室外光(50 000~60 000 W Lux)下放置4 d,其保留率不足60%;在室内光(50~100 Lux)照射或避光放置4 d后,其保留率均在95%以上。ARAMWIT等[31]报道桑椹提取物在室温下荧光(220 V,50 Hz,0.37 A)照射1~6 h,并未引起总花青素含量的显著变化,而持续照射10 h,总花青素含量显著降低(P<0.05)。
3.4 氧气
花青素的不饱和性使得其结构对氧气敏感。ZHOU等[32]研究发现,真空干燥桑椹中矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷的保留率高于热风干燥,2种干燥条件温度相同,但真空条件下氧分压更低,从而提高了花青素保留率。氧气可通过影响多酚氧化酶等氧化酶功能的方式加速花青素的降解[33]。
3.5 其他共存成分
3.5.1 氧化剂和还原剂
研究发现[23],H2O2可破坏桑椹花青素的结构。H2O2对花青素的C-2位亲核进攻,使吡喃环开环形成查尔酮,继而生成无色的酯和香草醛衍生物,进一步使花青素分解或聚合。徐玉娟等[34]报道,随着H2O2浓度(0%、0.5%、1.0%和1.5%)的升高,桑椹红色素溶液的吸光度(A515 nm分别为0.672、0.256、0.208和0.179)明显下降,溶液颜色由鲜红色逐渐变为无色。桑椹果酒生产过程中为防止果酒被氧化为醋酸,通常添加Na2SO3或维生素C作为还原剂。Na2SO3对桑椹红色素具有破坏作用,而维生素C对桑椹红色素具有双重作用,低温时维生素C对桑椹红色素有增色效果,温度较高时维生素C对其有破坏作用。含有0%、0.25%和2.0%维生素C的色素溶液在100 ℃加热100 min后,色素降解率分别为11.24%、40.57%和71.53%。这可能是维生素C在高温时本身会发生降解,产生过氧化物,从而进一步加剧对桑椹红色素的破坏作用[34]。
3.5.2 金属离子
不同金属离子对桑椹花青素稳定性的影响不同。Na+、Ca2+、Mg2+等碱金属[30]及碱土金属离子[30,35]对桑椹花青素稳定性影响不大。Al3+及过渡金属离子(Fe3+、Zn2+、Cu2+等)可与含有邻位酚羟基的花青素发生络合反应,符合要求的花青素包括飞燕草色素、矮牵牛色素、矢车菊色素及其衍生物[36]。Al3+对桑椹花青素稳定性影响不大;Fe3+、Cu2+、Mn2+和Zn2+对桑椹花色苷具有破坏作用,而Fe2+对桑椹花色苷具有增色作用和保护作用[30,35]。
3.5.3 糖类、食盐和食品添加剂
研究发现[37],经麦芽糖渗透处理后制得的桑椹干花青素保留率高于对照组和采用蔗糖或山梨糖醇渗透处理组。刘亮等[38]研究发现,葡萄糖、果糖、蔗糖(添加量15%)均促进了桑椹花色苷热降解(80 ℃加热3 h),这可能是因为糖在加热过程中形成了糠醛等热降解产物,加速花色苷的降解。刘瑜等[39]报道氯化钠具有一定辅色效果,其添加量不超过5%时可使桑椹果粉花青素含量显著增加;而苯甲酸钠和山梨酸钾(添加量0.2~1.0 g/L)使桑椹果粉中花色苷含量降低。KIM等[13]研究发现,在桑椹糖浆生产加工过程中,添加0.3%柠檬酸可使桑椹糖浆及残渣中总花青素含量分别提高24.48 mg/g和292.54 mg/g (以单体花青素含量之和计,鲜重)。
4 影响桑椹花青素稳定性的加工因素
桑椹不耐贮藏和运输,极易腐败、发霉和变质。通常可采取干制、制汁、浓缩、杀菌等食品加工手段来提升其应用价值。
4.1 干制因素
朱燕等[40]报道,新采摘的桑椹果实在短期贮藏(<24 h,10 ℃)时出现花青素含量持续增加的现象,这可能与桑椹采后生理有关。桑椹在干制过程中,花青素含量随着干燥温度升高及时间延长而逐渐降低,烘箱干燥(60 ℃、24 h或80 ℃、6 h)使花青素损失率均超过80%[40]。ZHOU等[32]对比分析了热风烘干和真空干燥对桑椹花色苷的影响,在相同温度下,干燥速度(影响干燥时间)和氧气分压是影响花青素保留的主要因素。真空干燥条件下桑椹中的2种主要花色苷矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷的保留率更高,因为花色苷更少暴露在氧气中。CHEN等[41]对比研究了4种干燥方式对黑桑(Morus nigra L.)花青素的影响,结果表明,冷冻干燥条件下花青素的保留率最高(与鲜果无显著差异),冷冻干燥-膨化-真空干燥组合处理次之(54.06%),其次是热风-膨化-真空干燥组合处理(35.52%)和热风干燥(20.67%)。
4.2 制汁因素
TOMAS等[42]研究了桑椹汁加工过程中花青素含量的变化。结果表明,破碎和压榨使桑椹花青素单体溶出,桑椹汁保留了果实中60%~70%的总花青素,其花青素含量达624 mg(以C3G计)/100 g干基,约为鲜果的3倍;但果渣中仍残留花青素,其含量189 mg/100 g干基。
4.3 浓缩因素
KARA等[43]采用旋转蒸发器(40 ℃)将桑椹汁从15.02 °Brix浓缩至45.20 °Brix,总花青素含量达到2 233 mg/L(以C3G计)。DINCER等[44]分别采取热蒸发和渗透蒸馏2种工艺对黑桑椹汁进行浓缩,结果表明,渗透蒸馏和热蒸发对花青素损失率分别为6.5%和16.2%;从其他指标(如贮藏性)看,渗透蒸馏同样优于热蒸发,更具应用前景。FAZAELI等[45]对比研究了旋转蒸发器和减压微波蒸发器对黑桑椹汁的浓缩效果,研究发现,真空度越低,浓缩耗费时间越长;在相同真空度条件下,微波加热可大幅缩短浓缩时间,降低花青素的损失率,更好保留了黑桑椹汁的色泽。
4.4 杀菌因素
李梦丽等[46]研究发现采用巴氏杀菌(中心温度达到80 ℃后保持20 min)或煮沸(沸腾后维持5 min)方式对桑椹汁进行杀菌处理会造成花青素的损失,而微波杀菌(700 W、2 min)可避免其损失。YOU等[47]研究了不同杀菌方式对桑椹汁贮藏性的影响,结果表明,与未杀菌样品相比,杀菌样品组的花青素保留率更高,从组间看,经30 d、4 ℃贮藏,高静压处理(400 MPa、5 min)对总花青素的保留率最高(84.87%),热处理(70 ℃、10 min)和高温短时处理(110 ℃、8.6 s)对总花青素也具有较高的保留率,分别达到83.19%和84.27%,这表明杀菌可以保持桑椹汁颜色和花青素的稳定。吴琼等[48]报道超高温瞬时杀菌(126 ℃、4 s)时桑椹花色苷损失率27.84%,巴氏杀菌(95 ℃、2 min)使其损失率达43.2%,高静压杀菌(30 ℃、500 MPa、15 min)时损失率高达49.54%。高静压处理使样品中溶解氧的增加和内源酶的激活作用是造成花色苷损失的主要原因。因此,选择杀菌方式需要结合桑椹汁的特性来综合考虑。
5 提高桑椹花青素稳定性的方法和技术
5.1 辅色作用
辅色作用是指花青素和辅色物质通过芳香环之间的π-π堆积力、氢键和范德华力的驱动形成非共价复合物的过程[49]。辅色作用阻断了水分子对花青素分子的亲核进攻,从而阻止花青素形成查尔酮结构,使其不被降解[49]。辅色物质主要包括酚酸、氨基酸、有机酸等小分子物质。YOU等[50]研究发现6种酚酸(咖啡酸、阿魏酸、对香豆酸、没食子酸、对羟基苯甲酸、丁香酸)对桑椹鲜汁4 ℃贮藏稳定性有改善作用,其中添加阿魏酸时总花青素含量以及桑椹鲜汁中2种主要花青素单体(矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷)的保留率最高,比空白组提高20%以上;通过添加咖啡酸、阿魏酸、对香豆酸、没食子酸或对羟基苯甲酸,桑椹鲜汁在4 ℃贮藏过程中λmax红移了1 nm(520 nm→521 nm),而Amax显著增加,说明酚酸对桑椹花青素的红移效应不明显,而增色效应显著(摩尔消光系数增加)。陈湘粤等[51]研究发现有机酸对桑椹花色苷的辅色作用表现为增色效应伴随红移效应,随着有机酸浓度增加溶液λmax红移(1~4 nm)加大;除了辅色物质的浓度因素,辅色物质的结构及环境条件(pH、温度)均能影响辅色作用的效果。有机酸通过降低花色苷溶液降解常数,延长半衰期(t1/2)来提高桑椹花色苷的热稳定性。KHALIFA等[52]研究了绿原酸和槲皮素复配体系对桑椹花青素的增色效应,结果表明,桑椹花青素在95 ℃加热5 h,其保留率仅20.45%,而添加绿原酸或槲皮素后,热稳定性分别提高4.59%和4.33%,将绿原酸和槲皮素复配添加,热稳定性可进一步提高,且溶液颜色加深。当绿原酸200 mg/L、槲皮素50 mg/L复配添加时,t1/2从2.04 h提高到5.78 h。因此,辅色作用是一种改善桑椹汁等饮品颜色品质及稳定性的有效方法。
5.2 构建桑椹花青素-蛋白质复合物
研究证实,花青素和食品蛋白质可以形成复合物。CHENG等[53]研究了桑椹花青素单体矢车菊素-3-葡萄糖苷与β-乳球蛋白的相互作用,光谱学及分子对接模拟计算结果表明,其主要作用力是疏水相互作用力和氢键,复合作用使β-乳球蛋白的高级结构发生改变。CHEN等[54]研究发现,桑椹花青素提取物在pH值3.6、热处理(80 ℃/120 min)条件下,乳清分离蛋白(0.16 mg/mL)使总花青素热降解率降低了5.8%(21.4%→15.6%),研究还发现乳清分离蛋白和芦丁同时添加可发挥协同效应,进一步降低总花青素热降解率。一方面乳清分离蛋白对桑椹花青素有很强的结合作用,另一方面芦丁对桑椹花青素具有辅色作用,乳清分离蛋白通过结合芦丁和桑椹花青素,有利于二者通过辅色作用增强热稳定性。MA等[55]报道,桑椹花青素通过疏水相互作用与大豆分离蛋白复合,在80 ℃加热条件下大豆分离蛋白能够有效地抑制桑椹花青素的热降解作用,但是在95 ℃加热时未能起到保护效果,这可能是因为过高的温度时大豆分离蛋白发生聚集,降低了大豆分离蛋白-桑椹花青素复合物在溶液中的热稳定性。JIANG等[56]研究发现,桑椹花青素提取物在pH值6.3、42 ℃条件下贮藏5 d,添加大豆蛋白使花青素降解半衰期延长15%,而添加大豆蛋白水解物可使半衰期延长225%,这主要是因为大豆蛋白水解物对桑椹花青素(矢车菊素-3-葡萄糖苷)的结合能力更强。在此基础上,HE等[57]分别采取胃蛋白酶、木瓜蛋白酶水解大豆蛋白制备大豆蛋白水解物。结果表明,在相同环境条件下(pH值6.3),2种水解物对溶液颜色和花青素有很好的保护作用,胃蛋白酶水解物与矢车菊素-3-葡萄糖苷结合亲和力更强,其添加量1.0 mg/mL时花青素半衰期从1.8 d延长到5.7 d。
5.3 构建桑椹花青素纳米颗粒
研究发现,通过构建花青素纳米颗粒,不仅可以发挥对花青素的保护作用,而且可以提升花青素的生物可及性,改善其生物利用度。张丽霞等[58]以鸡卵白蛋白为载体材料,通过蛋白质的结合作用构建了鸡卵白蛋白-桑椹酒渣花色苷纳米颗粒。经测定,包埋率可达82.34%,纳米颗粒直径40~45 nm,在模拟肠消化模型(pH值7.4)中,纳米颗粒中花色苷的保留率显著高于未包埋的花色苷。常影等[59]采用反溶剂法制备桑椹花色苷纳米脂质体,并将不同浓度壳聚糖溶液按照不同比例加入到纳米脂质体溶液中,得到壳聚糖修饰的桑椹花色苷纳米脂质体,结果表明,脂质体粒径111.5 nm,壳聚糖可改善脂质体对桑椹花色苷的包封效果(包封率86.22%),稳定脂质体结构,提高花色苷对热(80 ℃)、光和重金属离子(Fe2+、Fe3+、Cu2+)的稳定性。GÜLTEKIN-ÖZGÜVEN等[60]研究发现,壳聚糖修饰使黑桑(Morus nigra L.)提取物纳米脂质体粒度从约150 nm减小至约80 nm,对花青素的保留率提高,通过喷雾干燥将构建壳聚糖修饰的黑桑提取物纳米脂质体制备成粉末,将其作为配料可制成花青素含量达76.8%的黑巧克力。
5.4 微胶囊包埋技术
微胶囊包埋被证明是稳定和递送花青素的实用技术,不仅可以提高花青素的稳定性,而且能够拓宽花青素配料在食品中的应用范围。KHALIFA等[61]研究发现乳清蛋白是桑椹花青素微胶囊包埋的良好壁材,通过复配麦芽糊精或阿拉伯胶,经喷雾干燥可得到表面光滑致密的桑椹花青素微胶囊(粒径11~34 mm)。XU等[62]将桑椹汁经X-5大孔吸附树脂纯化后,采用阿拉伯胶乳化,将乳液冷冻干燥得到冻干粉,花青素包埋率90.07%~97.36%,以C3G计,花青素含量58.22~121.23 mg/100 g;冻干粉与阿拉伯胶按照1∶90(质量比)构建的微胶囊经热处理,花青素损失率19.88%,制成冻干粉后损失率为30.31%。YAMDECH等[63]将海藻酸钙微球干燥(60 ℃,4 h)后,加入到桑椹提取物溶液中使其充分吸附花青素(4 ℃放置2 h),取出冻干。经测定,海藻酸钙微球对桑椹花青素的吸附量为2.283 mg/g(干基)。在80 ℃(10 h)及100 ℃(5 h)处理条件下,吸附在海藻酸钙微球上的桑椹花青素保留率更高,而121 ℃(20 min)处理时,在提取物溶液中或在海藻酸钙微球上,桑椹花青素的保留率无显著性差异。
6 桑椹花青素在食品中的应用
6.1 用于食品着色
桑椹红是我国GB 2760—2014《食品安全国家标准 食品添加剂使用标准》批准使用的48种天然色素之一,可用于果糕类、糖果、果蔬汁(浆)类饮料、风味饮料、果酒、果冻等六类食品。GB 1886.345—2021明确桑椹红为紫红色或紫黑色的粉末或黏稠状液体,主要花青素单体为矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷。商品化的桑椹红产品可添加葡萄糖、食用糊精等其他辅料,以满足具体应用需要。在应用特性开发方面, BYAMUKAMA等[64]将桑椹汁用于酸奶着色,结果表明,桑椹汁按照花青素25~40 mg(C3G当量)添加到100 g酸奶中,其呈色效果与每100 g酸奶中添加20 mg FD&C红色3号相当;且随着桑椹汁添加量增加,其花青素及颜色稳定性增强。VEGA等[65]将桑椹(Morus nigra L.)经制汁、巴氏杀菌后,通过喷雾干燥得到粉末,在冷藏(3 ℃)和室温(23 ℃)下贮存12周,花青素组成分析及色差分析结果均表明粉末具有良好且稳定的着色能力。DU等[66]将桑椹果渣经热泵干燥后粉碎、过120目筛得到粉末,以1%、2%、3%(质量分数)添加到搅拌型风味酸奶中,研究发现桑椹果渣粉末不仅赋予其颜色(粉色→深红色),而且起到改善质地的作用,酸奶在28 d贮藏期内持水性增强,黏性和稠度增加,体系均匀性提高。
6.2 新鲜度指示剂
利用桑椹花青素在不同pH条件下呈现不同颜色的特性,可将其作为一种天然、安全的pH指示剂,用于制备食品新鲜度指示型智能包装材料。当食品变质腐败产生的酸或挥发性气体引起食品pH值改变,随即反映为pH指示材料的颜色变化,借此来监测食品新鲜度。SUN等[67]采用溶液流延法制备了基于魔芋葡甘聚糖/壳聚糖/纳米氧化锌和桑椹花青素提取物的多功能纳米复合膜,在pH值2~12内,该复合膜由红至蓝呈现出肉眼可区分的颜色差异。ZENG等[68]开发了一种基于明胶/聚乙烯醇基质和桑椹渣花青素提取物的pH指示膜,随着pH升高,该复合膜由亮红色(pH值2.0~3.0)、紫色(pH值4.0~6.0)、灰色(pH值7.0)逐渐变化为绿色至深绿色(pH值9.0~11.0),并具有肉眼可区分的颜色差异;该研究将pH指示膜用于监测鲮鱼(Cirrhina molitorella)腐败,结果表明,在24 h观测期内,鲮鱼腐败产生的挥发性盐基氮(total volatile basic nitrogen,TVB-N)使体系pH值升高,复合膜的颜色变化与TVB-N值具有较好的相关性。ZHANG等[69]制备了由羧甲基淀粉钠和κ-角叉菜胶结合桑椹花青素提取物制成的精确智能薄膜,用于监测镜鲤(Cyprinus carpio var. specularis)的新鲜度变化。研究结果表明,在40 h观测期内,TVB-N值在30 h时逼近限值(20 mg/100 g;GB 2733—2015),这时薄膜颜色由最初的红色变化为暗蓝色。LI等[25]采用3D打印技术制备了以壳聚糖为成膜基质的桑椹花青素指示膜并用于监测猪肉的新鲜度。结果表明,当猪肉发生变质时,指示膜的颜色从红色变为灰蓝色。采用智能手机拍摄图像并通过应用程序分析图像,建立颜色参数(RGB值)与腐败指标参数(TVB-N值)的定量关系模型,从而为桑椹花青素指示膜智能化应用奠定了基础。
6.3 抗菌和食品保鲜
桑椹花青素具有抗菌活性,类似其他酚类物质,主要通过渗透进入细胞膜,与膜上蛋白质结合使其失活,从而抑制细菌生长[25]。KHALID等[70]的研究显示,黑桑椹(Morus nigra L.)鲜汁中总花青素含量达769 mg/g(以C3G计),对5种革兰氏阳性菌(螺旋芽孢杆菌、枯草芽孢杆菌、白喉杆菌、粪肠球菌、金黄色葡萄糖球菌)和3种革兰氏阴性菌(大肠杆菌、铜绿假单胞菌、鼠伤寒沙门氏菌)均具有良好抗菌作用,其中对粪肠球菌的抑菌活性甚至高于新霉素(30 mg)和庆大霉素(10 mg)。LI等[25]对比分析了壳聚糖薄膜在添加桑椹花青素前后的抑菌性,薄膜经紫外线灭菌后投入到菌悬液中37 ℃保温2 h,采用平板计数法测定菌落总数。结果表明,添加桑椹花青素(0.1 g)使壳聚糖薄膜表现出抑菌作用,大肠杆菌(5.02 log CFU/mL→4.86 log CFU/mL)及金黄色葡萄球菌(5.03 log CFU/mL→4.97 log CFU/mL)的活菌计数显著下降(P<0.05),从结果看桑椹花青素对大肠杆菌有更强的抑制作用。SUN等[67]研究发现,添加纳米氧化锌可赋予魔芋葡甘聚糖-壳聚糖复合膜良好的抗菌性,在复合膜制备过程中添加桑椹花青素提取物,从抑菌圈直径看,复合膜的抗菌性得到提高,这进一步证实桑椹花青素对大肠杆菌和金黄色葡萄球菌具有抑菌作用。ZHOU等[71]将桑椹提取物按照不同配比(0%、5%、10%和20%,以魔芋葡甘聚糖计)与魔芋葡甘聚糖、羟丙甲基纤维素构建复合膜,抗菌性能评价(GB/T 20944.1—2017)结果表明,是桑椹提取物而非多糖基质赋予复合膜良好的抗菌性能,且随着桑椹提取物添加量增加,抑菌圈直径从18 mm增加到33 mm。
桑椹花青素除了作为食品着色剂,还可用作抗氧化剂或天然抗菌剂来抑制食品成分氧化或微生物生长,从而延长食品的保质期。TURAN等[72]考察了添加黑桑椹(Morus nigra L.)水提取物冻干粉对牛肉派的保鲜效果。研究发现,尽管真空包装比有氧包装能缓解牛肉派贮藏过程中脂质氧化和高铁肌红蛋白生成,添加冻干粉进一步提高了抑制脂质氧化和高铁肌红蛋白的含量水平;冻干粉通过着色、抑制脂质和蛋白质氧化等方式保持牛肉派的颜色稳定性,同时通过抑制腐败微生物生长延长产品货架期,使有氧包装牛肉派的货架期延长3~6 d,而真空包装的货架期超过15 d;综合感官评定结果,冻干粉的合适添加量为0.2%。CHENG等[73]报道,浓缩桑椹汁(总花青素含量4.91 mg/g干基,以C3G计)对猪肉脯在加工及贮藏过程中的脂质和蛋白质氧化均有很好的抑制作用,同时浓缩桑椹汁具有提高猪肉脯红度和增加颜色稳定性的作用;研究还发现,添加β-环糊精还可降低花青素在加工及贮藏过程中的损失率,与对照组相比,猪肉脯中添加1% β-环糊精可使总花青素损失率降低11.14%。桑椹花青素的着色、抗氧化、抑菌等多重作用使其作为多功能配料在新型健康型肉品开发方面极具应用潜力。
6.4 功能性食品开发
桑椹花青素具有抗氧化、降血脂、抗炎、调节脂质代谢等多种生理活性[7-8, 74]。因此,桑椹花青素作为生物活性成分应用于功能性食品,有望对人体健康发挥有益作用。WU等[8]的研究显示,高脂膳食喂养的小鼠(C57BL/6)摄取一定剂量桑椹(Morus australis Poir)花青素(200 mg/kg食物)可显著减少体重增加。与高脂膳食组相比,喂养8周后,奥利司他(一种治疗肥胖药物)使其减少17.1%,而桑椹花青素可使其减少32.7%。NATTIRA等[74]研制了一款含桑椹花青素的果冻,经感官评定,其总体可接受性良好;将其用于对血脂异常受试者进行干预,每天摄食果冻170 g(其中含桑椹花青素191 mg),连续干预7 d后,受试者体内炎症标志物白细胞介素-6降低,血脂中胆固醇和低密度脂蛋白水平分别下降7%和10%。王静[75]研究发现桑椹花青素饮品对人为造成脊髓损伤大鼠的运动功能具有促进恢复的作用,而且桑椹花青素纯度越高效果越好。THUKHAM-MEE等[76]报道,桑椹奶(每份180 mL,花青素含量34.30 mg/L,以矢车菊素葡萄糖苷计)可改善18~60岁成年人的记忆力(包括注意力、注意力的连续性、记忆速度和记忆质量)。300名健康受试者每天食用1~2份富含花青素的桑椹奶,6周后,受试者在单词识别、图片识别、简单反应、选择反应时间、空间记忆和数字工作记忆方面的反应时间显著缩短,且对文字识别、图片识别、数字警惕和空间记忆方面的准确率显著提高。
桑椹花青素对蛋白质、淀粉的消化有调节作用。MA等[55]报道,桑椹花青素通过疏水相互作用与大豆分离蛋白复合,提高了大豆分离蛋白对胃蛋白酶的消化率,但是在肠液中的消化受到一定的抑制,这主要是不同消化液环境中大豆分离蛋白的二级结构因桑椹花青素的作用发生了不同程度的改变。KHALIFA等[77]的研究表明,微胶囊化的桑椹花青素(添加量20%)可提升能量球模型中乳清蛋白的消化率,研究认为桑椹花青素与乳清蛋白结合,通过部分去折叠乳清蛋白的二级结构增加了消化酶对肽键的可及性。YAZDANKHAH等[78]研究了添加黑桑椹提取物冻干粉的意大利面条作为Ⅱ型糖尿病膳食的潜力,结果表明,该面条对α-淀粉酶和α-葡萄糖苷酶的活性有较强的抑制作用,在冻干粉添加量1.5%时其抑制效果甚至优于阿卡波糖,血糖生成指数预测值为47.32。
7 结论与展望
近年来,桑椹在国内外得到广泛关注,它富含花青素等对人体健康有益的活性成分。桑椹花青素含量受其品种、成熟度等因素的影响,其主要组成成分为矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷。桑椹花青素在氧气、光、热等因素的作用下易褪色和降解,因此在干制、制汁、杀菌等加工环节会受到损失。在桑椹果酒制备中花青素的损失率高达50%[79],将其加工成果酱(71 °Brix),主要花青素单体的损失率超过97%[80]。研究发现,通过辅色作用、构建花青素-蛋白质复合物或纳米颗粒、微胶囊包埋等技术手段可提高桑椹花青素的稳定性。桑椹花青素利用其呈色特性,可用于食品着色或作为食品新鲜度指示剂,根据其抑菌、抗氧化、降血脂等生理活性,可将其用于食品保鲜及功能性食品开发。当前,针对桑椹花青素稳定性的研究仍较为缺乏,这为桑椹花青素在食品加工及保藏过程中的稳定化带来巨大挑战。为了更好利用桑椹及其花青素资源,应考虑以下4个方面:a)当前对加工及保藏过程中花青素损失囿于对数据的解释,缺乏机制分析;b)桑椹花青素在加工及保藏过程中的损失是多因素引起的,今后宜对内部因素(花青素组成结构、内源酶等)和环境/加工因素开展关联性研究,以厘清花青素降解途径;c)对桑椹花青素稳定化的措施包括辅色作用、构建复合物等,仍处于摸索和试错阶段,建议借助分子动力学模拟等手段提升研究的技术水平;d)根据结构决定功能原因,优化花青素结构是改善其稳定性的基础,以花青素为主要目标对象的桑椹品种选育,应以培育具有结构稳定的桑椹花青素组分为目标。
[1] YUAN Q X, ZHAO L Y.The mulberry (Morus alba L.) fruit—A review of characteristic components and health benefits[J].Journal of Agricultural and Food Chemistry, 2017, 65(48):10383-10394.
[2] HUANG G Q, ZENG Y C, WEI L, et al.Comparative transcriptome analysis of mulberry reveals anthocyanin biosynthesis mechanisms in black (Morus atropurpurea Roxb.) and white (Morus alba L.) fruit genotypes[J].BMC Plant Biology, 2020, 20(1):279.
[3] KAMILOGLU S, SERALI O, UNAL N, et al.Antioxidant activity and polyphenol composition of black mulberry (Morus nigra L.) products[J].Journal of Berry Research, 2013, 3(1):41-51.
[4] ERCISLI S, ORHAN E.Chemical composition of white (Morus alba), red (Morus rubra) and black (Morus nigra) mulberry fruits[J].Food Chemistry, 2007, 103(4):1380-1384.
[5] ![]() M M,
M M, ![]() PAPETTI A, et al.Analysis and characterisation of phytochemicals in mulberry (Morus alba L.) fruits grown in Vojvodina, North Serbia[J].Food Chemistry, 2015, 171:128-136.
PAPETTI A, et al.Analysis and characterisation of phytochemicals in mulberry (Morus alba L.) fruits grown in Vojvodina, North Serbia[J].Food Chemistry, 2015, 171:128-136.
[6] YANG J F, LIU X J, ZHANG X X, et al.Phenolic profiles, antioxidant activities, and neuroprotective properties of mulberry (Morus atropurpurea Roxb.) fruit extracts from different ripening stages[J].Journal of Food Science, 2016, 81(10):C2439-C2446.
[7] 薛宏坤, 李鹏程, 钟雪, 等.高速逆流色谱分离纯化桑葚花色苷及其抗氧化活性[J].食品科学, 2020, 41(15):96-104. XUE H K, LI P C, ZHONG X, et al.Separation and purification of anthocyanins from mulberry fruit by high-speed counter-current chromatography and their antioxidant activity[J].Food Science, 2020, 41(15):96-104.
[8] WU T J, YIN J J, ZHANG G H, et al.Mulberry and cherry anthocyanin consumption prevents oxidative stress and inflammation in diet-induced obese mice[J].Molecular Nutrition &Food Research, 2016, 60(3):687-694.
[9] LUCIA K, OLGA G, EVA I, et al.Biological properties of black mulberry-derived food products (Morus nigra L.)[J].Journal of Berry Research, 2016, 6(3):333-343. [10] QIN C G, LI Y, NIU W N, et al.Analysis and characterisation of anthocyanins in mulberry fruit[J].Czech Journal of Food Sciences, 2010, 28(2):117-126.
[11] DU Q, ZHENG J, XU Y.Composition of anthocyanins in mulberry and their antioxidant activity[J].Journal of Food Composition and Analysis, 2008, 21(5):390-395.
[12] ZOU T B, WANG D L, GUO H H, et al.Optimization of microwave-assisted extraction of anthocyanins from mulberry and identification of anthocyanins in extract using HPLC-ESI-MS[J].Journal of Food Science, 2012, 77(1):C46-C50.
[13] KIM I, LEE J.Variations in anthocyanin profiles and antioxidant activity of 12 genotypes of mulberry (Morus spp.) fruits and their changes during processing[J].Antioxidants, 2020, 9(3):242.
[14] WU X Y, LIANG L H, ZOU Y, et al.Aqueous two-phase extraction, identification and antioxidant activity of anthocyanins from mulberry (Morus atropurpurea Roxb.)[J].Food Chemistry, 2011, 129(2):443-453.
[15] ESPADA-BELLIDO E, FERREIRO-GONZ LEZ M, CARRERA C, et al.Optimization of the ultrasound-assisted extraction of anthocyanins and total phenolic compounds in mulberry (Morus nigra) pulp[J].Food Chemistry, 2017, 219:23-32.
LEZ M, CARRERA C, et al.Optimization of the ultrasound-assisted extraction of anthocyanins and total phenolic compounds in mulberry (Morus nigra) pulp[J].Food Chemistry, 2017, 219:23-32.
[16] 杨若琳, 陈文胜, 卢小草, 等.不同品种和生长期桑葚花青素成分对比分析[J].福建林业科技, 2017, 44(4):48-51;78. YANG R L, CHEN W S, LU X C, et al.Contrastive analysis of the composition of anthocyanins in mulberry from different vaireties and growing periods[J].Journal of Fujian Forestry Science and Technology, 2017, 44(4):48-51;78.
[17] DUGO P, MONDELLO L, ERRANTE G, et al.Identification of anthocyanins in berries by narrow-bore high-performance liquid chromatography with electrospray ionization detection.[J].Journal of Agricultural and Food Chemistry, 2001, 49(8):3987-3992.
[18] 冉国敬, 蒋鑫炜, 黎浩仪, 等.利用中压制备液相色谱从桑葚中快速制备矢车菊素-3-葡萄糖苷单体[J].食品科学, 2019, 40(3):94-100. RAN G J, JIANG X W, LI H Y, et al.Rapid preparation of cyanidin-3-glucoside from mulberry fruit by preparative medium pressure liquid chromatography[J].Food Science, 2019, 40(3):94-100.
[19] KIM I, MOON J K, HUR S J, et al.Structural changes in mulberry (Morus Microphylla.Buckl) and chokeberry (Aronia melanocarpa) anthocyanins during simulated in vitro human digestion[J].Food Chemistry, 2020, 318:126449.
[20] HRAZDINA G, BORZELL A J, ROBINSON W B.Studies on the stability of the anthocyanidin-3,5-digucosides[J].American Journal of Enology and Viticulture, 1970, 21(4):201-204.
[21] ZHANG B, JIANG X, HUANG G, et al.Preparation and characterization of methylated anthocyanins from mulberry fruit with iodomethane as a donor[J].Sericologia, 2019, 59(3/4):106-116.
[22] 蒋希芝, 徐磊, 张蓓, 等.基于生物酶法的酰基化桑椹花青素的制备与特性[J].农业工程学报, 2021, 37(3):294-301. JIANG X Z, XU L, ZHANG B, et al.Preparation and characterization of acylated mulberry anthocyanins using biological enzyme method[J].Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(3):294-301.
[23] ZHANG P, LI Y, CHONG S L, et al.Identification and quantitative analysis of anthocyanins composition and their stability from different strains of Hibiscus syriacus L.flowers[J].Industrial Crops and Products, 2022, 177:114457.
[24] ZHAO C L, YU Y Q, CHEN Z J, et al.Stability-increasing effects of anthocyanin glycosyl acylation[J].Food Chemistry, 2017, 214:119-128.
[25] LI S Q, JIANG Y L, ZHOU Y T, et al.Facile fabrication of sandwich-like anthocyanin/chitosan/lemongrass essential oil films via 3D printing for intelligent evaluation of pork freshness[J].Food Chemistry, 2022, 370:131082.
[26] AKKARACHANEEYAKORN S, TINRAT S.Effects of types and amounts of stabilizers on physical and sensory characteristics of cloudy ready-to-drink mulberry fruit juice[J].Food Science &Nutrition, 2015, 3(3):213-220.
[27] 孙建霞, 张燕, 胡小松, 等.花色苷的结构稳定性与降解机制研究进展[J].中国农业科学, 2009, 42(3):996-1008. SUN J X, ZHANG Y, HU X S, et al.Structural stability and degradation mechanisms of anthocyanins[J].Scientia Agricultura Sinica, 2009, 42(3):996-1008.
[28] BORANBAYEVA T, KARADENIZ F, Y LMAZ E.Effect of storage on anthocyanin degradation in black mulberry juice and concentrates[J].Food and Bioprocess Technology, 2014, 7(7):1894-1902.
LMAZ E.Effect of storage on anthocyanin degradation in black mulberry juice and concentrates[J].Food and Bioprocess Technology, 2014, 7(7):1894-1902.
[29] 张国栋, 仇晓冬, 胡博然.桑葚红色素的微波辅助提取工艺优化与稳定性研究[J].中国食品添加剂, 2014(6):107-111. ZHANG G D, QIU X D, HU B R, et al.Study of microwave assisted extraction of red pigment from mulberry and its stability[J].China Food Additives, 2014(6):107-111.
[30] 唐榕, 宁恩创, 林莹.桑葚花色苷的提取纯化及稳定性[J].食品工业科技, 2018, 39(14):181-185;199. TANG R, NING E C, LIN Y, et al.Extraction, purification and stability of anthocyanin from mulberry[J].Science and Technology of Food Industry, 2018, 39(14):181-185;199.
[31] ARAMWIT P, BANG N, SRICHANA T.The properties and stability of anthocyanins in mulberry fruits[J].Food Research International, 2010, 43(4):1093-1097.
[32] ZHOU M, CHEN Q Q, BI J F, et al.Degradation kinetics of cyanidin 3-O-glucoside and cyanidin 3-O-rutinoside during hot air and vacuum drying in mulberry (Morus alba L.) fruit:A comparative study based on solid food system[J].Food Chemistry, 2017, 229:574-579.
[33] GHAREAGHAJLOU N, HALLAJ-NEZHADI S, GHASEMPOUR Z.Red cabbage anthocyanins:Stability, extraction, biological activities and applications in food systems[J].Food Chemistry, 2021, 365:130482.
[34] 徐玉娟, 肖更生, 刘学铭, 等.桑椹红色素稳定性的研究[J].蚕业科学, 2002, 28(3):265-269. XU Y J, XIAO G S, LIU X M, et al.Study on stability of the red pigment from mulberry fruit[J].Acta Sericologica Sinica, 2002, 28(3):265-269.
[35] 任二芳, 李昌宝, 孙健, 等.金属离子和食品添加剂对桑果花色苷稳定性的影响[J].南方农业学报, 2014, 45(1):98-103. REN E F, LI C B, SUN J, et al.Effects of metal ions and food additives on stability of anthocyanins from mulberry[J].Journal of Southern Agriculture, 2014, 45(1):98-103.
[36] HUANG Y X, ZHOU S Y, ZHAO G H, et al.Destabilisation and stabilisation of anthocyanins in purple-fleshed sweet potatoes:A review[J].Trends in Food Science &Technology, 2021, 116:1141-1154.
[37] CHOTTAMOM P, KONGMANEE R, MANKLANG C, et al.Effect of osmotic treatment on drying kinetics and antioxidant properties of dried mulberry[J].Drying Technology, 2012, 30(1):80-87.
[38] 刘亮, 吴悦, 曹少谦.桑椹花色苷在不同糖体系中的热降解动力学研究[J].湖北农业科学, 2011, 50(5):1018-1022. LIU L, WU Y, CAO S Q.Thermal degradation kinetics of anthocyanins obtained from mulberry juice in different sugar model systems[J].Hubei Agricultural Sciences, 2011, 50(5):1018-1022.
[39] 刘瑜, 黄文, 王益, 等.桑葚果粉的制备工艺及其稳定性研究[J].食品工业科技, 2019, 40(4):178-183. LIU Y, HUANG W, WANG Y, et al.Study on the preparation technology and stability of mulberry powder[J].Science and Technology of Food Industry, 2019, 40(4):178-183.
[40] 朱燕, 刘培刚, 陈文广, 等.不同果桑品种桑椹花青素含量比较分析及干燥工艺研究[J].蚕业科学, 2020, 46(6):749-756. ZHU Y, LIU P G, CHEN W G, et al.Comparison of anthocyanin content in fruit of different fruit mulberry varieties and study on its drying technology[J].Acta Sericologica Sinica, 2020, 46(6):749-756.
[41] CHEN Q Q, LI Z L, BI J F, et al.Effect of hybrid drying methods on physicochemical, nutritional and antioxidant properties of dried black mulberry[J].LWT, 2017, 80:178-184.
[42] TOMAS M, TOYDEMIR G, BOYACIOGLU D, et al.The effects of juice processing on black mulberry antioxidants[J].Food Chemistry, 2015, 186:277-284.
[43] KARA  , ERÇELEBI E A.Thermal degradation kinetics of anthocyanins and visual colour of Urmu mulberry (Morus nigra L.)[J].Journal of Food Engineering, 2013, 116(2):541-547.
, ERÇELEBI E A.Thermal degradation kinetics of anthocyanins and visual colour of Urmu mulberry (Morus nigra L.)[J].Journal of Food Engineering, 2013, 116(2):541-547.
[44] DINCER C, TONTUL I, TOPUZ A.A comparative study of black mulberry juice concentrates by thermal evaporation and osmotic distillation as influenced by storage[J].Innovative Food Science &Emerging Technologies, 2016, 38:57-64.
[45] FAZAELI M, HOJJATPANAH G, EMAM-DJOMEH Z.Effects of heating method and conditions on the evaporation rate and quality attributes of black mulberry (Morus nigra) juice concentrate[J].Journal of Food Science and Technology, 2013, 50(1):35-43.
[46] 李梦丽, 马建勇, 李春美.红树莓果汁和桑椹果汁花色苷结构的鉴定及杀菌方式对果汁品质的影响[J].食品科学, 2018, 39(11):75-82. LI M L, MA J Y, LI C M.Identification of anthocyanins in red raspberry and mulberry juices and effects of different sterilization treatments on the quality of juices[J].Food Science, 2018, 39(11):75-82.
[47] YOU Y L, LI N, HAN X, et al.Influence of different sterilization treatments on the color and anthocyanin contents of mulberry juice during refrigerated storage[J].Innovative Food Science &Emerging Technologies, 2018, 48:1-10.
[48] 吴琼, 冯卫敏, 蒋和体.不同杀菌方式对桑葚原汁品质的影响[J].食品科学, 2016, 37(9):144-149. WU Q, FENG W M, JIANG H T.Effect of sterilization methods on the quality of mulberry juice[J].Food Science, 2016, 37(9):144-149.
[49] NIE M, WANG L, LU S M, et al.Protective effect of amino acids on the stability of bayberry anthocyanins and the interaction mechanism between L-methionine and cyanidin-3-O-glycoside[J].Food Chemistry, 2022, 396:133689.
[50] YOU Y L, LI N, HAN X E, et al.The effects of six phenolic acids and tannic acid on colour stability and the anthocyanin content of mulberry juice during refrigerated storage[J].International Journal of Food Science &Technology, 2019, 54(6):2141-2150.
[51] 陈湘粤, 高群玉, 李倩, 等.有机酸对桑椹花色苷的辅色作用及其热降解动力学规律[J].现代食品科技, 2022, 38(6):116-125. CHEN X Y, GAO Q Y, LI Q, et al.Co-pigmentation of mulberry anthocyanins with organic acids:Color enhancement and thermal degradation kinetics[J].Modern Food Science and Technology, 2022, 38(6):116-125.
[52] KHALIFA I, DU J, NAWAZ A, et al.Multiple co-pigments of quercetin and chlorogenic acid blends intensify the color of mulberry anthocyanins:Insights from hyperchromicity, kinetics, and molecular modeling investigations[J].Journal of the Science of Food and Agriculture, 2021, 101(4):1579-1588.
[53] CHENG J, LIU J H, PRASANNA G, et al.Spectrofluorimetric and molecular docking studies on the interaction of cyanidin-3-O-glucoside with whey protein, β-lactoglobulin[J].International Journal of Biological Macromolecules, 2017, 105:965-972.
[54] CHEN X, GUAN Y M, ZENG M M, et al.Effect of whey protein isolate and phenolic copigments in the thermal stability of mulberry anthocyanin extract at an acidic pH[J].Food Chemistry, 2022, 377:132005.
[55] MA Z, CHENG J, JIAO S S, et al.Interaction of mulberry anthocyanins with soybean protein isolate:Effect on the stability of anthocyanins and protein in vitro digestion characteristics[J].International Journal of Food Science &Technology, 2022, 57(4):2267-2276.
[56] JIANG Y T, YIN Z C, WU Y R, et al.Inhibitory effects of soy protein and its hydrolysate on the degradation of anthocyanins in mulberry extract[J].Food Bioscience, 2021, 40:100911.
[57] HE W J, GUO F X, JIANG Y T, et al.Enzymatic hydrolysates of soy protein promote the physicochemical stability of mulberry anthocyanin extracts in food processing[J].Food Chemistry, 2022, 386:132811.
[58] 张丽霞, 刘书晶, 张晨颜, 等.鸡卵白蛋白-桑葚酒渣花色苷纳米颗粒特性[J].林业工程学报, 2021, 6(1):92-97. ZHANG L X, LIU S J, ZHANG C Y, et al.Characteristics of chicken ovalbumin-mulberry wine pomace anthocyanin nanoparticles[J]. Journal of Forestry Engineering, 2021, 6(1):92-97.
[59] 常影, 杨晓雪, 焦岩, 等.桑葚花色苷纳米脂质体的修饰及稳定性研究[J].食品科技, 2020, 45(12):251-257. CHANG Y, YANG X X, JIAO Y, et al.Study on the modification and stability of mulberry anthocyanin nanoliposomes[J].Food Science and Technology, 2020, 45(12):251-257.
[60] GÜLTEKIN-ÖZGÜVEN M, ![]() A, DUMAN
A, DUMAN  , et al.Fortification of dark chocolate with spray dried black mulberry (Morus nigra) waste extract encapsulated in chitosan-coated liposomes and bioaccessability studies[J].Food Chemistry, 2016, 201:205-212.
, et al.Fortification of dark chocolate with spray dried black mulberry (Morus nigra) waste extract encapsulated in chitosan-coated liposomes and bioaccessability studies[J].Food Chemistry, 2016, 201:205-212.
[61] KHALIFA I, LI M L, MAMET T, et al.Maltodextrin or gum arabic with whey proteins as wall-material blends increased the stability and physiochemical characteristics of mulberry microparticles[J].Food Bioscience, 2019, 31:100445.
[62] XU L, CHENG J R, LIU X M, et al.Effect of microencapsulated process on stability of mulberry polyphenol and oxidation property of dried minced pork slices during heat processing and storage[J].LWT, 2019, 100:62-68.
[63] YAMDECH R, ARAMWIT P, KANOKPANONT S.Stability of anthocyanin from mulberry extracts in alginate microspheres at high temperature[J]. Advanced Materials Research, 2012, 506: 587-590.
[64] BYAMUKAMA R, ANDIMA M, MBABAZI A, et al.Anthocyanins from mulberry (Morus rubra) fruits as potential natural colour additives in yoghurt[J].African Journal of Pure and Applied Chemistry, 2014, 8(12):182-190.
[65] VEGA E N, MOLINA A K, PEREIRA C, et al.Anthocyanins from Rubus fruticosus L.and Morus nigra L.applied as food colorants:A natural alternative[J].Plants, 2021, 10(6):1181.
[66] DU H X, YANG H G, WANG X P, et al.Effects of mulberry pomace on physicochemical and textural properties of stirred-type flavored yogurt[J].Journal of Dairy Science, 2021, 104(12):12403-12414.
[67] SUN J S, JIANG H X, WU H B, et al.Multifunctional bionanocomposite films based on konjac glucomannan/chitosan with nano-ZnO and mulberry anthocyanin extract for active food packaging[J].Food Hydrocolloids, 2020, 107:105942.
[68] ZENG P, CHEN X, QIN Y R, et al.Preparation and characterization of a novel colorimetric indicator film based on gelatin/polyvinyl alcohol incorporating mulberry anthocyanin extracts for monitoring fish freshness[J].Food Research International, 2019, 126:108604.
[69] ZHANG C J, SUN G H, CAO L L, et al.Accurately intelligent film made from sodium carboxymethyl starch/κ-carrageenan reinforced by mulberry anthocyanins as an indicator[J].Food Hydrocolloids, 2020, 108:106012.
[70] KHALID N, FAWAD S A, AHMED I.Antimicrobial activity, phytochemical profile and trace minerals of black mulberry (Morus nigra L.) fresh juice[J].Pakistan Journal of Botany, 2011, 43:91-96.
[71] ZHOU N, WANG L, YOU P Q, et al.Preparation of pH-sensitive food packaging film based on konjac glucomannan and hydroxypropyl methyl cellulose incorporated with mulberry extract[J].International Journal of Biological Macromolecules, 2021, 172:515-523.
[72] TURAN E,  IM
IM EK A.Effects of lyophilized black mulberry water extract on lipid oxidation, metmyoglobin formation, color stability, microbial quality and sensory properties of beef patties stored under aerobic and vacuum packaging conditions[J].Meat Science, 2021, 178:108522.
EK A.Effects of lyophilized black mulberry water extract on lipid oxidation, metmyoglobin formation, color stability, microbial quality and sensory properties of beef patties stored under aerobic and vacuum packaging conditions[J].Meat Science, 2021, 178:108522.
[73] CHENG J R, LIU X M, ZHANG W, et al.Stability of phenolic compounds and antioxidant capacity of concentrated mulberry juice-enriched dried-minced pork slices during preparation and storage[J].Food Control, 2018, 89:187-195.
[74] NATTIRA O N, UTHAIWAN S, JUTAMAS T, et al.Consumption of anthocyanin-rich mulberry fruit jelly with a high-fat meal decreases postprandial serum cardiometabolic risk factors in dyslipidemia subjects[J].Journal of Nutrition and Metabolism, 2020, 2020(10):1-9.
[75] 王静. 桑葚花青素饮品对脊髓损伤大鼠运动功能恢复的作用[J].动物医学进展, 2018, 39(5):86-90. WANG J.Effects of mulberry anthocyanin drinks on motor function recovery in rats with spinal cord injury[J].Progress in Veterinary Medicine, 2018, 39(5):86-90.
[76] THUKHAM-MEE W, WATTANATHORN J, PAHOLPAK P, et al.The positive modulation effect of a 6-week consumption of an anthocyanin-rich mulberry milk on working memory, cholinergic, and monoaminergic functions in healthy working-age adults[J].Oxidative Medicine and Cellular Longevity, 2021,2021:2-8.
[77] KHALIFA I, ZHU W, NAWAZ A, et al.Microencapsulated mulberry anthocyanins promote the in vitro-digestibility of whey proteins in glycated energy-ball models[J].Food Chemistry, 2021, 345:128805.
[78] YAZDANKHAH S, HOJJATI M, AZIZI M H.The antidiabetic potential of black mulberry extract-enriched pasta through inhibition of enzymes and glycemic index[J].Plant Foods for Human Nutrition, 2019, 74(1):149-155.
[79] PÉREZ-GREGORIO M R, REGUEIRO J, ALONSO-GONZ LEZ E, et al.Influence of alcoholic fermentation process on antioxidant activity and phenolic levels from mulberries (Morus nigra L.)[J].LWT-Food Science and Technology, 2011, 44(8):1793-1801.
LEZ E, et al.Influence of alcoholic fermentation process on antioxidant activity and phenolic levels from mulberries (Morus nigra L.)[J].LWT-Food Science and Technology, 2011, 44(8):1793-1801.
[80] MERVE T, GAMZE T, DILEK B, et al.Processing black mulberry into jam:Effects on antioxidant potential and in vitro bioaccessibility[J].Journal of the Science of Food and Agriculture, 2017, 97(10):3106-3113.