副溶血性弧菌(Vibrio parahaemolyticus,VP)隶属于弧菌科弧菌属,为革兰氏阴性嗜盐性海洋细菌,VP主要存在于浅海地区,并且在几乎所有水生生物中可大量生长繁殖。常存在于鱼、虾、贝等日常食用的海产品中,是在我国沿海地区导致食物中毒和夏季腹泻的主要病原菌,临床上可引起人类腹痛、呕吐及腹泻等症状,甚至会导致死亡;由于其生成的被膜加强了自身的抗性,导致其对环境有着很强的抵抗力,普通的加热方式难以将其杀灭,该菌也是高居微生物性食物中毒的榜首[1],因此探究生物被膜(biofilm,BF)的生成机制极其重要。表1是我国部分地区VP的检出率。由表1可以得知,在我国各地的水产品中,VP的检出率均较高。
表1 我国部分地区副溶血性弧菌阳性检出率
Table 1 Positive detection rate of V.parahaemolyticus in some regions of China
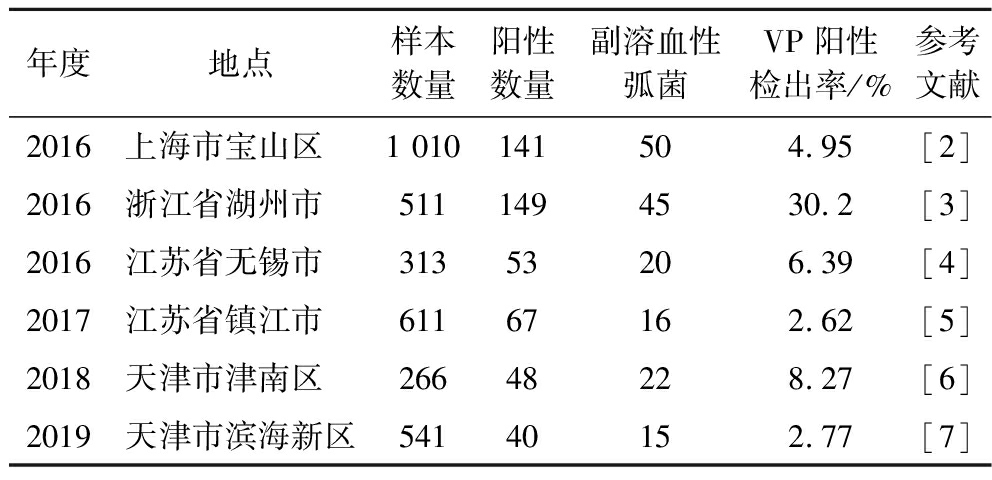
年度地点样本数量阳性数量副溶血性弧菌VP阳性检出率/%参考文献2016上海市宝山区 1 010141504.95[2]2016浙江省湖州市 5111494530.2[3]2016江苏省无锡市 31353206.39[4]2017江苏省镇江市 61167162.62[5]2018天津市津南区 26648228.27[6]2019天津市滨海新区54140152.77[7]
BF是微生物在特定条件下形成的一种特殊群体结构,是细菌为了适应环境、利于自身生存的一种存在形态,具有很强的抗性,当形成至成熟阶段,不仅容易产生毒素污染食品,还容易造成食物中毒,危害人民群众健康安全。BF是微生物群落附着在各种载体上,通过分泌多糖、纤维蛋白与脂质蛋白等胞外基质,将载体包绕其中而形成的大量高度组织化、系统化的膜样聚合物。据美国疾病控制与预防中心(Centers for Disease Control and Prevention,CDC)统计,人类细菌性感染中大约65%是由BF引起的[8]。同时,随着广谱抗菌药物的大量使用,多重耐药的VP的检出率越来越高,有研究表明,其耐药性的产生与生物被膜形成密切相关[9]。
VP能够在生物和非生物表面形成BF,甚至可以黏附到人体的肠道中,进而引发一系列疾病。有研究表明,BF还会促使更多的细菌协同共生,使宿主表面污染的更加严重,例如在VP的BF里,会与单增李斯特菌协同生长,对人体或者食品起着更大的破坏作用[10]。同时在自然环境中,BF是大部分细菌的温室,它使得细菌对环境的压力抗性增强。目前,关于研究细菌BF的形成机制中,多集中在铜绿假单胞菌和金黄色葡萄球菌中,对VP生物被膜的形成原理的探讨相对较少。因此,本文通过对VP BF形成的动态过程、信号分子以及它的具体调控过程进行综合论述,为解决该菌的BF出现在人类疾病治疗、食用食品和食品生产工具上等难题提供理论依据,并期望从中得出解决办法。
1 BF的形成过程
近年来,随着越来越多的国内外学者参与BF机制的研究,对BF的了解越发深入。BF的形成是一个复杂的动态过程,目前,学术界内普遍将BF的形成过程分为5个阶段,如图1所示,即分别为可逆附着阶段、不可逆附着阶段、微菌落的形成、BF的成熟及最终的分散阶段[11]。细菌在BF模式下抵抗力的强度是单个浮游细菌的上千倍,这就导致在宿主表面很难将其彻底消灭。
在第一阶段,由于细菌与被接触物体表面的非特异性相互作用,包括静电力、疏水作用等,以附着在宿主表面。在此期间,菌体一般都是通过浮游细菌形式存在的。此时菌体与被附着物体之间相互作用不强,可通过简单温和的方式将二者进行分离。第二阶段主要是细菌开始分泌群体感应分子和黏性聚合物,同时也因为细菌的一些附属结构(例如鞭毛和菌毛等),增强了与被接触物品之间的相互作用,导致其从第一阶段的可逆附着变为不可逆附着。在第三阶段中,由于第二阶段中的细菌数量逐渐增加,细菌会因为BF的形成而使得一些相关基因被激活和表达,在胞外聚合物(extracellular polymeric substance,EPS)内繁殖形成单一菌落,随后大量聚集而形成微菌落,同时大量的微菌落还会促使BF加厚。第三阶段中,随着大量的微菌落形成,BF的厚度逐渐增大,BF最终成熟并定殖于被附着物体表面。此阶段的BF,对恶劣的环境有着更强的抗性。最后阶段,细菌从成熟的BF中游离出来,再次转变为浮游状态,以寻求更适宜的生长环境,寻找适合的物体表面形成新的BF,形成浮游细菌-细菌BF-浮游细菌-细菌BF的循环形态,以此进行大量增殖直至污染物体表面各处,这是一个没有休止的循环。
成熟的BF对食品的加工过程和安全造成极大的影响。BF附着在食品,生产设备等表面,甚至还会附着在动物表皮、人的牙齿表面,对人体的健康以及财产造成极大的危害。其生长在食品表面,会造成食品的货架期和保质期的缩短,使经济遭受极大损失。李安琪[12]研究表明在VP(ATCC17802和VP-0)的生物被膜形成过程中,0~12 h为可逆黏附阶段,12~48 h为不可逆黏附和微菌落形成阶段,48~72 h为成熟阶段,72~144 h为分散阶段;这对VP的BF形成过程有了更进一步的了解,若在第一阶段就将其消灭,就可得到良好的控制,这对食品生产具有指导意义。由于现实环境的复杂性,BF的形成与实验室条件下存在一定差距,因此还需要更深一步研究。
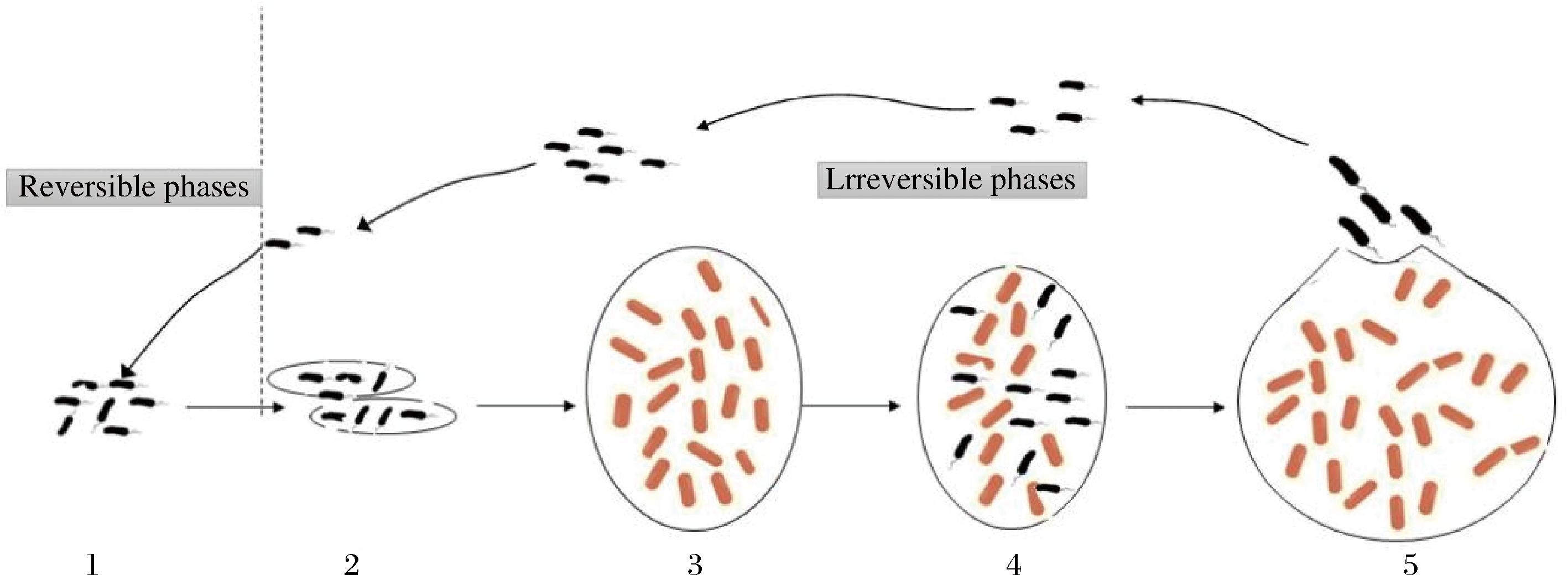
阶段1:可逆附着阶段;阶段2:不可逆附着阶段;阶段3:微菌落的形成;阶段4:生物被膜的成熟;阶段5:单个细菌从微菌落分散出来
图1 细菌生物被膜发育阶段的模
Fig.1 Model of the developmental stage of bacterial biofilm
2 影响生物被膜形成的调控因素
2.1 环二鸟苷酸(cyclic diguanylate, c-di-GMP)调控生物被膜的形成
2.1.1 c-di-GMP的形成及作用
在细菌中,c-di-GMP是最重要和最常见的第二信使分子,主要是由两分子的三磷酸鸟苷(guanosine triphosphate,GTP)经二鸟苷酸环化酶催化缩合形成的环状二核苷酸[13],其通常存在于原核生物细胞中,在革兰氏阴性菌中最为普遍;它是控制着细菌从游离状态、表面附着、形成成熟的BF到再次改变为游离状态的核心调控因子[14],其具体作用为诱导效应蛋白构象变化、转录激活、蛋白间的相互作用、基因下调和增强酶活性,从而调控生物被膜的形成、细菌动力和毒力因子等。c-di-GMP对细菌的BF形成具有重要的意义,不仅可以通过直接诱导蛋白产生BF,亦可通过间接调节EPS的方式来参与生成BF;但在不同生物中,EPS对生物被膜的形成和抗逆性了解的并不清晰,需更进一步的了解。
根据最近研究表明,c-di-GMP调节细菌下一步表型的方式大致有3种:c-di-GMP的受体蛋白与转录因子进行结合,进而调控转录因子对相关基因转录的调控[15];c-di-GMP通过调控靶蛋白来影响细菌的生命活动[16];c-di-GMP作为核糖开关,在核糖体上的mRNA结合位点结合,进一步调节mRNA的转录和翻译[17]。但是,通过第三步的方式来调控下游表型的细菌较少。
2.1.2 二鸟苷酸环化酶与磷酸二酯酶调控c-di-GMP的机制
含有GGEEF或GGDEF结构域的二鸟苷酸环化酶(diguanylate cyclases,DGCs)和含有EAL或HD-GYP结构域的磷酸二酯酶(phosphodiesterases,PDEs)参与c-di-GMP的共同调节。最新的研究表明,含有GGDEF结构域的DGCs会导致c-di-GMP浓度增高,即DGCs可合成c-di-GMP。活性DGCs由2个被GGDEF结构域整合的亚基组成,DGCs的催化活性位点插入到2个亚基的界面上,每个亚基可以结合一个GTP分子,这个位点对GGDEF基序有回应,并且这个基序处的任何突变都会导致DGCs失活[17]。具体合成c-di-GMP的机制是2个GTP以反平行的方式被DGCs的2个亚基结合,生成一个c-di-GMP分子。当细胞内存在Mn2+和Mg2+时,具有EAL或HD-GYP结构域活性的PDEs可以催化c-di-GMP降解,其中EAL结构域降解c-di-GMP为2分子GMP,HD-GYP结构域降解为5′-磷酸鸟苷酸-(3′-5′)-鸟苷(pGpG)[18]。对其晶体结构的研究表明,EAL二聚体具有一种蛤壳状的开启和关闭机制,负责调节PDEs的活性,其保守的二聚界面由2个螺旋组成,其中一个是α5,通过形成β5-α5环直接连接到2个中心的Asp残基,后者与活性位点上的金属离子进行配位,从而调节PDEs的活性[19];此外,在EAL二聚体的打开和关闭运动中,β5-α5环可能发生显著重排,该环可作为一个“铰链关节”,通过金属离子在活性位点上的定位,将EAL构象与PDEs的活性进行联系起来,一些含有c-di-GMP效应因子的EAL结构域蛋白通过使用这种底物结合的二聚体和β5-α5重排来调节细菌生理过程,进而抑制c-di-GMP形成[20]。其次,各种不同的受体对c-di-GMP浓度变化的感应,导致c-di-GMP与受体共同作用于下游的靶标,将信号传达下去,最后,将信号转化成对各种生物学性状的调控,具体如图2所示[21]。近年来,也新发现了一系列的含GGDEF结构域的基因,如cdgA、cdgB、cdgC、cdgD、cdgE、cdgF、cdgG和cdgH等,其中cdgF编码的二磷酸环化酶通过控制细菌的生长方向来完成向生物被膜的转换[22]。
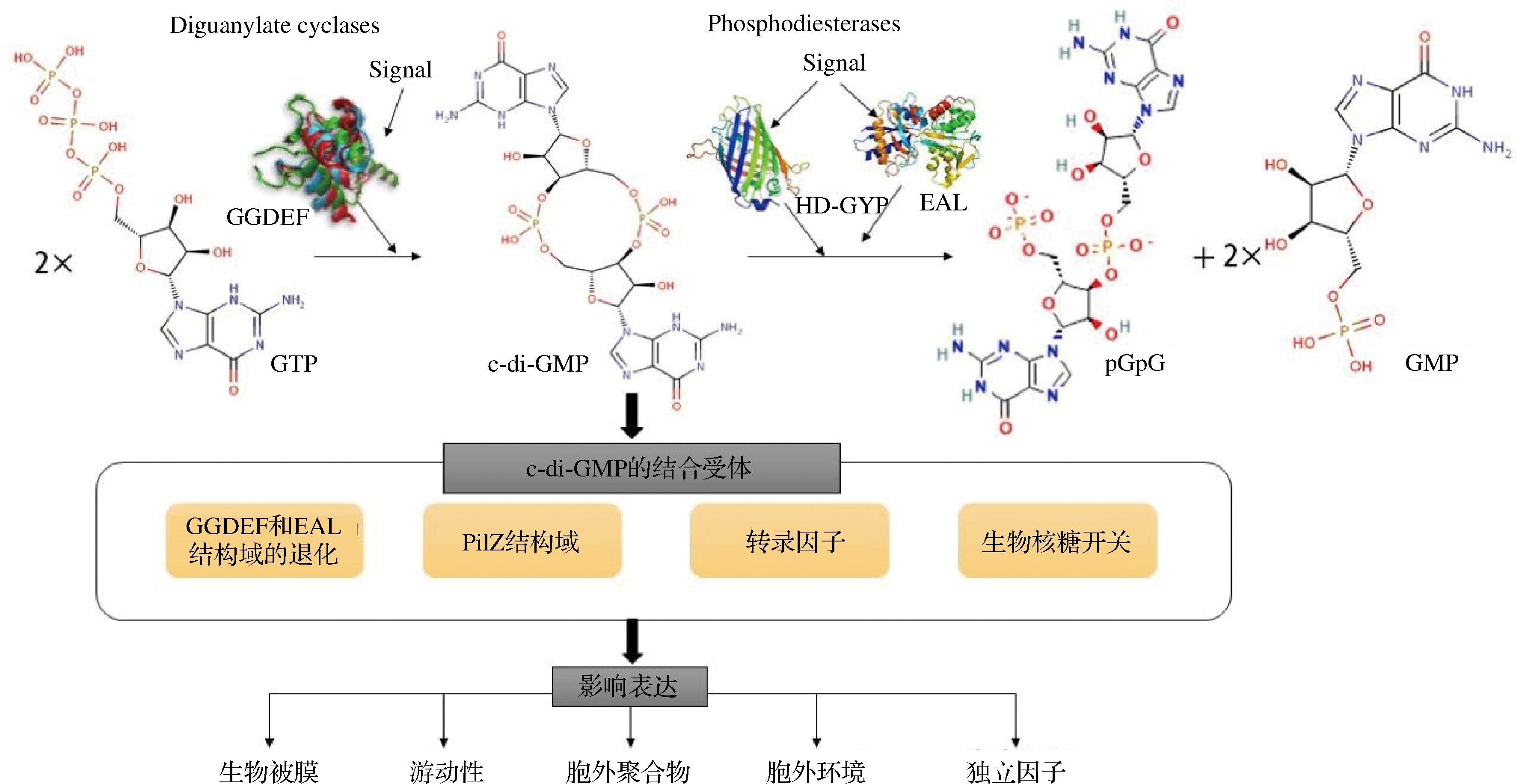
图2 c-di-GMP分子调控模式
Fig.2 c-di-GMP molecular regulatory model
不过,GGDEF和EAL结构域可能同时出现于同一个蛋白质中,这种蛋白被称作“混合型”蛋白质[23]。二者任何一个结构域被催化活化,另一个结构域即获得调控功能或出现第三方调控结构域来实现二者功能的分离,进而影响生物被膜的形成。有研究表明,若是细菌胞内的c-di-GMP浓度高于某一标准值,则可以促进生物被膜的形成,反之,若浓度过低,则可抑制生物被膜的形成[24]。GALPERIN等[25]发现,弧菌比其他细菌含有更多的DGCs和PDEs,说明c-di-GMP对弧菌生物学的重要意义,也反映了c-di-GMP在调控生物被膜中的重要作用。对不同的菌种而言,细菌体内的DGCs和PDEs含量不尽相同,但都处于动态平衡,在各自的生命活动中发挥着独特作用。
2.1.3 VP中c-di-GMP的具体表达
VP中的c-di-GMP受到ScrA、ScrB、ScrC、ScrG等十几个蛋白的调控,其中ScrA、ScrB、ScrC由操纵子scrABC编码;当ScrC与ScrA和ScrB共同存在时,它可以作为磷酸二酯酶减少细胞中的c-di-GMP;相反,ScrC在ScrA和ScrB两个都缺失的情况下,将作为二鸟苷酸环化酶产生c-di-GMP[26]。但没有研究表明ScrC或ScrA缺失一个是否会对BF的形成有影响。ScrA是一种存在于胞浆中的磷酸吡哆醛依赖型的氨基转移酶,其功能主要是产生分泌性信号(S信号),能与ScrB(一种存在于周质中的依赖蛋白)发生相互作用[27],当细胞中出现S信号后并达到一定标准后,使蛋白ScrC(为一种潜在的感觉蛋白)的EAL结构域表现出PDEs活性,使c-di-GMP发生降解,同时通过激活laf基因(鞭毛基因)使其运动能力增强,并抑制cps基因(荚膜多糖基因)的表达,从而使BF的形成能力减弱;当S信号浓度降低时,ScrC蛋白将会表现出GGDEF结构域的作用,开始表现出DGCs活性,以此来促进c-di-GMP的合成[28]。不过当scrABC操纵子突变后,由于其抑制了laf基因和cps基因的表达,将会导致菌体的爬动能力逐渐丧失并且呈现出皱缩的菌落形态,导致其比野生型菌株有更强的形成BF能力[29]。综上可知,Scr转录因子家族在VP BF发育所需的靶基因中发挥了独特和重叠的调控作用,如何避免或降低ScrABC操纵子突变率,也是抑制形成生物被膜的重要因素。
综上,若能提前抑制DGCs或激发PDEs的活性,即可以使细菌胞内的c-di-GMP含量降低到难以进行下一步表达的浓度,进而阻断VP产生部分后续的生理效应。根据研究表明,一些物质能提前抑制c-di-GMP的转录,具体见下表所示:
表2 抑制c-di-GMP转录的物质
Table 2 Substances that inhibit c-di-GMP transcription

调控系统种类具体抑制类型具体物质参考文献DGCs靶向抑制剂2′-F-c-di-GMP[30]c-di-GMPPDEs靶向抑制剂苯并噻唑酮衍生物[31]其他抑制方法蓝光、一氧化碳等[32-33]
但上表介绍的2种抑制剂对人体都有着较强的毒性,因而应用面较窄;而蓝光和NO的应用,却有着较高的经济成本,故若能发现一种对人体无害、成本低、且能抑制BF形成的物质或方法,将对食品行业带来积极的影响。
2.2 群体感应系统调控生物被膜的形成
群体感应(quorum sensing,QS)又称为“细胞与细胞的交流”,是微生物间通过化学信号分子进行信息传递的一种方式,且需要信号分子浓度达到一定的数值时才能发生的感应现象;当信号分子达到一定阈值时,可与相对应的应答原件结合,改变细菌代谢状态、某种特定蛋白转录及表达水平,进而形成对环境抗性极强的BF系统。这类分子被称为自诱导物(autoinducer,AI),AI通常可被分为三大类:自诱导子-2(autoinducer-2,AI-2)、N-酰化高丝氨酸内酯(N-acryl homoserine lactones,AHLs)和自诱导肽(autoinducing peptide,AIP)。AI-2是一种存在于革兰氏阳性菌和革兰氏阴性菌的信号分子,其可以实现细菌的种间交流,促进混合菌BF的形成[34]。AHLs是存在于大多数革兰氏阴性菌的信号分子,其分子结构主要是由N-酰基高丝氨酸内酯环外加一个含4~18个碳的酰基侧链构成[35],这是一类水溶性、膜透过性分子,可自由出入细胞。被修饰后的寡肽分子AIP是革兰氏阳性菌的主要信号分子[36],其氨基酸数量通常为5~17个,氨基酸侧链一般含有异戊烯,硫内酯环等修饰基因[37],但在不同细菌中产生的AIP信号分子,它的大小和结构略有差异。本节主要从AI-2、AHLs 和AIP这3个研究的较为彻底的QS信号分子为例,阐述其参与调控细菌BF形成的机制。
2.2.1 AI-2的形成及表达
自诱导子-2也就是呋喃硼酸二酯(furanosyl borate diester, AI-2),是甲基循环中的前产物,其产生依赖于S-核糖同型半胱氨酸酶 (S-ribose homocysteinase, LuxS)蛋白。其合成过程中为,蛋氨酸(methione,MET)结合ATP在S-腺苷甲硫氨酸合成酶(S-adenosylmethionine synthetase,SAMS)作用下生成S-腺苷甲硫氨酸(S-adenosylmethionine,SAM),SAM主要作为甲基供体,其在转甲基酶作用下产生的中间产物S-腺苷同型半胱氨酸(S-adenosine homocysteine, SAH)被S-腺苷高半胱氨酸核苷酶(S-adenosine homocysteine nucleosidase, SAHN)水解成S-核糖同型半胱氨酸(S-ribose homocysteine, SRH)和腺嘌呤;LuxS蛋白催化SRH裂解成4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD)和同型半胱氨酸(homocysteine,HCY),继而DPD与硼酸结合产生高活性的AI-2并通过自由扩散转运至细胞外,而HCY可接受甲基,继续参与SAM的循环[38]。在所有的细菌中,几乎都存在以AI-2为信号分子的群体感应系统;在细菌各自的生理活动过程,不仅参与自身蛋白表达,也积极参与和其他细菌之间的信息交流,进而形成共同的群体表达,例如形成BF、产生多种不同的毒力因子等。
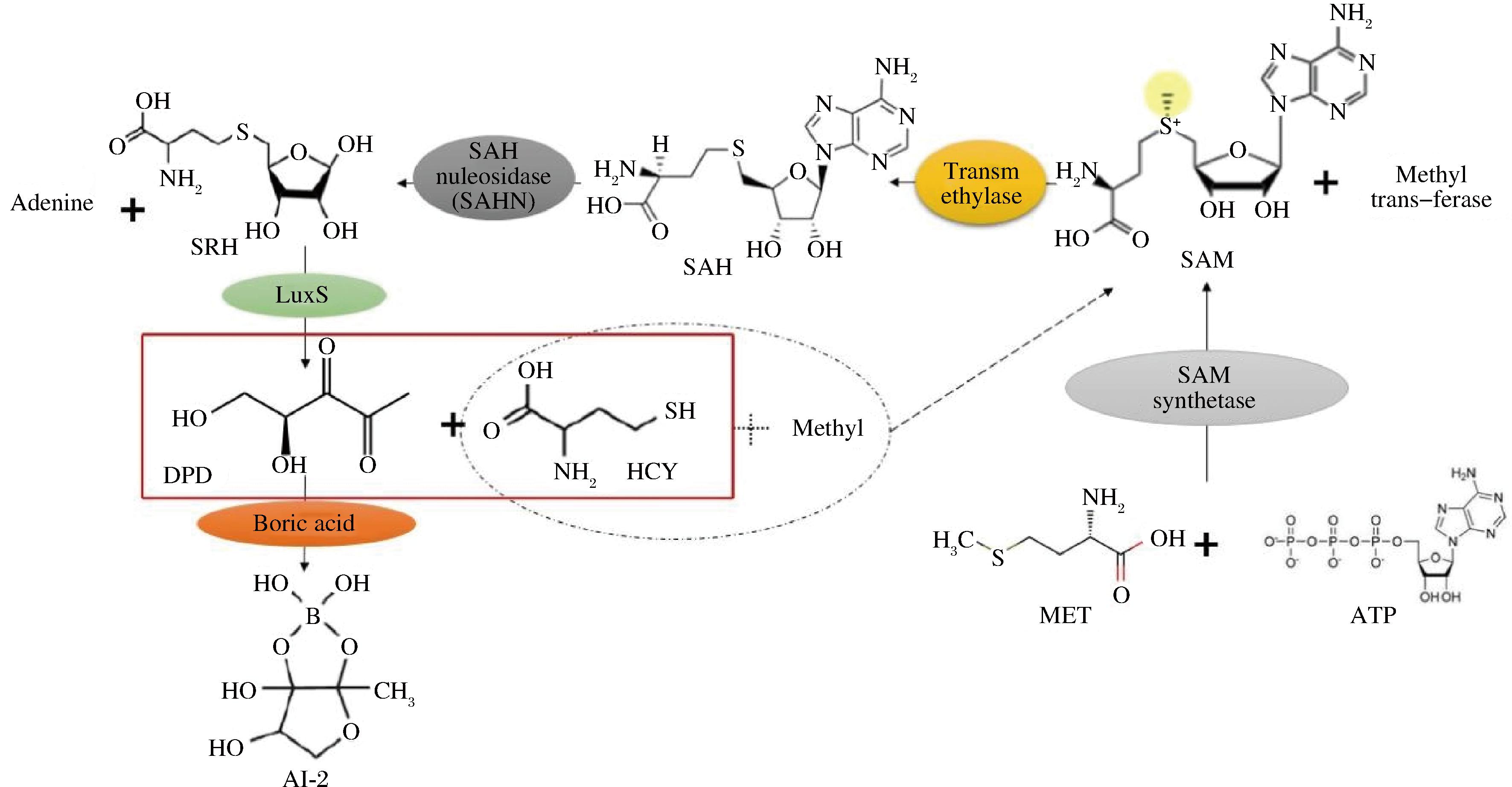
图3 AI-2合成过程
Fig.3 The AI-2 synthesis process
2.2.2 AHLs的形成及表达
AHLs的表达是由信号分子合成酶LuxI族蛋白和AHLs受体LuxR类结合转录激活蛋白组成;LuxI蛋白为AHLs的合成酶,通常SAM的高半胱氨酸基团被酰基-酰基化载体蛋白(acyl-acylated carrier proteins,acyl-ACP)上的酰基侧链结合,产生具有特异性的酰化高丝氨酸内酯(homoserine lactone,HSL)分子,再内酯化就形成了AHLs[39]。LuxR类蛋白由两个结构域组成,分别是由N端负责识别并结合酰基高丝酸内酯(acyl homosilkolactone,Acyl-HSL)的结构域和C端包含一个螺旋-转角-螺旋(helix-turn-helix, HTH)结构、并负责DNA结合及转录激活功能的结构域[40]。随着细菌密度的不断增加,AHLs合成后分泌到胞外,且当其浓度随着细菌细胞密度的提高而不断增加,达到一定阈值时,能被LuxR蛋白所感知并结合,形成LuxI-LuxR蛋白复合体,从而调控特定基因的表达,主要包括生物被膜的形成和毒力因子的释放[41]。
革兰氏阴性菌中除了典型的LuxI/LuxR型的QS系统外,还根据AHLs酰基侧链的排列不一致,分为Lasl/LasR和Abal/AbaR型等QS系统,也都分别调控细菌的生物被膜和毒力因子的形成[42]。例如,铜绿假单胞菌(Pseudomonas aeruginosa)具有Lasl/LasR和RhlR/Rhll两个体系的群体感应系统;鲍曼不动杆菌(Acinetobacter baumannii)具有Abal/AbaR为体系的群体感应系统。两者的研究表明在不同的细菌中,尽管具有调节蛋白和与它相结合蛋白功能的物质都大致相同,但在具体的某种菌体内,调节系统都根据其自身性质和具体环境条件而较为唯一。
2.2.3 AIP的形成及表达
AIP是由细胞中的核糖体合成的无活性的前体肽,在向细胞外输出过程中经过处理和修饰,经过修饰的前体肽由ABC转运蛋白(ATP-binding cassette transporter protein, ABCTP)输出,并通过蛋白水解去除其前序列来进行激活[43]。当AIP的浓度随细菌增长到一定阈值时,位于细胞膜上的AIP信号识别系统识别AIP并与之结合后,能够进行自磷酸化,并激活细胞膜上的双组分磷酸激酶系统(two-component phosphokinase system,TCS),磷酸化后的受体蛋白能与DNA特定靶位点相结合,两者结合后使组氨酸蛋白激酶被激活从而调控QS相关基因的表达[44];细菌BF的生成并不仅仅是由单一调控机制而决定,还会与其他机制相结合来表达此种生理性状。同时,因为不同细菌的AIP分子质量不同、结构不同,所以也会展示出不同的表达性,这就导致AIP信号分子只能用于细菌的种内交流。
2.2.4 VP中QS系统及其表达
在VP中,有3种不同类型的QS系统:利用CAI-1自我诱导的CqsA/S系统,CqsS为感应信号分子;利用AI-2自诱导因子,由LuxS合成信号分子,由LuxP/Q为感应信号分子;利用HAI-1自动诱导LuxM系统,由LuxN为感应信号分子[45]。在VP中,自诱导因子产生后,扩散穿过细胞膜再与膜上的受体蛋白结合,且AphA和OpaR蛋白是VP中群体感应2种主要调节因子,它们分别在低细胞密度(low cell density,LCD)和高细胞密度(high cell density,HCD)下大量产生和作用。当VP在低细胞密度中生长时,因与膜受体蛋白结合的自诱导因子浓度太低,受体蛋白作为激酶磷酸化磷酸转移蛋白LuxU, LuxU将磷酸基团转移到调控因子LuxO上,磷酸化的LuxO(LuxO-P)促进群体调节RNA(quorum regulatory RNAs,Qrr sRNA)的转录[46]。在LCD中,转录后的Qrr sRNA通过与aphA的mRNA碱基进行互补配对,促进转录因子AphA的翻译,并与AphA一起抑制OpaR的翻译,在此时期,AphA处于最高水平,OpaR处于最低水平;当VP在高细胞密度生长时,受体蛋白结合自动诱导剂转换为磷酸酶,调节回路中的磷酸盐使LuxO去磷酸化,促使Qrr sRNA不再表达,此时OpaR高表达,而AphA的表达受到抑制,OpaR开始积累并抑制aphA、opaR以及BF的相关基因的转录[46]。当所有的信号分子浓度达到稳定时,群体感应开始结束,这也是VP从群体感应开始表达到结束的整个阶段。跟绝大多数的细菌一样,完成了从前期信号分子开始分泌,到感应期的基因进行表达,最后在到结束期的整个阶段。
BF的形成是一个受多因素影响的过程。WANG等[47]研究表明BF的形成需要AphA;AphA属于有翼螺旋转录因子,其活性蛋白为二聚体结构,并具有DNA结合结构域,可以促进BF基因和毒力基因的转录,导致BF的形成。在ZHANG等[45]的研究中,OpaR通过降低细胞内c-di-GMP的浓度来抑制野生型VP RIMD2210633菌株形成生物被膜,其主要是OpaR通过对编码为GGDEF或EAL结构域蛋白7个基因的转录调控来直接影响细菌内c-di-GMP浓度的变化来影响BF的形成。虽然证实了AphA会促进BF的形成,但同时AphA会抑制MfqABC操纵子的转录,MfqABC是细胞膜融合转运蛋白,也是一种促进BF发育的膜融合转运蛋白;相反的是,OpaR却会与MfqABC蛋白结合,增强其转录[48]。在VP的QS系统中,它会与c-di-GMP这个调控因素相结合,共同参与BF的生成。
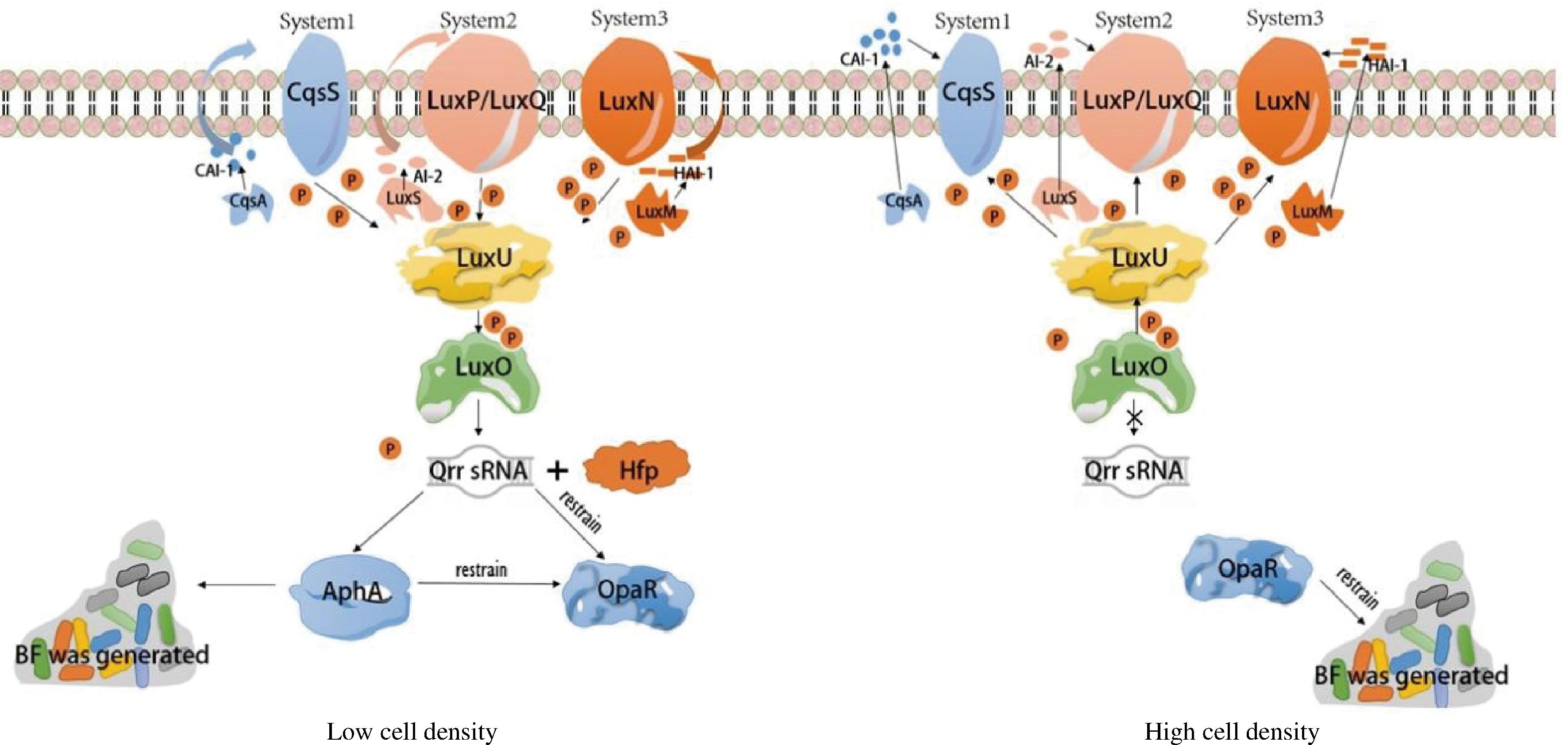
图4 副溶血性弧菌群体感应系统
Fig.4 V.parahaemolyticus quorum sensing system
研究表明,越来越多的物质被发现能够对QS系统进行干涉,抑制其BF的形成,例如:槲皮素[49]、青霉酸[50]和溴化噻吩酮化合物[51]可以提前对QS系统进行干预。
总之,VP的QS系统是一个十分复杂的信号调控网络,在毒力基因和BF基因转录之间起着非常重要的作用。该调控系统的复杂性和所需大量不同转运蛋白是整合大量信号分子、并进化出最适合细菌生存条件所必需的。
2.3 双组分系统调控生物被膜的形成
2.3.1 TCS的组成及表达
双组分系统(two-component system,TCS)是在所有生物中普遍存在的信号转导系统。该系统最早发现于大肠杆菌中,后来的研究者发现在所有已测序的细菌基因组中几乎都有TCS。TCS主要由2种蛋白组成:接受外部信号刺激的传感器蛋白组氨酸激酶蛋白(histidine protein kinase,HK)和调控基因表达的响应调节蛋白(response regulator,RR),表明了这2种蛋白与BF形成的相关性、重要性。
HK是一个跨膜感应蛋白,是由2个亚基组成的同型二聚体的膜蛋白,每个亚基包含一个ATP结合的催化结构域,一个二聚体结构域和一个组氨酸磷酸化位点,且每个组氨酸磷酸化位点嵌入二聚体结构域内;RR是胞内蛋白,含有保守的N端接收器结构域和C端可变的效应器结构域。接收器结构域中有一个保守的天冬氨酸(Asp)磷酸化位点,催化其同源组胺酸激酶的磷酸转移,进而引起本身的构象变化[52]。当细胞外刺激信号被HK接收时,激活自身和ATP结合部位,并将ATP转化为ADP,然后ATP的磷酸基团转移到二聚体功能区,与组氨酸结合,并在组氨酸残基处发生自磷酸化反应,然后磷酸化的HK基团转移至RR的N端处的天冬氨酸残基位点处,于是磷酸化的RR被激活,暴露出DNA结合位点,再与靶细胞基因的启动子序列进行特异性结合,从而调控特定基因的表达和蛋白的转录和合成[53]。同时,需要注意的是,不同细菌种类的HK和RR不同。例如,在铜绿假单胞菌中,目前鉴定出了60多种TCS,而GacS(HK)/GaxA(RR)是研究的最为深入的,同时也是控制BF形成的关键因素之一[54];在大肠杆菌中,KdpD(HK)/KdpE(RR)双组分系统响应K+的刺激,进而调控生物被膜、细菌毒力等基因的表达[55]。可以看出,不同细菌体内的各种应答蛋白并不相同。
研究表明,一些化合物质能够抑制双组分系统的表达,例如传感器激酶的抑制剂噻吩并吡啶化合物,它可以干扰TCS系统自磷酸化和磷酸转移反应[56];调节蛋白的抑制剂石胆酸,能够干扰TCS系统磷酸化作用或阻止信号与靶DNA结合[57]。但此2种物质应用面较为局限,只适用于金黄色葡萄球菌、结核杆菌和幽门螺旋杆菌,本身也都具有一定的毒性,不可大规模使用在食品行业中。
2.3.2 VP中TCS系统及其表达
在VP中,TCS系统中的EvnZ(HK)/OmpR(RR)蛋白调控生物被膜的形成[58]。当环境渗透压发生显著变化时,EvnZ肽段C端的His消耗一个ATP,发生自磷酸化(其中His243是EvnZ自磷酸化点),将磷酸基团传递给细胞内的OmpR上的Asp残基(Asp55是磷酸化转移的受体位点),激活OmpR磷酸化产生OmpR-R,从而调控膜孔蛋白OmpF和OmpC的表达来应对环境渗透强度的变化,进一步参与生物被膜形成的调控[59]。张艺蓓[60]通过EvnZ/OmpR对副溶血性弧菌毒力因子的调控实验也验证了EvnZ/OmpR会促进VP中BF的形成。但是否在该细菌中还有其他不同的HK和RR蛋白,还值得继续探索。
3 总结
VP本身作为一种食源性致病菌,具有较强的致病性,而当VP形成生物被膜以后,其抗性和毒性也会不断增加。综上所述,VP生物被膜的形成机制是一个极其复杂的过程,涉及多因素的独自参与、共同参与、直接参与或间接参与;QS系统会与c-di-GMP相结合,共同作用于生物被膜的生成,同时TCS系统与c-di-GMP和QS之间也存在着一些相同的功能。信使分子c-di-GMP对BF的形成有着核心调控作用,但是否还有效应蛋白能够参与调控形成BF的生物行为还需进一步研究。大多文献都探讨了c-di-GMP和QS对BF的形成的重要性,但由于环境中微生物的多样性、复杂性及微生物的种间交流,仍需要对TCS如何影响BF的形成进行更深入的研究,有助于探究抑制生物被膜的形成的方法,为食品生产提供安全指导,为人民健康生活提供有力保障。
[1] 刘伟, 尹可欣, 施丽飞, 等. 北京市海淀区2010—2019年食源性疾病暴发检测结果分析[J]. 海峡预防医学杂志, 2022, 28(1):91-93. LIU W, YIN K X, SHI L F, et al. Analysis on detection results of foodborne disease outbreaks in Haidian District of Beijing City, 2010-2019[J]. Strait Journal of Preventive Medicine, 2022, 28(1):91-93.
[2] 姚利利, 何平, 沈先标, 等. 2015—2018年上海市宝山区食源性疾病病原监测结果分析[J]. 职业与健康, 2020, 36(1):38-41. YAO L L, HE P, SHEN X B, et al. Analysis on monitoring results of foodborne disease pathogens in Baoshan District of Shanghai from 2015-2018[J]. Occupation and Health, 2020, 36(1):38-41.
[3] 强鑫华, 周丽华, 王萍, 等. 2016年-2017年湖州地区食源性疾病病原菌检出分析[J]. 中国卫生检验杂志, 2020, 30(9):1118-1120. QIANG X H, ZHOU L H, WANG P, et al. Detection and analysis of pathogenic bacteria in food-borne diseases from 2016 to 2017 in Huzhou[J]. Chinese Journal of Health Laboratory Technology, 2020, 30(9):1118-1120.
[4] 李文毅. 2016—2018年无锡市梁溪区食源性疾病监测报告[J]. 江苏预防医学, 2022, 33(2):197-199. LI W Y. Surveillance report on food-borne diseases in Liangxi district of Wuxi city from 2016 to 2018[J]. Jiangsu Journal of Preventive Medicine, 2022, 33(2):197-199.
[5] 许金凤, 张潇丹, 巢秀琴, 等. 2017—2019年镇江地区哨点医院食源性疾病病原监测结果[J]. 江苏预防医学, 2022, 33(4):469-471. XU J F, ZHANG X D, CHAO X Q, et al. Surveillance results of food-borne diseases in sentinel hospitals in Zhenjiang from 2017 to 2019[J]. Jiangsu Journal of Preventive Medicine, 2022, 33(4):469-471.
[6] 孙雅娜, 刘坚龄, 梁广忠, 等. 2018—2020年天津市津南区食源性致病菌分布及药敏分析[J]. 中国食品卫生杂志, 2021, 33(5):548-552. SUN Y N, LIU J L, LIANG G Z, et al. Distribution and drug sensitivity analysis of foodborne pathogens in Jinnan District of Tianjin from 2018 to 2020[J]. Chinese Journal of Food Hygiene, 2021, 33(5):548-552.
[7] 王雪娇, 刘钦, 赵苗苗, 等. 2016—2020年天津市滨海新区食源性疾病监测结果分析[J]. 职业与健康, 2022, 38(12):1637-1641. WANG X J, LIU Q, ZHAO M M, et al. Analysis on surveillance results of foodborne diseases in Tianjin Binhai New Area from 2016-2020[J]. Occupation and Health, 2022, 38(12):1637-1641.
[8] 刘爱萍. 细菌生物膜与食品安全[J]. 肉类工业, 2007(8):34-35. LIU A P. Bacterial biofilm and food safety[J]. Meat Industry, 2007(8):34-35.
[9] ASHRAFUDOULLA M, MIZAN M F R, PARK H, et al. Genetic relationship, virulence factors, drug resistance profile and biofilm formation ability of Vibrio parahaemolyticus isolated from mussel[J]. Frontiers in Microbiology, 2019, 10:513.
[10] 陈萍. 副溶血性弧菌-单增李斯特菌共培养下混合生物被膜形成及种间关系的研究[D]. 上海: 上海海洋大学, 2020. CHEN P. Mixed biofilm formation and the interspecies relationship between V.parahaemolyticus and L.monocytogenes[D]. Shanghai: Shanghai Ocean University, 2020.
[11] MAHAMUNI-BADIGER P P, PATIL P M, BADIGER M V, et al. Biofilm formation to inhibition: Role of zinc oxide-based nanoparticles[J]. Materials Science and Engineering: C, 2020, 108:110319.
[12] 李安琪. 副溶血性弧菌生物膜形成机制及其防控策略研究[D]. 芜湖: 安徽工程大学, 2022. LI A Q. Study on the mechanism of Vibrio parahaemolyticus biofilm formation and its prevention and control strategies[D]. Wuhu: Anhui Polytechnic University, 2022.
[13] KARAOLIS D K R, CHENG K R, LIPSKY M, et al. 3′, 5′-Cyclic diguanylic acid (c-di-GMP) inhibits basal and growth factor-stimulated human colon cancer cell proliferation[J]. Biochemical and Biophysical Research Communications, 2005, 329(1):40-45.
[14] YU M, CHUA S L. Demolishing the great wall of biofilms in Gram-negative bacteria: To disrupt or disperse?[J]. Medicinal Research Reviews, 2020, 40(3):1103-1116.
[15] DAHLSTROM K M, O′TOOLE G A. A symphony of cyclases: Specificity in diguanylate cyclase signaling[J]. Annual Review of Microbiology, 2017, 71:179-195.
[16] STEINER S, LORI C, BOEHM A, et al. Allosteric activation of exopolysaccharide synthesis through cyclic di-GMP-stimulated protein-protein interaction[J]. The EMBO Journal, 2013, 32(3):354-368.
[17] LEE E R, BAKER J L, WEINBERG Z, et al. An allosteric self-splicing ribozyme triggered by a bacterial second messenger[J]. Science, 2010, 329(5993):845-848.
[18] JENAL U, REINDERS A, LORI C. Cyclic di-GMP: Second messenger extraordinaire[J]. Nature Reviews. Microbiology, 2017, 15(5):271-284.
[19] SUNDRIYAL A, MASSA C, SAMORAY D, et al. Inherent regulation of EAL domain-catalyzed hydrolysis of second messenger cyclic di-GMP[J]. The Journal of Biological Chemistry, 2014, 289(10):6978-6990.
[20] NAVARRO M V A S, NEWELL P D, KRASTEVA P V, et al. Structural basis for c-di-GMP-mediated inside-out signaling controlling periplasmic proteolysis[J]. PLoS Biology, 2011, 9(2): e1000588.
[21] POVOLOTSKY T L, HENGGE R. ‘Life-style’ control networks in Escherichia coli: Signaling by the second messenger c-di-GMP[J]. Journal of Biotechnology, 2012, 160(1-2):10-16.
[22] FAGERLUND A, SMITH V, RØHR Å K, et al. Cyclic diguanylate regulation of Bacillus cereus group biofilm formation[J]. Molecular Microbiology, 2016, 101(3):471-494.
[23] GALPERIN M Y. Diversity of structure and function of response regulator output domains[J]. Current Opinion in Microbiology, 2010, 13(2):150-159.
[24] KALIA D, MEREY G, NAKAYAMA S, et al. Nucleotide, c-di-GMP, c-di-AMP, cGMP, cAMP, (p)ppGpp signaling in bacteria and implications in pathogenesis[J]. Chemical Society Reviews, 2013, 42(1):305-341.
[25] GALPERIN M Y, NIKOLSKAYA A N, KOONIN E V. Novel domains of the prokaryotic two-component signal transduction systems[J]. FEMS Microbiology Letters, 2001, 203(1):11-21.
[26] TRIMBLE M J, MCCARTER L L. Bis-(3′-5′)-cyclic dimeric GMP-linked quorum sensing controls swarming in Vibrio parahaemolyticus[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(44):18079-18084.
[27] FERREIRA R B R, ANTUNES L C M, GREENBERG E P, et al. Vibrio parahaemolyticus ScrC modulates cyclic dimeric GMP regulation of gene expression relevant to growth on surfaces[J]. Journal of Bacteriology, 2008, 190(3):851-860.
[28] 欧杰, 王秋钰, 黄奥迪, 等. 水产品中弧菌生物被膜的形成及调控机制[J]. 水产学报, 2022: 1-11. OU J, WANG Q Y, HUANG A D, et al. Formation and regulation mechanism of Vibrio biofilm in aquatic products[J]. Journal of Fisheries, 2022: 1-11.
[29] GODE-POTRATZ C J, KUSTUSCH R J, BREHENY P J, et al. Surface sensing in Vibrio parahaemolyticus triggers a programme of gene expression that promotes colonization and virulence[J]. Molecular Microbiology, 2011, 79(1):240-263.
[30] FERNICOLA S, TORQUATI I, PAIARDINI A, et al. Synthesis of triazole-linked analogues of c-di-GMP and their interactions with diguanylate cyclase[J]. Journal of Medicinal Chemistry, 2015, 58(20):8269-8284.
[31] ZHENG Y E, TSUJI G, OPOKU-TEMENG C, et al. Inhibition of P.aeruginosa c-di-GMP phosphodiesterase RocR and swarming motility by a benzoisothiazolinone derivative[J]. Chemical Science, 2016, 7(9):6238-6244.
[32] TUCKERMAN J R, GONZALEZ G, SOUSA E H S, et al. An oxygen-sensing diguanylate cyclase and phosphodiesterase couple for c-di-GMP control[J]. Biochemistry, 2009, 48(41):9764-9774.
[33] RYU M H, FOMICHEVA A, O’NEAL L, et al. Using Light-Activated Enzymes for Modulating Intracellular C-Di-GMP Levels in Bacteria[M]//c-di-GMP Signaling. New York, NY: Springer New York, 2017:169-186.
[34] LAGANENKA L, SOURJIK V. Autoinducer 2-dependent Escherichia coli biofilm formation is enhanced in a dual-species coculture[J]. Applied and Environmental Microbiology, 2018, 84(5): e02638-e02617.
[35] 莫祯妮, 熊盈盈, 邱树毅, 等. 群体感应抑制剂调控食源性微生物生物膜形成的研究进展[J]. 食品科学, 2021, 42(17):307-316. MO Z N, XIONG Y Y, QIU S Y, et al. Progress in quorum sensing inhibitors in regulating biofilm formation of foodborne microorganisms[J]. Food Science, 2021, 42(17):307-316.
[36] ZHU Y L, LI C Z, CUI H Y, et al. Feasibility of cold plasma for the control of biofilms in food industry[J]. Trends in Food Science &Technology, 2020, 99:142-151.
[37] 孔凡栋,周丽曼,马青云,等.革兰阳性细菌AIP型群体感应抑制剂的研究进展[J].热带生物学报,2017,8(2):236-240. KONG F D, ZHOU L M, MA Q Y, et al. Research advances in the AIP-based quorum sensing inhibitors of gram-positive bacteria[J]. Journal of Tropical Biology, 2017, 8(2):236-240.
[38] SCHAUDER S, SHOKAT K, SURETTE M G, et al. The LuxS family of bacterial autoinducers: Biosynthesis of a novel quorum-sensing signal molecule[J]. Molecular Microbiology, 2001, 41(2):463-476.
[39] 高敏. 细菌群体感应信号分子(AHLs)的释放模式及其对生物膜形成的强化作用[D]. 西安: 西安建筑科技大学, 2019. GAO M. Study on the release pattern of quorum sensing signaling molecules (AHLs) for bacteria and their bioaugmentation during biofilm formation process[D]. Xi′an: Xi′an University of Architecture and Technology, 2019.
[40] 薛挺. 大肠杆菌及金黄色葡萄球菌AI-2群体感应系统的调控研究[D]. 合肥: 中国科学技术大学, 2009. XUE T. Regulatory mode of AI-2 quorum sensing system in Escherichia coli and Staphylococcus aureus[D]. Hefei: University of Science and Technology of China, 2009.
[41] BANERJEE G, RAY A K. The talking language in some major Gram-negative bacteria[J]. Archives of Microbiology, 2016, 198(6):489-499.
[42] 廉雪花. 酸马奶酒中乳酸菌产AI-2信号分子的研究[D]. 呼和浩特: 内蒙古农业大学, 2014. LIAN X H. Study of AI-2Signal molecule in lactic acid bacteria from koumiss[D]. Hohhot: Inner Mongolia Agricultural University, 2014.
[43] STURME M H J, KLEEREBEZEM M, NAKAYAMA J, et al. Cell to cell communication by autoinducing peptides in gram-positive bacteria[J]. Antonie Van Leeuwenhoek, 2002, 81(1):233-243.
[44] ASAD S, OPAL S M. Bench-to-bedside review: Quorum sensing and the role of cell-to-cell communication during invasive bacterial infection[J]. Critical Care, 2008, 12(6):1-11.
[45] ZHANG Y Q, QIU Y, GAO H, et al. OpaR controls the metabolism of c-di-GMP in Vibrio parahaemolyticus[J]. Frontiers in Microbiology, 2021, 12:676436.
[46] BALL A S, CHAPARIAN R R, VAN KESSEL J C. Quorum sensing gene regulation by LuxR/HapR master regulators in vibrios[J]. Journal of Bacteriology, 2017, 199(19): e00105-e00117.
[47] WANG L, LING Y, JIANG H W, et al. AphA is required for biofilm formation, motility, and virulence in pandemic Vibrio parahaemolyticus[J]. International Journal of Food Microbiology, 2013, 160(3):245-251.
[48] ZHOU D S, YAN X J, QU F, et al. Quorum sensing modulates transcription of cpsQ-mfpABC and mfpABC in Vibrio parahaemolyticus[J]. International Journal of Food Microbiology, 2013, 166(3):458-463.
[49] OUYANG J, SUN F, FENG W, et al. Quercetin is an effective inhibitor of quorum sensing, biofilm formation and virulence factors in Pseudomonas aeruginosa[J]. Journal of Applied Microbiology, 2016, 120(4):966-974.
[50] HAN X P, CHEN Q Y, ZHANG X G, et al. Antibiofilm and antiquorum sensing potential of Lactiplantibacillus plantarum Z057 against Vibrio parahaemolyticus[J]. Foods, 2022, 11(15):2230.
[51] PANDE G S J, SCHEIE A A, BENNECHE T, et al. Quorum sensing-disrupting compounds protect larvae of the giant freshwater prawn Macrobrachium rosenbergii from Vibrio harveyi infection[J]. Aquaculture, 2013, 406-407:121-124.
[52] JACOB-DUBUISSON F, MECHALY A, BETTON J M, et al. Structural insights into the signalling mechanisms of two-component systems[J]. Nature Reviews Microbiology, 2018, 16(10):585-593.
[53] STOCK A M, ROBINSON V L, GOUDREAU P N. Two-component signal transduction[J]. Annual Review of Biochemistry, 2000, 69:183-215.
[54] ALI-AHMAD A, FADEL F, SEBBAN-KREUZER C, et al. Structural and functional insights into the periplasmic detector domain of the GacS histidine kinase controlling biofilm formation in Pseudomonas aeruginosa[J]. Scientific Reports, 2017, 7:11262.
[55] HEERMANN R, JUNG K. The complexity of the ‘simple’ two-component system KdpD/KdpE in Escherichia coli[J]. FEMS Microbiology Letters, 2010, 304(2):97-106.
[56] GILMOUR R, FOSTER J E, SHENG Q, et al. New class of competitive inhibitor of bacterial histidine kinases[J]. Journal of Bacteriology, 2005, 187(23):8196-8200.
[57] GONZ LEZ A, CASADO J, CHUECA E, et al. Small molecule inhibitors of the response regulator ArsR exhibit bactericidal activity against Helicobacter pylori[J]. Microorganisms, 2020, 8(4):503.
LEZ A, CASADO J, CHUECA E, et al. Small molecule inhibitors of the response regulator ArsR exhibit bactericidal activity against Helicobacter pylori[J]. Microorganisms, 2020, 8(4):503.
[58] WANG Q Y, WANG P F, LIU P P, et al. Comparative transcriptome analysis reveals regulatory factors involved in Vibrio parahaemolyticus biofilm formation[J]. Frontiers in Cellular and Infection Microbiology, 2022, 12:917131.
[59] WANG L C, MORGAN L K, GODAKUMBURA P, et al. The inner membrane histidine kinase EnvZ senses osmolality via helix-coil transitions in the cytoplasm[J]. The EMBO Journal, 2012, 31(11):2648-2659.
[60] 张艺蓓. EnvZ/OmpR感应Fe3+调控副溶血性弧菌毒力因子的分子机制研究[D]. 杨凌: 西北农林科技大学, 2020. ZHANG Y B. Study on molecular mechanism of EnvZ/OmpR sensing ferric iron and regulating Vibrio parahaemolyticus virulence factor[D]. Yangling: Northwest A &F University, 2020.