酪蛋白(casein,CS)是牛奶和其他反刍动物奶中的主要蛋白质,因其良好的营养特性和生物相容性,常用于食品和医药领域的生物活性物质的包埋递送。然而天然酪蛋白存在溶解度低、稳定性差以及胶束再聚集等问题[1],在一定程度上限制了酪蛋白的应用。酪蛋白与多糖在水溶液中通过静电力、氢键等相互作用形成的可溶性复合物,可作为乳液稳定剂和脂肪替代物等,起到改变食品的结构并改善其稳定性的作用[2]。LIU等[3]研究发现当pH值5.0(接近等电点)时,乳清分离蛋白-海藻酸钠复合溶液的粒径和浊度与乳清分离蛋白溶液相比分别显著降低了65.0%和68.5%。LAN等[4]的研究表明豌豆分离蛋白与果胶形成可溶性复合物,使其热变性温度略微升高,热稳定性增强。因此,通过酪蛋白与多糖复合解决酪蛋白溶解度低、稳定性差等问题,对于提高酪蛋白利用率以及拓展酪蛋白-多糖复合物在食品和医药领域的应用具有重要意义。
果胶(pectin,PE)是常见的天然多糖,主要分为高甲氧基果胶(甲酯化度>50%)和低甲氧基果胶(甲酯化度<50%)。果胶的酯化度可以显著地影响其与蛋白质的络合行为以及相互作用产物的理化性质(溶解度、乳化性能等)[5]。ARCHUT等[6]研究表明豌豆蛋白-柑橘果胶复合物的形成受果胶酯化度影响,且50%的酯化度最有利于复合物的形成。WARNAKULASURIYA等[7]研究发现豌豆分离蛋白与高甲氧基果胶复合后,其在pH值4.5处的溶解度显著高于其他低甲氧基果胶。然而上述研究仅从宏观实验指标分析了果胶酯化度对其与蛋白质形成的复合产物性能的影响,缺乏微观层面二者相互作用机制的研究。分子动力学(molecular dynamics,MD)模拟因其能直接揭示分子或原子间的相互作用,提供相互作用类型、结构变化等微观信息,而被广泛应用于复合物相互作用的研究[8-9]。因此,通过该计算方法有望阐明酪蛋白和果胶分子间的相互作用机理。
本文旨在通过浊度测定和溶解度测定考察不同酯化度果胶(PE 36.1%、PE 41.6%、PE 47.8%和PE 67.9%)对其与酪蛋白形成的复合产物性能的影响,并进一步借助MD模拟、荧光光谱以及红外光谱分析酪蛋白与果胶相互作用的机制,以期扩大酪蛋白与果胶复合产物的应用范围并为其理化性能的进一步改善提供理论依据。
1 材料与方法
1.1 材料与试剂
酪蛋白(CAS:9000-71-9,纯度>95%),合肥博美生物科技有限公司;果胶(酯化度:36.1%和67.9%),恒锐食品生物科技有限公司;溴化钾(光谱级),天津光孚精细化工研究所;其他试剂均属于分析纯。
1.2 仪器与设备
FD-1A-50型冷冻干燥机,北京博医康实验仪器有限公司;F-2500型荧光分光光度计,日本日立公司;T6新世纪紫外分光分度计,北京谱析通用仪器有限责任公司;Zetasizer ZS90型激光粒径仪,英国Malvemn公司;Spectrun 100型傅里叶红外光谱仪,美国PerkinElmer公司。
1.3 实验方法
1.3.1 酪蛋白-果胶复合物的制备
酪蛋白溶液和果胶溶液的制备:将酪蛋白粉末分散于去离子水中,然后用2 mol/L氢氧化钠溶液将pH值调节至8.0左右。在50 ℃下加热30 min,使其完全溶解得到酪蛋白溶液。将酯化度为36.1%和67.9%的果胶按照质量比12∶1和6∶1分散于去离子水中配制成果胶混合溶液,然后将其冷冻干燥得到酯化度为41.6%和47.8%的果胶。将4种酯化度的果胶分别分散于乙酸溶液中,在室温下以500 r/min持续搅拌1 h,使其充分溶解得到果胶溶液。
酪蛋白-果胶复合物的制备:将0.5 g/L的酪蛋白溶液和0.5 g/L的不同酯化度果胶溶液按照不同质量比(1∶1~7∶1)混合,室温下搅拌均匀后置于4 ℃下冷藏12 h使其完全水合,然后使用1.0 mol/L氢氧化钠和1.0 mol/L盐酸将混合物的pH值调节至所需值,继续搅拌1 h使其混合均匀得到不同质量比的酪蛋白-果胶复合物(CS-PE 36.1%、CS-PE 41.6%、CS-PE 47.8%和CS-PE 67.9%)。
1.3.2 浊度的测定和临界pH值(pHc、pHφ1、pHopt和pHφ2)的确定
参考LI等[10]的方法,采用可见紫外分光光度计测定不同pH值(2.0~8.0)作用下酪蛋白-果胶复合体系的浊度。以酪蛋白-果胶复合体系在600 nm处的光密度(optical density,OD)表示浊度,以超纯水作为空白对照。
参考LIU等[11]的方法,根据酪蛋白-果胶复合体系的OD曲线确定临界pH(pHc、pHφ1、pHopt和pHφ2)。延伸OD曲线拐点两侧的切线,并确定相邻2条切线的交点,从右向左依次出现的交点对应的pH分别为pHc、pHφ1、pHopt和pHφ2。
1.3.3 溶解度的测定
根据王鲁慧等[12]的方法,稍作修改,测定蛋白质溶解度。将10 mg/mL的复合溶液以9 690×g离心10 min,采用G250考马斯亮蓝法测定上清液中蛋白含量,以牛血清蛋白为标准物绘制标准曲线,酪蛋白作为对照组。溶解度表示为上清液中蛋白的含量比总蛋白的含量。
1.3.4 MD模拟
1.3.4.1 酪蛋白同源建模
采用同源模型构建β-酪蛋白的三维结晶。首先在UniProt数据库中搜索β-酪蛋白的氨基酸序列(P09116);局部比对后在RCSB蛋白质数据库中进行搜索,经比较后选择PDB ID为5TC1,2Q2F和6O35的晶体结构作为混合模板蛋白[13];最后利用MODELLER(版本号:9.2)[14]进行多模板联合建模,得到最优蛋白构象以进行后续的分子动力学模拟。
1.3.4.2 不同酯化度果胶模型构建
采用Gaussview 5.0.9构建果胶分子结构,果胶的代表模型有24个单糖残基,其组成如下[15-17]:{[GalA-α(1-4)]10-α(1-4)-GalA-α(1-2)-Rha-α(1-4)-GalA-α(1-2)-Rha-α(1-4)-[GalA-α(1-4)]6-α(1-4)-GalA-α(1-2)-Rha-α(1-4)-GalA-α(1-4)-GalA},其中36.1%酯化度果胶1、3、5、7、15、17、20和23位的GalA被甲基化,67.9%酯化度果胶1、2、3、5、7、9、10、15、16、17、19、20、23和24位的GalA被甲基化,然后使用Gaussian 09程序在PM6D3理论水平上对果胶进行结构初步优化。
1.3.4.3 酪蛋白与果胶分子动力学模拟
为阐明β-酪蛋白与不同酯化度果胶之间相互作用的差异,使用YASARA(版本号:19.12.14)软件进行MD模拟[18]。模拟过程中使用YASARA2力场,首先,利用周期性边界条件,将酪蛋白-果胶复合物包埋在立方盒子中(盒子边缘到复合物表面的最小距离为10 Å),然后加入TIP3P模型水,并通过Na+或Cl-中和系统电荷。在系统能量最小化后,设置pH值为4.6,模拟温度和压力分别为298 K和1 Bar,并分别运行15 ns,时间步长为2.5 fs[19]。最后,从轨迹分析获得酪蛋白和酪蛋白-果胶复合物的均方根偏差(root mean square deviation,RMSD)、回旋半径(radius of gyration,Rg)、氢键和酪蛋白-果胶复合物的结合能。
1.3.5 荧光光谱的测定
以酪蛋白溶液为对照,使用荧光分光光度计测定不同pH作用下的酪蛋白-果胶复合溶液中酪蛋白的荧光光谱。固定激发波长为280 nm,激发和发射狭缝宽度均为5 nm,扫描范围为300~500 nm。
1.3.6 傅里叶红外的测定(Fourier transformed infrared,FTIR)
使用Spectrun 100型傅里叶红外光谱仪对CS、PE 36.1%、PE 67.9%、CS-PE 36.1%和CS-PE 67.9%进行分析。仪器设定波数为4 000~400 cm-1,分辨率为4 cm-1,扫描32次。在测量前,将样品冷冻干燥,然后以1∶100的质量比与溴化钾混合,得到测试样品,用压片机将测试样品压入透明片中。
1.4 数据处理
实验指标平行测定3次,样品平行测定2次,结果以平均值±标准偏差表示。用统计软件SPSS(version 14.0 demo;SPSS Inc., Chicago, IL, USA)进行单因素(analysis of variance,ANOVA)分析(P<0.05时为差异显著)。
2 结果与分析
2.1 不同酯化度果胶及其与酪蛋白的质量比对体系复合凝聚的影响
图1表示酪蛋白与果胶的质量比和果胶的酯化度对不同pH值下酪蛋白溶液和酪蛋白-果胶复合溶液OD值的影响。如图1所示,与酪蛋白溶液的OD峰相比,酪蛋白-果胶复合溶液整体OD峰向左偏移,表明果胶与酪蛋白的聚集体间发生了相互作用[20]。随着pH值的降低,酪蛋白-果胶复合溶液的OD值呈现先增大后减小的趋势。当pH值为3.4~4.8时,不同酯化度的果胶与酪蛋白聚集体形成的复合物由于发生电荷中和而沉淀[21],从而导致复合溶液的OD值(0.37~0.68)达到最大。此外,酪蛋白-果胶复合溶液的OD峰值(0.37~0.68)低于酪蛋白溶液的OD峰值(0.72),这可能是因为果胶抑制了酪蛋白间的聚集[20]。

A-CS-PE 36.1%;B-CS-PE 41.6%;C-CS-PE 47.8%;D-CS-PE 67.9%
图1 酪蛋白与果胶的质量比和果胶酯化度对不同pH值下酪蛋白溶液和酪蛋白-果胶复合溶液OD值的影响
Fig.1 Effects of mass ratio of casein to pectin and the degree of esterification of pectin on OD values of casein solution and casein-pectin composite solution at different pH values
2.2 酪蛋白与果胶复合过程中的特征转变点
酪蛋白与果胶的质量比对复合体系临界pH(pHc、pHφ1、pHopt和pHφ2)及pHopt处的OD值的影响如图2所示。由图2可知,酪蛋白-果胶可溶性复合物形成的临界pH(pHc)始终高于酪蛋白的等电点(pI=4.6),且当酪蛋白与果胶的质量比由1∶1增加至7∶1时,除CS-PE 67.9%的pHc由4.90升高至6.40外,其他复合体系的pHc始终保持在6.10左右。此外,随着质量比的增加,酪蛋白与不同酯化度果胶形成不溶性复合物时的pH(pHφ1),发生最大相互作用时的pH(pHopt)以及复合物开始溶解时的pH(pHφ2)均呈升高的趋势。
图2-E为酪蛋白-果胶复合溶液在pHopt处的OD值随酪蛋白与果胶的质量比的变化情况。酪蛋白-果胶复合溶液在pHopt处的OD值反映了二者形成的复合物的产量,该值越大,表示酪蛋白与果胶间形成复合物的产量越高[22]。如图2-E所示,酪蛋白-果胶复合溶液在pHopt下的OD值随质量比的增加呈现先增大后减小的趋势。CS-PE 36.1%、CS-PE 41.6%、CS-PE 47.8%和CS-PE 67.9%分别在质量比为4∶1、4∶1、4∶1和5∶1时达到OD峰值。随着质量比继续增加,酪蛋白与不同酯化度果胶形成的复合溶液在pHopt处的OD值反而降低,表明蛋白质的聚集大于酪蛋白与果胶间的相互作用[23]。因此分别选择4∶1、4∶1、4∶1和5∶1的质量比来研究CS-PE 36.1%、CS-PE 41.6%、CS-PE 47.8%和CS-PE 67.9%的相互作用。

A-PE36.1%;B-PE41.6%;C-PE47.8%;D-PE67.9%;E-酪蛋白与果胶的质量比
图2 酪蛋白与果胶的质量比和果胶酯化度对酪蛋白-果胶可溶性复合物形成(pHc)、不溶性复合物形成(pHφ1)、 最大相互作用(pHopt)、复合物溶解(pHφ2)和pHopt处OD值的影响
Fig.2 Effects of mass ratio of casein to pectin and the degree of esterification of pectin on casein-pectin soluble complex formation (pHc), insoluble complex formation (pHφ1), maximal interaction (pHopt), complex dissolution (pHφ2) and OD at pHopt
注:不同字母和不同罗马数字表示差异显著(P<0.05)(下同)。
2.3 果胶酯化度对酪蛋白-果胶复合凝聚的影响
果胶分子的酯化度对其与蛋白质形成复合物的能力至关重要[20]。因此本环节研究了不同酯化度果胶对相关临界pH值的影响,结果如图3所示。当酪蛋白分别与不同酯化度果胶以不同质量比(CS∶PE 36.1%,4∶1;CS∶PE 41.6%,4∶1;CS∶PE 47.8%,4∶1;CS∶PE 67.9%,5∶1)混合时,随着果胶酯化度由36.1%增加至67.9%,酪蛋白与果胶形成的复合体系的pHc和pHφ2始终保持在2.20和6.12左右,而pHφ1和pHopt却分别降低了0.38和0.39,这与WARNAKULASURIYA等[7]的研究结果一致,表明果胶酯化度对于酪蛋白-果胶可溶性复合物的形成以及复合物的溶解没有显著影响,却与其不溶性复合物形成时的pH(pHφ1)及发生最大相互作用时的pH(pHopt)呈负相关。
2.4 果胶对酪蛋白溶解度的影响
图4显示了酪蛋白溶液和最佳质量比的酪蛋白-果胶复合溶液在酪蛋白等电点(pI=4.6)处的溶解度。由图4可知,酪蛋白与不同酯化度果胶混合后,其在pH值4.6处的溶解度显著增加,且随着果胶酯化度的升高其溶解度呈现逐渐增大的趋势。当果胶酯化度由36.1%升高至67.9%时,酪蛋白在此pH下的溶解度增加了10.44%。由此可见,添加果胶能够增加酪蛋白在等电点处的溶解度,且该溶解度与果胶的酯化度呈现正相关。

图3 果胶酯化度对酪蛋白-果胶复合物在最佳质量比 (CS∶PE 36.1%, 4∶1;CS∶PE 41.6%, 4∶1;CS∶PE 47.8%, 4∶1;CS∶PE 67.9%, 5∶1)下的临界pH值的影响
Fig.3 Effect of the degree of esterification of pectin on the critical pH values associated with complex coacervation of casein-pectin complex at optimum mass ratio (CS∶PE 36.1%, 4∶1; CS∶PE 41.6%, 4∶1;CS∶PE 47.8%, 4∶1;CS∶PE 67.9%, 5∶1)

图4 酪蛋白和酪蛋白-果胶复合物(CS∶PE 36.1%,4∶1; CS∶PE 41.6%,4∶1;CS∶PE 47.8%,4∶1;CS∶PE 67.9%, 5∶1)在pH 4.6时的溶解度
Fig.4 Solubility of CS and casein-pectin complex (CS∶PE 36.1%, 4∶1;CS∶PE 41.6%, 4∶1;CS∶PE 47.8%, 4∶1; CS∶PE 67.9%, 5∶1) at pH 4.6
2.5 酪蛋白和果胶的相互作用
2.5.1 MD模拟
2.5.1.1 RMSD分析和Rg分析
RMSD能够反映分子结构在特定时间内偏离其初始构象的程度,是衡量体系是否稳定的重要指标[24]。由图5-A可知,β-酪蛋白的RMSD在0~15 ns内曲直上升,且波动较大。而对于β-酪蛋白-PE 36.1%和β-酪蛋白-PE 67.9%而言,在10 ns之前,RMSD逐渐升高,模拟达到10 ns后趋于稳定,RMSD分别维持在0.51 nm(β-酪蛋白-PE 36.1%)和0.36 nm(β-酪蛋白-PE 67.9%)的平衡值,低于该范围(10~15 ns)内β-酪蛋白的平均RMSD值(0.56 nm),表明酪蛋白-果胶复合物的稳定性强于酪蛋白,且果胶酯化度越高,复合物的稳定性越强。
图5-B是β-酪蛋白、β-酪蛋白-PE 36.1%和β-酪蛋白-PE 67.9%的Rg随时间的变化情况。Rg是反映复合体系结构致密性的物理量,该值越小表示结构越紧密,反之,该值越大,则表示体系结构越膨胀[24]。如图5-B所示,β-酪蛋白的Rg随模拟时间的延长而逐渐升高并稳定在2.63左右;而β-酪蛋白-PE 36.1%和β-酪蛋白-PE 67.9%的Rg在10 ns前逐渐降低,随后维持在2.48 nm和2.49 nm附近,说明果胶的加入可以增大体系的致密性,有利于系统的稳定。

A-RMSD;B-Rg
图5 β-酪蛋白、β-酪蛋白-PE 36.1%和β-酪蛋白-PE 67.9% 在模拟过程中的RMSD和Rg变化
Fig.5 The RMSD and Rg of β-casein, β-casein-PE 36.1% and β-casein-PE 67.9% along the MD simulation
2.5.1.2 氢键分析和结合能分析
图6显示了15 ns模拟过程中β-酪蛋白-PE 36.1%和β-酪蛋白-PE 67.9%的氢键数目随时间的变化情况以及各项能量的贡献情况。如图6-A所示,在模拟达到平衡后(10~15 ns),β-酪蛋白-PE 36.1%在大多数时间内出现1个氢键,而β-酪蛋白-PE 67.9%呈现2个 或3个氢键,说明酯化度越高的果胶能与酪蛋白形成更多的分子间氢键,越有利于复合物的稳定性[3]。
由图6-B可知,酪蛋白-果胶复合物的范德华势能、键伸缩势能、键角弯曲势能、二面角扭曲势能以及离平面振动势能均为正值,且对结合能贡献较小;而分子间静电势能呈现负值,且与结合能的变化保持一致,说明静电相互作用主导了酪蛋白和果胶之间的结合。此外,β-酪蛋白-PE 67.9%的分子间静电势能(-2.29×106 kJ/mol)和结合能(-1.91×106 kJ/mol)分别低于β-酪蛋白-PE 36.1%的分子间静电势能(-2.20×106 kJ/mol)和结合能(-1.83×106 kJ/mol),表明β-酪蛋白-PE 67.9%复合物由于具有更强的静电相互作用而表现更好的稳定性。同时,这也说明酯化度越高的果胶可能因为与酪蛋白产生更强的静电相互作用,从而更有利于降低酪蛋白在等电点(pI=4.6)附近的浊度。
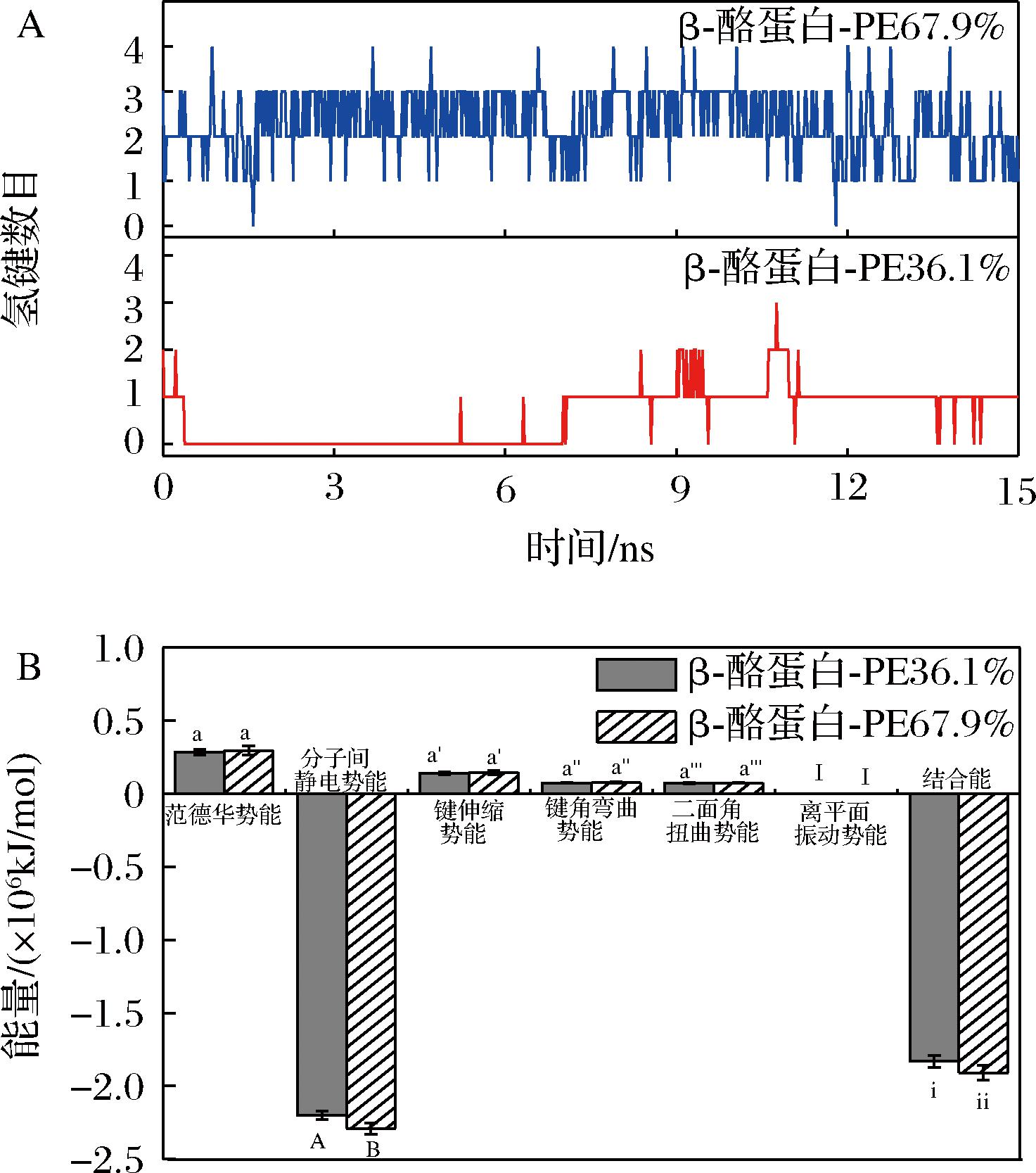
A-氢键数目变化;B-能量贡献
图6 β-酪蛋白-PE 36.1%和β-酪蛋白-PE 67.9%在模拟 过程中的氢键数目变化和能量贡献
Fig.6 The number of hydrogen bonds and energy contribution in the β-casein-PE 36.1% and β-casein-PE 67.9% along the MD simulation
2.5.2 荧光光谱分析
酪蛋白的内源荧光主要来源于色氨酸残基,故可通过该残基的荧光信息来研究酪蛋白与果胶之间的相互作用及酪蛋白的构象变化。图7所示为不同pH(3.5~7.0)处理的酪蛋白和酪蛋白-果胶复合体系的荧光光谱。由图7-A和图7-B可知,当pH值由3.5升高至7.0时,酪蛋白溶液和酪蛋白-果胶复合溶液的荧光强度均呈现先减弱后增强的趋势,且在pH值4.6时达到最弱,这可能是因为当pH值接近酪蛋白的等电点(pI=4.6)时,酪蛋白发生聚集导致色氨酸被包裹在酪蛋白内部的疏水基团中从而使荧光强度降低,随着pH值继续增加,酪蛋白肽链展开,越来越多的色氨酸残基暴露,导致荧光强度增强[25]。此外,与酪蛋白溶液相比,酪蛋白与不同酯化度果胶(PE 36.1%和PE 67.9%)复合后,其荧光强度降低,且荧光最大发射峰发生了轻微的蓝移(1~5 nm),说明果胶与酪蛋白之间的静电相互作用(图6-B),导致酪蛋白的构象发生变化,使色氨酸残基移动到疏水环境[26]。
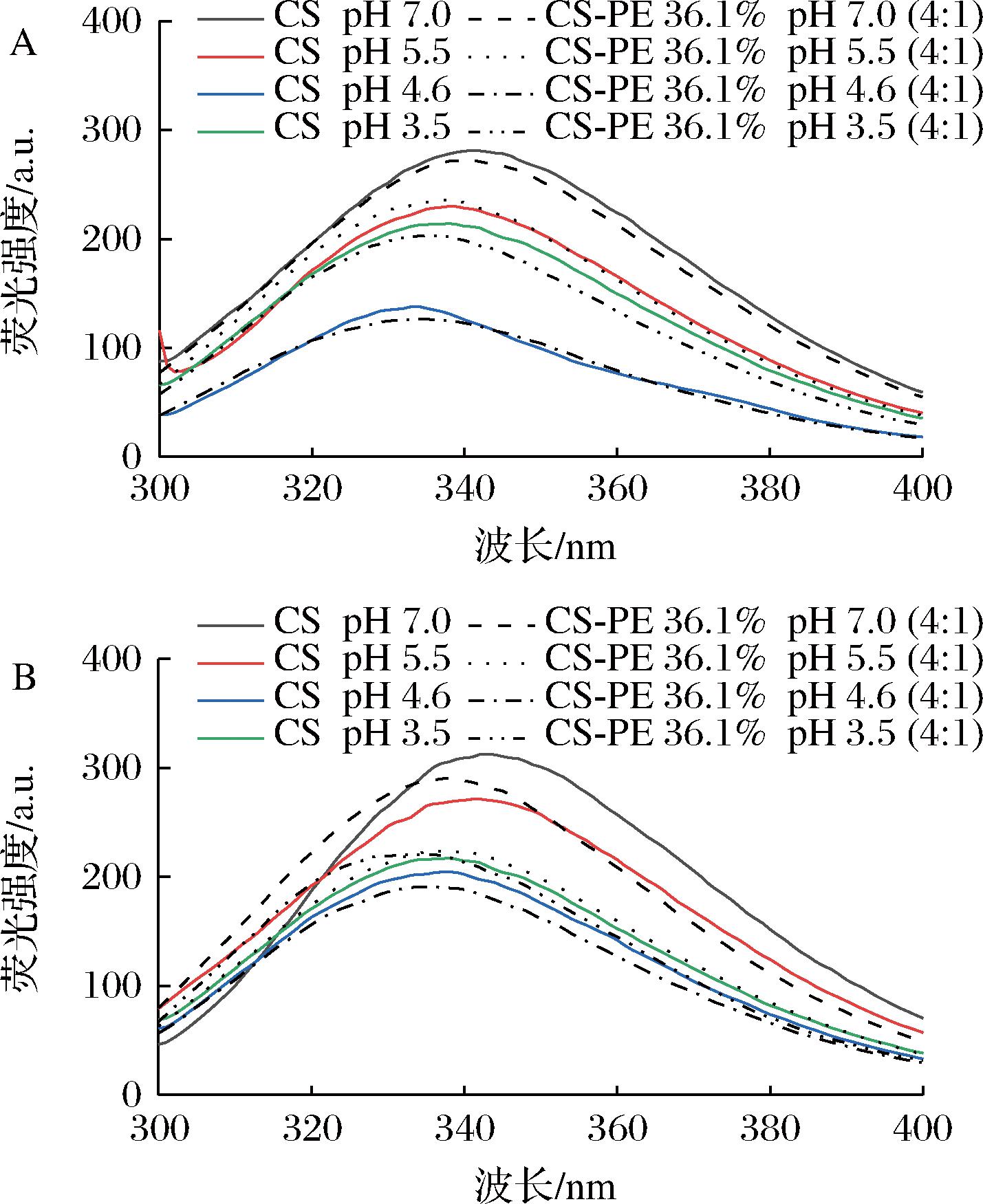
A-CS-PE 36.1%;B-CS-PE 67.9%
图7 CS、CS-PE 36.1%和CS-PE 67.9%在不同 pH下的荧光光谱
Fig.7 Fluorescence spectra of CS, CS-PE 36.1% and CS-PE 67.9% at different pH values
2.5.3 FTIR分析
图8是不同酯化度果胶与酪蛋白形成的可溶性复合物的红外光谱图。酪蛋白在1 650和1 542 cm-1处的特征峰分别与C![]() O键伸缩振动(酰胺I带)和N—H弯曲振动(酰胺II带)有关[27]。果胶分子在1 724 cm-1(PE 36.1%)和1 740 cm-1(PE 67.9%)出现的特征峰均对应于—COOR酯键上C
O键伸缩振动(酰胺I带)和N—H弯曲振动(酰胺II带)有关[27]。果胶分子在1 724 cm-1(PE 36.1%)和1 740 cm-1(PE 67.9%)出现的特征峰均对应于—COOR酯键上C![]() O的伸缩振动;出现在1 641 cm-1(PE 36.1%)和1 642 cm-1(PE 67.9%)的特征峰主要是由于羧基(—COOH)的伸缩振动引起的。然而,在酪蛋白-果胶复合物的红外光谱图中,代表酯键上C
O的伸缩振动;出现在1 641 cm-1(PE 36.1%)和1 642 cm-1(PE 67.9%)的特征峰主要是由于羧基(—COOH)的伸缩振动引起的。然而,在酪蛋白-果胶复合物的红外光谱图中,代表酯键上C![]() O伸缩振动和羧基(—COOH)伸缩振动的特征峰消失,同时酪蛋白酰胺I带的峰值分别移至1 659 cm-1(图8-A)和1 655 cm-1(图8-B),且酰胺II带的峰值分别移至1 535 cm-1(图8-A)和1 537 cm-1(图8-B),表明酪蛋白中的氨基酸残基可能与果胶中的酯羰基和羧基发生了静电相互作用。
O伸缩振动和羧基(—COOH)伸缩振动的特征峰消失,同时酪蛋白酰胺I带的峰值分别移至1 659 cm-1(图8-A)和1 655 cm-1(图8-B),且酰胺II带的峰值分别移至1 535 cm-1(图8-A)和1 537 cm-1(图8-B),表明酪蛋白中的氨基酸残基可能与果胶中的酯羰基和羧基发生了静电相互作用。
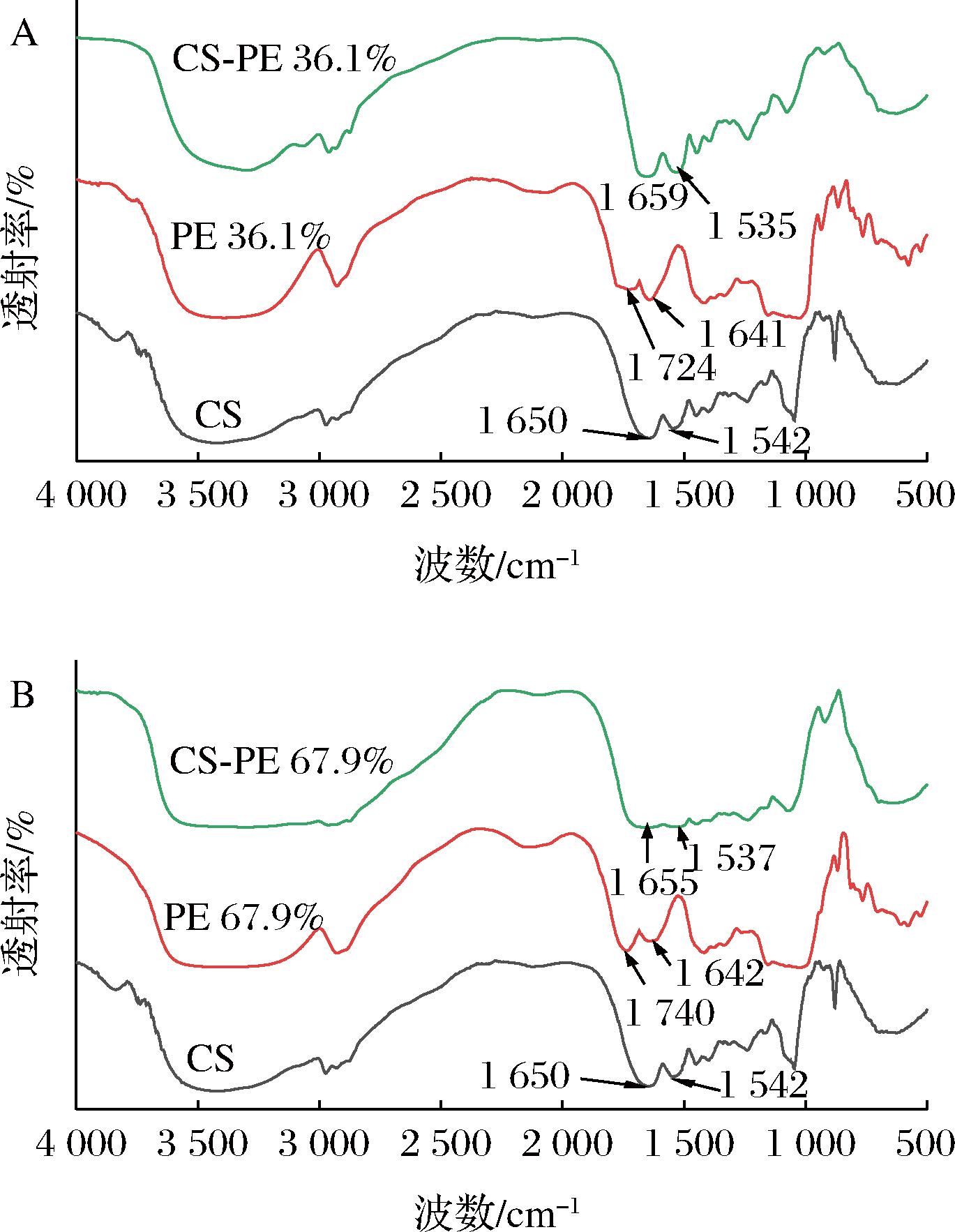
A-PE 36.1%, CS-PE 36.1%;B-PE 67.9%, CS-PE 67.9%
图8 CS、PE(A,PE 36.1%;B,PE 67.9%)和CS-PE复合物 (A,CS-PE 36.1%;B,CS-PE 67.9%)的红外光谱
Fig.8 FTIR spectra of CS, PE (A, PE 36.1%;B, PE 67.9%) and CS-PE complexes (A, CS-PE 36.1%;B, CS-PE 67.9%)
3 结论
本文研究了果胶酯化度对酪蛋白与果胶相互作用及其产物性能的影响。结果表明,CS与PE 36.1%、PE 41.6%、PE 47.8%和PE 67.9%分别在4∶1、4∶1、4∶1和5∶1质量比下形成的复合物的产量最高。在此条件下,随着果胶酯化度由36.1%增加至67.9%,酪蛋白在pI值4.6处的溶解度升高了10.44%。MD模拟结果显示CS-PE 67.9%复合物的RMSD值和结合能分别比CS-PE 36.1%少0.15 nm和8×104 kJ/mol,表现更强的稳定性;静电相互作用主导了β-酪蛋白与果胶复合物的形成,且有助于降低酪蛋白-果胶复合溶液在酪蛋白等电点处的浊度。本结果为提高酪蛋白的利用率以及为进一步研究酪蛋白-果胶复合性能提供了理论参考。
[1] 张晶晶, 李艾黎, 程金菊.美拉德反应修饰的酪蛋白递送生物活性物质的应用研究进展[J].食品科学, 2022, 43(23): 316-325. ZHANG J J, LI A L, CHENG J J.Review of the application of Maillard reaction modified-casein in the delivery of bioactive substances[J].Food Science, 2022, 43(23): 316-325.
[2] DONG X Y, DU S S, DENG Q C, et al.Study on the antioxidant activity and emulsifying properties of flaxseed gum-whey protein isolate conjugates prepared by Maillard reaction[J].International Journal of Biological Macromolecules, 2019, 153:1157-1164.
[3] LIU X Y, QIN X L, WANG Y H, et al.Physicochemical properties and formation mechanism of whey protein isolate-sodium alginate complexes:Experimental and computational study[J].Food Hydrocolloids, 2022, 131:107786.
[4] LAN Y, CHEN B C, RAO J J.Pea protein isolate-high methoxyl pectin soluble complexes for improving pea protein functionality:Effect of pH, biopolymer ratio and concentrations[J].Food Hydrocolloids, 2018, 80:245-253.
[5] LI X Y, FANG Y P, AL-ASSAF S, et al.Complexation of bovine serum albumin and sugar beet pectin:Structural transitions and phase diagram[J].Langmuir, 2012, 28(27):10164-10176.
[6] ARCHUT A, DRUSCH S, KASTNER H.Complex coacervation of pea protein and pectin:Effect of degree and pattern of free carboxyl groups on biopolymer interaction[J].Food Hydrocolloids, 2022, 133:107884.
[7] WARNAKULASURIYA S, PILLAI P K S, STONE A K, et al.Effect of the degree of esterification and blockiness on the complex coacervation of pea protein isolate and commercial pectic polysaccharides[J].Food Chemistry, 2018, 264:180-188.
[8] CHENG L L, ZHU X, HAMAKER B R, et al.Complexation process of amylose under different concentrations of linoleic acid using molecular dynamics simulation[J].Carbohydrate Polymers, 2019, 216:157-166.
[9] ZHAO R C, QIN X L, ZHONG J F.Interaction between curcumin and β-casein:Multi-spectroscopic and molecular dynamics simulation methods[J].Molecules, 2021, 26:165092. [10] LI Y, ZHANG X Y, SUN N, et al.Formation and evaluation of casein-gum arabic coacervates via pH-dependent complexation using fast acidification[J].International Journal of Biological Macromolecules, 2018, 120:783-788.
[11] LIU S H, LOW N H, NICKERSON M T.Effect of pH, salt, and biopolymer ratio on the formation of pea protein isolate-gum arabic complexes[J].Journal of Agricultural and Food Chemistry, 2009, 57(4):1521-1526.
[12] 王鲁慧, 肖军霞, 徐同成, 等.湿热条件下大豆分离蛋白与葡萄糖、麦芽糖的美拉德反应[J].食品科学, 2018, 39(16):19-26. WANG L H, XIAO J X, XU T C, et al.Maillard reaction of soybean protein isolate with glucose and maltose under wet heating conditions[J].Food Science, 2018, 39(16):19-26.
[13] KAUR J, KATOPO L, HUNG A.Combined spectroscopic, molecular docking and quantum mechanics study of β-casein and p-coumaric acid interactions following thermal treatment[J].2018, 252:163-170.
[14]  ALI A, BLUNDELL T L.Comparative protein modelling by satisfaction of spatial restraints[J].Journal of Molecular Biology, 1993, 234(3):779-815.
ALI A, BLUNDELL T L.Comparative protein modelling by satisfaction of spatial restraints[J].Journal of Molecular Biology, 1993, 234(3):779-815.
[15] FERREIRA-LAZARTE A, MORENO F J, CUEVA C, et al.Behaviour of citrus pectin during its gastrointestinal digestion and fermentation in a dynamic simulator (simgi®)[J].Carbohydrate Polymers, 2019, 207:382-390.
[16] FERNANDES A, BR S N F, MATEUS N, et al.Understanding the molecular mechanism of anthocyanin binding to pectin[J].Langmuir, 2014, 30(28):8516-8527.
S N F, MATEUS N, et al.Understanding the molecular mechanism of anthocyanin binding to pectin[J].Langmuir, 2014, 30(28):8516-8527.
[17] VORAGEN A G J, COENEN G J, VERHOEF R P, et al.Pectin, a versatile polysaccharide present in plant cell walls[J].Structural Chemistry, 2009, 20(2):263-275.
[18] KRIEGER E, VRIEND G.New ways to boost molecular dynamics simulations[J].Journal of Computational Chemistry, 2015, 36(13):996-1007.
[19] GAN N, SUN Q M, TANG P X, et al.Determination of interactions between human serum albumin and niraparib through multi-spectroscopic and computational methods[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2019, 206:126-134.
[20] PILLAI P K S, STONE A K, GUO Q, et al.Effect of alkaline de-esterified pectin on the complex coacervation with pea protein isolate under different mixing conditions[J].Food Chemistry, 2019, 284(30):227-235.
[21] AZARIKIA F, ABBASI S.Mechanism of soluble complex formation of milk proteins with native gums (tragacanth and Persian gum)[J].Food Hydrocolloids, 2016, 59:35-44.
[22] KLASSEN D R, ELMER C M, NICKERSON M T.Associative phase separation involving canola protein isolate with both sulphated and carboxylated polysaccharides[J].Food Chemistry, 2011, 126(3):1094-1101.
[23] ARYEE F N A, NICKERSON M T.Formation of electrostatic complexes involving mixtures of lentil protein isolates and gum Arabic polysaccharides[J].Food Research International, 2012, 48(2):520-527.
[24] 刘祥雨, 覃小丽, 钟金锋.采用分子动力学模拟研究温度对乳球蛋白稳定性的影响[J].食品与发酵工业, 2020, 46(7):89-96. LIU X Y, QIN X L, ZHONG J F.Effect of temperature on the stability of lactoglobulin:A molecular dynamics simulation[J].Food and Fermentation Industries, 2020, 46(7):89-96.
[25] CHEN F P, LI B S, TANG C H.Nano complexation between curcumin and soy protein isolate:Influence on curcumin stability/bioaccessibility and in vitro protein digestibility[J].Journal of Agricultural and Food Chemistry, 2015, 63(13):3559-3569.
[26] NIU F G, DONG Y T, SHEN F, et al.Phase separation behavior and structural analysis of ovalbumin-gum arabic complex coacervation[J].Food Hydrocolloids, 2015, 43:1-7.
[27] WANG C N, WANG H, SUN X M, et al.Heat-induced interactions between whey protein and inulin and changes in physicochemical and antioxidative properties of the complexes[J].International Journal of Molecular Sciences, 2019, 20(17):4089.