葡萄(Vitis vinifera L.)是世界上重要的经济作物之一,也是我国重要的经济水果。红地球葡萄因其味道甜美、汁液丰富而深受消费者喜爱,具有巨大的经济和营养价值。除此之外,葡萄和葡萄产品还具有广泛的健康益处,现代医学研究表明,其富含的酚类和其他生物活性物质,具有很高的抗氧化潜力,可以预防人类的各种慢性疾病[1]以及癌症[2],还可以作为皮肤美容剂促进皮肤细胞更生[3]。然而,葡萄采后容易出现果实软化、腐烂和果梗褐变等问题,这严重影响了葡萄的商品性。
近年来,学者们就葡萄采后保鲜技术开展了创新性研究,例如:γ-氨基丁酸、水杨酸和壳聚糖涂膜等被研发[4-6]。然而,二氧化硫(sulfur dioxide, SO2)在延长鲜食葡萄商业化贮运保鲜的过程中仍被大规模使用[7]。至今为止,还没有一种技术方法可以替代SO2的使用。一方面可能是由于SO2的抑菌作用维持了果蔬采后品质,例如有效改善荔枝、红毛丹果实外观[8],减少蓝莓的腐烂程度[9],维持樱桃贮藏期间的果实品质[10]等。另一方面,SO2可通过维持葡萄果实硬度和细胞壁代谢,保持葡萄的贮藏品质[11],也可通过激活苯丙烷代谢途径和增强抗病蛋白的表达,保持葡萄果实的营养和风味[12]。此外,从转录水平进一步发现了与葡萄果实软化和膜脂过氧化相关的靶基因[13]。上述结果表明,SO2对葡萄采后品质的影响可能与其代谢调节作用有关。
研究发现,代谢产物作为生物体在内外因素作用下基因转录和蛋白表达的最终结果,是生物体表型的基础物质[14]。与此同时,代谢产物又可以影响或调节基因的表达和活性。因此,代谢组物质信息更加接近生物体表型,可以帮助人们更好地了解生物体中各种复杂的相互作用及其本质。研究者可以提取相关的生物代谢标志物或标志物簇,通过分析寻找受影响的相关代谢途径,确立代谢网络的调控机制[15]。近年来,代谢组学分析技术在果蔬研究中相继开展,已广泛应用于植物科学领域高通量研究。目前,利用代谢组学技术不仅探究了紫外线辐射下甜樱桃类黄酮和花青素生物合成的分子机制[16],而且分析了黄酮类化合物在猕猴桃不同组织中积累的分子机制[17],还获得了黄酮类和脂质化合物与辣椒变色的关系[18]。此外,采用代谢组学技术还揭示了灌溉技术对赤霞珠果实浆果花青素生物合成和代谢的影响机制[19]。因此,为了更好地了解SO2调节葡萄贮藏期间果实中代谢物的变化,本研究基于亲水相互作用液相色谱-超高效液相色谱与四极杆飞行时间质谱联用技术(hydrophilic interaction liquid chromatography ultra-high-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry, HILIC UHPLC-Q-TOF MS)的非靶向代谢组学分析方法,探究了葡萄采后品质保鲜过程中的动态图谱变化特性。研究结果有助于进一步阐明SO2对葡萄采后贮藏保鲜过程果实品质的调控作用,并为丰富SO2在贮藏保鲜领域的作用机制提供新思路。
1 材料与方法
1.1 材料与试剂
红地球葡萄(可溶性固形物含量≥18%)于2021年9月采收自新疆乌鲁木齐市—八钢。挑选成熟度一致、大小均一、无机械损伤、无病害的葡萄为实验样品。采收后立即用冷链车运至新疆乌鲁木齐市格瑞德保鲜科技有限公司冷库,在(0±0.5) ℃预冷24 h。
乙酸铵,Sigma公司;乙腈,Merck公司;氨水、甲醇、硫代巴比妥酸、三氯乙酸,乌鲁木齐国耀化玻仪器有限公司。
1.2 仪器与设备
DDS-11A电导率仪,上海大普仪器有限公司;GY-4硬度计,艾德堡仪器有限公司;UV-2600紫外分光光度计,日本岛津有限公司;Triple TOF 5600+质谱仪,美国AB SCIEX公司;Agilent 1290 Infinity LC超高压液相色谱仪,美国Agilent公司;Himac CR-20B2大型台式冷冻离心机、5430R低温高速离心机,德国Eppendorf公司。
1.3 实验方法
1.3.1 样品处理
红地球葡萄预冷后随机分为2组,每份约重2.0 kg,放入框内,处理组放入SO2保鲜纸(对照组未放置SO2保鲜纸),框内上下衬有吸水纸,放入PE保鲜袋,扎紧袋口后贮藏64 d。贮藏过程中,每隔8 d取样。
1.3.2 腐烂率的测定
腐烂率的计算如公式(1)所示:
腐烂率![]()
(1)
1.3.3 硬度的测定
采用GY-4型果实硬度计,随机取9颗葡萄,在果实赤道部位进行测定,探头直径为3 mm,刺入深度为10 mm,单位N。
1.3.4 相对电导率和丙二醛的测定
参考游玉明等[20]的方法进行测定,称取的1.0 g葡萄果实置于烧杯中,加入50 mL蒸馏水,静置2 h后,测定浸泡液的电导率。再将葡萄果实煮沸15 min,待液体冷却后再次测定电导率,重复测定3次,相对电导率的计算如公式(2)所示:
相对电导率![]()
(2)
采用硫代巴比妥酸比色法[20]测定丙二醛。测定上清液在600、532、450 nm处的吸光度值。
1.3.5 葡萄果实预处理
腐烂率是衡量果实品质的重要指标,因此,本研究选取葡萄果实贮藏0、24、48 d进行代谢组学分析。将样品用液氮研磨后加入400 μL预冷甲醇/乙腈/水溶液(4∶4∶2,体积比),涡旋混合,-20 ℃静置60 min,14 000×g 4 ℃离心20 min,取上清液真空干燥,质谱分析时加入100 μL乙腈水溶液(乙腈与水,体积比1∶1)复溶,涡旋,14 000×g 4 ℃离心15 min,取2 μL上清液进样分析,重复3次[21]。
1.3.6 色谱-质谱分析
色谱条件:样品采用Agilent 1290 Infinity LC超高效液相色谱系统(UHPLC)HILIC色谱柱进行分离,柱温25 ℃;流速0.3 mL/min;进样量2 μL;流动相组成A:水+25 mmol/L乙酸铵+25 mmol/L氨水,B:乙腈;梯度洗脱程序如下:0~1 min,95% B;1~14 min,B从95%线性变化至65%;14~16 min,B从65%线性变化至40%;16~18 min,B维持在40%;18~18.1 min,B从40%线性变化至95%;18.1~23 min,B维持在95%;整个分析过程中样品置于4 ℃自动进样器中。样品经UHPLC分离后用Triple TOF 6600质谱仪(AB SCIEX)进行质谱分析。
Q-TOF质谱条件:电喷雾电离(electron spray ionization, ESI)用于检测正离子和负离子。ESI源的工作参数如下:离子源气体I(GSI)、气体II(GSII)和帘式气体(CUR)分别设置为60、60和30;源温度:600 ℃,离子喷射电压(IS)±5 500 V(正、负离子模式);TOF MS扫描m/z范围:60~1 000 Da,产品离子扫描m/z范围:25~1 000 Da,TOF MS扫描累积时间0.20 s/光谱,产品离子扫描累积时间0.05 s/光谱。通过进一步的去簇电压和碰撞能优化,完成了单个质谱多反应监测转换的去簇电压和碰撞能。根据在此期间洗脱的代谢物,对每个时期的一组特定质谱多反应监测转换进行监测。
1.4 数据处理
应用软件SIMCA-P 14.1(Umetrics,Umea,Sweden)对数据进行模式识别。通过KEGG数据库(http://www.genome.jp/kegg/)对差异代谢物进行注释和分类。使用Excel 2019软件进行数据整理,SPSS Statistics 26软件进行显著性分析,Sigma Plot 14.0(Systat software Inc, San Jose, CA, USA)软件作图。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 SO2处理对红地球葡萄贮藏品质的影响
腐烂率是衡量果实品质的重要指标,由图1-A可知,果实腐烂率随着贮藏时间的延长呈上升趋势。贮藏初期,葡萄果实未出现腐烂,贮藏24 d时,对照组出现腐烂;贮藏48 d时,对照组腐烂率为25.68%,处理组出现腐烂;贮藏56 d时,对照组腐烂率为38.02%,已丧失商品性,而SO2处理能明显抑制果实腐烂。在整个贮藏期间,果实硬度(图1-B)呈下降趋势。贮藏48、56、64 d,处理组的硬度分别是对照组的1.26、1.24和1.37倍,差异极显著(P<0.01)。
果实电导率(图1-C)随着贮藏时间的延长呈上升趋势,贮藏32 d后,与对照组相比SO2处理组显著抑制了电导率的增加。贮藏40、48、56、64 d时,对照组果实电导率比处理组分别高1.26、1.24、1.26和1.37倍,差异极显著(P<0.01)。在整个贮藏期间,丙二醛含量也呈上升趋势(图1-D),贮藏32 d后,SO2处理组的丙二醛含量与对照组相比有极显著性差异(P<0.01)。贮藏48、56、64 d,对照组丙二醛含量分别是处理组的1.51、1.61和1.67倍。结果表明,SO2处理维持葡萄果实的品质,延长葡萄贮藏期与‘阳光玫瑰’和醉金香葡萄对SO2处理的响应一致[11-12]。
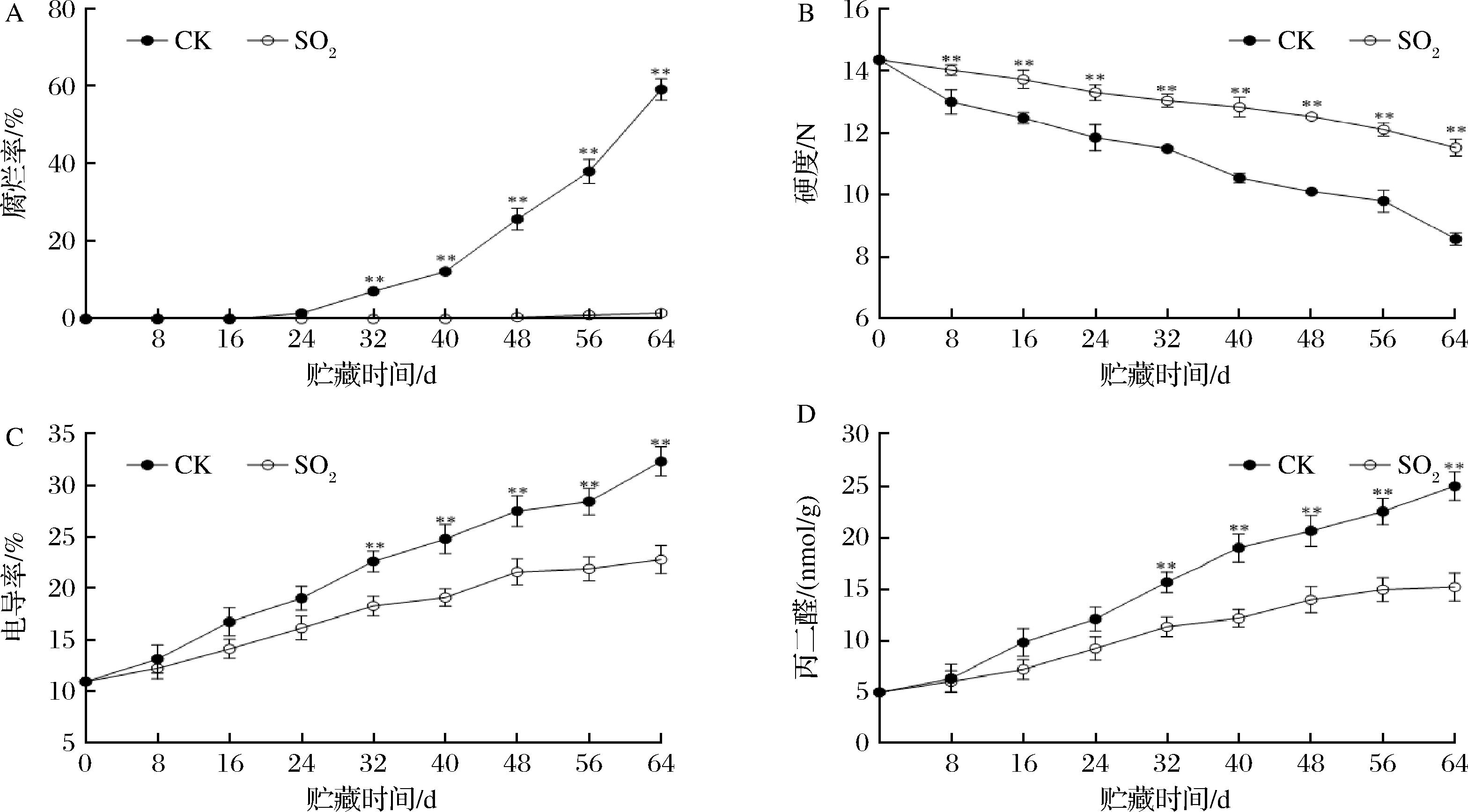
A-果实腐烂率;B-硬度;C-电导率;D-丙二醛
图1 SO2处理对果实腐烂率、硬度、电导率和丙二醛的影响
Fig.1 Effect of SO2 treatment on fruit decay rate, hardness, electrical conductivity and malondialdehyde
2.2 代谢组学数据质量评估
非靶向代谢组学服务应用于鉴定葡萄采后贮藏阶段的不同初级代谢产物(氨基酸等)和次级代谢产物(类黄酮等)。本实验采用HILIC UHPLC-Q-TOF MS技术对葡萄样本进行全谱分析。对葡萄果实的质控样本UHPLC-Q-TOF MS总离子流图,进行谱图重叠比较(图2)。结果表明,总离子流图谱重叠性较高,可以保证果实代谢组数据的可靠性和重复性。
2.3 正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis, OPLS-DA)
由OPLS-DA模型得分图(图3)可知,各组内样本均位于同一侧,各组间样本均分别位于两侧,表明贮藏不同时期/处理组的果实样本在小分子代谢物水平上发生了变化,具有显著代谢差异。由本实验的正、负离子模型评价参数(表1)可知,贮藏24 d,SO2处理组/对照组,正离子模式R2X=0.831,R2Y=1,Q2=1,负离子模式R2X=0.817,R2Y=1,Q2=1;贮藏48 d,SO2处理组/对照组,正离子模式R2X=0.85,R2Y=1,Q2=0.999,负离子模式R2X=0.838,R2Y=1,Q2=1,结果表明,OPLS-DA模型稳定可靠。
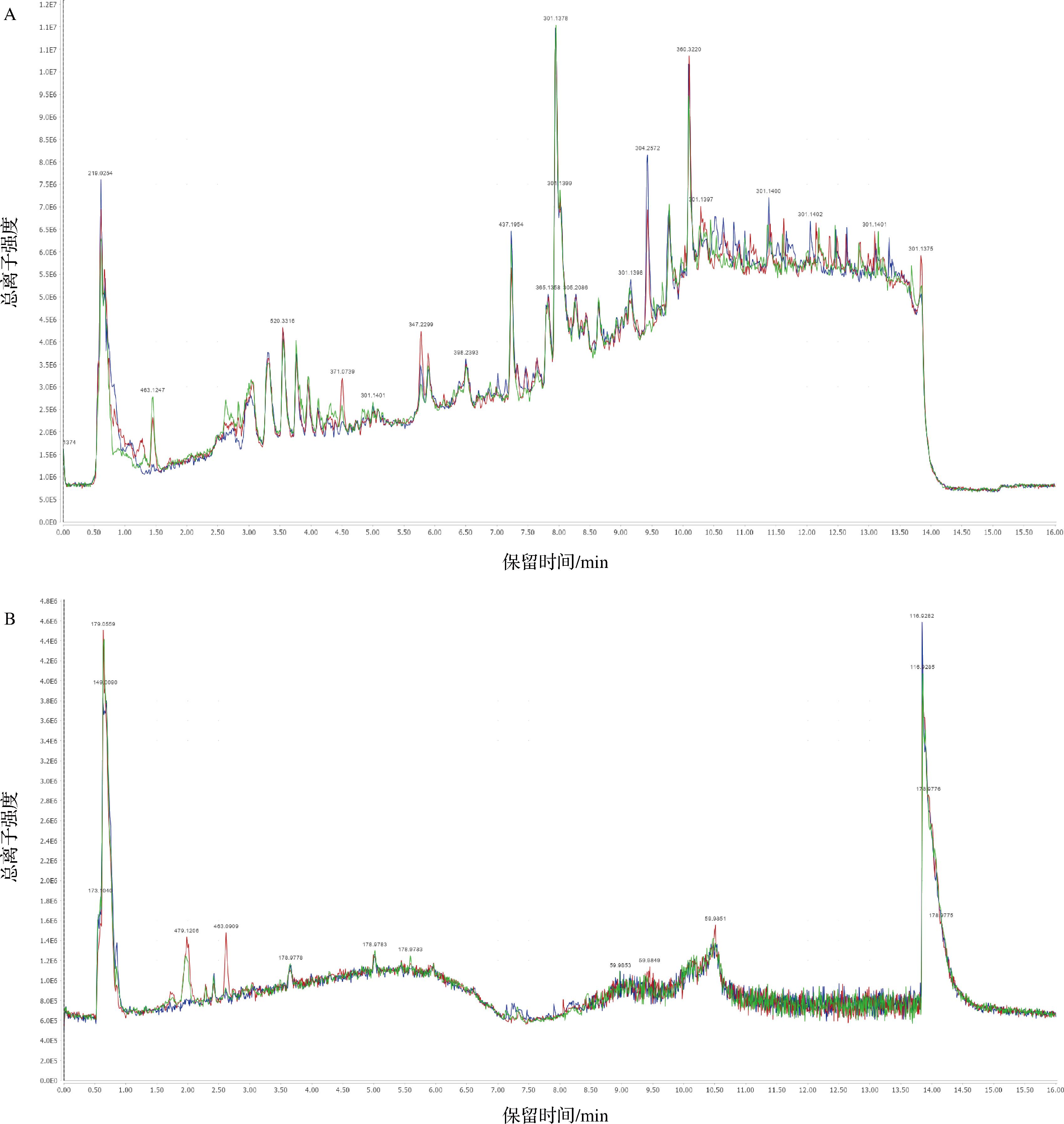
A-正离子模式;B-负离子模式
图2 质控样品正负离子模式全离子色谱法重叠图谱
Fig.2 Total ion chromatography overlapping map of positive and negative ion mode of quality control sample
2.4 单变量统计分析
根据OPLS-DA模型计算得到变量权重值(variable important in projection, VIP),本实验以VIP>1和P<0.05为筛选标准,确定显著差异代谢物。为了直观地显示样本之间代谢物变化的显著性,对差异代谢物进行单变量统计分析。由图4可知,贮藏24 d相比于原始样品(图4-B)更多下调代谢物的表达,SO2处理(图4-A)更多上调了代谢物的表达,贮藏48 d,差异代谢物在显著性和的丰度上,较贮藏24 d,差异均较小。结果表明,在整个贮藏期间,对照组更多下调代谢物的表达,与之相比,处理组更多上调代谢物的表达。
2.5 差异代谢物KEGG分析
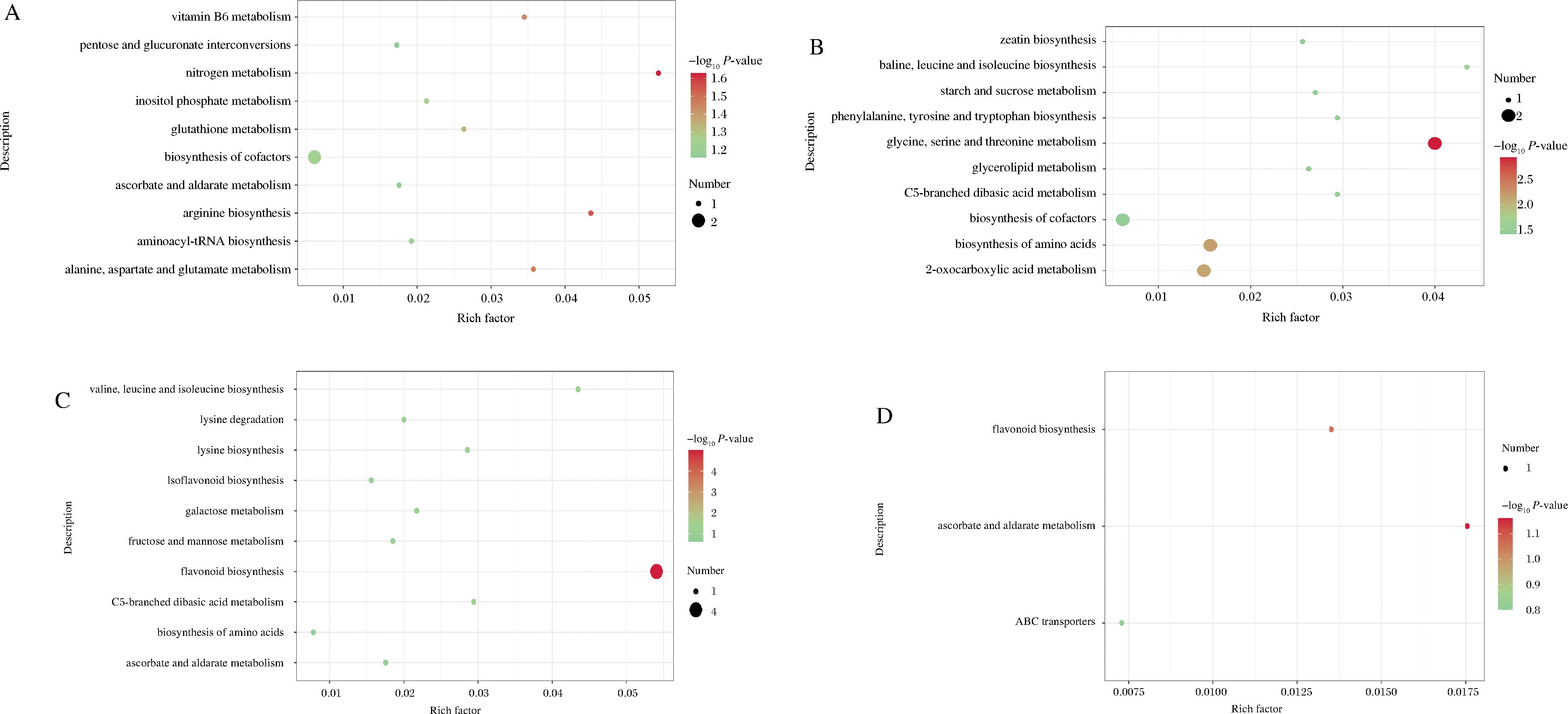
富集分析(图5)表明,贮藏24 d(图5-B),对照组差异代谢物主要富集在甘氨酸、丝氨酸和苏氨酸代谢、氨基酸生物合成、2-氧羰基酸代谢、缬氨酸、亮氨酸和异亮氨酸生物合成、苯丙氨酸、酪氨酸和色氨酸生物合成、C5支化二元酸代谢、淀粉和蔗糖代谢、甘油酯代谢、玉米素生物合成和辅助因子的生物合成等途径。贮藏48 d(图5-D),对照组主要在抗坏血酸和

图3 组间样品OPLS-DA正、负离子得分图
Fig.3 Positive and negative ion scores of OPLS-DA samples between groups
注:A(A′)、B(B′)、C(C′)、D(D′)分别代表葡萄果实SO2贮藏24 d/CK贮藏24 d、CK贮藏24 d/0 d;、SO2贮藏48 d/CK贮藏48 d、 CK贮藏48 d/CK贮藏24 d的正(负)离子得分图。
表1 组间样品OPLS-DA模型评价参数
Table 1 Evaluation parameters of OPLS-DA model for inter group samples
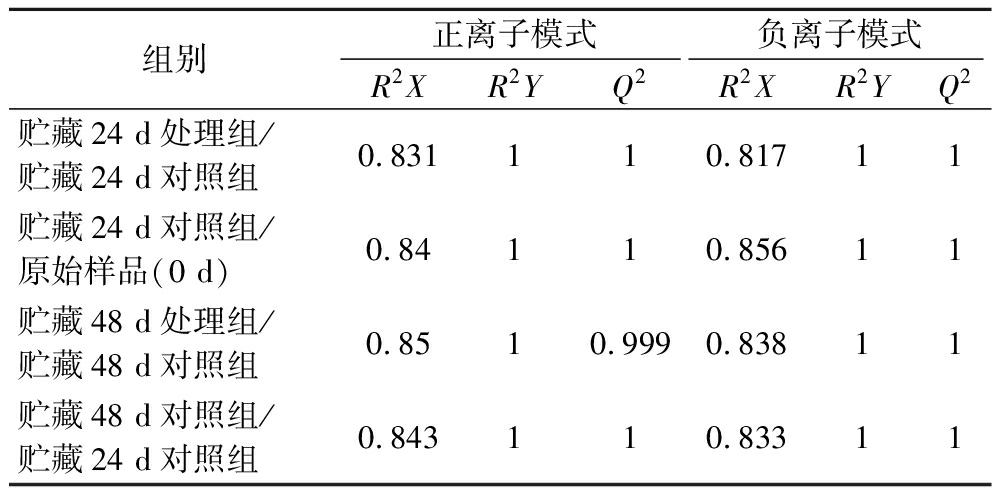
组别正离子模式负离子模式R2XR2YQ2R2XR2YQ2贮藏24 d处理组/贮藏24 d对照组0.831110.81711贮藏24 d对照组/原始样品(0 d)0.84110.85611贮藏48 d处理组/贮藏48 d对照组0.8510.9990.83811贮藏48 d对照组/贮藏24 d对照组0.843110.83311
醛酸代谢、类黄酮生物合成、ABC膜转运蛋白途径发生了显著的变化。贮藏24 d(图5-A),SO2处理组调控多个代谢途径发生了显著的变化,主要富集在氮代谢、精氨酸生物合成、维生素B6代谢、谷胱甘肽代谢、磷酸肌醇代谢、辅助因子的生物合成、氨酰tRNA生物合成、抗坏血酸和醛酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢等。贮藏48 d(图5-C),SO2处理主要在类黄酮生物合成、C5支化二元酸代谢、赖氨酸生物合成、半乳糖代谢、赖氨酸降解、果糖和甘露糖代谢、异黄酮生物合成、氨基酸的生物合成、缬氨酸、亮氨酸和异亮氨酸生物合成等途径发生了显著的变化。贮藏24 d,对照组葡萄果实差异代谢物,主要与氨基酸代谢及合成、碳水化合物代谢和膜脂代谢有关;贮藏48 d,主要与碳水化合物代谢、类黄酮生物合成和ABC膜转运蛋白有关。结果表明,贮藏24 d,SO2处理显著调控了氮代谢、氨基酸代谢、谷胱甘肽代谢和碳水化合物代谢等主要途径的富集作用;贮藏48 d,SO2处理显著调控了类黄酮生物合成、氨基酸代谢和碳水化合物代谢等主要途径的富集作用。进一步探究差异代谢物KEGG富集分析和显著差异代谢物,能够更直观地看到与类黄酮、氨基酸和脂质代谢等相关的代谢物的差异表达(表2、表3)。
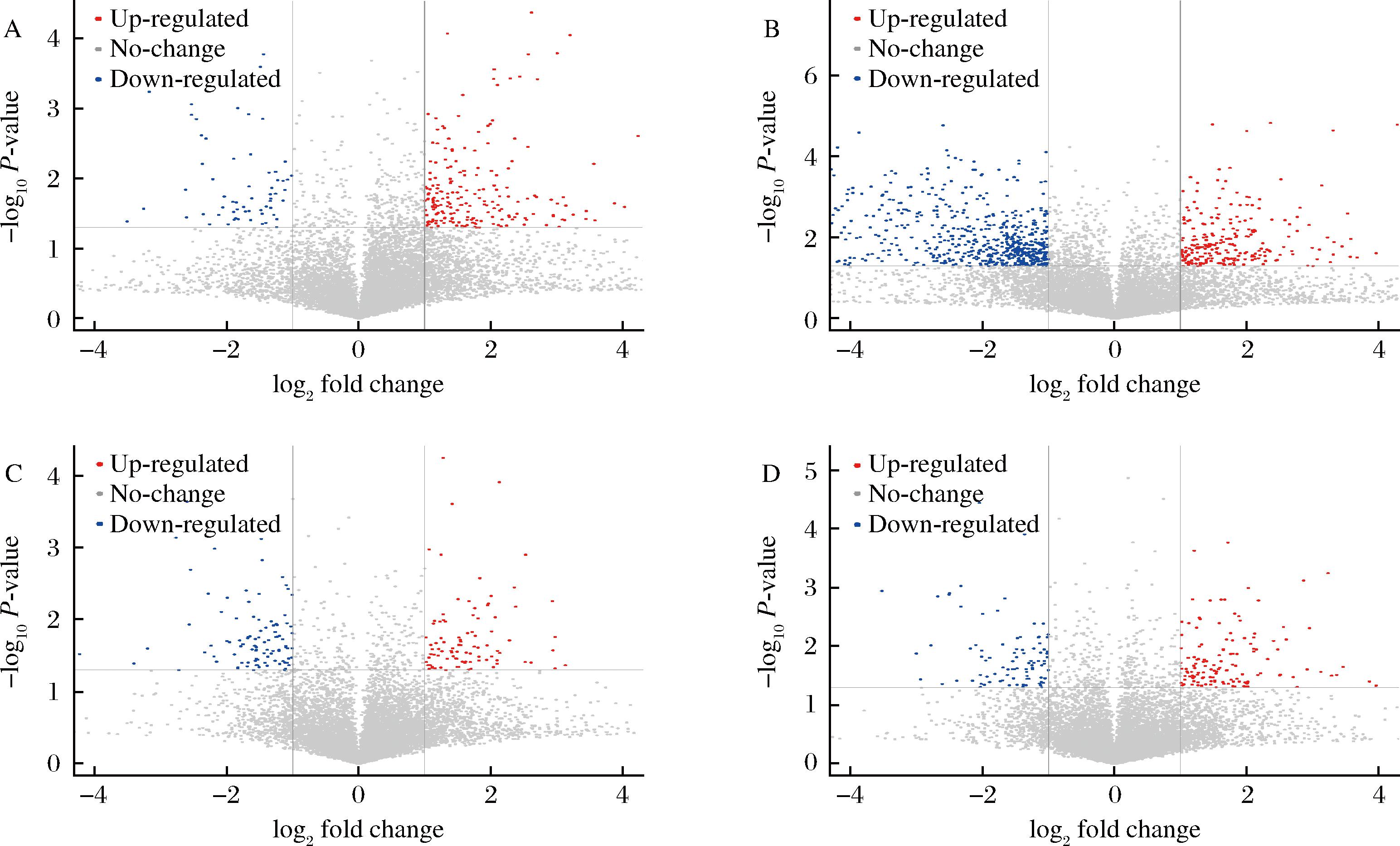
A-SO2贮藏24 d/CK贮藏24 d;B-CK贮藏24 d/0 d;C-SO2贮藏48 d/CK贮藏48 d;D-CK贮藏48 d/CK贮藏24 d
图4 单变量统计分析
Fig.4 Univariate statistical analysis
注:图中红色表示下调代谢物;蓝色表示上调代谢物;灰色表示组间没有显著差异。
A-SO2贮藏24 d /CK贮藏24 d;B-CK贮藏24 d/0 d;C-SO2贮藏48 d/CK贮藏48 d;D-CK贮藏48 d/CK贮藏24 d
图5 差异代谢物KEGG分析
Fig.5 KEGG analysis of differential metabolites
表2 对照组中主要差异代谢物
Table 2 Main differential metabolites in the control group

定位ID质荷比代谢物变化倍数P值VIP658157.081 5olanzapine (zyprexa)0.132 1320.012 4083.987 166 959493.133 9malvidin-3-O-beta-D-galactoside0.217 5820.027 9393.709 293 340331.076 6jaceosidin0.235 410.044 3681.727 644 446379.068 1bisdethiobis(methylthio)gliotoxin0.279 5510.007 9221.135 666 701481.139 7mulberroside C0.311 260.033 3381.260 446 312463.125 7peonidin-3-O-beta-D-glucoside0.319 630.026 4327.791 75 802439.201 6isokurarinone0.568 620.003 5641.165 351 120325.182 7dodecylbenzenesulfonic acid0.068 3570.010 13714.627 12 575509.127 8malvidin-3-O-beta-D-galactoside0.254 1260.049 672.940 214676.074 87trimethylamine N-oxide0.223 8590.038 7823.245 21342118.085 9glycine-betaine1.711 4940.0432.570 247 016496.325serine-cholic Acid2.022 0280.003 8311.017 01
表3 处理组与对照组中主要差异代谢物
Table 3 Main differential metabolites in treatment and control group

定位ID质荷比代谢物差异倍数P值VIP4 616385.181 4artesunate7.872 816 4390.017 343.171 812 603301.075 073′-hydroxygenkwanin1.239 417 6680.017 251.691 055 433423.120 672-[[(2R,3S)-2-(3,4-dihydroxyphenyl)-3,5-dihydroxy-3,4-dihydro-2H-chromen-7-yl]oxy]oxane-3,4,5-triol2.010 428 3760.076 261.724 932 121275.108 86phloretin2.028 650 8450.017 551.067 862 415291.083 5epicatechin2.635 860 0580.026 982.408 432 072272.997 92naringenin3.369 605 1370.006 913.568 262 470293.256 38heptadecanoic acid1.142 858 0110.005 731.211 724 578384.193dihydrozeatin-9-beta-D-glucoside0.243 8930.011 8712.182 642 768305.162aleuretic acid5.179 491 3560.001 0133.754 15939185.03glutamine (L)1.857 687 4820.001 5981.100 91182145.062 8glutamine1.359 7080.028 3082.643 9105128.034 5L-5-oxoproline2.395 2550.025 1723.524 292 681521.148 15-hydroxy-3-(5-hydroxy-2,4-dimethoxyphenyl)-6-methoxy-7-[3,4,5-trihy-droxy-6-(hydroxymethyl)oxan-2-yl]oxychromen-4-one0.165 6180.041 4761.433 241 883261.0953-hydroxyflavone0.811 561 6860.012 6573.281 137 016496.324 98serine-cholic Acid0.399 911 4860.029 321.002 73
3 讨论
代谢组学结果表明,随着贮藏时间延长,锦葵色素-3-O-β-D-半乳糖苷、棕矢车菊素、桑椹苷C、芍药苷-3-O-β-D-葡萄糖苷等类黄酮类物质表达下调。贮藏前期,SO2处理抑制了异黄酮O-糖苷和3-羟基黄酮的表达,在红地球葡萄贮藏试验中,也观察到贮藏前期,类黄酮物质被抑制的现象[12]。贮藏48 d,SO2处理显著诱导了类黄酮-7-O-糖苷、柚皮素、表儿茶素、根皮素和3′-羟基芫花素等类黄酮物质合成。研究发现,葡萄果实中类黄酮物质具有很强的抗菌和抗氧化效果,可以直接或间接地清除自由基,减缓细胞的退化,与果蔬衰老密切相关[22]。同时,类黄酮含量的变化代表着果实对外界刺激的应答能力[23],而SO2处理诱导类黄酮物质合成,限制了病原微生物的进一步扩散。在整个贮藏期中,SO2处理促进了类黄酮类物质的生成,提高果实抗菌和抗氧化活性,有利于维持果实贮藏品质,与前人研究一致[11-12]。
氨基酸作为一种渗透调节物质,在维持代谢物和细胞离子平衡等方面发挥着重要作用。研究发现,氨基酸与氧化脂质反应,可以产生具有抗氧化作用的次级产物[24],此外,谷氨酰胺作为氮供体是核苷酸生物合成所必需的,还作为碳源支持能量代谢[23]。本实验中,SO2处理调控氨基酸代谢途径,调控丝氨酸胆酸、谷氨酰胺和L-谷氨酰胺等物质,有利于维持果实贮藏品质,与前人研究一致[25]。
长链脂肪酸是果皮蜡质的主要成分,研究发现,果皮蜡质可以调控表皮细胞渗透性,抑制果实的软化、失水、腐烂、活性氧积累和膜脂过氧化,抵御病菌入侵,增强防御相关基因表达[26-28]。可能是果皮蜡质通过增强果实表面疏水性,减少了病原菌的附着和入侵,而葡萄对灰霉菌的抗性与葡萄果皮蜡质含量存在高度相关性[29-30]。本实验中,SO2处理显著诱导了十七烷酸和糊精酸等长链脂肪酸,有利于促进果皮蜡质积累,进一步提高葡萄采后贮藏品质。
4 结论
本实验基于HILIC UHPLC-Q-TOF MS技术,分析了SO2处理影响葡萄贮藏过程中的差异代谢物;通过KEGG代谢途径探究了SO2处理对红地球葡萄贮藏过程中的调控机制。研究结果表明,随着贮藏时间的延长,葡萄果实品质不断下降,而SO2处理通过维持果实硬度、推迟可溶固形物含量的下降、抑制腐烂率和丙二醛含量的上升、延缓细胞膜损伤,进而保持了果实贮藏品质。在整个贮藏过程中,SO2处理主要调控类黄酮、氨基酸和脂质代谢等途径,可能是通过提高十七烷酸和糊精酸等长链脂肪酸含量,促进了果皮蜡质积累;同时,提高类黄酮-7-O-糖苷、柚皮素、根皮素、3'-羟基芫花素、谷氨酰胺和L-谷氨酰胺等代谢物含量的增加,诱导了内源抗氧化物积累,维持了细胞离子平衡。综上所述,SO2处理通过调控这些差异代谢物,抑制葡萄果实细胞渗透性,有效清除自由基的积累,维持了细胞稳态,抑制了果实腐烂,对减缓果实品质劣变有积极作用。研究结果为进一步揭示SO2延缓贮藏过程中红地球葡萄劣变的作用机理提供了新的思路。
[1] ALKHEDAIDE A, ALSHEHRI Z S, SABRY A, et al.Protective effect of grape seed extract against cadmium induced testicular dysfunction[J].Molecular Medicine Reports, 2016, 13(4):3101-3109.
[2] GIOVANNELLI L, INNOCENTI M, SANTAMARIA A R, et al.Antitumoural activity of viniferin-enriched extracts from Vitis vinifera L.cell cultures[J].Natural Product Research, 2014, 28(22):2006-2016.
[3] MICHAILIDIS D, ANGELIS A, NIKOLAOU P E, et al.Exploitation of Vitis vinifera, Foeniculum vulgare, Cannabis sativa and Punica granatum by-product seeds as dermo-cosmetic agents[J].Molecules, 2021, 26(3):731.
[4] ASGARIAN Z S, KARIMI R, GHABOOLI M, et al.Biochemical changes and quality characterization of cold-stored ‘Sahebi’grape in response to postharvest application of GABA[J].Food Chemistry, 2022, 373:131401.
[5] 何庆, 郑素慧, 秦南南, 等.采前喷施水杨酸对红地球葡萄采后果实软化的影响[J].食品与发酵工业, 2022, 48(4):16-23. HE Q, ZHENG S H, QIN N N, et al.Effect of spraying salicylic acid to pre-harvest fruit on softening of postharvest Vitis vinifera L.cv.red globe[J].Food and Fermentation Industries, 2022, 48(4):16-23.
[6] WU P W, XIN F Y, XU H L, et al.Chitosan inhibits postharvest berry abscission of ‘Kyoho’ table gr-apes by affecting the structure of abscission zone, cell wall degrading enzymes and SO2 permeation[J].Postharvest Biology and Technology, 2021, 176:111507.
[7] AHMED S, ROBERTO S R, DOMINGUES A R, et al.Effects of different sulfur dioxide pads on Botrytis mold in ‘Italia’table grapes under cold storage[J].Horticulturae, 2018, 4(4):29.
[8] PAULL R E, REYES M E Q, REYES M U.Litchi and rambutan insect disinfestation:Treatments to minimize induced pericarp browning[J].Postharvest Biology and Technology, 1995, 6(1-2):139-148.
[9] SAITO S, OBENLAND D, XIAO C L.Influence of sulfur dioxide-emitting polyethylene packaging on blueberry decay and quality during extended storage[J].Postharvest Biology and Technology, 2020, 160:111045. [10] 陈嘉, 冯志宏, 赵迎丽, 等.不同SO2保鲜剂对先锋甜樱桃采后保鲜效果的研究[J].保鲜与加工, 2013, 13(3):17-19. CHEN J, FENG Z H, ZHAO Y L, et al. Study of different SO2 preservatives on preservation effect of Xianfeng sweet cherry[J]. Storage &Process, 2013, 13(3):17-19.
[11] 宁密密, 张群, 舒楠, 等.不同形式SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间果实硬度和细胞壁代谢的影响[J].食品与发酵工业, 2022,48(19):169-177. NING M M, ZHANG Q, SHU N, et al.Effects of different forms of SO2 preservative on fruit firmness and cell wall metabolism of ‘Sunshine Rose’ grape during storage[J].Food and Fermentation Industries, 2022,48(19):169-177.
[12] 薛美昭, 仪慧兰.果实抗病防御应答参与SO2对‘红提’葡萄的采后保鲜[J].应用与环境生物学报, 2017, 23(5):806-810. XUE M Z, YI H L.Induction of disease defense responses by SO2 during the preservation of ‘Red Globe’ grapes[J].Chinese Journal of Applied and Environmental Biology, 2017, 23(5):806-810.
[13] XUE M Z, YI H L, WANG H.Identification of miRNAs involved in SO2 preservation in Vitis vinifera L. by deep sequencing[J].Environmental and Experimental Botany, 2018, 153:218-228.
[14] NGO L T, OKOGUN J I, FOLK W R.21 st century natural product research and drug development and traditionalmedicines[J].Natural Product Reports, 2013, 30(4):584-592.
[15] WANG D J, BODOVITZ S.Single cell analysis:The new frontier in ‘omics’[J].Trends in Biotechnology, 2010, 28(6):281-290.
[16] ZHANG Q, YANG W B, LIU J C, et al.Postharvest UV irradiation increased the flavonoids and anthocyanins accumulation, phenylpropanoid pathway gene expression, and antioxidant activity in sweet cherries (Prunus avium L.)[J].Postharvest Biology and Technology, 2021, 175:111490.
[17] TAN C H, WANG Z G, FENG X L, et al.Transcriptomic and metabolomics of flavonoid compounds in Actinidia arguta var.arguta[J].Journal of King Saud University-Science, 2021, 33(8):101605.
[18] FENG X Y, YU Q Q, LI B, et al.Comparative analysis of carotenoids and metabolite characteristics in discolored-red pepper and normal red pepper based on non-targeted metabolomics[J].LWT, 2022, 153:112398.
[19] YANG B H, HE S, LIU Y, et al.Transcriptomics integrated with metabolomics reveals the effect of regulated deficit irrigation on anthocyanin biosynthesis in Cabernet Sauvignon grape berries[J].Food Chemistry, 2020, 314:126170.
[20] 游玉明, 汤洁, 张美霞, 等.外源24-表油菜素内酯调控仔姜活性氧及酚类代谢减轻冷害[J].食品科学, 2021, 42(3):273-280. YOU M Y, TANG J, ZHANG M X, et al.24-Epibrassinolide alleviates chilling injury in baby ginger rhizome by regulating active oxygen and phenolic metabolism[J].Food Science, 2021, 42(3):273-280.
[21] WU Y W, XU J A, HE Y Z, et al. Metabolic profiling of pitaya (Hylocereus polyrhizus) during fruit development and maturation[J]. Molecules, 2019, 24(6):1114.
[22] 卢素文, 郑暄昂, 王佳洋, 等.葡萄类黄酮代谢研究进展[J].园艺学报, 2021, 48(12):2506-2524. LU S W, ZHENG X A, WANG J Y, et al.Research progress on the metabolism of flavonoids in grape[J].Acta Horticulturae Sinica, 2021, 48(12):2506-2524.
[23] 贺军花, 马利菁, 周会玲.根皮苷对苹果采后灰霉病的影响[J].食品科学, 2018, 39(15):190-196. HE J H, MA L J, ZHOU H L, et al.Effect of phlorizin treatment on postharvest gray mold of apples[J].Food Science, 2018, 39(15):190-196.
[24] 陈冠群. 机体总抗氧化力的氨基酸和基因基础以及氧化对抗体活性及其它实验室指标的影响[D].大连:大连医科大学,2014. CHEN G Q.Amino acids and genetic basis of body′s total antioxidant activity and effects of oxidation on antibody activity and other laboratory indicators[D].Dalian:Dalian Medical University, 2014.
[25] 方珍. 贵州水晶葡萄低温贮运保鲜技术及机理研究[D].广州:华南农业大学, 2018. FANG Z.Study on the technology and mechanism of storage and preservation of Guizhou crystal grape at low temperature[D].Guangzhou:South China Agricultural University, 2018.
[26] SEUFERT P, STAIGER S, ARAND K, et al.Building a barrier:The influence of different wax fractions on the water transpiration barrier of leaf cuticles[J].Frontiers in Plant Science, 2022,12:766602.
[27] ZIV C, ZHAO Z, GAO Y G, et al.Multifunctional roles of plant cuticle during plant-pathogen interactions[J].Frontiers in Plant Science, 2018, 9:1088.
[28] LI X P, ZHU X Y, WANG H L, et al.Postharvest application of wax controls pineapple fruit ripening and improves fruit quality[J].Postharvest Biology and Technology, 2018, 136:99-110.
[29] HERZOG K, WIND R, T?PFER R.Impedance of the grape berry cuticle as a novel phenotypic trait to estimate resistance to Botrytis cinerea[J].Sensors, 2015, 15(6):12498-12512.
[30] GABLER F M, SMILANICK J L, MANSOUR M, et al.Correlations of morphological, anatomical, and chemical features of grape berries with resistance to Botrytis cinerea[J].Phytopathology®, 2003, 93(10):1263-1273.