蛋白质是组成人体的基本物质,动物蛋白质的氨基酸(特别是必需氨基酸)组成完整性更高、构成比例与人体更为接近、更容易吸收,同时动物蛋白质原料富含更多的维生素B12、DHA等人体重要的营养素,而凝集素、皂苷等抗营养素的含量则比植物蛋白质原料少。因此,动物蛋白质饮品的需求与发展空间越来越大。目前,市场上的蛋白质饮品依然以核桃仁、花生等植物蛋白质类居多,动物蛋白质饮品基本上局限于乳类产品,新型产品亟待开发[1]。
虾中蛋白质含量较高,同时磷脂等营养成分也十分丰富,具有较高的开发价值。近年来,中国产区虾产量连续呈增长趋势,2021年已达到200万t左右,在世界六大虾主产国中位居首位。虾产品以直接食用为主,精深加工研发力度不够,产品品种少,并且受市场波动、季节等因素影响明显,特别是近年来餐饮业受新冠疫情冲击,致使虾产业过剩现象加重。
虾酱作为一种传统发酵食品,是我国沿海以及东南亚地区常用的调味料之一,但是在其他地域至今难以推广,应用人群比较有限,而且盐含量较高,在健康方面并不理想。研究发现,虾酱中存在芽孢杆菌属、乳酸杆菌属、片球菌属、酵母菌属等多种天然的共生微生物[2]。
益生菌食品具有改善肠道微生态平衡、调节营养代谢、增强免疫效力及防治各类疾病的功效,具有巨大的商业价值[3-5]。本文从传统虾酱中筛选出能够较好地代谢虾肉的益生菌,然后通过系统性的优化与分析,对适于现代化工艺生产的益生菌虾肉蛋白发酵饮品进行了研发探索。
1 材料与方法
1.1 材料与试剂
虾酱,山东省滨州经济开发区某虾酱专卖店;鲜虾,天津市北塘海鲜市场;柠檬,天津市某水果专卖店;甜菊糖苷,曲阜香州甜菊制品有限责任公司;食品级木瓜蛋白酶,南宁庞博生物工程有限公司;食品级活性炭,巩义市海星供水材料有限公司;无水乙醇,天津市北联精细化学品有限公司;伯乐蛋白定量试剂盒,伯乐(Bio-Rad)公司;黄嘌呤氧化酶(xanthine oxidase, XOD)测定试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
HG35型厌氧培养箱,天津普瑞斯仪器有限公司;TG16B型高速台式离心机,湖南凯达科学仪器有限公司;LRH-150型生化培养箱,上海齐欣科学仪器有限公司;SW-CJ-2FD型双人超净工作台,苏净集团苏州安泰空气技术有限公司;UV-6100分光光度计,上海元析仪器有限公司;SPECTRAMAX190型酶标仪,美谷分子仪器有限公司;PSSJ-4V型精密pH计,上海精密科学仪器公司;HN-E905奥尔贝斯榨汁机,奥尔贝斯电器厂;4R2204CN型电子天平,奥豪斯仪器(上海)有限公司;1200高效液相色谱仪,安捷伦公司。
1.3 虾酱中益生菌的筛选
1.3.1 菌株的筛选
无菌条件下取1 g发酵虾酱于1 mL无菌水中混匀,梯度稀释后分别取各梯度下的样品100 μL均匀涂布至添加CaCO3的MRS固体培养基平板上,37 ℃厌氧培养48 h。依次挑选出现溶钙圈的白色圆形菌落于MRS固体平板上进行划线纯化,37 ℃厌氧箱中培养48 h。
1.3.2 菌株的鉴定
1.3.2.1 形态学鉴定
取纯化后的单菌落进行革兰氏染色并在显微镜下观察其形态。
1.3.2.2 基因序列比对
通过PCR扩增菌株16S rDNA并进行测序,BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析后使用MEGA-7软件的邻近法进行系统进化树构建[6],然后使用iTOL(https://itol.embl.de/)对进化树进行美化[7]。
1.3.3 生长曲线的绘制
取40 μL活化菌株于MRS液体培养基中,37 ℃培养24 h,每隔2 h测定OD600值,绘制生长曲线。
1.3.4 嘌呤代谢能力的测定
以鸟嘌呤和次黄嘌呤作为标准品,通过HPLC分析菌株发酵对样品的鸟嘌呤与次黄嘌呤代谢能力的影响[8-9]。
1.4 虾肉蛋白饮品的制备
1.4.1 工艺流程及操作要点
原料前处理→脱脂→酶解→煮沸灭酶→离心,合并上清液→加活性炭脱色脱苦脱腥→离心取上清液→巴氏灭菌→冷却得蛋白液→复配→接菌→培养→调配→成品[10-11]
原材料前处理:将新鲜的虾清洗干净后去壳,于65 ℃水浸泡30 min,烘干过夜,粉碎,过100目筛,保存待用。
脱脂:将原料与无水乙醇按质量比1∶6混合,在50 ℃下静置1 h,并每隔20 min搅拌1次,重复2次。
酶解:用木瓜蛋白酶在pH 7.2、60 ℃条件下,底物质量分数4%、酶用量6 000 U/g,反应6 h。
活性炭处理:添加15 g/L的活性炭,在55 ℃下处理30 min。
复配:将新鲜的巴氏灭菌后的柠檬汁与虾蛋白液按体积比7∶3混合[12]。
1.4.2 虾肉蛋白饮品工艺参数的优化
1.4.2.1 单因素试验
以感官评价为指标,进行单因素试验。
(1)发酵时间的确定:控制接种量为3%、甜菊糖苷添加量为1.25 g/L,对复配饮品分别发酵8、10、12、14、16 h。
(2)接种量的确定:控制发酵时间为12 h、甜菊糖苷添加量为1.25 g/L,分别按接种量1%、2%、3%、4%、5%,对复配饮品进行发酵。
(3)甜菊糖苷添加量的确定:控制接种量3%、发酵时间为12 h,分别添加0.75、1、1.25、1.5、1.75 g/L甜菊糖苷,对复配饮品进行发酵[13]。
1.4.2.2 正交试验
在单因素试验的基础上,取得分最高的2个水平,设计L4(23)正交试验,以感官评价为指标,优化最佳的工艺参数。
1.4.2.3 饮品感官评价标准
由固定的10人对综合样品的组织状态、气味、口感等指标作出评分,去掉最低分和最高分后的平均值为该产品的最终得分。评分标准见表1。
表1 感官评分标准表
Table 1 Sensory evaluation criteria
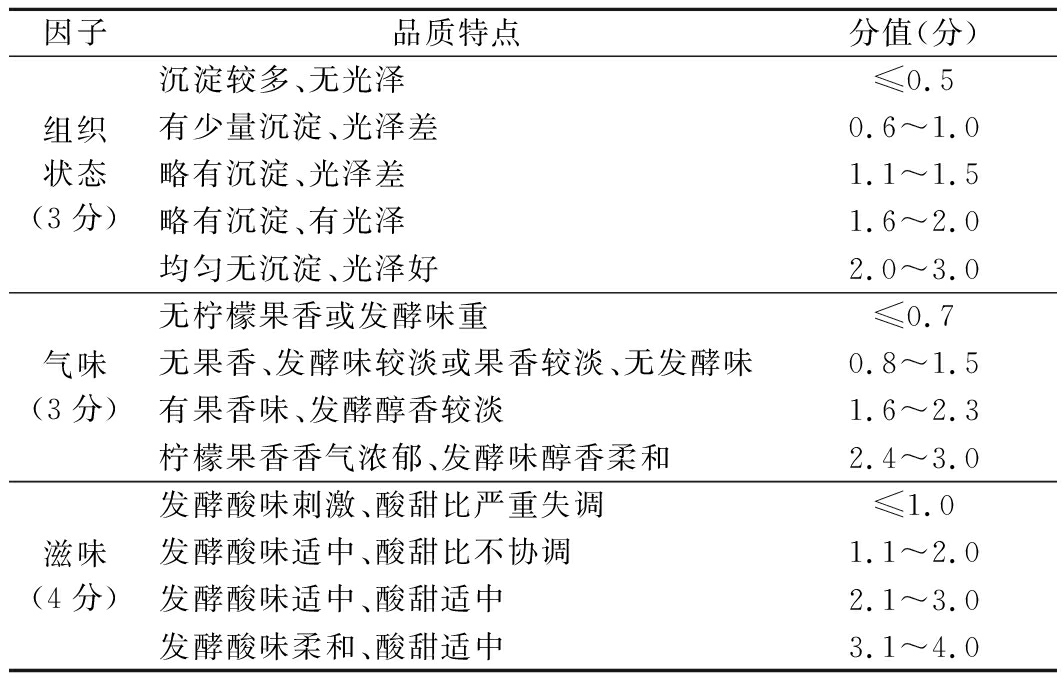
因子品质特点分值(分)组织状态(3分)沉淀较多、无光泽≤0.5有少量沉淀、光泽差0.6~1.0略有沉淀、光泽差1.1~1.5略有沉淀、有光泽1.6~2.0均匀无沉淀、光泽好2.0~3.0气味(3分)无柠檬果香或发酵味重≤0.7无果香、发酵味较淡或果香较淡、无发酵味0.8~1.5有果香味、发酵醇香较淡1.6~2.3柠檬果香香气浓郁、发酵味醇香柔和2.4~3.0滋味(4分)发酵酸味刺激、酸甜比严重失调≤1.0发酵酸味适中、酸甜比不协调1.1~2.0发酵酸味适中、酸甜适中2.1~3.0发酵酸味柔和、酸甜适中3.1~4.0
1.5 饮品参数的测定
1.5.1 饮品中蛋白质含量的测定
利用蛋白质定量试剂盒检测:避光条件下精密吸取4 μL试剂以及200 μL样品于孔板中,避光反应15 min,利用酶标仪测定其OD595值,与标准曲线进行对比。
1.5.2 抗氧化能力的测定
分别取1 mL蒸馏水、DPPH、样品于5 mL离心管中,摇匀,避光静置30 min,然后在517 nm处测量其吸光值,按公式(1)计算其清除率并与维生素C标准曲线进行对照[14]:
DPPH清除率![]()
(1)
式中:AX,1.0 mL样品+1.0 mL DPPH+1.0 mL蒸馏水的吸光值;A0,1.0 mL DPPH+2.0 mL蒸馏水的吸光值;AX0,3.0 mL无水乙醇的吸光值。
1.5.3 抑制XOD能力的测定
利用XOD测定试剂盒中的5个试剂分别加入蒸馏水、发酵前以及发酵后的样品于水浴37 ℃反应20 min,测定其OD530,XOD抑制率的计算如公式(2)所示:
(2)
式中:R,XOD的抑制率,%;ODC,对照组OD530值;ODS,实验组OD530值。
2 结果与分析
2.1 虾酱中益生菌的筛选、鉴定与检测
2.1.1 益生菌的筛选与鉴定
以传统虾酱为原料,最终筛选获得一株具有显著产酸能力、强嘌呤代谢能力的杆状菌,镜检结果如图1所示,革兰氏染色为紫色,菌株呈现明显的杆状且可观察到芽孢。测序比对结果显示其16S rDNA与凝结芽孢杆菌(Bacillus coagulans strain) wy01相似度高达97.71%(图2),再结合菌株的形态学特征和生理生化特征,最终鉴定为凝结芽孢杆菌,并命名为B.coagulans GH1-1,将其保藏于中国普通微生物菌种保藏管理中心,保藏编号为CGMCC No.24236。

图1 B.coagulans GH1-1镜检照片
Fig.1 Microscopic photos of B.coagulans GH1-1
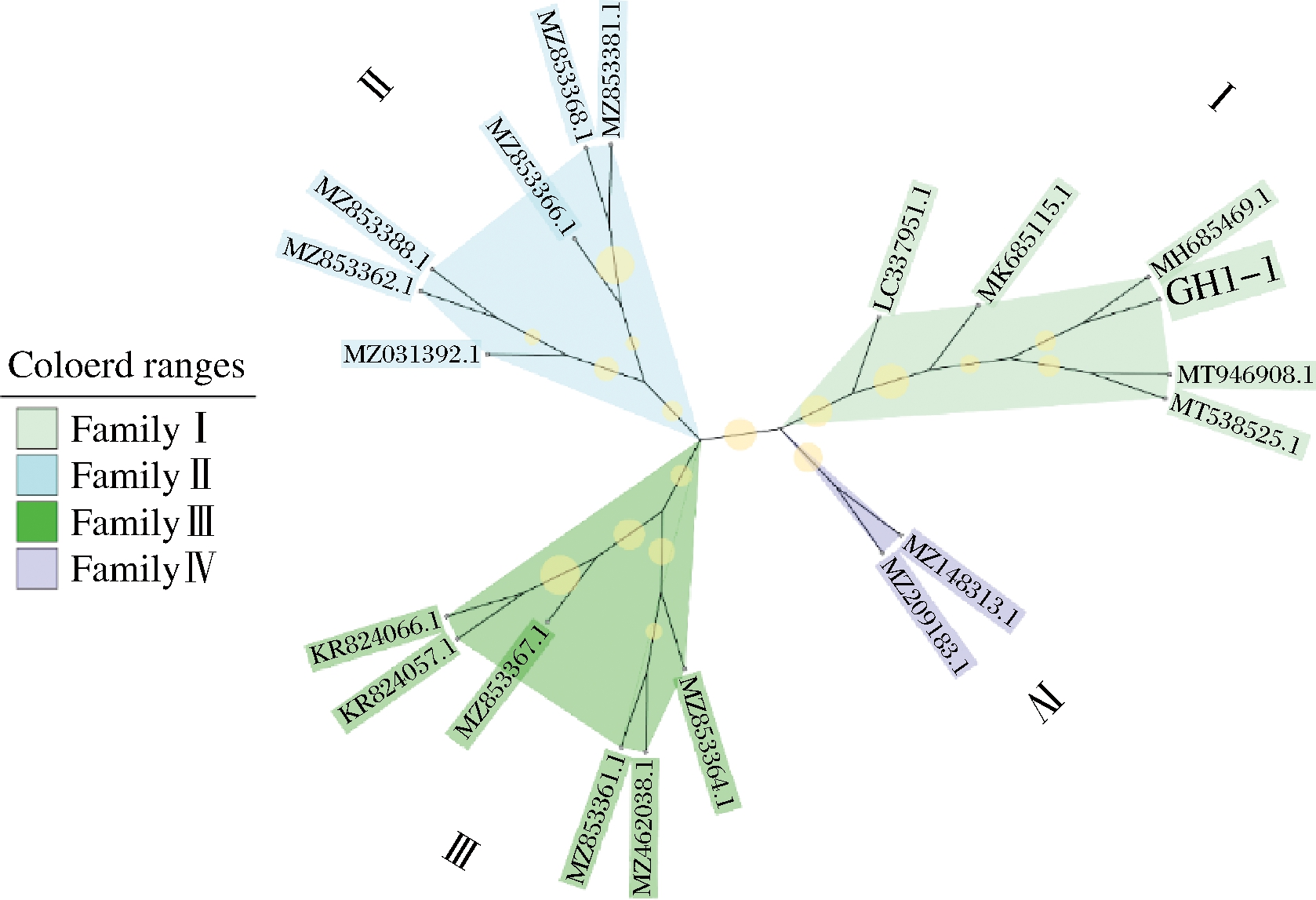
图2 B.coagulans GH1-1的进化树
Fig.2 Evolutionary tree of B.coagulans GH1-1
2.1.2 B.coagulans GH1-1生长曲线及嘌呤代谢能力的检测
如图3所示,B.coagulans GH1-1于0~4 h处于潜伏期,4~16 h处于对数生长期,16 h时到达稳定期,最大OD600在1.8左右。由于对数生长中后期的菌株具有生长速度快,各个体间均匀一致等优点,用做发酵的种子繁殖后代时可接近同步生长,使发酵代谢正常,周期缩短,因此种子发酵时间定为12 h。
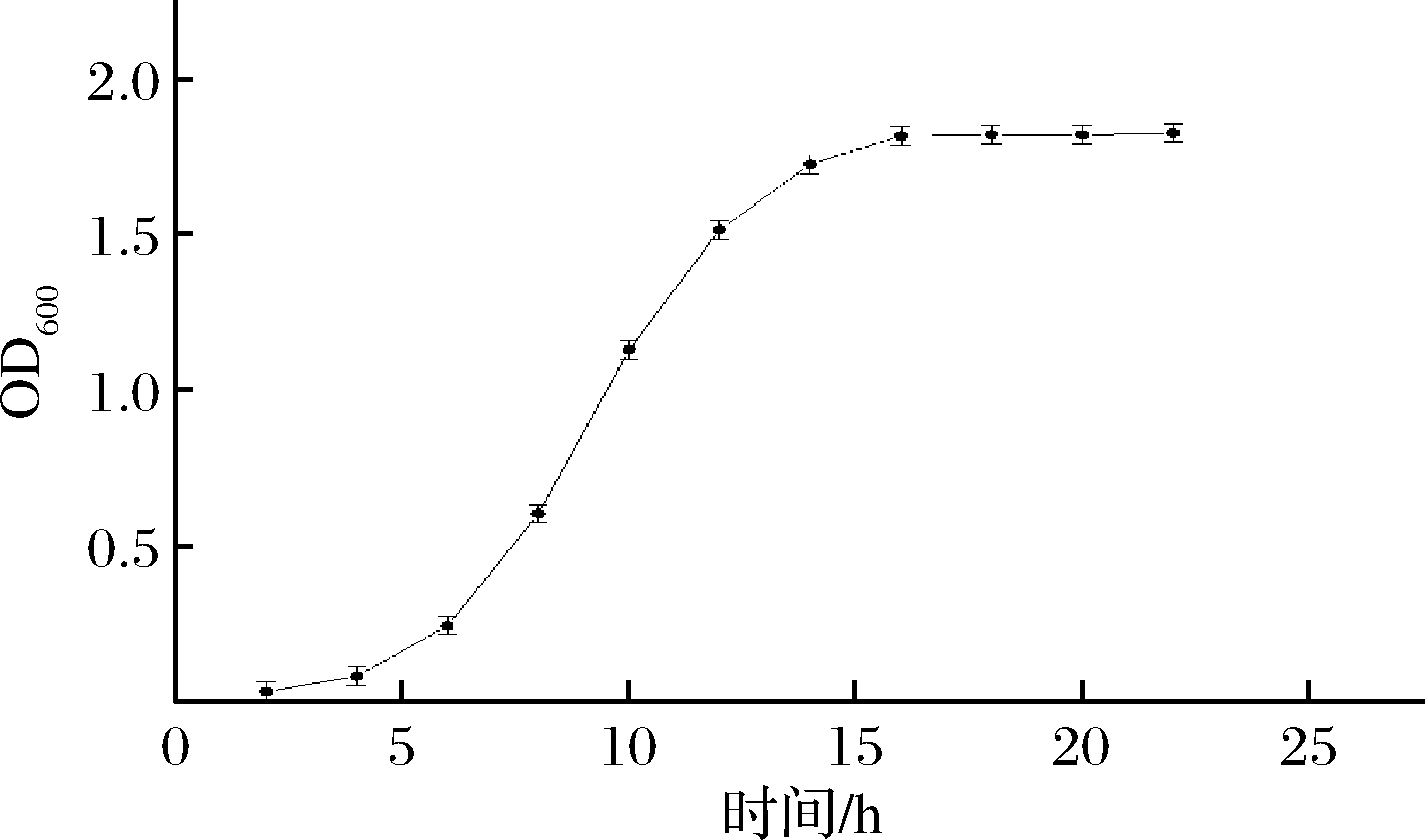
图3 B.coagulans GH1-1生长曲线
Fig.3 Growth curve of B.coagulans GH1-1
由图4可知,B.coagulans GH1-1可很好地代谢鸟嘌呤和次黄嘌呤,嘌呤总量减少了86.75%。因此,用该菌株发酵饮品可有效减少虾蛋白的嘌呤含量,且该菌株进入肠道后,具有代谢肠道中嘌呤的能力,对于防治高尿酸血症具有潜在的功效。
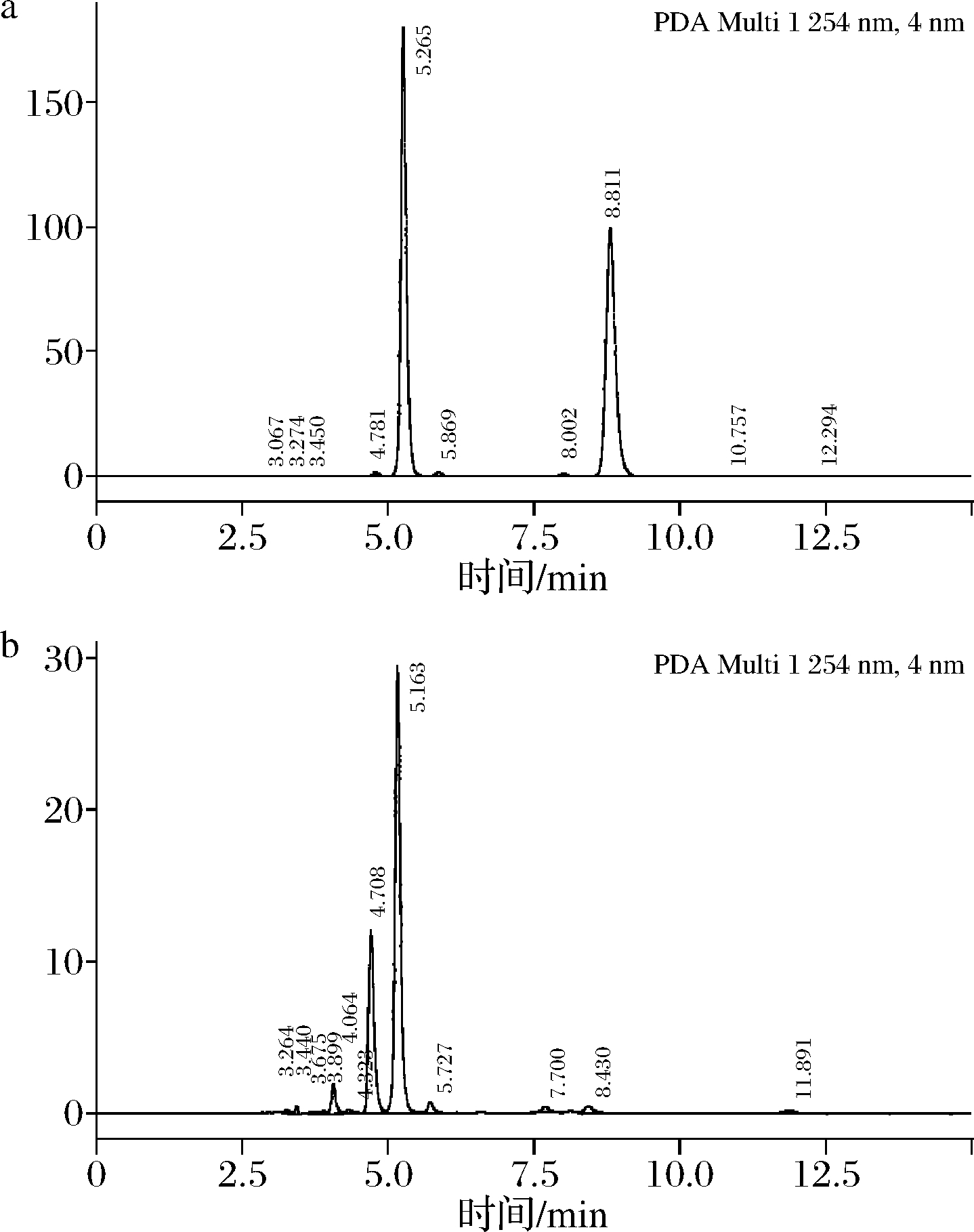
a-标准品液相图;b-GH1-1代谢后液相图
图4 B.coagulans GH1-1的嘌呤代谢能力HPLC检测图
Fig.4 B.coagulans GH1-1 purine metabolism ability HPLC detection chart
注:黄嘌呤、次黄嘌呤、鸟嘌呤的停留时间分别为4.7、5.2和8.8 min
2.2 B.coagulans GH1-1发酵虾肉蛋白饮品的工艺优化
由于使用单纯的虾肉蛋白液发酵口味难以被大众接受,且碱性过强(经测定pH>12),不利于菌株的生长和代谢,因此,为提高其口感,调节其pH,同时增加饮品的营养成分,使用柠檬汁与其进行复配发酵,并在发酵后添加适量甜菊糖苷进一步调节口味。
2.2.1 单因素试验结果
如图5所示,随着发酵时间的增加,感官评分呈先上升后降低的趋势。当发酵时间为14 h时,发酵饮品综合得分最高,果味、酸味、甜味交融,口感最佳。但随着发酵时间的增加,乳酸产量不断增加,当发酵时间超过14 h后,发酵酸味过重,饮品的新鲜感、柠檬特征香气伴随发酵逐渐消失,评分下降。

图5 发酵时间对感官评价的影响
Fig.5 Effect of fermentation time on sensory evaluation
随着接种量的增加,感官评分呈先上升后降低的趋势。当接种量过低时,乳酸风味不足,感官评分较低,随着接种量的增加,乳酸产量增加,酸味稍微加重,但饮品发酵更加充分的同时,饮品的新鲜感渐弱,柠檬特征香气渐弱,当接种量为3%时,酸度适中,果香味明显,饮品综合得分最高(图6)。
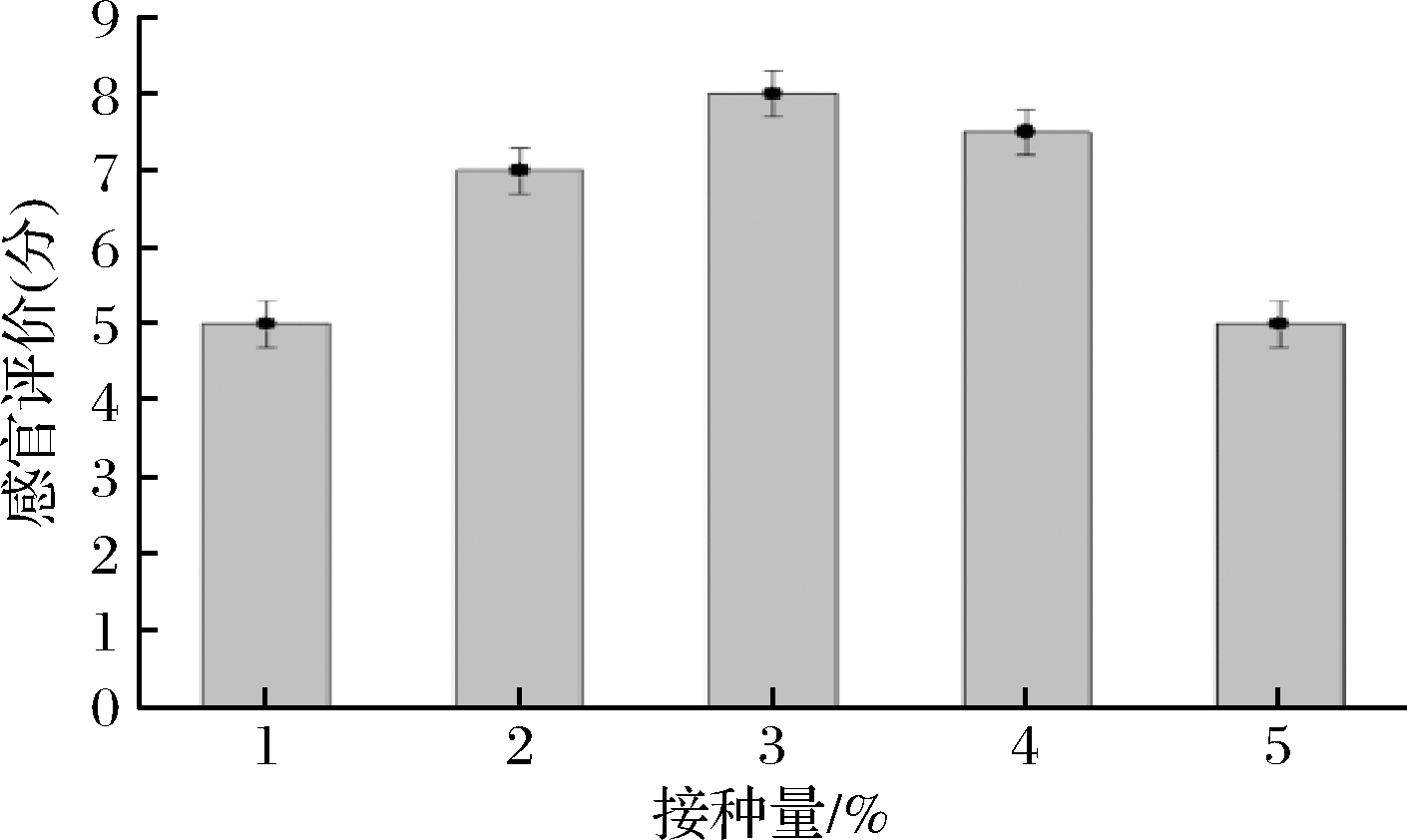
图6 B.coagulans GH1-1接种量对感官评价的影响
Fig.6 Effect of B.coagulans GH1-1 inoculum on sensory evaluation
随着甜菊糖苷添加量的增加,感官评分呈先上升后降低的趋势。适量的甜菊糖苷与饮品的酸味复合可增加口感,但随着添加量的增加,甜菊糖苷特殊甜味加重,会影响了柠檬的果香以及发酵口感,感官评分大幅度下降。当甜菊糖苷添加量为1 g/L时,饮品酸甜适度,符合多数人的口味,综合得分最高(图7)。
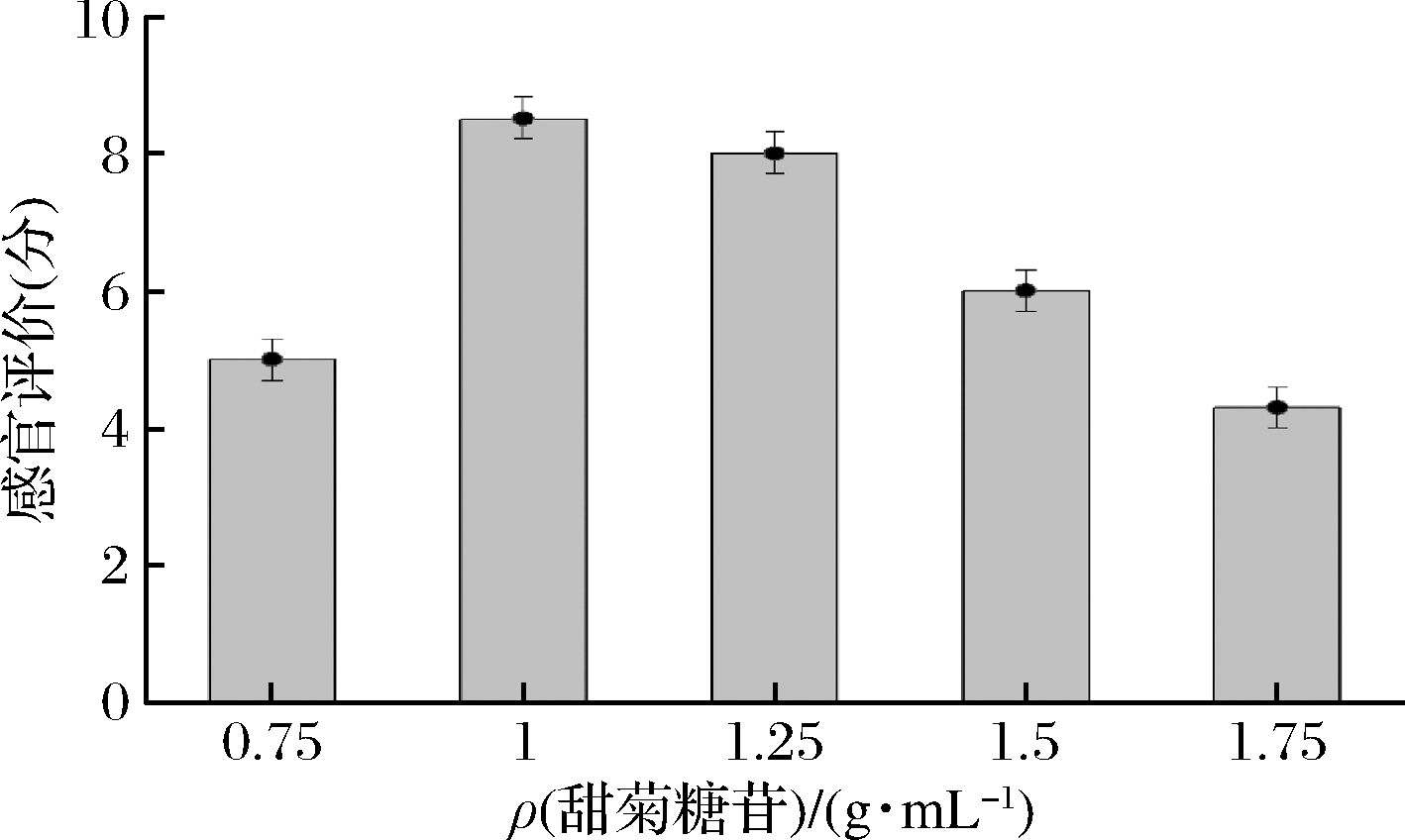
图7 甜菊糖苷添加量对口感的影响
Fig.7 Effect of stevioside addition on taste
2.2.2 正交试验结果
根据单因素试验结果,选择得分最高的2个水平进行正交,正交因素与水平见表2。
表2 正交因素水平表
Table 2 Orthogonal factor level table

水平因素A发酵时间/hB接种量/%C甜菊糖苷添加量/(g·L-1)1123121441.25
正交试验结果及极差如表3所示,极差RA>RB=RC,即3种因素对饮品感官评价的重要程度最大的为发酵时间。3个因素最佳配比为A1B1C1,即发酵时间为12 h、接种量为3%、甜菊糖苷添加量为1 g/L。
2.3 发酵饮品的特性分析
如表4所示,饮品中蛋白质的含量为2.44 g/100 mL。未发酵的饮品DPPH清除率为66.61%,与维生素C标准曲线对比,相当于859.13 μmol/L的维生素C;发酵后的DPPH清除率为80.03%,与维生素C标准曲线对比,相当于914.47 μmol/L的维生素C,可以看出发酵后,饮品的抗氧化能力可提高22.14%。经计算,未发酵的饮品可抑制53.11%的XOD活性,发酵后XOD活性抑制率可达66.67%,抑制XOD活性的能力提高25.53%。
表3 正交实验结果及极差分析
Table 3 Results and range analysis of orthogonal experiment
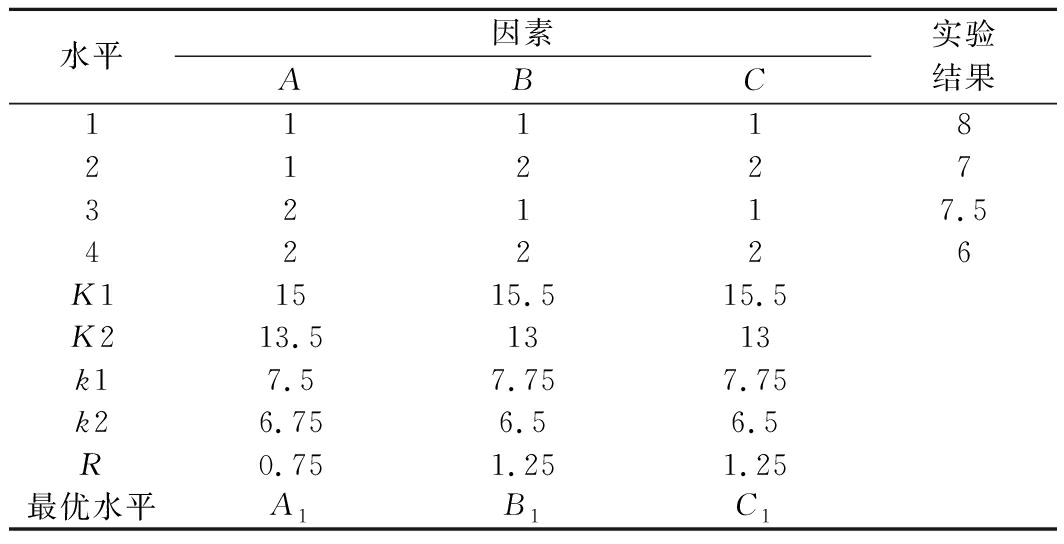
水平因素ABC实验结果111182122732117.542226K11515.515.5K213.51313k17.57.757.75k26.756.56.5R0.751.251.25最优水平A1B1C1
表4 发酵虾肉饮品的特性分析
Table 4 Beverage parameter measurement results

测定指标检测样品检测结果蛋白质含量/[g·(100 mL)-1]发酵饮品2.44DPPH自由基清除率/%未发酵饮品66.61发酵饮品80.03XOD活性/OD530蒸馏水0.177未发酵饮品0.083发酵饮品0.059
3 结论
凝结芽孢杆菌是一种可食用益生菌,它既有乳酸菌和双歧杆菌的益生作用,又具有芽孢菌的抗逆性强、易贮藏等优点,研究发现,大约有85%凝结芽孢杆菌能顺利到达小肠,通过调节微生物群组成、宿主免疫和代谢,对肠道疾病具有治疗作用。此外,毒理学实验和大量临床观察表明,凝结芽孢杆菌属于一类安全的可食用微生物[15]。早在1989年,凝结芽孢杆菌就被美国食品药品监督管理局(Food and Drug Administration, FDA)评为“普遍认为安全(Generally Recognized as Safe, GRAS)”的一类杆菌,目前已被FDA列入GRAS名单,并获得了欧盟食品安全局的安全资格认定。2005年,我国国家食品和药品监督管理局批准了凝结芽孢杆菌活菌药物上市,2016年我国卫生部也批准凝结芽孢杆菌作为新资源食品[16]。目前,凝结芽孢杆菌在食品、医药、饲料等方面的应用依然在不断发展[17]。
虾营养成分丰富,具有巨大的开发潜力[18-19]。然而,我国对虾资源的开发起步较晚,目前也还处在不断探索阶段,例如:一些研究将虾制成虾粉,再进一步用于提取油脂、虾青素、蛋白质等[20]。近年来,不少人也针对其易于微生物生长繁殖的特点,从其相关制品中筛选出益生菌,如2021年田亮金等[2]从虾酱中筛选出了6株益生芽孢杆菌并对其益生效果进行了分析。与其不同的是,本研究中所筛选获得凝结芽孢杆菌不仅具有较强抗氧化作用,而且有着明显的嘌呤代谢能力,为虾肉这一高嘌呤食材的深加工提供了新的优良发酵菌株。
虾肉相关饮品,目前市面上还极为罕见。谢伟斌等[11]曾对虾蛋白进行酶解,再与蜂蜜等调配制备了一款低分子多肽保健饮品;章雪琴等[21]将虾肉搅碎酶解,用3种益生菌联合发酵制备了一款发酵饮品。与前人研究有所不同,本文首先从虾酱中分离获得了具有生长性能良好、嘌呤代谢能力强的益生菌新菌株,经过较为系统的优化,研究制备了一款蛋白质等营养成分丰富且更符合大众口味的虾蛋白饮品。而且,该发酵饮品具有很强的抗氧化能力,有助于延缓组织器官功能减退以及细胞组织的老化,同时,所用菌株具有较强的代谢嘌呤的能力,且辅料柠檬汁具有降低尿酸的功效[22],所制得的饮品还可显著增强XOD抑制活性,因此,该饮品在预防高尿酸血症方面具有潜在的价值。
[1] 刘洋, 王卫.动物型蛋白饮料及其研究开发[J].食品与发酵科技, 2013(1):25-29.
LIU Y, WANG W.Research and development of animal protein drinks[J].Food and Fermentation Technology, 2013(1):25-29.
[2] 田亮金, 朱薇薇, 蔡岩, 等.虾酱中益生芽孢杆菌的筛选及其潜在益生效果的研究[J].海南大学学报(自然科学版), 2021, 39(3):269-279.
TIAN L J, ZHU W W, CAI Y, et al.Screening and analysis of potential probiotic effects of Bacillus from shrimp paste[J].Natural Science Journal of Hainan University, 2021, 39(3):269-279.
[3] SARAO L K, ARORA M.Probiotics, prebiotics, and microencapsulation:A review[J].Critical Reviews in Food Science and Nutrition, 2017, 57(2):344-371.
[4] KIM S K, GUEVARRA R B, KIM Y T, et al.Role of probiotics in human gut microbiome-associated diseases[J].Journal of Microbiology and Biotechnology, 2019, 29(9):1 335-1 340.
[5] KHOCHAMIT N, SIRIPORNADULSIL S, SUKON P, et al.Bacillus subtilis and lactic acid bacteria improve the growth performance and blood parameters and reduce Salmonella infection in broilers[J].Veterinary World, 2020, 13(12):2 663-2 672.
[6] 刘耀天, 席茂盛, 赵阳, 等.单齿螺肠道产褐藻胶裂解酶菌株的筛选、鉴别及酶学性质分析[J].食品与发酵工业, 2021, 47(15):29-35.
LIU Y T, XI M S, ZHAO Y, et al.Screening, identification and enzyme characteristics of alginate lyase-producing strains from the gut of Monodonta labio[J].Food and Fermentation Industries, 2021, 47(15):29-35.
[7] LI Z Y, WANG Y, LIU Z Q, et al.Biological detoxification of fumonisin by a novel carboxylesterase from Sphingomonadales bacterium and its biochemical characterization[J].International Journal of Biological Macromolecules, 2021, 169:18-27.
[8] LI M, YANG D B, MEI L, et al.Screening and characterization of purine nucleoside degrading lactic acid bacteria isolated from Chinese sauerkraut and evaluation of the serum uric acid lowering effect in hyperuricemic rats[J].PLoS One, 2014, 9(9):e105577.
[9] WU J W, WEI Z H, CHENG P, et al.Rhein modulates host purine metabolism in intestine through gut microbiota and ameliorates experimental colitis[J].Theranostics, 2020, 10(23):10 665-10 679.
[10] 李云捷, 谢玮.运动型鱼水解蛋白饮料工艺优化[J].湖北农业科学, 2013, 52(16):3 957-3 958;3 965.
LI Y J, XIE W.Optimization of the processing craft for sports drink of hydrolyzed fish protein[J].Hubei Agricultural Sciences, 2013, 52(16):3 957-3 958;3 965.
[11] 谢伟斌, 陈锦成, 林铓铧, 等.酶解低值虾蛋白制取功能多肽饮料的工艺技术研究[J].食品科技, 2007, 32(2):202-205.
XIE W B, CHEN J C, LIN M H, et al.Study on high quality peptide by low-value shrimp protein[J].Food Science and Technology, 2007, 32(2):202-205.
[12] 崔亚菲. 南极磷虾酶解工艺优化及风味成分分析[D].泰安:山东农业大学, 2018.
CUI Y F.Optimization of enzymatic hydrolysis of Antarctic krill and the analysis of flavor components[D].Tai’an:Shandong Agricultural University, 2018.
[13] 陈亚楠, 汪云阳, 王德行, 等.植物乳杆菌发酵陈皮柑饮料的工艺优化与分析[J].饮料工业, 2019, 22(5):28-34.
CHEN Y N, WANG Y Y, WANG D H, et al.Optimization and analysis of Chenpi citrus beverage fermented by Lactobacillus plantarum[J].Beverage Industry, 2019, 22(5):28-34.
[14] IONITA P.The chemistry of DPPH· free radical and congeners[J].International Journal of Molecular Sciences, 2021, 22(4):1545.
[15] MU Y, CONG Y.Bacillus coagulans and its applications in medicine[J].Beneficial Microbes, 2019, 10(6):679-688.
[16] 黄翠华. 一种陈皮发酵饮料的制备工艺研究及品质分析[D].广州:华南农业大学, 2016.
HUANG C H.The research of the fermentation technology of pericarpium citri reticulatae and the analysis of quality[D].Guangzhou:South China Agricultural University, 2016.
[17] 郭庆丰, 陈林, 马经纬.凝结芽孢杆菌益生机制及应用研究进展[J].食品研究与开发, 2018, 39(18):208-213.
GUO Q F, CHEN L, MA J W.Research advances in the probiotics mechanism and application of Bacillus coagulans[J].Food Research and Development, 2018, 39(18):208-213.
[18] ALFARIS N A, ALSHAMMARI G M, ALTAMIMI J Z, et al.Evaluating the effects of different processing methods on the nutritional composition of shrimp and the antioxidant activity of shrimp powder[J].Saudi Journal of Biological Sciences, 2022, 29(1):640-649.
[19] LI X, WANG Y, LI H Y, et al.Chemical and quality evaluation of Pacific white shrimp Litopenaeus vannamei:Influence of strains on flesh nutrition[J].Food Science & Nutrition, 2021, 9(10):5 352-5 360.
[20] 刘志东, 陈雪忠, 黄洪亮, 等.南极磷虾粉加工与贮藏技术研究进展[J].食品工业科技, 2016, 37(16):357-361.
LIU Z D, CHEN X Z, HUANG H L, et al.Progress in processing and storaging technologies of Antarctic krill (Euphausia superba) powder[J].Science and Technology of Food Industry, 2016, 37(16):357-361.
[21] 章雪琴, 吉宏武, 张迪, 等.南极磷虾微生物复合发酵制备呈味基料的工艺优化[J].食品与发酵工业, 2018, 44(3):107-113.
ZHANG X Q, JI H W, ZHANG D, et al.Optimization of preparation of flavor based on material by microbial composite fermentation of Antarctic krill[J].Food and Fermentation Industries, 2018, 44(3):107-113.
[22] CHEN L, LI M, WU J L, et al.Effect of lemon water soluble extract on hyperuricemia in a mouse model[J].Food & Function, 2019, 10(9):6 000-6 008.