嗜酸乳杆菌(Lactobacillus acidophilus)是革兰氏阳性无芽孢杆菌,呈链杆状或球杆状,是人体和动物肠道内的重要有益微生物,与人类和动物肠道健康息息相关,也是目前人类膳食补充剂、乳品饮料及饲料添加剂中常见的菌种之一[1-2]。国内乳酸菌的生产企业主要关注发酵过程中活菌数和冻干存活率,因此大多数研发工作者主要围绕着原料的筛选以及工艺的改进来达到提升活菌数和冻干存活率的目的[3-4],而很少关注到原料、工艺对微生物的菌体形态等微观生理状态的影响所导致的最终活菌数、冻干存活率差异。目前已有研究关注到菌体形态对同等培养条件下的微生物能达到的最高活菌数、冻干存活率以及货架期存在影响[5],但对于菌体形态的差异具体受到哪些因素的影响研究相对较少,其中报道的乳酸菌菌体形态的差异主要集中在培养过程的理化条件如pH[6]、温度[7]等的影响。但在研究中发现,不同的营养对乳酸菌菌体形态也会产生很大的影响。目前乳酸菌的生产中,国内企业一般会采用酵母浸出物、蛋白胨(大豆蛋白胨、牛骨蛋白胨)、牛肉浸膏等有机氮源混合使用,而国外生产企业如科汉森、雀巢、丹尼斯克则主要以酵母浸出物为唯一的有机氮源,酵母浸出物相对于其他动物源有机氮源具有来源稳定、生物安全的优点。因此本研究以酵母浸出物作为培养基中的唯一氮源,研究酵母浸出物中对嗜酸乳杆菌菌体形态产生影响的关键营养组分,以期在乳酸菌的工业化生产中,通过营养条件干预菌体形态,从而提升菌体稳定性。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
嗜酸乳杆菌,安琪酵母股份有限公司蛋白质营养与调味技术中心保存。
1.1.2 试剂
MgSO4、KH2PO4、MnSO4、柠檬酸氢二铵、吐温-80、葡萄糖、琼脂粉,国药集团化学试剂有限公司;酵母浸出物FM902、FM803、FM502、FM860、FM808,安琪酵母股份有限公司提供;脱脂乳粉,内蒙古伊利实业集团股份有限公司。
1.2 仪器与设备
SW-CJ-1C型双人单面超净工作台,苏州进化设备有限公司;FiveEasy Plus FP20型pH计,梅特勒-托利多国际贸易(上海)有限公司;HWS-350型生化培养箱,上海比朗仪器有限公司;Sp-750型分光光度计,上海光谱仪器有限公司;GI54DWS型灭菌锅,致微(厦门)仪器有限公司;CX43型生物显微镜/MII Image View4.11.19051拍照系统,奥林巴斯株式会社;BIOTECH-3 JG-6型离位灭菌玻璃多联发酵罐,上海保兴生物设备有限公司。
1.3 实验方法
1.3.1 培养基的配制
MRS(de Man,Rogosa and Sharpe)液体培养基(g/L):葡萄糖20、蛋白胨10、牛肉膏10、酵母浸出物5、乙酸钠5、K2HPO4 2、柠檬酸氢二铵2、MgSO4 0.58、MnSO4 0.25、吐温-80 1 mL,调节pH至6.2~6.4。
氮源影响分析培养基(g/L):葡萄糖20、有机氮源20、吐温-80 3 mL、MgSO4 0.1、MnSO4 0.075、K2HPO4 2、柠檬酸氢二铵2,调节pH至6.2~6.4,其中有机氮源为不同型号的酵母浸出物,具体包括酵母浸出物FM902、FM803、FM502、FM860、FM808。
RNA、核苷酸对嗜酸乳杆菌形态影响的分析培养基(g/L):葡萄糖20、酵母浸出物FM902 20、吐温-80 3 mL、MgSO4 0.1、MnSO4 0.075、K2HPO4 2、柠檬酸氢二铵2,实验组分别添加RNA水解物0.8、鸟嘌呤核苷酸(guanosine monophosphate,GMP)0.4、腺嘌呤核苷酸(adenosine monophosphate,AMP)0.4、尿嘧啶核苷酸(uridine monophosphate,UMP)0.4、肌苷酸(inosine monphosphate,IMP)0.4、胞嘧啶核苷酸(cytidine monophosphate,CMP)0.4,混合核苷酸组添加IMP 0.3、CMP 0.3、AMP 0.2、UMP 0.1、GMP 0.3,调节pH至6.2~6.4。
1.3.2 菌株的活化与培养
菌种的活化:用接种环从保菌管中蘸取1环,在MRS固体培养基上划线,平板置于37 ℃培养36~48 h,挑取单菌落,接入15 mL MRS液体培养基中,37 ℃培养12 h。以2%(体积分数)接种到新鲜的MRS培养基中,培养12 h得到活化的种子液。
嗜酸乳杆菌的扩大培养:将活化好的种子液按5%(体积分数)的接种量,转接于装有氮源影响分析培养基的3 L发酵罐(装液量2 L)中,以流加质量分数10% NaOH的方式,恒定pH 5.0培养,培养至发酵液中葡萄糖质量浓度低于2 g/L,结束培养。
1.3.3 嗜酸乳杆菌的菌体形态分析
嗜酸乳杆菌扩大培养结束后取1.5 mL发酵液于2 mL离心管中,10 000 r/min离心2 min,弃上清液,收集菌体,菌体用生理盐水悬浮洗涤1~2次,取适量菌悬液于载玻片固定,染色后用显微镜油镜观察,利用拍照系统进行拍照记录并统一添加2 μm的参照标尺,对比菌体长度差异。
1.3.4 生物量与活菌数的测定
菌体密度的测定:用紫外分光光度计在600 nm下测定发酵液的吸光度值,若吸光度值大于0.8,需要将发酵液进行稀释,使稀释后菌液的吸光值在0.2~0.8。
活菌数的测定:采用平板计数法。
1.3.5 不同型号酵母浸出物的营养特性分析
蛋白质含量测定:参照GB/T 20886.2—2021《酵母产品质量要求 第2部分: 酵母加工制品》计算总氮,总氮乘以换算系数即为蛋白质含量。
游离氨基酸和水解氨基酸的测定:参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》采用氨基酸分析仪测定样品中游离氨基酸,柱后茚三酮衍生法。采用氨基酸分析仪测定样品中盐酸水解后的游离氨基酸。
肽分子质量分布的测定:采用高效液相色谱法测定,采用排阻柱,依据样品组分中物质相对分子质量进行分离,在紫外吸收波长220 nm条件下检测。
RNA的测定:称取0.06~0.15 g酵母浸出物或者3 g发酵液于离心管中,加入8 mL,0.25 mol/L HClO4(冷)到离心管中,4 ℃水浴15 min。4 000 r/min离心10 min,轻轻倒出浮于表面的物质后加入5 mL 0.5 mol/L的HClO4振荡混匀,70 ℃水浴15 min,每隔3~4 min振荡1次,4 000 r/min离心10 min,吸取1 mL上清液,用蒸馏水定容至100 mL。使用紫外分光光度计在260 nm测定吸光值,蒸馏水作为空白对照。RNA含量按照公式(1)计算:
(1)
式中:R,RNA含量,%;A,吸光值;n,稀释倍数;m,样品质量,mg;w,样品固形物质量分数,%。
核苷酸的测定:称取样品0.5~1 g(精确至0.000 1 g),加水溶解,移入100 mL容量瓶中,超声波溶解,并用水定容至刻度。根据样品中的核苷酸含量对溶液进行适当的稀释(稀释倍数n)。用0.22 μm水相微孔膜过滤,滤液备用。如果用0.22 μm水相微孔膜过滤后样品仍然浑浊,将样品在4 000~10 000 r/min离心10 min后再过滤,进行超高液相色谱检测,具体条件如下:色谱柱(Waters Acquity H-Class UPLC),流动相B,10 mmol/L NaH2PO4;C,质量分数0.1%磷酸水溶液;D,乙腈;柱温50 ℃;进样量1 μL;检测波长3D扫描,254 nm;梯度洗脱条件见表1。
表1 梯度洗脱条件
Table 1 Process conditions of gradient elution
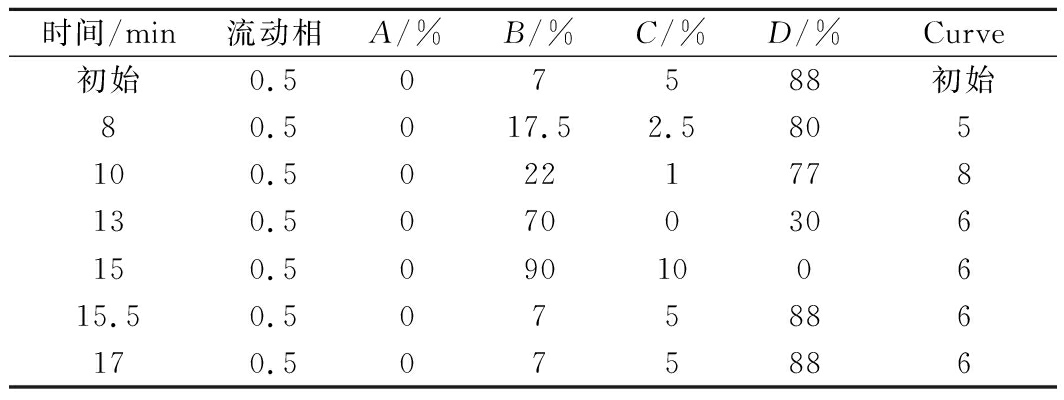
时间/min流动相A/%B/%C/%D/%Curve初始0.507588初始80.5017.52.5805100.50221778130.50700306150.5090100615.50.5075886170.5075886
结果与计算:将标准系列和样品溶液分别进样,进样量为1 μL,根据标准品的保留时间定性样品中的 CMP、UMP、GMP、IMP、AMP的色谱峰。根据样品的峰面积,以外标法计算各组分的含量。CMP、UMP、GMP、IMP、AMP含量按照公式(2)计算:
(2)
式中:X,样品中CMP、UMP、GMP、IMP、AMP的含量,%;ρ,由标准曲线获得的进样溶液中CMP、UMP、GMP、IMP、AMP的含量,μg/mL;V,定容体积,mL;n,稀释倍数;m,样品质量,g。
1.3.6 菌株对不同核酸类物质的消耗
在进行嗜酸乳杆菌的扩大培养时,完成接种后马上取样300 mL,将发酵液于10 000 r/min离心10 min,然后将上清液置于旋转蒸发仪浓缩至30~50 mL,利用快速水分测定仪进行水分测定,并按照RNA、核苷酸含量测定方法进行相关指标的测定。扩大培养结束后,按照同样的方法进行取样、离心,收集上清液进行浓缩,对浓缩液进行水分、RNA、核苷酸含量测定。培养前与培养后的RNA、核苷酸含量差值即为核酸类物质的消耗量。
1.3.7 RNA水解物的制备与检测
RNA充分溶解后调pH至5.0,加核酸酶酶解制备RNA水解物。
1.3.8 菌体形态对冻干存活率的影响
扩大培养结束后,离心发酵液,收集菌体,菌体量与冻干保护剂(质量分数10%灭菌脱脂乳)按照质量比1∶10混合,乳化后准确称取1 g稀释至一定的浓度进行活菌计数,同时准确称取5 g样品于西林瓶中进行冻干,每个样品3个重复。冻干结束后使用一定量的生理盐水对冻干粉进行复溶,并稀释至一定浓度进行活菌计数。统计冻干前后活菌总数,冻干存活率按照公式(3)计算:
(3)
式中:RS,冻干存活率,%;C1,冻干前每1 g乳化液活菌数总和,CFU;C2,每5 g乳化液冻干后活菌数总和,CFU。
1.4 数据统计与分析
所有实验均重复3次,实验结果表示为平均值±标准偏差,实验数据采用Origin 9.0绘图,采用SPSS 17.0统计软件进行单因素ANOVA判断(邓肯检验),P<0.05表示有显著性差异。
2 结果与分析
2.1 不同酵母浸出物对菌体形态的影响
嗜酸乳杆菌在使用不同酵母浸出物培养后,利用显微镜放大1 000倍(物镜100×,目镜10×)并添加2 μm标尺,进行观察记录。由图1的镜检结果可以看出,嗜酸乳杆菌在使用不同酵母浸出物制备的培养基和相同条件下进行培养,嗜酸乳杆菌菌体的形态呈现出了显著差异。其中,以酵母浸出物FM502为氮源的菌体最短,菌体长度均一且基本在2 μm左右,而其他酵母浸出物培养的嗜酸乳杆菌菌体形态均较长,最高长度可达6~8 μm。根据相关文献报道,菌体的形态一方面受到生长条件的影响[8],另一方面受到培养基营养条件的影响[9],本次实验整个培养过程中pH值、初始糖浓度、渗透压都维持在相当的水平,因此造成形态不同的可能原因是酵母浸出物的营养差异导致嗜酸乳杆菌的生理代谢发生了改变。虽然酵母浸出物的原料均来源于面包酵母,但不同酵母培养基及培养条件会造成面包酵母蛋白质含量、生长因子、核酸类物质的差异,最终导致该原料制备的酵母浸出物营养特性不同,造成微生物对其营养吸收和利用的差异,进而引起菌体表观形态的改变。
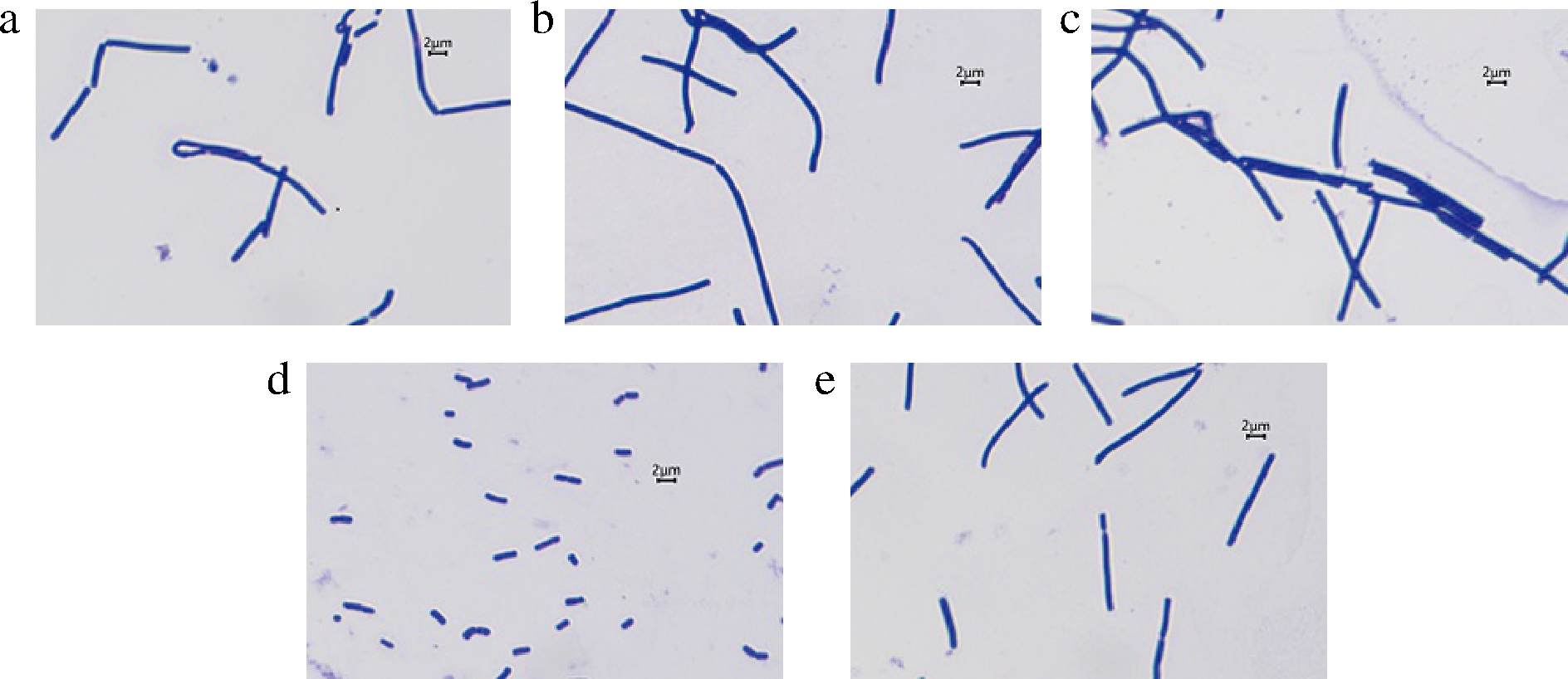
a-FM902;b-FM803;c-FM860;d-FM502;e-FM808
图1 不同酵母浸出物对嗜酸乳杆菌形态的影响
Fig.1 Effect of different yeast extracts on morphology of L.acidophilus
2.2 不同的酵母浸出物营养成分分析
有机氮源一方面提供微生物所需要的氮元素[10],另一方面为微生物提供各类生长因子[11]。表2结果显示,不同型号的酵母浸出物在蛋白质、蛋白分子质量分布、游离氨酸、RNA以及核苷酸上都存在一定的差异,其中FM902蛋白质含量最高,FM502核苷酸含量最高,FM803游离氨基酸含量最高。2.1小节中不同型号酵母浸出物培养的嗜酸乳杆菌出现的形态差异可能与酵母浸出物的上述营养特性存在密切关系。本研究中酵母浸出物是嗜酸乳杆菌培养的唯一氮源,一方面需要满足嗜酸乳杆菌蛋白合成所需要氮素需求[12],另一方面也要为菌体遗传物质合成提供所需核酸类物质[13],有文献报道嗜酸乳杆菌的合成代谢较弱[14],因此有机氮源中特定分子质量的蛋白类物质、游离氨基酸、核酸、核苷酸等物质的含量差异都有可能是影响嗜酸乳杆菌菌体形态的重要因素。
表2 不同酵母浸出物的营养组分含量 单位:g/100 g
Table 2 Nutritional components in different yeast extracts
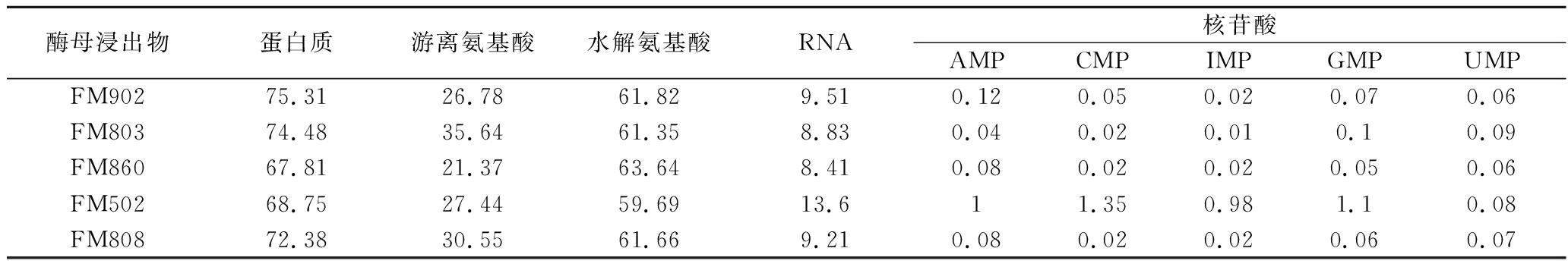
酶母浸出物蛋白质游离氨基酸水解氨基酸RNA核苷酸AMPCMPIMPGMPUMPFM90275.3126.7861.829.510.120.050.020.070.06FM80374.4835.6461.358.830.040.020.010.10.09FM86067.8121.3763.648.410.080.020.020.050.06FM50268.7527.4459.6913.611.350.981.10.08FM80872.3830.5561.669.210.080.020.020.060.07
2.3 嗜酸乳杆菌培养前后培养基中主要营养物质的变化分析
从氮源的吸收方面分析,影响微生物对有机氮源利用的主要因素包括分子质量分布、水解度、游离氨基酸含量等[15]。对比表3中培养前后发酵液中蛋白质、游离氨基酸含量变化发现,嗜酸乳杆菌对培养基中的蛋白质、游离氨基酸的利用率均只有30%左右,说明不同型号酵母浸出物均能够满足嗜酸乳杆菌的氮源需求,不同型号酵母浸出物中的蛋白质、游离氨基酸的差异可能不是造成嗜酸乳杆菌菌体形态发生重大变化的主要原因。
从表4中的分子质量分布可以看出,不同型号的酵母浸出物含有的多肽有细微差别,但从嗜酸乳杆菌培养前后培养基中蛋白质分子质量的构成对比发现,400~1 000 Da的多肽变化最为显著,但该分子质量段的小肽在不同型号酵母浸出物中的含量相当,因此2.1小节中菌体形态的差异可能与酵母浸出物中分子质量的分布也没有显著关系。
表3 培养基中蛋白质与氨基酸的消耗 单位:g/L
Table 3 Consumption of proteins and amino acids in culture medium by L.acidophilus
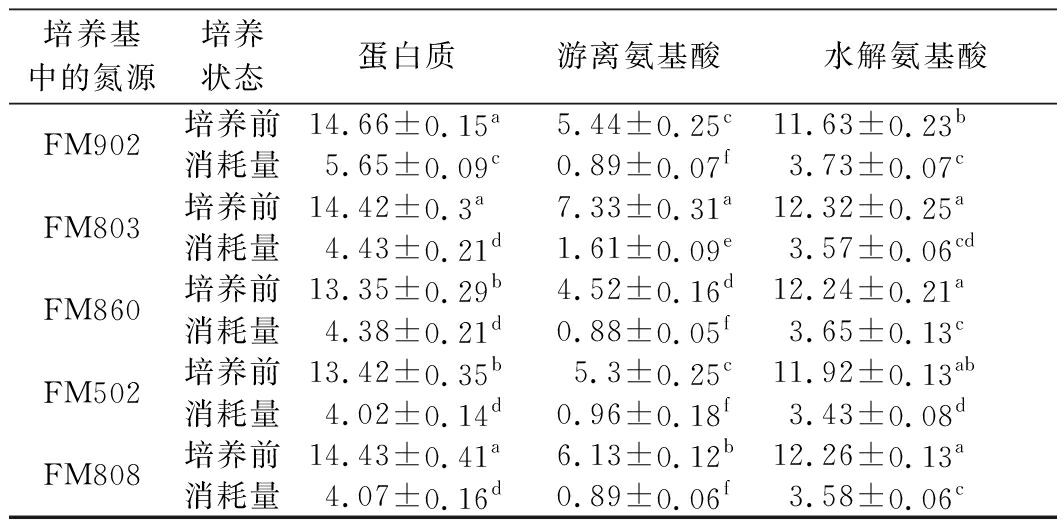
培养基中的氮源培养状态蛋白质 游离氨基酸 水解氨基酸 FM902培养前14.66±0.15a5.44±0.25c11.63±0.23b消耗量5.65±0.09c0.89±0.07f3.73±0.07cFM803培养前14.42±0.3a7.33±0.31a12.32±0.25a消耗量4.43±0.21d1.61±0.09e3.57±0.06cdFM860培养前13.35±0.29b4.52±0.16d12.24±0.21a消耗量4.38±0.21d0.88±0.05f3.65±0.13cFM502培养前13.42±0.35b5.3±0.25c11.92±0.13ab消耗量4.02±0.14d0.96±0.18f3.43±0.08dFM808培养前14.43±0.41a6.13±0.12b12.26±0.13a消耗量4.07±0.16d0.89±0.06f3.58±0.06c
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
表4 培养基中不同分子质量的多肽消耗
Table 4 Consumption of peptides of different molecular weights in the culture medium by L.acidophilus
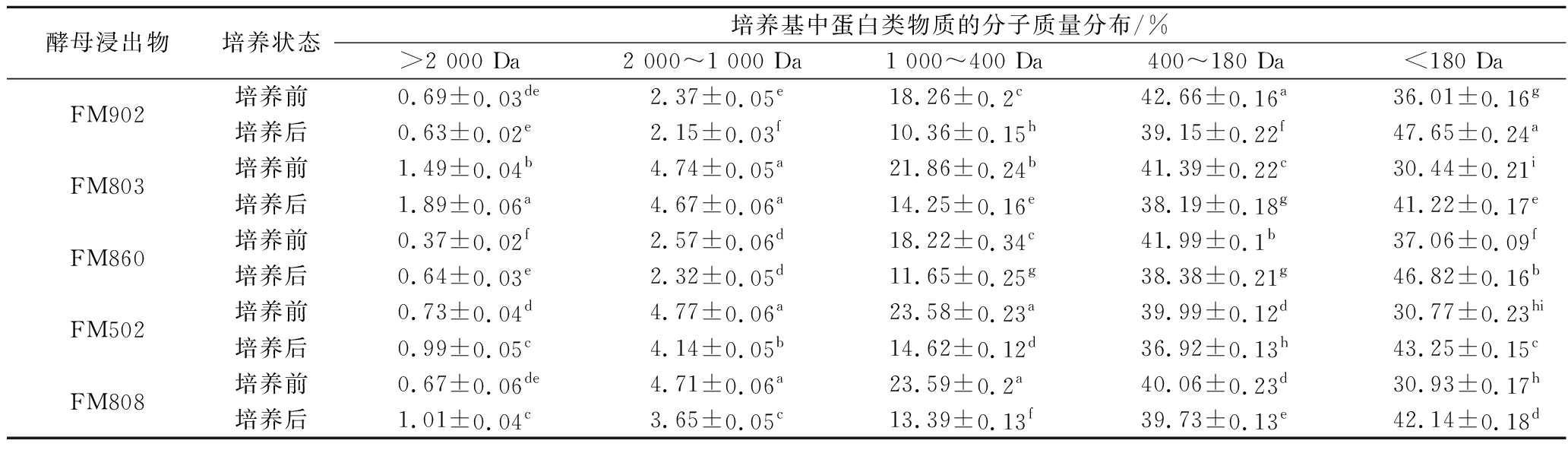
酵母浸出物培养状态培养基中蛋白类物质的分子质量分布/%>2 000 Da2 000~1 000 Da1 000~400 Da400~180 Da<180 DaFM902培养前0.69±0.03de2.37±0.05e18.26±0.2c42.66±0.16a36.01±0.16g培养后0.63±0.02e2.15±0.03f10.36±0.15h39.15±0.22f47.65±0.24aFM803培养前1.49±0.04b4.74±0.05a21.86±0.24b41.39±0.22c30.44±0.21i培养后1.89±0.06a4.67±0.06a14.25±0.16e38.19±0.18g41.22±0.17eFM860培养前0.37±0.02f2.57±0.06d18.22±0.34c41.99±0.1b37.06±0.09f培养后0.64±0.03e2.32±0.05d11.65±0.25g38.38±0.21g46.82±0.16bFM502培养前0.73±0.04d4.77±0.06a23.58±0.23a39.99±0.12d30.77±0.23hi培养后0.99±0.05c4.14±0.05b14.62±0.12d36.92±0.13h43.25±0.15cFM808培养前0.67±0.06de4.71±0.06a23.59±0.2a40.06±0.23d30.93±0.17h培养后1.01±0.04c3.65±0.05c13.39±0.13f39.73±0.13e42.14±0.18d
通过对发酵前后培养基中核苷酸含量的检测,发现培养过程中不同酵母浸出物所提供的核苷酸都发生了大量的消耗。由图2可以看出,鸟嘌呤单核苷酸的消耗量最大,消耗比例>70%;其次为IMP,消耗比例在50%左右,而尿嘧啶单核苷酸和胞嘧啶单核苷酸的消耗量相对较低,消耗比例在20%左右。表2结果表明,酵母浸出物FM502的游离核苷酸含量(IMP、GMP、CMP、UMP、AMP)总和达到了4.5%,而其他型号的酵母浸出物核苷酸含量不足0.5%。由表5可知,以酵母浸出物FM502为氮源制备的培养基在培养嗜酸乳杆菌后其核苷酸消耗总量为3 567 mg/L,其他型号酵母浸出物所能提供的单核苷酸总和远低于该值。另外从核苷酸的消耗比例可以看出GMP、IMP等的利用率远高于蛋白质的利用率,由此可推断造成嗜酸乳杆菌的形态差异主要原因可能是由于酵母浸出物中核酸类物质含量影响了微生物的遗传物质合成与正常分裂,导致菌体形态差异,而蛋白类组分对菌体形态没有显著影响。有文献曾提到嗜酸乳杆菌属于严苛营养型微生物[16],其自生合成代谢能力较弱,对培养基的营养要求高,一些营养的缺乏可导致菌体状态的变化[17]。因此从本研究结果来看有机氮源中核苷酸的含量可能通过影响嗜酸乳杆菌的正常分裂,进而造成嗜酸乳杆菌菌体形态过长,但是具体哪些核苷酸或核酸类物质起主要作用有待进一步研究。
表5 培养基中核苷酸的消耗 单位:mg/L
Table 5 Consumption of nucleotide in the culture medium by L.acidophilus
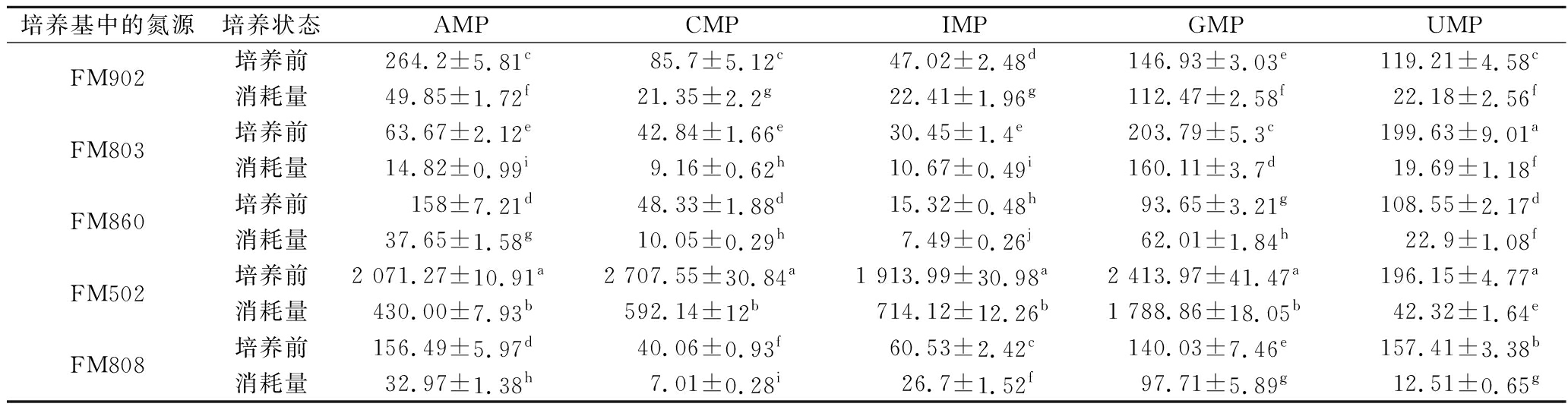
培养基中的氮源培养状态AMP CMP IMP GMP UMP FM902培养前264.2±5.81c85.7±5.12c47.02±2.48d146.93±3.03e119.21±4.58c消耗量49.85±1.72f21.35±2.2g22.41±1.96g112.47±2.58f22.18±2.56fFM803培养前63.67±2.12e42.84±1.66e30.45±1.4e203.79±5.3c199.63±9.01a消耗量14.82±0.99i9.16±0.62h10.67±0.49i160.11±3.7d19.69±1.18fFM860培养前158±7.21d48.33±1.88d15.32±0.48h93.65±3.21g108.55±2.17d消耗量37.65±1.58g10.05±0.29h7.49±0.26j62.01±1.84h22.9±1.08fFM502培养前2 071.27±10.91a2 707.55±30.84a1 913.99±30.98a2 413.97±41.47a196.15±4.77a消耗量430.00±7.93b592.14±12b714.12±12.26b1 788.86±18.05b42.32±1.64eFM808培养前156.49±5.97d40.06±0.93f60.53±2.42c140.03±7.46e157.41±3.38b消耗量32.97±1.38h7.01±0.28i26.7±1.52f97.71±5.89g12.51±0.65g
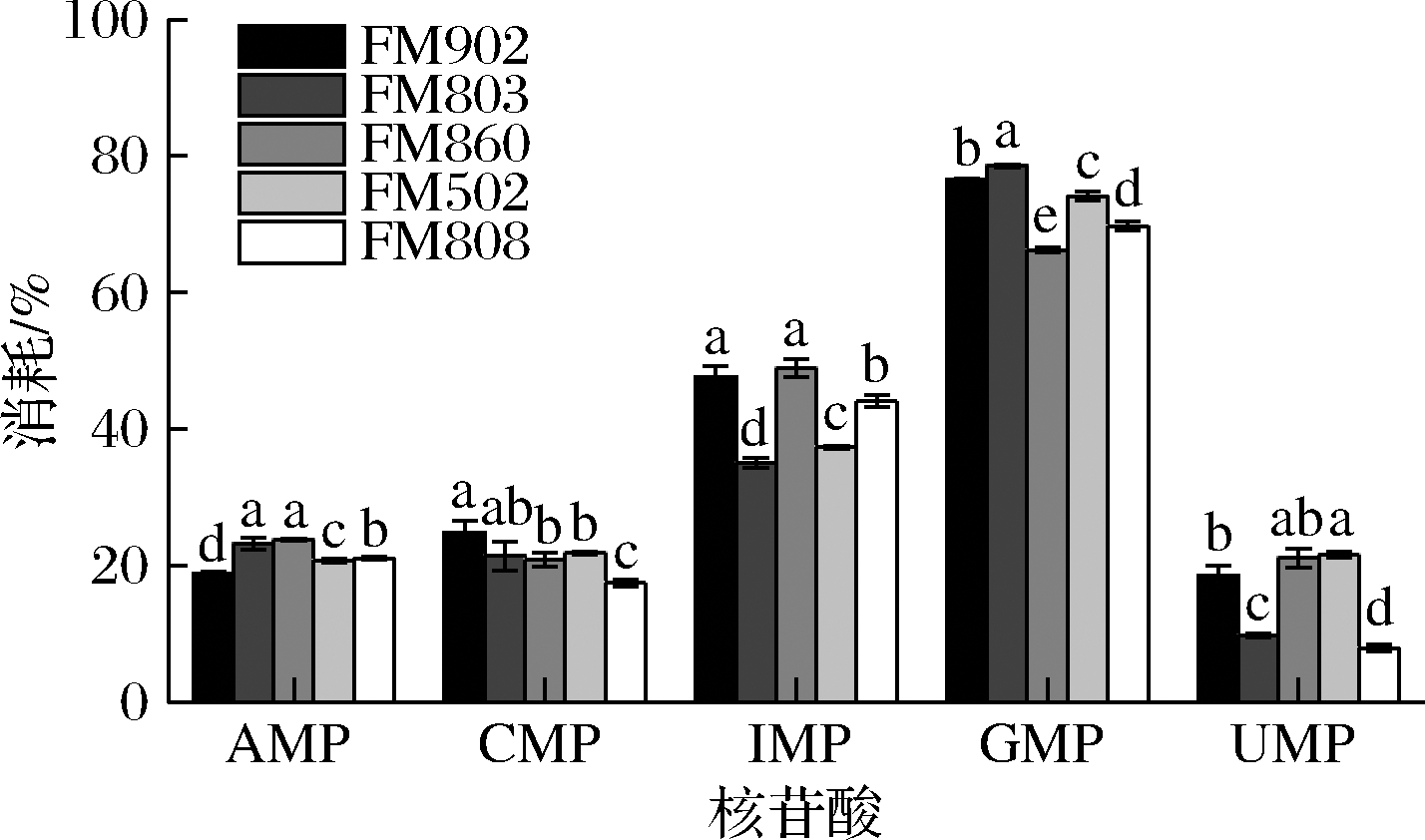
图2 不同酵母浸出物制备培养基中的核苷酸消耗比例
Fig.2 Nucleotides consumption rate in the culture media made with different yeast extracts
2.4 不同核苷酸及RNA水解物对嗜酸乳杆菌形态的影响
为了进一步验证造成菌体形态差异是受到何种核苷酸的影响,分别向FM902中添加一定量的单核苷酸(AMP、CMP、IMP、GMP、UMP)以及RNA水解物进行嗜酸乳杆菌的培养,菌体形态利用显微镜放大1 000倍进行观察记录。
由图3结果可以看出,向FM902添加核酸类物质后,嗜酸乳杆菌的菌体形态相对于未添加的均发生了变化。相同培养条件下,添加RNA水解物后菌体长度缩短最为明显,而添加单一的核苷酸虽能够在一定程度上使菌体长度变短,但与RNA水解物的相比存在较大的差距。另外,添加单核苷酸的混合物相比添加单一的核苷酸菌体的长度略短,此现象说明嗜酸乳杆菌的菌体形态不仅受到某种单一核苷酸的影响,更受到多种核苷酸的协同作用影响。RNA水解物的作用效果相对于添加单核苷酸化合物和5种核苷酸混合物更显著,可能主要是由于在RNA水解物的制备过程中,核酸酶的作用具有一定随机性,导致RNA水解物是一种复杂的混合物,一方面含有部分未经完全水解的RNA片段,另外也含有单核苷酸、碱基、核糖等组分[18],这些物质都是微生物遗传物质合成的前体物质[19]。由于嗜酸乳杆菌缺乏从头合成相关核酸类物质的能力[14],RNA水解物能为嗜酸乳杆菌提供更丰富的基础物质用于遗传物质合成,从而促进菌体的快速分裂,呈现出菌体短小的形态。而嗜酸乳杆菌在未添加核酸类物质的情况下生长,可能由于其菌体DNA的合成不足[20],使菌体的分裂和生长不协调[21],导致出现菌体过长、不均一的状态。

a-AMP;b-CMP;c-IMP;d-GMP;e-UMP;f-核苷酸混合物;g-RNA水解物
图3 不同核苷酸对嗜酸乳杆菌形态的影响
Fig.3 Effect of different nucleotides on morphology of L.acidophilus
2.5 菌体大小对冻干存活率的影响
为了验证菌体大小是否有助于后期的冻干存活力提升,收集使用FM902和FM902+RNA水解物培养的2种不同形态的嗜酸乳杆菌菌泥,进行冻干存活率测试,结果如表6所示。菌体短小的嗜酸乳杆菌冻干存活率明显高于较长的菌体,该结论与其他菌株的相关报道一致[22]。对于本研究的嗜酸乳杆菌,RNA水解物可以使嗜酸乳杆菌的菌体变短而达到提升冻干存活率的效果,该结果对于嗜酸乳杆菌的工业生产具有一定的参考意义。
表6 RNA水解物对嗜酸乳杆菌冻干存活率的影响
Table 6 Effect of RNA hydrolysate on freeze-drying survival rate of L. acidophilus
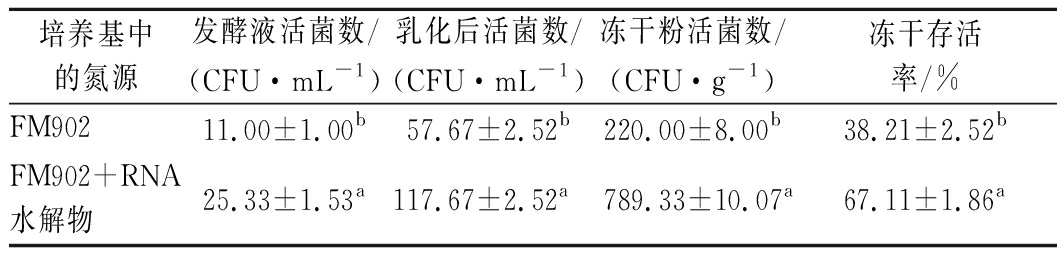
培养基中的氮源发酵液活菌数/(CFU·mL-1)乳化后活菌数/(CFU·mL-1)冻干粉活菌数/(CFU·g-1)冻干存活率/%FM90211.00±1.00b57.67±2.52b220.00±8.00b38.21±2.52bFM902+RNA水解物25.33±1.53a117.67±2.52a789.33±10.07a67.11±1.86a
3 结论
酵母浸出物中的核酸类物质是影响嗜酸乳杆菌的菌体形成的关键营养组分。不同单核苷酸、核苷酸的混合物、RNA水解物均有助于缩短嗜酸乳杆菌菌体长度,其中RNA水解物的效果最显著。核酸类物质通过改变嗜酸乳杆菌的形态,有助于提升嗜酸乳杆菌的冻干存活率。
[1] NGUYEN T T, NGUYEN P T, NGUYEN T T, et al.Efficacy of the incorporation between self-encapsulation and cryoprotectants on improving the freeze-dried survival of probiotic bacteria[J].Journal of Applied Microbiology, 2022, 132(4):3 217-3 225.
[2] LIN B Q, ZHAO F Y, LIU Y, et al.Randomized clinical trial:Probiotics alleviated oral-gut microbiota dysbiosis and thyroid hormone withdrawal-related complications in thyroid cancer patients before radioiodine therapy following thyroidectomy[J].Frontiers in Endocrinology, 2022, 13:834674.
[3] 姜彩霞, 姜秀杰, 李晶, 等.嗜酸乳杆菌增殖培养及冷冻干燥条件的优化[J].黑龙江八一农垦大学学报, 2020, 32(5):36-41.
JIANG C X, JIANG X J, LI J, et al.Optimization of proliferation culture and freeze-drying conditions of Lactobacillus acidophilus[J].Journal of Heilongjiang Bayi Agricultural University, 2020, 32(5):36-41.
[4] TANG H W, ABBASILIASI S, MURUGAN P, et al.Influence of freeze-drying and spray-drying preservation methods on survivability rate of different types of protectants encapsulated Lactobacillus acidophilus FTDC 3081[J].Bioscience, Biotechnology, and Biochemistry, 2020, 84(9):1 913-1 920.
[5] HANSEN M L R W, PETERSEN M A, RISBO J, et al.Implications of modifying membrane fatty acid composition on membrane oxidation, integrity, and storage viability of freeze-dried probiotic, Lactobacillus acidophilus La-5[J].Biotechnology Progress, 2015, 31(3):799-807.
[6] JURKOWSKI A, ZAPOTOCZNY B, KOZIO J J, et al.The effect of Fe3O4 nanoparticles on survival of probiotic bacteria Lactobacillus acidophilus PCM2499 at lower pH[J].Polish Journal of Microbiology, 2015, 64(3):307-310.
J J, et al.The effect of Fe3O4 nanoparticles on survival of probiotic bacteria Lactobacillus acidophilus PCM2499 at lower pH[J].Polish Journal of Microbiology, 2015, 64(3):307-310.
[7] ZHEN N, ZENG X Q, WANG H J, et al.Effects of heat shock treatment on the survival rate of Lactobacillus acidophilus after freeze-drying[J].Food Research International, 2020, 136:109507.
[8] SENZ M, VAN LENGERICH B, BADER J, et al.Control of cell morphology of probiotic Lactobacillus acidophilus for enhanced cell stability during industrial processing[J].International Journal of Food Microbiology, 2015, 192:34-42.
[9] WEGKAMP A, TEUSINK B, DE VOS W M, et al.Development of a minimal growth medium for Lactobacillus plantarum[J].Letters in Applied Microbiology, 2010, 50(1):57-64.
[10] HSIEH S C, LIU J M, PUA X H, et al.Optimization of Lactobacillus acidophilus cultivation using taro waste and evaluation of its biological activity[J].Applied Microbiology and Biotechnology, 2016, 100(6):2 629-2 639.
[11] 黄金珠, 朴金一, 姜成哲.矿物质复合微量元素对嗜酸乳杆菌效能影响的初步研究[J].中国饲料, 2021(5):52-56.
HUANG J Z, PIAO J Y, JIANG C Z.A preliminary study on the effect of mineral complex microelements on the efficacy of Lactobacillus acidophilus[J].China Feed, 2021(5):52-56.
[12] GARBOWSKA M, PLUTA A, BERTHOLD-PLUTA A.Contents of functionally bioactive peptides, free amino acids, and biogenic amines in Dutch-type cheese models produced with different lactobacilli[J].Molecules (Basel, Switzerland), 2020, 25(22):5465.
[13] MENG L, LI S, LIU G F, et al.The nutrient requirements of Lactobacillus acidophilus LA-5 and their application to fermented milk[J].Journal of Dairy Science, 2021, 104(1):138-150.
[14] KILSTRUP M, HAMMER K, RUHDAL JENSEN P, et al.Nucleotide metabolism and its control in lactic acid bacteria[J].FEMS Microbiology Reviews, 2005, 29(3):555-590.
[15] LV X P, LIU G F, SUN X M, et al.Short communication:Nutrient consumption patterns of Lactobacillus acidophilus KLDS 1.0738 in controlled pH batch fermentations[J].Journal of Dairy Science, 2017, 100(7):5 188-5 194.
[16] 苏馨. 嗜酸乳杆菌的体外筛选及优良菌株的高密度发酵研究[D].呼和浩特:内蒙古农业大学, 2021.
SU X.Screening of Lactobacillus acidophilus in vitro and study on high density fermentation of excellent strain[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[17] TORRES A C, ELEAN M, HEBERT E M, et al.Metabolic shift in the production of corrinoid compounds by Lactobacillus coryniformis in the absence of purines[J].Biochimie, 2020, 168:185-189.
[18] HUANG X L, LI L Q, CHEN Y H, et al.Separation and determination of purine bases and pyrimidine bases from nucleic acid hydrolysis by HPLC on BDS column[J].Chinese Journal of Chromatography, 2000, 18(6):500-502.
[19] GROSU-TUDOR S S, BROWN L, HEBERT E M, et al.S-layer production by Lactobacillus acidophilus IBB 801 under environmental stress conditions[J].Applied Microbiology and Biotechnology, 2016, 100(10):4 573-4 583.
[20] 杨玉洁. 乳脂肪球膜蛋白对嗜酸乳杆菌CICC 6074酸胁迫条件下的保护机制[D].南京:南京师范大学, 2021.
YANG Y J.The role of milk fat globule membrane protein in acid-resistance mechanism of Lactobacillus acidophilus CICC 6074[D].Nanjing:Nanjing Normal University, 2021.
[21] CALDERINI E, CELEBIOGLU H U, VILLARROEL J, et al.Comparative proteomics of oxidative stress response of Lactobacillus acidophilus NCFM reveals effects on DNA repair and cysteine de novo synthesis[J].Proteomics, 2017, 17(5).
[22] 袁峥, 赵瑞香, 牛生洋, 等.酸胁迫下嗜酸乳杆菌菌体形态的扫描电镜观察[J].食品工业科技, 2012, 33(24):199-201.
YUAN Z, ZHAO R X, NIU S Y, et al.Observation of the mycelia morphology of Lactobacillus acidophilus with scanning electron microscope under acid stress[J].Science and Technology of Food Industry, 2012, 33(24):199-201.