植物乳杆菌是一种杆状的兼性厌氧乳杆菌,能够抑制病原菌的生长,从而调节消化道菌群平衡。一旦肠道菌群失调,肠道的代谢和免疫环境将会受到影响,从而导致炎症的发展[1]。植物乳杆菌作为其治疗策略之一,可通过定植抗力和生态占位来排斥病原菌,从而调节肠道微生物菌群平衡[2-3]。在胃肠道消化过程中,胃的低pH、高胆盐等环境,降低了植物乳杆菌的存活率并影响它在宿主体内的定植,致使植物乳杆菌在人体内的活菌数达不到其发挥作用的数量要求,促使益生效果降低[4]。益生菌微胶囊技术是保护益生菌活细胞免受不利环境因素的影响并将其传递到肠道的有效方法。目前用于微囊化的制备技术主要有挤压法、乳化法、喷雾干燥法等传统方法。其中挤压法常用于益生菌的封装[5-6],但制备的微胶囊粒径相对较大(2~5 mm),微胶囊化过程较缓慢,不利于规模化生产。乳化法细胞存活率高,但制备的微胶囊形状不规则,微球均一性较差[7-8]。喷雾干燥是常用的微囊化工艺之一,操作成本低廉,生产能力高[9],但喷雾干燥中菌体与热空气接触,对益生菌的活力有所影响甚至使其失活。
液滴微流控技术主要研究微尺度范围内液滴的生成、操控及应用等。它是在微流控芯片上将分散相以微小体积(10-5~10-9 L)单元的形式分散于连续相中,形成的液滴在通道内运动[10]。在制备液滴的过程中,微流控技术可以对液滴的大小,数量和性质进行精确地控制,还可以通过调节微胶囊粒径、形态结构和组分来提高生物活性物质的包埋率和控释,为微囊化研究提供了一个新平台。该技术已用于生物、医疗、制药、环境等领域[11]。将细菌封装后进行单个细胞的单克隆扩增,再结合细菌微囊化使荧光活化细胞分选(fluorescent activated cell sorting system, FACS)可实现高通量筛选[12]。TEREKHOV等[13]将液滴微流控与FACS相结合,实现了超高通量筛选和细菌相互作用的检测。QUINTANA等[14]利用微流控设备成功将植物乳杆菌CIDCA83114封装在豆渣油和丙烯酸组成的W/O乳液中,并通过控制两相流速从而有规律地产生稳定且大小均一的液滴。
虽然液滴微流控技术为微胶囊的制备带来了方法上的变革,但单个微流体装置的生产率较低。开发能够并行操作多个微流体液滴生成器(microfluidic droplet generator, MFDG)的阵列芯片,使高通量制备微胶囊成为可能。在单层微流体芯片中,流体入口和出口的数量随着液滴发生器的数量增加而增加,限制了集成到单个芯片上的液滴发生器数量。通过加入第二层微流体通道,可以为每个MFDG供应流相,且整个并行结构共用一个进口和出口[15],能够增加液滴生成器的数量。另外,改变两相分布层和液滴生成器结构也有助于增加液滴生成器的数量,目前两相分布层大致分为梯度分布和树状分布,MFDG集成阵列也有平行阵列和圆形阵列2种[16-17]。HAN等[17]设计了一种8通道并行化芯片,探索了圆形阵列和平行阵列2种并行化模式生成液滴的情况,研究发现圆形阵列更能实现单分散液滴的制备,但此研究仅限于流体梯度分布,基于树状分布还有待探索。目前利用微流控芯片高通量制备液滴的研究大多基于单分散性液滴的形成,而几乎没有研究将其应用于益生菌微胶囊的高通量制备。
彭湉[18]利用流聚焦液滴微流控芯片制备植物乳杆菌微胶囊,通过正交试验确定了单个微流控单元的最佳几何参数。本文基于上述芯片的最佳几何参数,设计并加工了集成多个MFDG的微流控芯片,以液滴直径大小、变异系数及液滴生成频率为评价指标,研究了梯度分布和树状分布2种流体分布层结构,以及平行阵列和圆形阵列2种液滴生成器模式对液滴生成的影响;选择树状分布的圆形阵列芯片研究MFDG个数对液滴生成的影响;综合考虑流体分布结构、阵列模式和MFDG个数,实现对植物乳杆菌微胶囊的高通量制备。
1 材料与方法
1.1 材料与实验设备
1.1.1 材料与试剂
材料:植物乳杆菌,杜邦中国集团有限公司上海分公司;海藻酸钠、低脂果胶、卵磷脂、无水CaCl2、柠檬酸钠(分析纯),国药集团化学试剂有限公司;胃蛋白酶(酶活力1∶10 000)、胰蛋白酶(酶活力1∶250),生工生物工程(上海)股份有限公司。
试剂:MRS液体培养基,MRS固体培养基,模拟胃液,模拟肠液。
1.1.2 实验设备
MCO18AC CO2培养箱,日本松下医疗器械有限公司;HRLM-80高压灭菌锅,青岛海尔特种电器有限公司;ST16r低温离心机,北京赛默飞;CFI60光学显微镜,日本尼康;VLS2.30 CO2激光雕刻机,美国环球公司;TBK-508真空贴合机,深圳市旺达科技有限公司。
1.2 液滴微流控芯片的制备
液滴微流控芯片采用PMMA材料加工,利用Auto CAD分层绘制芯片的几何图形,将绘制好的各层芯片结构图案传输至激光雕刻机进行切割,得到各层结构基片。超声波清洗20 min后,利用真空贴合机对芯片进行键合。最后选取合适规格的针头、聚四氟乙烯管对芯片出口、入口进行插针、接管等操作,用UV紫外固化胶进行粘连密封。为了更好地形成W/O液滴,使用聚二甲基硅氧烷(polydimethylsiloxane, PDMS)注射涂覆的方法对亲水性PMMA通道进行疏水性改性。
1.3 高通量芯片流体分布层结构
高通量芯片流体层分为梯度分布和树状分布2种结构。图1-a所示,梯度分布由连续相通道、分散相通道、一个公共出口通道以及在水平方向上排布的多个MFDG组成。两相流体分别从盖板层的2个入口进入两相分布层,通过垂直通孔流入集成了多个MFDG的液滴生成层后生成单分散液滴,最后液滴流入收集通道,实现液滴集中收集。梯度分布芯片主要由盖板层、两相分布层、垂直通孔层、液滴生成器集成层、液滴收集层以及底板层共6层组成。芯片的整体尺寸为35 mm×50 mm,各MFDG的几何尺寸参数为:孔口宽度100 μm、通道高度300 μm、进油口宽度350 μm、进水口200 μm、出口宽度600 μm。

a-梯度分布;b-树状分布
图1 梯度分布芯片结构示意图
Fig.1 Schematic diagram of the gradient distribution chip structure
树状分布结构芯片主要由连续相树状分布层、分散相树状分布层与每个树状分支末端匹配的MFDG组成(图1-b)。连续相和分散相分别从入口引入后,两相流体均以树状分布展开,并通过直至通孔分流流入每个MFDG内,并剪切生成单分散液滴流向液滴收集层,导出液滴。基于分叉对称原理,树状分布结构将两相流体均匀地分配到液滴生成微通道中,具有最小的能量消耗和停留时间[19]。树状分布结构主要由8个基本层组成:盖板层、连续相分布层、垂直通孔层1、分散相分布层、垂直通孔层2、MFDG集成层、液滴收集层以及底板层。芯片的整体尺寸为40 mm×40 mm,各MFDG的几何尺寸参数与梯度分布芯片的MFDG设置一致。图2为2种分布芯片实物图。

a-梯度分布;b-树状分布
图2 微流控芯片实物图
Fig.2 Physical map of microfluidic chip
1.4 高通量芯片液滴生成器结构
高通量芯片液滴生成器分为平行阵列和圆形阵列2种结构,图3为平行阵列和圆形阵列芯片实物图。平行阵列是指液滴生成器集成层中各MFDG的排列方式为平行模式,多个MFDG(8、16、32)在水平方向上依次排开。平行阵列8、16、32-MFDG各芯片的尺寸分别为40 mm×40 mm,40 mm×70 mm,50 mm×80 mm,各MFDG的几何尺寸参数与梯度分布芯片的MFDG设置一致。圆形阵列是指液滴生成器集成层中各MFDG的排列方式为圆形模式,多个MFDG(8、16、32)以圆心为中心阵列排开。两相流体通过各自的进样口输入后均匀分配至芯片的MFDG堆栈中心放置,旨在保持从液体源到各MFDG相同的通道长度。两相流体都从圆形芯片的中心按树状分布流到边缘,然后再从上到下流动,实现集中式分配。在液滴生成层中各MFDG的出口均指向圆心,达到集中式收集的效果。圆形阵列8、16、32-MFDG芯片半径分别为23.5、23.5、35 mm,各MFDG的几何尺寸参数与梯度分布芯片的MFDG设置一致。

a-平行阵列-8MFDG;b-平行阵列-16MFDG;c-平行阵列-32MFDG;d-圆形阵列-8MFDG;e-圆形阵列-16MFDG;f-圆形阵列-32MFDG
图3 两种阵列芯片实物图
Fig.3 Physical map of two array chips
1.5 流体分布层结构对液滴生成的影响
按照梯度分布和树状分布结构设计,分别制作集成8个MFDG的微流控芯片,用于制备单分散液滴。其中,连续相为硅油,分散相为菌-壁材混合液(海藻酸钠-低酯果胶-卵磷脂复合壁材溶液),连续相流速为500 μL/min,分散相流速为50 μL/min,开启注射泵。随着时间的推移,两相流体稳定持续地注入到每个MFDG中并两相剪切形成W/O液滴,通过光学显微镜观察液滴生成过程,分析流体分布层结构对液滴生成的影响。设置分散相的流速分别为10、20、30、40、50 μL/min,两相流速比恒定为15,相应的连续相的流速为150、300、450、600、750 μL/min,在5组流速条件下制备微液滴,测定梯度和树状2种流体分布结构下液滴尺寸大小及变异系数,并分析液体流速对液滴生成的影响。
1.6 液滴生成器集成层形式对液滴生成的影响
在树状分布的基础上,分别用集成了8、16、32个MFDG的平行阵列芯片和圆形阵列芯片制备微液滴,连续相流速为500 μL/min,分散相流速为50 μL/min,在平行阵列、圆形阵列2种芯片结构和不同MFDG个数下,测定液滴尺寸大小及变异系数。
1.7 不同流速比对高通量微胶囊化的影响
将16个MFDG集成在基于树状分布的圆形阵列芯片中,用于植物乳杆菌微胶囊的高通量制备。保持分散相流速为50 μL/min不变,通过改变连续相流速,从而改变两相流速比值(10、12、15、20),制备不同粒径大小的微胶囊,对粒径大小、粒径分布以及生成频率进行统计分析。
1.8 微胶囊的性能测定
1.8.1 粒径大小及分布
随机抽取制备的植物乳杆菌微胶囊若干,置于显微镜下拍照获取放大40倍的微胶囊照片,每组样本选取3个视野,设置3次平行实验。拍摄的照片用Image-Pro Plus处理软件对微胶囊粒径进行测量统计。另外其粒径分布可以通过粒径大小的变异系数(coefficient of variation,CV)来衡量。变异系数定义为样品的标准偏差与平均直径之间的比率,当分布足够窄(CV≤5%),该样品被认为是单分散性的。
1.8.2 微胶囊包埋率
初始菌落数N0:菌种活化梯度稀释后在MRS平板上点样法(20 μL)进行初始菌落计数(CFU/mL)。计算方法如下:每毫升菌液中菌落形成单位(CFU)=同一稀释梯度3组平行实验的平均菌落数×稀释倍数×5;微胶囊包埋菌落数N:取制备所得的微胶囊,加入柠檬酸钠解囊液,放置在恒温摇床中37 ℃,180 r/min振荡使其完全崩解后,梯度稀释平板点样法进行菌落计数(CFU/mL)。包埋率按公式(1)计算:
包埋率![]()
(1)
1.8.3 液滴生成频率
通过视频记录液滴的生成过程,统计一定时间段内液滴生成的数量,并按公式(2)将液滴数量转换为液滴生成频率。
(2)
式中:f,液滴生成频率,Hz;N,液滴数量,个;t,时间,min。
2 结果与讨论
2.1 梯度分布和树状分布制备微液滴
在连续相流速为500 μL/min,分散相流速为50 μL/min的固定流速下,液滴在8个并行通道中产生,每个单一通道的液滴呈单分散性,但8个通道液滴大小及生成频率略有不同,这可能是共用一条公共入口通道和各平行液滴发生器之间的“串扰”引起的。虽然2种流体分布的芯片均存在这种现象,但由于梯度分布结构的不对称性,流体到达各MFDG时的流阻不一致,流体分布不均,从而导致各通道产液滴的频率差异较大;树状分布的芯片从入口到各MFDG的通道长度相同,能实现流体的对称均匀分布,各通道产生液滴的频率差异较小。这2种芯片分布的差异使得液滴生成的状态有所不同,实验结果表明,树状对称结构分布的微通道更倾向于单分散液滴的形成,满足植物乳杆菌微胶囊单分散性的要求。
在两相流速比恒定为15,同时改变两相流速的条件下,分别用2种分布结构阵列芯片制备微液滴,结果如表1所示。2种芯片制备的液滴尺寸随两相流体绝对流量的增加而减小,当两相流速分别从分散相Qd=10 μL/min,连续相Qc=150 μL/min增大至Qd=50 μL/min,Qc=750 μL/min时,梯度结构芯片制备的液滴平均直径由440.39 μm减小至325.14 μm,树状结构芯片制备的液滴平均直径由428.2 μm减小至300.85 μm。在两相流体低流速下(Qd=10 μL/min,Qc=150 μL/min),树状微流体芯片制备的液滴CV值为2.41%,明显低于梯度微流体芯片制备的微液滴的CV值(4.37%);而在较高流速下,树状结构芯片制备的液滴CV也有所增加,最高达到4.74%,与梯度分布之间的CV值差异减小。树状结构将流体均匀分配到每个MFDG,但受到相邻通道的压力影响以及产生液滴向喷射状态的过渡现象,从而导致液滴尺寸分布变广。实验表明均匀的液体加载在MFDG的平行化中起着重要的作用,非对称分布结构中流体的压力梯度、改变流动的气泡、两相回流以及通道阻塞等问题都将影响单分散液滴的生成。
表1 两种微流体装置制备的微胶囊的平均尺寸及其分布
Table 1 Average size and distribution of microcapsules prepared by two microfluidic devices
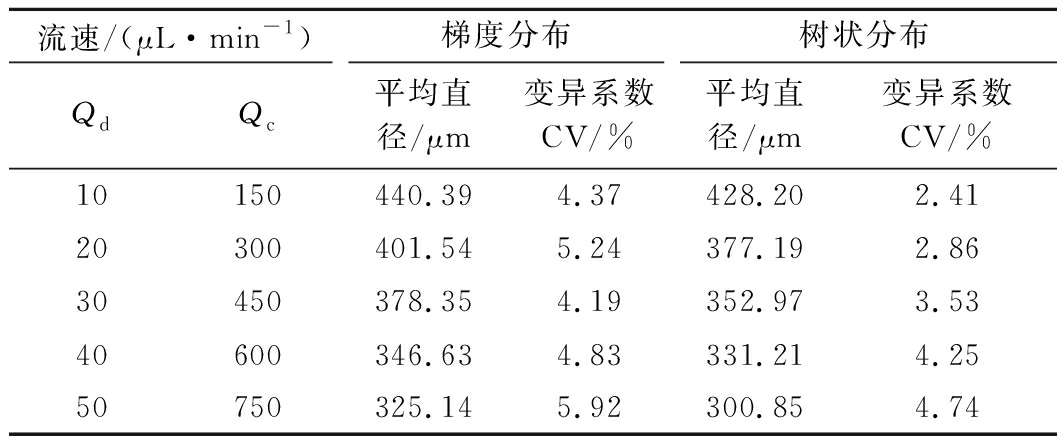
流速/(μL·min-1)梯度分布树状分布QdQc平均直径/μm变异系数CV/%平均直径/μm变异系数CV/%10150440.394.37428.202.4120300401.545.24377.192.8630450378.354.19352.973.5340600346.634.83331.214.2550750325.145.92300.854.74
注:Qd代表分散相流速;Qc代表连续相流速
2.2 平行阵列和圆形阵列制备微液滴
在树状分布的基础上,制作集成8、16、32-个MFDG的平行阵列和圆形阵列芯片,在相同面积条件下,圆形阵列对板材的利用率是平行阵列的200%,可见圆形阵列在空间结构上更高效。在连续相流速为500 μL/min,分散相流速为50 μL/min的条件下,分别用8、16、32-MFDG的平行阵列芯片和圆形阵列芯片制备微液滴,通入芯片的两相流体均借助树状分布层实现了流体的均匀分布,2种芯片均能稳定、快速、均匀地产生液滴。
由于流动分布性能的不同,在平行阵列和圆形阵列中产生的液滴的平均尺寸有所不同,图4为MFDG个数对平行阵列和圆形阵列芯片液滴的平均粒径及其变异系数的影响。当MFDG个数相同时,圆形阵列制备的液滴直径大小和尺寸分布,小于平行阵列制备的液滴,其中MFDG个数为8时,2种阵列芯片制备的液滴差异最小,平行阵列芯片制备的液滴平均直径为345.1 μm,变异系数为3.36%,圆形阵列芯片制备的液滴平均直径为343.3 μm,变异系数为3.29%。此外,从图4中还可以看出,随着MFDG个数的增加,流体分布的误差增大,导致2种阵列制备的液滴的平均直径和变异系数均呈上升趋势。相比之下,圆形阵列制备的液滴直径大小和变异系数更小,其中集成16个MFDG的圆形阵列芯片制备的液滴的变异系数CV=3.98%(<5%),呈现单分散性。该结论与HAN等[17]的研究结论相似。由此可见,流体分布不平衡是液滴多分散性的主要影响因素,圆形阵列相对平行阵列来说更能促进均匀的流体输送,适用于单分散液滴的高通量制备。
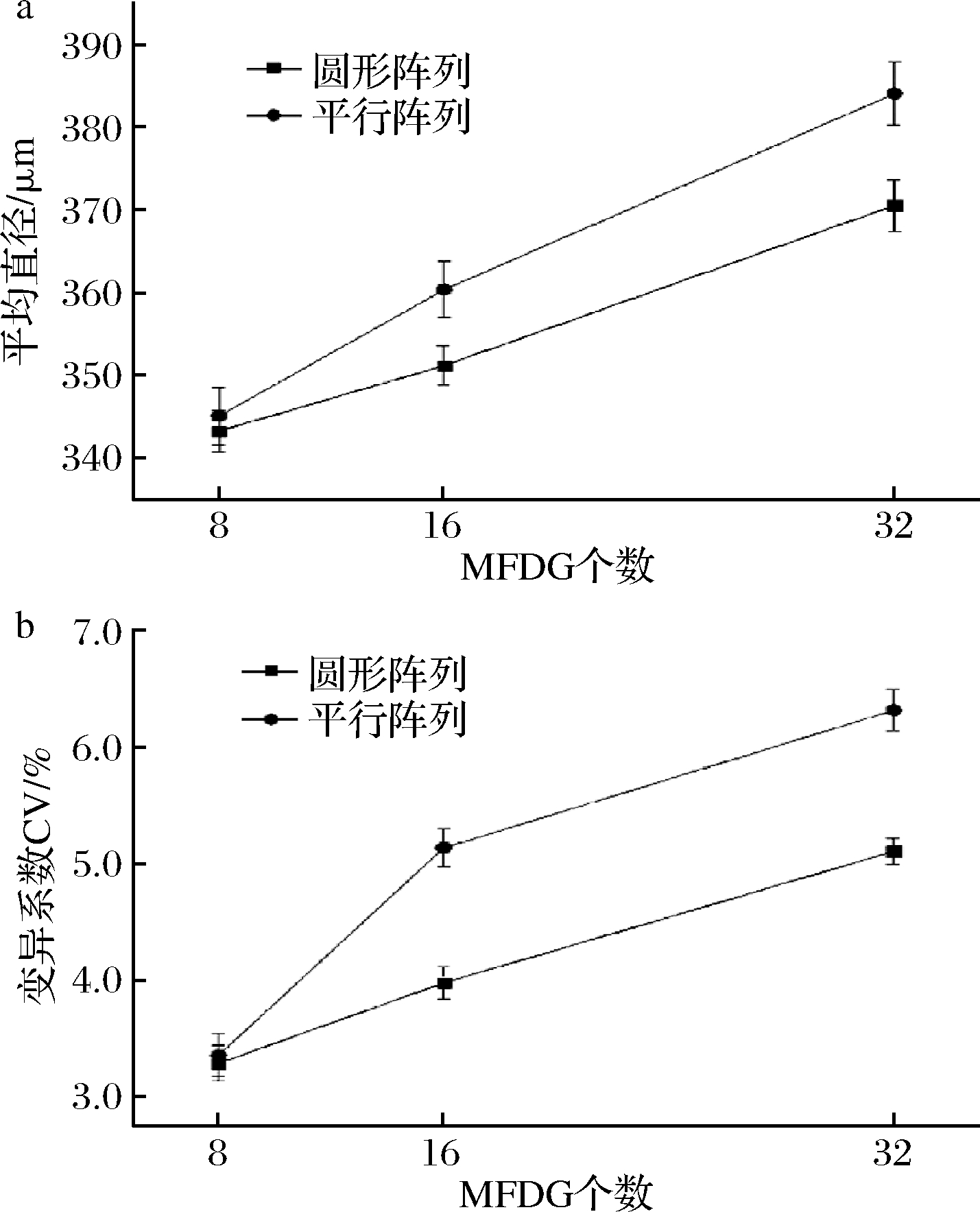
a-平均直径的变化;b-变异系数的变化
图4 MFDG个数对平行阵列和圆形阵列芯片液滴生成的影响
Fig.4 Effect of the number of MFDGs on droplet generation in parallel and circular array chips
2.3 不同流速比对高通量制备微胶囊的影响
将16个MFDG集成在基于树状分布的圆形阵列芯片中,在不同流速比下制备植物乳杆菌微胶囊,其粒径大小、粒径分布、生成频率及包埋率结果如表2所示。随着流速比的增加,植物乳杆菌微胶囊粒径呈减小趋势,从371.7 μm减小至298.7 μm,而粒径分布逐渐变宽,变异系数CV最大为4.95%。此外,植物乳杆菌微胶囊生成频率随流速比的增加而增加,当流速比为20时,其生成频率最高达到30.5 Hz。最后将所制备的植物乳杆菌微胶囊离心收集洗净后置于浓度为0.06 mol/L的无菌柠檬酸钠解囊液中进行菌体释放,活菌计数后得到其包埋率为93.7%~96.4%,在各流速比条件下差异不大。保持分散相流速为50 μL/min不变,通过改变连续相流速,从而改变两相流速比(10、12、15、20)来制备不同粒径大小的微胶囊。当分散相流速保持不变时,液滴尺寸随着连续相流速的增加而减小。
表2 不同流速比制备植物乳杆菌微胶囊的结果
Table 2 The results of preparing Lactobacillus plantarum microcapsules with different flow rate ratios
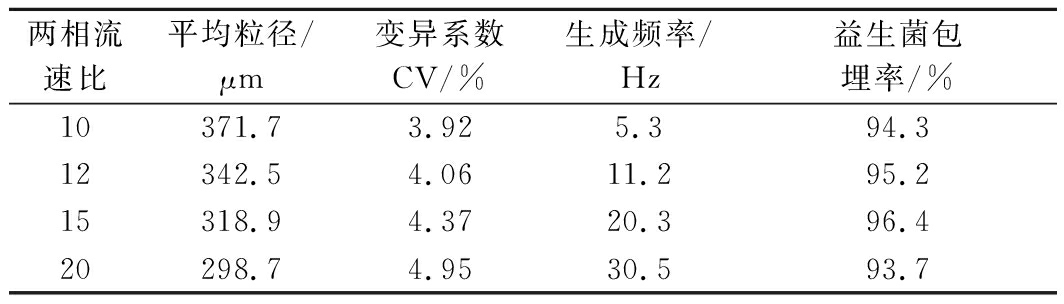
两相流速比平均粒径/μm变异系数CV/%生成频率/Hz益生菌包埋率/%10371.73.925.394.312342.54.0611.295.215318.94.3720.396.420298.74.9530.593.7
通过光学显微镜观察发现,随着流速比的增加,植物乳杆菌微胶囊粒径呈减小趋势,生成频率不断增大,而液滴的稳定性逐渐下降,由于流速比为10和12时,生成液滴的频率较慢,流速比为20时,生成液滴的稳定性不佳,液滴生成后期出现流体挂壁、拖尾、喷射等现象,液滴生成失控。综合考虑,选取流速比为15为最佳流速比。高通量阵列芯片制备所得微胶囊粒径分布均匀,形状较为规则(图5)。

图5 高通量微流控阵列芯片制备的微胶囊
Fig.5 Microcapsules fabricated by high-throughput microfluidic array chips
3 结论
本文通过液滴微流控芯片制备植物乳杆菌微胶囊,设计一种集成多个MFDG的微阵列芯片,用于植物乳杆菌微胶囊的高通量制备。得出以下结论:
(1)制作梯度分布和树状分布2种流体分布结构的微流控芯片用于制备单分散液滴。在两相流体低流速下,树状微流体芯片制备的液滴单分散性(CV=2.41%)明显优于梯度微流体芯片制备的微液滴(CV=4.37%);在较高流速下,树状分布与梯度分布之间的CV值差异减小,受到相邻通道的压力影响以及产生液滴向喷射状态的过渡现象,微液滴的尺寸分布变广;
(2)选取较佳的树状流体分布结构,用集成了8、16、32-MFDG的平行阵列芯片和圆形阵列芯片制备微液滴。当MFDG个数为8时,2种阵列制备的液滴差异不大,当MFDG个数增加时,圆形阵列比平行阵列制备的液滴直径更小以及更窄的尺寸分布;
(3)将16个MFDG集成在基于树状分布的圆形阵列芯片中,用于植物乳杆菌微胶囊的高通量制备。当流速比为15时,液滴生成频率为20.3 Hz,包埋率为96.4%。
本文对液滴微流控芯片的流体分布层及液滴生成器的结构进行了优化,用于植物乳杆菌微胶囊的制备。结果表明树状分布的圆形微流控阵列芯片实现了对植物乳杆菌的高效率封装,包埋效果良好。该研究为高通量制备植物乳杆菌微胶囊提供了思路,目前仅在二维方向上进行了液滴生成器的并行化设计,距实现真正工业化还有很大的上升空间,可设计三维阵列芯片,探寻更高通量的益生菌微胶囊制备方法。
[1] AGGELETOPOULOU I, KONSTANTAKIS C, ASSIMAKOPOULOS S F, et al.The role of the gut microbiota in the treatment of inflammatory bowel diseases[J].Microbial Pathogenesis, 2019, 137:103774.
[2] LE B, YANG S H.Efficacy of Lactobacillus plantarum in prevention of inflammatory bowel disease[J].Toxicology Reports, 2018, 5(3):314-317.
[3] IGBAFE J, KILONZO-NTHENGE A, NAHASHON S N, et al.Probiotics and antimicrobial effect of Lactiplantibacillus plantarum, Saccharomyces cerevisiae, and Bifidobacterium longum against common foodborne pathogens in poultry[J].Agriculture, 2020, 10(9):368.
[4] DE ANGELIS M, GOBBETTI M.Environmental stress responses in Lactobacillus:A review[J].Proteomics, 2004, 4(1):106-122.
[5] LI W, LIU L M, TIAN H F, et al.Encapsulation of Lactobacillus plantarum in cellulose based microgel with controlled release behavior and increased long-term storage stability[J].Carbohydrate Polymers, 2019, 223:115065.
[6] VAZIRI A S, ALEMZADEH I, VOSSOUGHI M, et al.Co-microencapsulation of Lactobacillus plantarum and DHA fatty acid in alginate-pectin-gelatin biocomposites[J].Carbohydrate Polymers, 2018, 199:266-275.
[7] SONG H Y, YU W T, GAO M, et al.Microencapsulated probiotics using emulsification technique coupled with internal or external gelation process[J].Carbohydrate Polymers, 2013, 96(1):181-189.
[8] HEIDEBACH T, FÖRST P, KULOZIK U.Microencapsulation of probiotic cells for food applications[J].Critical Reviews in Food Science and Nutrition, 2012, 52(4):291-311.
[9] 田文静, 孙玉清, 刘小飞.益生菌微胶囊技术及其在食品中的应用研究进展[J].食品工业科技, 2019, 40(16):354-362.
TIAN W J, SUN Y Q, LIU X F.Research progress on microcapsulation technology and its application in food[J].Science and Technology of Food Industry, 2019, 40(16):354-362.
[10] 林炳承. 微纳流控芯片实验室[M].北京:科学出版社, 2013.
LIN B C.Micro-Nanofluidic Chip Lab[M].Beijing:Science Press, 2013.
[11] 邓传富, 汪伟, 谢锐, 等.液滴微流控的集成化放大方法研究进展[J].化工学报, 2021, 72(12):5 965-5 974.
DENG C F, WANG W, XIE R, et al.Recent progress in scale-up integration of microfluidic droplet generators[J].CIESC Journal, 2021, 72(12):5 965-5 974.
[12] DUARTE J M, BARBIER I, SCHAERLI Y.Bacterial microcolonies in gel beads for high-throughput screening of libraries in synthetic biology[J].ACS Synthetic Biology, 2017, 6(11):1 988-1 995.
[13] TEREKHOV S S, SMIRNOV I V, STEPANOVA A V, et al.Microfluidic droplet platform for ultrahigh-throughput single-cell screening of biodiversity[J].Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(10):2 550-2 555.
[14] QUINTANA G, GERBINO E, ALVES P, et al.Microencapsulation of Lactobacillus plantarum in W/O emulsions of okara oil and block-copolymers of poly(acrylic acid) and pluronic using microfluidic devices[J].Food Research International, 2021, 140:110053.
[15] RODRIGUES F J, CEDRAN M F, BICAS J L, et al.Encapsulated probiotic cells:Relevant techniques, natural sources as encapsulating materials and food applications-A narrative review[J].Food Research International, 2020, 137(11):109682.
[16] CONCHOUSO D, CASTRO D, KHAN S A, et al.Three-dimensional parallelization of microfluidic droplet generators for a litre per hour volume production of single emulsions[J].Lab on a Chip, 2014, 14(16):3 011-3 020.
[17] HAN T T, ZHANG L, XU H, et al.Factory-on-chip:Modularised microfluidic reactors for continuous mass production of functional materials[J].Chemical Engineering Journal, 2017, 326(10):765-773.
[18] 彭湉. 微流控法制备植物乳杆菌微胶囊的实验研究[D].上海:上海理工大学, 2021.
PENG T.Experimental study on preparation of microcapsules of Lactobacillus plantarum by microfluidic method[D].Shanghai:University of Shanghai for Science & Technology, 2021.
[19] TETRADIS-MERIS G, ROSSETTI D, PULIDO DE TORRES C, et al.Novel parallel integration of microfluidic device network for emulsion formation[J].Industrial & Engineering Chemistry Research, 2009, 48(19):8 881-8 889.