乳液凝胶,是一种同时具有乳液结构和凝胶网络结构的软固体材料,具有独特的三维网状结构,可以将乳化油滴固定在凝胶网络结构中[1-2]。许多食品体系如豆腐、肉制品、奶酪和酸奶等都可以归类于乳液凝胶,乳液凝胶在食品加工中得到了广泛的应用。蛋白质是人类必需的营养物质,同时还具有多种功能特性,如凝胶性和乳化性,因此在乳液及凝胶体系中被广泛研究。随着消费者对健康、可持续生产越来越重视,植物蛋白在近年来成为研究的热点。并且,目前许多研究都强调了饮食中增加豆类的积极影响[3-5]。
为了获得具有更好性能的凝胶产品,采用微生物来源的谷氨酰胺转氨酶(transglutaminase,TGase)交联是一种有效且绿色的蛋白质凝胶改善方法[6-7]。TGase可以催化蛋白质中谷氨酰胺残基的γ-羧酰胺基和赖氨酸残基的ε-氨基之间的酰基转移反应,从而导致分子间或分子内交联[8]。TGase诱导的蛋白凝胶性质受大豆品种、蛋白质组成、盐浓度和热处理的影响[9-11]。其中大豆蛋白质的热变性是重要影响因素,热处理可以改变蛋白质的结构,改变其功能特性,通过预热获得的蛋白质聚集体具有更高的持水能力[12]。WANG等[13]发现较大的大豆分离蛋白(soybean protein isolate,SPI)聚集体对凝胶性能有积极作用,凝胶弹性模量显著增加。大豆蛋白的聚集状态可能是影响蛋白凝胶系统性能的重要因素。然而,在商品化SPI生产过程中,不可避免地会发生一定程度的热变性和聚集[14]。因此,对于实际加工和应用来说,了解大豆蛋白聚集体对TGase交联乳液凝胶性能的影响是必要的。然而,TGase诱导大豆蛋白交联的研究主要集中在天然蛋白上,热诱导的大豆蛋白聚集体对TGase交联乳液凝胶的影响尚未见报道。
为了解不同SPI聚集体的乳化性质以及对后续TGase交联凝胶行为的影响,本文考察了不同热变性程度的SPI对TGase交联形成的蛋白乳液凝胶性质的影响。此外,从不同蛋白含量及油含量的角度,探讨其与TGase交联的乳液凝胶的各种性质之间的关系。
1 材料与方法
1.1 材料
台湾292大豆,黑龙江庆美种业有限公司;TGase(酶活力90 U/g),购于江苏泰兴市东圣生物科技有限公司;大豆油,上海益海嘉里金龙鱼粮油食品股份有限公司;无水乙醇、正己烷、盐酸、NaOH(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器
9FZ-15B粉碎机,台州余国电器有限公司;DELTA320 pH计,梅特勒-托利多仪器(上海)有限公司;GL-10MD冷冻离心机,湖南湘仪仪器公司;TA-XT Plus质构仪,英国Stable Micro System公司;ZPH-300相称显微镜,上海宙山精密光学仪器有限公司;HAAKE MARSⅢ流变仪,德国Thermo Scientific公司;Ultra-Turrax T18 basic高速均质器,德国IKA公司;LUMiSizer651全功能稳定性分析仪,德国LUM公司。
1.3 实验方法
1.3.1 不同热处理的SPI聚集体的制备
大豆经过去皮、粉碎、脱脂处理后,将脱酯豆粉与水按照料液比1∶10 (g∶mL)混合,随后用2 mol/L的NaOH溶液调节pH至8.0,在室温条件下搅拌1.5 h。将分散体系进行离心(6 500 r/min,25 min,4 ℃)以分离出上清液。通过滴加2 mol/L的盐酸调节pH至4.5,在室温条件下搅拌1 h后通过离心(3 500 r/min,15 min,4 ℃)分离出沉淀。将沉淀与水以料液比1∶6 (g∶mL)进行复溶并调节pH至7.0,冷冻干燥,得到天然SPI(蛋白得率64.9%,蛋白含量85.5%,水分3.5%,脂肪0.3%,灰分4.6%),将样品研磨成粉末并真空包装,置于-80 ℃冰箱存放。
将天然SPI溶液(蛋白质量分数为6.1%)在不同温度下(65、85、95 ℃)水浴加热10 min,收集不同热变性程度的蛋白质聚集体及未加热的天然蛋白进行冷冻干燥,将其分别命名为65 ℃-SPI、85 ℃-SPI、95 ℃-SPI、Native-SPI。
1.3.2 蛋白乳液的制备
1.3.2.1 不同热处理SPI制备的乳液
将15% (质量分数)不同温度热处理的SPI样品充分溶解,SPI溶液与大豆油以质量比4∶1混合,并使用高速均质器在13 500 r/min下均质5 min,从而得到蛋白质量分数为12%的蛋白乳液。
1.3.2.2 不同蛋白浓度制备的乳液
将95 ℃-SPI样品按照10%、12.5%、15% (质量分数)分别进行充分溶解,将SPI溶液与大豆油以质量比4∶1混合,并使用高速均质器在13 500 r/min下均质5 min,从而得到蛋白质量分数分别为8%、10%、12%的蛋白乳液。
1.3.2.3 不同油浓度制备的SPI乳液
将95 ℃-SPI样品按照12.6%、13.3%、14.1%、15% (质量分数)进行充分溶解,将SPI溶液与大豆油以19∶1、9∶1、17∶3、4∶1(质量比)的比例混合,并使用高速均质器在13 500 r/min下均质5 min,从而得到油质量分数分别为5%、10%、15%、20%的蛋白乳液,不同油浓度乳液的蛋白质量分数为12%。
1.3.3 蛋白乳液凝胶的制备
将配制好的乳液,在4 ℃下保藏30 min,添加1%(质量分数,按照蛋白干基质量计)的TGase,搅拌均匀,在50 ℃下培养1 h,随后在75 ℃下加热15 min以达到灭酶的目的,灭酶结束后立即冰浴冷却,4 ℃冷藏过夜后脱模,以用于后续分析表征。
1.3.4 乳化性(emulsifying activity index,EAI)和乳化稳定性(end system identifier,ESI)的测定
将不同热处理的大豆蛋白溶液(10 g/L)与大豆油以4∶1的体积比混合,然后使用高速均质机在10 000 r/min下均质2 min。取出20 μL乳液加入到5 mL质量分数0.1%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液中振荡均匀,随后立即用紫外分光光度计测定其在500 nm处的吸光度A0。将上述制备的乳液在室温下保持30 min后,如上述方法,在500 nm处测定吸光度A30,取SDS溶液作为空白对照。EAI和ESI按公式(1)、(2)计算:
(1)
(2)
式中:T,浊度,为2.303;N,稀释倍数,为250;c,蛋白浓度;θ,油的体积分数。
1.3.5 乳液稳定性的测定
通过稳定性分析仪表征不同温度热变性SPI制备蛋白乳液的稳定性,参照CAI等[15]的方法,并稍作修改,离心转速设定为4 000 r/min,轮廓线560张,截图时间间隔为15 s,光因子设定为1.0,测试温度25 ℃,测试光源470 nm,测试总时长140 min。通过仪器自带软件对澄清指数进行计算。
1.3.6 乳液凝胶质构性能的测定
利用质构仪测定乳液凝胶的质构特性,样品的直径为29 mm,高度为30 mm。所用探头为P/50,测前速度2 mm/s,测定速度1 mm/s,测后速度5 mm/s,触发力为10 g,测定距离设定为凝胶50%应变,测得凝胶的硬度、弹性、咀嚼性等。
1.3.7 蛋白凝胶微观结构的表征
取蛋白凝胶中间位置切片,将凝胶片放在载玻片上用光学显微镜放大100倍观察并拍照。
1.3.8 乳液黏度的测定
利用流变仪测定乳液的表观黏度,在25 ℃下,剪切速率设置为0.01~100 s-1,间隙为1 mm,35 mm锥板进行旋转剪切,对乳液的表观黏度进行表征。
1.3.9 蛋白乳液凝胶持水性的测定
参照周士琪[16]的方法稍作修改,将新鲜制备的5 g乳液凝胶样品4 ℃放置24 h,取出恢复至室温,称质量(m1)后放入干燥的离心管中,4 ℃、7 000 r/min离心20 min,将乳液凝胶取出,吸取表面水分后再次称质量(m2),持水性按公式(3)计算:
持水性![]()
(3)
1.3.10 蛋白乳液凝胶持油性的测定
参照周士琪[16]的方法并稍作修改,新鲜制备的5 g乳液凝胶样品4 ℃放置24 h,将乳液凝胶称质量(m1)后放入预先称质量的离心管(m2)中,再于70 ℃水浴30 min,4 ℃、7 000 r/min离心20 min。离心完成后将乳液凝胶取出,随后将离心管于65 ℃下烘干至恒重,对烘干后的离心管进行称质量(m3),离心管增加质量即为油脂损失,持油性按公式(4)计算:
持油性![]()
(4)
1.3.11 数据分析
所有实验均重复3次,结果表示为平均值±标准偏差。采用Origin 2022软件进行作图。采用SPSS 19.0分析其显著性差异以及相关性(P<0.05)。
2 结果与分析
2.1 热处理温度对SPI乳化性能的影响
2.1.1 EAI及ESI性能
如图1所示,经过热变性后有效地改善了SPI的乳化性能。相较于Native-SPI,经过热处理后SPI的EAI和ESI显著增加。这是由于热处理诱导蛋白质的去折叠,并使得蛋白质内部的疏水基团暴露,在之前的研究中发现,随着热处理温度的增加,SPI的疏水性显著增加[17-18]。从而改变了蛋白分子表面的亲水/亲油性,增强其在油/水界面上的吸附能力和乳液的黏度,导致其乳化活性和乳化稳定性的增强。GUO等[19]发现热处理也会导致芸豆蛋白疏水性的增加,其稳定乳液的ESI和EAI显著增加。

a-ESI;b-EAI
图1 经不同加热处理SPI的ESI和EAI
Fig.1 ESI and EAI of SPI subjected to different heat treatment
注:小写字母不同表示样品间差异显著(P<0.05)(下同)
2.1.2 乳液稳定性
如图2所示,在测量之前,乳液被均匀化,几乎没有光线通过样品。离心后,在离心力的作用下,乳液体系不稳定会导致蛋白质沉淀于样品池底部,导致透光率的降低,同时会导致部分水相的析出,使得样品池中部区域透光率增加,而较轻且不太透明的油相会上升到顶部,形成奶油层。随着对SPI热处理温度的增加,离心结束后,最终的样品轮廓线较初始状态呈现越来越小的趋势。Native-SPI制备的乳液其稳定性轮廓图变化最为明显,随着离心的进行,样品池中的透光率逐渐增大,在测定结束后,样品池中部的透光率均已接近20%,说明乳液中有水相析出,此时乳液的澄清指数约为0.164。随着热处理温度的增加,乳液的澄清指数也显著降低。当热处理温度增加到85 ℃时,乳液在离心测定结束后,其稳定性轮廓图几乎与初始轮廓图保持一致,尤其是SPI热处理温度为95 ℃时制备的乳液,在经过140 min的离心测试后,轮廓线未发生任何变化,其澄清指数降低到0.001。此结果与图1所示的结果一致,热处理显著提高了SPI稳定乳液的EAI和ESI,由此其稳定性也相应地增加。

a-Native-SPI轮廓图;b-60 ℃-SPI轮廓图;c-85 ℃-SPI轮廓图;d-95 ℃-SPI轮廓图;e-澄清指数
图2 热处理温度对SPI乳液稳定性的影响
Fig.2 Effect of heat treatment temperature on the stability of SPI emulsion
2.2 不同温度热处理SPI对蛋白乳液凝胶性质的影响
如图3-a所示,65 ℃及85 ℃热处理的SPI乳液凝胶显示出与Native乳液凝胶相近的凝胶性能,三者的硬度无显著差异(P>0.05),这与SPI的热变性程度密切相关,SPI主要由大豆球蛋白(11S)和β-伴球蛋白(7S)组成。郭凤仙等[20]研究发现7S组分的变性温度为74.2 ℃,而11S组分的变性温度则为90 ℃,在65 ℃处理条件下,此时仅有7S组分发生部分变性,因此凝胶性与Native样品相近。先前的研究表明,随着大豆蛋白热处理温度的增加,形成的热聚集体粒径也相应增加,但当大豆蛋白接近完全变性后,平均粒径反而由于高温热处理导致大粒径聚集体热解聚,从而使得粒径呈现降低的趋势[21-23]。因此,当温度升高到85 ℃时,凝胶性没有显著增加的原因可能是由于在以TGase诱导SPI交联形成凝胶时,随着温度的升高,蛋白分子发生疏水性聚集,从而导致TGase反应位点减少。然而,当热处理温度升高至95 ℃时,7S、11S组分均完全变性,高温将导致SPI分子发生热解聚,蛋白分子重排和聚集,从而使得更多的TGase反应位点被暴露,凝胶强度显著增强,其制备的乳液凝胶硬度是Native乳液凝胶的2.2倍。如图3-b所示,尽管不同样品间硬度存在很大差异,但凝胶的持水性和持油性均没有显著差异(P>0.05),都表现出良好的稳定性。
通过图3-c和图3-d可以看出,随着SPI热处理温度的升高,乳液凝胶的气孔也相应增加,且气孔尺寸也呈现增大的状态,这种现象是由于乳液黏度的增加所导致的。由不同热处理温度的SPI稳定的乳液的表观黏度如图3-e所示。所有的SPI乳液均呈现剪切变稀的特性,表现出典型的假塑性流体特征。65 ℃热处理的蛋白乳液表现出与Native蛋白乳液相近的黏度,而随着热处理温度进一步增加,乳液的黏度也逐渐增加。前期的研究中发现,随着热变性温度的升高,SPI的疏水性也显著增加[17-18]。因此黏度显著增加的原因可能是由于蛋白分子间具有更高的聚集度和疏水性,从而增加乳液体系中SPI分子之间的相互作用,进而导致乳液呈现更高的表观黏度。蛋白的表观黏度随着疏水性的增加而增加的趋势也与ZHENG等[24]的研究结果一致。
由于95 ℃-SPI制备的乳液凝胶具有最高的凝胶性,因此后续以其为对象进一步研究蛋白浓度、油浓度对TGase交联的乳液凝胶的影响。
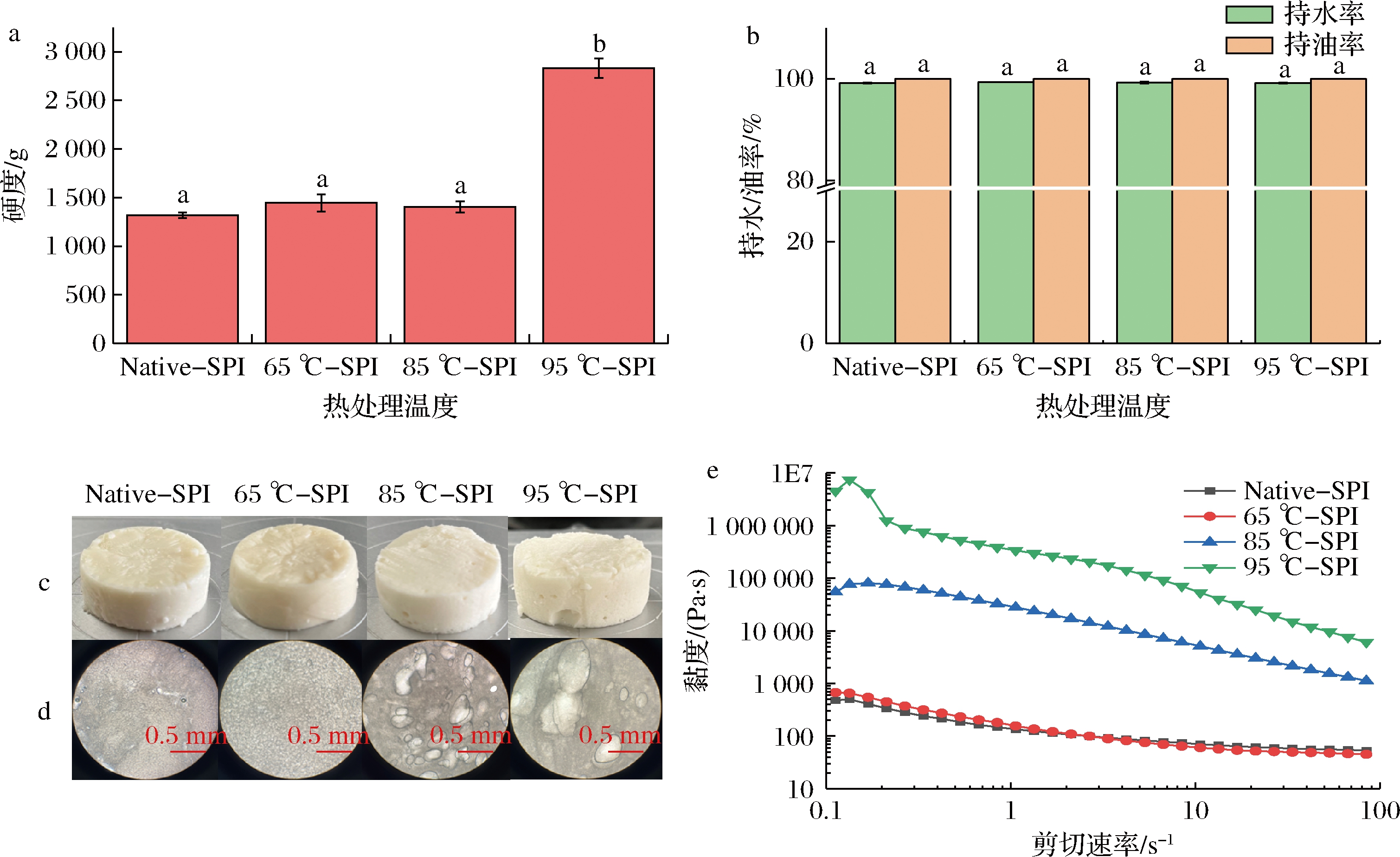
a-凝胶硬度;b-持水/油性;c-宏观凝胶形态;d-微观凝胶形态;e-表观黏度
图3 热处理温度对SPI乳液凝胶硬度、持水/油性、宏观、微观凝胶形态及表观黏度的影响
Fig.3 Effect of heat treatment temperature on gel hardness, water/oil holding capacity, macrograph, micrographof SPI emulsion gel, and apparent viscosity of SPI emulsion
2.3 不同蛋白浓度对SPI乳液凝胶性质的影响
图4-a为蛋白浓度对SPI乳液凝胶硬度的影响,蛋白浓度对蛋白质凝胶性能至关重要,凝胶网络的形成是蛋白分子间作用、分子和溶剂相互作用以及邻近肽链之间的相互吸引和相互排斥平衡后的结果[25]。当蛋白浓度为8%时,乳液凝胶的硬度仅为861.4 g。这是由于当蛋白浓度较低时,SPI分子-溶剂之间作用处于优势地位,致使蛋白乳液形成的凝胶网络弱。随着SPI浓度的增加,乳液凝胶的硬度呈现显著增加的趋势(P<0.05)。当蛋白浓度升高至12%时,此时的凝胶硬度是蛋白浓度为8%样品的3.3倍,此时蛋白分子间的相互作用占据优势地位,蛋白与蛋白分子之间的相互作用也显著增强,凝胶强度也相应的增加。通过图4-b和图4-c可以观察到,蛋白浓度从8%增加到12%,均能制备出硬挺、均匀的乳液凝胶。但随着浓度的增大,凝胶形成的气孔也由小变大。从图4-d可以看出在不同蛋白浓度下(8%~12%),SPI乳液凝胶均具有优异的持水性和持油性,说明凝胶具有紧密的网络结构。

a-凝胶硬度;b-宏观形态;c-微观形态;d-持水/油性
图4 SPI浓度对蛋白乳液凝胶硬度、宏观形态、微观形态和持水/油性的影响
Fig.4 Effect of SPI concentration on the gel hardness, macrograph, micrograph, and water/oil holding capacity of SPI emulsion gel
2.4 不同油浓度对SPI乳液凝胶性质的影响
图5-a探究了不同油浓度对乳液凝胶硬度的影响,随着油浓度从5%增加到20%,乳液凝胶的硬度显著增大(P<0.05)。这是由于随着油浓度的增加,蛋白在乳液水相的浓度也相应增加,因此,SPI蛋白分子分布更紧密,蛋白质分子间的相互作用增强,从而导致SPI乳液凝胶的凝胶性能改善。通过图5-b和图5-c可以观察到,油浓度从5%增加到20%所制备的SPI乳液凝胶均具有优异的形态,形状规整,不软塌。但随着油浓度的增加,凝胶形成的气孔也由少变多,由小变大。从图5-d可以看出,在不同油浓度下(5%~20%),SPI乳液凝胶均具有优异的持水性和持油性,说明95 ℃-SPI稳定的乳液凝胶具有优异的凝胶网络,可束缚住乳液凝胶体系中的水相和油相。

a-凝胶强度;b-宏观形态;c-微观形态;d-持水/油性
图5 油浓度对蛋白凝胶强度、宏观形态、微观形态和持水/油性的影响
Fig.5 Effect of oil concentration on the gel hardness, macrograph, micrograph, and water/oil holding capacity of SPI emulsion gel
3 结论
SPI经热处理后,其EAI、ESI和乳液离心稳定性均有显著改善。不同热处理温度的SPI样品经TGase诱导形成凝胶后,凝胶强度在95 ℃时得到显著改善,其凝胶硬度是天然蛋白乳液凝胶的2.2倍。表明大豆蛋白分子经过一定程度的热处理,逐渐形成聚集体,对TGase诱导乳液凝胶形成有促进作用。且随着温度的增加,乳液黏度相应增加,凝胶气孔也相应增大。对于95 ℃热处理蛋白的凝胶,随着蛋白浓度的增大,凝胶强度增大;随着油浓度的增加,凝胶强度显著增加。所有样品均具有优异的持水性和持油性。总之,SPI经过一定程度的热处理(95 ℃)有利于TGase诱导形成蛋白凝胶,这为工业生产蛋白基乳液凝胶制品提供了一定的理论依据。
[1] FARJAMI T, MADADLOU A.An overview on preparation of emulsion-filled gels and emulsion particulate gels[J].Trends in Food Science & Technology, 2019, 86:85-94.
[2] LIN D Q, KELLY A L, MIAO S.Preparation, structure-property relationships and applications of different emulsion gels:Bulk emulsion gels, emulsion gel particles, and fluid emulsion gels[J].Trends in Food Science & Technology, 2020, 102:123-137.
[3] LANG M.Consumer acceptance of blending plant-based ingredients into traditional meat-based foods:Evidence from the meat-mushroom blend[J].Food Quality and Preference, 2020, 79:103758.
[4] LEMKEN D, SPILLER A, SCHULZE-EHLERS B.More room for legume - Consumer acceptance of meat substitution with classic, processed and meat-resembling legume products[J].Appetite, 2019, 143:104412.
[5] WEN C T, LIU G Y, REN J Y, et al.Current progress in the extraction, functional properties, interaction with polyphenols, and application of legume protein[J].Journal of Agricultural and Food Chemistry, 2022, 70(4):992-1 002.
[6] AMIRDIVANI S, KHORSHIDIAN N, FIDELIS M, et al.Effects of transglutaminase on health properties of food products[J].Current Opinion in Food Science, 2018, 22:74-80.
[7] MOSTAFA H S.Microbial transglutaminase:An overview of recent applications in food and packaging[J].Biocatalysis and Biotransformation, 2020, 38(3):161-177.
[8] ROMEIH E, WALKER G.Recent advances on microbial transglutaminase and dairy application[J].Trends in Food Science & Technology, 2017, 62:133-140.
[9] HUANG Z R, SUN J, ZHAO L Z, et al.Analysis of the gel properties, microstructural characteristics, and intermolecular forces of soybean protein isolate gel induced by transglutaminase[J].Food Science & Nutrition, 2022, 10(3):772-783.
[10] WANG X F, LUO K Y, LIU S T, et al.Textural and rheological properties of soy protein isolate tofu-type emulsion gels:Influence of soybean variety and coagulant type[J].Food Biophysics, 2018, 13(3):324-332.
[11] FANG H C, LI J Y, HUO T Y, et al.Novel double cross-linked gels of soybean protein isolates and soluble dietary fiber from soybean coats with their functionalities[J].Food Hydrocolloids, 2021, 113:106474.
[12] LEE C H, RHA C.Microstructure of soybean protein aggregates and its relation to the physical and textural properties of the curd[J].Journal of Food Science, 1978, 43(1):79-84.
[13] WANG X F, HE Z Y, ZENG M M, et al.Effects of the size and content of protein aggregates on the rheological and structural properties of soy protein isolate emulsion gels induced by CaSO4[J].Food Chemistry, 2017, 221:130-138.
[14] TANG C H.Emulsifying properties of soy proteins:A critical review with emphasis on the role of conformational flexibility[J].Critical Reviews in Food Science and Nutrition, 2017, 57(12):2 636-2 679.
[15] CAI Z X, WEI Y, GUO Y L, et al.Influence of the degree of esterification of soluble soybean polysaccharide on the stability of acidified milk drinks[J].Food Hydrocolloids, 2020, 108:106052.
[16] 周士琪. 海带多糖复乳凝胶脂肪替代物的制备及其在低脂鸡肉肠中的应用[D].上海:华东理工大学, 2020.
ZHOU S Q.Preparation and physicochemical properties of double emulsion gels and its application in chicken sausages[D].Shanghai:East China University of Science and Technology, 2020.
[17] 赵海波. 硫酸钙诱导热变性大豆蛋白凝胶的影响因素及应用研究[D].无锡:江南大学, 2017.
ZHAO H B.Factors affecting the formation of thermo-denatured soybean protein gel induced by calcium sulfate and its application[D].Wuxi:Jiangnan University, 2017.
[18] 郭凤仙. 热处理对大豆分离蛋白结构及功能特性的影响[D].无锡:江南大学, 2009.
GUO F X.Influence of heat treatment on structural and functional properties of soy isolate protein[D].Wuxi:Jiangnan University, 2009.
[19] GUO Z W, HUANG Z X, GUO Y N, et al.Effects of high-pressure homogenization on structural and emulsifying properties of thermally soluble aggregated kidney bean (Phaseolus vulgaris L.) proteins[J].Food Hydrocolloids, 2021, 119:106835.
[20] 郭凤仙, 熊幼翎, 何志勇, 等.热处理对大豆分离蛋白功能特性的影响[J].食品与机械, 2009, 25(6):9-11;21.
GUO F X, XIONG Y L, HE Z Y, et al.Effect of heat treatment on functional properties of soybean protein isolate[J].Food & Machinery, 2009, 25(6):9-11;21.
[21] 陈力扬, 华欲飞, 孔祥珍, 等.预热变性程度对大豆蛋白凝胶性质的影响[J].中国油脂, 2019, 44(11):56-62.
CHEN L Y, HUA Y F, KONG X Z, et al.Effect of pre-heating denaturation degree on gel properties of soy protein[J].China Oils and Fats, 2019, 44(11):56-62.
[22] 王冬梅, 范志军, 安然, 等.大豆蛋白热聚集体的溶液行为表征[J].现代食品, 2020(7):182-184.
WANG D M, FAN Z J, AN R, et al.Characterization of solution behavior of soybean protein thermal aggregates[J].Modern Food, 2020(7):182-184.
[23] 安然. 大豆分离蛋白可溶性热聚集行为及其超声调控研究[D].哈尔滨:东北农业大学, 2019.
AN R.Study on soluble thermal aggregates of soybean protein isolate and its ultrasonic regulation[D].Harbin:Northeast Agricultural University, 2019.
[24] ZHENG H G, YANG X Q, TANG C H, et al.Preparation of soluble soybean protein aggregates (SSPA) from insoluble soybean protein concentrates (SPC) and its functional properties[J].Food Research International, 2008, 41(2):154-164.
[25] 杨岚. 热处理强度对大豆蛋白凝胶性质的影响及机制初探[D].无锡:江南大学, 2018.
YANG L.Effect of heat treatment intensity on the gel properties of soybean protein and study on its mechanism[D].Wuxi:Jiangnan University, 2018.