黄刺,学名直穗小檗(Berberi dasystachya M.),是青藏高原特色的药食同源浆果[1]。青海省是小檗属植物的重要分布区,该植物资源量十分丰富[2]。黄刺果实具有多种活性成分,如植物甾醇、有机酸、多糖和多酚等[3]。迄今为止,市面上已有黄刺加工成的果汁、果粉及保健食品等[4]。多年以来,国内外对于小檗属的研究大多集中在小檗碱上[5],而目前研究发现黄刺多糖也是一种重要的活性物质,具有良好的体外抗氧化活性[6]、降血糖活性[7]及调节肠道微生物等作用[3]。然而目前对于黄刺仅局限于粗多糖的提取和生物活性的初步研究,因此后续可从分子水平进一步阐述多糖抗氧化、降血糖活性及其机制。
糖尿病是一种复杂的代谢紊乱疾病,严重危害人们身体健康[8]。多种天然植物多糖被证实具有降血糖的功效[9],对于多糖降血糖分子机制的研究主要是从抑制胰岛细胞凋亡、降低胰岛素抵抗[10]、提高抗氧化应激能力、调节相关信号通路、调节肠道菌群[11-12]等方面发挥作用。氧化应激是指体内过多的活性氧与抗氧化物质同时存在的一种不平衡的状态[13]。机体在氧化应激状态下,体内抗氧化酶类活性逐渐降低,体内生成过多的活性氧(reactive oxygen species,ROS)会导致胰岛β细胞的凋亡[14]。H2O2作为一种化学诱导剂,是研究细胞氧化损伤的重要工具[15]。杨艳等[16]利用250 μmol/L H2O2诱导RIN-m5F细胞18 h建立氧化应激模型,MAHESHWARI等[17]通过H2O2体外诱导睾丸精细胞凋亡模型研究其作用途径。
目前植物多糖提取方法较为成熟,其中超声波辅助酶解法由于提取效率较高而常被采用,本实验采用纤维素酶辅助超声波法对黄刺果实多糖的提取工艺进行优化,确立提取多糖的最佳工艺条件,以H2O2诱导RIN-m5F细胞建立氧化损伤模型,并使用不同浓度的黄刺粗多糖(Berberi dasystachya polysaccharides,BDPs)干预模型细胞,通过CCK-8法检测细胞存活率、ROS水平测定、抗氧化酶活及丙二醛(malondialdehyde,MDA)含量探究BDPs对H2O2诱导胰岛β细胞氧化损伤的保护作用,对研究黄刺多糖活性具有重要意义,也为黄刺多糖的抗氧化功能作用提供更加充分的依据。
1 材料与仪器
1.1 材料与试剂
黄刺浆果,2021年8月采集于青海省大通县;RIN-m5F细胞(大鼠胰岛β细胞瘤细胞),赛百慷生物技术股份有限公司;胰蛋白酶细胞消化液、D-PBS、细胞增殖与毒性检测(CCK-8),上海生工生物工程股份有限公司;RPMI—1640培养基,上海逍鹏生物科技有限公司;胎牛血清(fetal bovine serum,FBS),浙江天杭生物科技股份有限公司;活性氧检测试剂盒、丙二醛检测试剂盒、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD),南京建成生物工程研究所;二甲基亚砜(dimethyl sulfoxide,DMSO),北京索莱宝科技有限公司;纤维素酶(酶活力>400 U/mg),南京都莱生物技术有限公司;α-硫辛酸(α-lipoic acid,α-LA),上海麦克林生化科技股份有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
FA2104电子天平,上海良平仪器仪表有限公司;KB-300E台式机械超声波清洗器,东莞市科桥超声波设备有限公司;GS55-9冷冻干燥机,基因有限公司;Optilab T-rEX示差检测器,美国怀雅特技术公司;Thermo ICS5000离子色谱系统,美国赛默飞世尔科技公司;UV-1780紫外分光光度计,岛津有限公司;SU8220冷场发射扫描电子显微镜,日本日立公司;Cytation 5 MV荧光酶标仪,美国伯腾仪器有限公司;BSC-1304IIA2生物安全柜,苏州安泰空气技术有限公司;HWS-12电热恒温水浴锅,上海一恒科学仪器有限公司;HF90二氧化碳培养箱,上海力申科学仪器有限公司;AE31E倒置生物显微镜,麦克奥迪实业集团有限公司;MLS-3751L-PC高压蒸汽灭菌器,日本松下健康医疗器械株式会社;H1850医用离心机,长沙湘仪离心机仪器有限公司;M200PRO酶标仪,帝肯(上海)贸易有限公司。
2 实验方法
2.1 多糖提取工艺优化
2.1.1 黄刺果实多糖提取工艺流程
原料—烘干粉碎—石油醚除脂—脱色脱单糖—纤维素酶浸提—超声波浸提—浓缩—醇沉—冷冻干燥
取黄刺鲜果于50 ℃的烘箱中彻底干燥后,粉碎过40目筛。将粉碎后的原料加入石油醚(料液比1∶5,g∶mL),水浴加热40 ℃脱脂2 h,经抽滤后烘干,在85%乙醇中50 ℃条件下水浴2 h,过滤后干燥备用。经过脱脂脱色的黄刺粉末按料液比15∶1(mL/g)加入蒸馏水,加入一定量纤维素酶,在45 ℃,pH=4.0条件下水浴酶解60 min,酶解结束于90 ℃灭酶10 min,140 W超声波浸提60 min。收集浸提液,待冷却后离心(4 500 r/min,10 min),上清液用Sevage试剂[V(氯仿)∶V(正丁醇)=4∶1]除蛋白,离心后减压浓缩至原体积的1/4。浓缩的多糖溶液装入截留量为5 000 Da透析袋进行透析48 h,加入浓缩液4倍体积无水乙醇静置48 h,醇沉后冷冻干燥,得到BDPs,得率按公式(1)计算:
多糖得率![]()
(1)
2.1.2 黄刺果实多糖提取单因素试验
2.1.2.1 加酶量
参考陈程等[18]的方法,固定酶解时间为60 min、酶解温度45 ℃、超声波功率140 W,考察不同加酶量0.50%、0.75%、1.00%、1.25%、1.50%(以黄刺原料质量分数计)对黄刺多糖提取率的影响。
2.1.2.2 酶解时间
固定加酶量1%、提取温度45 ℃、超声波功率140 W,考察不同酶解时间(20、40、60、80、100 min)对黄刺多糖提取率的影响。
2.1.2.3 酶解温度
固定加酶量1%、酶解时间60 min、超声波功率140 W,考察不同酶解温度(35、40、45、50、55 ℃)对黄刺多糖提取率的影响。
2.1.2.4 超声波功率
固定加酶量1%、酶解时间60 min、提取温度45 ℃,考察不同超声波功率(100、120、140、160、180 W)对黄刺多糖提取率的影响。
2.1.3 响应面试验设计
根据单因素试验结果,综合考虑得率、误差等因素,选择加酶量、酶解时间、酶解温度和超声波功率为影响因素,以黄刺多糖得率为衡量指标进行响应面设计。响应面优化试验因素及水平编码见表1。
表1 黄刺果实多糖提取工艺响应面优化试验因素及水平编码
Table 1 Factors and levels of response surface method for BDP extraction optimization
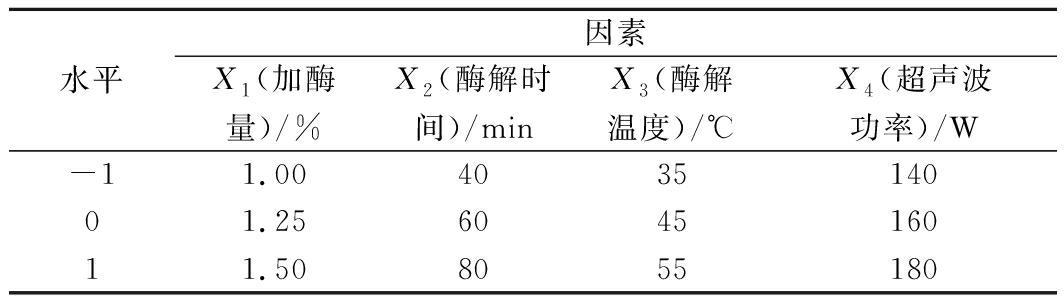
水平因素X1(加酶量)/%X2(酶解时间)/minX3(酶解温度)/℃X4(超声波功率)/W-11.00403514001.25604516011.508055180
2.2 黄刺多糖理化性质分析
2.2.1 多糖含量
多糖含量测定采用苯酚-硫酸法[19],根据回归方程y=9.703 3x+0.136 6计算。
2.2.2 分子质量测定
采用高效体积排阻色谱(high performance size exclusion chromatography,HPSEC)测定BDPs的分子质量[20]。
样品及标准品溶液配制:精密称取样品和标准品,样品用0.5%(质量分数,下同)LiBr-DMSO溶液配制终质量浓度为1 mg/mL,并通过0.45 μm的过滤器过滤,样品转置于进样小瓶中。
色谱条件:凝胶色谱-示差-多角度激光光散射系统;色谱柱为凝胶排阻色谱柱Ohpak SB-805 HQ(300 mm×8 mm),Ohpak SB-804 HQ(300 mm×8 mm),Ohpak SB-803 HQ(300 mm×8 mm);流动相为0.5% LiBr-DMSO溶液;流速0.3 mL/min,柱温45 ℃;进样量100 μL;示差检测器Optilab T-rEX。
2.2.3 单糖组成
根据文献[21]的方法,精确称量多糖样品5 mg于色谱瓶中,加入1 mL三氟乙酸(2 mol/L)溶液,121 ℃加热2 h使其充分水解。冷却后通N2吹干,加入甲醇清洗再吹干,重复2~3次。加入无菌水溶解,转入色谱瓶中待测。采用Thermo ICS5000离子色谱系统分析样品的单糖组成。测定条件如下:DionexTM CarboPacTM PA20液相色谱柱(150 mm×3.0 mm,10 μm);进样量5 μL;流动相A为0.1 mol/L NaOH,流动相B为0.1 mol/L NaOH,0.2 mol/L NaAc;流速0.5 mL/min;柱温30 ℃;洗脱方式为等梯度洗脱。
2.2.4 刚果红实验
取0.5 mL BDPs溶液(2.5 mg/mL),与1.5 mL刚果红溶液(2.0 mmol/L)混合,加入1 mol/L NaOH溶液混合至NaOH浓度为0~0.5 mol/L,室温放置30 min,采用紫外分光光度计在400~600 nm范围内扫描[22]。
2.2.5 微观结构观察
取大小厚度合适的BDPs样品于样品台,镀金处理后,通过扫描电镜观察分析[22]。
2.3 细胞实验
2.3.1 RIN-m5F细胞培养
RIN-m5F细胞复苏后培养于PRMI-1640完全培养基(含10%FBS,1%青霉素-链霉素混合液),置于37 ℃,5%CO2恒温培养箱中培养,隔日换液。待细胞密度达80%~90%,用0.25%胰蛋白酶消化后进行传代培养、冻存及后续实验[23]。
2.3.2 RIN-m5F细胞活力测定
采用CCK-8法进行细胞存活率检测,以1×105cells/mL的密度将细胞接种于96孔板,每孔100 μL,培养24 h后至细胞贴壁。弃去培养液,每孔加入100 μL CCK-8溶液[V(CCK-8试剂)∶V(无血清培养)=1∶10],每组设6个复孔,置于恒温培养箱孵育0.5 h后在450 nm处测定吸光值[24]。细胞存活率按照公式(2)计算:
细胞存活率![]()
(2)
式中:A1,实验组的吸光值;A2,空白组的吸光值;A3,正常对照组的吸光值。
2.3.3 ROS水平测定
2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针法进行ROS水平检测[25],以1×105cells/ mL的密度接种至96孔板中,每孔100 μL,37 ℃、5%CO2条件下培养24 h,取各处理组细胞,吸弃培养基,PBS冲洗2次后,参照试剂盒说明书,加入100 μL含有DCFH-DA(10 μmol/L)的无血清培养液,避光37 ℃孵育1 h,使用全波长多功能酶标仪上机检测,其中激发波长488 nm,发射波长525 nm。
2.3.4 BDPs对H2O2诱导的RIN-m5F细胞氧化损伤的保护作用
2.3.4.1 BDPs浓度选择
以1×105cells/mL的密度将细胞接种于96孔板,每孔100 μL,培养24 h后至细胞贴壁。加入不同质量浓度BDPs(0.0625、0.125、0.25、0.50、1、2 mg/mL)分别培养24、48、72 h,CCK-8法进行细胞存活率检测确定BDPs的最佳浓度范围。
2.3.4.2 细胞分组及处理
正常对照组(NC):含10%(体积分数)FBS的RPMI-1640培养基;阳性对照组(PC):300 μmol/L α-LA;模型组(MC):250 μmol/L H2O2;BDPs组:BDPs低剂量组(0.062 5 mg/mL),BDPs中剂量组(0.125 mg/mL),BDPs高剂量组(0.25 mg/mL)。
按照细胞分组,经前期实验选择250 μmol/L H2O2诱导3 h后,加入不同浓度BDPs(0.062 5、0.125、0.25 mg/mL)进行干预,同时空白组和模型组加入新的完全培养基同条件培养,每组6个复孔,培养24 h后进行后续实验。
2.3.5 细胞形态学观察
通过倒置显微镜观察细胞数量及生长状态。将生长于对数期的细胞按照密度为1×105cells/孔接种于六孔板,待细胞贴壁后用于实验。按照2.3.4.2实验分组处理细胞,镜下观察并留取图像。
2.3.6 SOD、CAT的活性及MDA含量的检测
参考文献[26]的方法,细胞分组及处理方式同2.3.4.2,处理结束后,收集细胞,用PBS洗涤后离心,加入提取液匀浆后电动研磨破碎细胞,每次10 s,间隔10 s,共8次。参照SOD、CAT、MDA试剂盒说明书进行操作。
2.4 数据分析
实验数据均表示为平均值±标准偏差。利用SPSS 20.0软件统计数据,进行单因素方差分析,利用Origin Pro 2019软件作图。P<0.05表示差异显著,P<0.01表示差异极显著。
3 结果与分析
3.1 单因素实验
由图1-a可知,黄刺果实多糖得率随着加酶量增加先升高后降低,加酶量1.25%时黄刺多糖提取得率最高。当加酶量超过1.25%后,多糖得率开始降低。这可能是由于随着酶量的增加,促使了黄刺果实细胞壁的破裂,使多糖易于溶出;当加酶量过多时,造成黄刺果实被过量纤维素酶包裹,阻止多糖的溶出,从而降低多糖提取率[27]。因此,最佳用酶量确定为1.25%。
由图1-b可知,随着提取时间延长提取率迅速上升,当酶解时间60 min时,黄刺多糖的提取率达到最高,提取时间超过60 min后,可能是时间过度延长使多糖结构会受到破坏,使得多糖提取率下降[28]。因此,最佳酶解时间确定为60 min。
由图1-c可知,在酶解温度为35~45 ℃时,多糖提取率逐渐升高,但45 ℃之后提取率开始下降,酶解温度为45 ℃时,多糖提取率最高。这可能是随着酶解温度的提高反应物能量增加,纤维素酶的活性增强加速多糖的溶出;但是当温度超过45 ℃后纤维素酶活性降低,酶促反应受到明显抑制而影响多糖的溶出[29]。因此,最佳酶解温度确定为45 ℃。

a-加酶量:b-酶解时间;c-酶解温度;d-超声波功率
图1 提取条件对黄刺多糖提取率的影响
Fig.1 Effect of extraction conditions on the yield of Berberis dasystachya polysaccharides
由图1-d可知,黄刺多糖提取率随着超声波功率的增加呈先上升后下降的趋势,当超声波功率为160 W时,多糖提取率最高。这可能是当超声波功率较低时产生的机械作用较弱,对多糖提取效果不明显;而随着超声波功率的增大,超声波的空化作用增强,破坏细胞壁结构,促进了多糖的溶出;当超声波功率过大时,溶出的多糖糖苷键被打破,致使多糖结构破坏,从而影响多糖提取率[30]。因此,最佳超声波功率确定为160 W。
3.2 响应面分析及黄刺果实多糖提取工艺的优化
以加酶量、酶解时间、酶解温度、超声波功率4个因素为自变量,多糖的提取得率为响应值,进行响应面试验设计,结果见表2。对黄刺果实多糖得率结果进行回归拟合,并用二阶多项式方程如公式(3)表示:
Y=3.43-0.015X1-0.11X2+0.003 3X3+0.092X4-0.045X1X2+0.028X1X3+0.083X1X4+0.025X2X3+0.045X2X4-0.007 ![]()
(3)
由回归方程的方差分析及显著性分析(表3)可知,回归模型P<0.000 1,说明黄刺多糖得率得回归模型极显著,能够比较好地反映考察的因素与响应值之间的关系;同时该模型R2为0.999 0,调整R2为0.997 9,表明该模型误差较小,与实际结果有较高的拟合度。由F值可知各因素对黄刺多糖得率的影响大小为:酶解时间(X2)>超声波功率(X4)>加酶量(X1)>酶解温度(X3),且模型中X1X2、X1X3、X1X4和X2X4的交互作用均为极显著(P<0.01),X3X4交互作用不显著。
经预测分析得到黄刺果实多糖提取的最佳提取条件:加酶量1.25%、酶解时间56.95 min、酶解温度44.96 ℃、超声波功率163.82 W,在此条件下,黄刺果实多糖的最大得率预测值为3.451%。结合实际操作将最佳工艺调整为:加酶量1.25%、酶解时间57 min、酶解温度45 ℃、超声波功率164 W。根据上述试验条件进行3次水平实验,所得平均提取得率为(3.478±0.075)%,与理论值的相对误差为0.782%,说明回归模型可以真实地反映各因素对黄刺多糖提取得率的影响。前期研究超声波辅助水提的多糖得率为1.3%[3],而本研究中多糖得率为(3.478±0.075)%,多糖提取效率显著提高,经苯酚-硫酸法测得多糖含量为(75.26±0.70)%。因此超声波辅助酶解法可作为黄刺多糖提取的有效方法。
表2 响应面试验设计及结果
Table 2 Experimental design and corresponding results for respond surface analysis
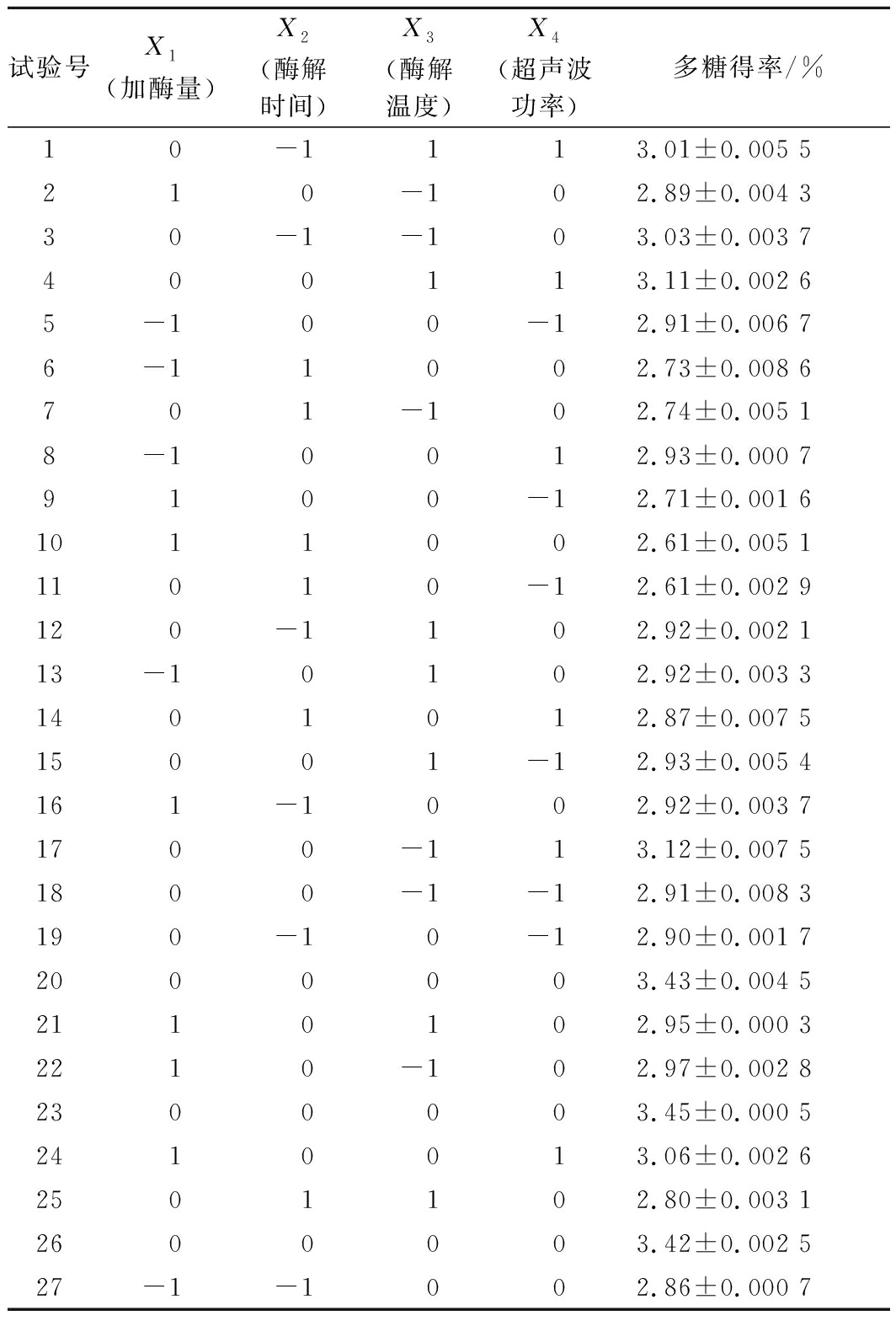
试验号X1(加酶量)X2(酶解时间)X3(酶解温度)X4(超声波功率)多糖得率/%1 0-1 1 13.01±0.005 5210-102.89±0.004 330-1-103.03±0.003 7400113.11±0.002 65-100-12.91±0.006 76-11002.73±0.008 6701-102.74±0.005 18-10012.93±0.000 79100-12.71±0.001 61011002.61±0.005 111010-12.61±0.002 9120-1102.92±0.002 113-10102.92±0.003 31401012.87±0.007 515001-12.93±0.005 4161-1002.92±0.003 71700-113.12±0.007 51800-1-12.91±0.008 3190-10-12.90±0.001 72000003.43±0.004 52110102.95±0.000 32210-102.97±0.002 82300003.45±0.000 52410013.06±0.002 62501102.80±0.003 12600003.42±0.002 527-1-1002.86±0.000 7
表3 回归模型中回归系数方差分析
Table 3 ANOVA of response surface model
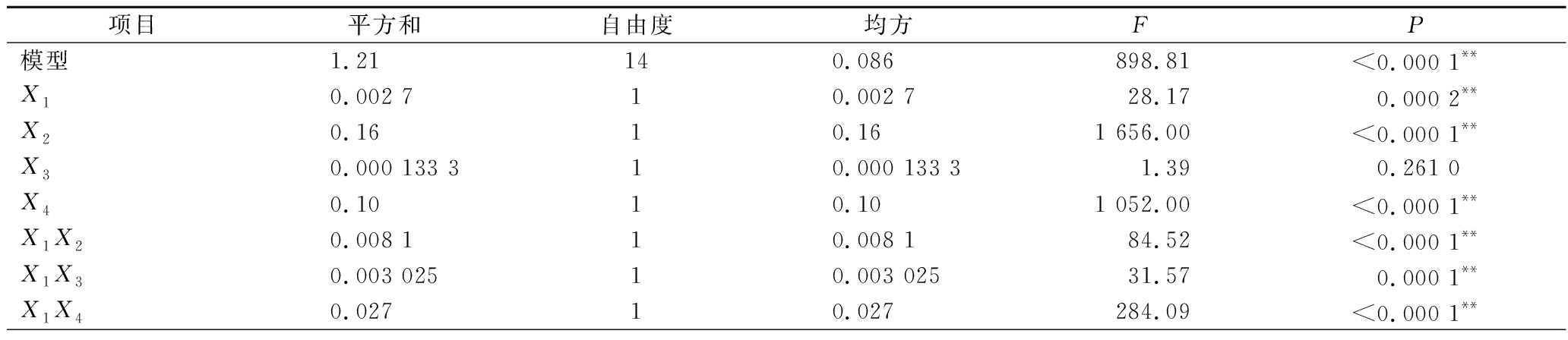
项目平方和自由度均方FP模型1.21 140.086 898.81<0.000 1**X10.002 710.002 728.170.000 2**X20.1610.161 656.00<0.000 1**X30.000 133 310.000 133 31.390.261 0X40.1010.101 052.00<0.000 1**X1X20.008 110.008 184.52<0.000 1**X1X30.003 02510.003 02531.570.000 1**X1X40.02710.027284.09<0.000 1**
续表3
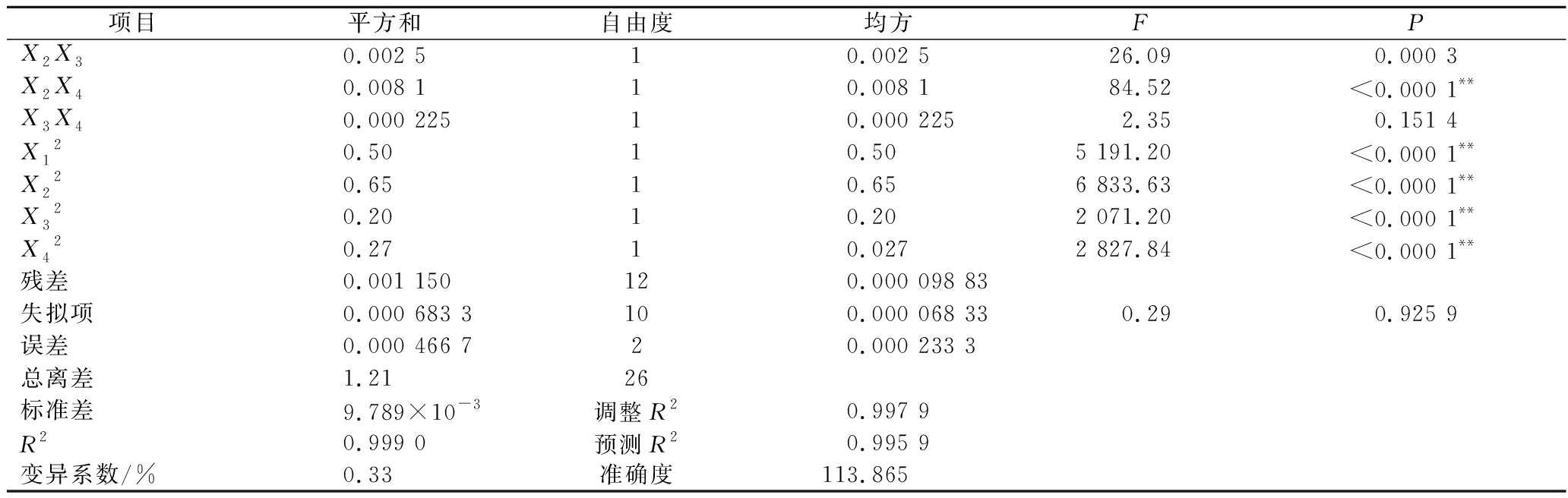
项目平方和自由度均方FPX2X30.002 510.002 526.090.000 3X2X40.008 110.008 184.52<0.000 1**X3X40.000 22510.000 2252.350.151 4X120.5010.505 191.20<0.000 1**X220.6510.656 833.63<0.000 1**X320.2010.202 071.20<0.000 1**X420.2710.0272 827.84<0.000 1**残差0.001 150120.000 098 83失拟项0.000 683 3100.000 068 330.290.925 9误差0.000 466 720.000 233 3总离差1.2126标准差9.789×10-3调整R20.997 9R20.999 0预测R20.995 9变异系数/%0.33准确度113.865
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
3.3 BDPs理化性质分析
3.3.1 分子质量测定
凝胶色谱可以将溶剂中的分子按照重量或尺寸大小依次洗脱从而达到分离的目的,进而利用示差检测器根据其折光强度可检测样品的浓度信息,通过多角度激光散射仪检测大分子的光散射信息,再根据马克·霍温克方程计算出每个组分对应的分子质量[31]。利用软件ASTRA 6.1处理色谱数据,以检测的保留时间为横坐标,以摩尔质量为纵坐标绘制样品的绝对分子质量HPSEC图谱,如图2所示。
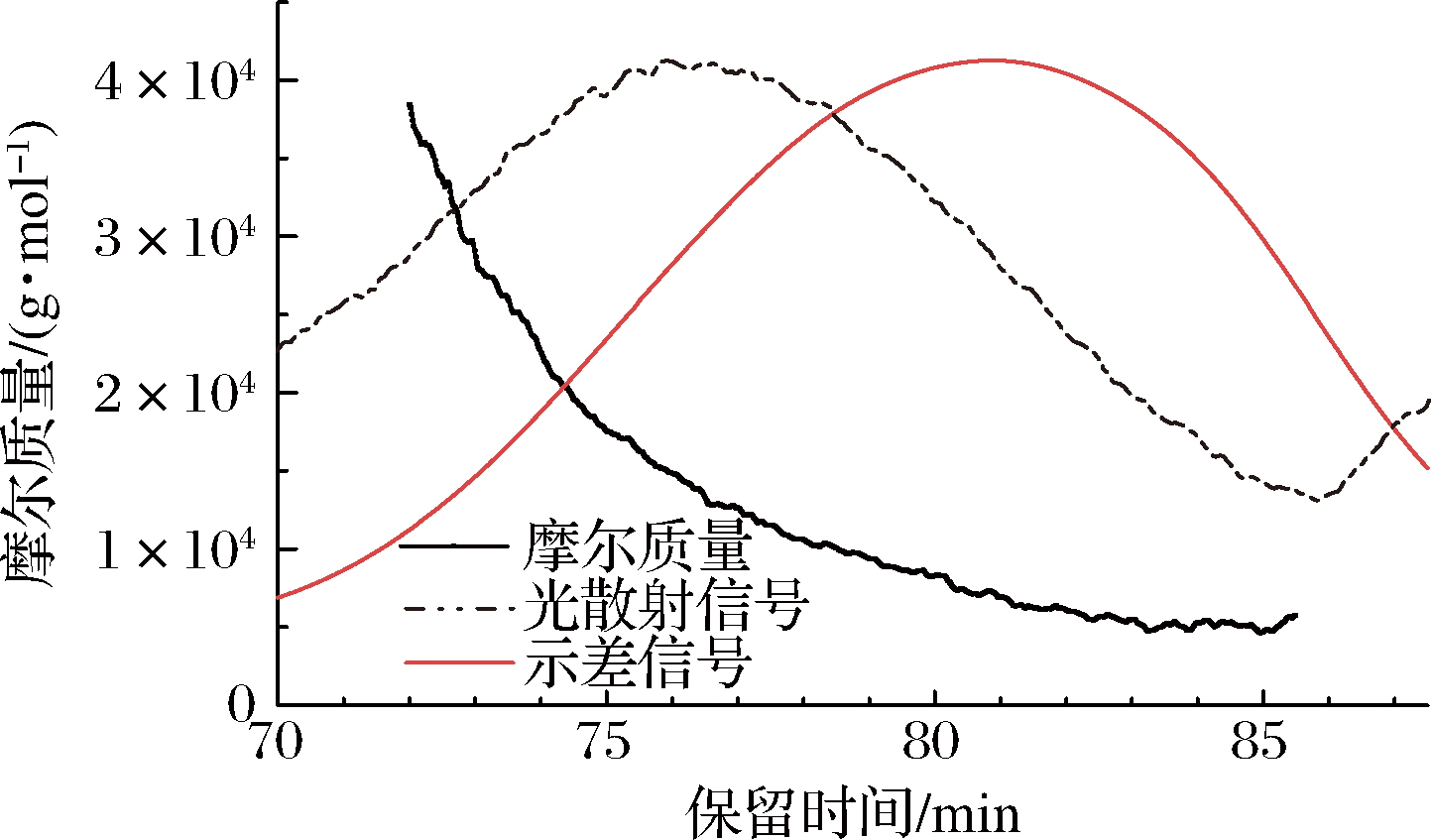
图2 BDPs的HPGPC图谱
Fig.2 HPSEC chromatogram of BDPs
示差信号图谱分布对称,说明分子质量分布相对均一,在80.8 min时出现信号尖峰,光散射信号在75.9 min处出现信号尖峰。基于光散射信号和示差信号计算所得分子质量在72~79 min之间呈直线关系,说明该段的多糖分子构型特征一致,80~85 min内呈不规则波动现象,可能是信号变弱引起的分子质量波动。BDPs的重均分子质量为10.2 kDa,均方根半径为15.3 nm,多分散系数为1.279,接近于1,说明分子质量分布均一且均在可接受范围。
3.3.2 单糖组成
BDPs及单糖标准品的离子色谱图如图3所示,与标准品对比,BDPs中含有岩藻糖、鼠李糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸以及葡萄糖醛酸,摩尔比为1∶42.2∶32.6∶ 11.8∶4.4∶56.1∶5.1∶1.8,表明BDPs是一种杂多糖,甘露糖是其主要单糖组分。
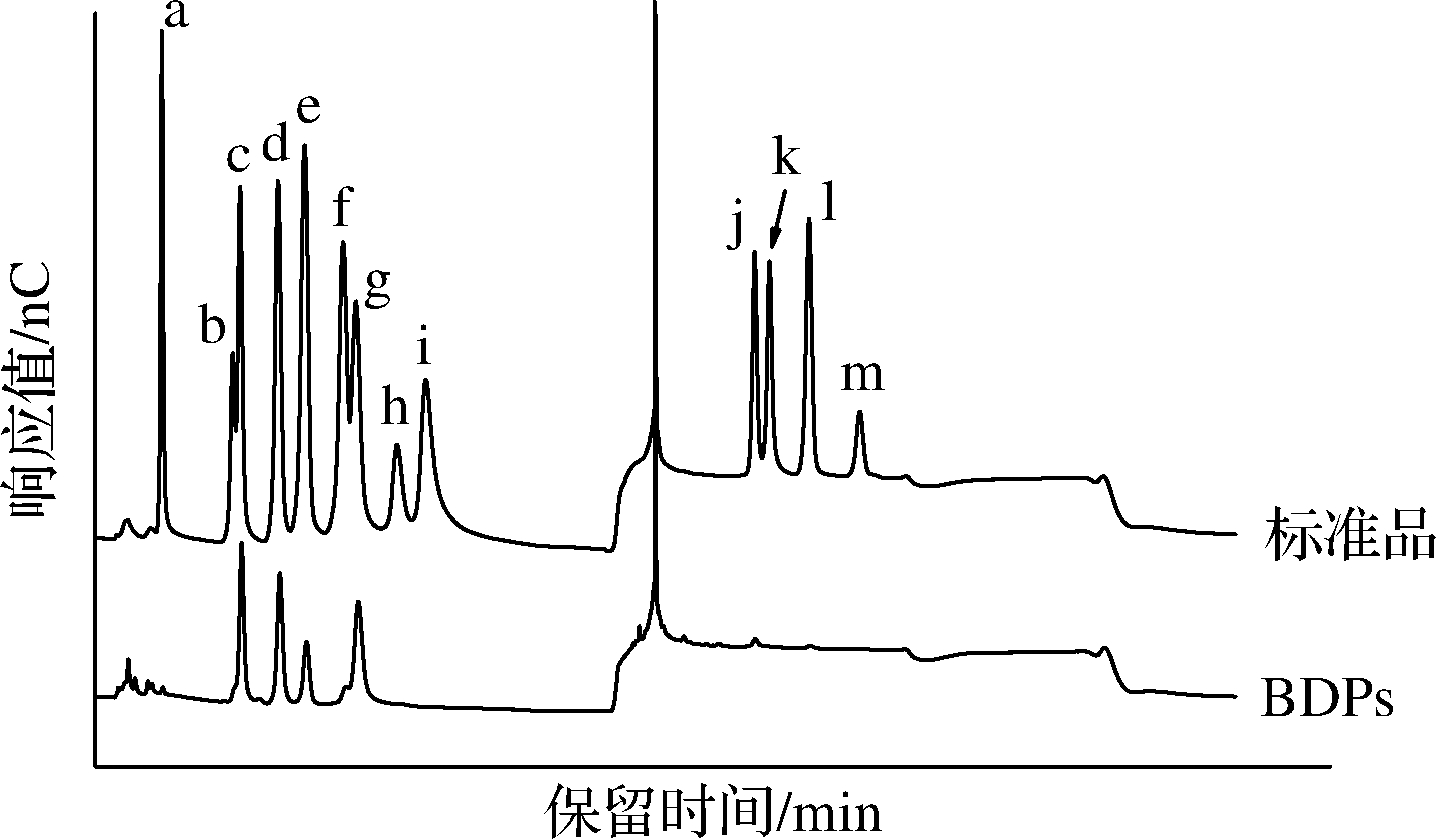
a-岩藻糖;b-阿拉伯糖;c-鼠李糖;d-半乳糖;e-葡萄糖;f-木糖;g-甘露糖;h-果糖;i-核糖;j-半乳糖醛酸;k-古罗糖醛酸;l-葡萄糖醛酸:m-甘露糖醛酸
图3 标准品及BDPs的离子色谱图
Fig.3 Chromatogram profiles of monosaccharide composition of BDPs and standards
3.3.3 刚果红实验
具有三螺旋构象的多糖在NaOH溶液中与刚果红形成络合物,最大波长会出现红移现象,随着NaOH溶液浓度逐渐增高,多糖螺旋结构发生解体,变成无规则的线团形式,最大吸收波长又会发生蓝移[32]。由图4可以看出,与单一刚果红溶液相比,BDPs的最大吸收波长发生了红移,说明BDPs存在三螺旋结构。随着NaOH浓度的增大,黄刺多糖与刚果红试剂作用产生络合物的最大吸收波长均呈现连续下降的趋势,造成这种结果的原因可能是黄刺多糖结构复杂,分子质量大,在水溶液中呈现无规则卷曲构象,碱性溶液使多糖的氢键不断断裂[22]。
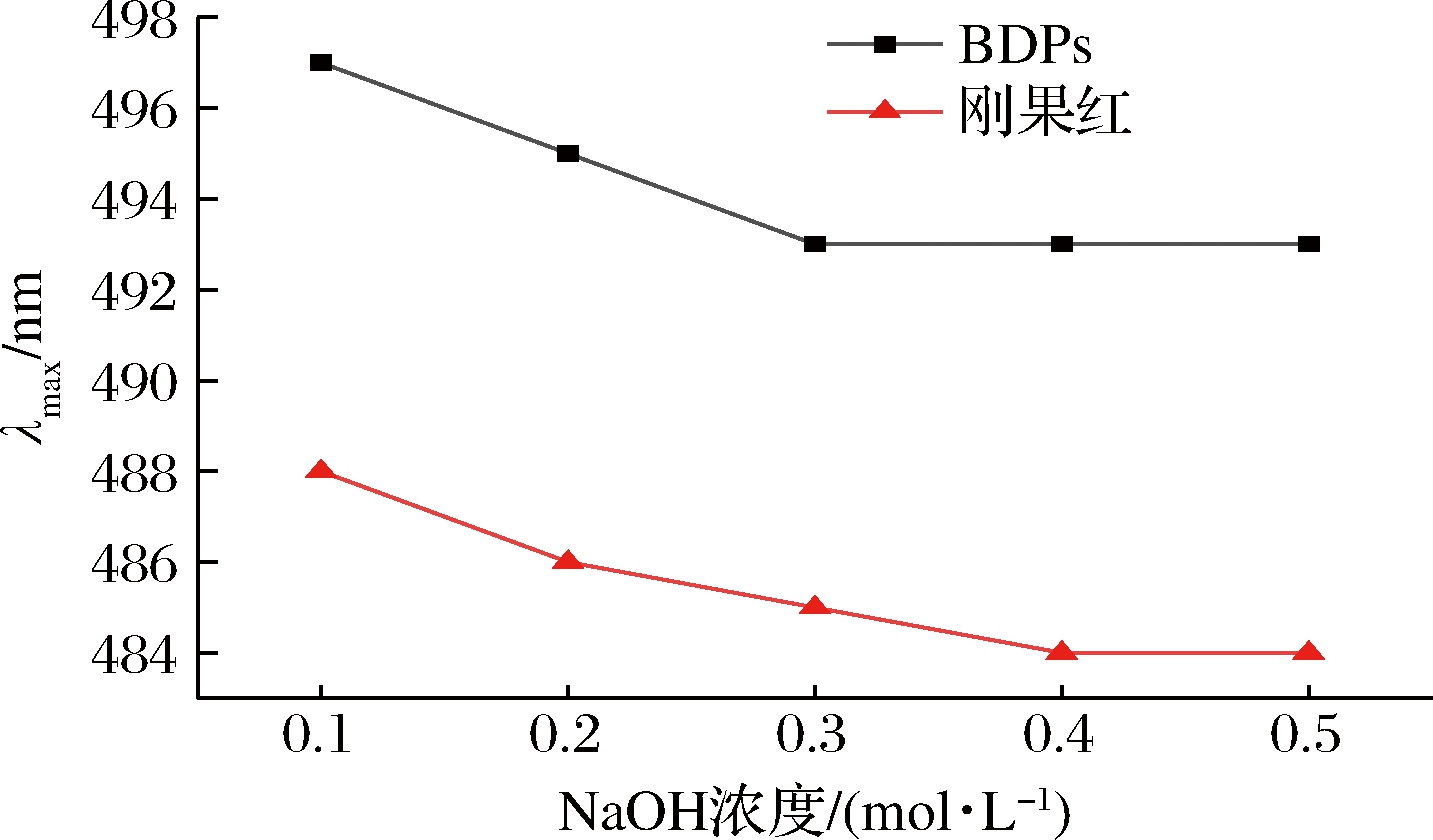
图4 BDPs与刚果红混合碱溶液的最大吸收波长变化
Fig.4 Changes in absorption wavelength maximum of mixture of Congo red and BDPs
3.3.4 微观结构观察
如图5所示,BDPs呈颗粒状,表面呈不规则褶皱,比较粗糙且孔洞多。而这与纤维素酶协同超声波提取北沙参多糖的形态结果一致,可能是由于酶解和超声波的协同作用下使多糖降解成小分子碎片堆叠[27]。

a-500×;b-2 500×;c-5 000×
图5 BDPs扫描电镜图
Fig.5 Scanning electron micrographs of BDPs
3.4 不同浓度BDPs对细胞存活率的影响
如图6所示,BDPs质量浓度在0.062 5~0.25 mg/mL作用24~72 h对细胞存活率无显著影响。BDPs作用细胞24 h后,质量浓度在0.062 5~0.25 mg/mL范围内时,细胞存活率是逐渐升高的,0.5 mg/mL之后开始下降;BDPs作用48 h后,在BDPs质量浓度0.062 5~0.25 mg/mL范围内时,细胞存活率是逐渐升高的,高于0.25 mg/mL时开始逐渐下降;BDPs作用72 h后,在BDPs浓度0.062 5~0.125 mg/mL范围内时,细胞存活率逐渐升高,高于0.125 mg/mL时开始下降,并且和对照组相比,在浓度为2 mg/mL时显著降低(P<0.05)。因此,0.062 5~0.5 mg/mL为细胞的安全质量浓度范围,所以最终选择24 h作为后续BDPs的作用时间,质量浓度范围选取在0.062 5~0.5 mg/mL。
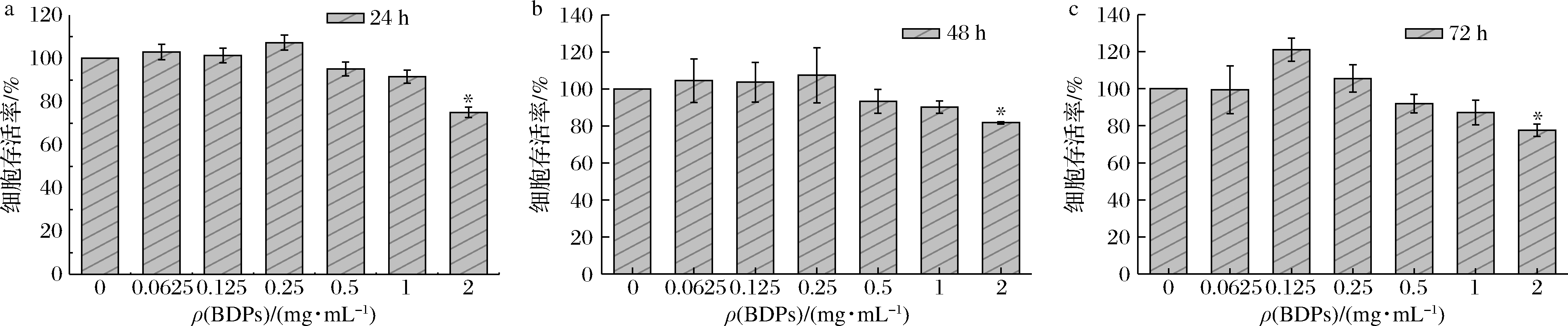
a-24 h;b-48 h;c-72 h
图6 不同质量浓度BDPs对细胞存活率的影响
Fig.6 Effects of different concentrations of BDPs on the survival rate of RIN-m5F cells
注:*P<0.05表示与正常对照组比较差异显著
3.5 BDPs对H2O2诱导的RIN-m5F细胞的保护作用
胰岛β细胞易受ROS损伤而凋亡,引发糖尿病[33]。大量研究采用H2O2建立细胞氧化损伤模型,诱导β细胞产生氧化损伤。如图7所示,经预实验选择250 μmol/L H2O2诱导细胞,诱导3 h后细胞存活率与正常对照组相比显著降低(P<0.05);使用质量浓度为0.062 5~0.5 mg/mL的BDPs干预细胞后,细胞存活率显著低于对照组(P<0.05),但与模型组相比细胞存活率呈现显著升高(P<0.05),故0.062 5~0.5 mg/mL的BDPs能够提高H2O2氧化损伤的细胞存活率,对氧化损伤的细胞有一定保护作用。
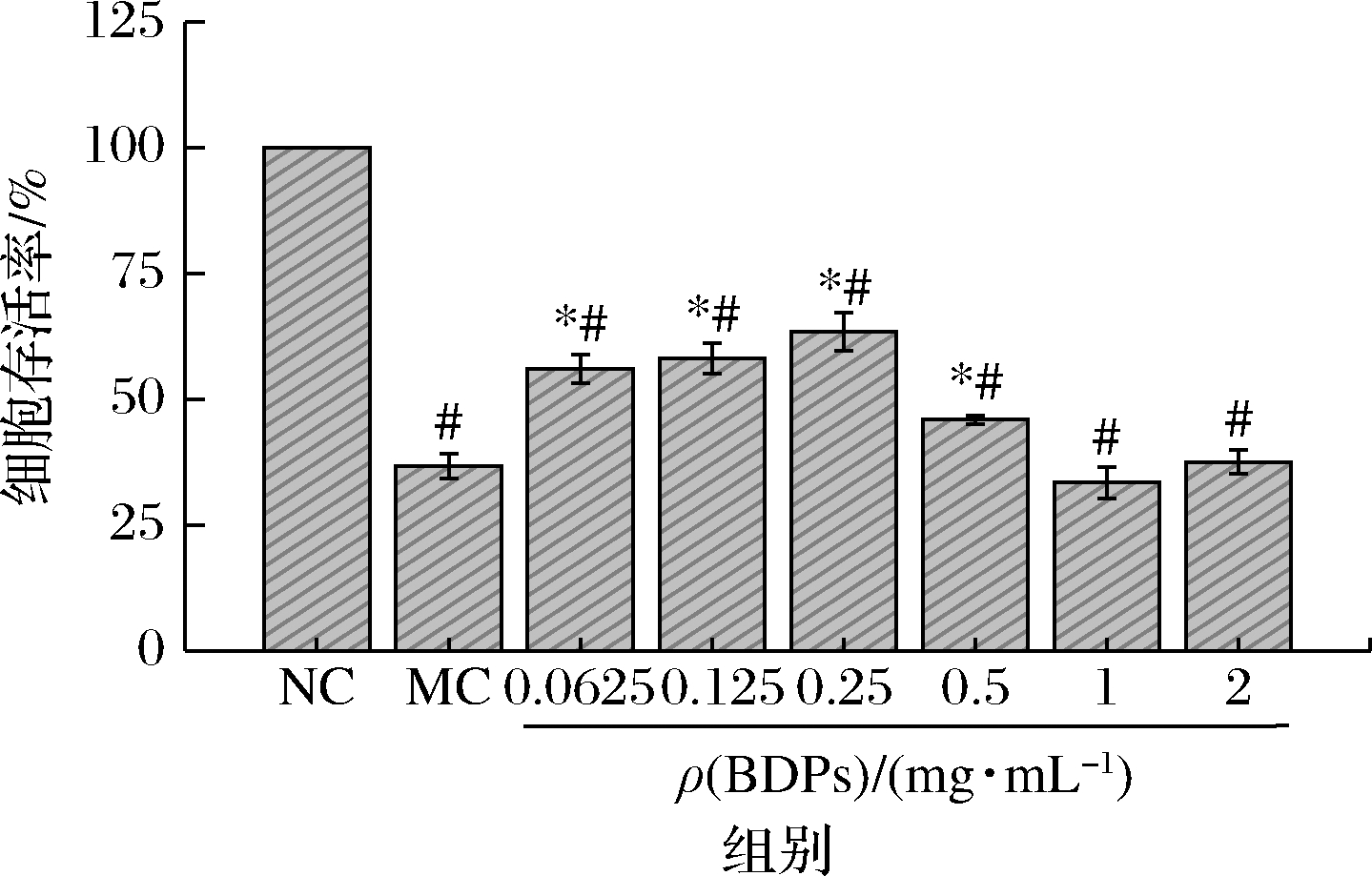
图7 BDPs对H2O2诱导的RIN-m5F细胞的保护作用
Fig.7 Protective effect of BDPs on H2O2-induced of RIN-m5F cells
注:*表示与模型组作相比差异显著(P<0.05);#表示与正常对照组相比差异显著(P<0.05),图9同
3.6 BDPs对细胞形态的影响
如图8所示,对照组为正常培养的RIN-m5F细胞,呈聚集圆球状或梭状,经250 μmol/L H2O2刺激后细胞发生皱缩、细胞密度降低,且边缘模糊;再经过BDPs干预后细胞形态慢慢恢复,并且密度增加,BDPs低剂量组(0.0625 mg/mL)干预H2O2刺激的细胞后细胞数量明显增加,细胞边界逐渐变圆滑。

a-正常对照组;b-阳性对照组;c-模型组;d-BDPS-低剂量组;e-BDPS-中剂量组;f-BDPS-高剂量组
图8 不同浓度BDPs对RIN-m5F细胞形态的影响
Fig.8 Effect of different concentrations of BDPs on RIN-m5F cells morphology
3.7 ROS水平测定
如图9所示,250 μmol/L H2O2诱导细胞后,增加了细胞内ROS积累,ROS水平显著高于对照组(P<0.01);经过0.062 5~0.25 mg/mL的BDPs干预24 h后,细胞ROS水平与模型组相比有显著下降的趋势(P<0.05),说明H2O2诱导RIN-m5F细胞ROS水平升高,不同剂量的BDPs可以降低H2O2损伤后RIN-m5F细胞内的ROS水平,抑制H2O2诱导的细胞氧化应激。

图9 不同浓度BDPs对RIN-m5F细胞内ROS的影响
Fig.9 Effect of different concentrations of BDPs on ROS level of RIN-m5F cells
3.8 SOD、CAT的活性及 MDA 含量的检测
BDPs对RIN-m5F细胞中SOD、CAT的活性及MDA含量测定结果如图10所示。由图10-a和图10-b可知,H2O2处理后细胞SOD、CAT的活性与对照组相比有显著降低(P<0.05),经过BDPs干预后,抗氧化酶活性逐渐升高且呈一定的剂量依赖性,在0.25 mg/mL时BDPs的SOD活性达到(69.67±3.26)U/mg,CAT活性达到(11.12±0.57)U/mg。
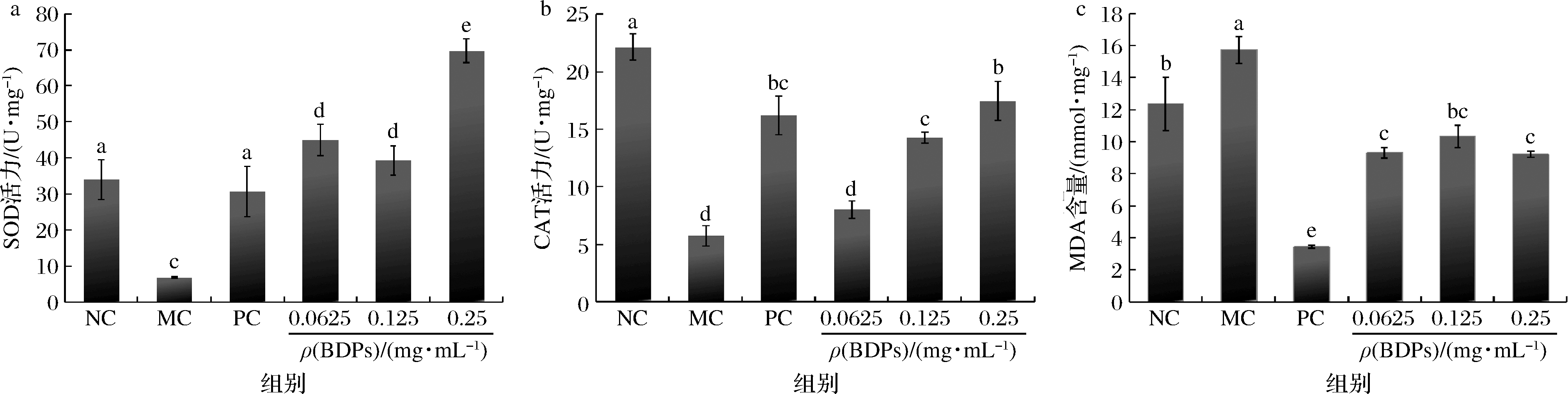
a-SOD;b-CAT;c-MDA
图10 BDPs对RIN-m5F细胞SOD、CAT和MDA含量的影响
Fig.10 Effect of BDPs on SOD,CAT and MDA in H2O2-induced RIN-m5F cells
由图10-c所示,H2O2诱导可以提升细胞中MDA含量(P<0.05),BDPs干预后细胞中MDA含量均有所降低,BDPs高剂量组(0.25 mg/mL)MDA含量为(9.22±0.17)mmol/mg,可见BDPs能够抑制MDA的释放,保护氧化应激损伤的细胞。
4 结论与讨论
前期研究发现黄刺果实中有大量活性多糖成分,但对于黄刺多糖的提取及生物活性研究较少。与传统的水提法相比,超声波辅助酶法提取多糖损失更小且得率更高[22],因此本研究通过单因素实验分析加酶量、酶解温度、酶解时间、超声波功率各因素对黄刺多糖提取率的影响,利用响应面优化黄刺果实多糖提取工艺,得到最佳提取工艺条件为:加酶量1.25%(质量分数),酶解时间57 min,酶解温度45 ℃,超声波功率164 W,黄刺果实多糖平均提取得率为(3.478±0.075)%,与预测值3.451%相近。结构解析是多糖研究中的难点,本文通过测定分子质量、单糖组成、扫描电镜及刚果红实验初步表征BDPs结构,表明BDPs重均分子质量平均为10.2 kDa,主要由岩藻糖、鼠李糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸以及葡萄糖醛酸组成,摩尔比为1∶42.2∶32.6∶11.8∶4.4∶56.1∶5.1∶1.8,说明BDPs是一种杂多糖,具有三螺旋结构,后续可进一步分离纯化,结合特定降解方法获得结构片段,采用甲基化、核磁共振等手段表征其精细多糖结构,可能存在的构效关系也值得进一步探讨。
氧化损伤是引起糖尿病的危险因素之一,因此抗氧化治疗是一个可以防治糖尿病的很重要的途径[34]。长期暴露于高水平H2O2中的胰岛β细胞会发生氧化损伤,H2O2诱导后氧化损伤的RIN-m5F细胞内ROS水平显著升高,抗氧化酶活性降低[35],这与本文研究结果一致。研究表明,天然产物多糖能有效对抗机体氧化应激状态,具有良好的抗氧化作用[36]。树莓多糖能够降低Ⅰ型糖尿病大鼠胰腺和血清中SOD、GSH-Px的活性,降低MDA的含量,一定程度改善链脲佐菌素(streptozocin,STZ)对胰岛β细胞造成的损伤[37]。灵芝多糖能够有效提高STZ诱导的糖尿病大鼠血清中胰岛素水平,降低血糖和脂质过氧化物含量[38]。枸杞多糖能够控制Ⅱ型糖尿病大鼠血糖水平,同时能显著提高SOD活性,减少MDA含量[39]。这与本文得出的BDPs能够提高H2O2损伤的胰岛细胞抗氧化酶活性,降低ROS水平及MDA含量从而缓解氧化应激的结果一致。
研究发现,氧化应激在胰岛β细胞的凋亡过程中发挥重要作用[40],ROS过多积累可以调节凋亡相关基因表达(如Bcl-2蛋白家族)或者通过激活NF-κB诱导β细胞损伤[41],本实验研究结果表明BDPs对H2O2诱导胰岛β细胞氧化损伤具有保护作用,但其具体抗凋亡机制还未明确,未来研究中可进一步讨论BDPs是否通过调节凋亡蛋白表达及调控NF-κB通路等途径保护胰岛β细胞凋亡,以期为黄刺多糖在医药或功能性食品中的应用提供支持。综上所述,BDPs可以提高氧化损伤细胞的抗氧化酶活性,从而减轻氧化应激对胰岛β细胞的损伤,这为青藏高原特色资源活性成分治疗糖尿病提供了新的思路。
[1] 韩丽娟, 乔杨波, 索有瑞, 等. 直穗小檗果粉对STZ诱导的Ⅰ型糖尿病大鼠糖脂代谢的调节作用[J]. 食品工业科技, 2020, 41(4):298-306.
HAN L J, QIAO Y B, SUO Y R, et al. Effect of Berberis dasystachya Maxim. fruit powder on glucoseand lipid metabolisms in STZ-induced type I diabetic rats[J]. Science and Technology of Food Industry, 2020, 41(4):298-306.
[2] 向前胜, 王宁, 赵越, 等. 青海省不同纬度小檗属3种植物不同部位小檗碱变化规律研究[J]. 西部林业科学, 2015, 44(2): 136-140.
XIANG Q S, WANG N, ZHAO Y, et al. Study on regularity of berberine in various organs of three kinds of Berberis in different latitude of Qinghai province[J]. Journal of West China Forestry Science, 2015, 44(2): 136-140.
[3] 周雯, 韩丽娟, 马娜娜, 等. 黄刺浆果不同组分多糖理化性质及生物活性的比较研究[J]. 食品与发酵工业, 2022, 48(2):189-197.
ZHOU W, HAN L J, MA N N, et al. Comparative study on the physicochemical properties and biological activities of polysaccharides from different components of the berry of Berberi dasystachya[J]. Food and Fermentation Industries, 2022, 48(2):189-197.
[4] 索有瑞, 韩丽娟, 杨芳. 一种青海三刺果粉组合物及其片剂和用途:CN105661392A[P]. 2016-06-15.
SUO Y R, HAN L J, YANG F. A kind of Qinghai Sanci fruit powder composition and its tablets and application: CN105661392A[P]. 2016-06-15.
[5] 纪兰菊. 沙棘、唐古特白刺、黄刺果实游离氨基酸和抗坏血酸的分析[J]. Journal of Integrative Plant Biology, 1989(6): 487-488.
JI L J. Analysis of free amino acids and vitamin C in fruits of Hippophae rhamnoides L., Nitraria tangutorum Bobr.,and Berberis dasystachya Maxim.[J]. Journal of Integrative Plant Biology, 1989(6): 487-488.
[6] HAN L J, SUO Y R, YANG Y J, et al. Optimization, characterization, and biological activity of polysaccharides from Berberis dasystachya Maxim[J]. International Journal of Biological Macromolecules, 2016, 85:655-666.
[7] 孟昭军, 韩丽娟, 索有瑞. 黄刺果实多糖及其制备方法和用途: CN104945525A[P]. 2015-09-30.
MENG S J, HAN L J, SUO Y R The polysaccharides of the berry of Berberi dasystachya and its preparation method and application:CN104945525A[P]. 2015-09-30.
[8] KESHTKAR S, KAVIAN M, JABBARPOUR Z, et al. Protective effect of nobiletin on isolated human islets survival and function against hypoxia and oxidative stress-induced apoptosis[J]. Scientific Reports, 2019, 9(1):11701.
[9] 周鸿. 芒果苷在INS-1胰岛β细胞的药代动力学研究[D]. 广州: 广州中医药大学, 2020.
ZHOU H. Pharmacokinetics of mangiferin in INS-1 β cells[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2020.
[10] YANG S W, YAN J M, YANG L L, et al. Alkali-soluble polysaccharides from mushroom fruiting bodies improve insulin resistance[J]. International Journal of Biological Macromolecules, 2019, 126(1):466-474.
[11] FEDERICI M, HRIBAL M, PEREGO L, et al. High glucose causes apoptosis in cultured human pancreatic islets of langerhans[J]. Diabetes, 2001, 50(6): 1 290-1 301.
[12] 孙焕. 小檗碱改善高糖高脂诱导的胰岛NIT-1细胞凋亡的分子机制[D]. 武汉: 华中科技大学, 2008.
SUN H. Molecular mechanism of Berberine’s inhibitory effects on the apoptosis of NIT-1 cells induced by high glucose and saturated fatty acids[D]. Wuhan: Huazhong University of Science and Technology, 2008.
[13] PAN X W, SHAO Y D, WANG F G, et al. Protective effect of apigenin magnesium complex on H2O2-induced oxidative stress and inflammatory responses in rat hepatic stellate cells[J]. Pharmaceutical Biology, 2020, 58(1):553-560.
[14] LI J, WU N H, CHEN X, et al. Curcumin protects islet cells from glucolipotoxicity by inhibiting oxidative stress and NADPH oxidase activity both in vitro and in vivo[J]. Islets, 2019, 11(6): 152-164.
[15] 源瀚祺, 黄庆华, 李娆玲. 通过细胞模型体外评价抗氧化活性实验方法研究综述[J]. 广东药学院学报, 2012, 28(2): 208-211.
YUAN H Q, HUANG Q H, LI R L. Review on cells models for in vitro evaluation of cellular antioxidant activity assay[J]. Journal of Guangdong Pharmaceutical University, 2012, 28(2): 208-211.
[16] 杨艳, 刘东波, 康信聪, 等. H2O2诱导胰岛RIN-m5F细胞构建氧化应激模型[J]. 食品与机械, 2014, 32(2):40-43.
YANG Y, LIU D B, KANG X C, et al. Hydrogen peroxide-induced oxidative stress model of pancreatic RIN-m5F cell[J]. Food and machinery, 2014, 32(2):40-43.
[17] MAHESHWARI A, MISRO M M, AGGARWAL A, et al. Pathways involved in testicular germ cell apoptosis induced by H2O2 in vitro[J]. The FEBS Journal, 2009, 276(3):870-81.
[18] 陈程, 张存劳, 罗国平, 等. 超声波辅助纤维素酶提取牡丹籽饼中多糖及其清除自由基活性研究[J]. 中国油脂, 2018, 43(4):120.
CHEN C, ZHANG C L, LUO G P, et al. Ultrasound-assisted cellulose extraction of polysaccharide from peony seed cake and its free radical scavenging activity[J]. China Oils and Fats, 2018, 43(4):120.
[19] SZEWCZYK K, HEISE E M, PIWOWARSKI J P. Preliminary characterization and bioactivities of some Impatiens L. water-soluble polysaccharides[J]. Molecules, 2018, 23(3): 631.
[20] SONG Q Q, JIANG L, YANG X Q, et al. Physicochemical and functional properties of a water-soluble polysaccharide extracted from mung bean (Vigna radiate L.) and its antioxidant activity[J]. International Journal of Biological Macromolecules. 2019(138):874-880.
[21] WANG L, ZHANG B, XIAO J, et al. Physicochemical, functional, and biological properties of water-soluble polysaccharides from Rosa roxburghii Tratt fruit[J]. Food Chemistry, 2018, 249:127-135.
[22] LIU J, WU S Y, CHEN L, et al. Different extraction methods bring about distinct physicochemical properties and antioxidant activities of Sargassum fusiforme fucoidans[J]. International Journal of Biological Macromolecules, 2020, 155: 1 385.
[23] TANG X, YU R Q, ZHOU Q, et al. Protective effects of γ-aminobutyric acid against H2O2-induced oxidative stress in RIN-m5F pancreatic cells[J]. Nutrition and Metabolism, 2018, 15(1):60.
[24] 倪青, 孟祥, 杜立娟. 半夏泻心汤对H2O2诱导的RIN-m5F细胞凋亡和胰岛素分泌的影响[J]. 北京中医药, 2017, 36(12): 1 117-1 120; 1 129.
NI Q, MENG X, DU L J. Effects of Banxia Xiexin Decoction on H2O2-induced RIN-m5F cell apoptosis and insulin secretion[J]. Beijing Journal of Traditional Chinese Medicine, 2017, 36(12): 1 117-1 120; 1 129.
[25] NOVOSELOVA E G, GLUSHKOVA O V, PARFENUYK S B, et al. Protective effect of Peroxiredoxin 6 against toxic effects of glucose and cytokines in pancreatic RIN-m5F β-cells[J]. Biochemistry. Biokhimiia, 2019, 84(6):637-643.
[26] TANG Q, ZHANG R Y, ZHOU J L, et al. The levels of bioactive ingredients in Citrus aurantium L. at different harvest periods and antioxidant effects on H2O2-induced RIN-m5F cells[J]. Journal of the Science of Food and Agriculture, 2021, 101(4):1 479-1 490.
[27] 景永帅, 袁鑫茹, 代立霞, 等. 纤维素酶协同超声波辅助提取北沙参多糖工艺优化及其理化性质和免疫调节活性研究[J]. 食品工业科技, 2022, 43(14): 185-193.
JING Y S, YUAN X R, DAI L X, et al. Optimization of cellulase synergistic ultrasonic-assisted extraction of polysaccharide from glehniae radix and its physicochemical properties and immunomodulatory activity[J]. Science and Technology of Food Industry, 2022, 43(14): 185-193.
[28] 何瑞阳, 王锋, 苏小军, 等. 玉竹多糖低共熔溶剂提取工艺优化及其抗氧化和抗糖基化活性研究[J]. 食品与发酵工业, 2022, 48(8): 190-198.
HE R Y, WANG F, SU X J, et al. Optimization of extraction process of Polygonatum odoratum polysaccharide by deep eutectic solvent and its antioxidant and anti glycosylation activities[J]. Food and Fermentation Industries, 2022, 48(8): 190-198.
[29] ZHAO Y M, SONG J H, WANG J, et al. Optimization of cellulase-assisted extraction process and antioxidant activities of polysaccharides from Tricholoma mongolicum Imai[J]. Journal of the Science of Food and Agriculture, 2016, 96(13): 4 484-4 491.
[30] 于中玉, 黄佳琪, 宇鹏. 响应曲面法优化超声波辅助提取螺旋藻硒多糖工艺[J]. 中国食品添加剂, 2021, 32(11): 107-112.
YU Z Y,HUANG J Q, YU P, et al. Optimization of ultrasonic-assisted extraction of selenium polysaccharides from Spirulina using response surface methodology[J]. China Food Additives, 2021, 32(11): 107-112.
[31] 曲一笛. 多组学分析杨树桑黄多糖通过调控Th1细胞分化的抗结直肠癌活性研究[D].长春: 吉林大学, 2022.
QU Y D. Multi-omics studies revealed the involvement of Th1 cell differentiation in the anti-tumor effect of purified polysaccharide from Sanghuangporus vaninii in colorectal cancer[D]. Changchun:Jilin university, 2022.
[32] ZHANG Y, GU M, WANG K P, et al. Structure, chain conformation and antitumor activity of a novel polysaccharide from Lentinus edodes[J]. Fitoterapia. 2010, 81(8): 1 163-1 170.
[33] 高健美, 李德芬, 牛爽, 等. 金丝桃苷对过氧化氢诱导的A549细胞氧化损伤的保护作用[J]. 中国实验方剂学杂志, 2017, 23(11): 128-133.
GAO J M, LI D F,NIU S, et al. Protective effect of hyperoside on H2O2-induced oxidative damage of A549 cells[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(11): 128-133.
[34] SIM Y C, LEE J S, LEE S, et al. Effects of polysaccharides isolated from Inonotus obliquus against hydrogen peroxide-induced oxidative damage in RIN-m5F pancreatic β-cells[J]. Molecular Medicine Reports, 2016, (14): 4 263-4 270.
[35] SAMPSON S R, BUCRIS E, HOROVITZ-FRIED M, et al. Insulin increases H2O2-induced pancreatic beta cell death[J]. Apoptosis, 2010, 15(10):1 165-1 176.
[36] 任春久. 桑叶多糖MLP对糖尿病大鼠胰岛β细胞氧化应激损伤的保护作用及其机制研究[D]. 泰安:山东农业大学, 2015.
REN C J. Study on protection of mulberry (Morus alba var. multicaulis (Perrott.) Loud) leaf polysaccharide MLP on oxidative stress on the function of pancreas islet β cells of diabetic rat and its mechanim[D]. Tai’an:Shandong Agricultural University, 2015.
[37] 田文慧, 杨永晶, 吴云, 等. 树莓果肉多糖在Ⅰ型糖尿病大鼠中的免疫调节和抗氧化活性研究[J]. 食品与发酵工业, 2020, 46(12): 102-108.
TIAN W H, YANG Y J, WU Y, et al. Immune regulation and antioxidant activity of raspberry pulp polysaccharide through typeⅠdiabetic rats[J]. Food and Fermentation Industries, 2020, 46(12): 102-108.
[38] JIA J, ZHANG X, HU Y S, et al. Evaluation of in vivo antioxidant activities of Ganoderma lucidum polysaccharides in STZ-diabetic rats[J]. Food Chemistry, 2009, 115: 32-36.
[39] WU H, GUO H, ZHAO R. Effect of Lycium babarum polysaccharide on the improvement of antioxidant ability and DAN damage in NIDDM rats[J]. The Pharmaceutical Society of Japan, 2006, 126(5): 365-371.
[40] PIRO S, ANELLO M, PIETRO C D, et al. Chronic exposure to free fattyacids or high glucose induces apoptosis in rat pancreatic islets: Possible role of oxidative stress[J]. Metabolism, 2002, 51(10):1 340-1 347.
[41] HAYDEN M R, SOWERS J R. Isletopathy in type 2 diabetes mellitus: Implications of islet RAS, islet fibrosis, islet amyloid, remodeling, and oxidative stress[J]. Antioxidants and Redox Signaling, 2007, 9(7): 891-910.