酚类物质是指植物体内次生代谢产物中的一类化合物,是由戊糖磷酸酯、莽草酸和苯丙烷类途径合成,广泛存在于各类植物中,如水果、谷物、蔬菜、茶叶等,具有抑菌、抗病毒、抗氧化等功能,有很好的应用前景。按其存在形态可分为游离态酚和结合态酚[1]。游离态酚是指不与蛋白质、纤维等大分子发生相互作用的酚类物质,易溶于有机试剂。结合态酚按照化学、物理相互作用方式不同分为:化学键合类、离子键合类、物理截留于植物基质类、物理包埋于细胞结构类[2]。目前,酚类物质的研究多集中在用有机试剂提取的游离态酚物质,忽略了不可直接提取的结合态酚,但其广泛分布于植物体内。研究表明,黑莓等水果的结合酚含量均显著高于游离酚,且占总酚含量的比例均高于70%[3]。目前,结合态酚的提取方法主要为碱水解[1]。碱水解能有效破坏酯键和醚键,常用NaOH作为碱解试剂,并在水解过程中充入N2,防止水解出来的多酚被氧化,造成含量的损失[4]。
青梅(Prunus mume sieb. Et Zucc.),属于蔷薇科李属,是一种传统的健康果品,在中国、日本和韩国等东亚地区广泛种植。已有研究报道,青梅及其多酚提取物能改善骨质疏松症、酒精肝、糖尿病、肥胖症、过敏和咳嗽等疾病[5-6]。青梅含有丰富的酚类物质,多酚含量约占2.07%[7],具有很强的抗氧化活性。已有研究表明,青梅的多酚含量和抗氧化活性明显高于苹果、柑橘等常见水果[8]。截至目前,国内外学者对于青梅的酚类物质定性研究主要集中在使用有机溶剂提取的游离酚类物质,并通过不同提取和仪器分析方法从不同品种、地区的青梅游离酚中共分离鉴定出40种单体酚物质,但其结合态酚类物质的含量组成以及发挥的功能活性还未见报道[6, 9]。此外,目前的研究报道大多基于有机溶剂提取后评价其功能活性,未充分考虑酚类物质在人体中的消化释放和吸收利用情况。酚类化合物的稳定性差,易受温度、氧气、光照、pH等环境因素影响。然而,人体消化吸收过程是一个复杂的环境体系,含有酚类物质的食物经过酸性的胃液环境和弱碱性的肠液环境,在不同消化酶体系、渗透压、甚至其他食物成分作用下从基质中释放出来,这导致经人体消化后酚类物质含量可能与其在食物中的含量有较大差异。酚类物质被人体消化和吸收的程度可用生物可接受率和生物利用度衡量。其中,生物可接受率是指多酚被人体摄入,经胃、小肠消化后,可被小肠吸收利用的含量占摄入总量的比值,反映了酚类物质在消化过程中的释放情况,是消化吸收最重要的一步[10]。不同来源的酚类物质生物可接受率不同,豆类、蔬菜、谷物的生物可接受率分别为25.47%、26.01%和28%。目前在已有的研究方法中,在生物体内进行实验最能准确反映实际消化情况,但其周期长,成本高,且伴随着伦理问题和个体差异。因此,国际多领域专家通过模拟人体实际消化过程,建立了标准化的体外静态消化INFOGEST 2.0模型,其实验结果与在人体和动物体内消化情况有良好的相关性[11]。
目前,青梅酚类物质的含量和生物活性已有研究报道。青梅多酚在体外模拟消化过程中生物接受率和抗氧化活性的变化未见报道。因此,本实验以青梅为材料,利用 UPLC-MS/MS 分析青梅的多酚含量及单体组成,并采用模拟体外消化模型(INFOGEST 2.0)研究消化过程中青梅酚类物质的释放、生物可接受率,及其抗氧化活性的变化,以期为青梅的功能活性研究和相关营养保健食品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
青梅,广东康辉集团有限公司。采用分组采样,从不同果树随机采摘青梅,青梅单果重约18 g,均产自广东普宁(23°29’N,116°117’E)的果园。将采摘后的青梅洗净,经冷冻干燥制得冻干粉后,储存在-20 ℃冰箱备用。胃蛋白酶、胰蛋白酶、胰酶、胆盐、ABTS、荧光素钠、2, 2-偶氮二(2-甲基丙基咪)二盐酸盐[2,2′-Azobis(2-methylpropionamidine)dihydrochloride,AAPH]、福林酚试剂,美国Sigma公司;新绿原酸(≥98%)、绿原酸(≥98%)、隐绿原酸(≥98%)、对羟基苯甲酸(≥98%)、p-香豆酸(≥98%)、阿魏酸(≥98%)、原花青素B1(≥98%)等,上海源叶生物科技有限公司;色谱级乙腈,美国Fisher公司;其他试剂均为分析纯。
1.1.2 主要仪器设备
UPLC-Q-Exactive Orbitrap/MS,美国Thermo Fisher Scientific 公司;VersaMAS酶标仪,美国Melecular Devices公司;数显恒温循环水浴锅,国华仪器制造有限公司。
1.2 实验方法
1.2.1 青梅酚类物质的提取
根据LI等[12]的方法稍加修改,用有机试剂法提取青梅的游离酚,用碱水解法提取青梅的结合酚,两部分提取物合并为总酚。精确称量0.5 g样品冻干粉,加入15 mL含体积分数1%甲酸的80%甲醇水溶液,超声处理30 min,在4 ℃以12 000 r/min离心10 min,合并上清液并加入等量的乙酸乙酯萃取3次,于35 ℃旋转蒸发去除乙酸乙酯后,用甲醇定容至10 mL,得青梅游离态酚。将15 mL 2 mol/L NaOH溶液加入提取完游离酚的青梅果渣,充入N2后,置于30 ℃的恒温摇床振荡4 h,用盐酸调节pH至2.0,在上述条件下离心、萃取,旋转蒸发去除溶剂后,用甲醇定容至10 mL得结合态酚,贮存在-20 ℃冰箱备用。
1.2.2 多酚含量的测定
采用Folin-Ciocalteu 法测定[12]。取25 μL样品溶液或没食子酸标准溶液加入96孔板,并加入125 μL的0.2 mol/L的福林酚试剂,在振荡器混匀后,放置室温避光反应10 min。向96孔板加入125 μL的饱和Na2CO3溶液,混匀后避光反应30 min。使用酶标仪在765 nm处测定吸光值,结果表示为每克干物质中所含的没食子酸当量(mg GAE/g DW),并以没食子酸浓度为横坐标,以吸光值为纵坐标,绘制标准工作曲线(y=0.005 4x+0.068 2;R2=0.999 7)。
1.2.3 UPLC-Q-Exative Orbitrap/MS 分析酚类物质组成及含量
用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(UPLC-Q-Exactive Orbitrap/MS)对酚类物质提取物进行定性和定量分析。液相条件:采用Agilent PoroShell HPH-C18色谱柱(2.1 mm×150 mm,4 μm)分离酚类物质;柱温设置为40 ℃;流动相A和B分别为超纯水(含体积分数1‰甲酸)和乙腈(含体积分数1‰甲酸);流速0.3 mL/min;进样体积5 μL;梯度洗脱:0~3 min 95%~85%A,3~11 min 85%~70%A,11~15 min 70%~50%A,15~21 min 50%~10%A,21~22 min 10%~95%A。质谱条件为:采用负离子模式,保护气体(N2):30 arb,辅助气体(N2):10 arb,毛细管电压3 200 V,毛细管温度320 ℃,扫描范围100~1 500 m/z。根据保留时间、一级质谱信息和二级质谱信息进行定性分析;根据标准工作曲线进行定量分析。
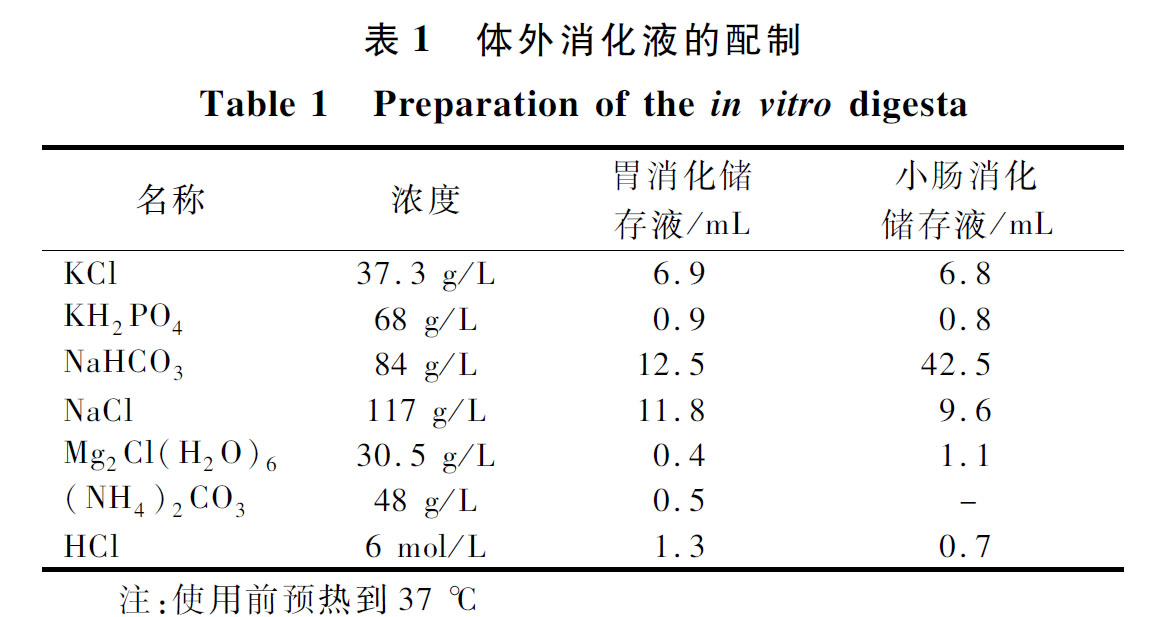
1.2.4 体外模拟消化模型及生物可接受率分析
为评估青梅酚类物质的生物可接受率,按照 INFOGEST 2.0的方法模拟体外胃肠消化[11]。消化过程分为胃和小肠2个消化阶段,胃消化储备液和小肠消化储备液配制方法参照表1。胃消化阶段:准确称量1 g青梅冻干粉到有螺丝盖的小瓶中,加入8 mL胃消化储备液、0.42 mL胃蛋白酶(2 000 U/mL)和0.24 mL胃脂肪酶(60 U/mL)、27.5 μL CaCl2溶液(44.1 g/L),调节pH至3.00,超纯水定容至10 mL,充分混匀后,置于37 ℃恒温摇床避光振荡反应2 h,在胃消化结束后取出样品。小肠消化阶段:继续加入4 mL小肠消化储备液、2.5 mL胰酶(100 U/mL)、1.5 mL胆盐(200 mg/mL)、20 μL CaCl2溶液,调节pH至7.00,超纯水定容至20 mL,充分混匀后,置于37 ℃恒温摇床避光振荡反应2 h,在小肠消化结束后取出样品。将上述取得的样品pH调至2,4 ℃离心(10 000 r/min)10 min,取上清液作为待测样品,置于-20 ℃备用。多酚的生物可接受率表示为消化后样品中酚类物质的含量与消化前样品中酚类物质含量的比值。消化前后总酚含量和单体酚含量分别采用1.2.2和1.2.3的方法测定。
1.2.5 抗氧化活性评价
为进一步分析青梅多酚在消化过程中抗氧化活性的变化,本研究测定青梅多酚提取液和不同阶段消化液的抗氧化能力。ABTS自由基清除能力测定采用96孔法[13],单位表示为每克样品含有水溶性维生素E当量(Trolox equivalent,TE)的毫克数(mg TE/g DW),并以Trolox浓度为横坐标,以吸光值为纵坐标,绘制标准工作曲线(y=-0.004 6x+0.679 1;R2=0.999 8);DPPH自由基清除能力测定采用VEL ZQUEZ等[14]的方法,单位表示为每克样品含有TE当量的毫克数(mg TE/g DW),并以Trolox浓度为横坐标,以吸光值为纵坐标,绘制标准工作曲线(y=-0.003 6x+1.455 9;R2=0.998 3)。
ZQUEZ等[14]的方法,单位表示为每克样品含有TE当量的毫克数(mg TE/g DW),并以Trolox浓度为横坐标,以吸光值为纵坐标,绘制标准工作曲线(y=-0.003 6x+1.455 9;R2=0.998 3)。
1.3 数据分析
采用Orign 2020软件进行单因素方差、显著性分析。所有实验重复3次,结果以“平均值±标准差”表示。采用SPSS 24.0对多酚释放量与抗氧化活性进行相关性分析。检验水准α=0.05,P<0.05,差异具有统计学意义。
2 结果与分析
2.1 青梅多酚在体外消化过程中释放量和生物可接受率的变化
体外消化实验是一种广泛使用的测定摄入化合物生物可接受率的方法。本研究采用INFOGEST 2.0体外静态模拟胃肠道消化方法,研究青梅在不同消化阶段酚类物质含量释放效应的差异,以期探究青梅酚类物质在体外消化的情况。如表2所示,未消化的青梅多酚含量为(10.72±0.23)mg GAE/g DW。经体外胃消化后,在胃消化阶段的释放量为(3.10±0.13)mg GAE/g DW。进一步经体外小肠消化后,消化液中的多酚含量较胃消化阶段显著减少(P<0.05),其多酚的释放量为(1.00±0.04)mg GAE/g DW,较胃消化阶段降低了67.74%,青梅多酚的生物可接受率为9.33%。
表2 青梅多酚在体外消化过程中含量及其生物可接受率
Table 2 Contents of total phenolics released into digestive fluid and their bioaccessibility during in vitro digestion of P.mume

消化前多酚含量/[mg GAE·(g·DW)-1]胃消化多酚含量/[mg GAE·(g·DW)-1]小肠消化多酚含量/[mg GAE·(g·DW)-1]生物接受率/%青梅10.72±0.23a3.10±0.13b1.00±0.04c9.33
注:不同小写字母表示组间差异显著(P<0.05)
青梅的多酚含量高于罗鸣等[15]测得的结果,这可能是本实验同时提取结合酚导致,也可能是产地、采摘时间和成熟度等因素造成的差异。青梅的胃和小肠消化液中多酚含量显著低于化学试剂提取的含量,与文献报道中黑莓的变化趋势一致[16]。这表明酚类物质在消化过程中的释放与化学试剂从果实直接提取存在显著性差异。另一个可能的原因是多酚的完全释放受消化环境的影响,并不都是在胃和小肠消化阶段中为人体所消化利用。有研究表明,膳食多酚在人体的吸收特性与其存在形式相关,游离态酚的消化吸收部位主要是胃和小肠,而结合态酚主要在结肠部位,被肠道菌群及其生物酶代谢,供人体吸收。由于不同食品中酚类物质的组成和含量不同,其酚类物质的生物可接受率也不同。不同种类水果酚类物质在消化过程中的消化释放机制也存在差异。有学者[17]报道新鲜蓝莓的生物可接受率为11.5%,黑莓的生物可接受率为15.29%。本研究中青梅多酚的生物可接受率为9.33%,低于蓝莓等水果。原因可能是青梅中的酚类物质结构不稳定,例如在弱碱性环境下,原花青素和表儿茶素等黄酮类物质不稳定而发生降解[18]。另外,可能仍有多酚截留在食物基质中,随着消化道进入了结肠部位。
2.2 青梅单体酚在体外消化过程中组成含量和生物可接受率
为进一步分析青梅在体外消化过程中单体酚的组成含量变化,通过UPLC-Q-Exactive Orbitrap/MS,在青梅多酚提取物中共鉴定出10种单体物质(图1和表3),包括7种酚酸(新绿原酸、绿原酸、隐绿原酸、对羟基苯甲酸、p-香豆酸、阿魏酸和异阿魏酸)和3种黄酮(原儿茶素B1、表儿茶素和芦丁)。由于地区、提取工艺和检测手段的不同,青梅多酚的单体物质鉴定结果存在差异。夏道宗[19]通过HPLC分析青梅乙酸乙酯提取物的单体酚物质,其中绿原酸类含量最高,与本研究结果一致。SHIN等[5]在青梅乙醇提取物中鉴定出橙皮苷和芹菜素-7-葡萄糖苷。在本研究中(表4),青梅的主要成分为新绿原酸 (220.94±14.32)mg/100 g DW,其次为表儿茶素(43.25±2.40)mg/100 g DW、异阿魏酸(36.75±4.24)mg/100 g DW和p-香豆酸(32.42±2.85)mg/100 g DW,其他单体酚化合物含量在2.12~20.36 mg/100 g DW。对羟基苯甲酸的生物可接受率最高,其次为芦丁、p-香豆酸和隐绿原酸等。不同食物的单体酚物质,因与食物基质结合程度不同、截留在植物结构中的方式不同和自身性质的差异,在胃和小肠消化过程中表现的含量不同[20]。在本研究中,青梅单体酚酸(除隐绿原酸)的含量经胃和小肠消化后均出现不同程度的下降(表4)。其中,隐绿原酸的含量显著增加,原因可能是绿原酸类物质的结构含有不稳定的酯键和双键较易受消化环境的影响,发生同分异构体的转化[21],进而导致在胃消化阶段绿原酸和新绿原酸含量降低,隐绿原酸含量增加。有研究报道,体系中酸和碱的变化能使分子发生外消旋作用,进而改变手性异构的产物[20]。TENORE等[22]研究茶叶多酚在体外消化过程中的变化,表明黄酮类物质在肠液的弱碱性条件下,易发生氧化、降解等反应。本研究中单体黄酮类物质(表儿茶素、原花青素B1和芦丁)含量降低原因可能是对胃和小肠消化过程pH发生变化敏感,且消化体系中的溶解氧也能导致表儿茶素和原花青素B1等多聚体自氧化[20]。
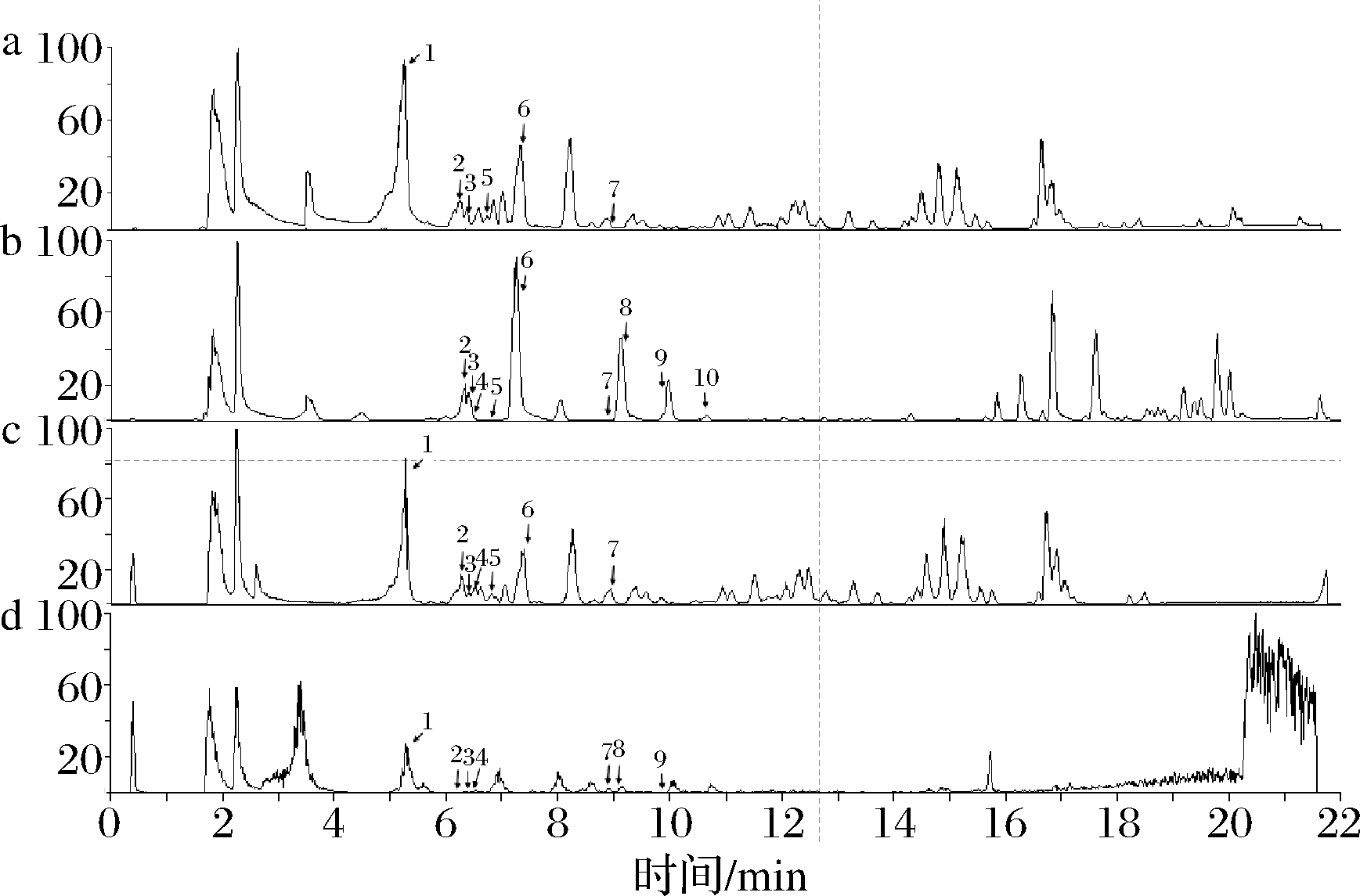
a-青梅游离酚;b-结合酚;c-胃消化液;d-肠消化液
图1 酚质谱总离子流图(TICs)
Fig.1 Total ion chromatograms (TICs)
表3 单体酚类物质的离子碎片
Table 3 Identification of individual phenolics from P.mume by UPLC-Q-Exactive Orbitrap/MS

峰序号保留时间多酚物质分子式母离子二级质谱碎片15.16新绿原酸C16H18O9353.087 34191.054 98, 179.034 3926.2绿原酸C16H18O9 353.087 52191.055 2836.42隐绿原酸C16H18O9 353.087 83173.044 66, 191.055 47, 135.044 2146.51对羟基苯甲酸C7H5O3137.021 5693.033 22;109.027 7289.02p-香豆酸C9H8O3163.038 57119.040 0899.78阿魏酸C10H10O4193.049 44178.026 46, 149.059 8656.7原花青素B1C30H26O12577.134 71289.072 49, 125.023 31;451.104 3867.29表儿茶素C15H14O6289.071 38245.082 06, 205.049 5578.92芦丁C27H30O16609.146 61300.027 521010.53异阿魏酸C10H10O4193.049 8178.026 47, 134.036 27
表4 青梅多酚单体在体外消化过程中的释放量及其生物可接受率
Table 4 Changes of individual phenolics content in P.mume during simulated digestion in vitro

名称未消化/[mg·(100 g)-1 DW]胃消化/[mg·(100 g)-1 DW]小肠消化/[mg·(100 g)-1 DW]生物可接受率/%对羟基苯甲酸2.12±0.040.23±0.011.34±0.1963.2p-香豆酸32.42±2.85-2.64±0.918.14隐绿原酸2.99±0.308.55±1.780.08±0.052.68绿原酸20.36±1.6818.03±3.070.11±0.050.54新绿原酸220.94±14.32158.19±15.180.31±0.160.14
续表4

名称未消化/[mg·(100 g)-1 DW]胃消化/[mg·(100 g)-1 DW]小肠消化/[mg·(100 g)-1 DW]生物可接受率/%阿魏酸6.75±0.84-0.17±0.112.52表儿茶素43.25±2.4023.99±2.37--芦丁4.56±0.931.46±0.121.00±0.1521.93异阿魏酸36.75±4.24---原花青素 B110.41±1.532.02±0.6--
2.3 青梅在体外消化过程中抗氧化活性的变化
如表5所示,青梅的ABTS和DPPH抗氧化值在体外消化中均出现显著性下降(P<0.05)。未消化的青梅ABTS抗氧化值为(16.03±1.00)mg TE/g DW,在体外胃和小肠消化过程中,胃消化液的ABTS抗氧化值为(2.02±0.29)mg TE/g DW,小肠消化液的ABTS 抗氧化值仅为(0.30±0.08)mg TE/g DW。青梅的DPPH抗氧化值与ABTS抗氧化值变化趋势一致,未消化的青梅DPPH抗氧化值为(14.65±1.40)mg TE/g DW,青梅体外胃和小肠消化液的DPPH抗氧化值分别为(2.05±0.04)和(0.32±0.02)mg TE/g DW。
表5 体外模拟消化过程中青梅的抗氧化活性 单位:mg TE/g DW
Table 5 Antioxidant activity of P.mume during simulated digestion in vitro
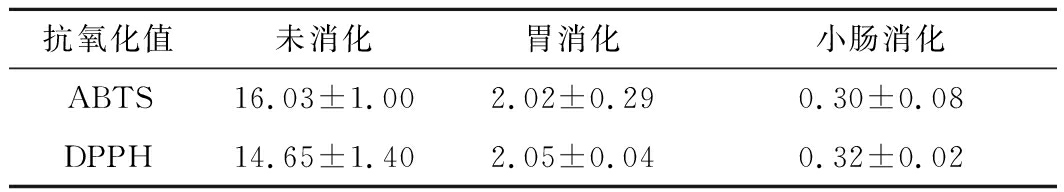
抗氧化值未消化胃消化小肠消化ABTS16.03±1.002.02±0.290.30±0.08DPPH14.65±1.402.05±0.040.32±0.02
酚类物质是青梅的重要活性物质,能通过单电子和氢原子转移有效清除自由基,在生理和细胞水平上能有效防止氧化损伤。目前体外抗氧化评价方法按照反应机制的不同,主要分为基于氢离子转移机制(hydrogen atom transfer,HAT)和基于单电子转移机制(single electron transfer mechanism,SET)的评价方法[21]。HAT法反映以提供氢离子的方式发挥抗氧化活性的能力,SET法则表示通过转移电子的方式清除自由基的能力[10]。本研究选取了兼具HAT和SET机制的DPPH自由基和ABTS阳离子自由基清除能力评价方法。
有研究表明,天然食物的抗氧化能力与多酚含量呈正相关。不同果品的植物结构、多酚组成含量及其与其他物质如蛋白质等的相互作用不同,抗氧化能力存在差异。钱井[23]测定35种柑橘的抗氧化活性,DPPH抗氧化值为5.48~21.11 mg TE/g;曾少敏[24]研究表明,梨的ABTS抗氧化值为1.54 mg TE/g。青梅的DPPH和ABTS抗氧化能力分别为14.65和16.03 mg TE/g,清除自由基能力远高于香梨,与柑橘相当。可能原因是青梅含量较高的单体酚是新绿原酸和咖啡酸,已有研究表明绿原酸类和咖啡酸具有良好的自由基清除能力[25]。
胃和小肠消化后,青梅消化液的DPPH和ABTS抗氧化值出现显著降低(P<0.05),且与多酚含量变化趋势一致,具有极显著相关(P<0.01)。多酚含量与ABTS、DPPH抗氧化值的相关系数分别为0.935和0.949,表明抗氧化活性降低可能是与酚类物质在体外消化的损失有关。酚类物质在弱碱性环境不稳定,且易与蛋白质等大分子络合,降低其在消化液的溶解性,进而降低抗氧化能力。本研究结果中,原花青素B1、对羟基苯甲酸、阿魏酸和芦丁等单体物质的含量在体外消化过程中显著下降,进一步通过SPSS软件进行相关性检验发现,在体外消化过程中,青梅的ABTS抗氧化值与原花青素B1、p-香豆酸、阿魏酸和芦丁的相关性系数分别为1.000、0.988、0.994和0.959;DPPH抗氧化值与原花青素B1、对羟基苯甲酸、阿魏酸和芦丁分别为0.997、0.986、0.992和0.974,均呈显著性相关(表6),这表明原花青素B1、p-香豆酸、阿魏酸和芦丁可能是青梅抗氧化活性的主要贡献物质。
表6 模拟消化过程中青梅多酚释放量与抗氧化活性的关系
Table 6 Relationships between polyphenol release and antioxidant activity of P.mume during simulated digestion
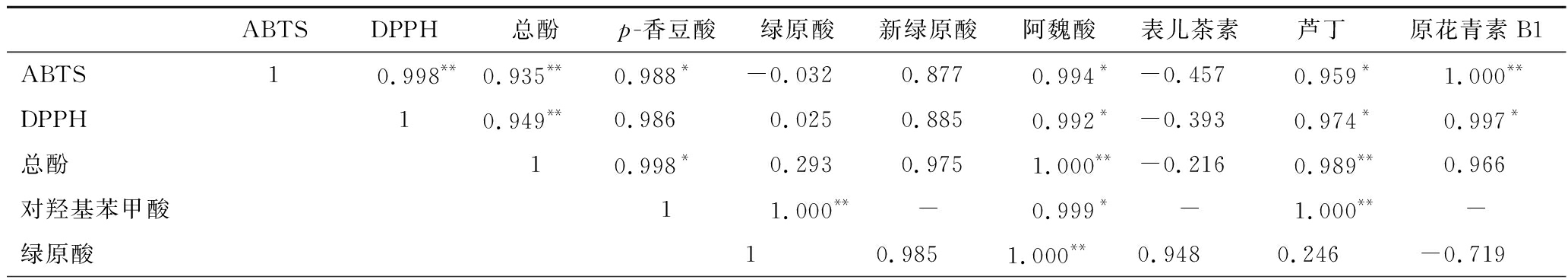
ABTSDPPH总酚p-香豆酸绿原酸新绿原酸阿魏酸表儿茶素芦丁原花青素B1ABTS1 0.998**0.935**0.988*-0.032 0.877 0.994*-0.457 0.959* 1.000**DPPH10.949**0.986 0.025 0.885 0.992*-0.393 0.974* 0.997*总酚10.998* 0.293 0.975 1.000**-0.216 0.989** 0.966对羟基苯甲酸1 1.000**- 0.999*- 1.000**-绿原酸10.9851.000**0.948 0.246-0.719
续表6

ABTSDPPHTPCp-香豆酸绿原酸新绿原酸阿魏酸表儿茶素芦丁原花青素B1新绿原酸1-1.000**0.9201.000**阿魏酸1- 1.000**-表儿茶素1-0.115 -0.461芦丁10.935原花青素B11
注:*表示为显著相关性(P<0.05);**表示为极显著相关性(P<0.01)
3 结论
本研究采用INFOGEST 2.0体外静态模拟胃肠道消化模型,研究青梅在消化过程中酚类化合物的释放量和抗氧化活性的变化,青梅总酚含量、单体酚含量在胃消化阶段比小肠消化阶段高,表明其在胃消化阶段释放量高且稳定,而在小肠消化阶段降解相对较多。此外,模拟消化过程中青梅多酚释放量与ABTS和DPPH抗氧化值存在显著正相关,表明酚类化合物是青梅中主要的抗氧化活性物质。该研究从模拟人体胃肠道消化角度对青梅酚类化合物的生物可接收率及其抗氧化性进行了全面系统的评估,为青梅的健康作用及相关产品开发应用提供科学依据。
[1] 邢晨, 王俐娟, 王晓琴.可食用植物不同形态酚类化合物研究进展[J].食品科学, 2020, 41(5):266-275.
XING C, WANG L J, WANG X Q.Recent studies on free and bound phenolic compounds in edible plants:A review[J].Food Science, 2020, 41(5):266-275.
[2] TUFAN A N, ÇELIK S E, ÖZYÜREK M, et al.Direct measurement of total antioxidant capacity of cereals:QUENCHER-CUPRAC method[J].Talanta, 2013, 108:136-142.
[3] AYOUB M, DE CAMARGO A C, SHAHIDI F.Antioxidants and bioactivities of free, esterified and insoluble-bound phenolics from berry seed meals[J].Food Chemistry, 2016, 197:221-232.
[4] 姚增玉. 山杏种皮黑色素提取及其性质研究[D].杨凌:西北农林科技大学, 2007.
YAO Z Y.Isolation and characterization of melanin from testae of wild apricots[D].Yangling:Northwest A & F University, 2007.
[5] SHIN E J, HUR H J, SUNG M J, et al.Ethanol extract of the Prunus mume fruits stimulates glucose uptake by regulating PPAR-γ in C2C12 myotubes and ameliorates glucose intolerance and fat accumulation in mice fed a high-fat diet[J].Food Chemistry, 2013, 141(4):4 115-4 121.
[6] YAN X T, LEE S H, LI W, et al.Evaluation of the antioxidant and anti-osteoporosis activities of chemical constituents of the fruits of Prunus mume[J].Food Chemistry, 2014, 156:408-415.
[7] 马嫄, 罗鸣, 殷晓翠, 等.果梅的化学成分及应用研究进展[J].食品工业科技, 2018, 39(4):337-341;352.
MA Y, LUO M, YIN X C, et al.Research advances in chemical components of Prunus mume and its applications[J].Science and Technology of Food Industry, 2018, 39(4):337-341;352.
[8] CHEN G L, CHEN S G, ZHAO Y Y, et al.Total phenolic contents of 33 fruits and their antioxidant capacities before and after in vitro digestion[J].Industrial Crops and Products, 2014, 57:150-157.
[9] JANG A J, LEE J H, YOTSU-YAMASHITA M, et al.A novel compound, “FA-1” isolated from Prunus mume, protects human bronchial epithelial cells and keratinocytes from cigarette smoke extract-induced damage[J].Scientific Reports, 2018, 8:11504.
[10] 汪芙蓉. 体外模拟消化对酚类化合物稳定性和抗氧化活性的影响[D].南昌:南昌大学, 2020.
WANG F R.Stability and antioxidant activity of phenolic compounds during in vitro digestion[D].Nanchang:Nanchang University, 2020.
[11] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1 014.
[12] LI W, YANG R L, YING D Y, et al.Analysis of polyphenols in apple pomace:A comparative study of different extraction and hydrolysis procedures[J].Industrial Crops and Products, 2020, 147:112250.
[13] HE Z Y, TAO Y D, ZENG M M, et al.High pressure homogenization processing, thermal treatment and milk matrix affect in vitro bioaccessibility of phenolics in apple, grape and orange juice to different extents[J].Food Chemistry, 2016, 200:107-116.
[14] VEL ZQUEZ E, TOURNIER H A, DE BUSCHIAZZO P M, et al.Antioxidant activity of Paraguayan plant extracts[J].Fitoterapia, 2003, 74(1-2):91-97.
ZQUEZ E, TOURNIER H A, DE BUSCHIAZZO P M, et al.Antioxidant activity of Paraguayan plant extracts[J].Fitoterapia, 2003, 74(1-2):91-97.
[15] 罗鸣, 张桂容, 罗钰婕, 等.不同干燥方式对青梅品质的影响[J].食品与发酵工业, 2018, 44(10):152-159.
LUO M, ZHANG G R, LUO Y J, et al.Effects of different drying methods on the quality of plum[J].Food and Fermentation Industries, 2018, 44(10):152-159.
[16] 李滨旭. 黑莓酚类物质抗氧化活性及体外模拟消化研究[D].沈阳:沈阳农业大学, 2020.
LI B X.Study on antioxidant activity of blackberry phenolic compounds and in vitro simulated digestion[D].Shenyang:Shenyang Agricultural University, 2020.
[17] GODAGAMA UDAHA WALAUWE UTHTHARA PUBUDU KUMARI, GUNATHILAKE K D P P.In vitro bioaccessibility and antioxidant activity of black plum (Syzygium caryophyllatum)[J].Journal of Food Biochemistry, 2020, 44(12):e13499.
[18] 刘国艳, 张洁, 徐鑫, 等.体外消化对芹菜黄酮混合物和单体的含量及抗氧化应激能力的影响[J].食品科学, 2018, 39(18):8-14.
LIU G Y, ZHANG J, XU X, et al.Changes in total and individual flavonoid contents from celery and antioxidative stress ability after in vitro digestion[J].Food Science, 2018, 39(18):8-14.
[19] 夏道宗. 青梅有效部位防治高尿酸血症和痛风的作用及机制研究[D].杭州:浙江大学, 2010.
XIA D Z.Study on the effective fractions from Prunus mume to treat hyperuricemia and gout and their mechanisms[D].Hangzhou:Zhejiang University, 2010.
[20] 王娟, 李莎怡静, 张佳欣, 等.消化过程中多酚类物质的稳定性研究进展[J].粮食与饲料工业, 2020(3):33-37.
WANG J, LI S Y J, ZHANG J X, et al.Research progress on stability of polyphenols during digestion[J].Cereal & Feed Industry, 2020(3):33-37.
[21] 陈希苗. 炮制山楂酚类物质及新生成分的分析鉴定与功能评价[D].广州:华南农业大学, 2018.
CHEN X M.Analysis and functional evaluation of phenols and new compounds in processed hawthorn[D].Guangzhou:South China Agricultural University, 2018.
[22] TENORE G C, CAMPIGLIA P, GIANNETTI D, et al.Simulated gastrointestinal digestion, intestinal permeation and plasma protein interaction of white, green, and black tea polyphenols[J].Food Chemistry, 2015, 169:320-326.
[23] 钱井. 柑橘黄酮类化合物组分鉴定与抗氧化活性研究[D].杭州:浙江大学, 2017.
QIAN J.Determination and antioxidant evaluation of flavonoids compounds from different citrus cultivars[D].Hangzhou:Zhejiang University, 2017.
[24] 曾少敏. 梨果实主要酚类物质含量及抗氧化活性研究[D].北京:中国农业科学院, 2013.
ZENG S M.Study on the major phenolic contents and antioxidant activities in pear fruits[D].Beijing:Chinese Academy of Agricultural Sciences, 2013.
[25] 邢慧颖, 黄莉, 丁波, 等.体外消化对不同极性植物多酚的抗氧化能力及生物利用度的影响[J].食品与发酵工业, 2020, 46(16):70-77.
XING H Y, HUANG L, DING B, et al.Effects of in vitro digestion on antioxidant activity and bioavailability of plant polyphenols with different polarities[J].Food and Fermentation Industries, 2020, 46(16):70-77.