三萜类化合物是以环戊烷骈多氢菲为母核的天然产物,广泛分布于自然界中,不仅是维持宿主自身生命活动的必需物,还是新药发现的重要来源。三萜结构的多样性决定了其丰富的药理活性,如保肝、抗炎、抗氧化、抗肿瘤、抗糖尿病、免疫调节等[1-5]。
三萜类化合物在植物或真菌中的天然产量极低,且非模式生物遗传操作体系的不成熟导致原生宿主的代谢改造较为困难,无法从天然原料中获得足量三萜满足市场需求,其复杂多样的化学结构又导致化学合成法难以推动,阻碍了三萜类化合物的深入研究与广泛应用[6]。因此,在易操作的异源宿主中进行生物合成是实现三萜类化合物高效生产的一个有吸引力的策略。大肠杆菌作为表达宿主的应用已经非常广泛,具有遗传背景清晰、遗传操作简单、生长迅速、成本低、易于控制和大规模发酵等优点,此外大肠杆菌中萜烯合成途径简单线性,基本不分流三萜前体[7],已被用作多种三萜类化合物合成的细胞工厂,如达玛烯二醇-Ⅱ[8]、龙涎香醇[9]、β-香树脂醇和环阿屯醇[10]等。
大肠杆菌中的甲基赤藓糖醇磷酸(2-C-methyl-D-erythrito-4-phosphate,MEP)途径可以为三萜类化合物的合成提供前体法尼基焦磷酸(farnesyl pyrophosphate, FPP),FPP可经鲨烯合酶(squalene synthase,SQS)和鲨烯环氧酶(Squalene epoxidase,SE)催化生成2,3-环氧角鲨烯,在不同的氧化鲨烯环化酶(oxidosqualene cyclase, OSCs)作用下环化形成各种类型的骨架。羊毛甾醇是主要的三萜骨架,可以通过一系列细胞色素P450的官能化修饰衍生为羊毛甾烷型、麦角甾烷型、胆甾烷型等类型的三萜及甾体类化合物[11]。目前已有在大肠杆菌中合成角鲨烯和2,3-环氧角鲨烯的研究,KATABAMI等[12]通过在大肠杆菌中表达人源SQS实现了角鲨烯的合成,LI等[8]和邵喜喜等[13]将酵母SQS分别与来源于荚膜甲基球菌和大鼠的SE共表达,在大肠杆菌中实现了2,3-环氧角鲨烯的合成。然而尚未有大肠杆菌合成羊毛甾醇的报道,本研究设想在大肠杆菌中构建并优化三萜骨架羊毛甾醇合成途径,为三萜类化合物的异源生物合成提供参考与借鉴(图1)。
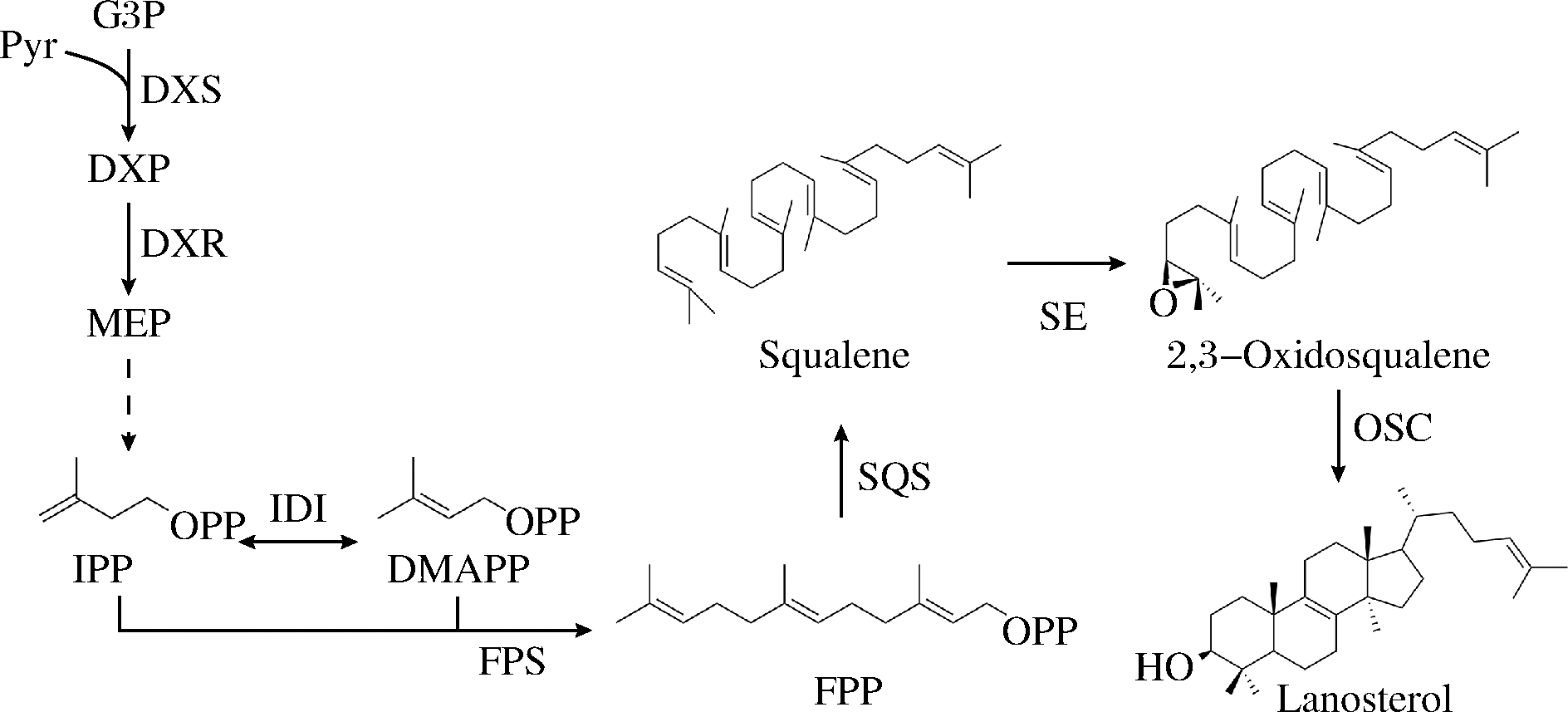
图1 大肠杆菌工程菌中羊毛甾醇合成途径的构建
Fig.1 Biosynthetic pathway of lanosterol in the engineered E.coli
1 材料与方法
1.1 实验材料
1.1.1 主要材料与试剂
质粒pET28a(+)、pCDF-DUET-1,大肠杆菌菌株JM109、BL21(DE3),酿酒酵母菌株W303-1a均为实验室保存;荚膜甲基球菌鲨烯环氧酶McSE和氧化鲨烯环化酶McOSC的基因,苏州金唯智生物科技有限公司。
硫酸卡那霉素(kanamycin sulfate, Kan)、硫酸链霉素(streptomycin sulfate, Str)、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG),上海生工生物工程有限公司;角鲨烯标准品,上海麦克林生化科技股份有限公司, 2,3-环氧角鲨烯标准品,美国Sigma公司,羊毛甾醇标准品,梯希爱(上海)化成工业发展有限公司。
LB固体培养基(g/L):NaCl 10,胰蛋白胨 10,酵母提取物 5,琼脂20。
TB培养基(g/L):KH2PO4 2.31,K2HPO4 12.54,胰蛋白胨 12,酵母提取物24,甘油4,pH值7.5。
1.1.2 主要仪器与设备
C1000型PCR仪、164-5070型核酸电泳仪,美国Bio-Rad公司;5200Multi型凝胶成像系统,上海Tanon科技有限公司;5424型离心机,德国Eppendorf公司;UV-1600型紫外分光光度计,美国Thermo Science公司;JY92-IIN型超声破碎仪,宁波新芝生物科技股份有限公司;1260 Infinity Ⅱ型高效液相色谱仪,美国Agilent公司;Pegasus BT气相-高通量飞行时间质谱仪,美国Leco公司。
1.2 实验方法
1.2.1 质粒构建
改造pET28a(+)载体,在NotI和XhoI位点之间再插入1个T7启动子区域,得到改造后的双T7启动子载体,命名为pET28T。以酿酒酵母W303-1a基因组为模板克隆截短的鲨烯合酶基因Scsqs,并在5′端引入RBS结合位点,插入pET28T载体的XbaI和BamHI位点之间,构建了质粒pET28T-tSS。荚膜甲基球菌鲨烯环氧酶基因Mcse经大肠杆菌密码子优化后合成,亚克隆至pET28T-tSS的BamHI和SacI位点之间,构建了质粒pET28T-tSSE。
在pCDF-DUET-1载体的BamHI和EcoRI位点之间引入促溶标签TrxA,改造后的载体命名为pDX。荚膜甲基球菌氧化鲨烯环化酶基因Mcosc经大肠杆菌密码子优化后合成至pDX的SacI和NotI位点之间,构建了质粒pDXOSC。
从大肠杆菌基因组克隆了MEP途径关键酶基因1-脱氧-D-木酮糖-5-磷酸合酶基因dxs、法尼基焦磷酸合酶基因ispA、异戊烯焦磷酸异构酶基因idi,分别插入pET28T-tSSE的KpnI和XhoI位点之间,构建了质粒pET28T-tSSED、pET28T-tSSEA、pET28T-tSSEI。通过融合PCR将dxs和ispA扩增为dxs-ispA融合片段,插入pET28T-tSSE的KpnI和XhoI位点之间,构建了质粒pET28T-tSSEDA,本研究使用的引物见表1,所构建的质粒和菌株见表2。

1.2.2 菌株与培养条件
大肠杆菌JM109作为克隆菌株,BL21(DE3)作为蛋白表达和产物合成的宿主菌。将构建的质粒通过化学转化法转入JM109中,涂布于在LB固体培养基上,倒置于37 ℃培养箱中过夜培养。通过菌落PCR和测序验证筛选重组菌株,挑取验证正确的单克隆于10 mL的LB液体培养基中,37 ℃,220 r/min过夜培养,然后将发酵液以2%(体积分数)的接种量接种到50 mL的TB培养基中,37 ℃,220 r/min培养2~3 h。当OD600达0.6~0.8时,添加终浓度为0.3 mmol/L的诱导剂IPTG,20 ℃诱导48 h。培养基中根据需要添加抗生素(终质量浓度均为50 mg/L的硫酸卡那霉素和/或链霉素)。测序工作均由苏州金唯智生物科技有限公司完成。
1.2.3 产物的提取与测定
取20 mL发酵液,4 ℃,8 000 r/min离心5 min,弃上清液,沉淀中加入10 mL超纯水涡旋打散,4 ℃,8 000 r/min离心5 min,弃净上清液,再用5 mL丙酮重悬菌体,在冰水浴中进行超声波破碎萃取羊毛甾醇,设定为超声波破碎功率300 W,工作10 s,间歇10 s,共超声波处理20 min。将萃取液于8 000 r/min离心5 min,上清液用0.22 mm有机滤膜过滤,-20 ℃静置过夜后12 000 r/min离心5 min,将上清液转移至洁净离心管内,用N2流吹干,再加入2 mL丙酮复溶管壁残余物质。
表2 本研究构建的质粒与菌株
Table 2 Plasmids and strains constructed in this study

名称相关特性质粒pET28TPBR322 ori;kanR;PT7*2pET28T-tSSPBR322 ori;kanR;PT7*2:: tScsqspET28T-tSSEPBR322 ori;kanR;PT7*2:: tScsqs, McsepET28T-tSSEDPBR322 ori;kanR;PT7*2:: tScsqs, Mcse, dxspET28T-tSSEAPBR322 ori;kanR;PT7*2:: tScsqs, Mcse, ispApET28T-tSSEIPBR322 ori;kanR;PT7*2:: tScsqs, Mcse, idipET28T-tSSEDAPBR322 ori;kanR;PT7*2:: tScsqs,Mcse, dxs-ispApDXCloDF13 ori;StrR;PT7*2pDXOSCCloDF13 ori;StrR;PT7*2:: Mcosc菌株BTBL21 (DE3),含有pET28T质粒BT-tSSBL21 (DE3),含有pET28T-tSS质粒BT-tSSEBL21 (DE3),含有pET28T-tSSE质粒BTDBL21 (DE3),含有pET28T和pDX质粒BT-tSSE-DXOSCBL21 (DE3),含有pET28T-tSSE和pDXOSC质粒BT-tSSED-DXOSCBL21 (DE3),含有pET28T-tSSED和pDXOSC质粒BT-tSSEA-DX-OSCBL21 (DE3),含有pET28T-tSSEA和pDXOSC质粒BT-tSSEI-DXOSCBL21 (DE3),含有pET28T-tSSEI和pDXOSC质粒BT-tSSEDA-DX-OSCBL21 (DE3),含有pET28T-tSSEDA和pDXOSC质粒
通过HPLC检测角鲨烯和2,3-环氧角鲨烯。色谱柱:Waters C18柱;色谱条件:柱温30 ℃,流动相为V(乙腈)∶V(甲醇)=6∶4,流速1 mL/min,紫外检测波长为203 nm,进样体积20 mL,等度洗脱。通过GC-MS检测羊毛甾醇,检测条件参考LI等[14]的研究。
1.2.4 工程菌株生产羊毛甾醇的发酵条件优化
发酵条件对菌株生长和产物积累影响重大,本文从pH、IPTG浓度和诱导温度3个因素进行研究,得出重组菌株的最适发酵条件。以BT-tSSEDA-DXOSC作为待试菌株,以胞内羊毛甾醇的产量为指标,在TB培养基的基础上进行单因素试验设计:在诱导温度为20 ℃,IPTG浓度为0.3 mmol/L的条件下,设置各实验组初始pH分别为6.0、6.5、7.0、7.5、8.0;在初始pH为7.5,IPTG浓度为0.3 mmol/L的条件下,设置诱导温度分别为16、20、25、30、37 ℃;在初始pH为7.5,诱导温度20 ℃的条件下,设置IPTG终浓度分别为0.05、0.1、0.3、0.5、1.0、1.5、2.0 mmol/L。根据单因素试验结果,各因素选取3个最佳水平进行正交试验,确定重组菌株生产羊毛甾醇的最佳发酵条件组合。
2 结果与分析
2.1 大肠杆菌角鲨烯及2,3-环氧角鲨烯合成途径的构建
将质粒pET28T-tSS转化入大肠杆菌表达宿主BL21 (DE3)中,生成重组菌株BT-tSS,同时将仅含空质粒pET28T的菌株BT作为对照组(表2)。所构建的工程菌株发酵48 h后用丙酮提取胞内产物进行HPLC分析。HPLC结果显示,菌株BT-tSS在22.3 min处出现角鲨烯特征峰,表明角鲨烯合成模块的成功构建(图2)。
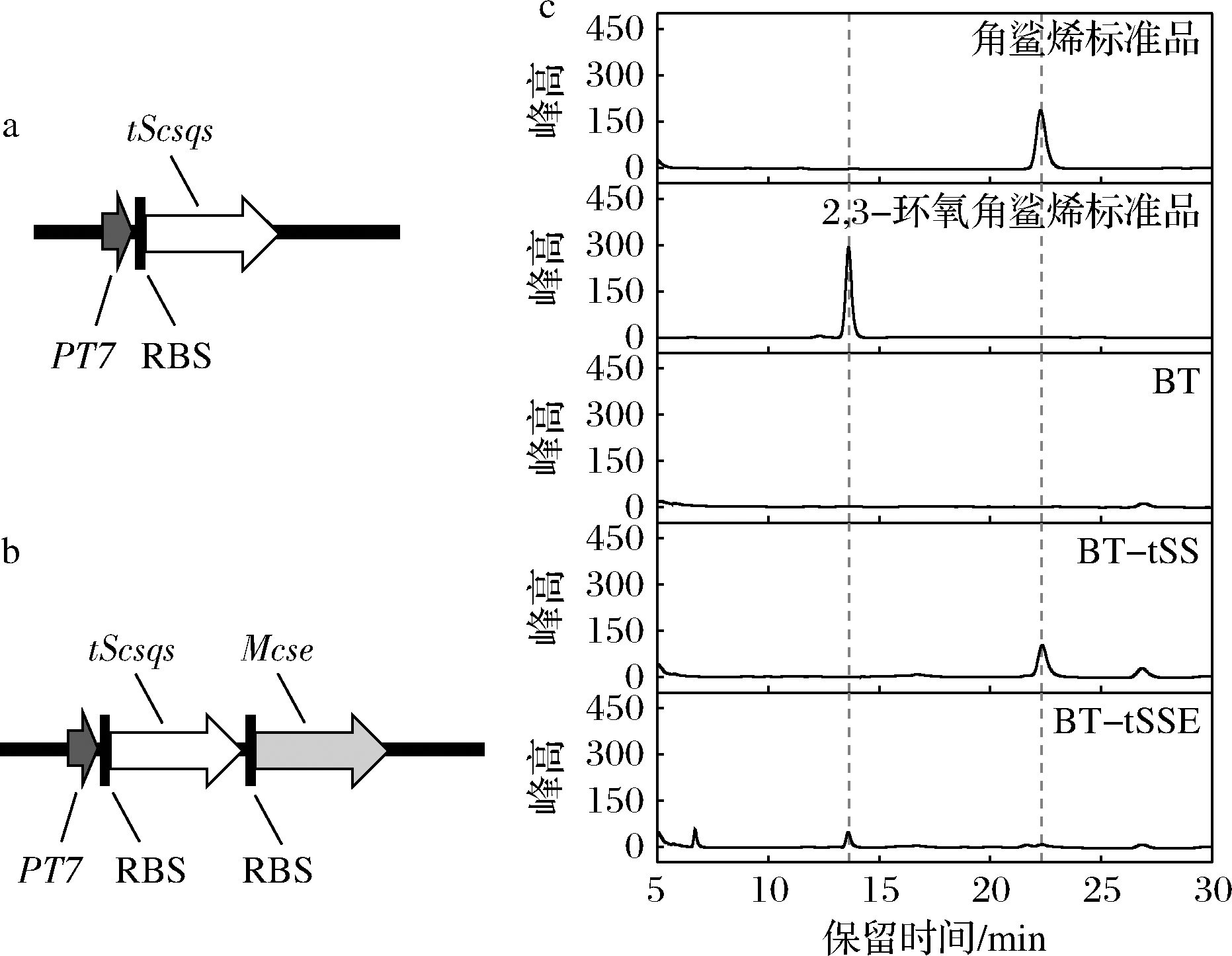
a-角鲨烯合成模块示意图;b-2,3-环氧角鲨烯合成模块示意;c-工程菌株丙酮提取物的HPLC检测
图2 角鲨烯与2,3-环氧角鲨烯合成模块的构建与HPLC检测
Fig.2 Construction of squalene and 2,3-oxidosqualene biosynthesis module and the HPLC analysis.
在此基础上向大肠杆菌中引入McSE,得到菌株BT-tSSE。HPLC结果显示菌株BT-tSSE在13.6 min处出现了2,3-环氧角鲨烯的特征峰,表明2,3-环氧角鲨烯合成模块的成功构建。
2.2 大肠杆菌羊毛甾醇合成途径的构建与优化
真核生物来源的OSC为膜结合蛋白,不适配于无细胞器膜的大肠杆菌表达体系。LAMB等[15]在原核生物荚膜甲基球菌中发现了与真核生物OSC同源的McOSC,在荚膜甲基球菌中表达为可溶形式。NAKANO等[16]在大肠杆菌中异源表达了McOSC,其纯酶能以2,3-环氧角鲨烯为底物生成羊毛甾醇。本研究将McOSC经大肠杆菌密码子优化后合成至载体pDX上得到质粒pDXOSC,再与质粒pET28T-tSSE共转化至大肠杆菌感受态细胞BL21 (DE3)中,获得重组菌株BT-tSSE-DXOSC。将转入空质粒pET28T和pDX的菌株BTD作为对照组,所得菌株发酵48 h后用丙酮提取胞内产物进行GC-MS分析。结果显示在工程菌BT-tSSE-DXOSC在16.8 min处出现了羊毛甾醇特征峰,表明羊毛甾醇合成模块的成功构建(图3)。
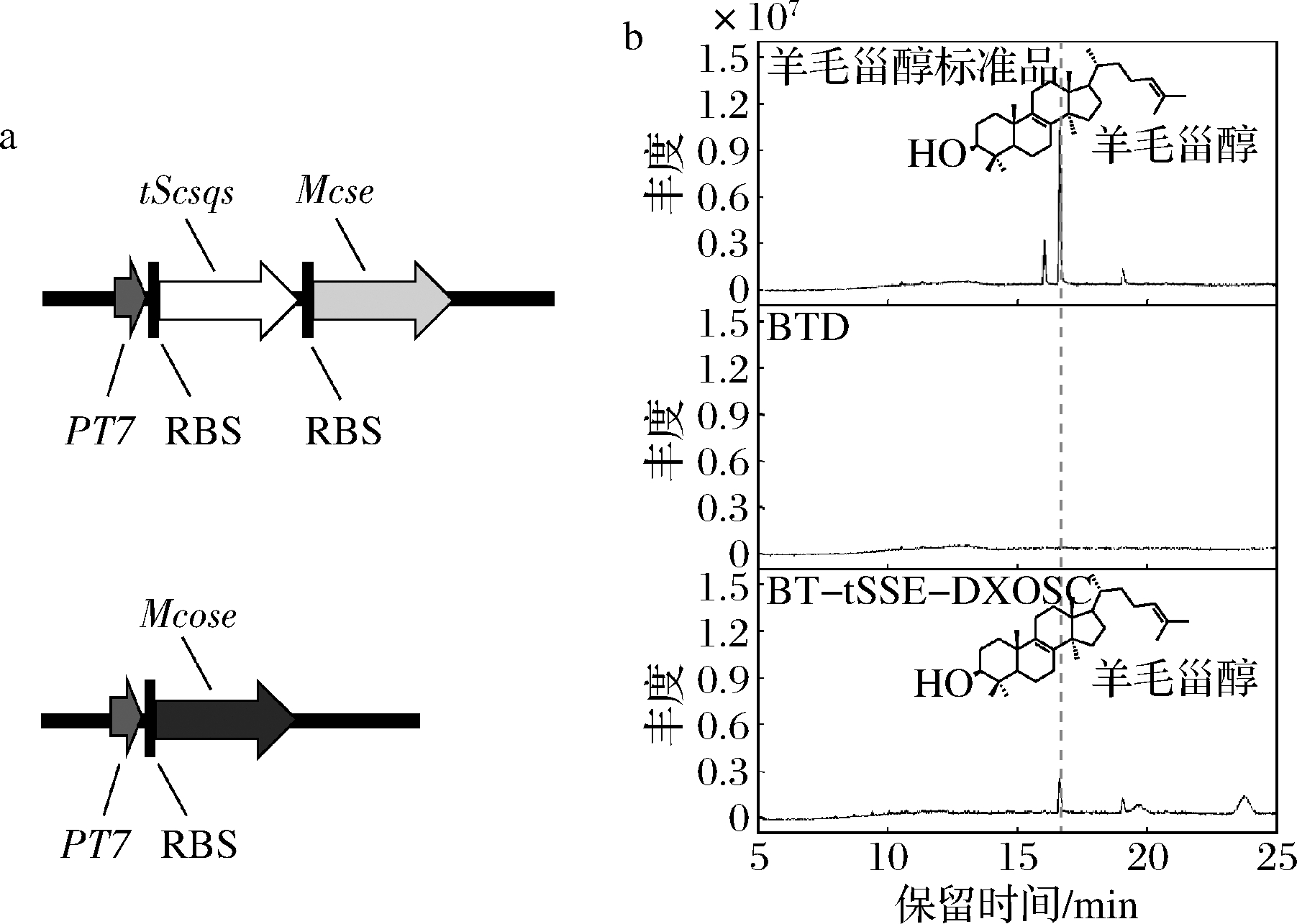
a-羊毛甾醇合成模块示意图;b-工程菌株丙酮提取物的GC-MS检测
图3 羊毛甾醇合成模块的构建与GC-MS检测
Fig.3 Construction of lanosterol biosynthesis module and the GC-MS analysis.
虽然BT-tSSE-DXOSC已有羊毛甾醇生成,但产量仅0.77 mg/L,因此需要对该菌株的羊毛甾醇合成途径进行优化。1-脱氧-D-木酮糖-5-磷酸合酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)和法尼基焦磷酸合酶(farnesyl pyrophosphate synthase,FPS)是三萜类化合物合成的关键限速酶,DXS催化MEP途径的第一步反应,FPS催化萜类共同前体FPP的生成[17-18];异戊烯焦磷酸异构酶(isopentenyl diphosphate isomerase, IDI)催化异戊烯焦磷酸与烯丙基焦磷酸的相互转化,决定二者的配比,从而影响下游产物的合成[19],以上3种途径酶均为代谢改造的重要靶点。目前已有许多研究通过过表达上述关键酶使得萜类物质的产量显著提高[18,20-21]。
本研究在BT-tSSE-DXOSC的基础上分别单独过表达了MEP途径关键酶1-脱氧-D-木酮糖-5-磷酸合酶基因dxs、法尼基焦磷酸合酶基因ispA和异戊烯焦磷酸异构酶基因idi,得到菌株BT-tSSED-DXOSC、BT-tSSEA-DXOSC和BT-tSSEI-DXOSC。上述3株工程菌株在pH值7.5,0.3 mmol/L IPTG,诱导温度20 ℃的条件下的羊毛甾醇产量分别为1.86、1.62和1.50 mg/L,较BT-tSSE-DXOSC各提高了1.4、1.3和1倍。对比可知dxs和ispA过表达对羊毛甾醇生产的促进作用较idi更为明显,因此我们构建了dxs-ispA融合过表达菌株BT-tSSEDA-DXOSC,该菌株的羊毛甾醇产量为2.39 mg/L,较BT-tSSE-DXOSC提高了2.1倍(图4)。
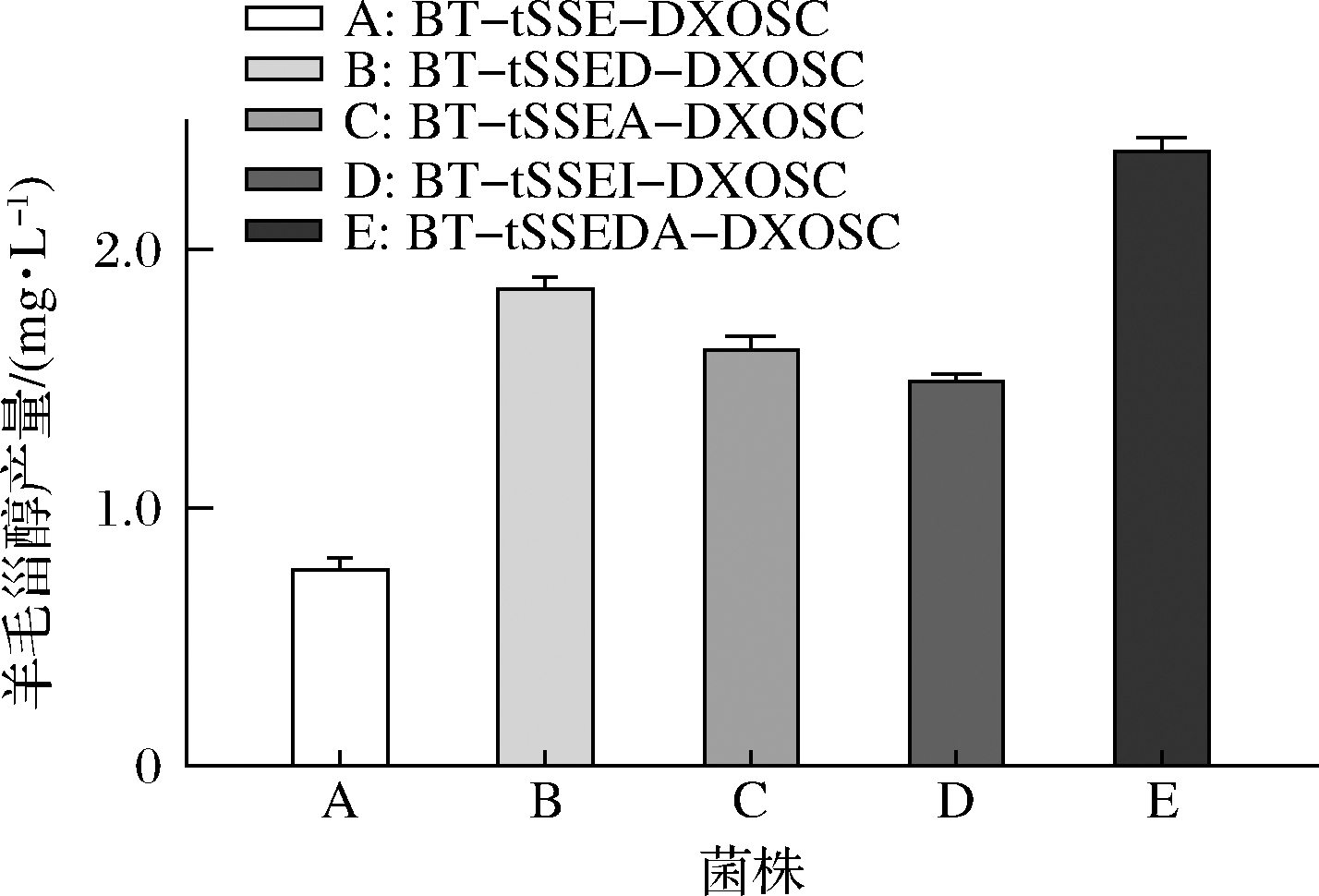
图4 工程菌株羊毛甾醇产量对比
Fig.4 Lanosterol production of different engineered strains
2.3 pH、IPTG浓度、诱导温度对羊毛甾醇产量的影响
随着pH增大,菌体干重和羊毛甾醇产量的变化趋势一致,均为先升高后降低,在pH为7.5时达到最大值,表明pH通过影响菌体生长从而影响羊毛甾醇的生产(图5-a)。随着IPTG浓度增大,菌体干重逐渐降低,羊毛甾醇产量则先升高后降低,IPTG浓度为0.5 mmol/L时达羊毛甾醇产量最高,这是由于IPTG在促进蛋白表达的同时对菌体有一定的毒害作用,且IPTG浓度较高时,蛋白合成速度过快,错误折叠率上升,从而影响了羊毛甾醇的生成(图5-b)。当诱导温度分别为16、20、25、30、37 ℃时,随着诱导温度的升高,菌体干重呈升高趋势,羊毛甾醇产量先升后降,在30 ℃时达到最大值,这是由于37 ℃最适宜大肠杆菌菌体生长,而稍低的温度则更有利于酶蛋白表达进而促进产物生成(图5-c)。
根据单因素试验结果,各因素选择产量最高的3个水平设计正交试验,每组试验重复3次。使用Minitab软件进行正交试验极差分析(表3)和方差分析(表4)。由方差分析可知,pH、IPTG浓度、诱导温度对羊毛甾醇产量均有显著影响(P<0.05)。由极差R值可得,3个因子对羊毛甾醇产量影响的主次顺序为诱导温度(C)>pH(A)>IPTG浓度(B)。根据均值k值得出各因素的最优水平组合,即A2B2C3。
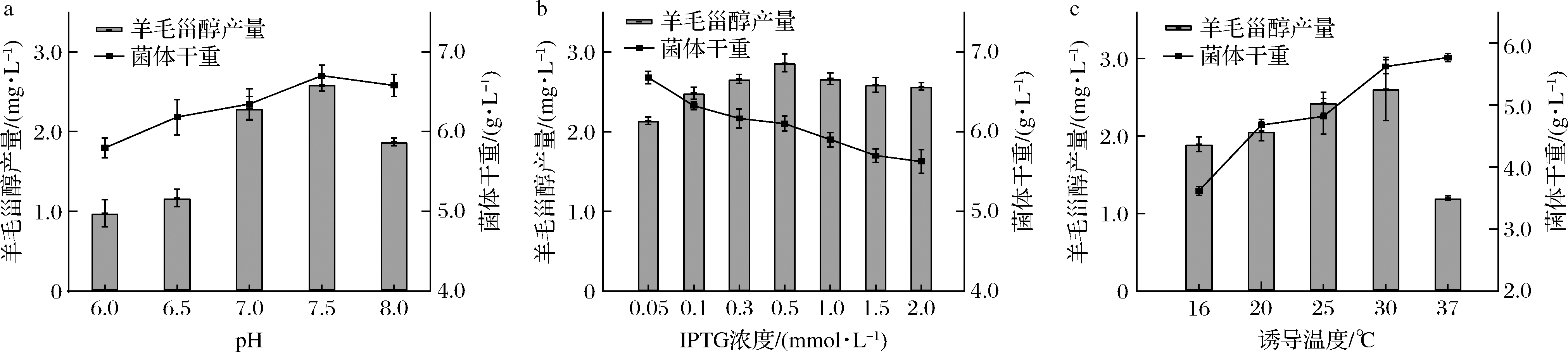
a-pH;b-IPTG浓度;c-诱导温度
图5 pH、IPTG浓度和诱导温度对菌株BT-tSSEDA-DXOSC羊毛甾醇产量的影响
Fig.5 Effect of pH, IPTG concentration and inducing temperature on lanosterol production of strain BT-tSSEDA-DXOSC
表3 大肠杆菌工程菌株发酵条件的正交试验设计及结果
Table 3 The design and results of the orthogonal experiment for fermentation condition to engineered E.coli
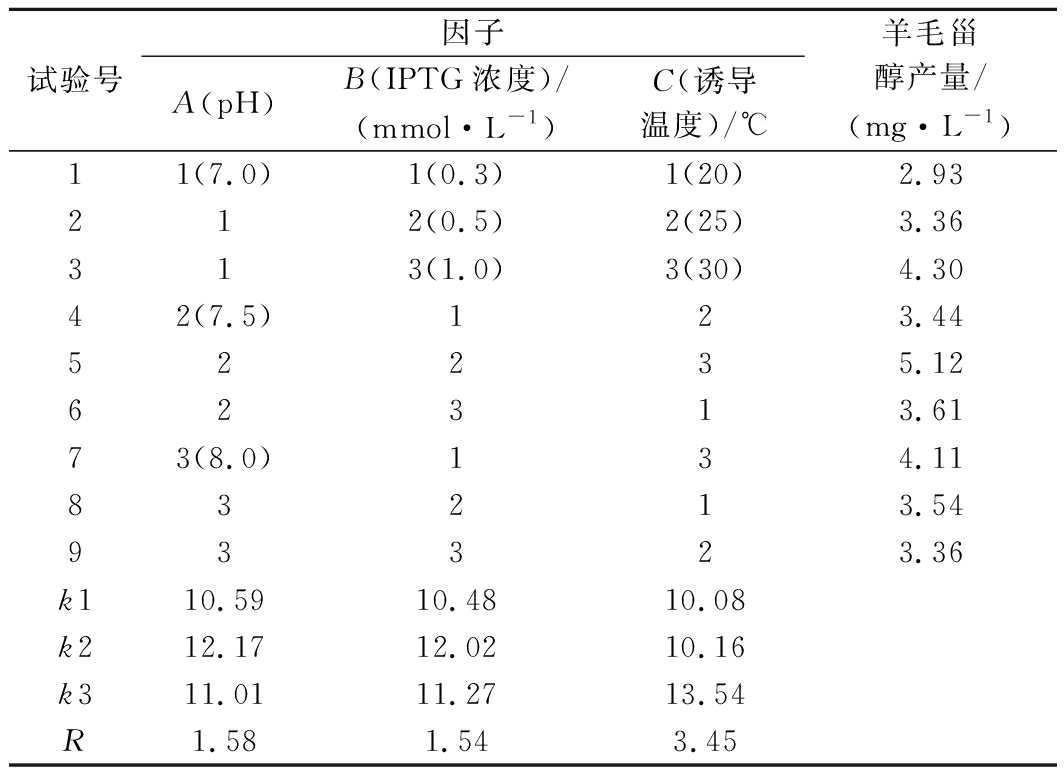
试验号因子A(pH)B(IPTG浓度)/(mmol·L-1)C(诱导温度)/℃羊毛甾醇产量/(mg·L-1)11(7.0)1(0.3)1(20)2.93212(0.5)2(25)3.36313(1.0)3(30)4.3042(7.5)123.4452235.1262313.6173(8.0)134.1183213.5493323.36k110.5910.4810.08k212.1712.0210.16k311.0111.2713.54R1.581.543.45
表4 正交试验方差分析
Table 4 The variance results of the orthogonal experiment

方差来源F值P值显著性pH24.83<0.05*IPTG浓度21.87<0.05*诱导温度143.91<0.01**
由于表中已有最优组合A2B2C3,且试验结果与分析结果一致,因此可以得出重组菌株生产羊毛甾醇的最佳发酵条件为pH 7.5,IPTG浓度0.5 mmol/L,诱导温度30 ℃,此时羊毛甾醇产量为5.12 mg/L,较优化前提高了1.14倍。
3 结论
本研究通过在大肠杆菌中共表达ScSQS、McSE和McOSC,构建了羊毛甾醇合成途径,工程菌株BT-tSSE-DXOSC产生了0.77 mg/L的羊毛甾醇。为提高羊毛甾醇的产量,分别单独过表达了MEP途径关键限速酶DXS、FPS和IDI,对比发现DXS和FPS对羊毛甾醇产量的促进效果优于IDI。因此构建了DXS和FPS的融合过表达菌株BT-tSSEDA-DXOSC,羊毛甾醇产量为2.39 mg/L,较BT-tSSE-DXOSC提高了2.1倍。同时对pH、IPTG浓度和诱导温度进行了单因素优化,并通过正交试验确定了最佳发酵条件:pH 7.5,IPTG浓度0.5 mmol/L,诱导温度30 ℃,该条件下BT-tSSEDA-DXOSC的羊毛甾醇产量为5.12 mg/L,较初始条件提高了1.1倍。本研究成功构建产羊毛甾醇的双质粒重组大肠杆菌,为羊毛甾醇下游代谢途径酶功能的研究及三萜类化合物的合成提供有效工具,同时为利用原核生物异源合成羊毛甾醇为骨架的三萜类化合物奠定基础。
[1] THIMMAPPA R, GEISLER K, LOUVEAU T, et al.Triterpene biosynthesis in plants[J].Annual Review of Plant Biology, 2014, 65:225-257.
[2] HILL R A, CONNOLLY J D.Triterpenoids[J].Natural Product Reports, 2013, 30(7):1 028-1 065.
[3] CHEN D Q, FENG Y L, CHEN L, et al.Poricoic acid A enhances melatonin inhibition of AKI-to-CKD transition by regulating Gas6/AxlNFκB/Nrf2 axis[J].Free Radical Biology and Medicine, 2019, 134:484-497.
[4] SENTHIL KUMAR K J, VANI M G, CHEN C Y, et al.A mechanistic and empirical review of antcins, a new class of phytosterols of Formosan fungi origin[J].Journal of Food and Drug Analysis, 2020, 28(1):38-59.
[5] SHI J, WANG H, LIU J M, et al.Ganoderic acid B attenuates LPS-induced lung injury[J].International Immunopharmacology, 2020, 88:106990.
[6] YAO L, WANG J, HE J P, et al.Endophytes, biotransforming microorganisms, and engineering microbial factories for triterpenoid saponins production[J].Critical Reviews in Biotechnology, 2021, 41(2):249-272.
[7] JIANG M, STEPHANOPOULOS G, PFEIFER B A.Toward biosynthetic design and implementation of Escherichia coli-derived paclitaxel and other heterologous polyisoprene compounds[J].Applied and Environmental Microbiology, 2012, 78(8):2 497-2 504.
[8] LI D S, ZHANG Q, ZHOU Z J, et al.Heterologous biosynthesis of triterpenoid dammarenediol-II in engineered Escherichia coli[J].Biotechnology Letters, 2016, 38(4):603-609.
[9] KE D, CAIYIN Q, ZHAO F L, et al.Heterologous biosynthesis of triterpenoid ambrein in engineered Escherichia coli[J].Biotechnology Letters, 2018, 40(2):399-404.
[10] TAKEMURA M, TANAKA R, MISAWA N.Pathway engineering for the production of β-amyrin and cycloartenol in Escherichia coli-a method to biosynthesize plant-derived triterpene skeletons in E.coli[J].Applied Microbiology and Biotechnology, 2017, 101(17):6 615-6 625.
[11] 高铫晖, 王高乾, 黄蕙芸, 等.真菌三萜及甾体的生物合成研究进展[J].有机化学, 2018, 38(9):2 335-2 347.
GAO Y H, WANG G Q, HUANG H Y, et al.Biosynthesis of fungal triterpenoids and steroids[J].Chinese Journal of Organic Chemistry, 2018, 38(9):2 335-2 347.
[12] KATABAMI A, LI L, IWASAKI M, et al.Production of squalene by squalene synthases and their truncated mutants in Escherichia coli[J].Journal of Bioscience and Bioengineering, 2015, 119(2):165-171.
[13] 邵喜喜, 孟云鹤, 周沈婷, 等.环氧角鲨烯合成通路在大肠杆菌中的构建和优化[J].生物工程学报, 2021, 37(6):2 105-2 115.
SHAO X X, MENG Y H, ZHOU S T, et al.Construction and optimization of squalene epoxide synthetic pathway in Escherichia coli[J].Chinese Journal of Biotechnology, 2021, 37(6):2 105-2 115.
[14] LI K, FORCINITI D.Solubility of lanosterol in organic solvents and in water-alcohol mixtures at 101.8 kPa[J].Journal of Chemical & Engineering Data, 2020, 65(2):436-445.
[15] LAMB D C, JACKSON C J, WARRILOW A G S, et al.Lanosterol biosynthesis in the prokaryote Methylococcus capsulatus:Insight into the evolution of sterol biosynthesis[J].Molecular Biology and Evolution, 2007, 24(8):1 714-1 721.
[16] NAKANO C, MOTEGI A, SATO T, et al.Sterol biosynthesis by a prokaryote:First in vitro identification of the genes encoding squalene epoxidase and lanosterol synthase from Methylococcus capsulatus[J].Bioscience Biotechnology and Biochemistry, 2007, 71(10):2 543-2 550.
[17] ESTÉVEZ J M, CANTERO A, REINDL A, et al.1-deoxy-D-xylulose-5-phosphate synthase, a limiting enzyme for plastidic isoprenoid biosynthesis in plants[J].Journal of Biological Chemistry, 2001, 276(25):22 901-22 909.
[18] 李宁, 刘波, 刁梦雪, 等.产角鲨烯细胞工厂的构建及关键基因的筛选、克隆与表达[J].生物工程学报, 2021, 37(8):2 813-2 824.
LI N, LIU B, DIAO M X, et al.Construction of squalene producing cell factories and screening, cloning and expression of key genes[J].Chinese Journal of Biotechnology, 2021, 37(8):2 813-2 824.
[19] 韩莉, 张莎莎, 王博军, 等.重组产番茄红素大肠杆菌工程菌株中异戊烯异构酶(IDI)基因的筛选[J].食品工业科技, 2016, 37(13):137-142.
HAN L, ZHANG S S, WANG B J, et al.Screening of isopentenyl diphosphate isomerase(IDI)in engineering Escherichia coli strains for lycopene production[J].Science and Technology of Food Industry, 2016, 37(13):137-142.
[20] 张亦男, 刘振, 毛相朝.大肠杆菌角鲨烯合成途径的构建与调控[J].工业微生物, 2019, 49(3):1-6.
ZHANG Y N, LIU Z, MAO X Z.Construction and regulation of squalene synthesis pathway in Escherichia coli[J].Industrial Microbiology, 2019, 49(3):1-6.
[21] MENG Y, SHAO X, WANG Y, et al.Extension of cell membrane boosting squalene production in the engineered Escherichia coli[J].Biotechnology Bioengineering, 2020, 117(11):3 499-3 507.