原花青素(proanthocyanidins,PCs)是一类广泛存在于植物中的天然多酚类化合物,分子结构中含多个酚羟基,具有广泛的药理学活性,如抗氧化、抗肥胖、抗糖尿病等。而且,PCs成本低、安全性高,在医药、食品等方面具有较高的利用价值。然而,PCs稳定性较差,在加工过程中易受到光照、温度、pH、氧化剂、金属离子等因素影响。因此,提高PCs稳定性是亟待解决的关键问题。目前,提高PCs稳定性的方法主要有化学法和物理法,其中化学法存在潜在的安全问题,物理方法更为常用。物理方法主要是通过加入保护气、辅色素、与生物大分子形成复合物等,以提高PCs的稳定性[1]。
生物大分子负载提升PCs稳定性是基于PCs和大分子间以氢键、疏水作用、静电作用等次级键结合,既不会影响PCs天然结构,又不会产生新的物质,安全性高,是提高PCs稳定性的主要手段。蛋白质、糖类、脂类等生物大分子是负载PCs的主要基质,负载后PCs稳定性提升显著,如β-环糊精添加量为2 500 mg/L时,可显著提高紫薯花色苷的贮存稳定性[2];葡萄籽花色苷与磺基丁基醚-β-环糊精形成的包合物不仅提高了花色苷的溶解度和稳定性,而且保留了花色苷的抗糖尿病作用[3]。
蛋白质来源广泛,价格低廉,不仅生物相容性好,而且营养价值高,是活性小分子主要载体;其中乳蛋白因其制备工艺简单、成本低廉而成为蛋白质中的首选基质。乳蛋白主要由乳清蛋白和酪蛋白组成,有文献指出,乳清蛋白-PCs复合物的热稳定性大于游离PCs的热稳定性[4]。乳清蛋白和酪蛋白在热、氧化和光照条件下能使PCs的降解量减少,对其稳定性有较好的改善作用[5];α-酪蛋白和β-酪蛋白均能提高蓝莓花青素稳定性,并保护其抗氧化能力[6]。由此可见,利用乳蛋白负载可提升PCs的稳定性。
乳中,酪蛋白占总蛋白的80%,由4种不同类型的酪蛋白(αs1,αs2,β和κ,质量比例约为4∶1∶4∶1)组成,这些酪蛋白与磷酸钙自组装成一种纳米级复合物,称为酪蛋白胶束(micellar casein,MC),其结构特殊,具有疏水内部和亲水表面[7]。本团队前期研究发现,MC对活性小分子具有较高的结合能力,如在37 ℃条件下,MC与大黄素、咖啡酸和咖啡酸苯乙酯的结合常数分别为5.470×104、8.12×104和8.93×106[8-9],有利于提高疏水分子的溶解性和生物利用度。然而,MC对PCs稳定性影响研究报道较少。
本文以MC为基质,以PCs为配体,制备PCs-MC复合物,利用紫外-可见光谱、荧光光谱、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、X-射线衍射(diffraction of x-rays,XRD)、粒径和Zeta电位等表征复合物结构,并分析热处理、超声处理、添加H2O2和金属离子对PCs-MC复合物中PCs稳定性的影响规律及作用机制,为PCs稳定性提升提供参考依据。
1 材料与方法
1.1 材料与试剂
PCs,上海麦克林生化科技有限公司;FeCl3、ZnCl2,烟台市双双化工有限公司;香草醛,兰州嘉特星工贸有限公司;其他试剂均为分析纯。
新鲜牛乳购自兰州天天鲜乳制品有限责任公司,离心脱脂(4 000×g,30 min),过100 kDa有机膜,浓缩液冷冻干燥制得胶束酪蛋白,4 ℃冷藏备用[9]。
1.2 仪器与设备
RF-5301PC荧光分光光度计,日本日立仪器有限责任公司;Nicolet iS50 FTIR光谱仪,美国赛默飞世尔科学公司;HX-T涡旋混合器,中国金坛百塔鑫宝仪器有限公司;XD3 X射线多晶衍射仪,北京普析通用仪器有限责任公司;STA 449 F5 TG-DSC热分析仪,德国耐驰仪器制造有限公司;FD-1-50真空冷冻干燥机,北京博医康实验仪器有限公司;H1850台式高速离心机,湖南湘仪实验室仪器开发有限公司;UV-1780双光束紫外可见分光光度计,岛津仪器有限公司;BT-Zeta100 Zeta电位/纳米粒度/分子量分析仪,丹东百特仪器有限公司。
1.3 实验方法
1.3.1 PCs-MC复合物制备
用0.05 mol/L pH 6.86磷酸盐缓冲液溶解MC,获得3 g/L MC溶液。将适量PCs用二甲基亚砜助溶后置于0.05 mol/L pH 6.86磷酸盐缓冲液中,涡旋振荡使其充分溶解,制得浓度分别为2、4、6、8 mmol/L的溶液。上述PCs溶液与MC以体积比1∶1混合,37 ℃水浴中磁力搅拌加热20 min,制得PCs-MC复合物,备用。取一部分复合物溶液进行冷冻干燥,获得粉末状复合物,冷藏备用。
1.3.2 紫外-可见光谱分析
PCs-MC复合物溶液用0.05 mol/L pH 6.86磷酸盐缓冲液稀释30倍,用紫外-可见分光光度计进行全波长扫描,扫描范围为190~500 nm。
1.3.3 荧光光谱分析
PCs-MC复合物溶液用0.05 mol/L pH 6.86磷酸盐缓冲液稀释10倍,用荧光分光光度计测量,测量范围为290~500 nm,激发波长为280 nm,激发狭缝为10 nm,发射狭缝为5 nm。
1.3.4 FTIR分析
参照文献[10],将PCs-MC复合物粉末置于ATR元件,用FTIR仪测量,对酰胺Ⅰ带(1 600~1 700 cm-1)进行二级结构含量分析。
1.3.5 XRD 分析
参照QIN等[8]的方法,将PCs-MC复合物粉末用X射线多晶衍射仪在Cu Kα辐射下进行XRD扫描。
1.3.6 粒径和Zeta电位分析
参照LI等[11]的方法,将PCs-MC复合物溶液用0.05 mol/L pH 6.86磷酸盐缓冲液稀释10倍,使用BT-Zeta100 粒度仪测定粒径及电位。
1.3.7 差示扫描量热法(thermogravimetric analysis-differential scanning calorimetry,TG-DSC)分析
参照QIN等[8]的方法,使用TG-DSC热分析仪测定PCs-MC复合物粉末的热稳定性。
1.3.8 PCs稳定性分析
1.3.8.1 PCs含量的测定
PCs含量测定参考WEN等[12]报道的方法,取0.5 mL样品,加入4.5 mL体积分数2%盐酸-10 g/L香草醛乙酸溶液中,在37 ℃恒温水浴锅中加热30 min后冷却至室温,使用紫外-可见分光光度计在500 nm处测量吸光度,绘制标准曲线(图1)。
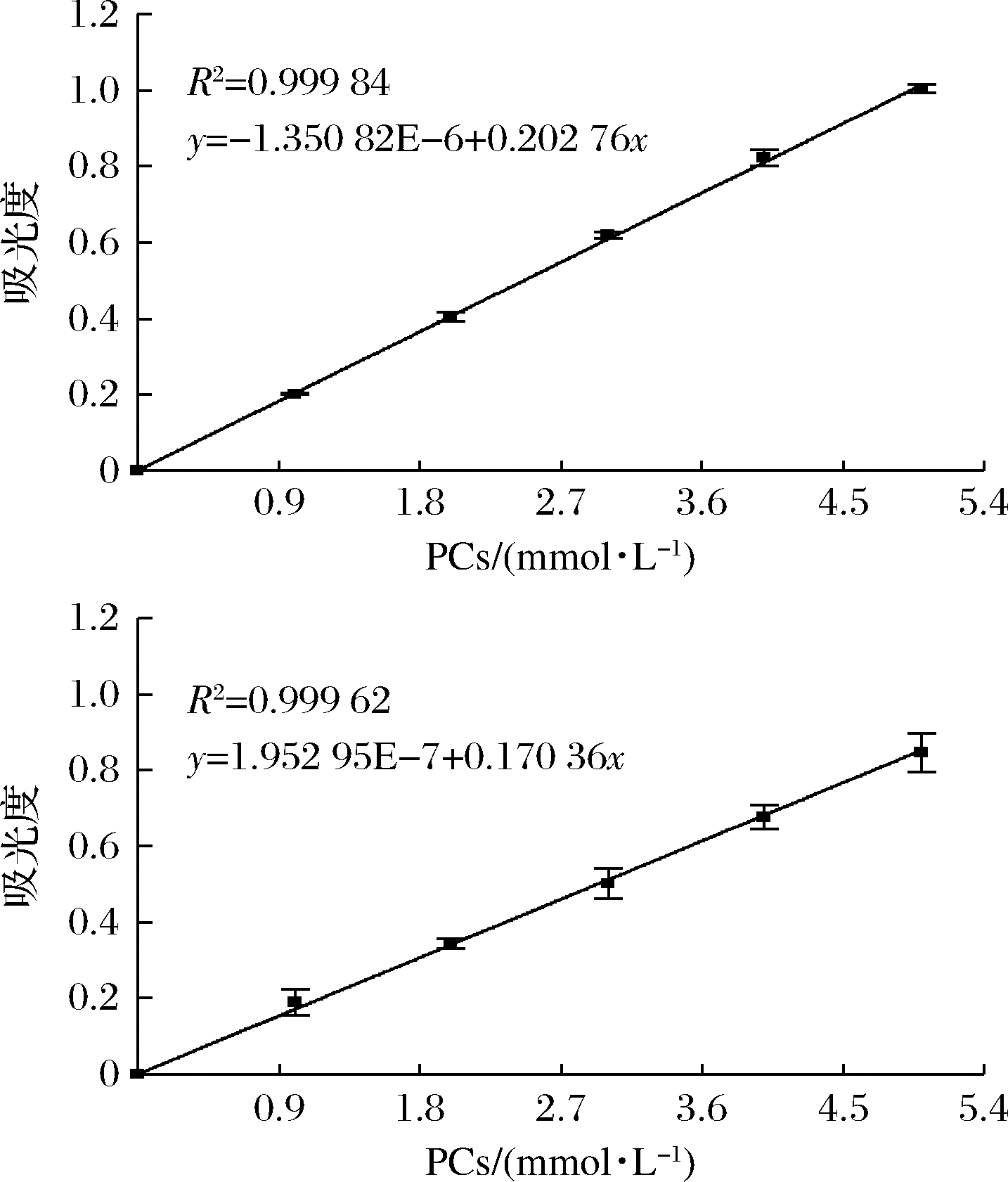
a-PCs;b-PCs-MC
图1 游离PCs和PCs-MC复合物中PCs的标准曲线
Fig.1 Standard curves of free PCs and PCs in PCs-MC complexes
PCs的稳定性用保留率表示,计算如公式(1)所示[12]:
保留率![]()
(1)
式中:c0,PCs的初始浓度,mmol/L;ct,t时刻PCs的浓度,mmol/L。
1.3.8.2 温度对PCs稳定性的影响
将PCs-MC复合物溶液及相同浓度游离PCs溶液分别置于4 ℃冰箱、37、50和65 ℃水浴中恒温60 h,每隔12 h取样测定PCs保留率。
1.3.8.3 金属离子对PCs稳定性的影响
将PCs-MC复合物溶液及相同浓度游离PCs溶液分别与0.01 mol/L FeCl3和0.01 mol/L ZnCl2溶液以体积比1∶1混合均匀,室温静置150 min,每隔30 min取样测定PCs保留率。
1.3.8.4 H2O2对PCs稳定性的影响
在PCs-MC复合物溶液及相同浓度游离PCs溶液中分别加入一定量H2O2溶液,使其终体积分数为0.006%和0.024%,室温静置75 min,每隔15 min取样测定PCs保留率。
1.3.8.5 超声处理PCs稳定性的影响
将PCs-MC复合物溶液及相同浓度游离PCs溶液进行超声处理50 min,频率为20 kHz,振幅为30%,采用间歇超声模式(工作5 s停1 s),每隔10 min取样测定PCs保留率。
1.3.9 PCs降解动力学分析
根据文献[13],采用一级动力学模型分析PCs降解动力学,如公式(2)所示:
lnct=-kt+lnc0
(2)
式中:c0,PCs的初始浓度,mmol/L;ct,t时刻PCs的浓度,mmol/L;k,降解速率常数,h-1或min-1;t,时间,h或min。
1.4 数据统计分析
所有试验重复3次,试验数据采用Excel 2010处理并用平均数±标准偏差表示,用Origin Pro 9.0作图,用IBM SPSS Statistics 22进行差异显著性分析,数据间差异显著分析采用Duncan法。
2 结果与分析
2.1 PCs-MC复合物结构表征
2.1.1 紫外-可见光谱分析
由图2-a可知,随着游离PCs浓度的增加, 280 nm处的吸光度逐渐增大。由图2-b可知,随着PCs浓度的增加,PCs-MC复合物在280 nm附近的吸收峰不断增大,且最大吸收波长从277 nm红移到280 nm,表明MC二级结构发生改变,疏水氨基酸残基向亲水微环境转变,证明PCs和MC发生相互作用,形成了复合物。另一方面,MC疏水性氨基酸残基微环境发生变化,说明PCs与MC可能以疏水作用结合。WANG等[14]研究发现,随着花青素浓度的增加,黑豆分离蛋白的吸光度逐渐增加,且最大吸收波长从272 nm红移到279 nm,与本研究结果基本一致。
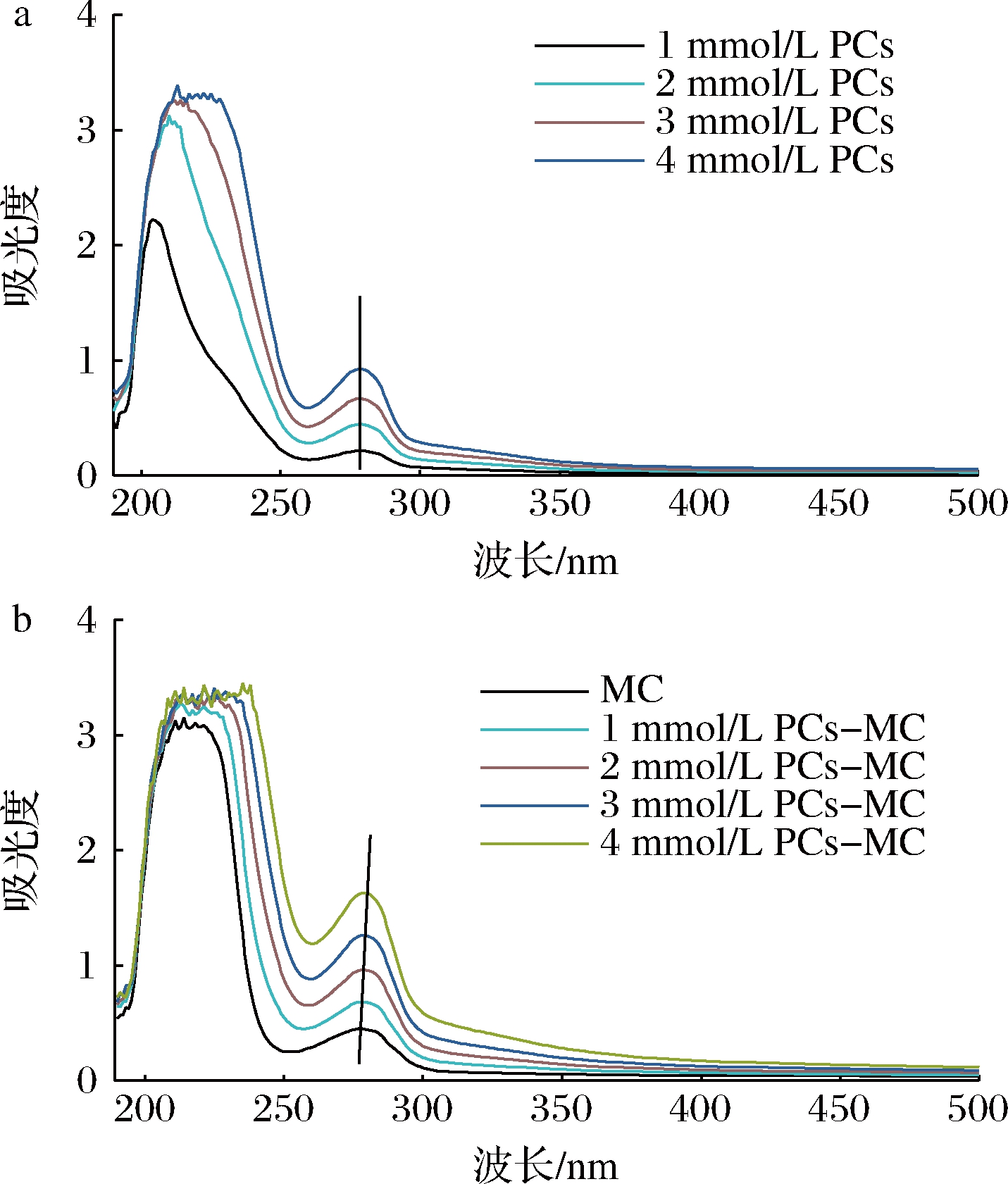
a-游离PCs;b-PCs-MC复合物
图2 游离PCs和PCs-MC复合物的紫外光谱图
Fig.2 UV-Vis spectra of PCs and PCs-MC complexes
2.1.2 荧光光谱分析
PCs-MC复合物的荧光光谱如图3所示。MC在336.4 nm处有最大荧光值(1 682.6);随着PCs浓度的增加,最大荧光强度逐渐降低。当PCs 浓度为4 mmol/L时,复合物的荧光强度降低到59.0,表明PCs使MC中色氨酸、酪氨酸残基微环境发生改变,对MC有荧光猝灭作用,再次证实PCs与MC发生相互作用,形成PCs-MC复合物。LI等[15]研究表明,PCs通过静态猝灭抑制乳铁蛋白的固有荧光,乳铁蛋白和PCs之间主要由疏水作用和氢键形成复合物。MA等[16]发现,PCs B1、B2、B3和A2可通过静态猝灭抑制β-酪蛋白的固有荧光,PCs C1可通过动态和静态猝灭抑制β-酪蛋白的固有荧光,PCs与β-酪蛋白的结合作用主要是疏水作用、范德华力和氢键。可见,PCs更易于与蛋白质形成疏水作用。
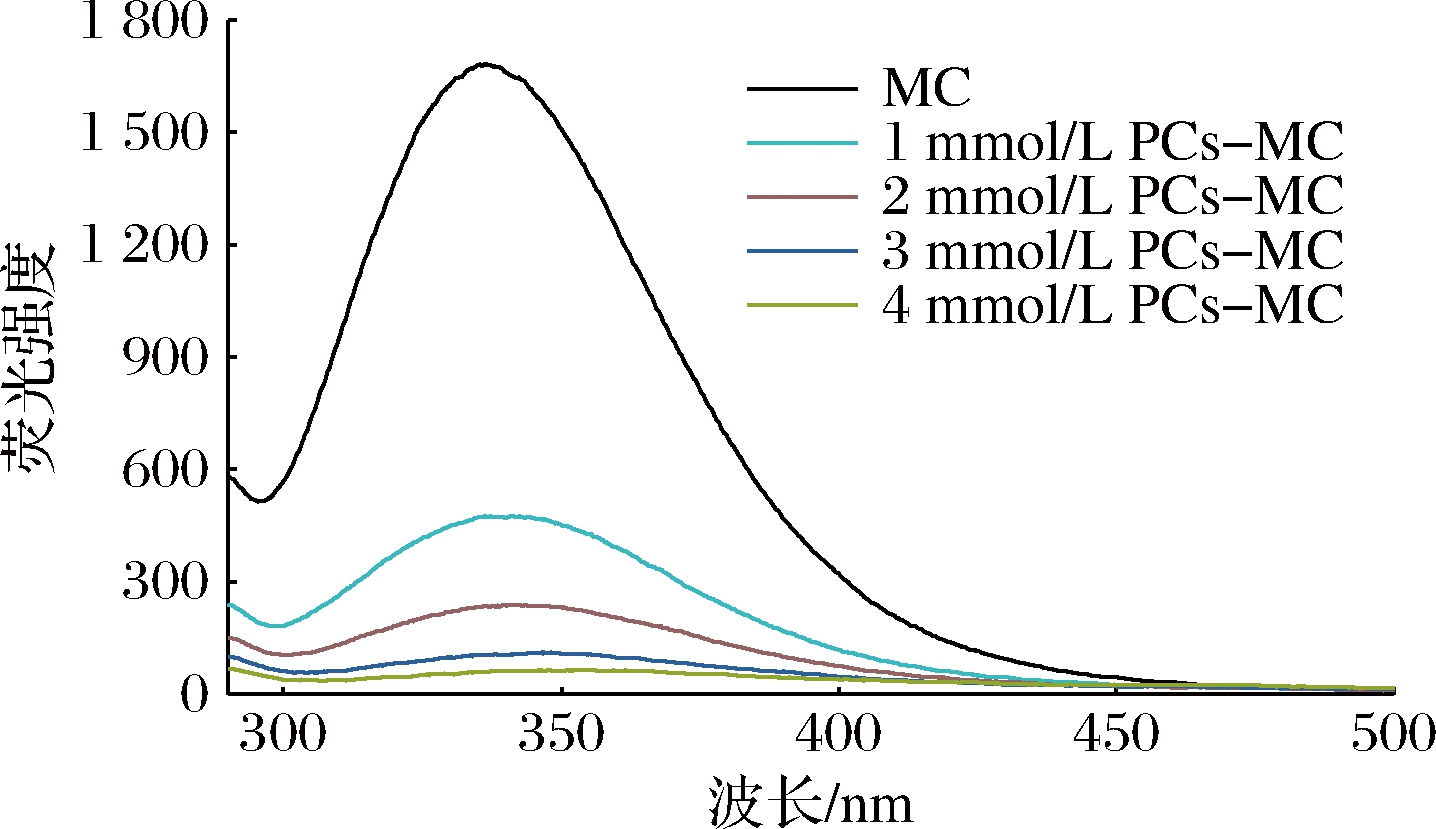
图3 PCs-MC复合物的荧光光谱图
Fig.3 Fluorescence spectra of PCs-MC complexes
2.1.3 FTIR分析
由图4-a可知,MC酰胺I带为1 632.9 cm-1,酰胺II带为1 516.3 cm-1。就PCs而言,在3 323.8 cm-1处为缔合羟基伸缩振动,1 440.0 cm-1为C—H弯曲振动,1 518.2 cm-1为C![]() C骨架伸缩振动,1 604.4 cm-1为C
C骨架伸缩振动,1 604.4 cm-1为C![]() C伸缩振动。加入PCs后,MC酰胺I带移动到1 645.5 cm-1,表明MC的二级结构发生了变化。另外,PCs在1 440.0 cm-1处的峰消失,说明MC与PCs之间形成PCs-MC复合物,与MA等[16]的研究报道一致。WANG等[17]研究发现,与花青素相比,花青素-壳聚糖和乳清蛋白纳米复合物在1 080、1 230、1 650、3 420 cm-1的特征峰出现了红移,证明了复合物的形成和蛋白质构象变化。
C伸缩振动。加入PCs后,MC酰胺I带移动到1 645.5 cm-1,表明MC的二级结构发生了变化。另外,PCs在1 440.0 cm-1处的峰消失,说明MC与PCs之间形成PCs-MC复合物,与MA等[16]的研究报道一致。WANG等[17]研究发现,与花青素相比,花青素-壳聚糖和乳清蛋白纳米复合物在1 080、1 230、1 650、3 420 cm-1的特征峰出现了红移,证明了复合物的形成和蛋白质构象变化。
对酰胺I带进行二级结构含量分析,结果如图4-b所示。添加PCs后,MC中β-折叠结构含量显著降低,转角含量显著增加(P<0.05)。当PCs添加量为1~3 mmol/L时,各二级结构含量随PCs浓度增加变化不显著(P>0.05)。当PCs浓度为4 mmol/L时,复合物中转角结构含量最高,β-折叠含量最低,且与其他样品差异显著(P<0.05)。由此可见,添加PCs后,MC二级结构发生改变,这与紫外-可见光谱研究结果一致(图2)。
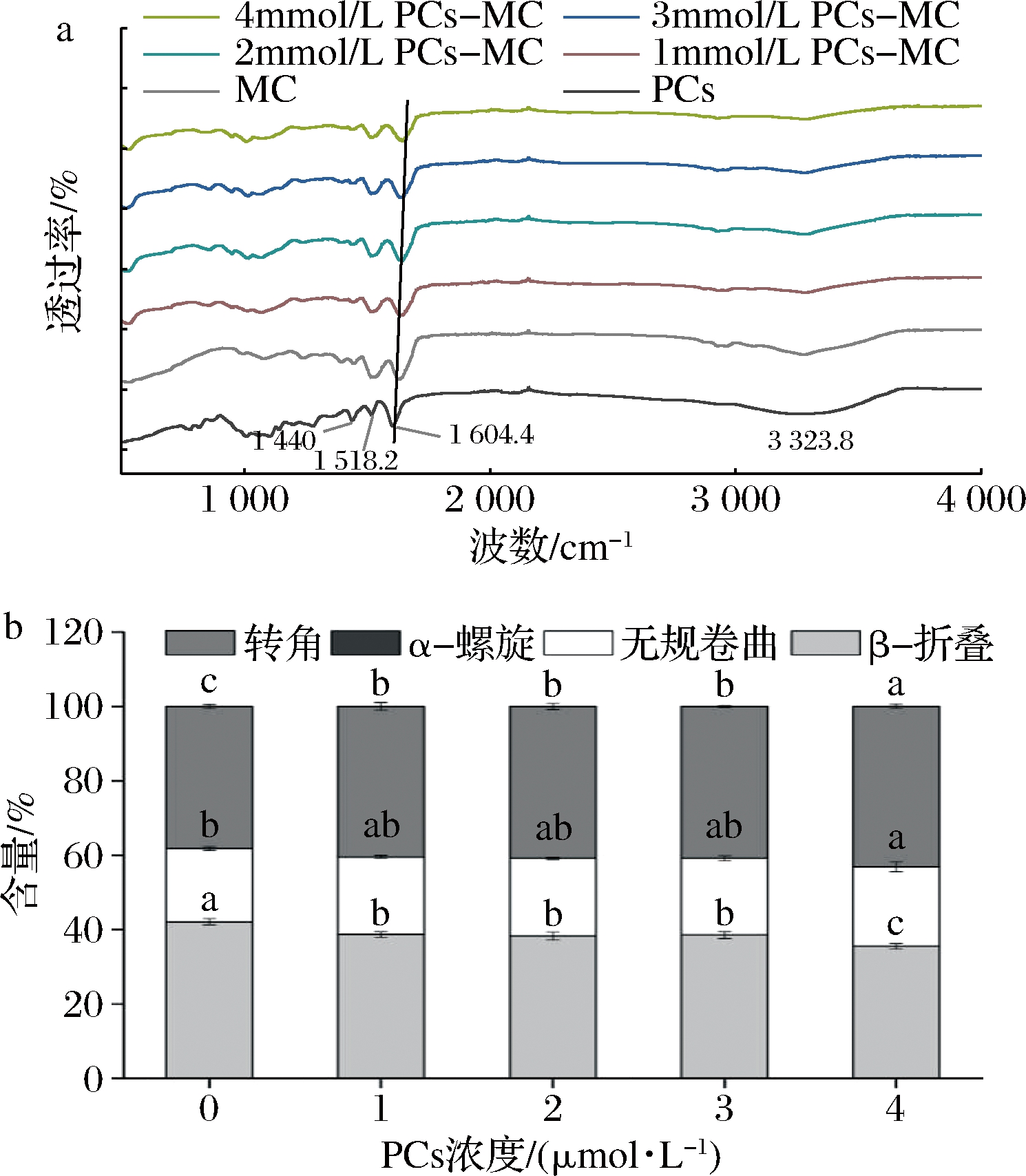
a-FTIR图;b-二级结构含量
图4 PCs-MC复合物的FTIR图和二级结构含量
Fig.4 FTIR spectra and secondary structure conctents of PCs-MC complexes
注:不同小写字母表示差异显著
2.1.4 XRD分析
PCs-MC复合物的XRD如图5所示。游离MC和PCs出现较宽的峰,说明二者均呈现无定形结构。PCs-MC复合物在32°处出现一个新的晶体衍射峰,表明PCs与MC形成复合物。SHADDEL等[18]研究发现,加入花青素后,以明胶和阿拉伯胶为基质的微胶囊晶体结构发生改变,形成明显的晶体衍射峰,与本研究结果一致。
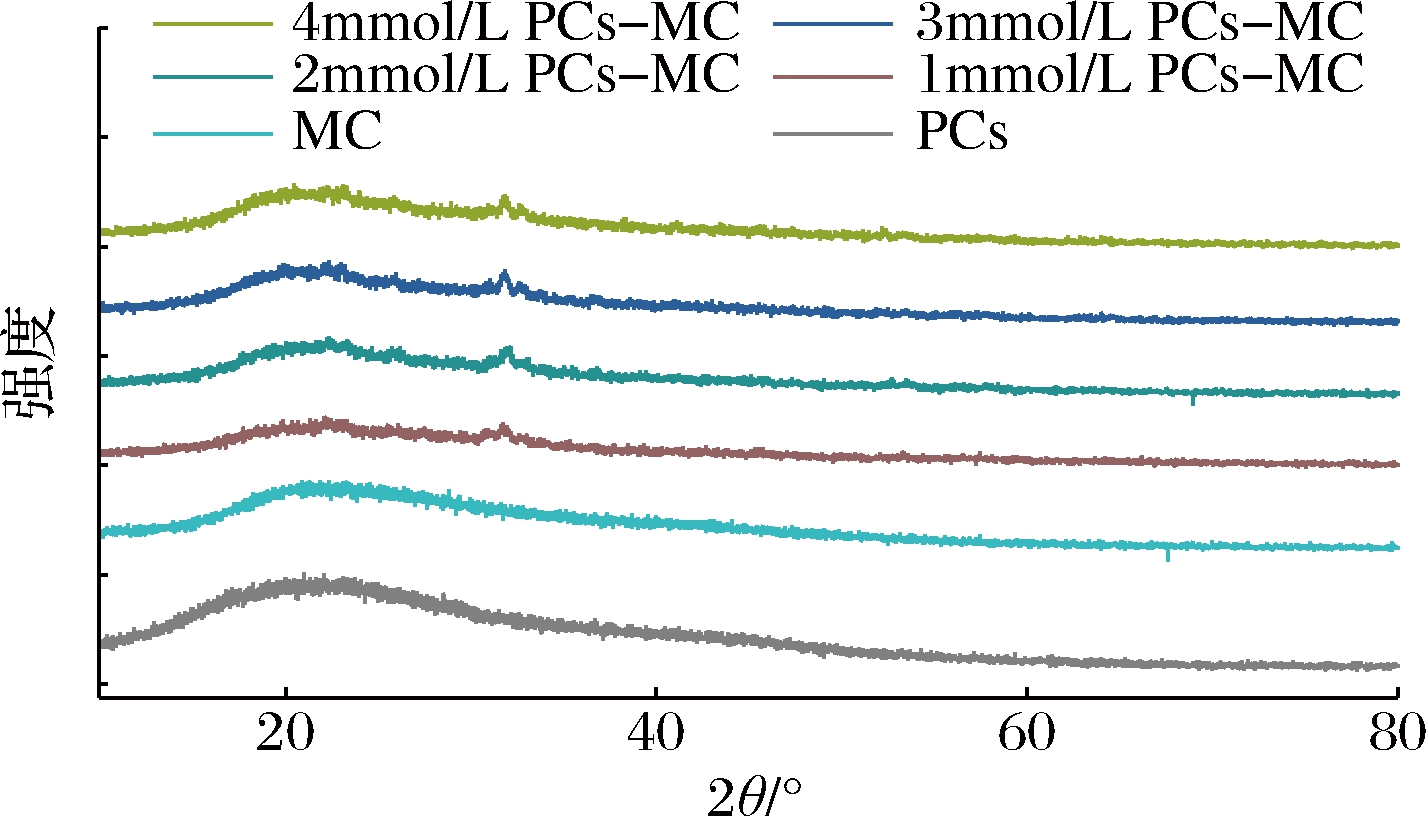
图5 PCs-MC复合物XRD图
Fig.5 XRD patterns of PCs-MC complexes
2.1.5 粒径及电位分析
由图6-a可知,随着PCs浓度的增大,游离PCs和PCs-MC复合物粒径都逐渐增大,且PCs-MC复合物粒径小于游离PCs粒径。由于PCs为聚合物,在水中溶解度不高,多形成团聚体,因此粒径较大。将PCs添加到MC溶液中后,PCs与MC以物理相互作用结合,有效改善了PCs的团聚,使其分散为小分子,因此复合物粒径显著小于游离PCs(P<0.05)。由于MC为近球形粒子,PCs结合于其表面,因此随着PCs结合量的增加,复合物粒径略有增大。YAN等[19]研究发现,与樟仁分离蛋白相比,樟仁分离蛋白-酚复合物的粒径更大,表明蛋白质-酚复合物的形成,与本文研究结果一致。
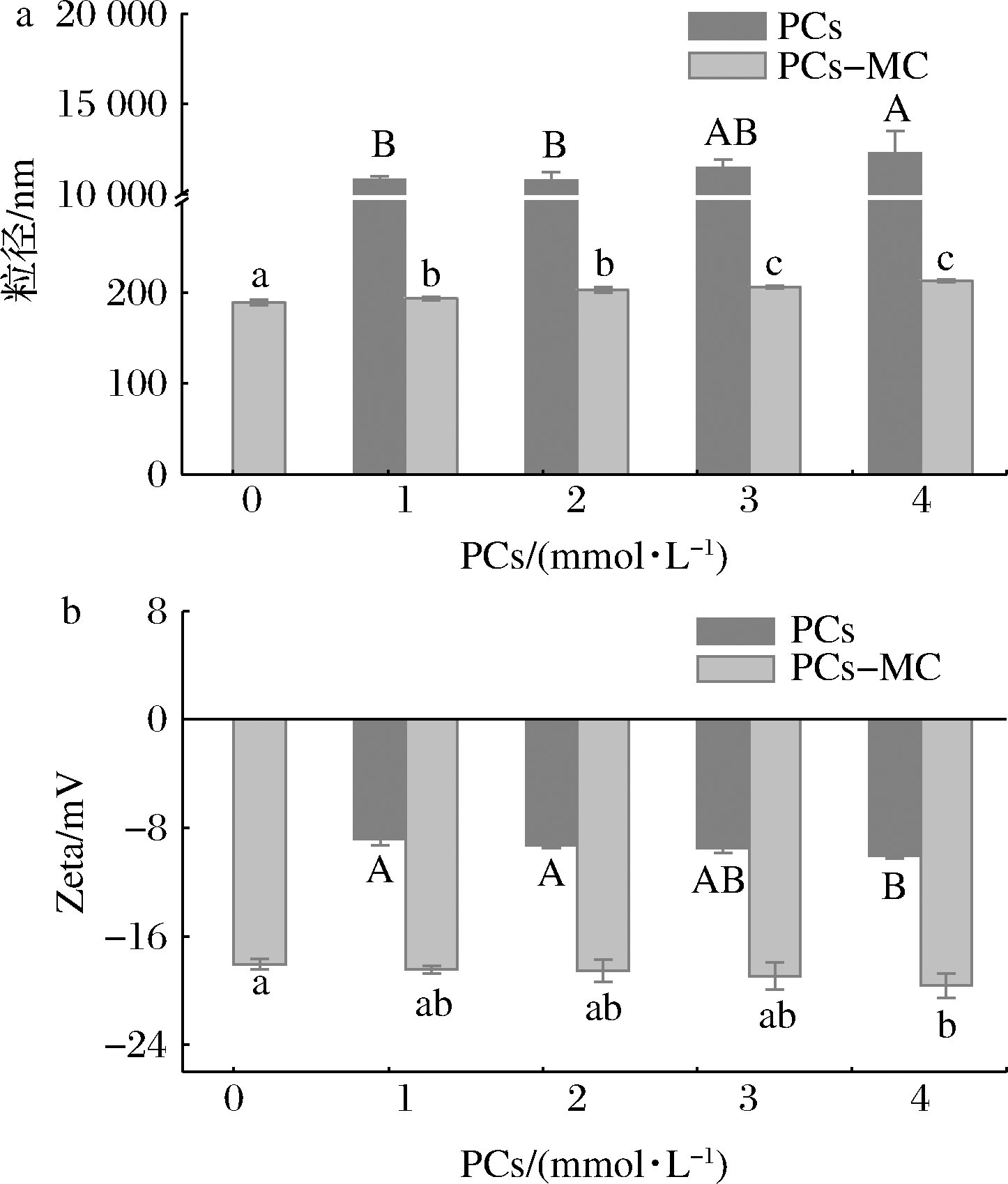
a-粒径;b-Zeta电位
图6 PCs-MC复合物的粒径和Zeta电位
Fig.6 Particle size and Zeta-potential of PCs-MC complexes
注:图中不同小写字母表示PCs-MC样品间差异显著;不同大写字母表示PCs样品间差异显著(下同)
由图6-b可知,在pH 6.86的缓冲体系中,PCs带负电荷,1 mmol/L时电位值为-8.8 mV。相同体系中,MC带负电荷,电位值为-18.0 mV。随着PCs浓度的增大,PCs-MC复合物的负电量有所增加,表明PCs改变了MC二级结构,形成PCs-MC复合物,且PCs-MC复合物粒子间静电斥力增强,与红外光谱分析结果一致(图4)。LI等[11]研究发现,当儿茶素浓度增加到1.5 g/L时,复合物的电位值增大了1倍多。
2.1.6 TG-DSC分析
由图7-a中可知,在80 ℃左右出现吸热峰,是由于水分蒸发所致。PCs-MC复合物在350 ℃附近出现较大放热峰,为复合物热分解所致,与文献[18]的研究结果一致。
由图7-b可知,PCs和MC第一次失重在80 ℃附近,为水分蒸发所致;第二次失重在275~350 ℃,表明大分子热分解。PCs-MC复合物在该阶段的质量损失低于MC,且损失率随着PCs含量的增加而降低,说明复合物之间形成了相互作用,减缓了MC的热分解。可见,PCs-MC复合物的热稳定性高于游离MC和PCs。有研究指出,微胶囊化的花色苷质量损失更加缓慢,卡拉胶对花色苷的降解起到保护作用,与本文研究结果相似[20]。
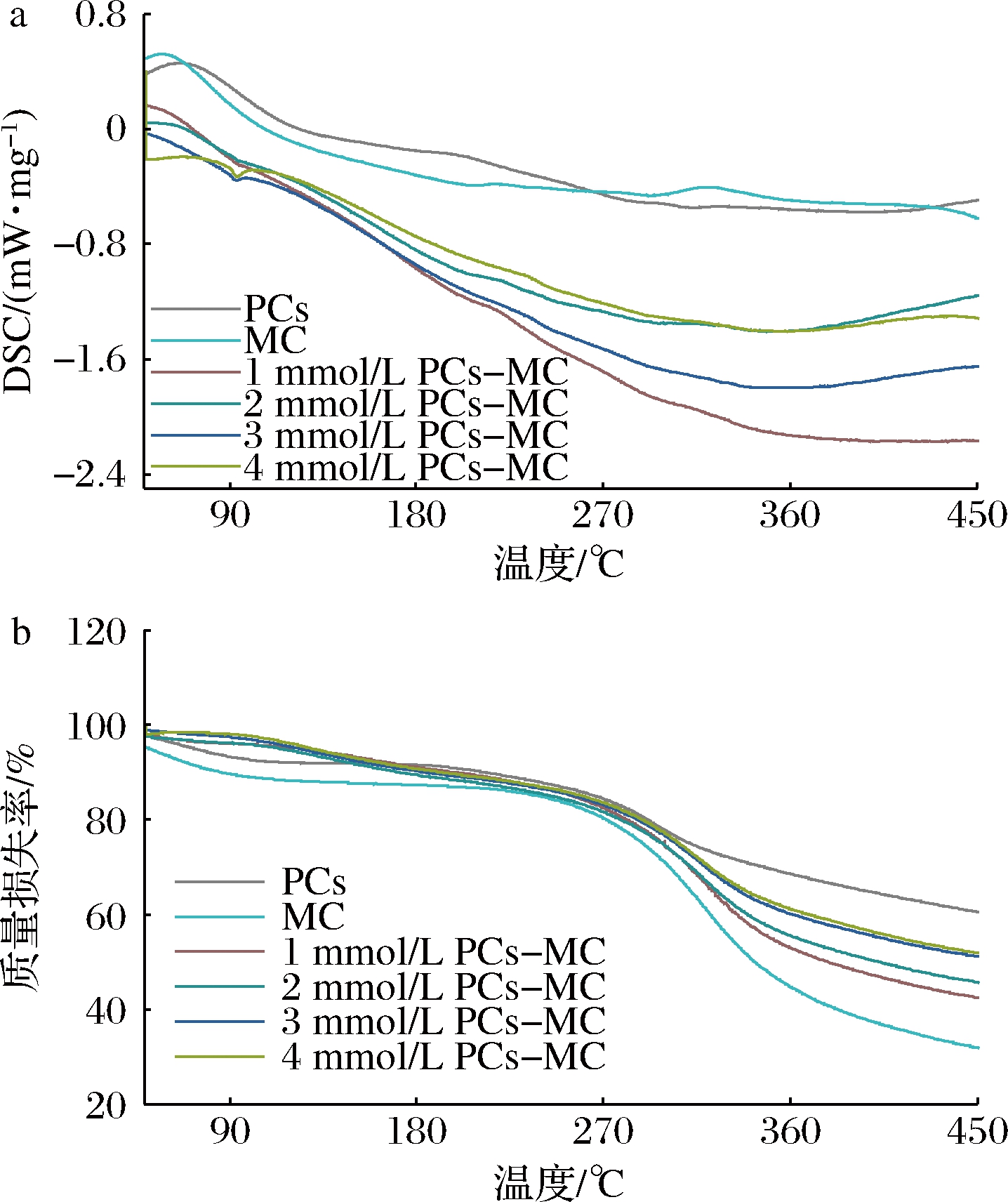
a-DSC;b-TG
图7 PCs-MC复合物的DSC和TG曲线
Fig.7 DSC and TG curves of PCs-MC complexes
2.2 温度对PCs-MC复合物稳定性的影响
2.2.1 不同温度下PCs保留率分析
不同温度处理下的PCs保留率如图8所示。
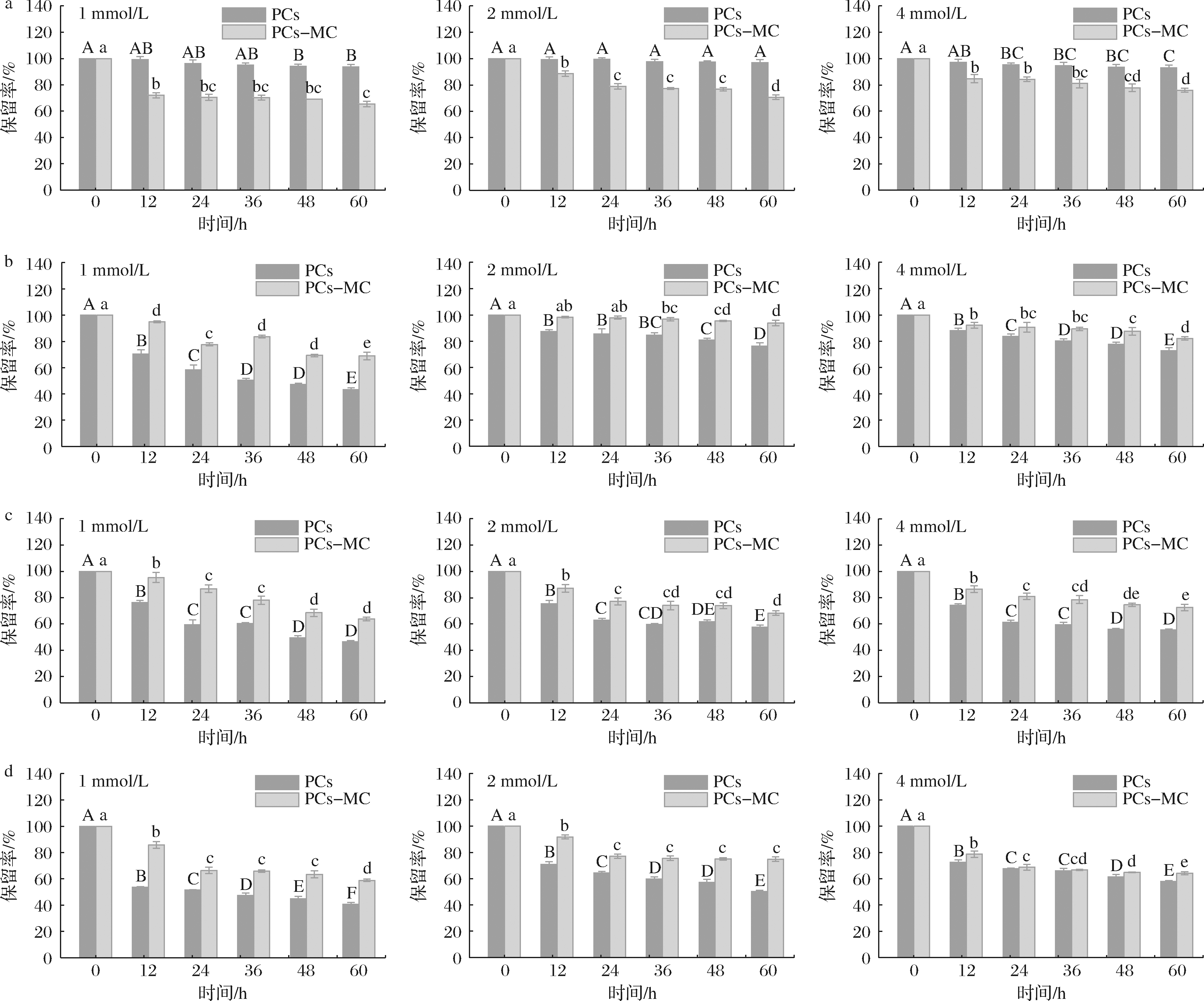
a-4 ℃;b-37 ℃;c-50 ℃;d-65 ℃
图8 不同温度处理下PCs保留率
Fig.8 Retention rate of PCs with different heat treatment
由图8-a可知,4 ℃贮藏时,复合物中PCs保留率低于游离PCs,这可能是由于低温下酪蛋白胶束结构发生改变,部分β-酪蛋白析出,PCs可能进入酪蛋白胶束内部,从而难以检测到[21]。另一方面,复合物中PCs浓度越大,其保留率越大,这可能是因为PCs之间形成π-π堆积等作用,进而结构稳定性提升[22]。由图8-b~图8-d可知,37、50和65 ℃处理时,MC对PCs均起到保护作用,复合物中PCs降解率明显低于游离PCs,与QUAN等[2]的研究结果一致。由于PCs分子以特定基团与MC形成物理相互作用,使其结构稳定性提升,在外界环境影响下降解减缓,从而提高了PCs的保留率。就游离PCs而言,浓度为1 mmol/L时PCs保留率最低,可见PCs分子之间的相互作用也有利于其结构稳定,但这种作用弱于MC与PCs之间的相互作用。与其他温度相比,随着贮藏时间的延长,4 ℃下游离PCs和复合物中PCs保留率最高且变化缓慢,可见低温贮藏有利于保持PCs的稳定性。
有文献指出,β-环糊精与花青素之间的相互作用会促进花青素的降解[23],与本文研究结果不同,可能是由于原料间的相互作用机理不同所导致。综上所述,MC与PCs结合有利于改善PCs在中高温环境下的稳定性。
不同温度下PCs一级降解动力学拟合结果如表1所示。不同温度处理下,游离PCs和复合物中的PCs降解均符合一级降解动力学,拟合度较高,与WANG等[17]报道一致。
表1 不同影响因素下PCs的一级降解速率常数(k)和相关系数(R2)
Table 1 Degradation rate constants (k) and correlation coefficients (R2) of PCs under different treatment

影响因素PCs/(mmol·L-1)游离的PCsPCs-MCk(h-1)×10-4R2k(h-1)×10-4R24 ℃112.1±0.80.98176.9±5.00.97925.3±0.50.96564.9±5.10.970414.2±1.60.94250.4±5.50.94437 ℃1156.6±9.30.98266.9±8.70.920247.4±6.30.9179.7±5.00.987478.8±8.90.93948.4±4.40.95950 ℃1135.7±7.30.98773.9±2.60.9942125.9±15.70.92767.3±5.90.9634117.5±11.20.95662.0±5.00.96965 ℃1255.7±24.00.95898.3±8.00.9682130.6±14.80.93961.8±7.20.9364109.8±15.70.90693.0±6.70.975k(min-1) ×10-4k(min-1) ×10-40.006% H2O21101.7±14.30.90824.0±1.40.9832124.8±12.90.94960.2±7.50.928446.8±2.80.98230.4±3.90.9220.024% H2O21176.7±24.30.91242.3±2.70.981298.0±11.20.93835.0±3.70.9484162.5±21.00.92259.7±3.60.982Zn2+120.7±2.30.94223.8±1.70.972212.8±0.40.99523.2±1.80.970411.5±1.20.94819.8±1.40.975Fe3+158.3±6.50.94273.9±8.80.933228.8±2.50.96355.5±7.50.914425.6±3.10.93235.4±1.80.987超声182.9±10.50.92413.5±12 0.962226.2±0.40.99977.3±7.60.953451.2±3.80.97497.4±10.70.942
2.2.2 PCs-MC复合物粒径和电位分析
为了进一步解释MC对PCs稳定性的保护作用,选取50 ℃下不同贮藏期的PCs-MC复合物为样品,进行粒径和电位分析,结果如图9所示。由图9-a可知,随着热处理时间的延长,游离PCs粒径减小;且浓度越小,粒径降低幅度越大,说明PCs对温度敏感,在热处理下发生降解。就PCs-MC复合物而言,其粒径随热处理时间延长虽呈现出增大趋势,但增大幅度较小。电位方面,PCs-MC复合物电荷为-20 mV左右,是较为稳定的体系。随着热处理时间的延长,游离PCs降解后,负电荷增加,而复合物的电荷变化规律性不强,整体变化程度较小。由此可见,MC与PCs的相互作用有效缓解了PCs的热降解。

a-PCs-MC复合物粒径;b-PCs-MC复合物Zeta电位
图9 50 ℃处理下PCs-MC复合物的粒径和Zeta电位
Fig.9 Particle size and Zeta-potential of PCs-MC complexes at 50 ℃
2.3 Fe3+和Zn2+对PCs-MC复合物稳定性的影响
2.3.1 PCs保留率分析
Fe3+和Zn2+处理下PCs保留率如图10所示。由图10-a可知,加入Fe3+后,游离PCs保留率高于复合物中PCs保留率,且PCs浓度越小,复合物中PCs保留率越低,如1 mmol/L时游离PCs和复合物中PCs保留率最低,加入Fe3+150 min后,游离PCs保留率为48.8%,而复合物中PCs保留率为37.1%。由图10-b可知,加入Zn2+150 min后,浓度为1 mmol/L的游离PCs和复合物中PCs保留率分别为76.2%、68.8%,其变化趋势与Fe3+的影响一致,均表现为MC促进了PCs的降解,与RATANAPOOMPINYO等[24]的研究报道一致。文献报道指出,金属离子可以与PCs形成螯合物,从而增加其结构稳定性[24]。与MC非共价结合后,降低了PCs与金属离子的螯合能力,因此降低了其稳定性。PATRAS等[25]研究发现,Fe3+提高了矢车菊素-3-O-葡萄糖苷在60 ℃加热80 min的稳定性。另外,由表1可以看出PCs在Fe3+和Zn2+存在时的降解动力学符合一级反应。根据文献报道,矢车菊素-3-O-葡萄糖苷在Fe3+存在下的一级降解速率常数为0.001 53(min-1),与本文研究结果相似[24]。
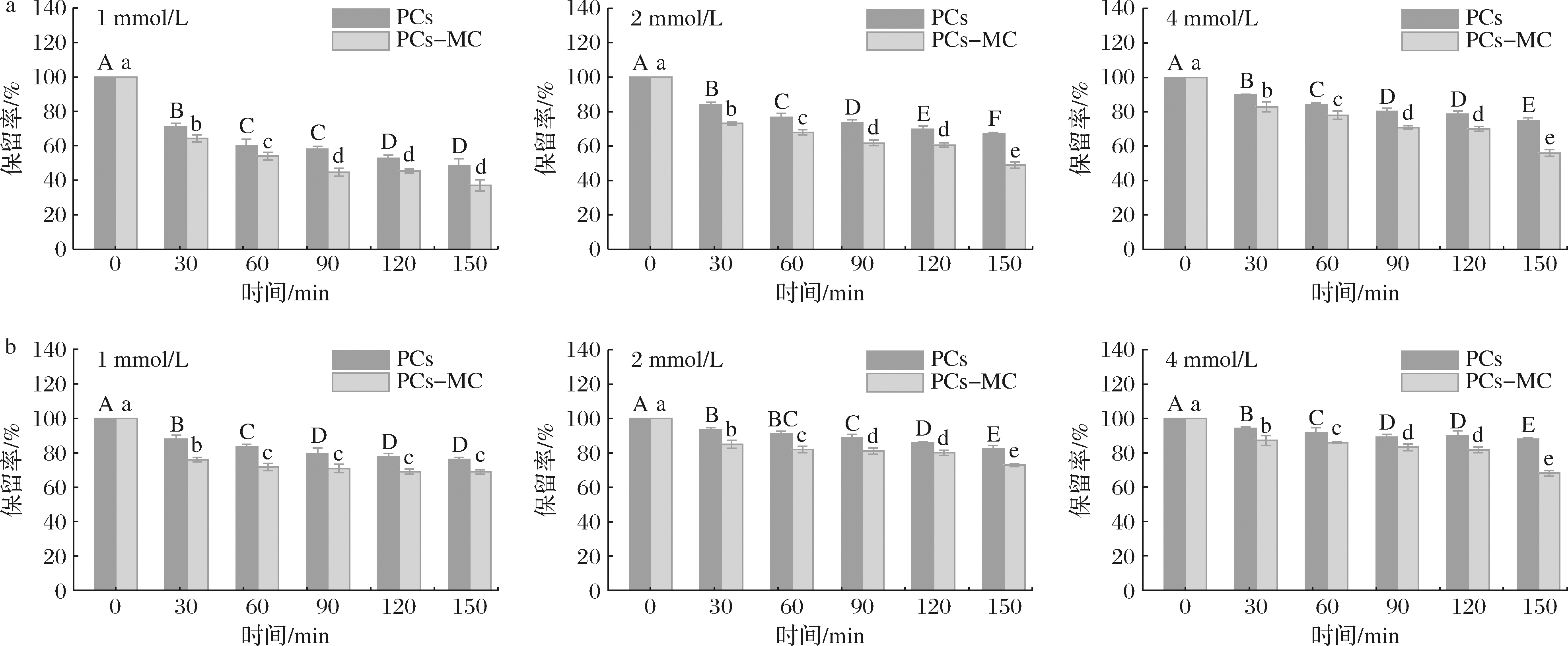
a-Fe3+对PCs保留率的影响;b-Zn2+对PCs保留率的影响
图10 Fe3+和Zn2+对PCs保留率的影响
Fig.10 Effect of Fe3+ and Zn2+ on the retention rate of PCs
2.3.2 Fe3+对PCs-MC复合物粒径和电位的影响
由图11-a可知,加入Fe3+后,游离PCs粒径迅速降低,可能是由于Fe3+与PCs螯合后结构发生改变,分子结构更紧凑所致。然而,PCs-MC复合物在Fe3+作用下粒径迅速增大,且随着时间的延长粒径越大,这可能是由于Fe3+与MC上特定的氨基酸残基或结合于MC上的PCs产生了螯合作用,将MC交联起来,形成更大的团簇结构。
由图11-b可知,加入Fe3+后,游离PCs体系电荷由负电变成正电,说明其与PCs产生了螯合作用;而PCs-MC复合物体系依然为负电体系,且带电量随着时间的延长逐渐降低,说明MC间可能发生了交联。由此可见,MC降低PCs的金属离子稳定性,其本质在于阻碍了PCs与金属离子的螯合作用,而该作用有利于稳定PCs的醌式碱结构不受亲核试剂攻击[25]。虽然MC与PCs的疏水作用也有利于提高其结构稳定性,但该作用效果弱于螯合作用。

a-Fe3+处理下PCs-MC复合物粒径;b-Fe3+处理下PCs-MC复合物Zeta电位
图11 Fe3+处理下PCs-MC复合物的粒径和Zeta电位
Fig.11 Particle size and Zeta-potential of PCs-MC complexes with Fe3+
2.4 H2O2对PCs-MC复合物稳定性的影响
2.4.1 不同H2O2浓度下PCs保留率分析
如图12所示,加入H2O2后,2种样品中PCs保留率都随时间的延长而降低,说明H2O2使PCs逐渐降解。

a-0.006% H2O2处理;b-0.024% H2O2处理
图12 不同浓度H2O2处理对PCs保留率的影响
Fig.12 Retention rate of PCs with different concentrations of H2O2
另外,随着H2O2浓度的增大,PCs保留率减小。与游离PCs相比,相同条件下复合物中PCs保留率均较高。MC与PCs的非共价结合,保护了PCs结构稳定,使其难以被氧化;而且,MC与 PCs结合后,其结构发生改变,可能将PCs包埋在肽链内部,使其不易与氧化剂接触,从而提高了稳定性。由此可见,MC对PCs在H2O2下的氧化降解有明显的抑制作用,与HE等[5]的研究报道一致。
同一浓度H2O2处理下,不同浓度样品中PCs保留率不同。其中,浓度为1 mmol/L时,H2O2处理后复合物中PCs保留率最高,浓度为2 mmol/L时PCs保留率最低,这可能是由于不同PCs浓度下,添加H2O2引起MC结构变化程度不同所致。当PCs浓度较低时,MC结构变化有利于将其包裹在分子内或分子间,从而提高其稳定性。H2O2存在下,PCs的降解符合一级降解动力学(表1)。有研究发现[26],在H2O2处理条件下,蓝莓花色苷降解符合一级动力学方程,0.0%~2.0% H2O2条件下花色苷降解速率k为0.000 4~0.057 4 min-1,与本文研究相似。
2.4.2 H2O2对PCs-MC复合物粒径和电位的影响
由图13-a可知,加入H2O2后,虽然游离PCs粒径随时间延长呈减小趋势,但粒径较大,说明PCs 在氧化剂作用下团聚现象严重,可能是PCs氧化聚集。PCs-MC复合物粒径随时间变化不大,说明体系基本没有发生团聚现象,证实体系较为稳定。由图13-b可知,加入H2O2后,游离PCs和PCs-MC复合物的电位变化不大。

a-0.024% H2O2处理下PCs-MC复合物粒径;b-0.024% H2O2处理下PCs-MC复合物Zeta电位图
图13 0.024% H2O2处理下PCs-MC复合物粒径和Zeta电位
Fig.13 Particle size and Zeta-potential of PCs-MC complexes with 0.024% H2O2
2.5 超声处理对PCs-MC复合物稳定性的影响
2.5.1 PCs保留率分析
由图14可知,超声处理下,MC促进了PCs的降解,这可能是由于超声处理不仅削弱了PCs与MC的相互作用,而且破坏了PCs分子间作用,使其稳定性降低。由表1可以看出,超声处理下PCs的降解符合一级降解动力学。
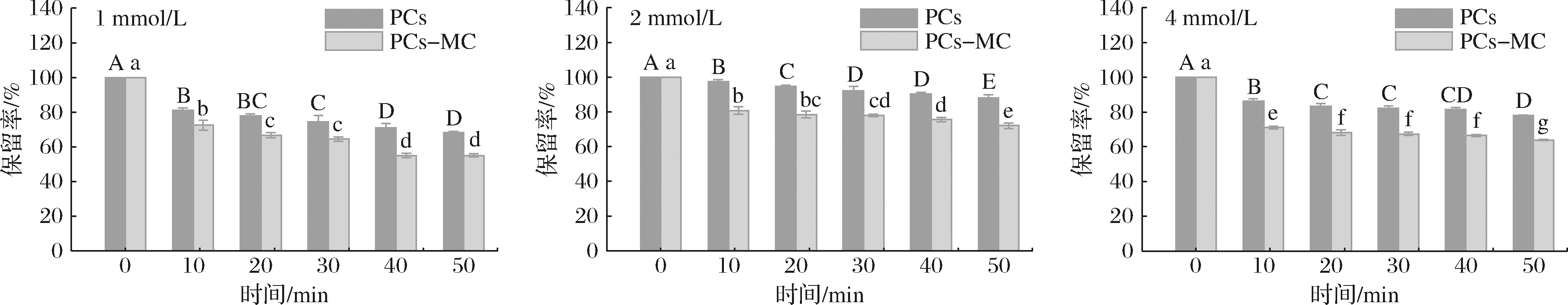
图14 超声处理对PCs保留率的影响
Fig.14 Retention rate of PCs-MC complexes during ultrasound treatment
2.5.2 超声处理对PCs-MC复合物粒径和电位的影响
从图15-a可以看出,游离PCs在超声10 min时粒径明显减小(P<0.05),但随着超声时间的延长粒径逐渐增大,可能是短时间超声促进了PCs的溶解,而长时间超声使其聚集。就PCs-MC复合物而言,超声处理对其粒径影响不大。由图15-b可知,超声处理对游离PCs和PCs-MC复合物的电位影响不大。可见,超声处理主要通过改变PCs分子间及PCs与MC之间的相互作用,从而影响PCs的稳定性。

a-超声处理下PCs-MC复合物粒径;b-超声处理下PCs-MC复合物Zeta电位
图15 超声处理时不同浓度PCs-MC复合物的粒径和Zeta电位
Fig.15 Particle size and Zeta-potential of PCs-MC complexes during ultrasound treatment
3 结论
以MC为载体,制备PCs-MC复合物,发现 PCs对MC有显著的荧光猝灭作用,且改变了MC的二级结构。XRD和FTIR光谱证实,PCs与MC形成复合物。MC对PCs的热稳定性影响与温度有关,其中MC降低了PCs在4 ℃时的稳定性,而提高了其在37、50、65 ℃时的保留率。另外,MC改善了PCs在H2O2作用下的稳定性。但是,在Fe3+、Zn2+作用下和超声处理时,PCs-MC复合物中PCs保留率低于游离PCs,可见MC促进了PCs的降解。综上所述,MC对PCs的稳定性影响与处理条件有关。
[1] 纪秀凤, 吕长鑫, 芦宇, 等.红树莓籽低聚原花青素微胶囊制备工艺优化及其稳定性分析[J].食品工业科技, 2019, 40(3):165-172.
JI X F, LYU C X, LU Y, et al.Optimization of preparation technology of microencapsulation of oligomeric proanthocyanidins from red raspberry seeds and its stability analysis[J].Science and Technology of Food Industry, 2019, 40(3):165-172.
[2] QUAN W, HE W, QIE X J, et al.Effects of β-cyclodextrin, whey protein, and soy protein on the thermal and storage stability of anthocyanins obtained from purple-fleshed sweet potatoes[J].Food Chemistry, 2020, 320:126655.
[3] KONG F S, SU Z P, ZHANG L Z, et al.Inclusion complex of grape seeds extracts with sulfobutyl ether β-cyclodextrin:Preparation, characterization, stability and evaluation of α-glucosidase and α-amylase inhibitory effects in vitro[J].LWT, 2019,101:819-826.
[4] LIU P, LI W R, HU Z Z, et al.Isolation, purification, identification, and stability of anthocyanins from Lycium ruthenicum Murr[J].LWT, 2020, 126:109334.
[5] HE Z Y, XU M Z, ZENG M M, et al.Preheated milk proteins improve the stability of grape skin anthocyanins extracts[J].Food Chemistry, 2016, 210:221-227.
[6] LANG Y X, LI B, GONG E S, et al.Effects of α-casein and β-casein on the stability, antioxidant activity and bioaccessibility of blueberry anthocyanins with an in vitro simulated digestion[J].Food Chemistry, 2021, 334:127526.
[7] SMITH G N, BROK E, CHRISTIANSEN M V, et al.Casein micelles in milk as sticky spheres[J].Soft Matter, 2020, 16(43):9 955-9 963.
[8] QIN J J, YANG M, WANG Y C, et al.Interaction between caffeic acid/caffeic acid phenethyl ester and micellar casein[J].Food Chemistry, 2021, 349:129154.
[9] YANG M, WEI Y M, ASHOKKUMAR M, et al.Effect of ultrasound on binding interaction between emodin and micellar casein and its microencapsulation at various temperatures[J].Ultrasonics Sonochemistry, 2020, 62:104861.
[10] YANG M, ZENG Q B, WANG Y C, et al.Effect of ultrasound pretreatment on the physicochemical properties and simulated gastrointestinal digestibility of micellar casein concentrates[J].LWT, 2021, 136:110319.
[11] LI D, ZHAO Y, WANG X, et al.Effects of (+)-catechin on a rice bran protein oil-in-water emulsion:Droplet size, zeta-potential, emulsifying properties, and rheological behavior[J].Food Hydrocolloids, 2020, 98:105306.
[12] WEN K S, RUAN X, WANG J, et al.Optimizing nucleophilic depolymerization of proanthocyanidins in grape seeds to dimeric proanthocyanidin B1 or B2[J].Journal of Agricultural and Food Chemistry, 2019, 67(21):5 978-5 988.
[13] ZANG Z H, CHOU S R, TIAN J L, et al.Effect of whey protein isolate on the stability and antioxidant capacity of blueberry anthocyanins:A mechanistic and in vitro simulation study[J].Food Chemistry, 2021, 336:127700.
[14] WANG C, XIE Y L.Interaction of protein isolate with anthocyanin extracted from black soybean and its effect on the anthocyanin stability[J].Journal of Food Science, 2019, 84(11):3 140-3 146.
[15] LI C H, DAI T T, CHEN J, et al.Protein-polyphenol functional ingredients:The foaming properties of lactoferrin are enhanced by forming complexes with procyanidin[J].Food Chemistry, 2021, 339:128145.
[16] MA G Q, TANG C Y, SUN X J, et al.The interaction mechanism of β-casein with oligomeric proanthocyanidins and its effect on proanthocyanidin bioaccessibility[J].Food Hydrocolloids, 2021, 113:106485.
[17] WANG S, YE X Q, SUN Y, et al.Nano complexes derived from chitosan and whey protein isolate enhance the thermal stability and slow the release of anthocyanins in simulated digestion and prepared instant coffee[J].Food Chemistry, 2021, 336:127707.
[18] SHADDEL R, HESARI J, AZADMARD-DAMIRCHI S, et al.Double emulsion followed by complex coacervation as a promising method for protection of black raspberry anthocyanins[J].Food Hydrocolloids, 2018, 77:803-816.
[19] YAN X H, LIANG S B, PENG T, et al.Influence of phenolic compounds on physicochemical and functional properties of protein isolate from Cinnamomum camphora seed kernel[J].Food Hydrocolloids, 2020, 102:105612.
[20] 王丽霞, 肖辉民, 吴浈浈, 等.喷雾干燥玫瑰茄花色苷微胶囊化效果及其性质[J].食品工业, 2021, 42(6):6-10.
WANG L X, XIAO H M, WU Z Z, et al.The encapsulation effect and the properties of spray-dried microencapsulated Roselle anthocyanins[J].The Food Industry, 2021, 42(6):6-10.
[21] LIU D S, ZHANG J, WANG L L, et al.Membrane-based fractionation, enzymatic dephosphorylation, and gastrointestinal digestibility of β-casein enriched serum protein ingredients[J].Food Hydrocolloids, 2019, 88:1-12.
[22] FAN L L, WANG Y, XIE P J, et al.Copigmentation effects of phenolics on color enhancement and stability of blackberry wine residue anthocyanins:Chromaticity, kinetics and structural simulation[J].Food Chemistry, 2019, 275:299-308.
[23] FERNANDES A, SOUSA A, AZEVEDO J, et al.Effect of cyclodextrins on the thermodynamic and kinetic properties of cyanidin-3-O-glucoside[J].Food Research International, 2013, 51(2):748-755.
[24] RATANAPOOMPINYO J, NGUYEN L T, DEVKOTA L, et al.The effects of selected metal ions on the stability of red cabbage anthocyanins and total phenolic compounds subjected to encapsulation process[J].Journal of Food Processing and Preservation, 2017, 41(6):e13234.
[25] PATRAS A, BRUNTON N P, O’DONNELL C, et al.Effect of thermal processing on anthocyanin stability in foods;mechanisms and kinetics of degradation[J].Trends in Food Science & Technology, 2010, 21(1):3-11.
[26] 李恩惠, 矫馨瑶, 王晨歌, 等.蓝莓花色苷降解动力学及稳定性[J].食品科学, 2018, 39(5):1-7.
LI E H, JIAO X Y, WANG C G, et al.Degradation kinetics and stability of of anthocyanins from blueberry[J].Food Science, 2018, 39(5):1-7.