羊乳与牛乳相比,营养价值高,脂肪球小,更易于人体吸收,且蛋白质组成更接近于人乳,是1种健康、安全、营养的重要代替乳源[1]。乳中酪蛋白占总蛋白含量的80%左右,主要以酪蛋白胶束形式存在,清蛋白主要由β-乳球蛋白(β-lactoglobulin,β-Lg)、α-乳白蛋白(α-lactalbumin,α-La)、免疫球蛋白(immunoglobulins,Ig)、血清白蛋白(bovine serum albumin,BSA)、乳铁蛋白(lactoferrin,LF)等组成。山羊乳的酪蛋白胶束较小,直径在160 nm左右,等电点约在4.1。相比于牛乳,山羊乳酪蛋白胶束结构较疏松,稳定性较低。乳清中含量最高的清蛋白是α-La和β-Lg,约占清蛋白含量的70%以上。α-La分子为球状单体蛋白,由123个氨基酸残基构成,其中包含8个半胱氨酸,形成4个分子内的二硫键,相对分子质量仅为14 kDa。其二级结构及三级结构有序紧密。山羊乳相较于牛乳,α-La缺乏蛋氨酸。山羊乳的β-Lg单体由162个氨基酸残基组成,含5个半胱氨酸残基,两两形成二硫键后,剩余1个游离的巯基基团[2],相对分子质量为18.3 kDa,易被氧化与其他蛋白质结合。热处理是乳品加工中最常用的方法,其目的主要是杀死乳中存在及滋生的致病菌及大部分微生物,使乳品达到卫生安全标准。但经热处理可能导致乳清蛋白的变性与流失。DEETH等[3]研究发现,牛乳经超高温瞬时灭菌(ultra-high temperature instantaneous sterilization,UHT)处理后,乳清蛋白与酪蛋白发生相互作用,特别是位于胶束表面的κ-酪蛋白。羊乳与牛乳在蛋白组成、含量及结构等方面都存在一定差异,在pH 5~9,山羊乳的β-Lg比牛乳少3个负电荷,多1个正电荷残基,在碱性下电泳迁移率不同[4]。因此羊乳使用牛乳常用杀菌方式并不适合,有研究发现,羊乳热稳定性低于牛乳,尤其是在UHT处理时,羊乳极易发生凝聚、沉淀,甚至发生变性[5]。针对羊乳热稳定性低,在选择热杀菌温度时,羊乳应相应降低处理温度。目前对于羊乳蛋白质结构及热加工稳定性的研究较为薄弱,故研究羊乳的热凝聚行为,为大规模液态羊乳生产提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜羊乳,陕西金牛乳业有限公司;N’N-亚甲基双丙烯酰胺,美国Sigma公司;丙烯酰胺、四甲基乙二胺、甘氨酸、Tris-base,美国Amresco公司;其他化学试剂均为分析纯。
1.2 仪器与设备
BP-Power电泳仪,北京百晶生物技术有限公司;HC-3018R高速冷冻离心机,安徽中科中佳科学仪器有限公司;GIS400凝胶成像分析系统,南京驰顺科技有限公司;傅里叶红外光谱仪,德国布鲁克公司;纳米粒度及Zeta电位仪,奥地利安东帕公司;环境扫描电子显微镜,捷克TESCAN公司。
1.3 实验方法
1.3.1 脱脂乳的制备及热处理羊乳样品制备
将新鲜羊乳采取常用商业杀菌方式进行热处理,处理方式设定如下:63 ℃/30 min、75 ℃/15~20 s、85 ℃/15~20 s、100 ℃/300 s、121 ℃/4 s,不进行热处理的乳样作为对照组。
1.3.2 不同温度热处理羊乳组分胶束粒径及电位分析
蛋白质的聚集程度可以用粒径来表示。不同热处理后的羊乳样品加入超纯水稀释20倍后用纳米粒度仪进行粒径测量。
Zeta电位的大小可以用来表征蛋白质在体系中的稳定程度。不同热处理后羊乳加入超纯水稀释10倍后进行Zeta电位的测量。
1.3.3 不同温度热处理羊乳微观结构分析
利用扫描电镜(scanning electron microscope,SEM)观察热处理后羊乳蛋白微观结构[6]。热处理后羊乳样品冷冻干燥,将干燥后粉末均匀置于导电胶上,样品台喷金处理。放入样品台后,调节到最佳视野后扫描图像。
1.3.4 傅里叶红外光谱二级结构分析
样品处理:将1.3.1中不同热处理后羊乳样品,分别进行真空冷冻干燥,于-20 ℃保存。傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析蛋白二级结构方法参照文献[7]。
1.3.5 羊乳清蛋白的分离
分离方法如图1所示。
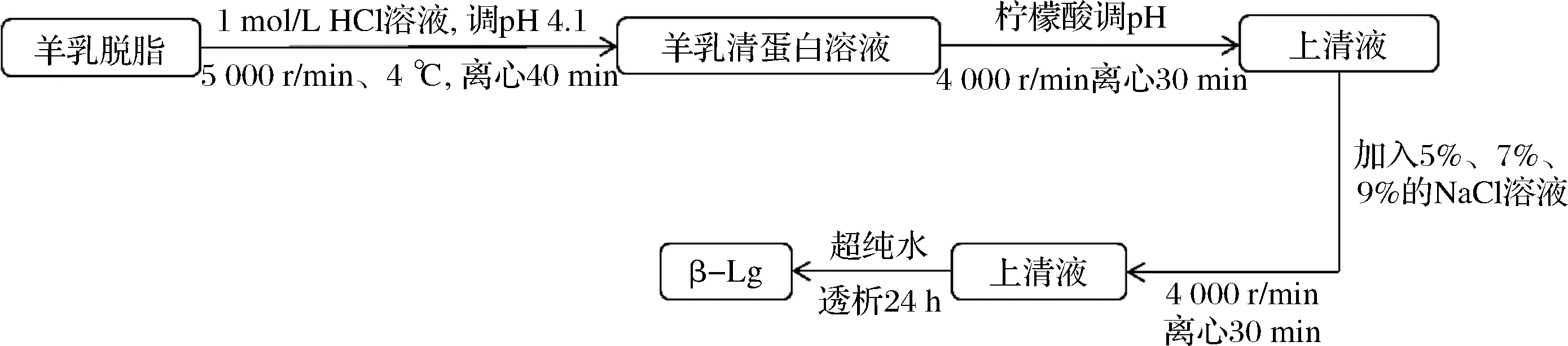
图1 羊乳清蛋白的分离及化学沉淀法分离β-乳球蛋白组分
Fig.1 Separation of goat whey protein and separation of β-lactoglobulin by chemical precipitation
1.3.6 β-乳球蛋白与羊乳中其他蛋白组分相互作用
经1.3.5中分离得到的羊乳β-Lg分别与标准品羊乳α-La、α-CN、β-CN和κ-CN按相应组分在羊乳中含量(α-CN,20.6%;β-CN,47.3%;κ-CN,17.7%;α-La,4%;β-Lg,10.3%)溶解混匀,分别对其进行热处理,取样后置于-20 ℃冰箱待测。
1.3.7 乳样中蛋白质SDS-PAGE分子质量分析
取β-乳球蛋白样品质量浓度为1 mg/mL,选择浓度15%的分离胶和浓度为5%的浓缩胶,分别加入还原性(含β-巯基乙醇,+β)与非还原性(无β-巯基乙醇,-β)的2倍蛋白样品缓冲液,分析蛋白在巯基乙醇是否还原二硫键的情况下蛋白的电泳迁移行为变化。点样量10 μL/孔。电泳结束后剥胶,放置摇床染色大约2~6 h。待染色完成后,更换脱色液至背景为无色。使用凝胶成像仪采集图像,并采用Image J对蛋白质条带灰度值进行分析,根据各条带的百分含量计算蛋白质纯度。
2 结果与分析
2.1 羊乳β-Lg的分离纯化结果
图2为不同NaCl浓度条件下对乳清蛋白的分离结果,当NaCl质量分数为9%时,即泳道3,能够得到较纯的β-Lg,采用Image J对蛋白质条带灰度值进行分析,根据各条带的百分含量计算β-Lg纯度为95%以上,纯度达到后续研究要求。
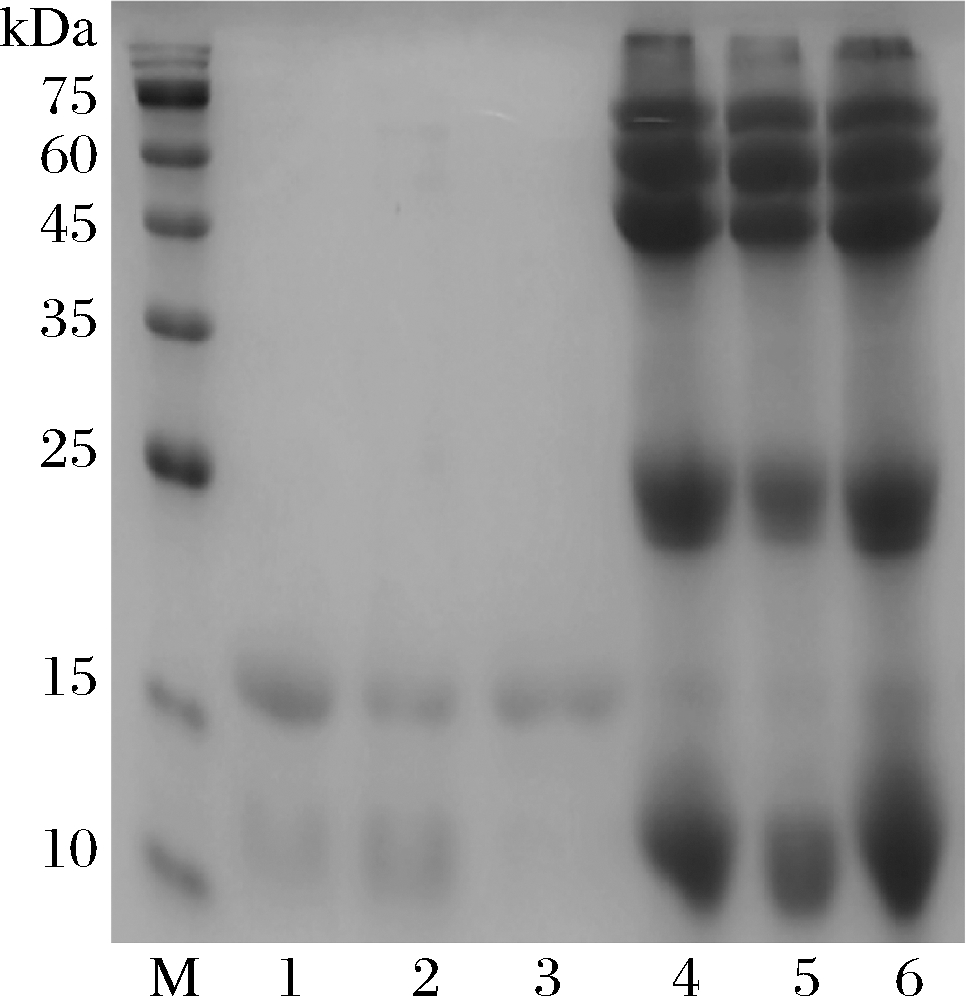
M-Marker;1~3为质量分数是5%,7%,9%NaCl溶液分离β-Lg上清;4~6为沉淀
图2 β-Lg分离的电泳结果
Fig.2 Electrophoresis results of separation of β-Lg
2.2 不同温度热处理后脱脂山羊乳胶束粒径分析
未经热处理羊乳的粒径主要分布在100~1 000 nm,平均粒径为209.6 nm(图3-a),由图3-b可见,热处理显著改变乳的粒径,经低温巴氏杀菌,平均粒径增大为217.7 nm,75 ℃处理后,粒径为219.7 nm,85 ℃的高温巴氏杀菌使得粒径增加到228.6 nm,当121 ℃处理时,平均粒径增加到289.2 nm,粒径增加显著。RAYNAL等[8]研究表明,在75 ℃/30 s加热后,羊奶中的胶束平均粒径增加不明显,在85 ℃/30 s加热后,胶束平均粒径增加。热处理使得乳清蛋白发生变性,且乳清蛋白与酪蛋白胶束也发生凝聚,故随着处理温度的增加,粒径分布峰宽扩大,平均粒径也在不断增大。
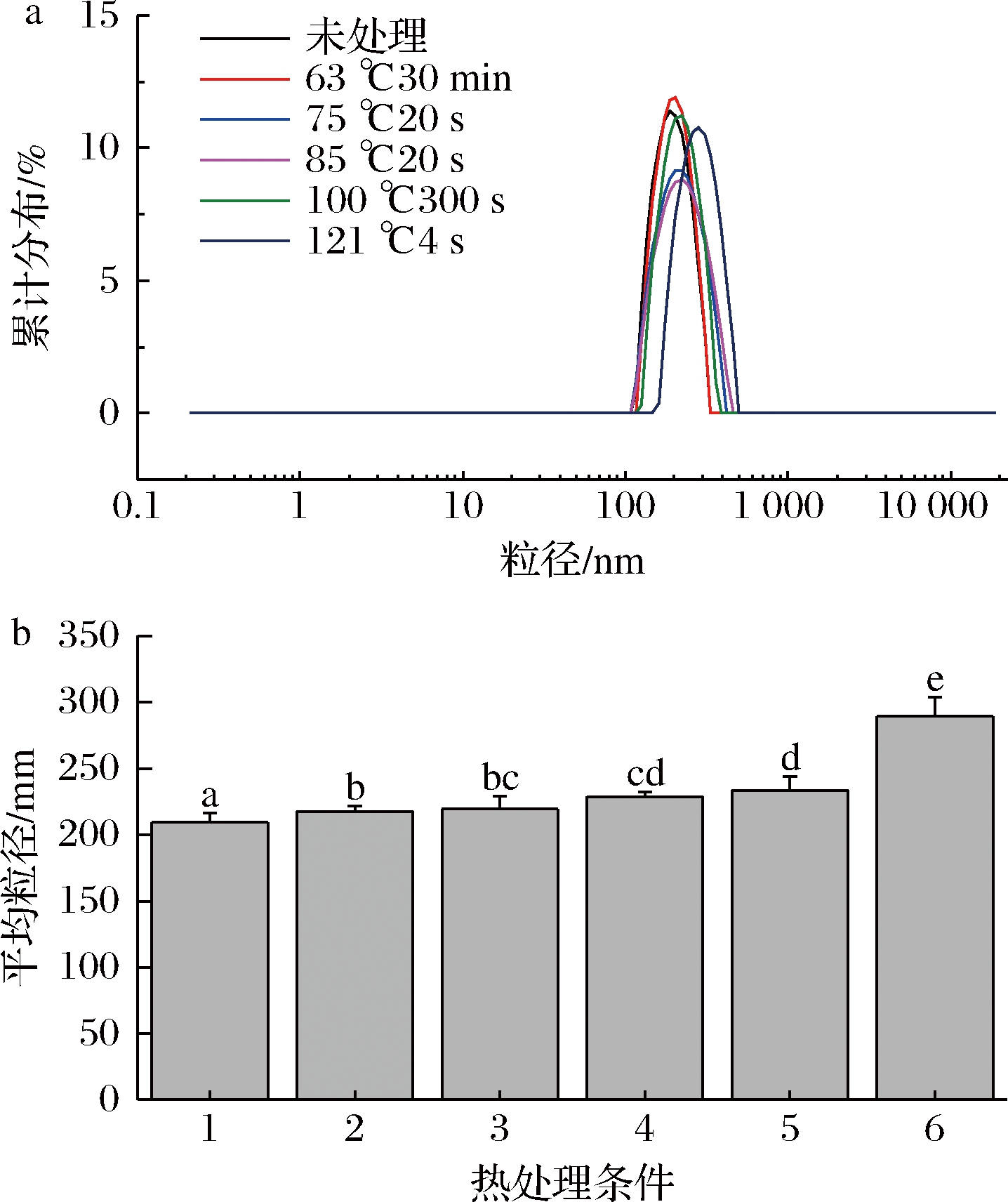
a-粒径分布图;b-平均粒径分布图
图3 不同热处理羊乳粒径图
Fig.3 The particle size of different heat-treated goat milk
注:1~6分别为未热处理、63 ℃/30 min、75 ℃/15 s、85 ℃/15 s、100 ℃/300 s、121 ℃/4 s处理羊乳,字母不同表示与对照组比具有显著性差异(P<0.05)(下同)
2.3 不同温度热处理羊乳Zeta电位分析
Zeta电位可以用来表征胶体分散系的稳定性,胶体粒子之间相互排斥或吸引,Zeta电位的绝对值越高,斥力越大,体系越稳定。由图4可知,鲜羊乳的电位为(-22.5±0.6) mV,经100 ℃处理,羊乳电位为(-15.7±0.2) mV,经121 ℃处理羊乳,平均电位为(-16.2±0.2) mV,较100 ℃的电位有所降低,随热处理强度增加,羊乳电位绝对值普遍降低,胶束稳定性越弱。张雪喜[9]对热处理后羊乳进行电位测定,与生鲜羊乳相比,不同热加工羊乳组的Zeta电位值均有不同程度地减小,85 ℃/15 s和125 ℃/4 s处理组间具有显著性差异。热处理使得乳清蛋白发生变性,并聚集在酪蛋白胶束表面,胶束表面的电荷下降,乳体系稳定性降低。
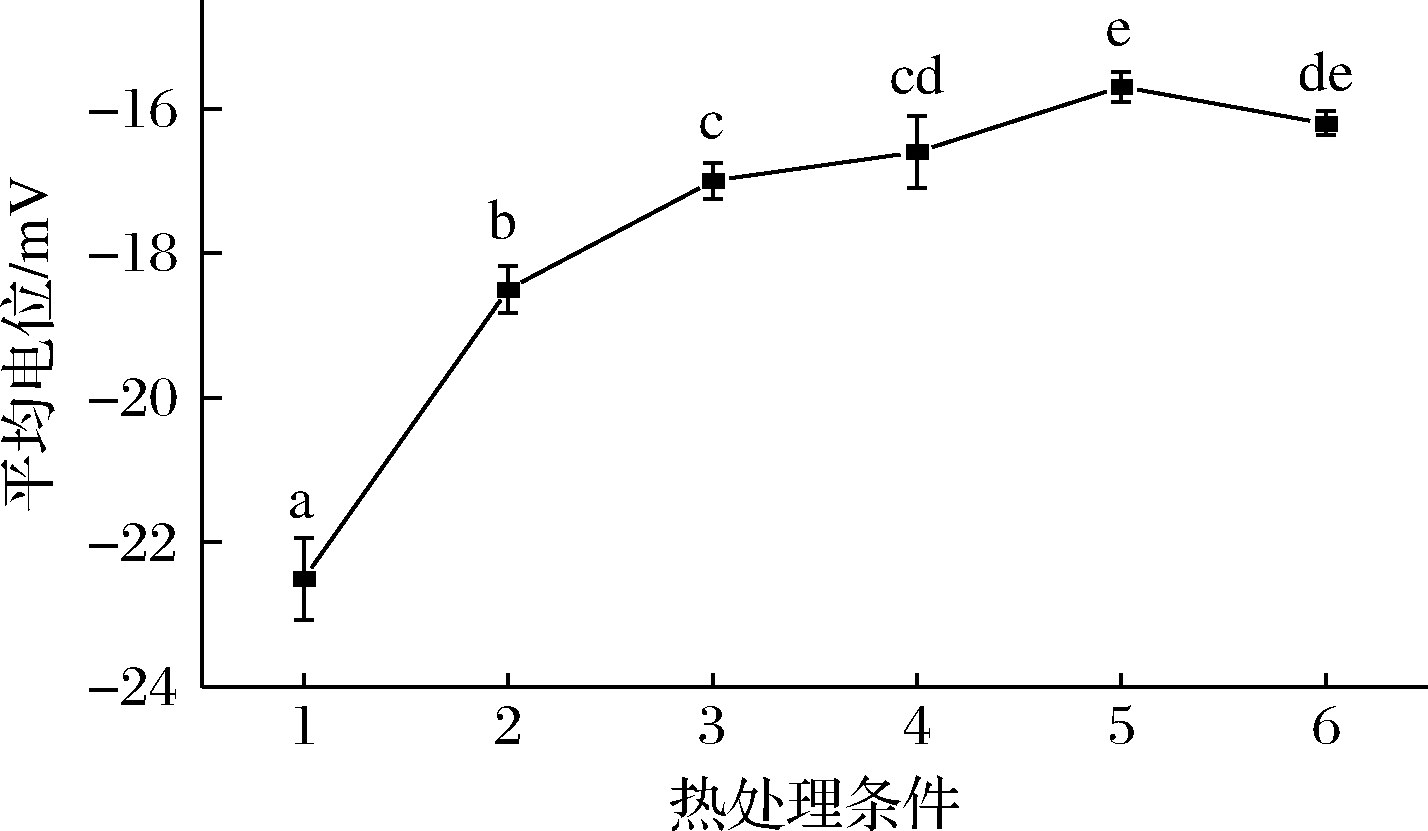
图4 不同热处理羊乳平均Zeta电位图
Fig.4 The average Zeta potential diagram of different heat-treated goat milk
2.4 不同温度热处理羊乳扫描电镜分析
图5为不同温度热处理脱脂山羊乳冷冻干燥后的SEM图,由图5-a可知,未处理羊乳的结构比较疏松,孔隙大小较均一,而经63和100 ℃处理的颗粒较大且大小不一,表面多孔网状结构消失,开始产生聚集,75 ℃处理组的表观来看呈片层结构且无明显网状结构,85 ℃处理后的乳蛋白相比于原料乳蛋白,明显有部分凝集,可能是由于乳蛋白部分形成热变性蛋白聚合物,表明蛋白质分子间的结合更紧密。121 ℃热处理的山羊乳乳粒表面平整孔隙明显。ZHANG等[10]对奶牛及牦牛酪蛋白胶束微观结构进行观察,奶牛酪蛋白胶束结构更为松散,孔隙较大。孙佳悦[11]对不同热处理牛乳蛋白质胶束结构进行观测,63及80 ℃处理牛乳后,相比于鲜牛乳,颗粒增大,且有部分凝集,形成蛋白聚合物。本实验中山羊乳在75和100 ℃热处理的蛋白质微观结构与上述牛乳有相似的结果。

a-未处理羊乳;b-63 ℃/30 min;c-75 ℃/15 s;d-85 ℃/15 s;e-100 ℃/300 s;f-121 ℃/4 s
图5 不同温度热处理羊乳扫描电镜图
Fig.5 Scanning electron microscope images of goat milk treated at different temperatures
2.5 不同温度热处理羊乳红外光谱分析
为分析经不同热处理后羊乳中蛋白二级结构的变化,对羊乳样品进行傅里叶红外光谱分析,结果如图6所示,经不同程度热处理羊乳与未经热处理羊乳的谱图差异较小。不同热处理条件下羊乳的透光度发生变化,特征吸收峰产生了不同程度的红移或蓝移,变化最明显的波段为3 600~3 100 cm-1和1 700~1 600 cm-1。
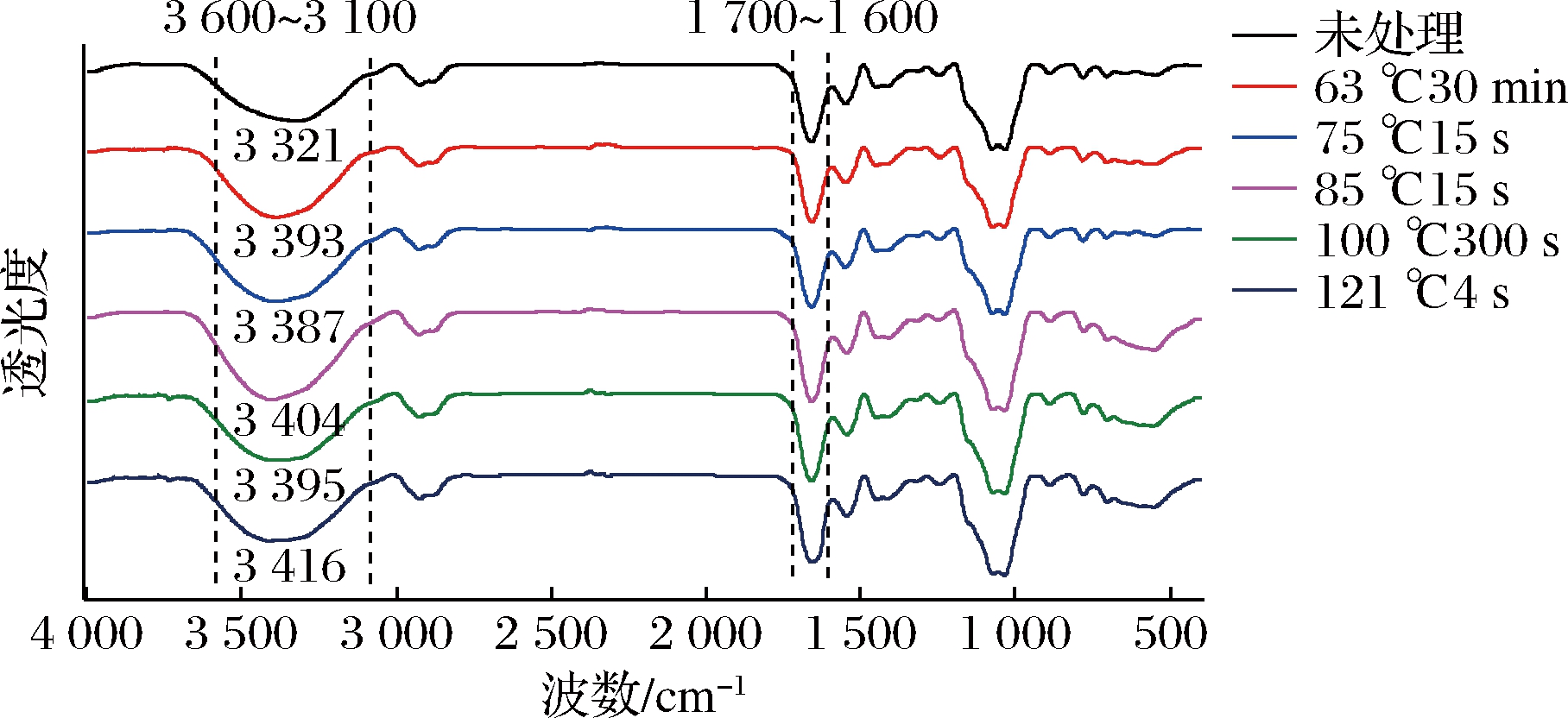
图6 不同热处理条件下羊乳蛋白FT-IR光谱图
Fig.6 FT-IR spectra of goat milk protein under different heat treatment conditions
研究表明,游离羟基的吸收峰位于3 600~3 500 cm-1,当其由游离态向结合态转化形成分子内或分子间氢键时,它的吸收峰也会随之红移并与N—H(谱带范围3 500~3 200 cm-1)的吸收峰重叠,从而会在3 400 cm-1左右形成吸收峰。在乳蛋白分子多聚体中存在大量分子内或分子间氢键时,在红外光谱图中表示为在3 400 cm-1左右波段吸收峰宽而强[12]。
由图6可知,未处理原料羊乳的红外谱带在3 321 cm-1处存在明显的特征吸收峰,说明氢键在分子内和分子间大量存在。经热处理后羊乳的吸收峰均发生一定程度的红移,说明蛋白分子间氢键断裂与重新缔合,羊乳蛋白的空间结构发生变化。在121 ℃的超高温处理下,羊乳吸收峰红移至3 416 cm-1,移动幅度最大,表明氢键破坏最为严重。
图7为羊乳经不同热处理后的酰胺Ⅰ带红外光谱图,经热处理后均有不同程度红移。对该图做二阶导数并进行高斯拟合,根据各子峰位置确定其与二级结构的对应关系,计算各峰的积分面积,得到各二级结构含量。
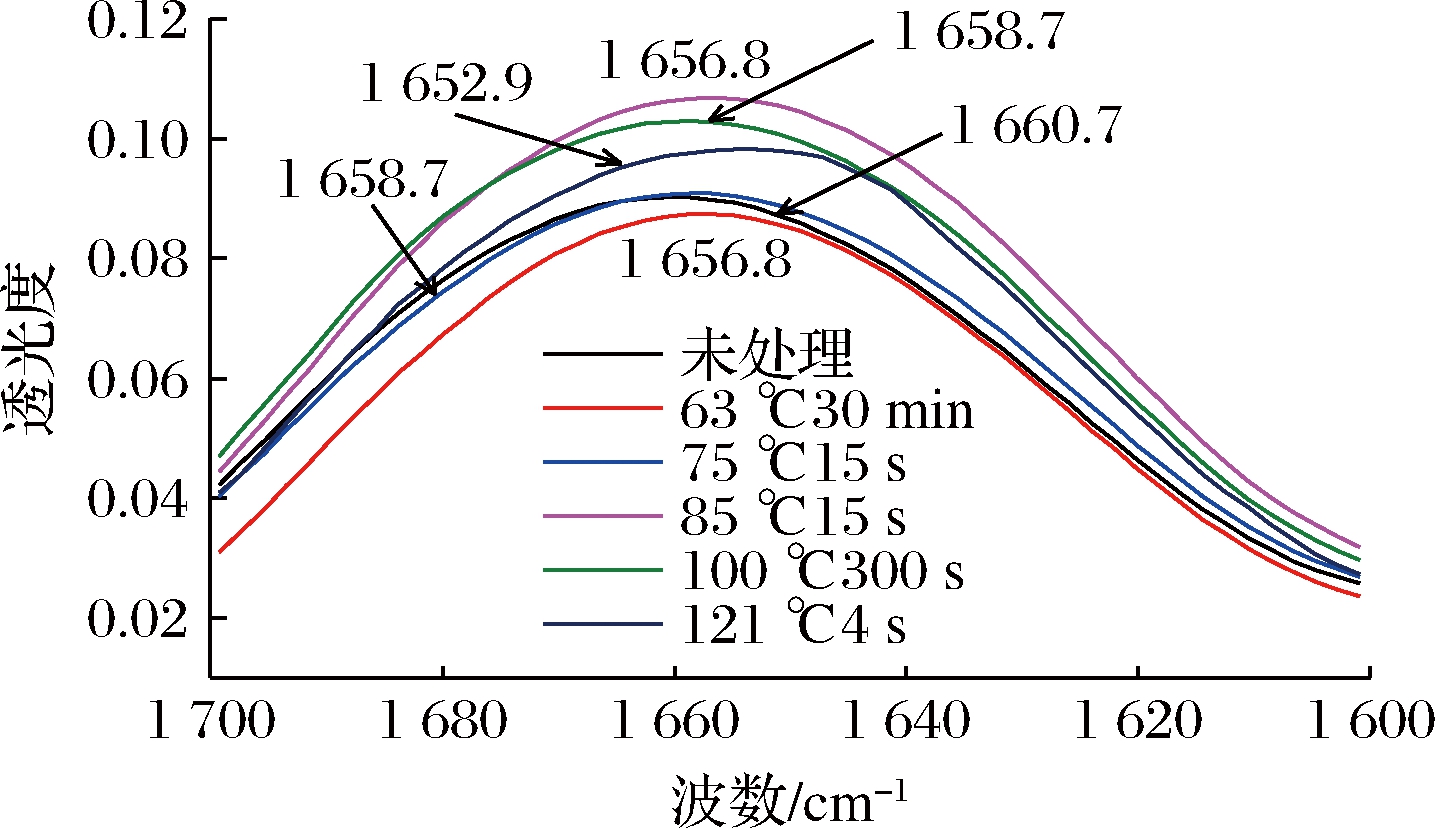
图7 羊乳蛋白经不同热处理酰胺Ⅰ带FT-IR光谱图
Fig.7 FT-IR spectra of goat milk protein amide Ⅰ with different heat treatment conditions
图8为不同热处理后羊乳蛋白酰胺Ⅰ带经高斯拟合处理得到的拟合图谱,拟合后的二级结构含量变化见表1,未处理羊乳蛋白α-螺旋结构占37.14%,羊乳蛋白经热处理后α-螺旋结构均有不同程度的减少,其中经121 ℃热处理的α-螺旋结构减少最为显著,达到14.47%。α-螺旋是蛋白质中常见且最为稳定的二级结构,靠链内氢键维持。热处理程度增大,使α-螺旋中的氢键逐渐断裂,发生解螺旋,乳蛋白发生热变性。故蛋白的结构稳定性与蛋白α-螺旋结构呈正比例关系。

a~f分别为未热处理、63 ℃/30 min、75 ℃/15 s、85 ℃/15 s、100 ℃/300 s、121 ℃/4 s热处理羊乳
图8 经不同热处理后羊乳蛋白酰胺Ⅰ带高斯曲线拟合图
Fig.8 Gaussian curve fitting diagram of goat milk protein amide Ⅰ under different heat treatment conditions
β-转角含量表现为先增加后降低,但总体呈现为增加趋势,未处理羊乳β-转角结构占30.66%,经85 ℃热处理后增加到45.35%,经100 ℃以上处理又减少到30%以上。β-折叠结构在原乳中为16.38%,经63及100 ℃处理的β-折叠结构含量增加,高温短时处理的羊乳β-折叠结构含量减少,含量处于波动状态。β-折叠结构常见于蛋白质内部折叠区域,经热处理后羊乳蛋白形成热聚集体,分子间的β-折叠结构易转变为β-转角结构,且部分β-转角结构转变为无规则卷曲结构[13]。
无规则卷曲结构在未处理羊乳中为15.83%;随着热处理温度升高,无规则卷曲含量逐渐升高,其中100 ℃热处理的乳蛋白中无规则卷曲含量显著增加到30.73%,这是由于热处理破坏了部分蛋白的二级结构。且随着热处理程度的增强,部分有序的乳蛋白结构逐渐向无序转化,无规则卷曲结构含量也就不断增加。孙佳悦等[14]对牛乳蛋白二级结构的研究结果与本研究中山羊乳的变化趋势一致。
表1 不同热处理条件下羊乳蛋白质二级结构含量变化
Table 1 The secondary structure content of goat milk protein under different heat treatment conditions
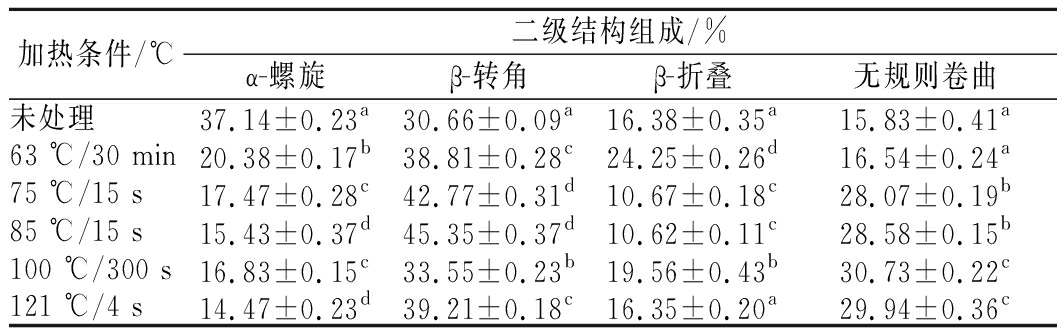
加热条件/℃二级结构组成/%α-螺旋β-转角β-折叠无规则卷曲未处理37.14±0.23a30.66±0.09a16.38±0.35a15.83±0.41a63 ℃/30 min20.38±0.17b38.81±0.28c24.25±0.26d16.54±0.24a75 ℃/15 s17.47±0.28c42.77±0.31d10.67±0.18c28.07±0.19b85 ℃/15 s15.43±0.37d45.35±0.37d10.62±0.11c28.58±0.15b100 ℃/300 s16.83±0.15c33.55±0.23b19.56±0.43b30.73±0.22c121 ℃/4 s14.47±0.23d39.21±0.18c16.35±0.20a29.94±0.36c
注:每列不同字母表示与对照组比有显著性差异(P<0.05)
2.6 不同温度热处理羊乳SDS-PAGE结果
用SDS-PAGE对不同温度热处理的羊乳样品的分子质量进行分析,羊乳蛋白经不同温度的热处理,蛋白发生变性、聚集、凝结的程度也不同。
不同热处理脱脂羊乳电泳结果见图9,对非还原性样品与还原性样品电泳结果作对比。
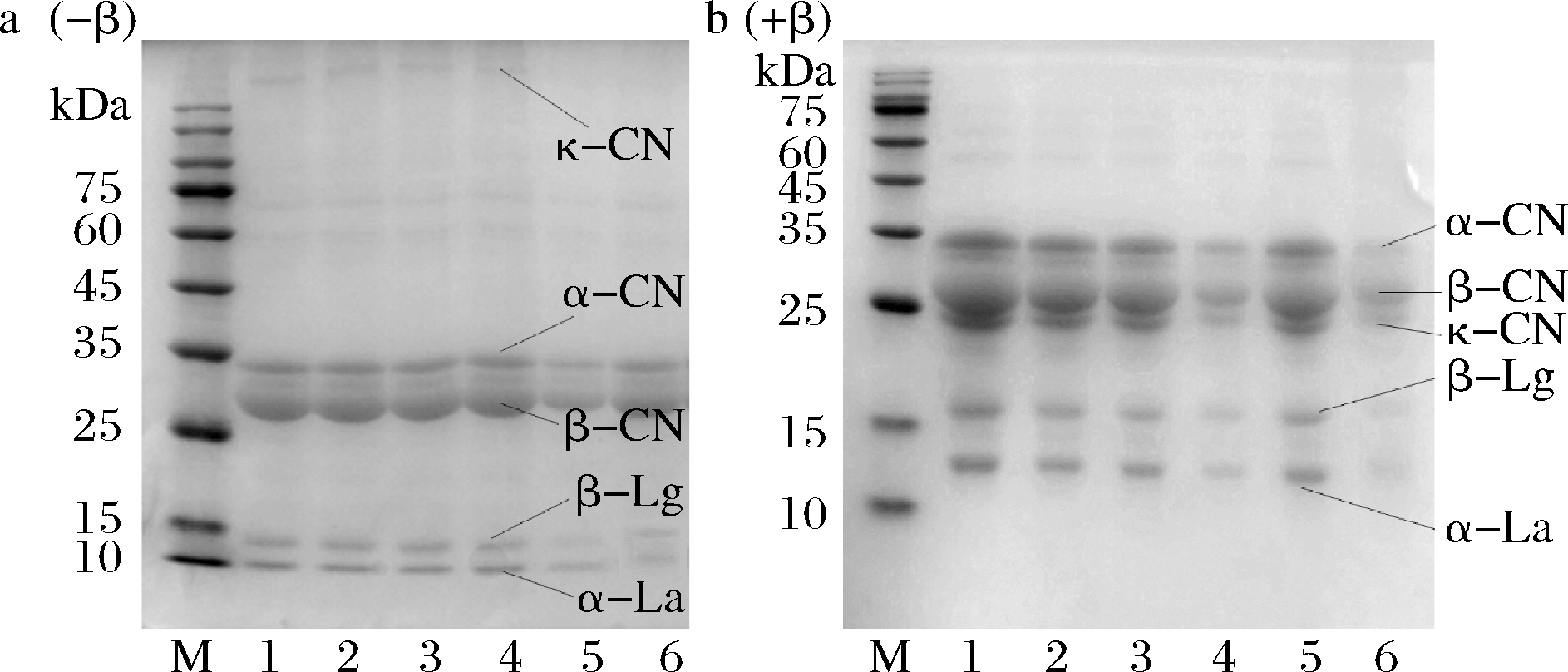
M-Marker;1-未处理羊乳;2~6分别为63 ℃/30 min、75 ℃/15 s、85 ℃/15 s、100 ℃/300 s、121 ℃/4 s处理羊乳a图(-β)表示非还原性样品,不含有β-巯基乙醇;b图(+β)为还原性样品,含有β-巯基乙醇
图9 不同热处理羊乳SDS-PAGE(-β) (+β)结果
Fig.9 SDS-PAGE (-β) (+β) results of different heat-treated goat milk
与鲜羊乳相比,脱脂羊乳经63 ℃低温长时巴氏杀菌与75和85 ℃的高温瞬时巴氏杀菌,蛋白电泳条带未发生明显变化,当热处理温度为100 ℃时,电泳条带发生明显变化,清蛋白变浅,且β-Lg较α-La蛋白条带更浅,且非还原性电泳κ-CN条带可明显观察到消失,比较还原和非还原电泳图可以发现,三者可能通过二硫键结合,当羊乳经121 ℃处理时,清蛋白与κ-CN变性,条带变浅。羊乳经85 ℃以上温度处理时,蛋白即聚集形成大分子物质无法通过浓缩胶,在加样口形成条带。
将热处理后的羊乳5 000 r/min离心分离出乳清,由上清液电泳可看出(图10),非还原性样品85 ℃处理后κ-CN条带就已消失,100 ℃以上处理β-Lg,κ-CN以及血清白蛋白条带都消失,α-La条带明显变浅,而上方上样孔存在不能迁移的大分子;故α-La的热稳定性比β-Lg的要高,β-Lg在85 ℃左右发生蛋白变性,α-La在90 ℃左右发生较大程度变性。结合还原性样品电泳图(+β),100 ℃处理后α-La和β-Lg条带变浅但未消失,故清蛋白β-Lg与部分的α-La经较高温度热处理可能与部分酪蛋白如κ-CN等发生交联聚集形成大分子蛋白。HOVJECKI等[15]研究热处理羊乳的电泳结果显示,经72 ℃/30 s以上处理后的样品中乳清蛋白显著聚集,85 ℃/5 min处理的样品中存在高分子质量二硫键蛋白复合物,不能扩散到凝胶中。本研究显示羊乳蛋白质对热敏感,85 ℃处理较短时间即发生变性。

注:1~6分别为未热处理、63 ℃/30 min、75 ℃/15 s、85 ℃/15 s、100 ℃/300 s、121 ℃/4 s处理羊乳离心后的上清液a-非还原性样品,不含有β-巯基乙醇;b-还原性样品,含有β-巯基乙醇
图10 不同热处理羊乳乳清部分SDS-PAGE(-β) (+β)结果
Fig.10 SDS-PAGE (-β) (+β) results of different heat-treated goat milk whey parts
2.7 酪蛋白与羊β-Lg间相互作用分析
经热处理后羊乳蛋白间存在聚集与交联,但交联方式与参与蛋白尚不清楚,故利用分离纯化的单组分蛋白进行热处理,探索蛋白间的聚集行为及相互作用。
热处理羊β-Lg与酪蛋白组分非还原性(-β)与还原性(+β)蛋白质电泳图见图11、图12。羊β-Lg与ɑ-CN混合热处理后,β-Lg条带颜色浅,由于β-Lg 分子含有游离巯基和二硫键容易发生热变性[16],经121 ℃处理,β-Lg与ɑ-CN条带都变浅,且有大分子蛋白生成,β-Lg与ɑ-CN可能发生二硫键的交联与转换而相互结合。羊β-Lg与β-CN混合热处理后,β-Lg条带未发生明显变化,β-Lg与β-CN可能未发生蛋白间的交联,且β-CN作为疏水性最强的蛋白,不能与β-Lg结合。羊β-Lg与κ-CN混合热处理,可观察到在121 ℃热处理时κ-CN有拖尾现象(图11-b),上方加样孔有条带,说明有大分子蛋白生成,可能是β-Lg与κ-CN形成了大小不一的蛋白质聚集物,β-Lg与κ-CN发生二硫键的结合[17-20]。PARRIS等[21]的研究表明牛乳在温度高于90 ℃,其中β-Lg也可通过二硫键与κ-CN形成大分子络合物。
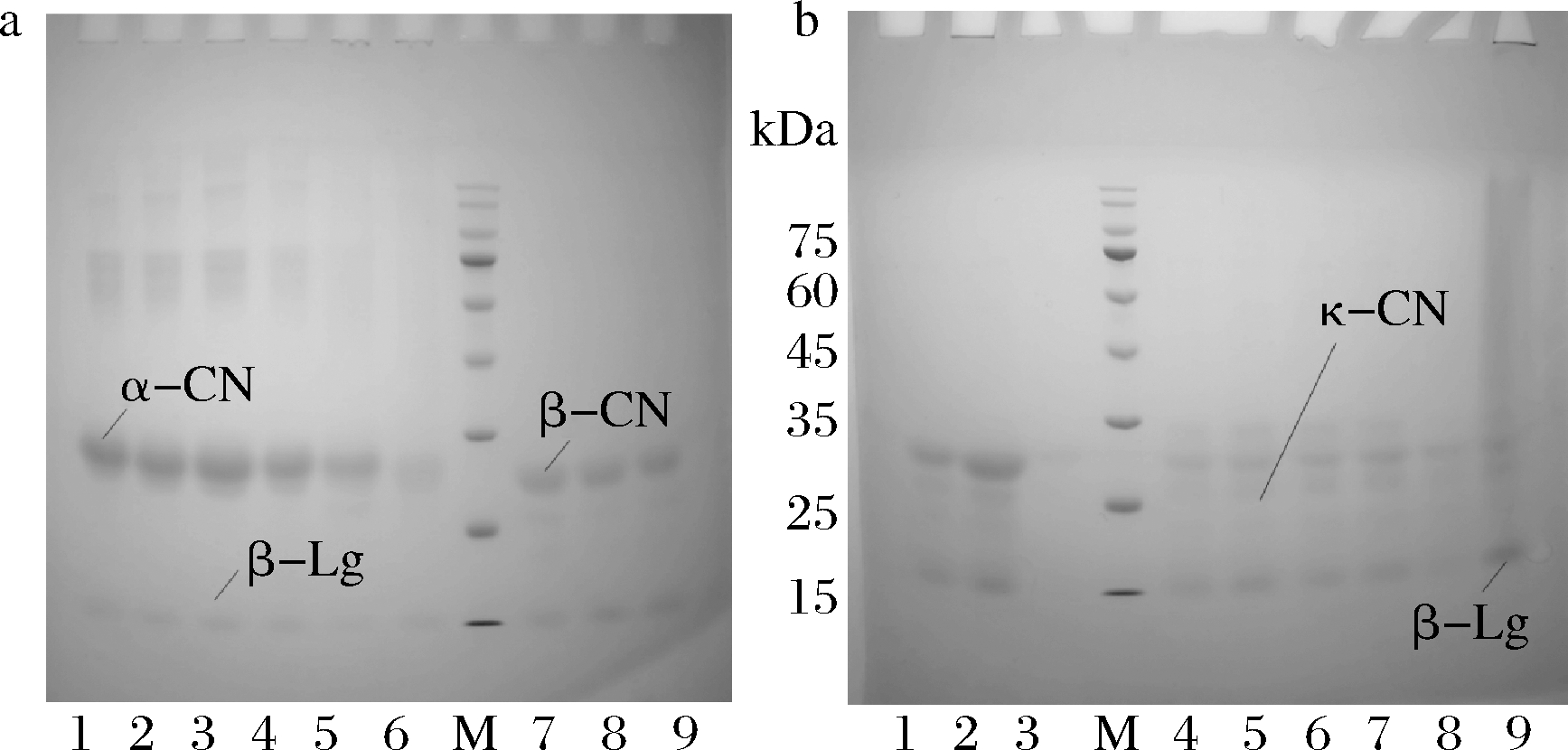
M-Marker;图a中1~6为β-Lg与ɑ-CN混合物;图a中7~9和图b中1~3为β-Lg与β-CN混合物;图b中4~9为β-Lg与κ-CN混合物;各组样本按顺序分别为:未热处理、63 ℃/30 min、75 ℃/15 s、85 ℃/15 s、100 ℃/300 s、121 ℃/4 s
图11 热处理羊β-Lg与酪蛋白组分的电泳结果(-β)
Fig.11 Electrophoresis results of heat-treated goat β-Lg and casein components (-β)

图12 热处理羊β-Lg与酪蛋白组分的电泳结果(+β)
Fig.12 Electrophoresis results of heat-treated goat β-Lg and casein components (+β)
3 结论
本研究对羊乳进行不同程度热处理,研究羊乳在热处理后蛋白变性,聚合及蛋白间相互作用关系,结果表明,经热处理后羊乳蛋白粒径增大,Zeta电位绝对值降低,乳体系稳定性下降;经红外光谱分析,蛋白质分子氢键断裂,二级结构中α-螺旋含量降低,无规则卷曲含量升高,乳蛋白质结构由有序向无序转变。羊乳经85 ℃处理,乳清蛋白发生变性,100 ℃处理后乳清蛋白完全变性,并交联产生蛋白聚合物;经单组分蛋白质间相互作用分析发现,山羊乳中β-Lg极易与胶束外围的κ-CN发生二硫键的交联与转化,使蛋白间凝聚,而α-CN则表现出与β-Lg有较低程度的结合。因此,在乳制品生产过程中,应选用合适的加工方式,使乳蛋白质结构能保持较高的稳定性。
[1] 程漱兰, 姚莉, 崔惠玲, 等.WTO背景下的中国奶业发展前景[J].农业经济问题, 2002, 23(3):9-16.
CHENG S L, YAO L, CUI H L, et al.The prospect of milk industrial development after China accession to WTO[J].Problem of Agricultural Economy, 2002, 23(3):9-16.
[2] 蒋超. 干酪乳清中乳蛋白分离纯化的研究[D].大连:大连工业大学, 2010.
JIANG C.Study on separation and purification of milk protein in cheese whey[D].Dalian:Dalian Polytechnic University, 2010.
[3] DEETH H, LEWIS M.Protein Stability in Sterilised Milk and Milk Products[M].New York:Springer New York, 2016:247-286.
[4] KEPPLER J K, HEYSE A, SCHEIDLER E, et al.Towards recombinantly produced milk proteins:Physicochemical and emulsifying properties of engineered whey protein beta-lactoglobulin variants[J].Food Hydrocolloids, 2021, 110:106132.
[5] HORNE D S.Casein interactions:Casting light on the black boxes, the structure in dairy products[J].International Dairy Journal, 1998, 8(3):171-177.
[6] MARTIN A H, GOFF H D, SMITH A, et al.Immobilization of casein micelles for probing their structure and interactions with polysaccharides using scanning electron microscopy (SEM)[J].Food Hydrocolloids, 2006, 20(6):817-824.
[7] 李萌, 王娟, 魏子凯, 等.圆二色光谱、红外光谱法解析羊乳和牛乳β-酪蛋白结构及性质差异[J].光谱学与光谱分析, 2020, 40(3):770-776.
LI M, WANG J, WEI Z K, et al.Analyzing structure and properties of goat milk β-casein and bovine milk β-casein by circular dichroism and Fourier transformation infrared spectroscopy[J].Spectroscopy and Spectral Analysis, 2020, 40(3):770-776.
[8] RAYNAL K, REMEUF F.The effect of heating on physicochemical and renneting properties of milk:A comparison between caprine, ovine and bovine milk[J].International Dairy Journal, 1998, 8(8):695-706.
[9] 张雪喜. 羊乳乳清蛋白的热变性作用及其微观特性和功能性质研究[D].济南:齐鲁工业大学, 2018.
ZHANG X X.Study on thermodenaturation, microscopically and functional properties of whey protein from goat milk[D].Jinan:Qilu University of Technology, 2018.
[10] ZHANG Y, REN F Z, WANG P J, et al.The influence of yak casein micelle size on rennet-induced coagulation properties[J].Journal of the Science of Food and Agriculture, 2021, 101(1):327-333.
[11] 孙佳悦. 乳清蛋白和酪蛋白热凝集反应机理研究[D].大连:大连工业大学, 2017.
SUN J Y.Study on the thermal polymerization reaction mechanism of whey protein and casein in different heat-treated conditions[D].Dalian:Dalian Polytechnic University, 2017.
[12] 张熙桐, 关博元, 孔繁华, 等.人乳、牛乳、羊乳中乳清部分氨基酸组成及乳清蛋白中蛋白质二级结构的对比[J].食品科学, 2017, 38(24):107-112.
ZHANG X T, GUAN B Y, KONG F H, et al.Comparative study of amino acid composition and secondary structure of whey proteins in human milk, cow milk, and goat milk[J].Food Science, 2017, 38(24):107-112.
[13] 张熙桐. 人、牛、羊乳乳清蛋白质组成及二级结构的研究[D].沈阳:沈阳农业大学, 2018.
ZHANG X T.Comparative study on composition and secondary structure of whey protein in human, bovine and goat milk[D].Shenyang:Shenyang Agricultural University, 2018.
[14] 孙佳悦, 钱方, 姜淑娟, 等.基于红外光谱分析热处理对牛乳蛋白质二级结构的影响[J].食品科学, 2017, 38(23):82-86.
SUN J Y, QIAN F, JIANG S J, et al.Effect of heat treatments on the secondary structure of milk proteins analyzed by Fourier transform infrared spectroscopy[J].Food Science, 2017, 38(23):82-86.
[15] HOVJECKI M, MILORADOVIC Z, RAC V, et al.Influence of heat treatment of goat milk on casein micelle size, rheological and textural properties of acid gels and set type yoghurts[J].Journal of Texture Studies, 2020, 51(4):680-687.
[16] 王立枫. 牦牛乳清蛋白热变性机制及乳蛋白的热凝聚作用[D].哈尔滨:哈尔滨工业大学, 2018.
WANG L F.Thermal denaturation mechanism of yak whey protein and thermal aggregation of milk protein[D].Harbin:Harbin Institute of Technology, 2018.
[17] ANEMA S G, LI Y M.Effect of pH on the association of denatured whey proteins with casein micelles in heated reconstituted skim milk[J].Journal of Agricultural and Food Chemistry, 2003, 51(6):1 640-1 646.
[18] RASMUSSEN L K, JOHNSEN L B, TSIORA A, et al.Disulphide-linked caseins and casein micelles[J].International Dairy Journal, 1999, 9(3-6):215-218.
[19] OLDFIELD D J, SINGH H, TAYLOR M W.Kinetics of heat-induced whey protein denaturation and aggregation in skim milks with adjusted whey protein concentration[J].The Journal of Dairy Research, 2005, 72(3):369-378.
[20] GUYOMARC’H F, LAW A J R, DALGLEISH D G.Formation of soluble and micelle-bound protein aggregates in heated milk[J].Journal of Agricultural and Food Chemistry, 2003, 51(16):4 652-4 660.
[21] PARRIS N, PURCELL J M, PTASHKIN S M.Thermal denaturation of whey proteins in skim milk[J].Journal of Agricultural and Food Chemistry, 1991, 39(12):2 167-2 170.