多孔淀粉(porous starch, PS)又称微孔淀粉,色白,呈粉末状,外观与原淀粉类似。它是由天然淀粉经过酶处理、化学/物理处理或酶与化学/物理处理相结合的方法得到的一种淀粉改性产物[1],与天然淀粉相比,多孔淀粉的形状呈多孔性蜂窝状,表面仍为圆形状,但其内部具有大量的孔隙结构或凹陷,从淀粉表面延伸至中心,导致其具有较大的比容积和比表面积,因而表现出较强的吸附性能。由于其良好的生物相容性、生物降解性、吸附性和廉价易得等优点,多孔淀粉已被广泛应用于化学[2]、制药业[3]、食品[4]、医疗[5]和环境[6]行业领域。
姜黄素(curcumin, Cur)又称姜黄色素,是常用的天然黄色色素,有特殊芳香味道。它是一个多酚类化合物,主要从姜科植物姜黄、莪术、郁金等传统中药材根茎[7]中提取,已被广泛应用于色素、食品添加剂及调味品中。实验证明姜黄素具有抗肿瘤、抗突变、降压、保肝等广泛的药理活性[8-11]。然而姜黄素还存在稳定性差、体内释放缓慢、半衰期短、在肠道中吸收率低等不足[12],这些不足导致其在人体内生物利用度较低,限制了它的实际应用。如何改善姜黄素在应用方面的缺点、提高体内生物利用度已经成为研究者们亟需解决的问题。近年来,新型姜黄素缓释载体的研究逐渐受到重视,其主要载体类型包括固体分散体[13]、脂质体载体[14]、纳米粒载体[15]、自微乳载体[16]、缓释微球载体[17]、线性糊精载体[18]等。其中,缓释微球载体具有制备简易、稳定性好、能提高难溶性药物的生物利用率等优点,受到了广泛关注。
目前已报到的姜黄素-多孔淀粉类微球,其载体主要有海藻酸盐和多孔淀粉复合凝胶[19]、多孔大米淀粉与黄原胶混合物[20]、多孔淀粉与β-环糊精混合物[21]等。但是这些报道并没有对玉米多孔淀粉作为载体展开优化制备、体外释放率等详细研究。基于此,本文选取姜黄素为模型药物、以玉米多孔淀粉为载体,制备得到负载姜黄素的多孔淀粉微球,考察微球的最佳制备条件、表征和性质,以及微球在模拟人体胃肠条件下的释放情况,为提高难溶性姜黄素在食品领域的生物利用率提供理论和实践依据。
1 材料与方法
1.1 材料
姜黄素,国药集团化学试剂有限公司,质量分数≥95%,批号20190305;玉米多孔淀粉(酶法制备),辽宁立达生物科技有限公司;无水乙醇(分析纯)、盐酸(分析纯),西陇科学股份有限公司;K2HPO4(分析纯)、KH2PO4(分析纯),天津市永大化学试剂有限公司;十二烷基硫酸钠(分析纯SDS),西陇科学股份有限公司;胰蛋白酶(1∶250,猪胰脏)、胃蛋白酶(1∶3 000,猪源),西亚试剂有限公司。
1.2 仪器设备
DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;GT10-1型高速台式离心机,北京时代北利离心机有限公司;ZWY-100H恒温培养振荡器,上海智城分析仪器制造有限公司;(2487型紫外检测器)高效液相色谱仪,美国Waters;扫描电子显微镜(scanning electron microscope,SEM),美国FEI INSPECT公司;全自动比表面及孔隙度分析仪(Brunauer-Emmett-Teller, BET),麦克ASAP 2020;460 ATR型傅里叶红外光谱仪(Fourier transform infteared inspectroscopy, FT-IR),美国NICOLET;D8 ADVANCE型X射线衍射仪(X-Ray diffraction, XRD),布鲁克;STA 449C差示量热扫描仪(differential scanning calorimetry-thermogravimetric analysis, DSC-TG),德国耐驰。
1.3 实验方法
1.3.1 负载姜黄素的多孔淀粉微球的制备
准确称取100 mg姜黄素溶于100 mL V(二氯甲烷)∶V(甲醇)=3∶1溶液中,按照不同的质量配比(姜黄素与多孔淀粉质量比1∶1~1∶5)加入适量的多孔淀粉,将混合体系密封、在室温下超声30 min后,置于恒温加热水浴锅中,在37 ℃下搅拌吸附2 h。每组实验重复3次。吸附完成后旋转蒸发除去二氯甲烷-甲醇混合液体,用上述混合液体洗涤除去微球表面的姜黄素,得到均匀的黄色固体。真空干燥、研磨、过80目筛,即得到负载姜黄素的多孔淀粉微球,置于干燥器备用。
1.3.2 负载姜黄素的多孔淀粉微球的优化
1.3.2.1 最佳投药质量浓度的确定
参考文献[22]的方法,烧杯中加入100 mL V(二氯甲烷)∶V(甲醇)=3∶1混合溶液,分别按姜黄素原药的投药质量浓度为40、50、60、70、80、90、100 mg/mL投入吸附体系中,再分别加入相应的多孔淀粉(按姜黄素原药与多孔淀粉质量比1∶5投药),将体系密封室温中超声30 min后,置于恒温加热水浴锅中,在37 ℃下磁力搅拌吸附2 h。每组实验重复3次。吸附完成后分别取样置入离心管内8 000 r/min离心10 min后,取上清液再次以8 000 r/min离心10 min后过滤,用HPLC法[23]检测上清液姜黄素含量。根据差减法,原始的姜黄素投入量减去上清液中所含的姜黄素的质量,即为理论上被多孔淀粉负载的姜黄素的质量。姜黄素的载药量和包封率如公式(1)(2)所示:
载药量![]()
(1)
包封率![]()
(2)
根据最大载药量与包封率时的姜黄素质量浓度来确定最佳投药质量浓度。
1.3.2.2 最佳投料比例的测定
在烧杯中加入100 mL V(二氯甲烷)∶V(甲醇)=3∶1混合溶液,计算出上述步骤得到的最佳投药浓度的姜黄素原药质量,将其分别投入几个吸附体系中,再依次加入相应配比质量的多孔淀粉(姜黄素原药与多孔淀粉质量配比设置在1∶1.50、1∶2.00、1∶2.50、1∶3.00、1∶3.50、1∶4.00)。重复上述实验步骤,吸附完成后分别取样置入离心管内8 000 r/min 离心10 min后,用HPLC法检测上清液中含有的姜黄素的含量。同上,依次计算出包封率,根据最大的包封率来探究最佳投料比例。
参照文献[22]还可以依据化学动力学来推算出单位质量多孔淀粉中最多可以吸附姜黄素原药的量。根据Langmuir吸附方程推导出载药量计算公式(3):
A=Qe(1+Qe)
(3)
式中:A,载药量;Qe,多孔淀粉的吸附率。
Ce为上清液中所含姜黄素的浓度。根据1/Ce与1/Qe的曲线可以得出线性回归方程y=kx+b。根据常数k=1/(Kd·Qmax),b=1/Qmax,可分别计算出Kd、Qmax的值。Qmax即为每克多孔淀粉中最多可以吸附姜黄素原药的量,Kd为吸附常数。
1.3.2.3 探究吸附时间的影响
在确定最佳姜黄素投药浓度和最佳吸附比例后,在100 mL V(二氯甲烷)∶V(甲醇)=3∶1混合溶液中投入上述得到的最佳投药浓度姜黄素及多孔淀粉。将吸附体系在室温下超声30 min后,置于37 ℃水浴锅中分别搅拌吸附2、5、10、15、20、30、45、60、120 min,并设置未搅拌吸附的空白作为对照。每组实验重复3次。吸附完成后分别取样置入离心管内8 000 r/min离心10 min,再次离心过滤后,取上清液用HPLC检测。对照标准品所绘制的回归方程曲线得到样品上清液中的姜黄素浓度。同上,依次计算出载药量和吸附率,根据最大的载药量和吸附率,来探究最佳吸附时间。
1.3.3 含量测定
1.3.3.1 色谱条件
姜黄素的含量可以通过高效液相色谱法[23]来测定,色谱条件如下:检测器:紫外检测器;色谱柱:Thermo Hyperil ODS C18柱(250 mm×4.6 mm, 5 μm);流动相:质量分数0.5%磷酸溶液-乙腈(体积比52∶48);流速1 mL/min;检测波长431 nm;进样量20 μL;柱温35 ℃。
1.3.3.2 模拟体外释放评价
为了进一步考察微球在模拟体外肠胃液中的释放性能,根据2020版《中国药典》第四部目录中通用技术要求之指导原则第9013条“缓释、控释和迟释制剂指导原则”,本文体外释放实验采用一定pH值的PBS作为释放液,其中加入质量分数0.5%的SDS作为溶出介质。参考文献[24],模拟肠液的释放实验如下:分别精密称取姜黄素微球10.0 mg,放入具塞离心管中,分别加入上述含0.5%SDS的60 mL pH 8.0的PBS溶液,加入0.60 g胰蛋白酶摇匀,恒温(37±0.5)℃气浴振荡(100 r/min)。在预定的时间内取4 mL上清液,以8 000 r/min转速离心10 min后,按上面的色谱条件进样,测定样品、计算释放率。并同时加入等体积的新鲜释放液,摇匀继续进行体外释放实验。除了加入不同pH值的缓冲溶液和酶,即加入pH 1.2的PBS溶液和0.20 g胃蛋白酶,模拟胃液实验步骤同上。
1.3.4 表征
1.3.4.1 SEM检测
取少量样品涂布在带有双面黏附胶的玻璃片上,操作电压为20 kV,并在Ar环境下喷金,放大不同倍数进行观察。
1.3.4.2 BET检测
采用全自动比表面及孔隙度分析仪,用低温液氮(-196 ℃)吸附法测定。相对压力(P/Po)范围0.01~1.0,称量样品0.06 g,测定前样品在300 ℃下脱气10 h。氮吸附法以BET吸附公式为测定依据,通过BET法测定比表面积。
1.3.4.3 傅里叶变换红外(Fourier transform infrared,FT-IR)检测
分别称取2 mg样品和200 mg KBr,同时放入玛瑙研钵中研磨均匀,烘干后的样品即可用红外压片模制片,在4 000~500 cm-1扫描。
1.3.4.4 XRD分析
电压与电流分别为40 kV和30 mA,扫描速度为4°/min,扫描范围为5°~85°。
1.3.4.5 DSC和TG检测
DSC检测:准确称取淀粉样品3 mg与蒸馏水以m(淀粉样品)∶m(蒸馏水)=1∶3在坩埚中混合并密封,置于4 ℃下平衡24 h,以10 ℃/min的速度由30 ℃加热至250 ℃,另取空坩埚作为空白对照。TG检测:分别取3 mg样品置于样品池后,以10 ℃/min升温速度从30 ℃升温到800 ℃。
1.3.4.6 粒径分析
分别将0.5 g未载药的微球与载药微球分散在10 mL去离子水中,超声形成混悬液。以去离子水作为分散剂,在2 000 r/min转速下将混悬液滴加到去离子水中。设置参数如下:0.1~5 000 nm进行扫描,水的折射率1.33,淀粉的折射率1.52,吸收率为0.01。
1.4 统计分析
所有的测试结果均为3次,结果均以平均值±标准差表示。
2 结果与讨论
2.1 最佳投料质量浓度的测定
如图1所示,当姜黄素的投药量为90 mg/mL时,载药量和吸附率达到最大,分别为17.85%和21.73%,且当投料质量浓度继续增大时,载药量和吸附率趋于平衡,不再增大,甚至出现下降趋势。这可能是由于多孔淀粉的吸附作用在90 mg/mL时已出现饱和,所以可以看出姜黄素的最佳投料质量浓度为90 mg/mL。
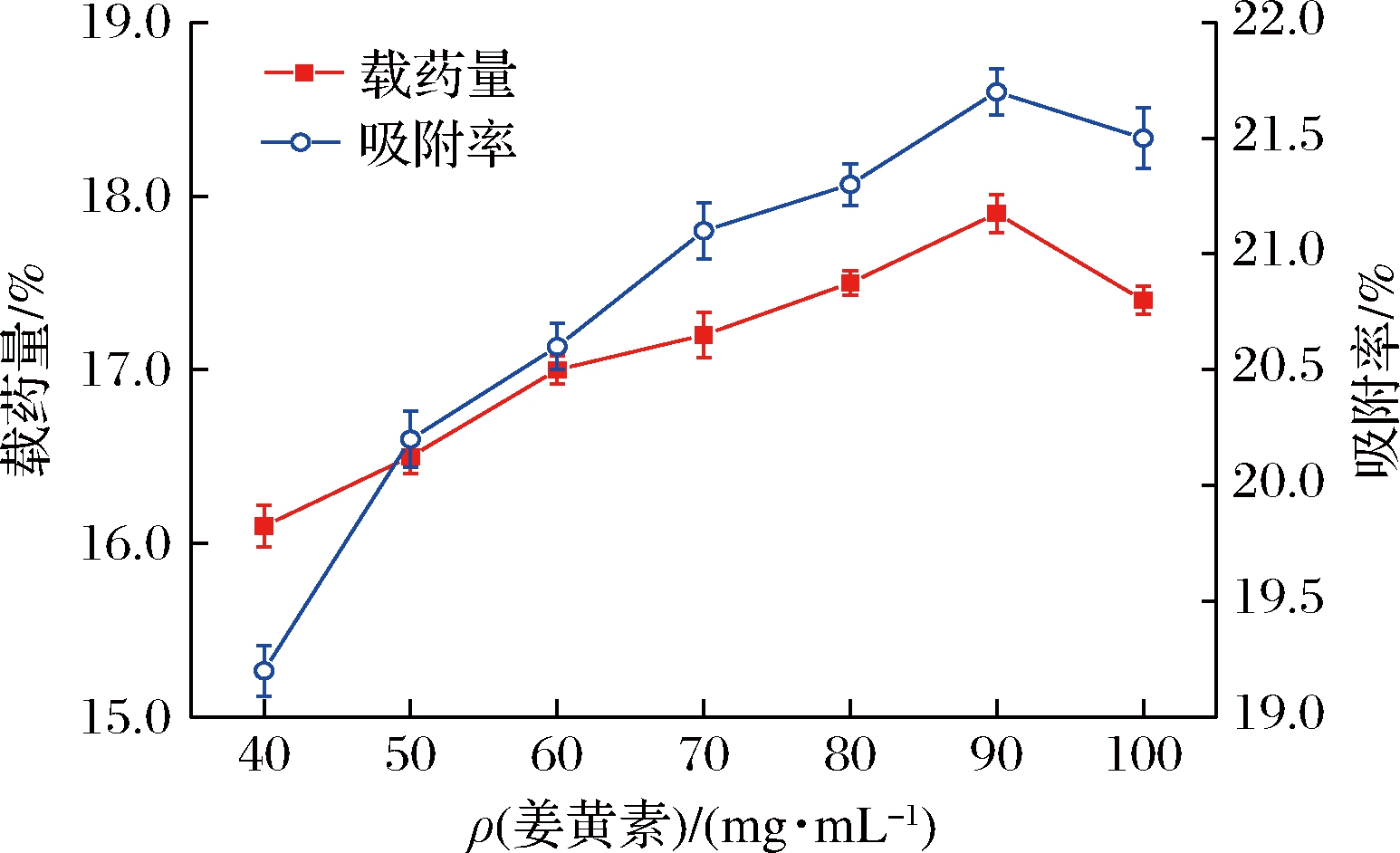
图1 姜黄素不同投药质量浓度下的载药量和吸附率
Fig.1 Drug loading and adsorption rate under different dosage concentrations of curcumin
2.2 最佳投料比例的测定
参照文献[22],图2为根据1/Ce与1/Qe所得的线性回归方程Y=19.54X+2.584,r2=0.99的等温吸附曲线。根据常数k=19.54=1/(KdQmax),b=2.58=1/Qmax,可计算出Qmax=0.39 mg/mg,即每毫克多孔淀粉可负载0.39 mg姜黄素。
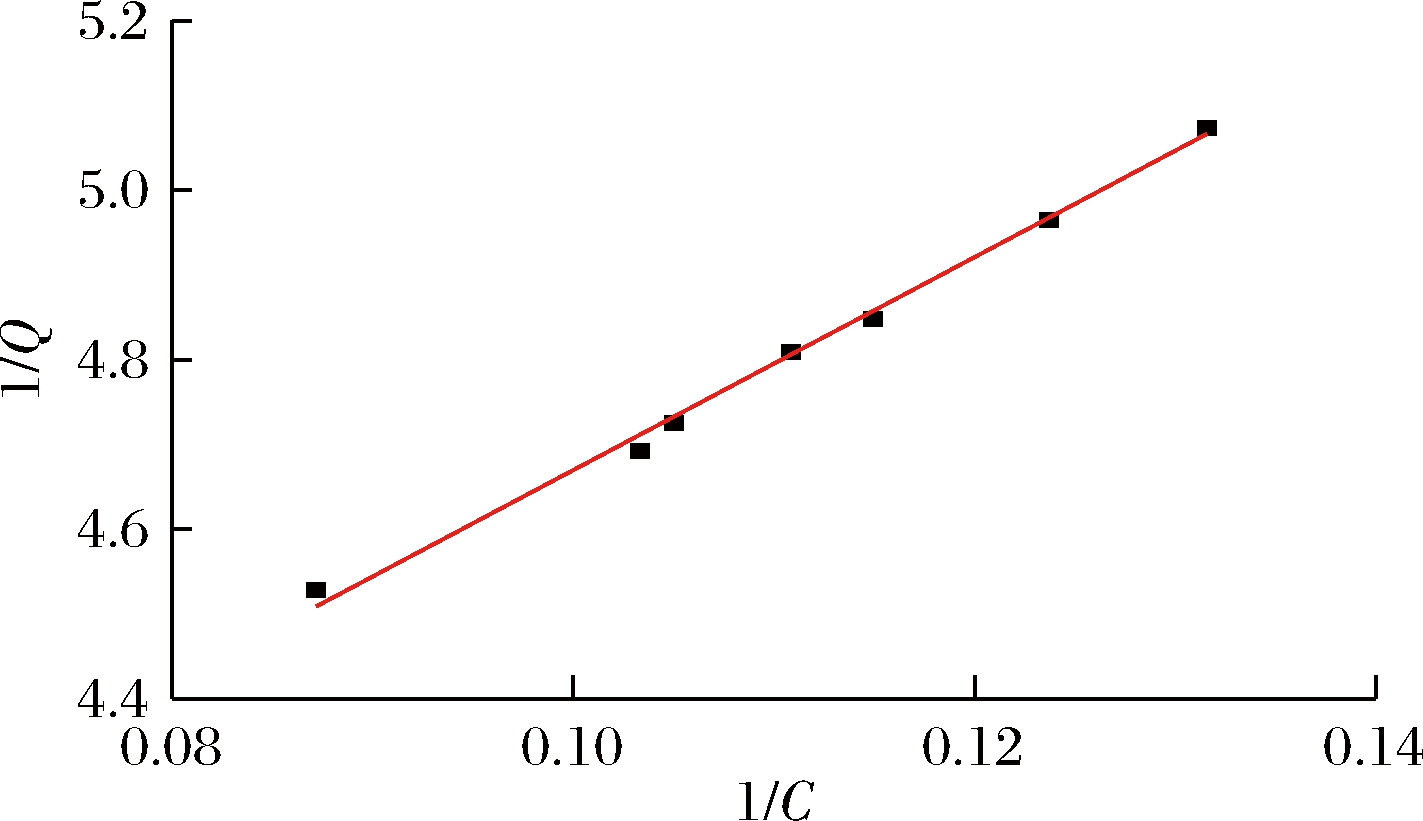
图2 多孔淀粉对姜黄素的等温吸附曲线
Fig.2 Porous starch adsorption isotherm curve of curcumin
如图3所示,当姜黄素原药与多孔淀粉的投药比例在1∶2.50附近时,包封率达到最大为(90.70±0.12)%,且当投料比例继续增大时,包封率趋于平衡,不再增大,甚至出现下降趋势。这与上面得到的结论“每毫克多孔淀粉可负载0.39 mg姜黄素”相一致,由此可以推出最佳吸附配比为:姜黄素900 mg、多孔淀粉2 250 mg,即两者最佳质量投料比例为1∶2.50。

图3 吸附体系不同投料比例时的包封率
Fig.3 Encapsulation efficiency of the adsorption system with different feeding ratios
2.3 探究吸附时间对姜黄素负载的影响
根据上述实验确定的最佳投药质量与吸附比例,应在10 mL V(二氯甲烷)∶V(甲醇)=3∶1混合溶液中分别投入姜黄素900 mg,多孔淀粉2 322 mg。在相同的吸附体系下吸附不同时间,根据不同时间下的载药量和吸附率绘制曲线方程,结果如图4所示。在吸附时间达到20 min时,载药量和吸附率均出现最大值,分别为(35.22±0.46)%和(54.37±0.51)%,之后的2 h内吸附过程趋于平衡状态,其载药量和吸附率的曲线也趋于平衡。因此,综合考虑载药量和吸附率,负载姜黄素的最佳吸附时间确定为20 min。

图4 不同吸附时间的载药量和吸附量
Fig.4 Drug loading and adsorption rate for different adsorption time of adsorption system
2.4 表征结果
2.4.1 SEM检测
为了观察姜黄素的负载情况,本文对多孔淀粉负载前后进行了形貌表征。图5-a为原生多孔淀粉形貌图,多孔淀粉粒径约5.00~8.00 μm,呈不规则球状,表面具有多孔连通结构,孔径小于1.00 μm。图5-b为负载姜黄素的多孔淀粉,孔隙被姜黄素填充满,大部分姜黄素被吸附在多孔淀粉空隙中,少量姜黄素分布在表面。这表明多孔淀粉成功负载姜黄素,形成了负载姜黄素的多孔淀粉微球。
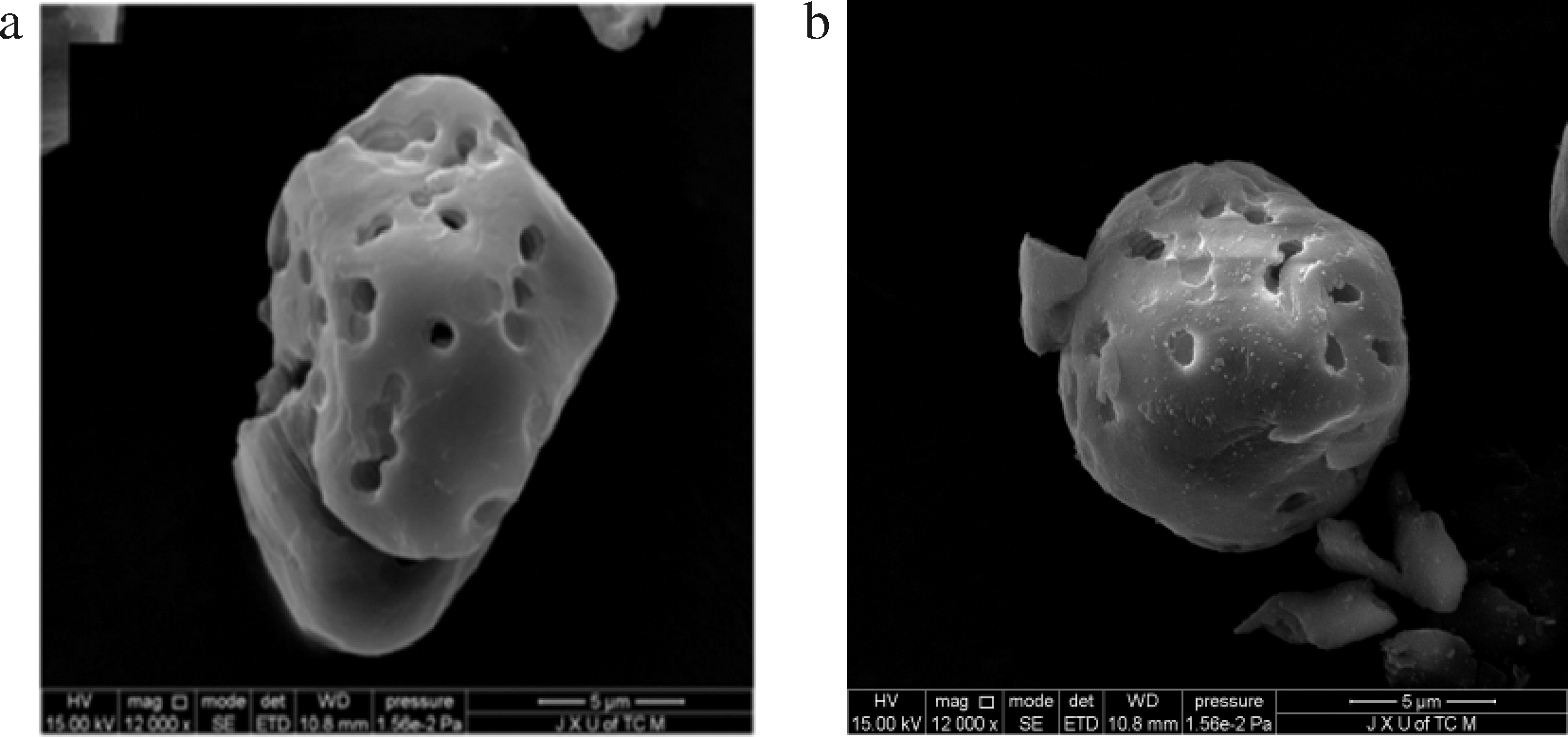
a-多孔淀粉;b-负载姜黄素的多孔淀粉
图5 多孔淀粉,负载姜黄素的多孔淀粉的扫描电镜图
Fig.5 SEM of porous starch, curcumin loaded porous starch microspheres
2.4.2 BET检测及粒径分析
多孔淀粉属于无定形态结构,粒径小、表面多孔,而姜黄素原药具有晶体结构。在制备过程中,多孔淀粉吸附姜黄素原药,使姜黄素的粒径变小。孔径结果如表1所示,原生多孔淀粉的平均孔径为5.80 nm,姜黄素多孔淀粉微球样品的平均孔径为1.06 nm,比负载前减少了81.72%;比表面积测定结果显示,多孔淀粉比表面积为16.76 m2/g,负载姜黄素的多孔淀粉微球样品比表面积为3.50 m2/g,比负载前减少了79.12%。而负载姜黄素的多孔淀粉微球样品和多孔淀粉的粒径基本变化不大,这表明姜黄素已成功负载于多孔淀粉载体内,多孔淀粉孔隙被姜黄素填充。
表1 比表面积和粒径分析
Table 1 BET and particle size analysis

样品比表面积/(m2·g-1)总孔容/(cm3·g-1)×10-3平均孔径/nm粒径/μm多孔淀粉16.760.455.8014.45负载姜黄素的多孔淀微球3.500.201.0614.89
2.4.3 FT-IR检测
为了进一步了解多孔淀粉和姜黄素之间的相互作用,对样品进行了FT-IR表征,如图6所示,3 520 cm-1为苯环上的—OH伸缩振动,1 627.96 cm-1处的特征吸收峰为C![]() O和C
O和C![]() C振动所致,1 510.68 cm-1为C—O和C—C振动,1 429.49 cm-1为烯烃C—H弯曲振动,1 281.86 cm-1为芳烃C—O伸缩振动[25]。对比多孔淀粉,负载姜黄素的多孔淀粉的—OH对应的伸缩振动峰由3 417.52 cm-1移动到3 409.53 cm-1,这可能归因于姜黄素的羟基与多孔淀粉葡萄糖之间的相互作用[25]。由此表明,多孔淀粉与姜黄素的相互作用主要是化学吸附引起的,姜黄素主要被吸附在孔道内;尽管吸附了姜黄素,多孔淀粉的表面化学结构没有发生显著变化。
C振动所致,1 510.68 cm-1为C—O和C—C振动,1 429.49 cm-1为烯烃C—H弯曲振动,1 281.86 cm-1为芳烃C—O伸缩振动[25]。对比多孔淀粉,负载姜黄素的多孔淀粉的—OH对应的伸缩振动峰由3 417.52 cm-1移动到3 409.53 cm-1,这可能归因于姜黄素的羟基与多孔淀粉葡萄糖之间的相互作用[25]。由此表明,多孔淀粉与姜黄素的相互作用主要是化学吸附引起的,姜黄素主要被吸附在孔道内;尽管吸附了姜黄素,多孔淀粉的表面化学结构没有发生显著变化。
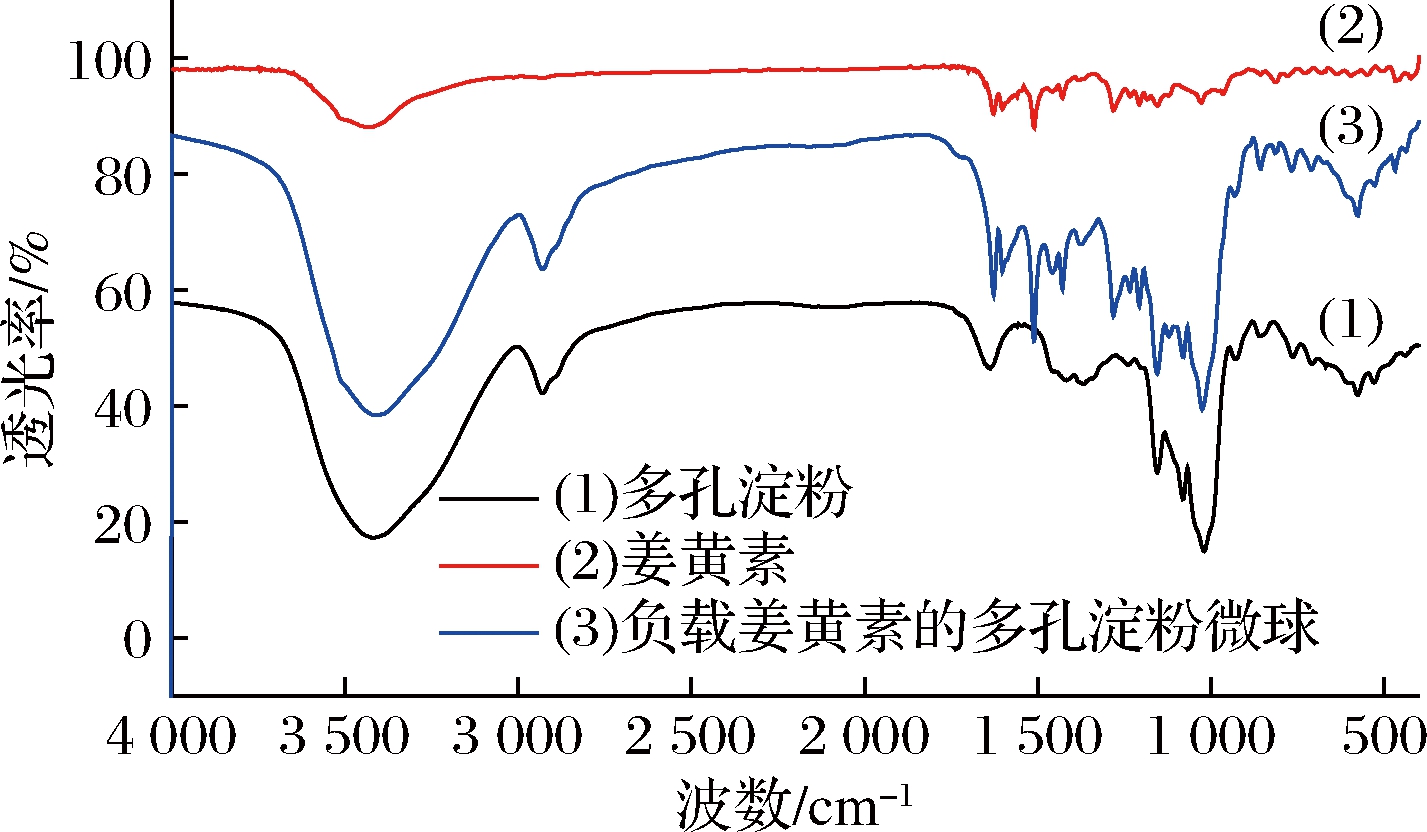
图6 多孔淀粉、姜黄素和负载姜黄素的多孔淀粉微球的FT-IR检测图谱
Fig.6 Infrared spectrum of porous starch, curcumin and curcumin loaded porous starch microspheres
2.4.4 XRD分析
如图7所示,多孔淀粉样品分别在2θ 15.12°、17.13°和23.25°表现出微弱的峰值,这是A型淀粉的典型特征,表明以无定形态形式存在。姜黄素图谱中的衍射峰,分别在2θ 8.98°、12.28°、14.69°、17.50°、23.52°、24.66°、25.66°和27.52°有明显衍射峰,证明姜黄素具有晶体结构并以晶体形式存在。在负载姜黄素的多孔淀粉微球的图谱上仍旧可以看到姜黄素的部分特征衍射峰(14.71°、17.84°、23.81°、25.84°、27.53°),只是与姜黄素相比,这些峰的强度有所减弱,说明大部分姜黄素被分散,少量以晶体形式存在。对比多孔淀粉,负载姜黄素的多孔淀粉微球图谱在2θ 14.71°和23.32°也出现了相似的很弱衍射峰,这说明,多孔淀粉起到了载体分散作用,姜黄素结晶度降低,以微晶状态分散于载体孔道和表面。这与FT-IR的测试结果相一致。

图7 多孔淀粉、姜黄素和负载姜黄素的多孔淀粉微球的XRD检测图谱
Fig.7 XRD spectrum of porous starch, curcumin and curcumin loaded porous starch microspheres
2.4.5 DSC和TG检测
如图8所示,多孔淀粉主要以无定形态存在,68 ℃出现一个熔点峰。姜黄素原药在177 ℃处显示出一个很明显的吸热峰,该峰为其熔点特征峰,表明姜黄素原药以晶体形式存在。多孔淀粉微球也出现同样较小的吸热峰,而其峰强度明显降低,这说明大部分的姜黄素已经被多孔淀粉吸附在内部空隙中,只有少量吸附在多孔淀粉微球的表面,这与XRD的检测结果是一致的。

图8 多孔淀粉、姜黄素和负载姜黄素的多孔淀粉微球的DSC检测图谱
Fig.8 DSC spectrum of porous starch, curcumin and curcumin loaded porous starch microspheres
根据图9的TG数据结果分析,多孔淀粉从30 ℃开始出现少量热失重,到100 ℃左右基本处于稳定状态,100~300 ℃时质量损失不明显,300 ℃开始迅速失重,在350 ℃时只剩余20%。姜黄素原药也在300 ℃左右开始迅速失重,直至400 ℃时已经热分解50%,而微球也从30 ℃开始热分解,30~100 ℃时质量损失不明显,而当温度升高到300 ℃后开始出现较为迅速的质量损失。这一现象说明在多孔淀粉微球中,2种物质几乎同时受热分解。值得注意的是,在400 ℃时,多孔淀粉微球的质量损失比多孔淀粉少30%,而这一结果和测得的载药量(35.22±0.46)%也是接近的。
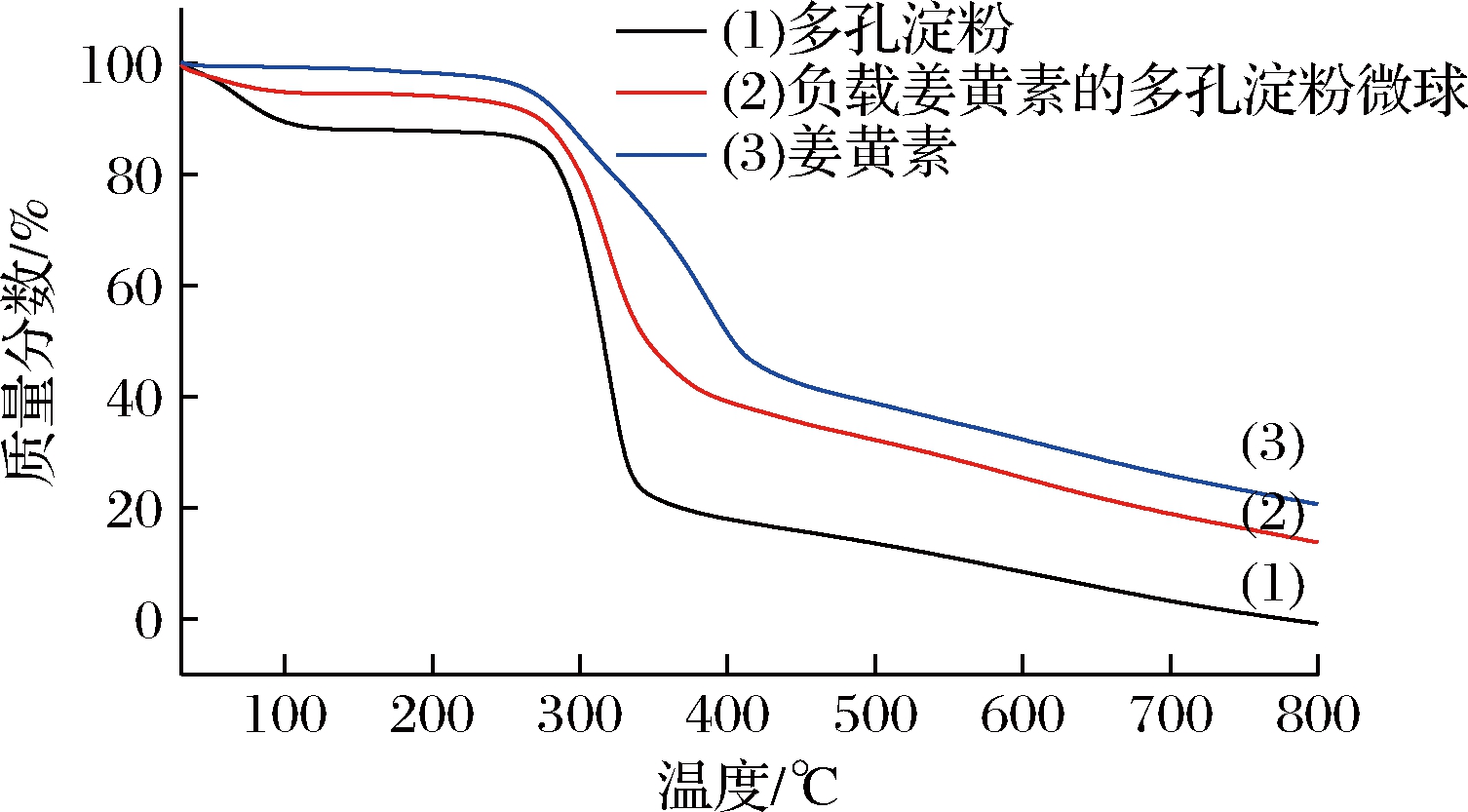
图9 多孔淀粉、姜黄素和负载姜黄素的多孔淀粉微球的热重检测图谱
Fig.9 TG spectrum of porous starch, curcumin and curcumin loaded porous starch microspheres
2.5 体外释放实验
为了证明负载姜黄素的多孔淀粉微球的缓释行为,除了对比姜黄素原药、负载姜黄素的多孔淀粉微球(质量配比为1∶2.50),还进行了姜黄素与多孔淀粉(质量配比同上)的物理混合物在磷酸缓冲溶液的体外释放研究。图10为体外释放曲线,通过观察可以发现与物理混合物和姜黄素相比,多孔淀粉微球的姜黄素释放率显著提高。模拟胃液的释放率如图10-a所示,在2.5 h内,物理混合物的释放率比姜黄素提高了2.10%,然而负载姜黄素的多孔淀粉微球比纯姜黄素提高了16.10%。
模拟肠液的释放率如图10-b所示,在4.5 h内,物理混合物的释放率比纯姜黄素提高了1.90%,然而负载姜黄素的多孔淀粉微球比姜黄素提高了17.00%。这些结果表明:将姜黄素包裹在多孔淀粉中可以提高姜黄素在肠道中的释放率。这可能跟多孔淀粉的亲水性相关[21],通常亲水性辅料会提高药物的溶解度,这里姜黄素溶解到有机溶剂后与多孔淀粉混合,可以防止姜黄素聚集,增加姜黄素的润湿性,进而提高姜黄素的溶出。而物理混合物中,姜黄素没有经过溶解重构过程,仅与多孔淀粉混合。
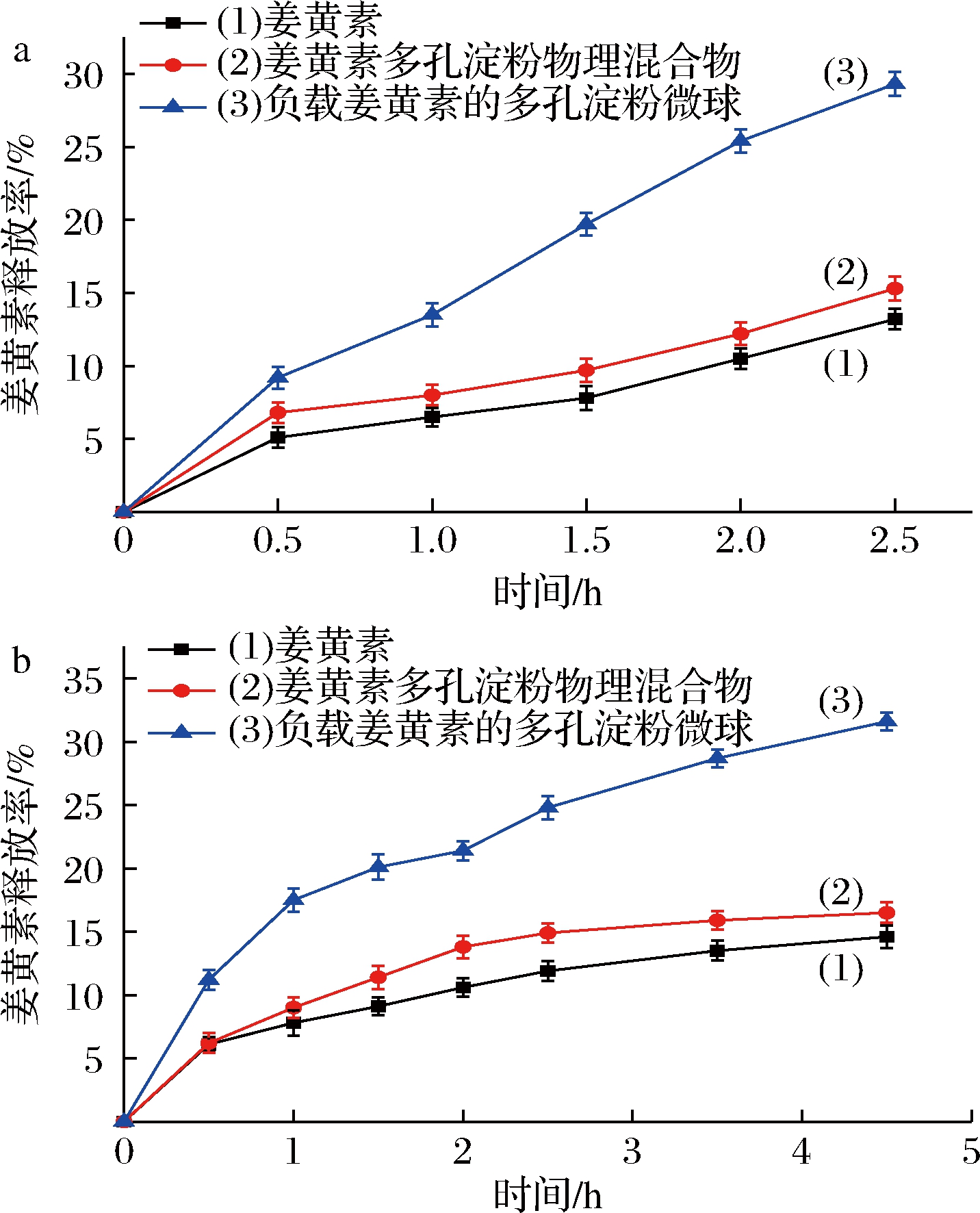
a-模拟胃液;b-模拟肠液
图10 负载姜黄素的多孔淀粉微球的体外释放曲线模拟胃液,模拟肠液
Fig.10 In vitro cumulative drug release of curcumin loaded porous starch microspheres under stimulated gastric and intestinal
3 结论
本文制备了负载姜黄素的多孔淀粉微球,表征结果表明,多孔淀粉作为载体可明显提高姜黄素的溶出速率;其中姜黄素与多孔淀粉的质量比为1∶2.50时,姜黄素体外释放率达到最大;姜黄素使多孔淀粉的孔径变小、比表面积减小;姜黄素吸附进入多孔淀粉的孔隙结构,但是在孔隙内部受到纳米孔道的约束,姜黄素没按晶型结构有序排列,而大多呈无定型态或极细小的微晶态分布。这为提高难溶性姜黄素的生物利用度提供新的研究方法,也为拓宽多孔淀粉在食品领域的研究提供思路。
[1] HJ LATIP D N, SAMSUDIN H, UTRA U, et al.Modification methods toward the production of porous starch:A review[J].Critical Reviews in Food Science and Nutrition, 2021, 61(17):2 841-2 862.
[2] DU X Y, ZHANG Y C, PAN X M, et al.Preparation and properties of modified porous starch/carbon black/natural rubber composites[J].Composites Part B:Engineering, 2019, 156:1-7.
[3] NADAF S, JADHAV A, KILLEDAR S.Mung bean (Vigna radiata) porous starch for solubility and dissolution enhancement of poorly soluble drug by solid dispersion[J].International Journal of Biological Macromolecules, 2021, 167:345-357.
[4] CHAIREH S, NGASATOOL P, KAEWTATIP K.Novel composite foam made from starch and water hyacinth with beeswax coating for food packaging applications[J].International Journal of Biological Macromolecules, 2020, 165:1 382-1 391.
[5] QIAN J Q, CHEN Y, YANG H Y, et al.Preparation and characterization of crosslinked porous starch hemostatic[J].International Journal of Biological Macromolecules, 2020, 160:429-436.
[6] JIA X Z, ZHANG B, CHEN C, et al.Immobilization of chitosan grafted carboxylic Zr-MOF to porous starch for sulfanilamide adsorption[J].Carbohydrate Polymers, 2021, 253:117305.
[7] 李丽, 陈鹤, 匡艳青, 等.姜黄素制剂研究进展[J].广州化工, 2021, 49(16):1-3;23.
LI L, CHEN H, KUANG Y Q, et al.Research progress on curcumin preparation[J].Guangzhou Chemical Industry, 2021, 49(16):1-3;23.
[8] ZHANG L Y, ZONG H Y, LU H P, et al.Discovery of novel anti-tumor curcumin analogues from the optimization of curcumin scaffold[J].Medicinal Chemistry Research, 2017, 26(10):2 468-2 476.
[9] ZHU G H, SHEN Q, JIANG H, et al.Curcumin inhibited the growth and invasion of human monocytic leukaemia SHI-1 cells in vivo by altering MAPK and MMP signalling[J].Pharmaceutical Biology, 2020, 58(1):25-34.
[10] NUGROHO A.The vasodilation effects of curcumin and its derivatives on isolated aortic of rats[J].Indonesian Journal of Pharmacy, 2008, 19(2):70-77.
[11] GARCEA G, JONES D J L, SINGH R, et al.Detection of curcumin and its metabolites in hepatic tissue and portal blood of patients following oral administration[J].British Journal of Cancer, 2004, 90(5):1 011-1 015.
[12] 黄浩河, 黄崇杏, 张霖雲, 等.姜黄素在食品保鲜中应用的研究进展[J].食品工业科技, 2020, 41(7):320-324;331.
HUANG H H, HUANG C X, ZHANG L Y, et al.Research progress of curcumin in food preservation application[J].Science and Technology of Food Industry, 2020, 41(7):320-324;331.
[13] 严红梅, 贾晓斌, 张振海, 等.多孔淀粉作为淫羊藿总黄酮固体分散体载体的研究[J].中国中药杂志, 2015, 40(9):1 723-1 726.
YAN H M, JIA X B, ZHANG Z H, et al.Study on porous starch as solid dispersion carrier of total Epimedium flavonoids[J].China Journal of Chinese Materia Medica, 2015, 40(9):1 723-1 726.
[14] CHENG W W, LUO Z G, LI L, et al.Preparation and characterization of debranched-starch/phosphatidylcholine inclusion complexes[J].Journal of Agricultural and Food Chemistry, 2015, 63(2):634-641.
[15] ACEVEDO-GUEVARA L, NIETO-SUAZA L, SANCHEZ L T, et al.Development of native and modified banana starch nanoparticles as vehicles for curcumin[J].International Journal of Biological Macromolecules, 2018, 111:498-504.
[16] AHMED K, LI Y, MCCLEMENTS D J, et al.Nanoemulsion- and emulsion-based delivery systems for curcumin:Encapsulation and release properties[J].Food Chemistry, 2012, 132(2):799-807.
[17] JAFARI Y, SABAHI H, RAHAIE M.Stability and loading properties of curcumin encapsulated in Chlorella vulgaris[J].Food Chemistry, 2016, 211:700-706.
[18] SUN B H, TIAN Y Q, CHEN L, et al.Linear dextrin as curcumin delivery system:Effect of degree of polymerization on the functional stability of curcumin[J].Food Hydrocolloids, 2018, 77:911-920.
[19] LI Y H, WANG Y S, ZHAO J S, et al.A pH-sensitive curcumin loaded microemulsion-filled alginate and porous starch composite gels:Characterization, in vitro release kinetics and biological activity[J].International Journal of Biological Macromolecules, 2021, 182:1 863-1 873.
[20] WU L R, TIAN J H, YE X Q, et al.Encapsulation and release of curcumin with the mixture of porous rice starch and xanthan gum[J].Starch - Stärke, 2021, 73(1-2):2000042.
[21] ZHENG X Y, QIU C, LONG J, et al.Preparation and characterization of porous starch/β-cyclodextrin microsphere for loading curcumin:Equilibrium, kinetics and mechanism of adsorption[J].Food Bioscience, 2021, 41:101081.
[22] 赵雪, 杨逢建, 葛云龙, 等.青蒿素多孔淀粉微球的制备、表征与水溶性评价[J].中草药, 2019, 50(7):1 596-1 602.
ZHAO X, YANG F J, GE Y L, et al.Preparation, characterization and water solubility evaluation of porous starch loaded artemisinin microspheres[J].Chinese Traditional and Herbal Drugs, 2019, 50(7):1 596-1 602.
[23] FANG M, JIN Y L, BAO W, et al.In vitro characterization and in vivo evaluation of nanostructured lipid curcumin carriers for intragastric administration[J].International Journal of Nanomedicine, 2012, 7:5 395-5 404.
[24] 刘静敏, 史静兰, 鲁江, 等.体外模拟胃肠消化过程中四种茶叶活性成分及抗氧化性变化规律[J].食品工业科技, 2020, 41(1):301-306.
LIU J M, SHI J L, LU J, et al.Changes of active constituents and antioxidant properties of four kinds of tea during gastrointestinal digestion in vitro[J].Science and Technology of Food Industry, 2020, 41(1):301-306.
[25] 俞力月, 李海燕, 马云翔, 等.多孔淀粉对姜黄素的吸附[J].食品与发酵工业, 2020, 46(5):224-230.
YU L Y, LI H Y, MA Y X, et al.Study on adsorption of curcumin by porous starch[J].Food and Fermentation Industries, 2020, 46(5):224-230.