杨梅是一种亚热带水果,在华东和湖南、广东、广西、贵州等地区均有分布,全国杨梅栽培面积达30多万hm2,年产量100多万t,约占全球的90%以上[1]。杨梅富含花色苷、黄酮、酚酸、维生素和矿物质等物质,但货架期极短[2],因此杨梅深加工对减少浪费、延长保质期、提高其附加值有重大意义。
杨梅果汁含有丰富的花色苷(例如,荸荠种的杨梅花色苷含量为64.8 mg/100 g)[3],矢车菊素-3-葡萄糖苷占杨梅花色苷总量的95%以上[4],因其具有抗氧化、抗肿瘤、预防糖尿病和心血管疾病等功效受到广泛关注[5-8]。花青素在酸性pH值下稳定,而在中性pH值下稳定性下降,发生水合、环裂变和电离形成查尔酮[9]。因此,提高花色苷稳定性是保证其发挥生理活性的关键因素。
传统的杨梅加工方法主要包括将杨梅加工成果汁、果酒、罐头、果脯、凉果等,虽然能延长保存期,但其活性成分损失较多。新兴的微胶囊技术采用特定工艺手段,如喷雾干燥,利用壁材对生物活性物质进行包埋,可有效提高其稳定性[10]。利用微胶囊技术制备固体饮料,产品颗粒均匀一致,具有独特浓郁的香味,在冷热水中均能迅速溶解,色泽与新鲜果汁相似,能减少活性物质的损失,产品能长期保存,便于携带和食用。
蛋白质已被广泛用作敏感生物活性成分的壁材,以提高花青素等活性成分的稳定性,保护花色苷在消化过程中不被降解,以及提高花色苷的抗氧化性[11-17]。豌豆蛋白含有成人所必需的8种氨基酸,氨基酸种类齐全、比例平衡,赖氨酸含量丰富,能满足联合国粮农组织或世界卫生组织的建议,具有降胆固醇、降血压功能,相对于常用的乳清蛋白,不含致敏原,安全性更高,营养价值高,吸收率能达到98%以上[18-25]。目前,豌豆蛋白已经成功用于抗坏血酸、α-维生素E和甘油三酯的包埋[26],但未见应用在果汁加工方面,因此具有很大的研究价值。
本研究利用微胶囊技术,以豌豆蛋白为壁材,通过高压均质和喷雾干燥技术将杨梅果汁包埋并加工成杨梅果汁蛋白粉固体饮料产品(以下简称杨梅-蛋白粉),通过扫描电镜、傅里叶红外分析(Fourier transform infrared spectrometry,FTIR)、热重分析(thermogravimetric analysis,TG)、粒度测定和电位分析对杨梅-蛋白粉的包埋特性、稳定性进行表征。同时利用体外模拟消化对杨梅-蛋白粉中花色苷的生物利用率进行分析,以期为开发杨梅产品提供新思路,同时带动豌豆和杨梅资源的合理利用和附加值提升。
1 材料与设备
1.1 实验材料
新鲜杨梅,中国仙居;豌豆蛋白,嘉吉食品(天津)有限公司。
1.2 仪器设备
CQC2-600型全液相HPP食品灭菌机,北京速原中天公司;e2695高效液相色谱仪,美国Waters公司;Is50 FT-IR傅里叶红外分析仪、ZetaFinder ZF400电位分析仪,美国Thermo Fisher公司;TGA 2 (SF)热重分析仪、LE104E/02电子天平,美国梅特勒-托利多仪器有限公司;EVO-MA15扫描电子显微镜,德国ZEISS公司;SPXAPV2000高压均质机,丹麦APV公司;Mini Spray Dryer B-200喷雾干燥机,瑞士BUCHI公司;手持糖度计,日本ATAGO公司;LRH-150生化培养箱,上海一恒科学仪器有限公司;HR2874榨汁机,荷兰飞利浦公司;Centrifuge5810R离心机,德国Eppendorf公司;SHZ-D循环水式真空泵,巩义市子华仪器有限责任公司。
2 实验方法
2.1 样品制备
2.1.1 新鲜杨梅果汁的制备
冰水浴中将杨梅去核,用榨汁机挤压得到粗果汁;用冷冻高速离心机8 000 r/min,4 ℃下离心10 min,取上清液,抽滤得到澄清果汁。用蔗糖调节果汁可溶性固形物至15 °Brix,用聚乙烯袋无菌包装。
2.1.2 杨梅-蛋白粉的制备
分别取300 g新鲜杨梅果汁,40 g豌豆蛋白溶于蒸馏水中,均匀混合并定容至1 L,得到含有质量分数30%杨梅果汁、4%豌豆蛋白的溶液,将溶液通过压力为450 bar的高压均质机3次后按照设定的操作条件进行喷雾干燥,得到杨梅-蛋白粉,操作条件为:进风温度170 ℃,出风温度70 ℃,风机速度 50.0 Hz,蠕动泵转速为1 000 mL。
2.1.3 杨梅果肉粉的制备
将脱核后的杨梅果肉在-80 ℃下冷冻后,通过真空冷冻干燥机干燥48 h,收集果肉粉末,置于-20 ℃保存。
2.1.4 杨梅果汁粉
将2.1.1中制得的新鲜杨梅果汁在-80 ℃下冷冻后,通过真空冷冻干燥机干燥48 h,收集果汁粉末,置于-20 ℃保存。
2.2 杨梅-蛋白粉物理性质的测定
2.2.1 平均粒径(mean diameter of dominant, MDD)和粒径分布
杨梅-蛋白粉及豌豆蛋白粉的MDD由重组饮料的MDD表征。重组饮料参照文献[27]配制:准确称取1.000 g粉末溶解于9 g水中,搅拌至完全溶解。测定方法:采用动态激光散射技术,将制备的饮料用蒸馏水稀释(1∶50,V∶V)以避免多次散射效应,设定仪器测定方法和程序后直接放入样品池测定,重复3次测定取平均值。
2.2.2 微观形态
杨梅-蛋白粉及豌豆蛋白粉的表面颗粒形态由扫描电镜进行评价。分别称取约2 mg的样品固定于贴有双面胶的铜台上,喷金后等待测定。选择不同的放大倍数对粉末粒子进行扫描,在15 kV加速电压下进行分析[28]。
2.2.3 傅里叶红外光谱分析
样品预处理:取 1~2 mg 的样品在玛瑙研钵中研磨成细粉末与干燥的KBr(分析纯)粉末(约100 mg,粒度200目)混合均匀,装入模具内,在压片机上压制成片测试。设定扫描波数为1 500~4 000 cm-1,分辨率4 cm-1,扫描32次。傅里叶红外光谱图采用OMNIC 9.2软件处理,通过软件自动修饰校正,使用 PeakFit v4.12软件对红外图谱进行基线校正、高斯去卷积、二阶导数拟合。计算相应波长处对应的二级结构百分比。
2.2.4 热重分析
以25 ℃/min速率升温,在50~700 ℃进行加热,得到温度与质量关系TG曲线。
2.3 体外模拟消化
根据表1所示成分配制体外模拟消化液,对2.1中制得的杨梅-蛋白粉、杨梅果汁粉、杨梅果肉粉进行体外模拟消化实验,消化流程如图1所示[29],生物利用率计算如公式(1)所示:
生物利用率![]()
(1)
表1 消化液的组成成分(1 L)
Table 1 Composition of digestive juice (per L)
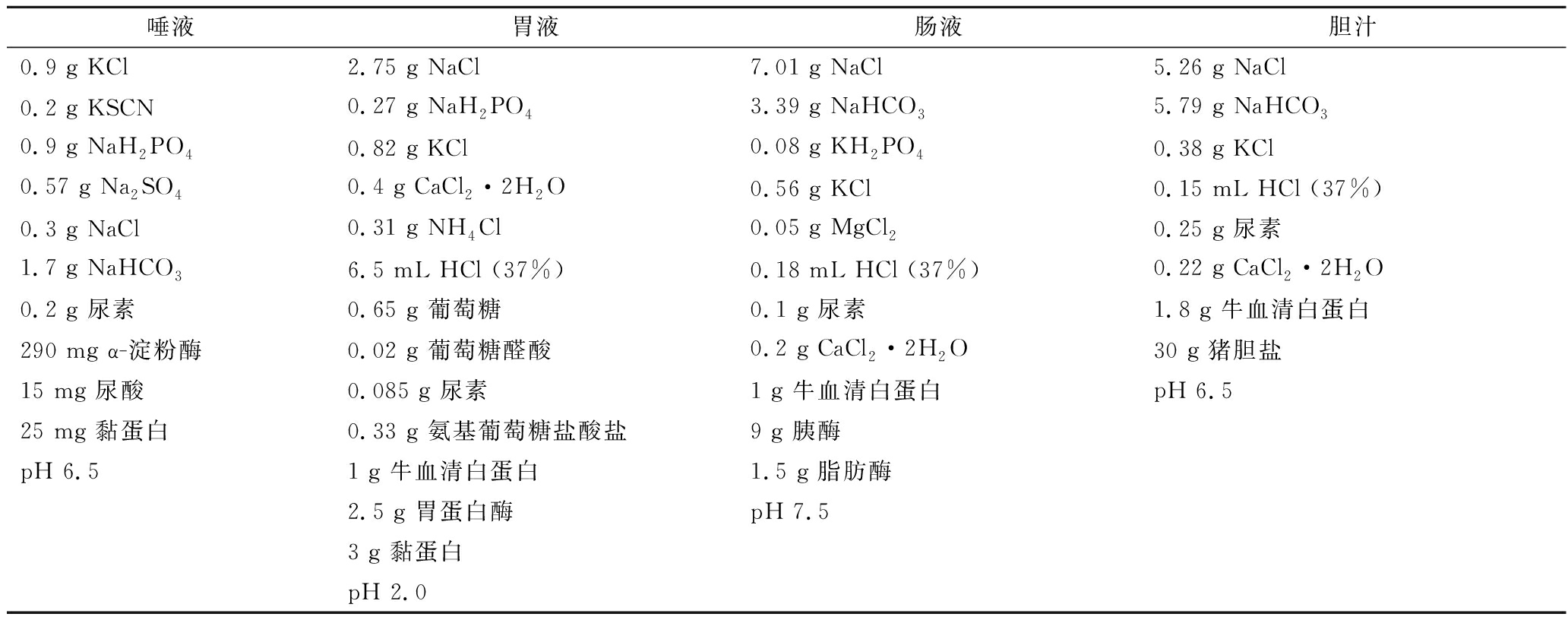
唾液胃液肠液胆汁0.9 g KCl2.75 g NaCl7.01 g NaCl5.26 g NaCl0.2 g KSCN0.27 g NaH2PO43.39 g NaHCO35.79 g NaHCO30.9 g NaH2PO40.82 g KCl0.08 g KH2PO40.38 g KCl0.57 g Na2SO40.4 g CaCl2·2H2O0.56 g KCl0.15 mL HCl (37%)0.3 g NaCl0.31 g NH4Cl0.05 g MgCl20.25 g 尿素1.7 g NaHCO36.5 mL HCl (37%)0.18 mL HCl (37%)0.22 g CaCl2·2H2O0.2 g 尿素0.65 g 葡萄糖0.1 g 尿素1.8 g 牛血清白蛋白290 mg α-淀粉酶0.02 g 葡萄糖醛酸0.2 g CaCl2·2H2O30 g 猪胆盐15 mg 尿酸0.085 g 尿素1 g 牛血清白蛋白pH 6.525 mg 黏蛋白0.33 g 氨基葡萄糖盐酸盐9 g 胰酶pH 6.51 g 牛血清白蛋白1.5 g 脂肪酶2.5 g 胃蛋白酶pH 7.53 g 黏蛋白pH 2.0
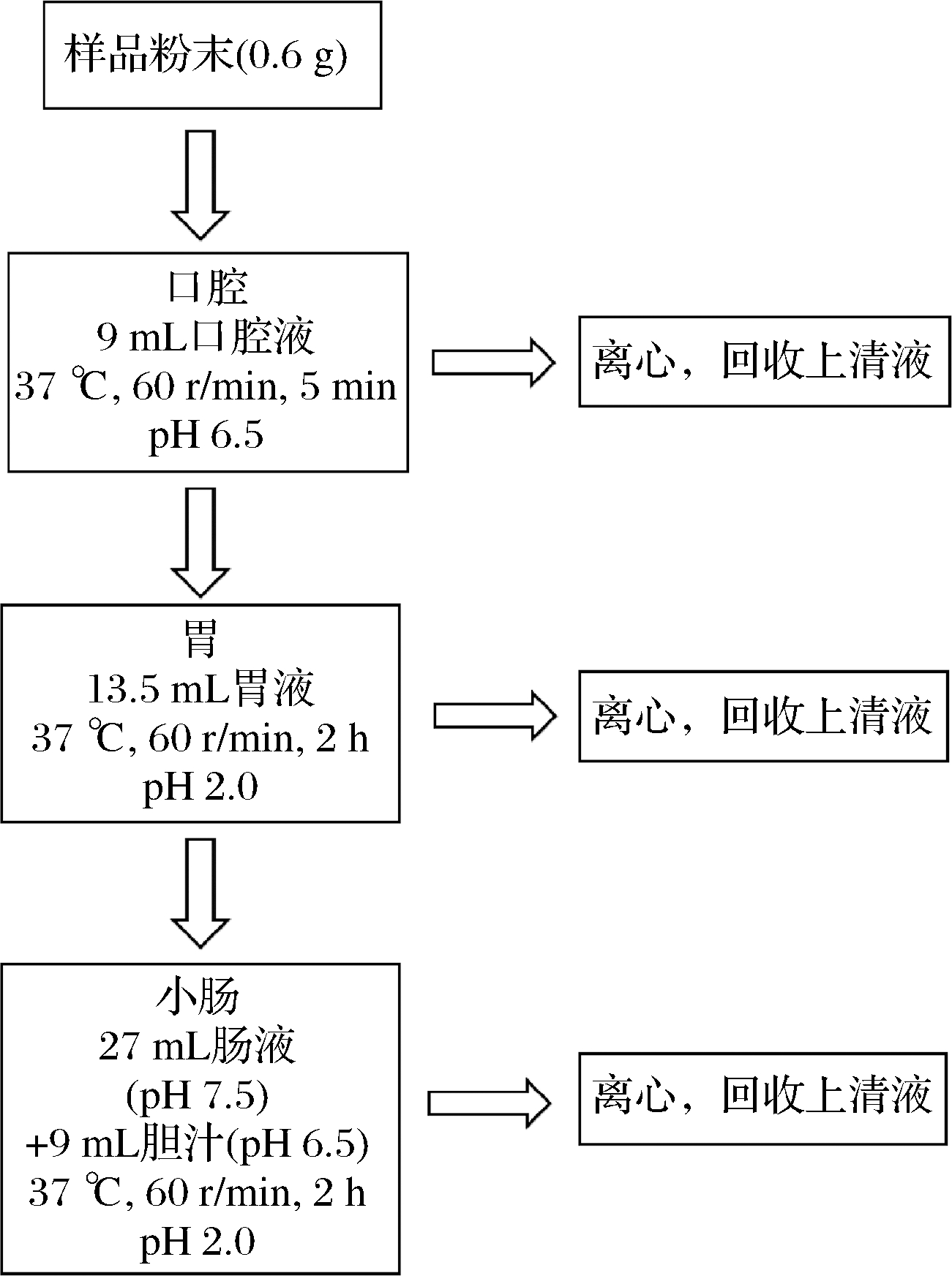
图1 消化步骤流程图
Fig.1 Flow chart of digestion steps
2.3.1 口腔模拟消化
分别取0.6 g杨梅-蛋白粉、杨梅果汁粉、杨梅果肉粉加入9 mL模拟唾液,充N2覆盖顶空,盖紧并用膜密封旋涡混匀3 min,水平放置在37 ℃、转速60 r/min振荡水浴5 min,立即取出冷却,5 000 r/min离心35 min,收集上清液,通过0.45 nm聚四氟乙烯注射器过滤器进入液相小瓶,HPLC测定花色苷含量。消化后的残渣冷冻干燥,喷金,用扫描电镜观察。
2.3.2 胃部模拟消化
在口腔消化残渣中加入13.5 mL胃液,充N2覆盖顶空,盖紧并用膜密封,旋涡混匀3 min,水平放置在37 ℃、转速60 r/min振荡水浴2 h(每30 min取1次样,结束前约15 min制备小肠液),立即取出冷却,5 000 r/min离心35 min,收集上清液,通过0.45 nm聚四氟乙烯注射器过滤器进入液相小瓶,测定花色苷含量。消化后的残渣冷冻干燥,喷金,用扫描电镜观察。
2.3.3 肠道模拟消化
在胃部消化残渣中加入27 mL十二指肠液和9 mL胆汁,充N2覆盖顶空,盖紧并用膜密封,旋涡混匀3 min,水平放置在37 ℃、转速60 r/min振荡水浴2 h,立即取出冷却,5 000 r/min离心35 min,收集上清液,通过0.45 nm聚四氟乙烯注射器过滤器进入液相小瓶,测定花色苷含量。
2.4 花色苷含量测定
采用HPLC测定杨梅果汁花色苷含量变化,参照段翰英等[30]的花色苷检测方法并稍作改进。
色谱条件:色谱柱为Waters Symmetry C18反相色谱柱(150 mm×4.6 mm,5 μm);流动相A:含体积分数5%甲酸-水溶液,流动相B:含体积分数5%甲酸-乙腈溶液;梯度洗脱条件:0 min(0% B)→30 min(40% B)→32 min(100% B)→38 min(0% B);流速1 mL/min;进样量25 μL;自动进样器温度4 ℃;柱温40 ℃;扫描波长200~700 nm;检测波长520 nm。
2.5 数据分析处理
所有实验均进行3次平行,结果用平均数±方差表示。采用Microsoft Excel进行数据统计,并用IBM SPSS Statistics 26软件进行方差分析(analysis of variance,ANOVA)(P<0.05),用Origin 2021进行柱形图的绘制。
3 结果与讨论
3.1 杨梅-蛋白粉的物理特性表征
3.1.1 杨梅-蛋白粉微观形貌分析
豌豆蛋白粉和杨梅-蛋白粉的形貌主要以近似球状颗粒为主(图2),但杨梅-蛋白粉颗粒表面光滑程度和均匀程度均优于豌豆蛋白粉。喷雾干燥工艺对微胶囊粉末的成型性和表面形貌都有显著影响[31-32],豌豆蛋白粉表面出现裂纹和褶皱,可能是喷雾干燥过程中固体原料间相互碰撞引起的[33]。杨梅果汁蛋白饮料在喷雾前经过高压均质处理,粒径更小且均匀,减少了颗粒间碰撞等影响,从而形成更光滑表面。

a-豌豆蛋白粉放大500倍;b-豌豆蛋白粉放大502倍;c-杨梅-蛋白粉放大2 500倍;d-杨梅-蛋白粉放大4 930倍
图2 杨梅-蛋白粉与豌豆蛋白粉的扫描电镜图像
Fig.2 Scanning electron image of protein-bayberry powder and pea protein powder
3.1.2 杨梅-蛋白粉的蛋白质结构与热稳定性分析
蛋白质的结构特性与蛋白质的功能特性密切相关,利用FTIR对豌豆蛋白粉和杨梅-蛋白粉结构进行分析,如图3所示,豌豆蛋白粉和杨梅-蛋白粉的光谱图在主要特征区域1 500~4 000 cm-1吸收没有明显差别。3 600~3 300 cm-1处的峰强通常可以表示蛋白分子氢键(内部和外部)及O—H、N—H键的伸缩振动强度[34],蛋白质酰胺Ⅰ带(1 700~1 600 cm-1)中的信息对于研究蛋白质的二级结构最有价值,与氢键作用力紧密相关。通过对FTIR去卷积、二阶求导、曲线拟合[35],获得二级结构图谱相关数据(表2)。结果表明,相比于豌豆蛋白粉,杨梅-蛋白粉的α-螺旋下降1.22%,α-螺旋是豌豆蛋白二级结构中主要的有序结构,通过分子内氢键维持,约占总结构的18%[36],凝胶硬度与α-螺旋含量之间呈负相关[37]。β-折叠下降1.98%,β-转角上升3.72%,无规则卷曲下降0.52%,其原因可能是喷雾干燥导致氢键断裂,蛋白质部分分子空间构象改变,β-折叠或无规则卷曲的多肽链结构发生了180°的反转,转变为β-转角结构[38]。

图3 杨梅-蛋白粉与豌豆蛋白粉傅里叶红外分析图
Fig.3 FTIR of protein-bayberry powder and pea protein powder
表2 蛋白二级结构相对百分比 单位:%
Table 2 The relative percentage of secondary structure of sample proteins

蛋白二级结构α-螺旋β-折叠β-转角无规卷曲豌豆蛋白粉18.32±0.0135.97±0.0136.35±0.019.36±0.00杨梅-蛋白粉17.10±0.0233.99±0.0040.07±0.018.84±0.02
热学性质是物质的一种重要物理性质,通过测量物质在程序升温或冷却过程中的物理、化学性质的变化,可以对物质的性质有更深入的了解。本实验利用TG测量豌豆蛋白包埋杨梅果汁前后的热学性质。由图4可见,2种粉末均有2个质量损失阶段。第一个阶段是在30~100 ℃。这是由物质中的结合水蒸发所引起的,但杨梅-蛋白粉下降幅度稍缓慢一些,推测是因为喷雾干燥后粉末水分含量有所降低导致的[39]。第二个阶段是质量完全损失阶段,可以看到在接近750 ℃时,2种粉末均完全分解。总体来看,喷雾干燥前后样品热稳定性无明显变化,表明了蛋白-杨梅复配并没有改变豌豆蛋白原有的热稳定性。

图4 杨梅-蛋白粉与豌豆蛋白粉的热重图
Fig.4 TG figure of protein-bayberry powder and pea protein powder
3.1.3 杨梅-蛋白粉重组饮料的稳定性分析
由图5可见,豌豆蛋白重组饮料MDD为0.718 μm,杨梅蛋白重组饮料为0.476 μm,高压均质后,溶液粒径分布范围变窄,粒子分散更均匀,并且向小粒径液滴偏移。这是因为高压下,饮料中高速运动的物料自相碰撞,从而产生粒径更小的溶液且分布更加集中和均匀,有效提升蛋白饮料口感[40]。Zeta电位方面来看,豌豆蛋白重组饮料Zeta电位为-18 mV,杨梅蛋白重组饮料为-45 mV,复配饮料电位绝对值更大,饮料具有更高的液体稳定性,这与高压均质处理会使溶液成分分布更均匀相关。

a-豌豆蛋白重组饮料;b-杨梅蛋白重组饮料
图5 杨梅-蛋白粉与豌豆蛋白重组饮料的粒径、Zeta电位分布图
Fig.5 Distribution diagram of particle size and Zeta potential of protein-bayberry powder and pea protein recombinant beverage
3.2 杨梅-蛋白粉花色苷生物利用率分析
本文通过体外模拟消化实验来探究花色苷生物利用率。经口腔消化后,杨梅-蛋白粉、杨梅果汁、果肉粉的生物利用率分别为4.86%、99.10%、8.60%,可见包埋后的杨梅-蛋白粉中的花色苷释放非常少。3种样品在进入胃液消化30 min后(图6),杨梅-蛋白粉和果肉中花色苷的生物利用率分别为74.98%和91.23%,均低于果汁含量99.31%,推测是因为杨梅-蛋白粉微胶囊壁材在短时间内还未被完全消化,部分杨梅果汁还被包埋在球状结构中,而果肉组是因为部分花色苷还存在于果肉组织当中,并未被完全释放至胃液中。60~120 min,杨梅-蛋白粉与果肉花色苷逐渐释放至胃液,并发生降解。由于果汁中花色苷不存在释放过程,所以在90~120 min时出现了含量突然下降的情况。最终,在胃液中消化120 min后,3种样品花色苷生物利用率基本一致(65%~75%)。在经过肠液消化后,HPLC并未检测到花色苷的存在,这可能是在胃液的强酸性环境中,花色苷能以2-苯基苯并阳离子形式稳定存在,但当到达肠道时,由于pH突变上升至中性,花色苷分子迅速降解转化为醌式结构、半缩酮和查儿酮等形式,稳定性显著下降,含量大大减少[9]。文献表明,90%的葡萄花青素在胃肠道消化后丢失[41]。杨梅中的花青素对消化过程非常敏感,经胃肠消化后,生物利用率为40%~65%[41-43],而FLORES等[17]则发现蓝莓花色苷在乳清蛋白包埋前后的胃肠道消化率为60%~80%,与本实验中的数据相符。

图6 胃部消化过程中花色苷的生物利用率
Fig.6 Changes of anthocyanin bioaccessibility during gastric juice digestion
2种粉末经口腔和胃液消化后的微观图像见图7。可以观察到在经过口腔消化后,粉末表面出现明显褶皱,推测这与干燥粉末进入唾液后,水分活度增大,吸水收缩有关。经胃液消化后,粉末颗粒球状结构被破坏,呈现碎片状,是因为豌豆蛋白会被胃蛋白酶消化所致。

a、b-杨梅-蛋白粉口腔消化后;c、d-杨梅-蛋白粉胃液消化后
图7 杨梅-蛋白粉体外消化后的扫描电镜图像
Fig.7 Scanning electron image of protein-bayberry powder and pea protein powder after in vitro digestion
因此,利用豌豆蛋白为壁材没有显著提高杨梅果汁花色苷生物利用率(P>0.05)。其他一些研究也发现了类似的结果。OIDTMANN等[44]发现乳清蛋白包埋的花色苷在胃液前20 min快速释放,1 h后,包埋和未包埋的花色苷浓度相同。FLORES等[17]利用乳清蛋白制备花色苷粉末并评价生物利用率,结果显示,消化后包埋和未包埋的花色苷释放量相等,但微胶囊包埋后比未包封的果渣提取物显示出更大的抗氧化能力。
4 结论
利用豌豆蛋白作为壁材将杨梅果汁加工成杨梅-蛋白粉是一种新型果蔬深加工方法的探讨。杨梅-蛋白粉形貌圆润,近似球形,与豌豆蛋白粉相比更加光滑,粒径更小且均匀,FTIR和TG分析表明,杨梅果汁与豌豆蛋白复配后,对豌豆蛋白二级结构有一定的影响,α-螺旋下降1.22%,β-折叠下降1.98%,β-转角上升3.72%,无规则卷曲下降0.52%,且较好地保留了豌豆蛋白热稳定性。杨梅-蛋白粉Zeta电位为-45 mV,比豌豆蛋白粉的稳定性显著提高。体外消化结果表明,在口腔中杨梅-蛋白粉的生物率只有4.86%,说明只有微弱释放。在胃液中消化30 min后,杨梅-蛋白粉中花色苷的生物利用率为74.98%,低于果肉(91.23%)和果汁(99.31%),推测由于微胶囊壁材未被完全消化,花色苷被包埋未能完全释放至胃液中。60~120 min,杨梅-蛋白粉与果肉花色苷逐渐释放至胃液,同时花色苷发生降解。在胃液中消化120 min后,杨梅-蛋白粉、果肉、果汁中花色苷生物利用率基本一致(65%~75%),但花色苷由于在中性条件下发生降解经肠道消化后未检出。虽然杨梅-蛋白粉产品并未有效提高花色苷生物利用率,有研究表明相比于未经包埋的,包埋后的花色苷具有更高的抗氧化活性[17],这将是下一步研究的方向。通过本文杨梅-蛋白粉产品的探讨,可为杨梅的开发及花色苷稳定性研究提供理论依据和新思路。
[1] 中国科学院《中国植物志》编辑委员会. 中国植物志[M].北京:科学出版社, 1990.
Flora of China Editorial Committee of Chinese Academy of Sciences.The Flora of China[M].Beijing:Science Press, 1990.
[2] 申杰. 杨梅落果花色苷的提取、纯化及其抑菌活性研究[D].南京:南京农业大学, 2010.
SHEN J.Extraction, purification and antifungal activity of anthocyanins in drop fruits of Chinese baberry[D].Nanjing:Nanjing Agricultural University, 2010.
[3] 方波, 武峥, 杨丽, 等.杨梅果实生物活性物质研究进展[J].南方农业, 2018, 12(28):29-34;66.
FANG B, WU Z, YANG L, et al.Research progress on bioactive substances in waxberry[J].South China Agriculture, 2018, 12(28):29-34;66.
[4] 楼乐燕. 杨梅果汁的澄清工艺优化及辅色作用研究[D].杭州:浙江大学, 2019.
LOU L Y.Study on the optimal clarification process and copigmentation of bayberry juice[D].Hangzhou:Zhejiang University, 2019.
[5] FANG Z X, ZHANG M, WANG L X.HPLC-DAD-ESIMS analysis of phenolic compounds in bayberries (Myrica rubra Sieb.et Zucc.)[J].Food Chemistry, 2007, 100(2):845-852.
[6] FANG Z X, ZHANG Y H, LYU Y, et al.Phenolic compounds and antioxidant capacities of bayberry juices[J].Food Chemistry, 2009, 113(4):884-888.
[7] WANG C J, ZHAO J B, CHEN F, et al.Separation, identification, and quantitation of phenolic acids in Chinese waxberry (Myrica rubra) juice by HPLC-PDA-ESI-MS[J].Journal of Food Science, 2012, 77(2):C272-C277.
[8] XIE L J, YE X Q, LIU D H, et al.Quantification of glucose, fructose and sucrose in bayberry juice by NIR and PLS[J].Food Chemistry, 2009, 114(3):1 135-1 140.
[9] LIANG L H, WU X Y, ZHAO T, et al.In vitro bioaccessibility and antioxidant activity of anthocyanins from mulberry (Morus atropurpurea Roxb.) following simulated gastro-intestinal digestion[J].Food Research International, 2012, 46(1):76-82.
[10] 王芳, 田建文.微胶囊技术在食品抗氧化剂中的应用研究进展[J].食品与机械, 2010, 26(4):149-152.
WANG F, TIAN J W.Progress of microencapsulation application in food anti-oxidants[J].Food & Machinery, 2010, 26(4):149-152.
[11] 吴敏, 林嘉璐, 欧阳程淼.原花青素与食品成分相互作用的研究进展[J].黑龙江粮食, 2021(1):70-72.
WU M, LIN J L, OUYANG C M.Research progress on the interaction between procyanidins and food components[J].Journal of Heilongjiang Grain, 2021(1):70-72.
[12] VILJANEN K, KYLLI P, HUBBERMANN E M, et al.Anthocyanin antioxidant activity and partition behavior in whey protein emulsion[J].Journal of Agricultural and Food Chemistry, 2005, 53(6):2 022-2 027.
[13] HE Z Y, XU M Z, ZENG M M, et al.Preheated milk proteins improve the stability of grape skin anthocyanins extracts[J].Food Chemistry, 2016, 210:221-227.
[14] MOSER P, GALLO T C B, ZUANON L A C, et al.Water sorption and stickiness of spray-dried grape juice and anthocyanins stability[J].Journal of Food Processing and Preservation, 2018, 42(12):e13830.
[15] FLORES F P, SINGH R K, KERR W L, et al.Total phenolics content and antioxidant capacities of microencapsulated blueberry anthocyanins during in vitro digestion[J].Food Chemistry, 2014, 153:272-278.
[16] MANSOUR M, SALAH M, XU X Y.Effect of microencapsulation using soy protein isolate and gum Arabic as wall material on red raspberry anthocyanin stability, characterization, and simulated gastrointestinal conditions[J].Ultrasonics Sonochemistry, 2020, 63:104927.
[17] FLORES F P, SINGH R K, KERR W L, et al.In vitro release properties of encapsulated blueberry (Vaccinium ashei) extracts[J].Food Chemistry, 2015, 168:225-232.
[18] CHAUDHARY A, MARINANGELI C P F, TREMORIN D, et al.Nutritional combined greenhouse gas life cycle analysis for incorporating Canadian yellow pea into cereal-based food products[J].Nutrients, 2018, 10(4):490.
[19] DING J, LIANG R, YANG Y Y, et al.Optimization of pea protein hydrolysate preparation and purification of antioxidant peptides based on an in silico analytical approach[J].LWT, 2020, 123:109126.
[20] GAO Z L, SHEN P Y, LAN Y, et al.Effect of alkaline extraction pH on structure properties, solubility, and beany flavor of yellow pea protein isolate[J].Food Research International (Ottawa, Ont.), 2020, 131:109045.
[21] WARNAKULASURIYA S, PILLAI P K S, STONE A K, et al.Effect of the degree of esterification and blockiness on the complex coacervation of pea protein isolate and commercial pectic polysaccharides[J].Food Chemistry, 2018, 264:180-188.
[22] GORISSEN S H M, CROMBAG J J R, SENDEN J M G, et al.Protein content and amino acid composition of commercially available plant-based protein isolates[J].Amino Acids, 2018, 50(12):1 685-1 695.
[23] LI H, ALUKO R E.Identification and inhibitory properties of multifunctional peptides from pea protein hydrolysate[J].Journal of Agricultural and Food Chemistry, 2010, 58(21):11 471-11 476.
[24] LI H, PRAIRIE N, UDENIGWE C C, et al.Blood pressure lowering effect of a pea protein hydrolysate in hypertensive rats and humans[J].Journal of Agricultural and Food Chemistry, 2011, 59(18):9 854-9 860.
[25] POWNALL T L, UDENIGWE C C, ALUKO R E.Amino acid composition and antioxidant properties of pea seed (Pisum sativum L.) enzymatic protein hydrolysate fractions[J].Journal of Agricultural and Food Chemistry, 2010, 58(8):4 712-4 718.
[26] 夏亚穆, 夏军.植物蛋白在微胶囊中应用的研究进展[J].农产品加工(学刊), 2013(12):49-51.
XIA Y M, XIA J.Research progress of vegetable proteins in microencapsulation[J].Academic Periodical of Farm Products Processing, 2013(12):49-51.
[27] MUR A-PAGOLA B, BERISTAIN-GUEVARA C, MART
A-PAGOLA B, BERISTAIN-GUEVARA C, MART NEZ-BUSTOS F.Preparation of starch derivatives using reactive extrusion and evaluation of modified starches as shell materials for encapsulation of flavoring agents by spray drying[J].Journal of Food Engineering, 2009, 91:380-386.
NEZ-BUSTOS F.Preparation of starch derivatives using reactive extrusion and evaluation of modified starches as shell materials for encapsulation of flavoring agents by spray drying[J].Journal of Food Engineering, 2009, 91:380-386.
[28] SOOTTITANTAWAT A, YOSHII H, FURUTA T, et al.Microencapsulation by spray drying:Influence of emulsion size on the retention of volatile compounds[J].Journal of Food Science, 2003, 68(7):2 256-2 262.
[29] WANG C, DUAN H Y, TENG J W.Assessment of microwave cooking on the bioaccessibility of cadmium from various food matrices using an in vitro digestion model[J].Biological Trace Element Research, 2014, 160(2):276-284.
[30] 段翰英, 王超, 戴雄杰, 等.不同巴氏杀菌条件对三华李果汁主要抗氧化成分的影响[J].食品科学, 2013, 34(21):69-74.
DUAN H Y, WANG C, DAI X J, et al.Effect of pasteurization on major antioxidant compounds of Sanhua plum juice[J].Food Science, 2013, 34(21):69-74.
[31] KAUSHIK P, DOWLING K, MCKNIGHT S, et al.Microencapsulation of flaxseed oil in flaxseed protein and flaxseed gum complex coacervates[J].Food Research International, 2016, 86:1-8.
[32] ERATTE D, MCKNIGHT S, GENGENBACH T R, et al.Co-encapsulation and characterisation of Omega-3 fatty acids and probiotic bacteria in whey protein isolate-gum Arabic complex coacervates[J].Journal of Functional Foods, 2015, 19:882-892.
[33] GARC A-TEJEDA Y V, SALINAS-MORENO Y, MART
A-TEJEDA Y V, SALINAS-MORENO Y, MART NEZ-BUSTOS F.Acetylation of normal and waxy maize starches as encapsulating agents for maize anthocyanins microencapsulation[J].Food and Bioproducts Processing, 2015, 94:717-726.
NEZ-BUSTOS F.Acetylation of normal and waxy maize starches as encapsulating agents for maize anthocyanins microencapsulation[J].Food and Bioproducts Processing, 2015, 94:717-726.
[34] CHEN W S, YU H P, LIU Y X, et al.Individualization of cellulose nanofibers from wood using high-intensity ultrasonication combined with chemical pretreatments[J].Carbohydrate Polymers, 2011, 83(4):1 804-1 811.
[35] HE S D, SHI J, WALID E, et al.Reverse micellar extraction of lectin from black turtle bean (Phaseolus vulgaris):Optimisation of extraction conditions by response surface methodology[J].Food Chemistry, 2015, 166:93-100.
[36] 夏轩泽, 李言, 钱海峰, 等.改性处理对豌豆蛋白结构和功能特性的影响[J].食品科学技术学报, 2021, 39(5):32-38;48.
XIA X Z, LI Y, QIAN H F, et al.Effects of modification treatments on structural characteristics and functional properties of pea protein[J].Journal of Food Science and Technology, 2021, 39(5):32-38;48.
[37] KIM J Y, KIM M R, PARK K H, et al.Effect of pH adjustment during production of egg white powder on foaming and gelling properties[J].Food Science and Biotechnology, 2007, 15(3):418-423.
[38] 刘丽莉, 代晓凝, 杨晓盼, 等.喷雾冷冻干燥对鸡蛋清蛋白结构和特性的影响[J].食品与机械, 2020, 36(1):30-35;41.
LIU L L, DAI X N, YANG X P, et al.Effect of spray freeze drying on the structure and properties of egg white protein[J].Food & Machinery, 2020, 36(1):30-35;41.
[39] CASTRO N, DURRIEU V, RAYNAUD C, et al.Influence of DE-value on the physicochemical properties of maltodextrin for melt extrusion processes[J].Carbohydrate Polymers, 2016, 144:464-473.
[40] JAFARI S M, MCCLEMENTS D J.Nanoemulsions:Formulation, Applications, and Characterization[M].Salt Lake City:Academic Press, 2018.
[41] TAGLIAZUCCHI D, VERZELLONI E, BERTOLINI D, et al.In vitro bio-accessibility and antioxidant activity of grape polyphenols[J].Food Chemistry, 2010, 120(2):599-606.
[42] HUANG H Z, SUN Y J, LOU S T, et al.In vitro digestion combined with cellular assay to determine the antioxidant activity in Chinese bayberry (Myrica rubra Sieb.et Zucc.) fruits:A comparison with traditional methods[J].Food Chemistry, 2014, 146:363-370.
[43] MCDOUGALL G J, DOBSON P, SMITH P, et al.Assessing potential bioavailability of raspberry anthocyanins using an in vitro digestion system[J].Journal of Agricultural and Food Chemistry, 2005, 53(15):5 896-5 904.
[44] OIDTMANN J, BETZ M, RICHLING E, et al.Antioxidant capacity of bilberry extract microencapsulated in whey protein hydrogels[J].Food Research International, 2012, 47(1):51-57.