几丁质是一种由乙酰氨基葡萄糖通过β-1,4糖苷键连接而成的多糖,来源丰富,在自然界的含量仅次于纤维素[1]。几丁质和纤维素一样,由于内部致密的结晶结构,导致其溶解性很差,从而限制其商业化应用[1]。壳聚糖作为几丁质脱乙酰基后的衍生产物,可以溶于稀酸,但是不溶于水,且具有高黏度等缺陷,限制了其应用[2]。壳聚糖进一步分解,则形成壳寡糖。相比几丁质和壳聚糖,壳寡糖具有很好的溶解性,可以溶于水和多种溶剂[3]。壳寡糖具备多种生物活性,如抗氧化、抗肿瘤、抑菌等,在保健食品、化妆品、医药等领域具有巨大的应用潜力[4]。此外许多研究证明,壳寡糖的生物活性取决于其聚合度和脱乙酰度,根据不同应用领域,需要定向制备不同特性壳寡糖,才能最大化发挥其价值。目前壳寡糖的制备方式主要分为物理、化学和酶法3大类[5]。相比于另外2种方法,酶法具有绿色无污染、产物结构完整、反应过程及产物可控等优势,因此酶法成为主流方式用于壳寡糖制备领域[5]。
有多种酶可以水解壳聚糖制备壳寡糖,这些酶主要分为特异性酶(壳聚糖酶)和非特异性酶(蛋白酶、纤维素酶、脂肪酶等)[6]。作为壳聚糖特异性水解酶,壳聚糖酶的水解效率远高于非特异性酶[6]。壳聚糖酶根据氨基酸相似性,可以分为6个糖苷水解酶家族(包括糖苷水解酶5家族、7家族、8家族、46家族、75家族和80家族),目前的研究主要集中在46家族和75家族[7]。已报道的46家族壳聚糖酶主要来源于芽孢杆菌和链霉菌,其中芽孢杆菌壳聚糖酶的研究集中于枯草芽孢杆菌、解淀粉芽孢杆菌和莫海威芽孢杆菌,其他来源芽孢杆菌壳聚糖酶则报道较少[8-10]。因此研究和探索其他芽孢杆菌壳聚糖酶不仅能够丰富壳聚糖酶的种类,而且有望获得更高效的壳聚糖酶。
壳聚糖酶的制备方式主要分为天然菌发酵和异源重组表达2大类。天然菌发酵制备壳聚糖酶存在产量低、重复性差、酶系复杂等缺点,从而限制其大规模产业化应用[11]。异源重组表达则很好地规避了天然菌发酵存在的缺点,适用于大规模工业化生产。目前壳聚糖酶异源重组表达宿主包括大肠杆菌和毕赤酵母,其中大部分的研究选用大肠杆菌进行重组表达[12]。相对于大肠杆菌,毕赤酵母具备胞外表达、内源蛋白少、发酵过程及后处理工艺简便等优势,因此毕赤酵母更适合用于壳聚糖酶的高效制备[13-16]。本论文首先通过基因克隆获得萎缩芽孢杆菌Rk1壳聚糖酶基因(简称bacsn46),其次以毕赤酵母为宿主,通过密码子优化和分子伴侣蛋白共表达,高效制备萎缩芽孢杆菌壳聚糖酶(简称BaCsn46),最后系统研究了重组BaCsn46酶学特性,为其下一步研究和产业化应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种与试剂
萎缩芽孢杆菌(Bacillus atrophaeus)Rk1由实验室前期从土壤分离获得;不同分子伴侣蛋白表达载体由前期实验构建[17](表1);表达载体pPICZαA和毕赤酵母X33,赛默飞世尔科技公司;大肠杆菌Top10感受态细胞,深圳辉诺生物技术有限公司;TA克隆试剂盒、PCR扩增酶TaqTM、无缝克隆试剂盒和限制性内切酶Sac I、Bln I,宝日医生物技术(北京)有限公司;木聚糖、几丁质、羧甲基纤维素钠、可溶性淀粉、不同脱乙酰度壳聚糖(85%、90%和95%)、氨基葡萄糖、G418硫酸盐、卡那霉素,上海源叶生物科技有限公司;不同聚合度壳寡糖(壳二糖~壳六糖),青岛博智汇力生物科技有限公司;蛋白纯化试剂盒(Ni-IDA),上海生工股份有限公司;细菌基因组提取试剂盒、琼脂糖胶纯化试剂盒和质粒提取试剂盒,天根生化科技(北京)有限公司;薄层层析硅胶板,德国默克公司。
表1 分子伴侣蛋白信息表
Table 1 Information of secretion helper factor
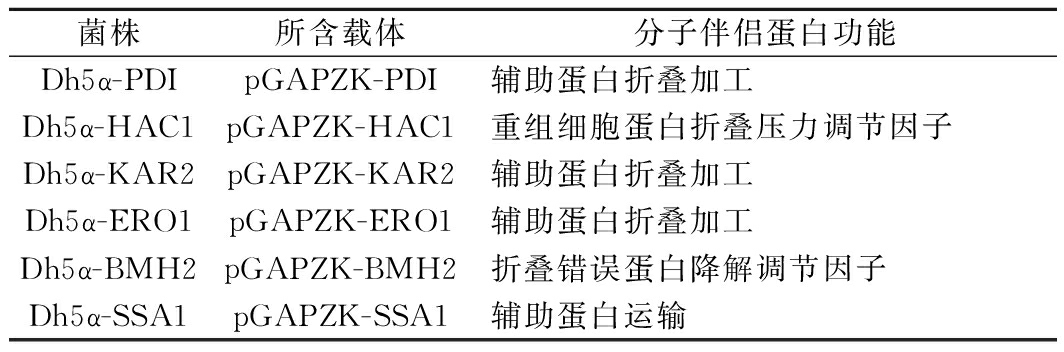
菌株所含载体分子伴侣蛋白功能Dh5α-PDIpGAPZK-PDI辅助蛋白折叠加工Dh5α-HAC1pGAPZK-HAC1重组细胞蛋白折叠压力调节因子Dh5α-KAR2pGAPZK-KAR2辅助蛋白折叠加工Dh5α-ERO1pGAPZK-ERO1辅助蛋白折叠加工Dh5α-BMH2pGAPZK-BMH2折叠错误蛋白降解调节因子Dh5α-SSA1pGAPZK-SSA1辅助蛋白运输
1.1.2 仪器与设备
ProFlex PCR仪,美国应用生物系统(ABI)公司;GelDoc XR+凝胶成像系统、GenePulser XcellTM电转化仪,美国伯乐公司;ND5000核酸浓度测定仪,北京百泰克生物技术有限公司;7 L发酵罐,镇江东方生物工程设备技术公司;UV-1780紫外分光光度计,日本岛津公司;UltiMate3000高效液相色谱仪,美国赛默飞世尔科技公司。
1.1.3 培养基
LBA培养基(LB培养基添加质量浓度为0.03 g/L的氨苄青霉素);LBZ培养基(LB培养基添加质量浓度为0.025 g/L的博来霉素);YPDZ培养基(YPD培养基添加不同浓度博来霉素);YPDG培养基(YPD培养基添加不同浓度遗传霉素);重组工程菌筛选培养基包括BMGY和BMMY培养基;重组工程菌高密度发酵培养基为BSM培养基;所有培养基的配制均可参照毕赤酵母表达手册进行(https://www.thermofisher.com)。
1.2 实验方法
1.2.1 萎缩芽孢杆菌壳聚糖酶Rk1基因克隆
将低温保存的萎缩芽孢杆菌Rk1在LB固体培养基37 ℃活化后接入LB液体培养基,37 ℃、200 r/min培养24 h后提取基因组用于PCR扩增。根据NCBI中萎缩芽孢杆菌BA59基因组序列假定壳聚糖酶基因序列(基因登录号:CP024051.1,2510631-2511455)和萎缩芽孢杆菌UCMB-5137基因组序列假定壳聚糖酶基因序列(基因登录号:CP011802.1,1493426-1494250)设计一对引物[bacsn46-fw:ATGAAGGCAAAA(A/G)TAGATTCATG和bacsn46-rev:TTACTTGATTACGAAATCACCATAC]用于壳聚糖酶基因bacsn46扩增。以提取的萎缩芽孢杆菌壳聚糖酶Rk1基因组为模板,通过PCR扩增以及琼脂糖凝胶电泳获得目标产物,将目标产物纯化回收后,连接至pMD20-T,转入大肠杆菌Top10,通过菌液PCR获得阳性转化子,通过提取质粒酶切并测序,最终获得壳聚糖酶基因bacsn46。
1.2.2 壳聚糖酶BaCsn46生物信息学分析
壳聚糖酶基因bacsn46序列比对分析通过NCBI在线软件blastn和blastp完成;壳聚糖酶BaCsn46理化性质及二级结构分析由expasy平台提供的软件完成(https://www.expasy.org/);信号肽预测分析通过在线软件SignalP-6.0 Server完成;壳聚糖酶BaCsn46氨基酸比对分析由在线软件ClustalW(https://www.genome.jp/tools-bin/clustalw)和ENDscript/ESPript(https://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)完成;壳聚糖酶BaCsn46三维建模以及分子对接分别由软件Modeller10.2和软件Autodock vinerv.1.2.0完成;蛋白三维结构比对以及分析通过软件PyMOL1.8.x完成。
1.2.3 密码子优化提升重组BaCsn46表达
在本研究中选择毕赤酵母α信号肽用于分泌表达重组BaCsn46,因此构建表达载体时需要去掉BaCsn46自身信号肽。以方法1.2.1获得的bacsn46为模板,设计引物bacsn46s-fw(GAGGCTGAAGCTGAATTCGCGGGACTGAACAAGGATCAG)和bacsn46s-rev(TAGAAAGCTGGCGGCCGCCTTGATTACGAAATCAC-CATA)进行PCR扩增获得不含信号肽的编码序列(命名为bacsn46s)。通过无缝克隆将bacsn46s连接至表达载体pPICZαA后转入大肠杆菌Top10,通过菌液PCR,酶切以及测序验证最终获得表达载体pPICZαA-bacsn46s。为了研究密码子偏好性对重组BaCsn46表达的影响,根据毕赤酵母密码子偏好性,通过在线软件GenSmart Codon Optimization对bacsn46s序列进行优化。优化后的基因命名为bacsn46sopt,由通用生物(安徽)股份有限公司合成并连接至表达载体pPICZαA,从而获得表达载体pPICZαA-bacsn46sopt。
用SacI分别线性化表达载体pPICZαA-bacsn46s和pPICZαA-bacsn46sopt,纯化回收后测定浓度。分别将线性化表达载体pPICZαA-bacsn46s和pPICZαA-bacsn46sopt转入毕赤酵母X33。转化子均匀涂布于YPDZ平板(博来霉素质量浓度分别为0.2,0.4,0.6和0.8 g/L),30 ℃培养3 d后,通过24孔板法进行初步筛选,通过摇瓶培养进行复筛。筛选过程参照之前方法进行[17]。
1.2.4 分子伴侣蛋白共表达
以1.2.3中筛选出来的酶活性优势菌为宿主,通过共表达不同分子伴侣蛋白,进一步提升重组BaCsn46表达量。参照文献[17]的方法将酶活性优势菌制备成感受态细胞;提取不同分子伴侣蛋白共表达载体并用限制性内切酶Bln I线性化;纯化回收不同线性化后的分子伴侣蛋白表达载体并转入酶活性优势菌,转化子均匀涂布于YPDG固体平板,30 ℃培养3~4 d;共表达分子伴侣蛋白转化子筛选和1.2.3中方法一致。
1.2.5 高密度发酵
参照文献[17]的方法进行。将重组工程菌接入YPD培养基制备一级和二级种子液;将二级种子液按照10%(体积分数)的接种量接入7 L发酵罐进行培养;初始阶段流加葡萄糖作为碳源进行培养,当菌体湿重达到170 g/L后,开始进行甲醇诱导培养,整个过程保持溶氧大于10%;诱导阶段每隔24 h进行菌体湿重、总蛋白浓度以及酶活力的测定。
酶活力测定采用DNS方法[10],以95%脱乙酰度胶体壳聚糖为底物(5 g/L),反应pH和温度分别为6.0和55 ℃。首先将胶体壳聚糖底物和酶液分别预热5 min;其次分别取50 μL酶液和350 μL胶体壳聚糖,振荡混匀,水浴反应10 min后加入600 μL DNS溶液终止反应;最后将反应溶液煮沸5 min,冷却至室温后在OD540测定吸光值,以失活的酶液作为对照。酶活力定义为每分钟生成1 μmol氨基葡萄糖为一个酶活力单位。总蛋白浓度采用Bradford法进行测定,具体步骤参照试剂盒说明书进行。菌体湿重测定方法如下:将发酵液离心去掉上清液后进行称重,根据前后质量差计算菌体湿重。
1.2.6 重组BaCsn46分离纯化及酶动力学参数测定
参照文献[10]的方法分离纯化重组BaCsn46。首先采用超滤管(10 kDa)进行浓缩,浓缩后的重组BaCsn46参照Ni-IDA蛋白纯化试剂盒进行纯化。酶动力学参数测定参照文献[10]的方法进行,以不同浓度95%脱乙酰度胶体壳聚糖为底物,测定重组BaCsn46反应速度,通过Graph分析获得最大反应速度Vmax和米氏常数Km。
1.2.7 重组BaCsn46表征分析
重组BaCsn46表征分析包括pH特性、温度特性、金属离子特性、底物特异性。pH特性包括最适反应pH和pH稳定性:在不同pH缓冲液条件下测定重组BaCsn46的酶活力,将酶活力最高pH条件下的酶活力设置为100%计算其他pH条件下的相对酶活力;将重组BaCsn46在pH 3.0~11.0条件下室温放置4 h后进行剩余酶活力测定,以没有处理的样品作为对照,计算不同pH条件下的剩余酶活力。
重组BaCsn46温度特性包括最适反应温度和热稳定性:在不同温度条件下测定重组BaCsn46的酶活性,以酶活力最高温度设置为100%计算其他温度的相对酶活力;将重组BaCsn46在不同温度条件下水浴处理30和60 min后进行剩余酶活力测定,以没有热处理的样品作为对照,计算剩余酶活力。
不同金属离子(Co2+、Cu2+、Fe2+、Na+、Ca2+、K+、Mn2+和Mg2+)对重组BaCsn46稳定性影响如下:将重组BaCsn46分别加入含有1和5 mmol/L不同金属离子缓冲液(pH 7.0),室温放置4 h后进行活性测定,以没有处理的样品作为对照,计算剩余酶活力。
重组BaCsn46对不同底物水解活性的测定如下:分别测定重组BaCsn46对羧甲基纤维素钠、木聚糖、可溶性淀粉、胶体几丁质、粉末几丁质以及不同脱乙酰度胶体壳聚糖的活性,把酶活力最高的底物设置为100%,计算其他底物的相对酶活力。
1.2.8 重组BaCsn46水解模式分析
以不同聚合度壳寡糖为底物分析重组BaCsn46的水解模式。重组BaCsn46的添加量为10 U/mL,不同壳寡糖底物质量浓度为5 g/L,在50 ℃、100 r/min条件下反应2 h,反应过程中定时取样进行薄层色谱(thin layer chromatography,TLC)分析。扩展剂为V(异丙醇)∶V(氨水)∶V(水)=15∶7.5∶1,层析完成后,喷显色剂(0.5 g茚三酮溶于100 mL无水乙醇),在微波炉高温5 min后,观察实验结果。
1.2.9 重组BaCsn46酶法制备壳寡糖
重组BaCsn46酶法制备壳寡糖所用底物为95%脱乙酰度胶体壳聚糖(质量浓度为40 g/L)。首先研究不同酶添加量(10~30 U/mL)条件下壳寡糖的组成。总反应体系为10 mL,在50 ℃、100 r/min反应1 h后进行水解率测定以及产物分析。水解率测定参照文献[10]的方法进行,将水解产物(5 mL)加入NaOH溶液调整pH至8.5,离心去上清液,在100 ℃烘干至恒重,根据质量差进行计算。通过TLC分析水解产物壳寡糖组成。
根据第一步酶解实验结果,进一步研究15 U/mL酶添加量不同反应时间水解率以及壳寡糖组成。反应总体系为200 mL,反应条件为50 ℃、100 r/min。反应过程中定时取样进行TLC分析、水解率测定以及水解产物分析[8]。
2 结果与分析
2.1 壳聚糖酶基因bacsn46克隆及分析
通过PCR扩增获得长度约为830 bp的特异条带,将该条带纯化连接至pMD20-T,转化至大肠杆菌Top10,结合酶切和测序验证最终获得壳聚糖酶基因bacsn46。bacsn46全长为825 bp,编码274个氨基酸。通过预测分析,发现BaCsn46分子质量为30.7 kDa,等电点为6.22,前32个氨基酸为信号肽。NCBIblastp比对结果表明,BaCsn46属于壳聚糖酶46家族,与耐盐芽孢杆菌相似性最高(87.5%),其次为漠海威芽孢杆菌(87.1%)。
以去除信号肽的氨基酸序列进行蛋白三维建模,实验结果如图1所示。由图1-a可知,BaCsn46三维构象可分为上下2个半球,其中上、下半球均主要由4个α螺旋构成,这2个半球通过一个长的α螺旋进行连接。PyMOL软件分析BaCsn46蛋白表面静电分布,发现其底物结合区域主要带负电荷(图1-b),有利于其与壳聚糖进行结合和发生催化反应。BaCsn46与壳六糖分子对接结果表明,BaCsn46主要以氢键的方式和壳六糖进行结合(图1-c),此外在底物结合区域多个氨基酸(E19、Y29、D35、R37、T40、A44、G45、T50、D52、Y118、Q146、D149、W204、E206和E235)在水解反应中发挥重要作用。

a-BaCsn46三维构象;b-BaCsn46静电分析图;c-BaCsn46催化活性中心关键氨基酸和壳六糖相互作用
图1 壳聚糖酶BaCsn46三维结构分析
Fig.1 Homology-modeling structure of BaCsn46
2.2 密码子优化提升重组BaCsn46表达量
根据毕赤酵母密码子偏好性,分析bacsn46s基因序列,发现存在多个低频密码子,如编码丙氨酸所对应的密码子GCG、编码亮氨酸所对应的密码子CTC等,因此需要优化bacsn46s基因序列。经过优化bacsn46s内部166个碱基,使得bacsn46s基因序列的GC含量由44.72%提升至46.78%,表达适应指数由0.61提升至0.82,优化后的基因bacsn46sopt与bacsn46s相似性约为77%(图2)。

图2 壳聚糖酶基因bacsn46s 密码子优化前后序列比对
Fig.2 Sequence comparison between the native and optimized gene of bacsn46s
初步筛选实验,bacsn46s和bacsn46sopt所对应重组菌分别挑选96个转化子进行培养,经过酶活力测定,最终各获得3个酶活性优势菌。bacsn46s所对应的3个重组工程菌分别命名为B1、B26和B75,酶活力分别为12.6,12.3和12.1 U/mL。bacsn46sopt所对应的3个重组工程菌分别命名为Bo11、Bo35和Bo86,酶活力分别为17.2、16.5和16.2 U/mL。通过摇瓶培养进一步比较初步筛选获得的酶活力优势菌,bacsn46sopt所对应的重组工程菌Bo11、Bo35和Bo86发酵酶活力均高于bacsn46s所对应的重组工程菌B1、B26和B75,重组工程菌Bo11、Bo35、Bo86、B1、B26和B75摇瓶发酵酶活力分别为71.5、63.3、66.5、52.8、55.3和49.6 U/mL。
相比于摇瓶培养,发酵罐培养更容易控制补料速度、温度、pH等技术参数,因此能够更精确地比较不同菌种的发酵特性。为了更精确地比较bacsn46s和bacsn46sopt所对应酶活力优势菌B26和Bo11的发酵特性,分别将2个菌种在7 L发酵罐进行高密度培养,实验结果如图3所示。7 L发酵罐培养条件下,重组工程菌B26和Bo11最高发酵酶活力分别为3 521和4 929 U/mL;总蛋白质量浓度分别为2.88和4.21 g/L。
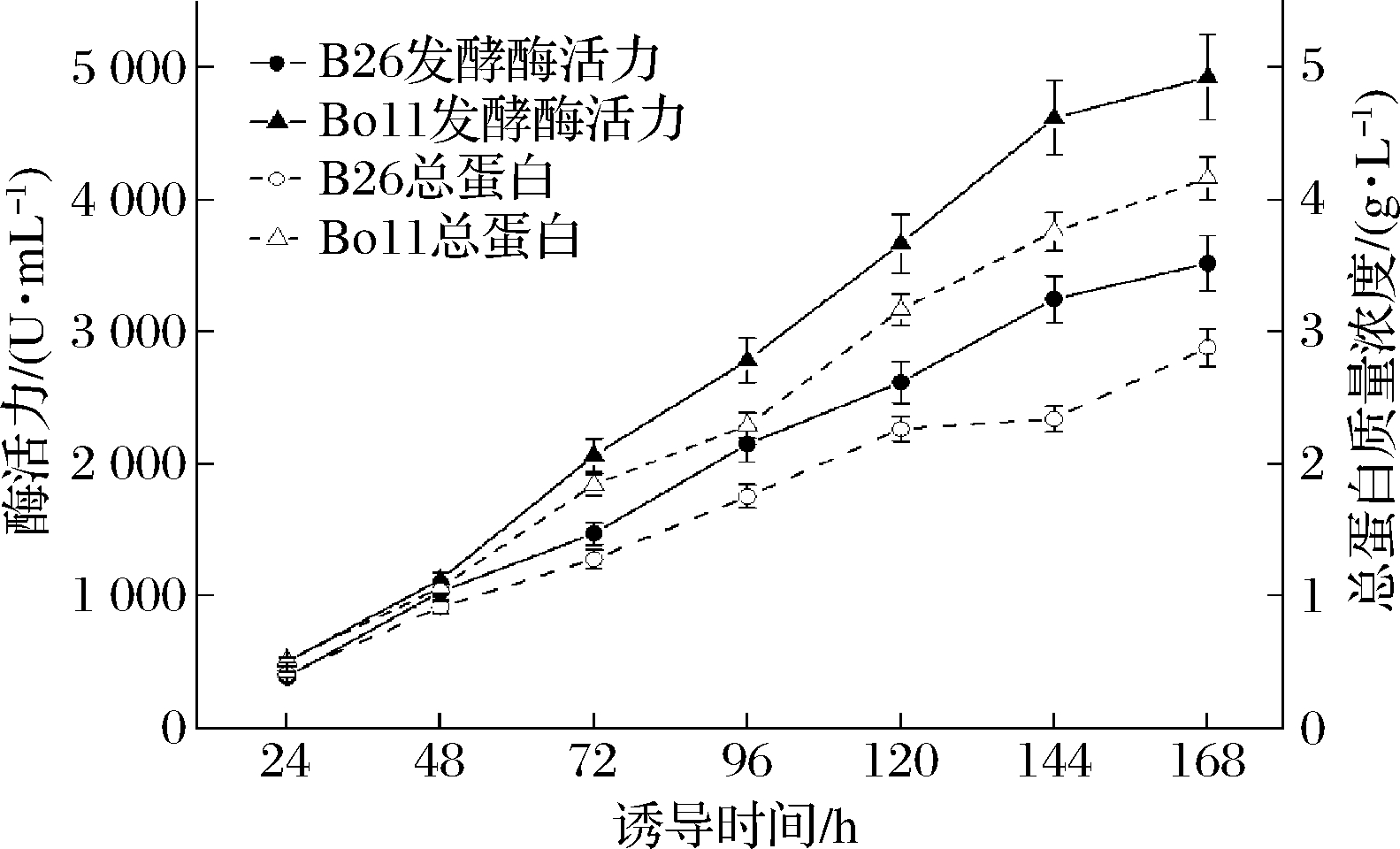
图3 重组工程菌B26和Bo11高密度发酵
Fig.3 High density fermentation of recombinant strain B26 and Bo11
2.3 分子伴侣蛋白共表达提升重组BaCsn46表达量
以重组工程菌Bo11为宿主,将不同线性化后的分子伴侣蛋白表达载体转入重组工程菌Bo11,获得不同分子伴侣蛋白共表达重组工程菌。初步筛选结果表明分子伴侣蛋白KAR2效果最好,其次为HAC1和SSA1。将共表达分子伴侣蛋白KAR2、HAC1和SSA1最高酶活性工程菌分别命名为Bo11K、Bo11H和Bo11S。摇瓶培养结果显示,重组工程菌Bo11K、Bo11H和Bo11S最高发酵酶活力分别为105.8、96.2和89.3 U/mL,分别是重组工程菌Bo11的1.46,1.34和1.24倍。
为了进一步比较重组工程菌Bo11和Bo11K的发酵特性,分别用7 L发酵罐进行培养,实验结果如图4所示。重组工程菌Bo11和Bo11K发酵酶活力分别为5 126和7 356 U/mL;总蛋白质量浓度分别为4.16和5.95 g/L;菌体湿重分别为432和486 g/L。此外将重组工程菌Bo11K不同诱导时间上清发酵液进行蛋白电泳,实验结果如图4-b所示。重组工程菌Bo11K发酵上清液中基本为重组BaCsn46,便于下游后处理工艺的进行。

a-重组菌Bo11和Bo11K在7 L发酵罐发酵酶活力、总蛋白浓度和细胞湿重;b-重组菌Bo11K发酵上清液蛋白电泳
图4 重组菌Bo11和Bo11K高密度发酵
Fig.4 High density fermentation of recombinant strain Bo11 and Bo11K
2.4 重组BaCsn46纯化及酶动力学参数测定
通过实验获得纯化后的重组BaCsn46,其酶比活力为1 782 U/mg。此外重组BaCsn46米氏常数(Km)、最大反应速度(Vmax)、转化数(Kcat)以及专一性常数(Kcat/Km)分别为1.02 g/L、1 962 μmol/(min·mg)、423 min-1和202 mL/(mg·min),表明重组BaCsn46对壳聚糖具有良好的亲和力并且能够高效水解壳聚糖。
2.5 重组BaCsn46温度和pH特性
以纯化后的重组BaCsn46为研究对象,进行温度和pH特性测定,实验结果如图5所示。由图5-a可知,重组BaCsn46最适反应pH为6.0,在pH 5.0~6.5相对酶活力均大于60%。重组BaCsn46在pH 5.0~9.0范围内,具有良好的稳定性,室温放置4 h后,剩余酶活力均高于70%(图5-b)。
重组BaCsn46最适反应温度为60 ℃,在50~60 ℃相对酶活力均大于80%,当温度升至70 ℃,相对酶活力快速下降,仅为24%(图5-c)。由图5-d可知,重组BaCsn46在45~50 ℃具有很好的稳定性,热处理60 min后,剩余酶活力均大于90%,当热处理温度高于55 ℃,重组BaCsn46剩余酶活力急剧下降。
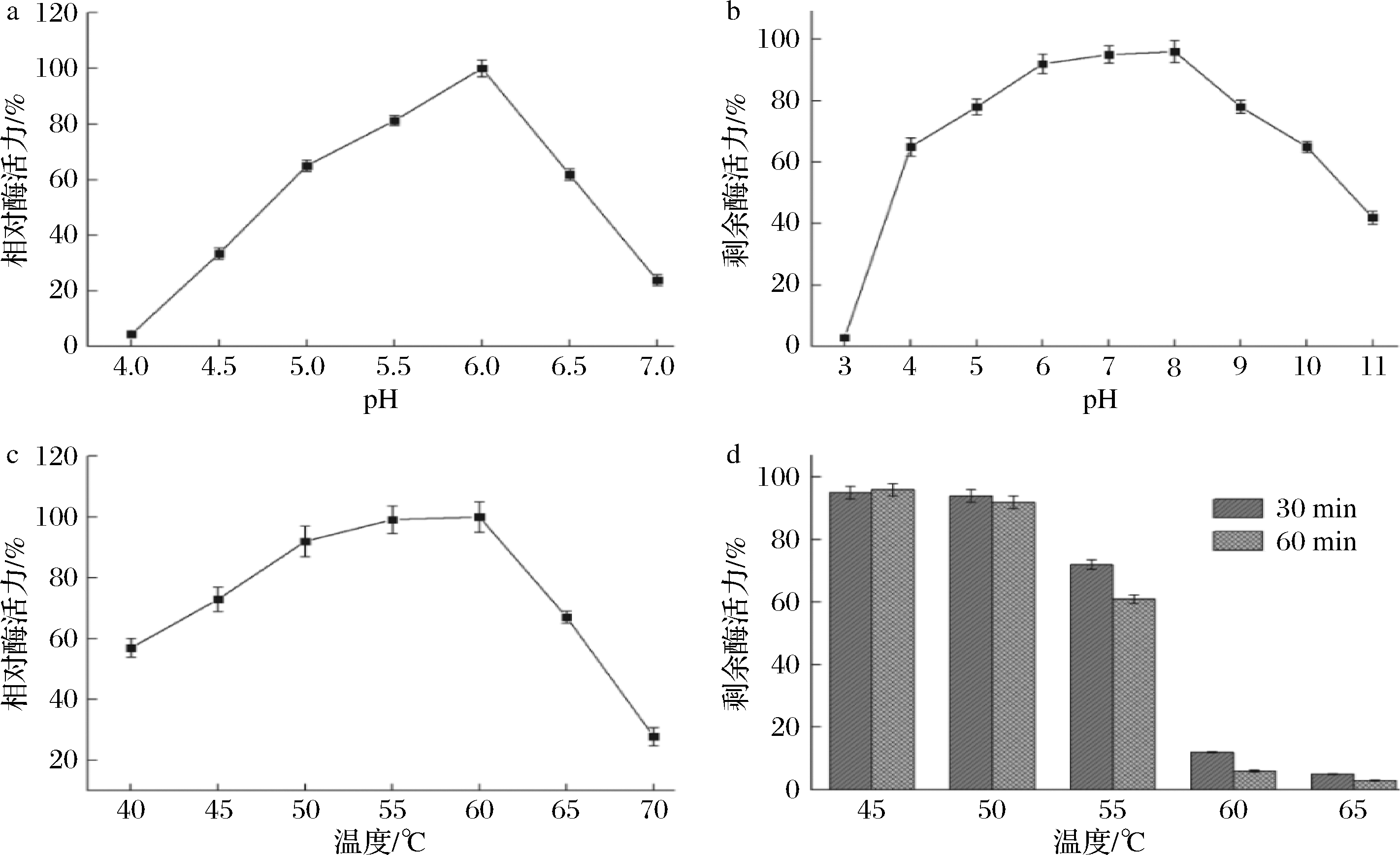
a-最适反应pH;b-pH稳定性;c-最适反应温度;d-热稳定性
图5 重组BaCsn46酶学特性
Fig.5 Enzymatic properties of recombinant BaCsn46
2.6 金属离子特性
在1 mmol/L条件下,Mg2+和Mn2+对重组BaCsn46具有激活作用,剩余酶活力分别为108%和123%,Fe2+则明显抑制重组BaCsn46活性,剩余酶活力仅为8%,其他金属离子剩余酶活力均大于80%。在5 mmol/L条件下,Mg2+、Ca2+和Mn2+对重组BaCsn46具有激活作用,剩余酶活力均高于105%;Fe2+和Cu2+则具有抑制作用,剩余酶活力仅为5%和32%。
2.7 底物特异性
重组BaCsn46最适反应底物为95%脱乙酰度胶体壳聚糖、其次分别为脱乙酰度90%和85%胶体壳聚糖,此外重组BaCsn46对胶体几丁质、粉末几丁质、羧甲基纤维素钠、可溶性淀粉和木聚糖均没有活性。
2.8 重组BaCsn46水解模式分析
由图6可知重组BaCsn46对壳二糖和壳三糖均没有水解活性,反应120 min后,壳二糖和壳三糖均没有被分解成更小的糖。重组BaCsn46对壳四糖有微弱的水解活性,反应120 min后,只有少部分壳四糖被分解。重组BaCsn46对壳五糖和壳六糖具有较高的水解活性:反应60 min后,大部分壳五糖转化为壳二糖和壳三糖;反应30 min后,壳六糖则全部被分解,转化成壳二糖、壳三糖和壳四糖。
2.9 不同聚合度壳寡糖制备
不同酶添加量的水解效果如图7-a所示。酶添加量在10~15 U/mL,反应1 h后,水解产物由壳二糖至壳五糖构成,含有少量壳六糖,酶添加量>20 U/mL,水解产物则主要由壳二糖、壳三糖和壳四糖构成。
根据不同酶添加量实验结果,选择酶添加量15 U/mL研究不同反应时间下壳寡糖组成及水解率的变化。由图7-b和图7-c可知,反应15 min后,水解率达到90.2%,水解产物主要由壳三糖至壳六糖组成,其中壳五糖和壳六糖占比为44.2%。随着水解反应进行,壳五糖和壳六糖逐渐被分解成壳二糖、壳三糖和壳四糖。反应30 min后,水解产物由壳二糖至壳六糖组成,质量浓度分别为5.58、8.24、10.37、7.34和6.06 g/L。当反应时间为45和60 min,水解产物主要包括壳二糖、壳三糖和壳四糖,水解率则均大于95.3%。

a-壳二糖;b-壳三糖;c-壳四糖;d-壳五糖;e-壳六糖
图6 重组BaCsn46水解模式分析
Fig.6 Analysis of hydrolytic pattern of recombinant BaCsn46
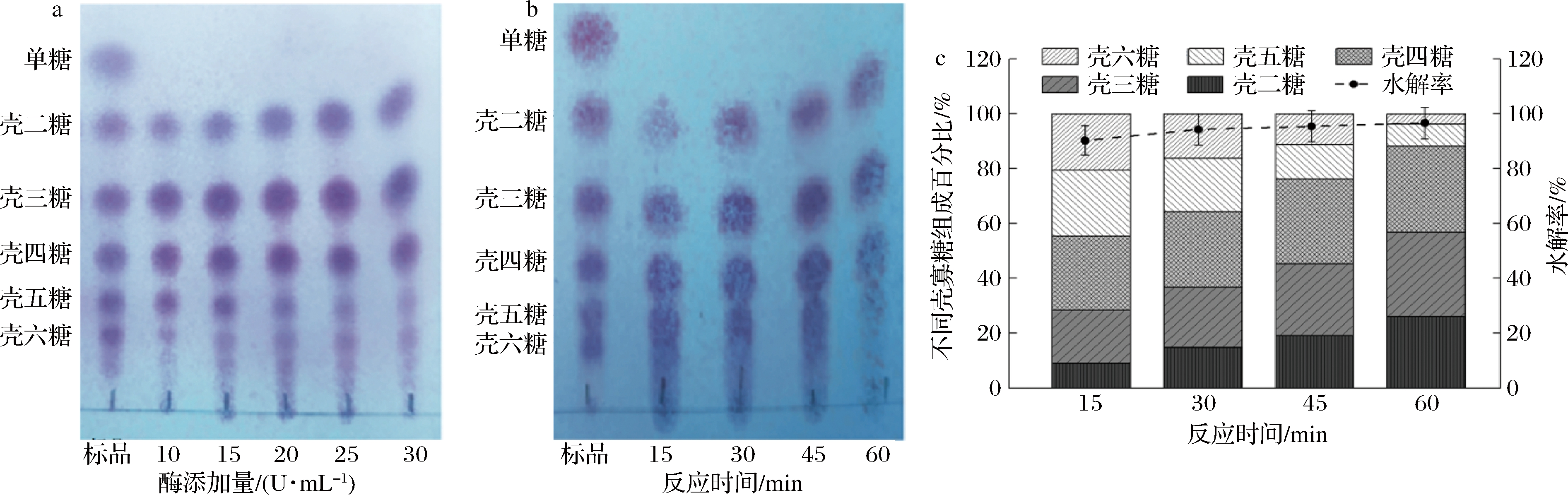
a-不同酶添加量水解效果;b-不同反应时间水解效果;c-不同反应时间壳寡糖组成及水解率
图7 重组BaCsn46酶法制备壳寡糖
Fig.7 Preparation of chitosan oligosaccharides by recombinant BaCsn46
3 讨论
壳寡糖由于具备多种生物活性,在许多领域具有巨大的应用潜力,壳聚糖酶在壳寡糖酶法制备过程中发挥重要作用。迄今,关于壳聚糖酶的研究主要集中在46家族和75家族,相比于75家族,46家族壳聚糖酶具备催化活性高、反应条件温和等优势,更适于壳寡糖的制备[7,11]。本研究获得的壳聚糖酶BaCsn46属于46家族,和已报道的46家族壳聚糖酶相似[6,9-11],BaCsn46三维构象主要由上下2个半球组成,催化活性区域呈负电荷,此外BaCsn46催化活性区的关键氨基酸主要通过氢键和底物发生反应。
重组BaCsn46最适反应pH为6.0并且在pH 4.5~6.0具有良好的活性和稳定性,这一特性与来源于莫海威芽孢杆菌和解淀粉芽孢杆菌壳聚糖酶相似[10,15],优于芽孢杆菌MD-5[18]。壳聚糖的水解效率取决于其溶解状态,在酸性条件下壳聚糖具有良好的溶解性,有利于进行水解反应[1]。重组BaCsn46的pH特性表明其适用于壳寡糖的制备。迄今,报道的芽孢杆菌壳聚糖酶最适反应温度主要分布在40~60 ℃[8,10,15,18]。虽然重组BaCsn46最适反应温度为60 ℃,但其在60 ℃条件下热稳定性较差,热处理30 min后剩余酶活力仅为17%。重组BaCsn46在50 ℃的相对酶活力为88%,并且具有良好的热稳定性(热处理30 min,剩余酶活力为96%),因此重组BaCsn46制备壳寡糖反应温度可控制在50 ℃。
金属离子通过改变酶蛋白的结构从而影响其活性。本研究中金属离子Ca2+、Mg2+和Mn2+对重组BaCsn46具有激活作用;Fe2+和Cu2+则明显抑制重组BaCsn46活性。已有文献表明同一种金属离子展现出激活或者抑制作用,和具体的壳聚糖酶相关。例如Cu2+明显抑制重组BaCsn46活性,而Cu2+对来源于雪白链霉菌的壳聚糖酶则具有激活作用,在1 mmol/L条件下,其剩余酶活力高于150%[7]。
前期研究显示,46家族壳聚糖酶具有高度底物特异性,对几丁质、木聚糖、纤维素等多糖均没有水解活性。此外胶体壳聚糖的脱乙酰度影响46家族壳聚糖酶水解活性,脱乙酰度越高,相对水解活性越高[8,18],可能的原因是乙酰基团降低了壳聚糖酶和底物的结合和水解速率。壳聚糖酶水解壳聚糖主要分为外切和内切2种方式:外切主要从壳聚糖还原端进行水解,水解产物含有氨基葡萄糖;内切则是在壳聚糖内部随机切割形成不同聚合度(>2)壳寡糖[19-20]。重组BaCsn46水解不同壳寡糖结果表明其是一种内切壳聚糖酶。此外在所有水解反应中重组BaCsn46没有呈现转糖苷酶活性,这一结果和已报道大部分46家族壳聚糖酶相似。
聚合度是影响壳寡糖生物活性的重要因素,不同聚合度壳寡糖在不同应用领域呈现出不一样的效果。研究表明当壳寡糖的聚合度>5时,对金黄色葡萄球菌才具有抑菌效果[21]。ZOU等[22]的研究显示,壳寡糖能够提升小麦种子在寒冷条件下的发芽率和生长,其中壳六糖效果最好。LI等[23]在实验过程中发现随着壳寡糖聚合度降低,清除羟自由基能力逐渐增强,其中壳三糖效果最好。因此根据不同的应用领域,需要定向制备不同聚合度壳寡糖。本研究报道的重组BaCsn46能够高效水解胶体壳聚糖,且通过控制酶添加量和反应时间,可定向制备不同聚合度壳寡糖。当酶添加量15 U/mL,底物质量浓度40 g/L,50 ℃条件下,反应15 min,水解率便达到90.2%。在反应前期,水解产物主要由壳四糖至壳六糖构成,在反应后期则主要由壳二糖至壳四糖组成。
作为壳寡糖酶法工艺的核心,壳聚糖酶的生产成本直接影响壳寡糖生产成本,因此高效制备壳聚糖酶具有重要意义。毕赤酵母作为一种成熟的表达系统,已成功重组表达多种酶蛋白。前期已有壳聚糖酶在毕赤酵母重组表达的报道,实验结果表明毕赤酵母具有产量高、杂蛋白少等优势。此外为了进一步提升重组蛋白在毕赤酵母的表达量,研究人员也尝试了密码子优化、基因拷贝数、分子伴侣蛋白共表达等策略[24-25]。本研究以毕赤酵母X33为宿主,通过结合密码子优化和分子伴侣蛋白共表达实现了重组BaCsn46高效制备。在7 L发酵罐条件下,最高酶活力和总蛋白质量浓度分别为7 356 U/mL和5.95 g/L。由于酶活力测定方法存在差异,因此不能根据酶活力判断表达水平的高低。通过分析不同文献发现总蛋白浓度测定方法基本一致,目前链霉菌174壳聚糖酶在毕赤酵母表达量最高,总蛋白质量浓度达到8.5 g/L[25],其次为解淀粉芽孢杆菌壳聚糖(总蛋白质量浓度约为4.5 g/L)[15]。此外和已报道的研究一样,重组工程菌Bo11K发酵上清液中基本为重组BaCsn46,有利于后期纯化和下游后处理工艺。
4 结论
本研究通过同源克隆获得萎缩芽孢杆菌Rk1壳聚糖酶基因bacsn46,其全长为825 bp,编码274个氨基酸。通过结合密码子优化、分子伴侣蛋白共表达以及高密度发酵实现重组BaCsn46高效制备,发酵酶活力和总蛋白质量浓度最高分别达到7 356 U/mL和5.95 g/L。重组BaCsn46在45~55 ℃以及pH 5.0~6.0具有良好的稳定性和活性。重组BaCsn46作为一种内切壳聚糖酶,能够高效水解不同浓度胶体壳聚糖,此外通过控制酶添加量和反应时间可以定向制备不同聚合度的壳寡糖。本研究为重组BaCsn46下一步的研究和产业化应用奠定基础。
[1] MOHAN K N, GANESAN A R, EZHILARASI P N, et al.Green and eco-friendly approaches for the extraction of chitin and chitosan:A review[J].Carbohydrate Polymers, 2022, 287:119349.
[2] KOU S, PETERS L M, MUCALO M R.Chitosan:A review of sources and preparation methods[J].International Journal of Biological Macromolecules, 2021, 169:85-94.
[3] AHMAD S I, AHMAD R, KHAN M S, et al.Chitin and its derivatives:Structural properties and biomedical applications[J].International Journal of Biological Macromolecules, 2020, 164:526-539.
[4] YUAN X B, ZHENG J P, JIAO S M, et al.A review on the preparation of chitosan oligosaccharides and application to human health, animal husbandry and agricultural production[J].Carbohydrate Polymers, 2019, 220:60-70.
[5] HAO W T, LI K C, LI P C.Review:Advances in preparation of chitooligosaccharides with heterogeneous sequences and their bioactivity[J].Carbohydrate Polymers, 2021, 252:117206.
[6] WANG J, WANG P, ZHU M, et al.Overexpression and biochemical properties of a GH46 chitosanase from marine Streptomyces hygroscopicus R1 suitable for chitosan oligosaccharides preparation[J].Frontiers in Microbiology, 2021, 12:816845.
[7] THADATHIL N, VELAPPAN S P.Recent developments in chitosanase research and its biotechnological applications:A review[J].Food Chemistry, 2014, 150:392-399.
[8] QIN Z, LUO S, LI Y, et al.Biochemical properties of a novel chitosanase from Bacillus amyloliquefaciens and its use in membrane reactor[J].LWT, 2018, 97:9-16.
[9] LI Y B, GOU Y, LIU Z C, et al.Structure-based rational design of chitosanase CsnMY002 for high yields of chitobiose[J].Colloids and Surfaces B:Biointerfaces, 2021, 202:111692.
[10] WANG J, LI X, CHEN H, et al.Heterologous expression and characterization of a high-efficiency chitosanase from Bacillus mojavensis SY1 suitable for production of chitosan oligosaccharides[J].Frontiers in Microbiology, 2021, 12:781138.
[11] VIENS P, LACOMBE-HARVEY M  , BRZEZINSKI R.Chitosanases from family 46 of glycoside hydrolases:From proteins to phenotypes[J].Marine Drugs, 2015, 13(11):6 566-6 587.
, BRZEZINSKI R.Chitosanases from family 46 of glycoside hydrolases:From proteins to phenotypes[J].Marine Drugs, 2015, 13(11):6 566-6 587.
[12] GUO N, SUN J N, WANG W, et al.Cloning, expression and characterization of a novel chitosanase from Streptomyces albolongus ATCC 27414[J].Food Chemistry, 2019, 286:696-702.
[13] 赵宁, 王玉川, 易萍, 等.樟绒枝霉α-淀粉酶在毕赤酵母中的高效表达及在麦芽糖浆制备中的作用[J].食品与发酵工业, 2019, 45(2):1-6.
ZHAO N, WANG Y C, YI P, et al.High level expression of α-amylase from Malbranchea cinnamomea in Pichia pastoris and preparation of maltose syrup[J].Food and Fermentation Industries, 2019, 45(2):1-6.
[14] 赵一凡, 常晓娇, 杜稳, 等.毕赤酵母产伏马毒素B1羧酸酯酶发酵条件和培养基的优化[J].食品与发酵工业, 2021, 47(1):43-49.
ZHAO Y F, CHANG X J, DU W, et al.Optimization of fermentation condition and medium for fumonisin B1 carboxylesterase production in Pichia pastoris[J].Food and Fermentation Industries, 2021, 47(1):43-49.
[15] LUO S, QIN Z, CHEN Q, et al.High level production of a Bacillus amlyoliquefaciens chitosanase in Pichia pastoris suitable for chitooligosaccharides preparation[J].International Journal of Biological Macromolecules, 2020, 149:1 034-1 041.
[16] 苑馨瑶, 田康明, 金鹏, 等.黑曲霉低聚葡萄糖氧化酶的分子克隆与生化特征[J].食品与发酵工业, 2020, 46(1):30-35.
YUAN X Y, TIAN K M, JIN P, et al.Molecular cloning and characterization of gluco-oligosaccharide oxidase from Aspergillus niger[J].Food and Fermentation Industries, 2020, 46(1):30-35.
[17] WANG J R, WU Z Z, ZHANG T Y, et al.High-level expression of Thermomyces dupontii thermophilic lipase in Pichia pastoris via combined strategies[J].3 Biotech, 2019, 9(2):62.
[18] YANG G S, SUN H H, CAO R, et al.Characterization of a novel glycoside hydrolase family 46 chitosanase, Csn-BAC, from Bacillus sp.MD-5[J].International Journal of Biological Macromolecules, 2020, 146:518-523.
[19] SHINYA S, FUKAMIZO T.Interaction between chitosan and its related enzymes:A review[J].International Journal of Biological Macromolecules, 2017, 104:1 422-1 435.
[20] WEIKERT T, NIEHUES A, CORD-LANDWEHR S, et al.Reassessment of chitosanase substrate specificities and classification[J].Nature Communications, 2017, 8:1698.
[21] LI K C, XING R E, LIU S, et al.Size and pH effects of chitooligomers on antibacterial activity against Staphylococcus aureus[J].International Journal of Biological Macromolecules, 2014, 64:302-305.
[22] ZOU P, TIAN X Y, DONG B, et al.Size effects of chitooligomers with certain degrees of polymerization on the chilling tolerance of wheat seedlings[J].Carbohydrate Polymers, 2017, 160:194-202.
[23] LI K C, XING R E, LIU S, et al.Separation of chito-oligomers with several degrees of polymerization and study of their antioxidant activity[J].Carbohydrate Polymers, 2012, 88(3):896-903.
[24] WANG Y X, LUO X, ZHAO Y Q, et al.Integrated strategies for enhancing the expression of the AqCoA chitosanase in Pichia pastoris by combined optimization of molecular chaperones combinations and copy numbers via a novel plasmid pMC-GAP[J].Applied Biochemistry and Biotechnology, 2021, 193(12):4 035-4 051.
[25] DING M, ZHANG T, SUN C, et al.A Chitosanase mutant from Streptomyces sp.N174 prefers to produce functional chitopentasaccharide[J].International Journal of Biological Macromolecules, 2020, 151:1 091-1 098.