铁棍山药(Dioscorea opposita)为薯蓣科薯蓣属植物的块茎[1],主要产地是我国河南省焦作市,被誉为“四大山药”之首。铁棍山药富含碳水化合物、多糖、多酚以及钙、铁、锌等多种微量元素,具有极高的营养价值[2]。但新鲜铁棍山药的含水率高,不易储存,容易出现发芽、变质等现象[3]。目前,经常对铁棍山药进行切片及干燥加工,通过降低其含水量及水分活度延长铁棍山药的贮藏期,保证铁棍山药的品质及营养成分,还能拓宽其应用市场。
热泵干燥(heat pump drying, HPD)是一种将热源循环利用的现代干燥技术,具有低能耗、污染少等优势[4],但同时也存在仅对物料表面加热、干燥时间偏长等缺点[5],进而不利于热敏性营养物质的保留。直触超声(contact ultrasound, CU)可以通过超声设备直接将超声波能量传入物料内部,该技术所特有的机械效应和空化效应[6]可使物料组织结构变蓬松、微观孔道数量增多,能够大大减小传质阻力,从而有利于干燥过程中物料内部水分扩散,进而缩短干燥时间。将HPD和直触超声2种技术联合应用的超声强化热泵干燥技术(contact ultrasound enhanced heat pump drying, CU-HPD),理论上可实现2种技术的优势互补,直触超声技术能够强化HPD过程中的传质进程,促进物料内部水分扩散[7],进而缩短干燥时间和提升产品品质。但目前未见铁棍山药CU-HPD品质特性的研究报道
变异系数法[8]是通过统计学方法计算得出各参数指标变化程度的权重分析方法,能够对参数指标进行客观评价。白洁等[9]利用变异系数法对气流膨化处理马铃薯方便粥的品质进行综合评价,发现130 ℃处理30 s得到的马铃薯方便粥品质最优。该方法是权重分析及指标评价的有效方法,能够很好地评判产品指标变化程度,但目前未见CU-HPD的变异系数法研究与应用。
因此,本文以新鲜铁棍山药为试验材料,进行CU-HPD试验。分析不同HPD温度和超声功率对铁棍山药品质特性的影响,并利用变异系数法对其进行综合评分,得到最优干燥条件,以期为新鲜铁棍山药的高效干燥及CU-HPD研究与应用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜铁棍山药,市售。其大小均匀、无损伤。
本试验中所用试剂:柠檬酸、L-抗坏血酸、D-异抗坏血酸钠、Na2CO3、无水乙醇,天津德恩化学试剂有限公司;浓硫酸(纯度≥98%),洛阳昊华化学试剂有限公司;蒽酮,天津市科密欧化学试剂有限公司;无水葡萄糖(纯度≥98%)、Folin-Ciocalteu试剂、没食子酸(纯度≥98%)、DPPH(纯度≥97%),上海源叶生物科技有限公司,以上试剂均为分析纯。
1.2 仪器设备
超声强化热泵干燥设备,河南科技大学自制[5];福瑞特多功能不锈钢果蔬切片机,佛山市凌齐电器有限公司;DT型电子天平,常熟市嘉衡天平仪器有限公司;NMI120-015V-1型核磁共振分析仪,上海纽迈电子科技有限公司;TM3030Plus型台式扫描电镜,日本日立高新技术公司;TA.XT EXPRESS型物性分析仪,英国SMS公司;Color i5型色差仪,美国X-Rite公司;ALC-210.3型分析天平,赛多利斯艾科勒公司;UV-4800型紫外-可见分光光度计,尤尼柯上海仪器有限公司;TG16-WS型高速离心机,湘仪仪器有限公司;KQ-500DE型超声波清洗机,昆山市超声仪器有限公司。
1.3 实验方法
将新鲜铁棍山药洗净、去皮,并切成5 mm厚的薄片。将切好的铁棍山药放入混合护色液(含有0.06% L-抗坏血酸、0.02% D-异抗坏血酸钠、0.24% 柠檬酸,均为质量分数)中护色处理15 min,用吸水纸把铁棍山药表面水分吸干。分别称取(60±5)g预处理过的铁棍山药,使用CU-HPD设备进行脱水实验,随后再分析不同干燥条件下铁棍山药样品的品质特性。
1.3.1 干燥脱水实验
将物料放置于CU-HPD设备中进行干燥脱水,分别设置干燥介质温度为45、55、65 ℃,超声功率为0、30、60 W,固定风速为1.5 m/s。CU-HPD设备中的铁棍山药样品每30 min称量1次,直至样品的含水率降至安全水分(干基含水率0.17 g/g干基)时,干燥试验结束。新鲜铁棍山药的初始干基含水率采用105 ℃直接干燥法[10]测得,为(3.37±0.20)g/g。干燥试验过程中物料干基含水率按公式(1)计算:
(1)
式中:Mt,t时刻物料的干基含水率,g/g;mt,t时刻物料的质量,g;md,绝干物质的质量,g。
1.3.2 水分状态
本试验中使用低场核磁共振(low field-nuclear magnetic resonance,LF-NMR)分析仪测定不同温度和功率下铁棍山药样品中的水分状态。将待测样品放入低场核磁共振分析仪中,利用Carr-Purcell-Meiboom-Gill(CPMG)多脉冲回波序列采集待测样品数据。其主要参数:采样点数(TD)为479 992,前置放大倍数(PRG)为1,采样等待时间(TW)为2 000 ms,回波时间(TE)为0.3 ms,回波个数(NECH)为15 000,模拟增益(RG1)为20.0 dB,累加次数(NS)为16。
1.3.3 微观结构
使用扫描电镜(scanning electron microscope,SEM)观察不同温度和功率下铁棍山药的微观结构,其中设置扫描电镜的放大倍数为×150,并调整焦距得到清晰的SEM图片。
1.3.4 硬度
使用物性分析仪测定不同干燥温度和超声功率下铁棍山药片的硬度值。用P/2探针以0.5 mm/s的测试速度刺穿山药样品,设置测试前速度为2 mm/s,测试中速度为0.5 mm/s,测试后速度为5 mm/s,压缩距离为1 mm。每组样品进行3次测量。
1.3.5 复水比(rehydration ratio,RR)
分别称取大约5 g不同干燥条件下得到的山药样品,将其浸泡在(25±1)℃的蒸馏水中2 h,再用吸水纸除去样品表面水分,然后称量铁棍山药样品复水后的质量。所有复水试验重复3次。RR按公式(2)计算:
(2)
式中:mf,复水后样品的质量,g;m0,干燥样品的质量,g。
1.3.6 色差
将不同条件干燥脱水后的铁棍山药样品打粉,再使用色差仪测定铁棍山药样品的色差参数指标。其中L*表示样品的明暗度、a*表示样品的红绿值,b*表示样品的黄蓝值。对不同干燥条件下获得的样品进行3次测量,并记录其平均值。总色差ΔE按公式(3)计算:
(3)
式中:ΔE,总色差;L0*、a0*、b0*分别是新鲜铁棍山药的明暗度、红绿值和黄蓝值;L*、a*、b*分别为干燥后样品的明暗度、红绿值和黄蓝值。
1.3.7 多酚含量
本文采用福林酚法[11]测定不同干燥条件下铁棍山药样品中的多酚含量。先将干制后的铁棍山药样品粉碎,过60目筛备用。然后,精确称取0.50 g样品,按1∶20的料液比(g∶mL)加入70%的乙醇溶液,超声提取30 min,重复3次。随后将提取液过滤并离心(8 000 r/min,离心30 min),所得上清液即为多酚待测液。取1 mL待测液于10 mL容量瓶中,加入1 mL福林酚试剂,暗反应5 min后,再加入3 mL质量分数为10%的Na2CO3溶液,用70%乙醇溶液定容,于室温下暗反应30 min。以70%乙醇溶液为对照,在765 nm处测定待测液的吸光值,每组试验重复3次。在没食子酸的标准曲线上计算待测液中的多酚浓度,进而确定铁棍山药样品中的多酚含量。
1.3.8 多糖含量测定
本文利用硫酸-蒽酮比色法[12]测定不同干燥条件下铁棍山药中多糖的含量。先将干制后的铁棍山药样品粉碎,过60目筛备用。精确称取0.50 g样品于试管中,加入10 mL蒸馏水,将其置于超声提取器中提取30 min,随后将提取液离心,所得的上清液即为多糖待测液。取1 mL多糖待测液于试管,加入5 mL质量分数为0.5%的蒽酮-硫酸溶液,摇匀,90 ℃水浴加热15 min,以蒸馏水为对照,在620 nm处测定待测液的吸光值,每组试验重复3次,并在标准曲线上计算待测液中的多糖含量,从而求得铁棍山药样品中的多糖含量。
1.3.9 抗氧化性能测定
本研究中以DPPH自由基清除率来表征不同干燥条件下铁棍山药样品的抗氧化性能。先配制质量浓度梯度为20、40、60、80、100 μg/mL的溶液,然后准确吸取0.2 mL于试管中,加入5 mL浓度为0.1 mmol/L的DPPH乙醇溶液,于室温中暗反应30 min。以蒸馏水为对照,在517 nm处测定吸光值,并计算不同干燥条件下铁棍山药样品的DPPH自由基清除率,每组试验重复3次。DPPH自由基清除率按公式(4)计算:
(4)
式中:I,自由基清除率,%;A0,DPPH乙醇溶液的吸光度;A1,样品与DPPH乙醇溶液混合后的吸光度;A2,样品的吸光度。
1.3.10 权重分析
本研究采用变异系数法对不同干燥条件下铁棍山药的干燥时间、硬度值、复水比、色差值、多酚含量、多糖含量以及抗氧化活性7个指标进行权重分析。
首先,各指标的变异系数及权重按公式(5)、公式(6)计算:
(5)
式中:Vi,第i个指标的变异系数;σi,第i个指标的标准差;![]() 第i个指标的平均值。
第i个指标的平均值。
(6)
式中:Wi,第i个指标的权重。
之后,对各项指标数据标准化处理按公式(7)计算:
(7)
式中:Zij,标准化处理后各指标的数值;xij,各指标的试验测量值;![]() 第i个指标的平均值;σi,第i个指标的标准差。其中,干燥时间、硬度值和抗氧化活性3个指标的标准化数值越小,对应的铁棍山药品质越好,所以应在其Zij前加负号。
第i个指标的平均值;σi,第i个指标的标准差。其中,干燥时间、硬度值和抗氧化活性3个指标的标准化数值越小,对应的铁棍山药品质越好,所以应在其Zij前加负号。
最后,将各指标的权重和标准化数值相乘,计算总和求得不同干燥条件下铁棍山药样品的综合评分。
1.4 数据处理
采用Origin 2018及Spss 20.0等软件进行试验数据分析及图表绘制。
2 结果与分析
2.1 铁棍山药CU-HPD脱水曲线
不同干燥条件下铁棍山药CU-HPD的干燥脱水曲线如图1所示。
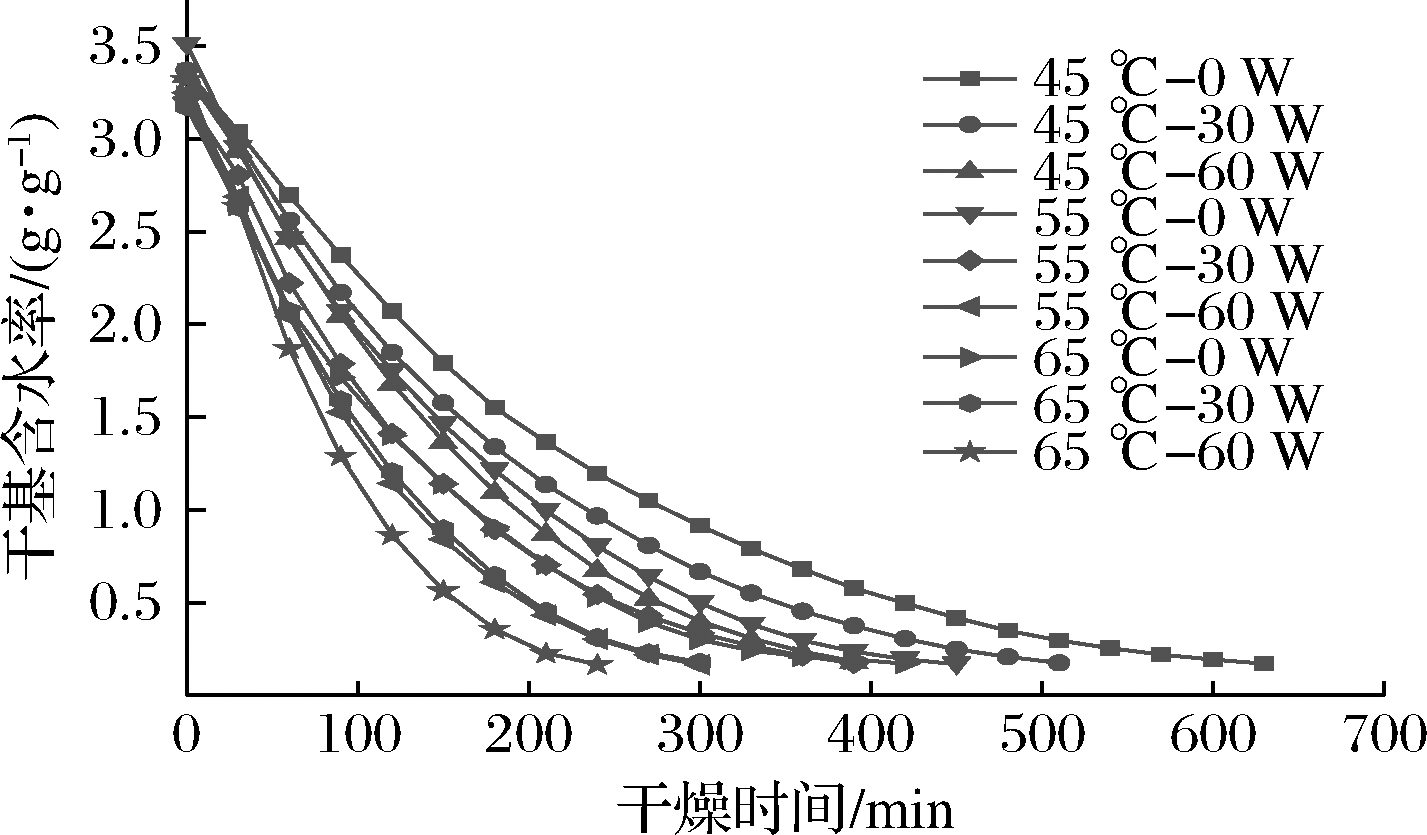
图1 不同干燥条件下铁棍山药的干燥曲线
Fig.1 Drying curves of contact ultrasound enhanced heat pump drying of D. opposite under different drying conditions
在干燥温度45 ℃、超声功率0 W的条件下,样品所需的干燥时间最长,为630 min;当干燥温度65 ℃、超声功率60 W时,样品的干燥时间最短,为240 min。此外,在同一超声功率下,铁棍山药的干燥时间随着干燥温度的升高而缩短;在同一干燥温度下,其干燥时间随着超声功率的升高而缩短。这是因为在干燥过程中,随着干燥温度的升高,物料内外形成外高内低的温度梯度,在此温度梯度作用下,水分子跃迁频率增高,加快物料与外界的传热传质,缩短干燥时间[13]。与此同时,超声能量可以直接由超声设备传入物料并作用于内部水分[14]。在超声的机械效应和空化效应作用下[15],铁棍山药内部结构变得疏松,降低了物料内部对水分的束缚力,从而有效减小内部扩散阻力,提高水分迁移能力,进而缩短干燥时间,且超声的强化效应随着超声功率的升高而更加明显。
2.2 水分状态
根据LF-NMR原理[16],铁棍山药样品的T2弛豫时间曲线可以反映干燥过程中样品内部水分状态的变化。弛豫时间越短,说明水分与样品结合的越紧密,其自由度越低,流动性就越差。反之,弛豫时间越长,则说明其自由度越高,流动性就越好。被不同T2信号覆盖的峰面积可以代表不同状态水分的相对含量[17]。
不同干燥温度和超声功率下铁棍山药的核磁共振弛豫谱如图2所示。新鲜铁棍山药的核磁共振弛豫谱中有3个峰T21、T22和T23,其相对应的峰面积分别为A21、A22、A23,它们分别代表结合水、不易流动水和自由水。其中新鲜的铁棍山药核磁共振信号幅值最大,说明新鲜的铁棍山药水分含量最高,且新鲜铁棍山药的核磁共振信号中A23明显高于A22和A21,说明新鲜铁棍山药的水分主要是自由水,而且远多于不易流动水和结合水的含量。以图2-a~图2-c为例,可以发现在干燥过程中施加超声之后,A23下降速度明显加快,且超声功率越高,A23下降速度越快。在A23减小的过程中,A22先缓慢增大后逐渐下降。A21则几乎不变。这表明在铁棍山药CU-HPD过程中,铁棍山药内部的自由水含量一直在减少,直至完全去除;不易流动水含量先缓慢增大,后逐渐减小,干燥结束时物料中仍存在部分不易流动水;结合水含量则在干燥过程中几乎不变。由图2-b、图2-e、图2-h还可看出,在同一超声功率下,A23随着温度的升高,下降得越来越快。干燥温度升高,使得铁棍山药吸收的热量变多,加快表面水分的蒸发,有利于内部水分向外流出,缩短脱去自由水的时间,加快物料的干燥脱水进程。

a-45 ℃-0 W;b-45 ℃-30 W;c-45 ℃-60 W;d-55 ℃-0 W;e-55 ℃-30 W;f-55 ℃-60 W;g-65 ℃-0 W;h-65 ℃-30 W;i-65 ℃-60 W
图2 不同干燥条件下铁棍山药的T2弛豫曲线
Fig.2 T2 relaxation curves of D. opposite under different drying conditions
2.3 微观结构
不同干燥温度和超声功率下铁棍山药样品的SEM结果如图3所示。不同干燥温度和超声功率是影响样品微观结构的重要因素。在同一干燥温度下,超声功率为0 W时,铁棍山药样品的干燥时间较长,其切面皱缩较为严重,组织结构致密,且微孔道的数目不多。这种结构会使铁棍山药的传质阻力变大,从而不利于物料内部的水分迁移;随着超声功率的升高,铁棍山药样品切面的部分组织结构变得疏松,微观孔道数量增多,且超声功率越大,铁棍山药样品切面的组织结构越疏松,微观孔道数量越多。这与万芳新等[18]在胡萝卜超声强化远红外辐射干燥的研究结果类似。超声波能量在样品中传递时,超声的机械效应和空化效应使铁棍山药样品的微观结构变得疏松,这说明超声波能够强化干燥过程中铁棍山药的内部传质,促进物料内部水分扩散,且随着超声功率的提高,这种强化效应越明显,越有利于物料内部的水分扩散,进而缩短物料受热时间和脱水过程。

a-45 ℃-0 W;b-45 ℃-30 W;c-45 ℃-60 W;d-55 ℃-0 W;e-55 ℃-30 W;f-55 ℃-60 W;g-65 ℃-0 W;h-65 ℃-30 W;i-65 ℃-60 W
图3 不同干燥条件下铁棍山药的扫描电镜图
Fig.3 SEM pictures of D. opposite under different drying conditions
2.4 硬度
不同干燥条件下铁棍山药样品的硬度值如图4所示,在同一干燥温度下,其硬度值随着超声功率的升高而降低。以干燥温度55 ℃为例,当超声功率从0 W升高到60 W时,样品的硬度值从1 695.56 g降低到829.25 g。在同一超声功率下,铁棍山药样品的硬度值随着温度的升高而降低,以超声功率30 W为例,当干燥温度从45 ℃升高到65 ℃,样品的硬度值从1 392.19 g降低至1 031.89 g。在干燥温度45 ℃、超声功率0 W的条件下,样品的硬度值最大,为1 834.94 g;在干燥温度65 ℃、超声功率60 W的条件下,样品的硬度值最小,为628.39 g。在干燥温度较低的条件下,干燥时间较长,不利于铁棍山药样品中水分的去除,导致样品表面硬化、结块,从而导致样品硬度值较高[19]。根据不同干燥条件下铁棍山药样品的微观结构,并结合图3可知,在较高的超声功率水平下,样品内部组织结构较为疏松,进而降低其硬度值。因此,铁棍山药样品的硬度值与其微观结构具有很强的相关性。
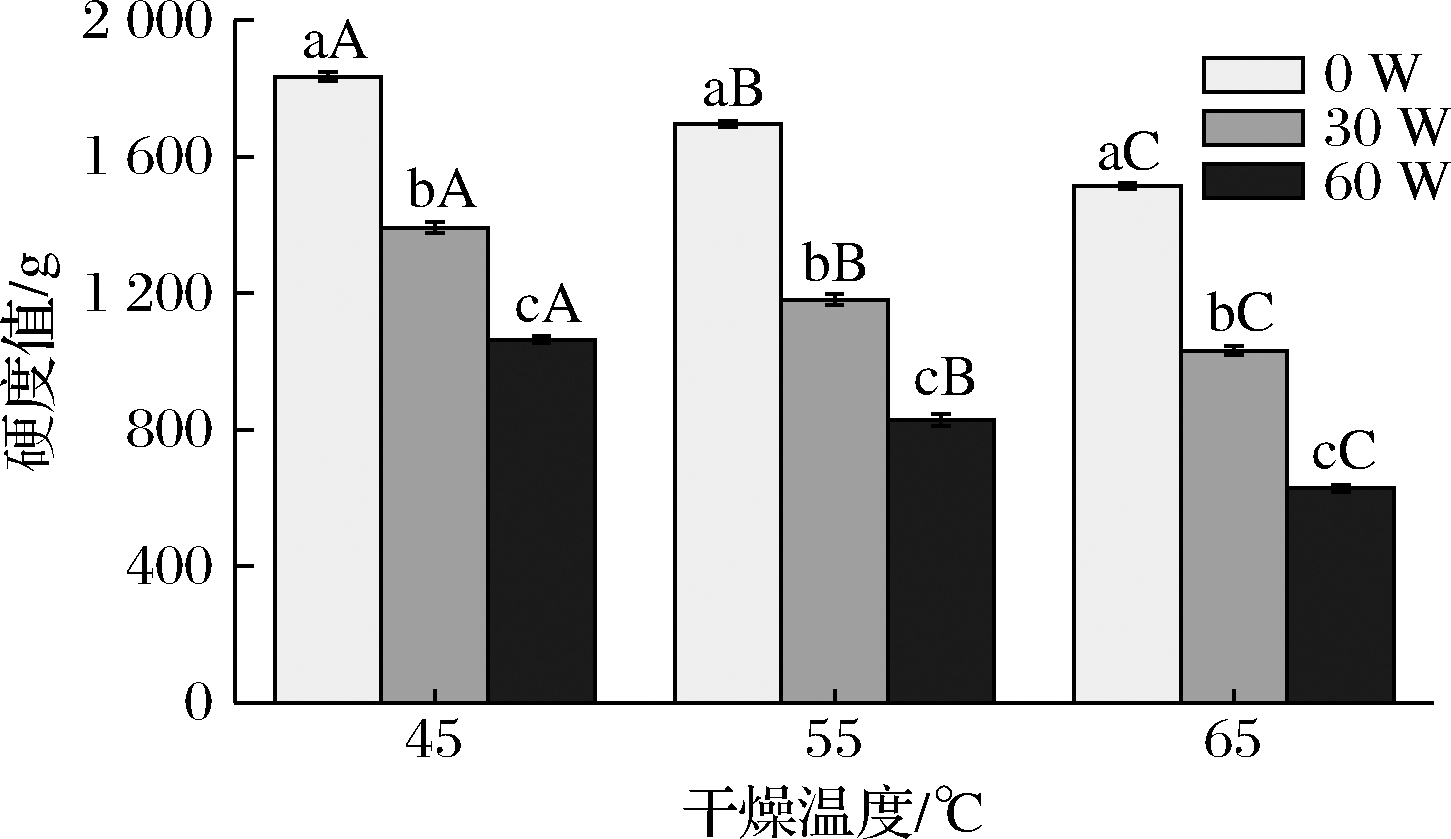
图4 不同干燥条件下铁棍山药的硬度值
Fig.4 Hardness value of D. opposite under different drying conditions
注:不同字母代表差异显著,小写字母表示超声功率,大写字母表示干燥温度(P<0.05)(下同)
2.5 复水比
复水比是评价干制品品质的一个重要指标[20]。复水能力也在一定程度上反映了产品内部组织结构状态。表1是不同干燥温度和超声功率下铁棍山药干制品的复水比,方差分析结果表明,在不同干燥条件下所得的铁棍山药干制品复水率有显著性差异(P<0.05)。在同一干燥温度下,复水比随着超声功率的升高而变大;在同一超声功率水平下,复水比随着干燥温度的升高而变大。以干燥温度55 ℃为例,当超声功率为0、30、60 W时,干制品复水比分别为1.92、2.01、2.17 g/g;以超声功率60 W为例,当干燥温度为45、55、65 ℃时,干制品复水比分别为2.06、2.17、2.31 g/g。
其中在干燥温度为45 ℃、超声功率为0 W的条件下所得铁棍山药干制品的复水率最小,为1.78 g/g,这可能与其干燥时间较长,干燥脱水过程中物料表面皱缩、结构硬化,不能较多的吸收水分,导致其复水能力差;在干燥温度为65 ℃、超声功率为60 W的条件下,铁棍山药干制品的复水率最大,为2.31 g/g。这是由于其在干燥过程中受超声波的作用,内部形成疏松多孔的海绵状结构,可以更好地吸收水分,从而有较大的复水比。结合前述结果可知,铁棍山药的复水比与其微观结构、硬度值具有很大的关联性。
表1 不同干燥条件下铁棍山药的复水比
Table 1 Rehydration ratio of D. opposite under different drying conditions

干燥温度/℃超声功率/W复水比/(g·g-1)4501.78±0.02cC301.90±0.01bC602.06±0.03aC5501.92±0.01cB302.01±0.05bB602.17±0.01aB6501.99±0.03cA302.10±0.06bA602.31±0.01aA
注:不同字母代表差异显著,小写字母表示超声功率,大写字母表示干燥温度(P<0.05)(下同)
2.6 色差
色差也是评价干制品品质的一个重要指标,表2为不同干燥温度和超声功率下铁棍山药干制品的色差参数值。干制后的铁棍山药色泽参数值与新鲜铁棍山药相比,其L*值显著升高,a*值有小幅升高,b*值有明显升高。在同一干燥温度下,铁棍山药干制品的ΔE值随着超声功率的升高而减小。以干燥温度45 ℃为例,当超声功率从0 W升高至60 W,ΔE值从57.01减小至51.95。在同一超声功率水平下,ΔE值随着干燥温度的升高呈现出先减小后增大的趋势。以超声功率30 W为例,在45、55、65 ℃的干燥温度下,ΔE值分别为54.50、51.04和56.25。干燥温度和超声功率对铁棍山药的ΔE值有显著的影响。干燥温度45 ℃时,样品干燥脱水需要较长的干燥加工时间,这就导致样品在干燥过程中发生褐变、氧化,在一定程度上影响样品的色泽;干燥温度65 ℃时,物料中的部分酚类物质氧化产生有色物质,从而影响产品色泽[21]。因此,干燥温度较低或者较高都对色泽有一定影响。超声除了可以缩短干燥时间,减少样品与热空气的接触时间之外,还具有一定的抑酶能力,能够减少褐变的发生,使样品具有较小的ΔE值,有利于保证产品具有良好的色泽。
表2 不同干燥条件下铁棍山药的色差值
Table 2 Color parameters of D. opposite under different drying conditions
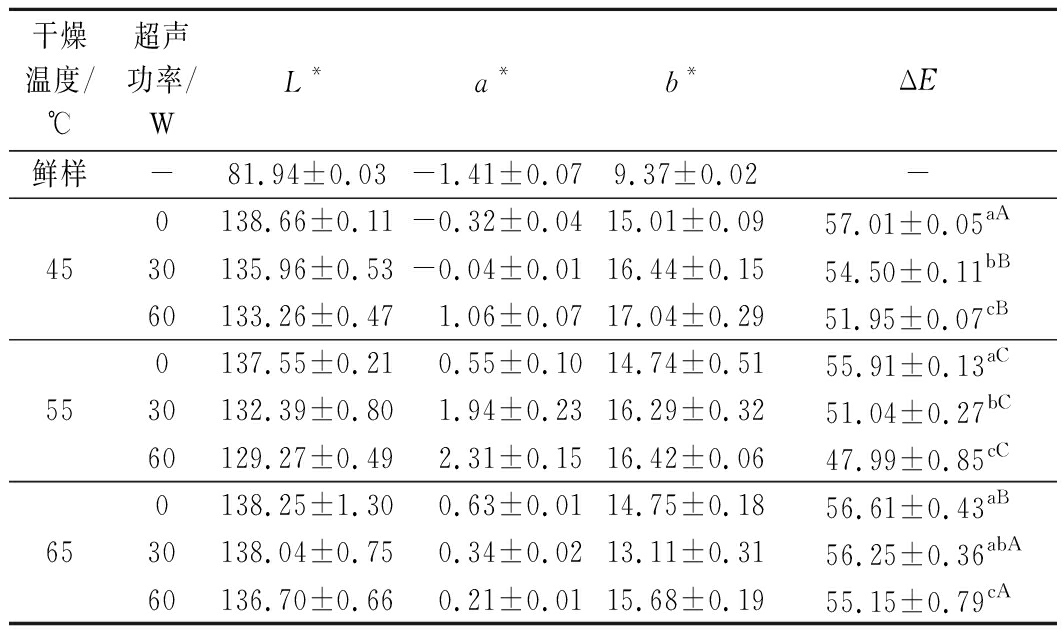
干燥温度/℃超声功率/WL*a*b*ΔE鲜样-81.94±0.03-1.41±0.079.37±0.02-450138.66±0.11-0.32±0.0415.01±0.0957.01±0.05aA30135.96±0.53-0.04±0.0116.44±0.1554.50±0.11bB60133.26±0.471.06±0.0717.04±0.2951.95±0.07cB550137.55±0.21 0.55±0.1014.74±0.5155.91±0.13aC30132.39±0.801.94±0.2316.29±0.3251.04±0.27bC60129.27±0.492.31±0.1516.42±0.0647.99±0.85cC650138.25±1.30 0.63±0.0114.75±0.1856.61±0.43aB30138.04±0.750.34±0.0213.11±0.3156.25±0.36abA60136.70±0.660.21±0.0115.68±0.1955.15±0.79cA
2.7 多酚含量
不同干燥温度和超声功率下铁棍山药干制品中多酚含量如图5所示。在同一干燥温度下,多酚含量随着超声功率的升高而增高;在同一超声功率水平下,多酚含量随着干燥温度的升高,呈现出先增高、后降低的趋势。其中干燥温度55 ℃、超声功率60 W条件下的多酚含量最高,为36.17 μg/g;干燥温度65 ℃、超声功率0 W条件下的多酚含量最低,为9.47 μg/g。
由于酚类化合物不稳定,在干燥过程中很容易被氧化[22],干燥温度45 ℃时,铁棍山药样品在干燥过程中长时间与O2接触,导致酚类化合物氧化严重,多酚含量明显降低;在干燥温度为65 ℃的条件下,干燥温度过高不利于铁棍山药所含多酚类物质的保留。经CU-HPD处理的铁棍山药干燥时间缩短,酚类化合物氧化程度有所缓解,表现为CU-HPD所得样品中多酚含量要高于单纯的HPD,说明在HPD中施加超声强化,可以更好地减弱氧化,有利于铁棍山药中的酚类物质的保留,获得更高品质的产品。
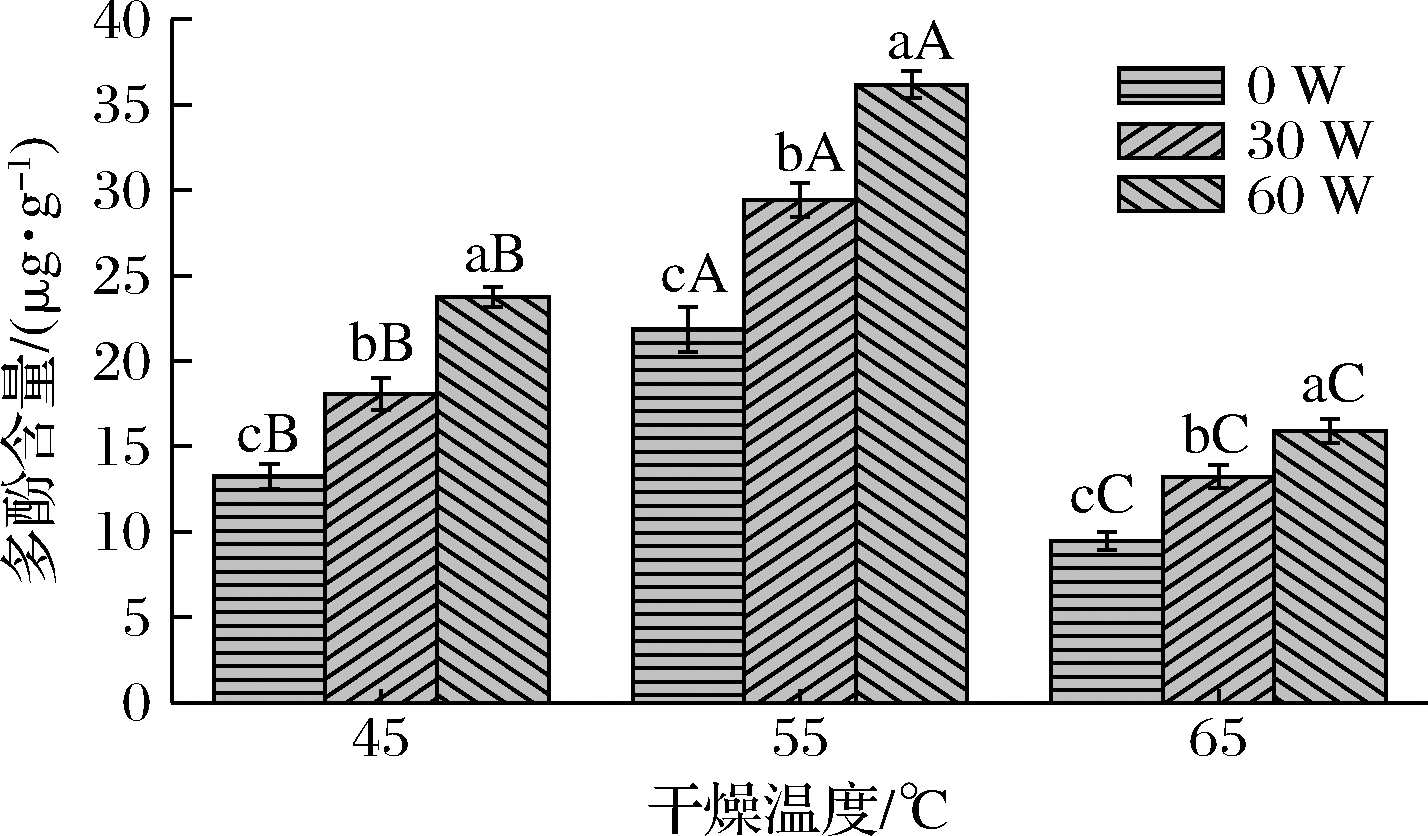
图5 不同干燥条件下铁棍山药的多酚含量
Fig.5 Polyphenol content of D. opposite under different drying conditions
2.8 多糖含量
多糖是铁棍山药的有效成分之一[23],具有调节血糖、提高机体免疫能力的作用,因此不同干燥条件下所得铁棍山药的多糖含量在一定程度上,反映铁棍山药品质的优劣。图6为不同干燥条件下铁棍山药的多糖含量,铁棍山药样品中的多糖含量与干燥温度和超声功率密切相关。在同一干燥温度下,多糖含量随着超声功率的升高而增高;在同一超声功率水平下,多糖含量随着干燥温度的升高,呈现出先增高、再降低的趋势。其中在干燥温度65 ℃、超声功率0 W条件下所得铁棍山药干制品的多糖含量最低,为56.36 μg/g;在干燥温度55 ℃、超声功率60 W条件下得到的铁棍山药干制品中多糖含量最高,为137.47 μg/g。热处理对多糖结构的影响较大,易使多糖氧化降解[24],所以在干燥温度为65 ℃的条件下,样品中多糖含量较低;施加超声能够缩短铁棍山药的干燥时间,从而减少多糖的氧化降解及受热分解。
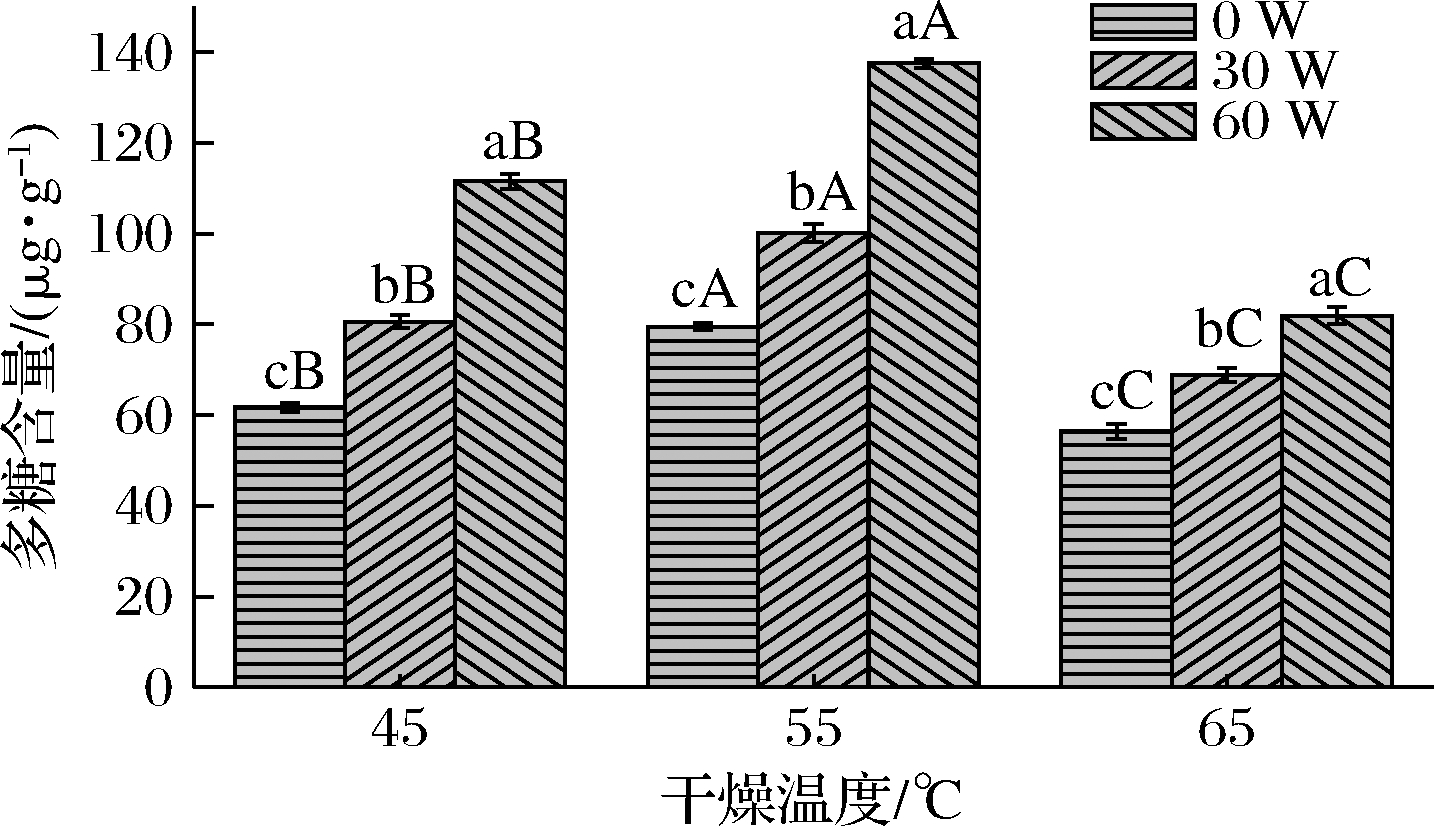
图6 不同干燥条件下铁棍山药的多糖含量
Fig.6 Polysaccharide content D. opposite under different drying conditions
2.9 抗氧化性能
本研究中采用IC50值来表征不同干燥条件下铁棍山药样品抗氧化活性的强弱。IC50是DPPH自由基清除率为50%时对应的铁棍山药样品浓度,其数值越小,表明DPPH自由基清除率越大,该干燥条件下所得铁棍山药干制品的抗氧化性能越强[25]。图7为不同干燥温度和超声功率下铁棍山药的IC50值,在干燥温度不变的条件下,铁棍山药干制品的IC50值随着超声功率的提高而降低,这说明在HPD过程中施加超声可对保护产品抗氧化性能产生积极作用。在同一超声功率水平,铁棍山药干制品的IC50值随着干燥温度的升高,呈先降低再升高的趋势。其中干燥温度65 ℃、超声功率0 W的条件下,所得铁棍山药干制品的IC50值最大;干燥温度为55 ℃、超声功率为60 W的条件下,所得铁棍山药干制品的IC50值最小,这说明干燥温度过高、干燥处理时间过长都不利于样品中抗氧化物质的保存。
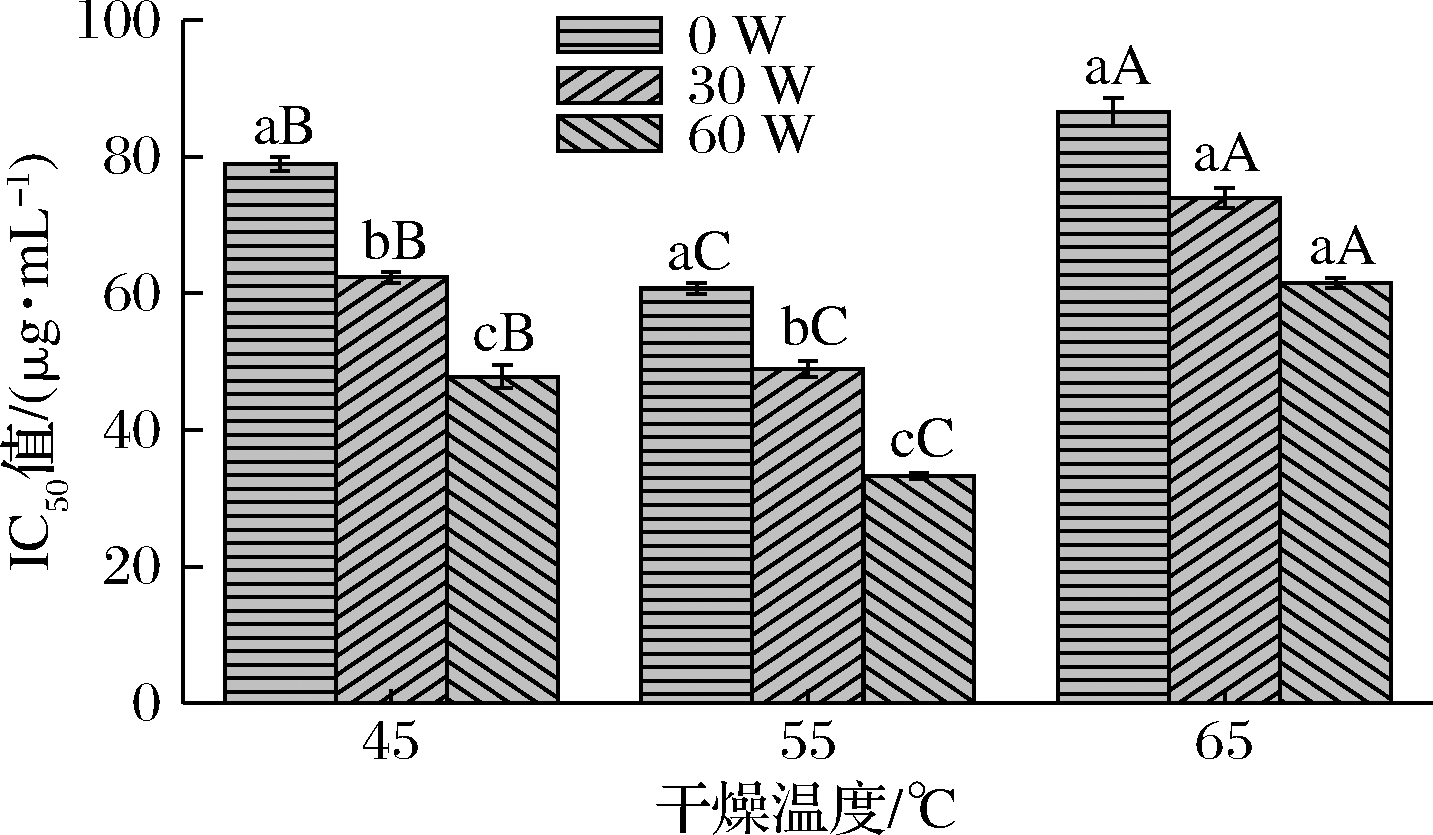
图7 不同干燥条件下铁棍山药的IC50值
Fig.7 IC50 value of D. opposite under different drying conditions
2.10 不同干燥条件下铁棍山药干制品的综合评分
不同干燥条件下铁棍山药的脱水时间、硬度值、复水比、ΔE、多酚含量、多糖含量以及IC50这7个指标的变异系数及权重如表3所示。脱水时间、硬度值、多酚含量、多糖含量和IC50值对铁棍山药样品品质的权重影响比较大,分别占0.17、0.19、0.24、0.18和0.15;复水比和ΔE的权重较小,只占0.04和0.03。
表3 不同干燥条件下铁棍山药各品质指标的权重
Table 3 Weight of each index of D. opposite under different drying conditions
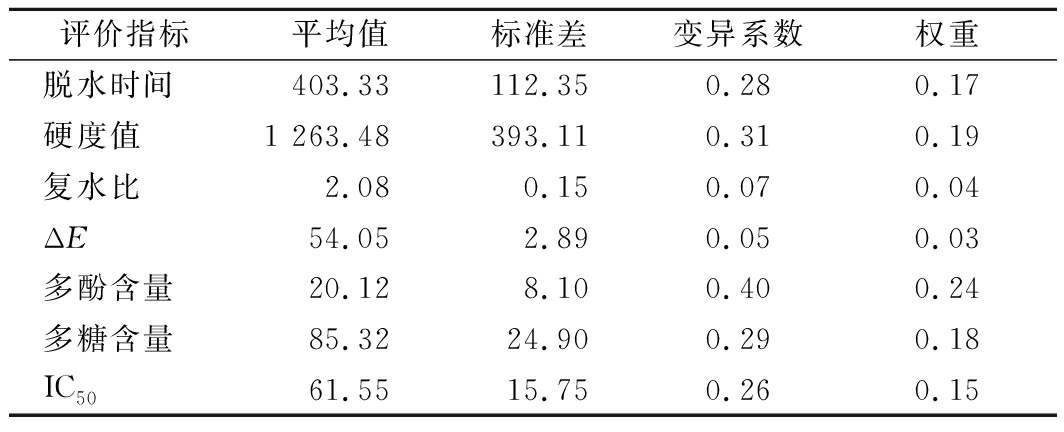
评价指标平均值标准差变异系数权重脱水时间403.33112.350.280.17硬度值1 263.48393.110.310.19复水比2.080.150.070.04ΔE54.052.890.050.03多酚含量20.128.100.400.24多糖含量85.3224.900.290.18IC5061.5515.750.260.15
不同干燥条件下铁棍山药各指标的标准化数值和综合评分如表4所示。

续表4
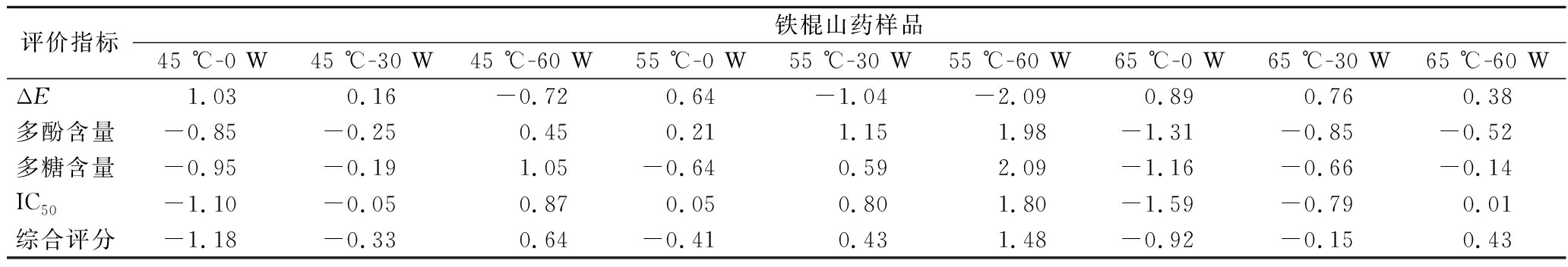
评价指标铁棍山药样品45 ℃-0 W45 ℃-30 W45 ℃-60 W55 ℃-0 W55 ℃-30 W55 ℃-60 W65 ℃-0 W65 ℃-30 W65 ℃-60 WΔE1.030.16-0.720.64-1.04-2.090.890.760.38多酚含量-0.85-0.250.450.211.151.98-1.31-0.85-0.52多糖含量-0.95-0.191.05-0.640.592.09-1.16-0.66-0.14IC50-1.10-0.050.870.050.801.80-1.59-0.790.01综合评分-1.18-0.330.64-0.410.431.48-0.92-0.150.43
从表4可知,不同干燥条件下铁棍山药干制品的综合评分有较大差异,其中在干燥温度55 ℃、超声功率60 W条件下铁棍山药的综合评分最高,为1.48,且远高于其他干燥条件下样品的综合评分。因此,铁棍山药CU-HPD的最优干燥条件为干燥温度55 ℃、超声功率60 W。
3 结论
在铁棍山药CU-HPD中,HPD温度和超声功率对干燥脱水时间、样品内部的水分状态和微观结构有较大的影响。随着干燥温度和超声功率的提高,干燥脱水时间缩短了30~390 min,样品内部的自由水被加速去除,且样品的组织结构变得疏松多孔。
结果表明,干燥温度和超声功率对铁棍山药的硬度值、复水比、ΔE值、多酚含量、多糖含量和IC50值有显著影响(P<0.05)。在干燥温度65 ℃、超声功率60 W的条件下,硬度值最小,复水比最大,分别为628.39 g,2.31 g/g。在干燥温度55 ℃、超声功率60 W的条件下,多酚含量和多糖含量最大,ΔE值和IC50值最小,分别为36.17 μg/g和137.47 μg/g、47.99和33.27 μg/mL。在HPD过程中施加超声强化有利于保护产品品质。
通过变异系数法的权重分析可知,干燥脱水时间、硬度值、多酚含量、多糖含量和IC50值5个指标所占的权重较大,其中在干燥温度55 ℃、超声功率60 W的条件下所得铁棍山药样品的综合评分最高,故为铁棍山药CU-HPD的最优干燥参数。
[1] 李红涛, 袁书林.山药产品的功能价值及开发利用探讨[J].中国食物与营养, 2009, 15(10):15-18.
LI H T, YUAN S L.Function value of yam foods and its exploitation[J].Food and Nutrition in China, 2009, 15(10):15-18.
[2] 王邈, 李德远, 李玮, 等.山药的药理作用分析及其开发利用[J].中国食物与营养, 2010, 16(4):72-75.
WANG M, LI D Y, LI W, et al.Function of Chinese yam and its utilization[J].Food and Nutrition in China, 2010, 16(4):72-75.
[3] ZHANG Z D, GAO W Y, WANG R F, et al.Changes in main nutrients and medicinal composition of Chinese yam (Dioscorea opposita) tubers during storage[J].Journal of Food Science and Technology, 2014, 51(10):2 535-2 543.
[4] SALEHI F.Recent applications of heat pump dryer for drying of fruit crops:A review[J].International Journal of Fruit Science, 2021, 21(1):546-555.
[5] LIU Y H, ZENG Y, GUO L G, et al.Drying process and quality characteristics of contact ultrasound reinforced heat pump drying on kiwifruit slices[J].Journal of Food Processing and Preservation, 2019, 43(10):e14162.
[6] LORANGER E, CANTAGREL M, LEDUC C, et al.Ultrasound-assisted hydrogen peroxide bleaching of a softwood thermomechanical pulp[J].Journal of Science and Technology for Forest Products and Processes, 2012, 2(2):6-12.
[7] 刘云宏, 孙畅莹, 曾雅.直触式超声功率对梨片超声强化热风干燥水分迁移的影响[J].农业工程学报, 2018, 34(19):284-292.
LIU Y H, SUN C Y, ZENG Y.Effect of contact ultrasound power on internal moisture migration of pear slices during ultrasound enhanced hot air drying[J].Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(19):284-292.
[8] 郑峰, 王忠明, 王迪, 等.基于变异系数权重法评价干燥无花果多糖品质[J].保鲜与加工, 2019, 19(4):119-124.
ZHENG F, WANG Z M, WANG D, et al.Quality evaluation of drying Ficus carica polysaccharides based on variation coefficient weight method[J].Storage and Process, 2019, 19(4):119-124.
[9] 白洁, 蒋华彬, 张小飞, 等.基于变异系数法对气流膨化处理马铃薯方便粥品质的评价[J].食品科学, 2021, 42(15):81-88.
BAI J, JIANG H B, ZHANG X F, et al.Quality evaluation of instant potato congee treated by air puffing based on variation coefficients[J].Food Science, 2021, 42(15):81-88.
[10] LIU Y H, ZENG Y, HU X Y, et al.Effect of ultrasonic power on water removal kinetics and moisture migration of kiwifruit slices during contact ultrasound intensified heat pump drying[J].Food and Bioprocess Technology, 2020, 13(3):430-441.
[11] 张砚垒, 高琳, 付亚玲, 等.圆铃1号枣多酚的提取及抗氧化活性分析[J].食品研究与开发, 2021, 42(8):49-55.
ZHANG Y L, GAO L, FU Y L, et al.Extraction and antioxidant activities of polyphenols from Zizyphus jujuba cv.Yuanling 1[J].Food Research and Development, 2021, 42(8):49-55.
[12] 魏苑, 张盛贵.蒽酮-硫酸法测定枸杞多糖含量的研究[J].食品工业科技, 2011, 32(3):399-401.
WEI Y, ZHANG S G.Determination of content of Lycium barbarum polysaccharide by anthrone-sulfuric acid method[J].Science and Technology of Food Industry, 2011, 32(3):399-401.
[13] 朱文学, 杨帆, 刘玉兰.油莎豆热风干燥特性及数学模型的研究[J].中国粮油学报, 2021, 36(3):91-97.
ZHU W X, YANG F, LIU Y L.Characteristics and mathematical model of Cyperus esculentus drying by hot air[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(3):91-97.
[14] LIU Y H, MIAO S, WU J Y, et al.Drying and quality characteristics of Flos lonicerae in modified atmosphere with heat pump system[J].Journal of Food Process Engineering, 2014, 37(1):37-45.
[15] 郝启栋, 乔旭光, 郑振佳, 等.超高压和超声波预处理对蒜片热风干燥过程及品质的影响[J].农业工程学报, 2021, 37(3):278-286.
HAO Q D, QIAO X G, ZHENG Z J, et al.Effects of ultrahigh pressure and ultrasound pretreatments on hot-air drying process and quality of garlic slices[J].Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(3):278-286.
[16] LI W M, WANG P, XU X L, et al.Use of low-field nuclear magnetic resonance to characterize water properties in frozen chicken breasts thawed under high pressure[J].European Food Research and Technology, 2014, 239(2):183-188.
[17] 李定金, 段振华, 刘艳, 等.利用低场核磁共振技术研究调味山药片真空微波干燥过程中水分的变化规律[J].食品科学, 2019, 40(5):116-123.
LI D J, DUAN Z H, LIU Y, et al.Variation in water content during vacuum microwave drying of flavored yam chips process analyzed by low-field nuclear magnetic resonance imaging[J].Food Science, 2019, 40(5):116-123.
[18] 万芳新, 李武强, 杜小龙, 等.胡萝卜切片的超声强化远红外干燥特性及动力学模拟[J].中国农业大学学报, 2019, 24(8):147-156.
WAN F X, LI W Q, DU X L, et al.Ultrasound-enhanced far-infrared drying characteristics and dynamics simulation of carrot slices[J].Journal of China Agricultural University, 2019, 24(8):147-156.
[19] 刘春菊, 王海鸥, 牛丽影, 等.蔗糖调控对气流膨化黄桃片微观结构及品质的影响[J].食品科学, 2020, 41(11):113-120.
LIU C J, WANG H O, NIU L Y, et al.Effect of sucrose control on microstructure and quality of explosion-puffed yellow peach chips[J].Food Science, 2020, 41(11):113-120.
[20] 赵圆圆, 易建勇, 毕金峰, 等.干燥方式对复水香菇感官、质构及营养品质的影响[J].食品科学, 2019, 40(3):101-108.
ZHAO Y Y, YI J Y, BI J F, et al.Sensory, texture and nutritional quality of dried shiitake mushrooms(Lentinus edodes) as affected by different drying methods[J].Food Science, 2019, 40(3):101-108.
[21] 任亚敏, 张明玉.玛咖真空远红外干燥特性及品质特征研究[J].食品科技, 2019, 44(1):133-138.
REN Y M, ZHANG M Y.Drying and quality characteristics of the vacuum far-infrared drying of maca(Lepidium meyenii)[J].Food Science and Technology, 2019, 44(1):133-138.
[22] TUYEN K C, CONG N T, THINH P V, et al.Effects of various drying methods on physicochemical characteristics, flavonoids and polyphenol content, and antioxidant activities of different extracts from Morinda citrifolia fruit[J].Journal of Pharmaceutical Research International, 2020:72-82.
[23] 郭林宇, 汤晓艳.国内山药营养品质、影响因素及评价方法研究进展[J].中国食物与营养, 2021, 27(12):53-60.
GUO L Y, TANG X Y.Research progress on nutritional quality, influencing factors and evaluation methods of Chinese yam[J].Food and Nutrition in China, 2021, 27(12):53-60.
[24] 陈欢, 姜媛媛, 徐峰, 等.不同干燥方式对川芎多糖理化性质及抗氧化活性的影响[J].中成药, 2021, 43(1):173-177.
CHEN H, JIANG Y Y, XU F, et al.Effects of different drying methods on the polysaccharide properties and antioxidant activity of Sichuan[J].Chinese Traditional Patent Medicine, 2021, 43(1):173-177.
[25] 石晓微, 刘云宏.超声—远红外辐射干燥对香蕉片品质的影响[J].食品与机械, 2021, 37(1):204-209.
SHI X W, LIU Y H.Effects of ultrasound combined far-infrared radiation drying on the quality of banana slices[J].Food & Machinery, 2021, 37(1):204-209.