松脂酸铜(copper abietate)是以松香为原料,添加无机铜、有机酸及催化剂等多种试剂制备的一种具广谱杀菌性的含铜类农药,作为新型铜制剂杀菌剂,具有高效低毒、兼顾预防保护和治疗等特性,可用于防治槟榔叶斑病[1]、杧果蒂腐病菌[2]、柑橘溃疡病[3]、瓜类霜霉病、细菌性角斑病、火龙果炭疽病、溃疡病等多种细菌和真菌引起的蔬菜病害,同时对蔬菜也有明显的刺激生长的作用,近年来在我国主要的蔬菜水果产区被广泛应用[4]。
松脂酸铜作为含铜类化合物,长期过量摄入可引发系列疾病,食用蔬菜水果中含铜农药超标而中毒的事件也有发生[5],因此,迫切需要开展松脂酸铜的残留以及相关检测方法的研究。目前关于松脂酸铜测定的方法主要有液相色谱法,其中杨德毅等[6]使用高效液相色谱法测定了柑橘中松脂酸铜残留量,并开展了不确定度分析,但是其对于松脂酸铜盐酸衍生物的转化过程未进行分析。此外,有文献报道使用高效液相色谱法[7-8]测定松脂酸铜农药[9],使用高效液相色谱-质谱联用对食品[10]和跌打片[11]中松香酸进行测定,但目前有关于松脂酸铜在作物中残留检测的相关研究仍未见报道。
本研究以果蔬中火龙果、豇豆和杧果为主要研究对象,建立高效液相色谱法检测果蔬中松脂酸铜农药残留的方法,为在果蔬中准确快速的农药残留检测提供参考。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
松脂酸铜标准品(纯度95.0%),山东禾宜生物科技有限公司;石油醚、甲醇、乙腈(色谱纯),美国Thermo Scientific公司;36.0%~38.0%盐酸(优级纯),广州化学试剂厂;丙酮(优级纯),美国Thermo Scientific公司;冰醋酸(纯度99.5%)为分析纯,西陇科学股份有限公司。本实验中所用试剂未经说明者均为分析纯,所用水均为超纯水。
1.1.2 仪器与设备
Waters e2695高效液相色谱仪-紫外检测器,美国Waters 公司;Q-Exactive QE四极杆静电轨道阱高分辨质谱仪,美国Thermo Scientific 公司;电子天平,瑞士Mettler Toledo 公司;水浴恒温振荡器,上海江星仪器有限公司;超声清洗仪,昆山舒美超声仪器有限公司;低速离心机,上海安亭科学仪器厂;旋转蒸发仪,德国海道夫公司;超纯水仪,美国Milli-pore公司;涡旋振荡器,美国Thermo公司;移液器,德国艾本德公司。
1.2 实验方法
1.2.1 实验样品
田间采摘火龙果、豇豆和杧果样品,根据GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》标准要求,分别取火龙果全果(去除叶冠部分)、豇豆全豆(带荚)和杧果全果(去核)样品,经匀浆机制备后,按照四分法进行缩分,在-20 ℃保存,供实验使用。
火龙果、豇豆和杧果样品,均购自海口本地市场或采自中国农业科学院分析测试中心试验基地。
1.2.2 标准溶液配制
用天平精确称量松脂酸铜标准品10 mg至10 mL容量瓶中,选择有机溶剂甲醇定容,得到质量浓度为1 000 μg/mL松脂酸铜单标储备液,避光冷藏保存,有效期为6个月;取适量储备液,利用逐级稀释法,将经过前处理得到的空白基质提取液进行逐级稀释,得到松脂酸铜质量浓度为0.1、0.2、0.5、1、2 μg/mL的基质标准溶液。
1.2.3 样品前处理
用天平分别称取火龙果、豇豆和杧果样品置于50 mL离心管中,样品质量为(2.0±0.01) g,分别加入10 mL 4 mol/L HCl溶液和20 mL石油醚进行提取,振荡均匀后超声反应提取10 min,4 000 r/min的条件下离心5 min,吸取全部上清液于50 mL圆底烧瓶中,45 ℃旋转蒸干,蒸干后取2 mL乙腈定容,用0.22 μm针式滤膜过滤,待测备用。
1.2.4 色谱检测条件
设置紫外检测器波长为241 nm。选择SunFire C18 (4.6 mm×150 mm,5 μm,美国Waters公司),柱温35 ℃,进样量10 μL,流速1 mL/min,设置流动相A为体积分数0.1%冰醋酸,流动相B为乙腈,V(冰醋酸)∶V(乙腈)=20∶80,等度洗脱。
1.2.5 松脂酸铜残留量的计算
根据公式(1)计算松脂酸铜的残留量,以每克农药所残留的质量表示残留量,单位为μg/g。
(1)
式中:xi,样品中待测组分残留量,μg/g;ρi,待测组分工作液质量浓度,μg/mL;V0,样品溶液最终定容体积,mL;m,样品质量,g。
2 结果与分析
2.1 测定对象的确认
液相色谱法测定松脂酸铜需要加入盐酸,将松脂酸铜衍生转化为松脂酸(abietic acid)。因此本研究首先对松脂酸铜衍生转化为松脂酸的过程进行确证,使用Q Exactive-Orbitrap高分辨质谱对加入盐酸前后的松脂酸铜标准溶液进行分析[12-14]。首先,查询松脂酸和松脂酸铜在高分辨质谱的准确分子碎片为303.231 8和666.370 4。实验结果发现,加入盐酸前,松脂酸铜和松脂酸在高分辨质谱中均不能检测到;加入盐酸后,能够测得溶液中存在松脂酸,其离子碎片为303.231 8(图1-a),但是松脂酸铜仍未能检测到(图1-b)。因此,松脂酸铜在加入盐酸后,衍生转换成为松脂酸,图2列出了其可能的转化途径,确定松脂酸铜实际测定对象为松脂酸。
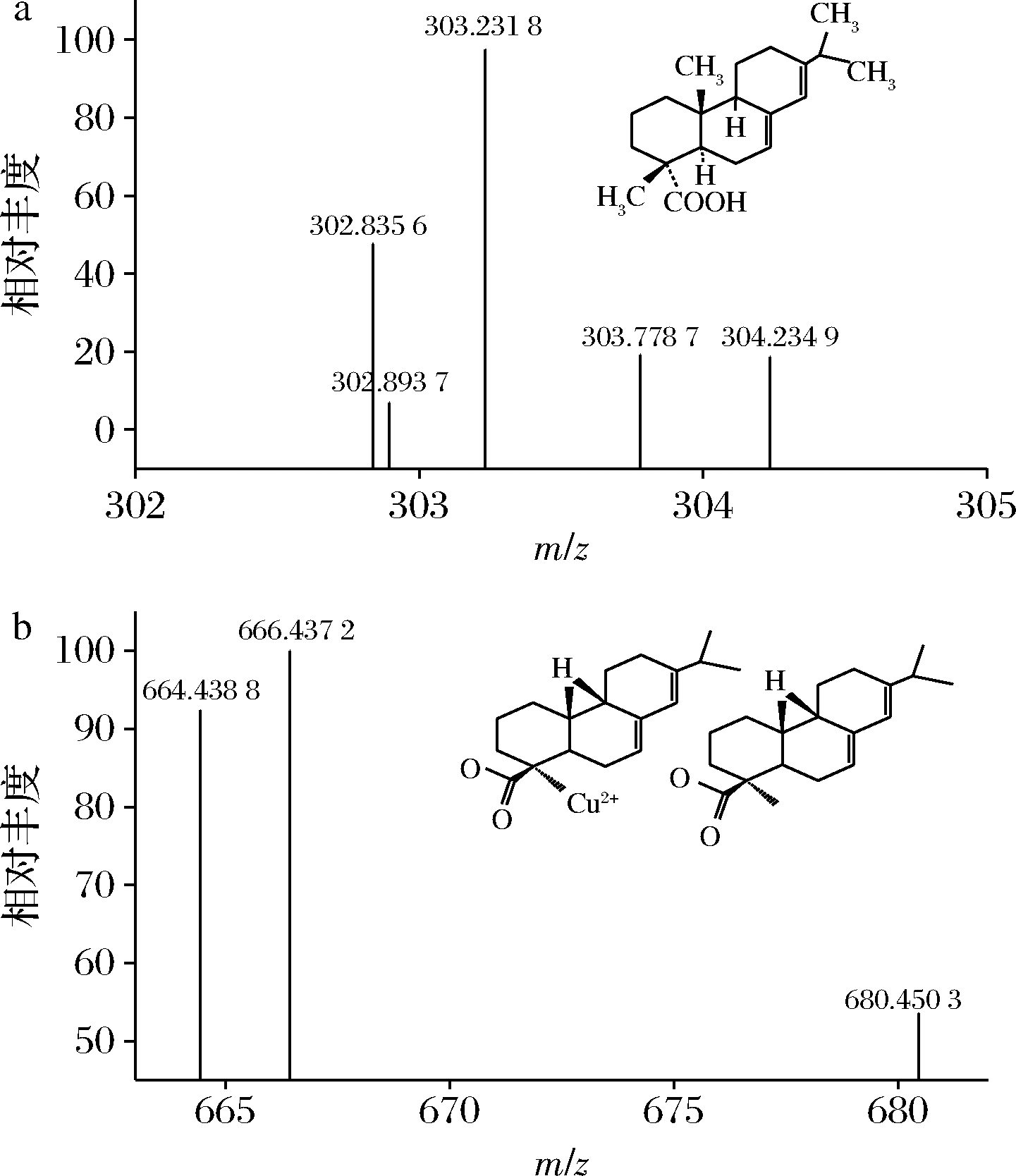
a-松脂酸;b-松脂酸铜
图1 松脂酸铜溶液的离子碎片
Fig.1 Fragment ion of copper abietate of turpentine
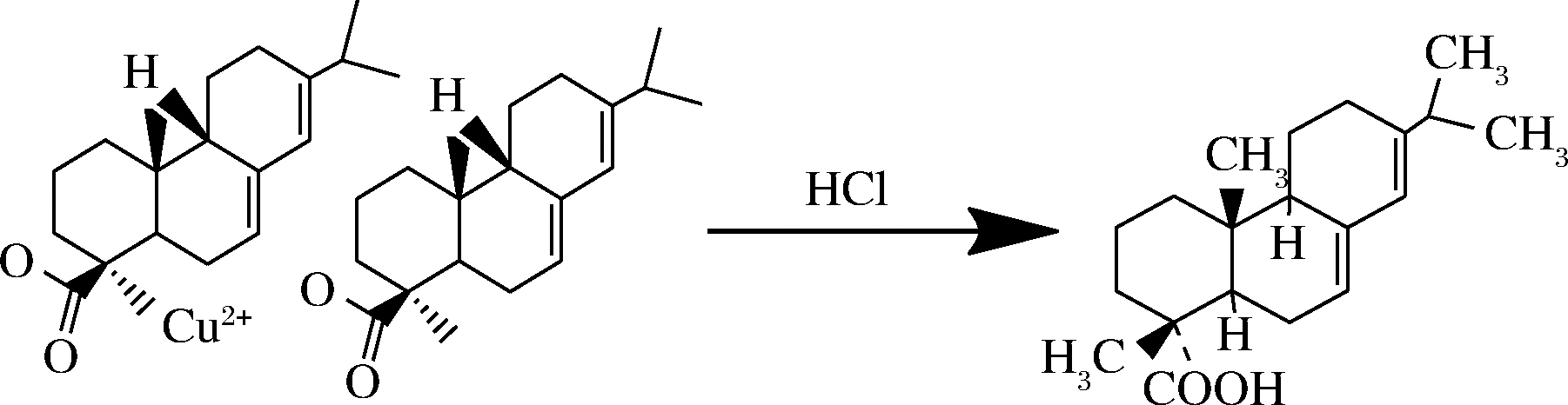
图2 松脂酸与松脂酸铜间的转化
Fig.2 Conversion between abietic acid and copper abietate
2.2 条件优化
2.2.1 提取溶剂的选择
本研究选用甲醇、乙腈、丙酮3种常规萃取试剂对松脂酸铜进行直接提取,并设计对比实验,对比这3种不同的提取剂对松脂酸铜的提取效果,得出回收率均未达到70%,未达到要求。故在火龙果、豇豆和杧果样品中加入4 mol/L盐酸和石油醚作为提取剂,旋转蒸发后再用乙腈定容,如图3所示,对比前3种提取方法,该方法得到回收率最高。因此,采取添加4 mol/L盐酸和石油醚对上述3种基质中的松脂酸铜进行提取是可行的。
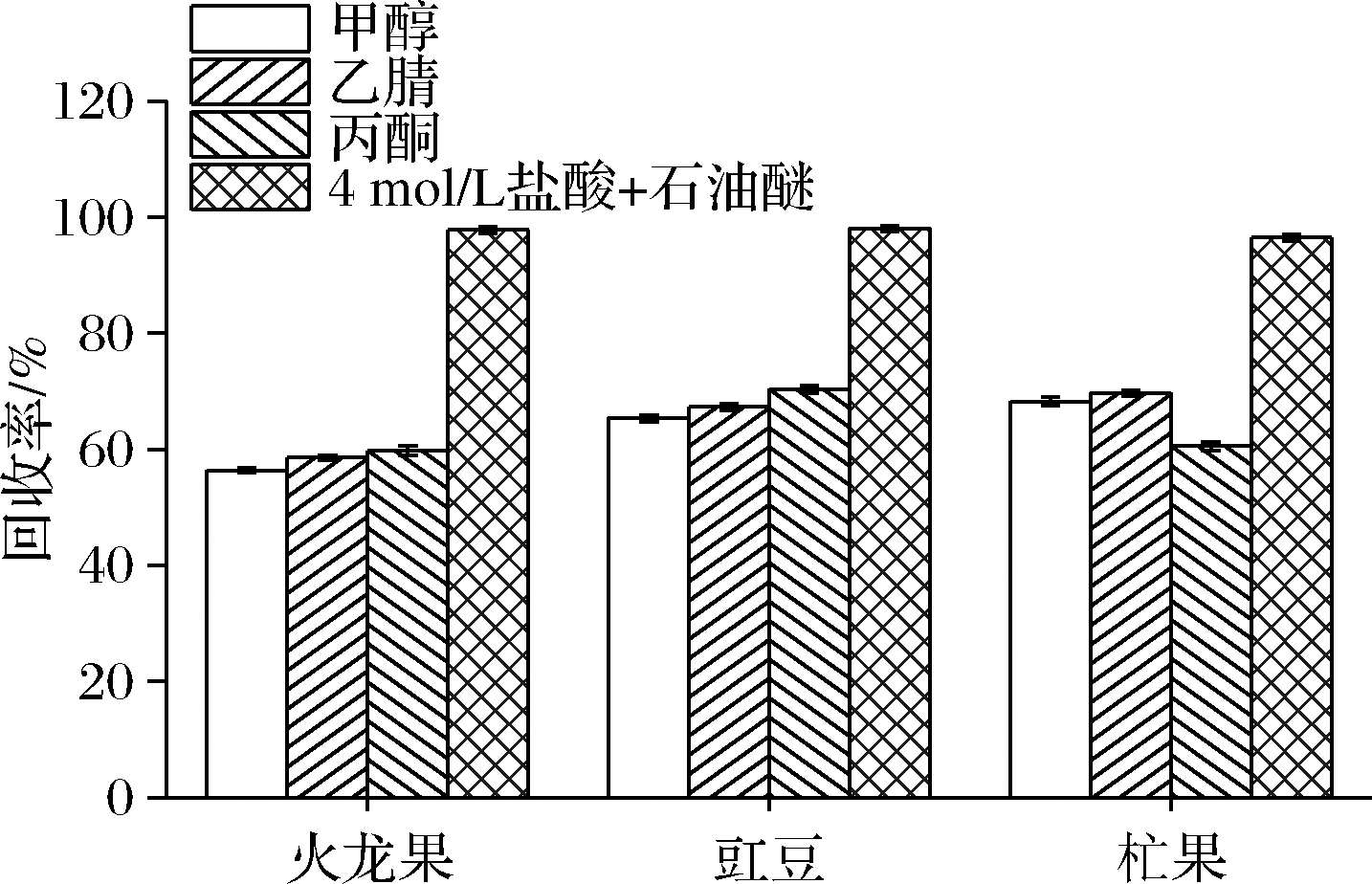
图3 松脂酸铜提取剂效果对比
Fig.3 Comparison of the effect of copper abietate extractant
2.2.2 提取时间的选择
超声时间不同,对农药的提取效率也不同,时间过短会造成农药提取不完全,时间过长可能会造成农药的降解。将超声波时间设置为5、10、15、20、25、30 min,分别上机检测,观察超声时间对回收率的影响。由图4可以看出,在10 min时松脂酸铜的提取效率最高。但在10 min之后,回收率逐渐降低,可能是由于随着时间的增加,超声使目标物分子碰撞速度不断加快,直至分子链断裂,分解为其他的物质。试验进一步使用电喷雾质谱法直接进样进行验证,分别测试超声10 min和超声30 min的松脂酸溶液的一级母离子,发现在m/z为275.2的中间物信号强度增加,该中间物在超声10 min时信号强度为7.90×104每秒计数(counts per second,cps),在超声20 min后信号强度为1.05×105 cps。经过计算,该中间物可能为松脂酸结构发生断裂,母体丢失2个甲基。因此,为避免超声时间过长导致松脂酸降解,引起信号降低,本试验选择最佳超声时间为10 min。
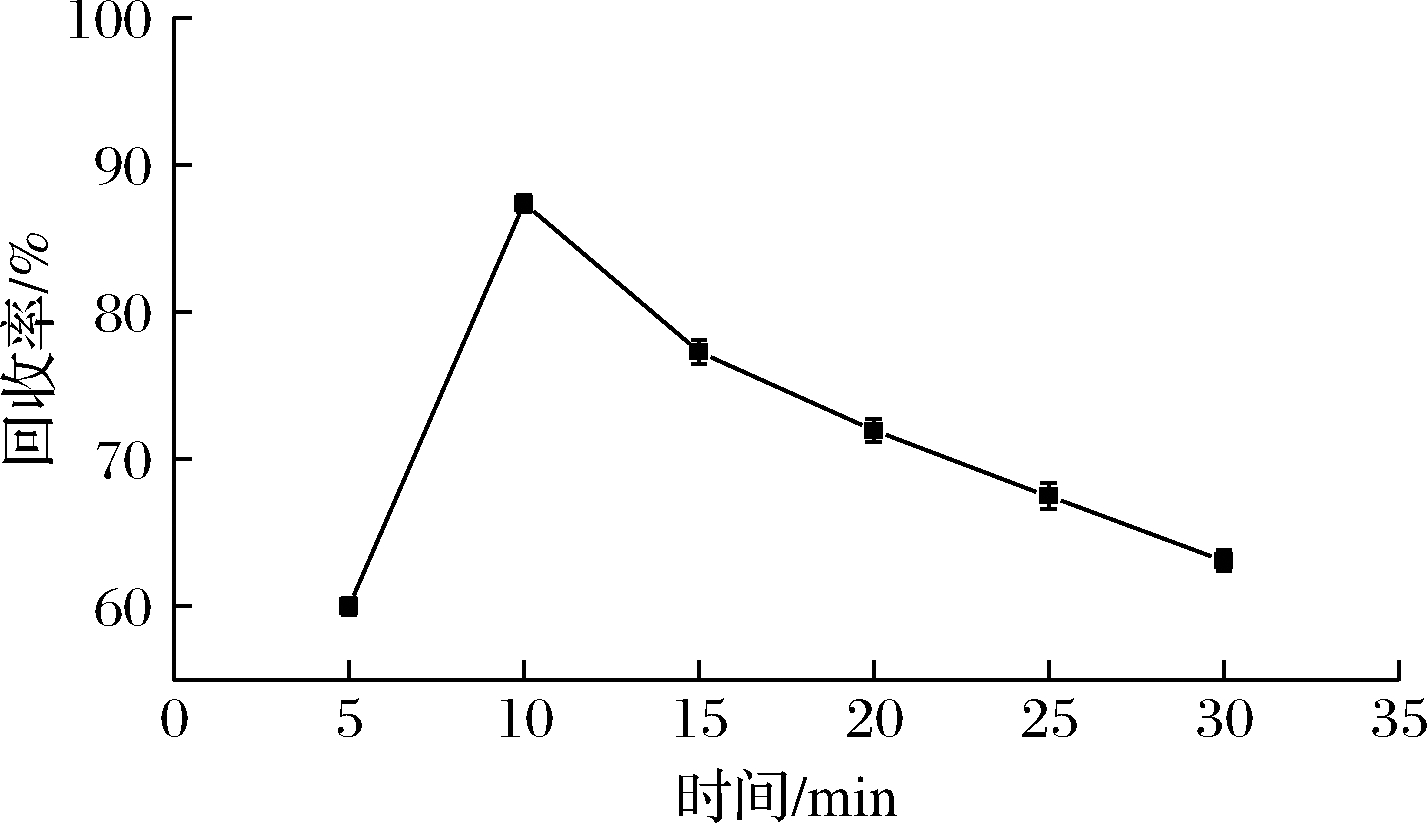
图4 超声时间对松脂酸铜回收率的影响
Fig.4 The effect of ultrasound time on recovery rate of copper abietate
2.2.3 流动相的选择
本研究采用0.1%冰醋酸和乙腈作为检测松脂酸铜的流动相,分别设置流动相比例为10/90、20/80进行对比,观察不同比例的流动相对峰形的影响以及各基质杂质峰与目标峰分离情况。从图5和图6可以看出,在V ∶V=10 ∶90的流动相条件下,目标物出峰较快,保留时间为5.674 min;在V ∶V=20 ∶80的流动相条件下,目标物出峰较慢,保留时间为6.297 min。
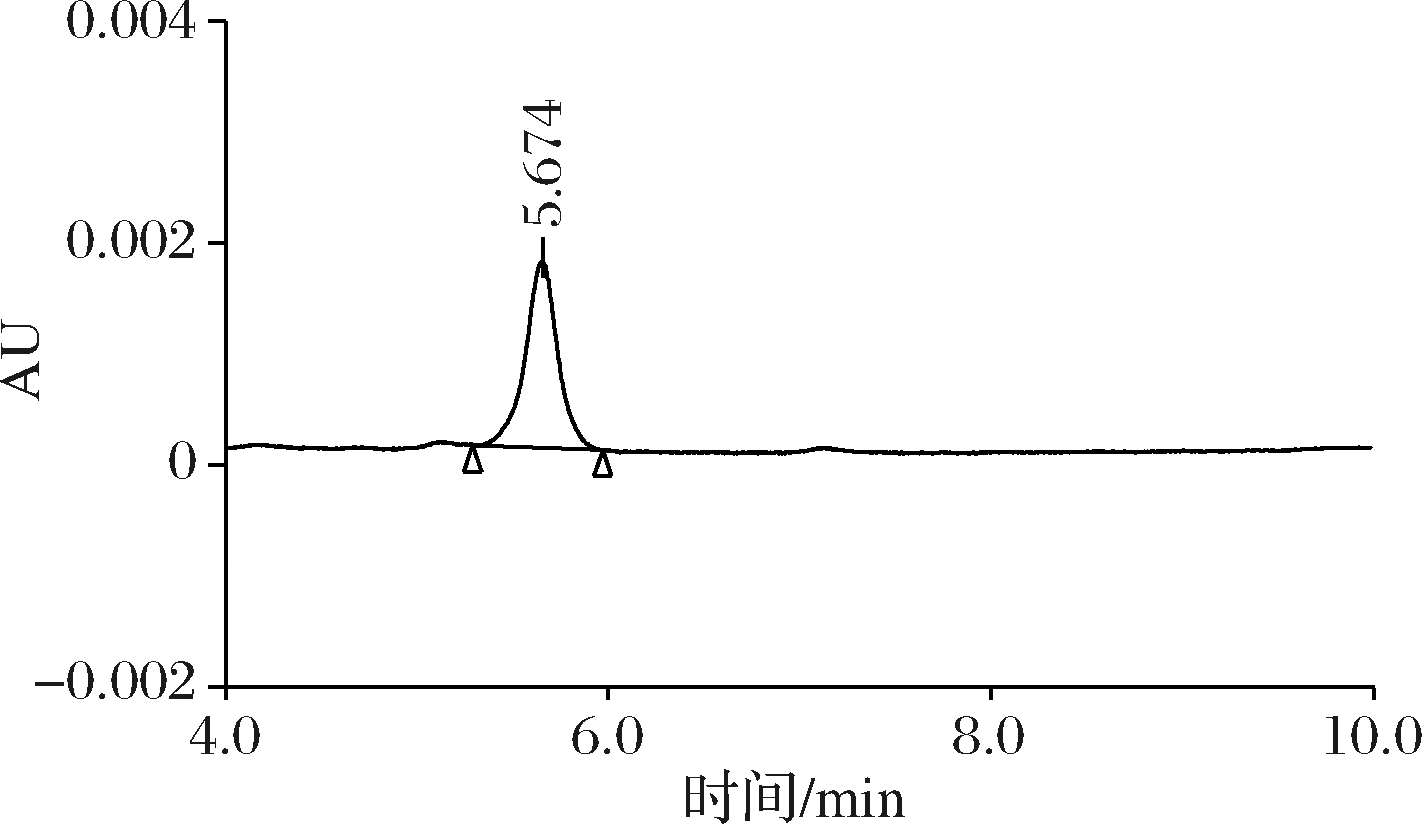
图5 流动相比例V ∶V=10 ∶90时松脂酸铜色谱图
Fig.5 Chromatogram of copper abietate at 10 ∶90 mobile phase ratio
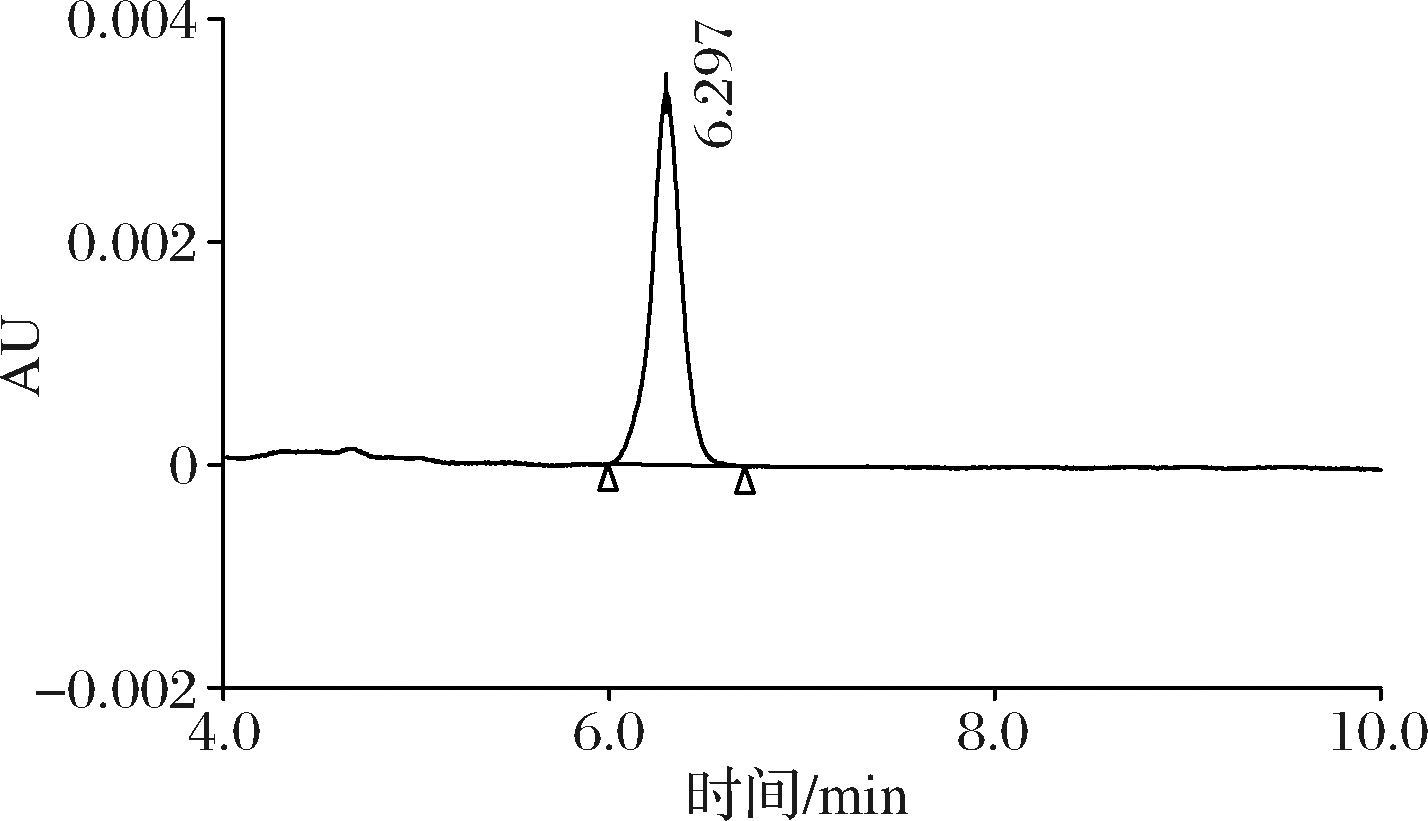
图6 流动相比例V ∶V=20 ∶80时松脂酸铜色谱图
Fig.6 Chromatogram of copper abietate at 20 ∶80 mobile phase ratio
如图7所示,在杧果样品分析时,保留时间为5.875 min存在杂质干扰,导致加标回收率偏高。因此,本实验选择流动相比例V ∶V=20 ∶80进行松脂酸铜的分析,选择保留时间较长的色谱条件,保证目标物与杂质峰实现良好分离。
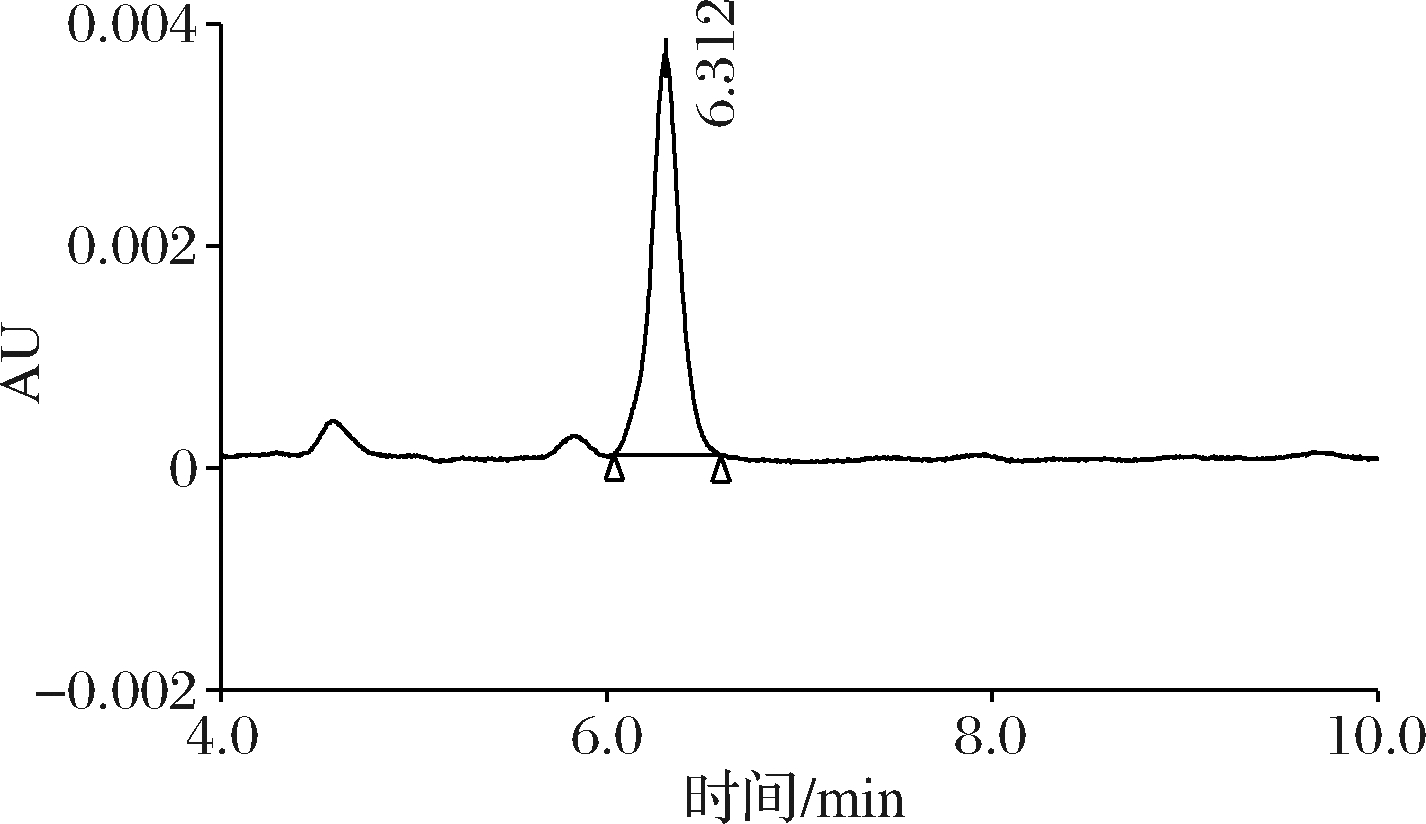
图7 流动相比例V ∶V=20 ∶80时松脂酸铜的杧果样品色谱图
Fig.7 Chromatogram of copper abietate in mango sample at 20 ∶80 mobile phase ratio
2.3 标准曲线及方法检出限
用甲醇配制1 000 μg/mL松脂酸铜标准样品溶液,用甲醇采用逐级稀释法配制0.1、0.2、0.5、1、2 μg/mL系列标准工作液。取系列标准溶液,参照样品处理加入盐酸衍生和石油醚进行提取,并将石油醚浓缩干后分别用乙腈定容,得到0.1、0.2、0.5、1、2 μg/mL松脂酸铜标准液,利用HPLC测定各浓度下松脂酸铜的标准工作液,如图8所示。并以工作溶液浓度(X)为横坐标、以监测定量响应峰面积(Y)为纵坐标绘制标准曲线。松脂酸铜在0.1~2 μg/mL线性关系良好,线性回归方程为Y=15 919X-209.22,相关系数R2为0.999 6,以定量离子响应的3倍信噪比(S/N=3)确定检出限,松脂酸铜的检出限为0.03 mg/kg,以定量离子响应的10倍信噪比(S/N=10)确定定量限为0.1 mg/kg。
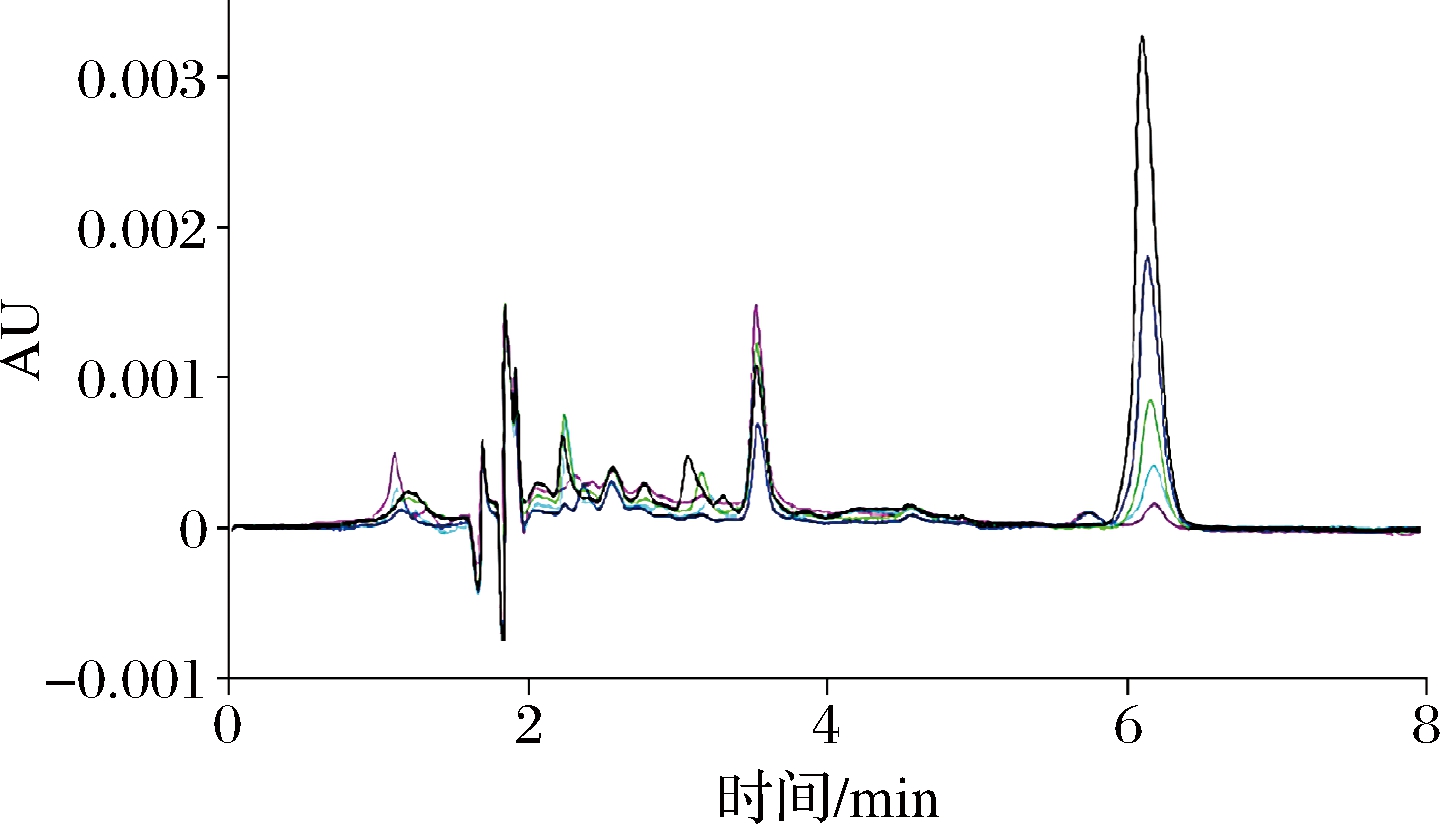
图8 松脂酸铜各质量浓度色谱图
Fig.8 Typical chromatogram of each mass concentration of copper abietate turpentine
2.4 回收率及方法精密度
以不添加农药的火龙果、豇豆和杧果分别作为空白样品,进行回收率检测。加入松脂酸铜标准品,进行添加浓度为0.4、1.0、4.0 mg/kg的3个添加回收实验,重复处理5次,测得回收率如表1所示。空白样品的平均回收率为77%~108%,相对标准偏差在0.8%~3.3%,这一结果满足果蔬中农药残留检测的要求。
表1 松脂酸铜加标回收率和相对标准偏差(n=5)
Table 1 The recovery rate and relative standard deviation of copper abietate
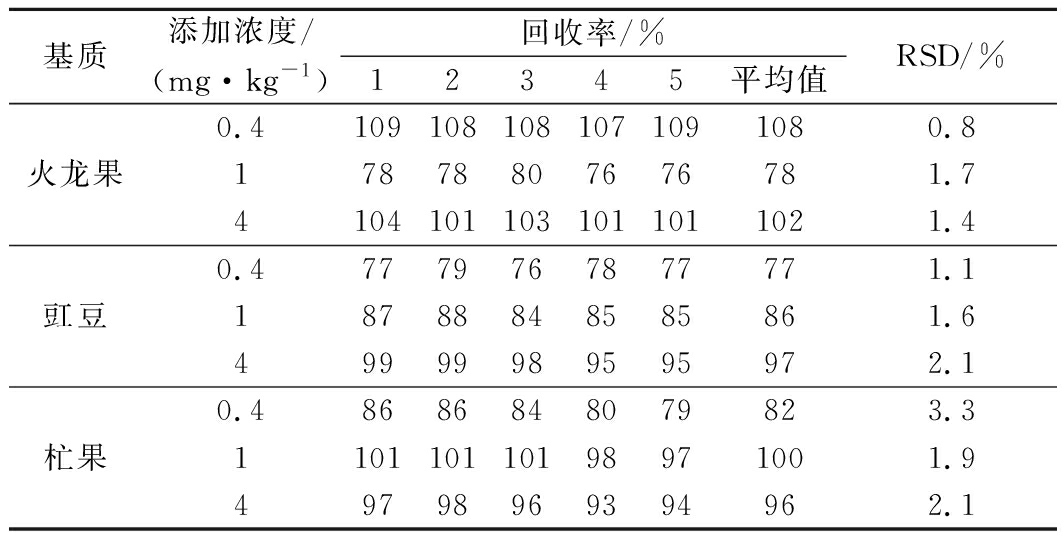
基质添加浓度/(mg·kg-1)回收率/%12345平均值RSD/%火龙果0.41091081081071091080.817878807676781.741041011031011011021.4豇豆0.47779767877771.118788848585861.649999989595972.1杧果0.48686848079823.3110110110198971001.949798969394962.1
2.5 实际样品检测
以本分析方法进行火龙果、豇豆和杧果样品中的松脂酸铜残留量检测,从而验证方法的实际应用效果。检测结果表明,当地所出售的火龙果、豇豆和杧果样品中均未检出松脂酸铜残留。
市场采购松脂酸铜农药,按照推荐剂量稀释300倍进行喷施,分别在施药后2 h和安全间隔期7 d采集样品进行分析,得到松脂酸铜在3种样品上的初始沉积量(施药后2 h)分别为0.129、0.181、0.158 mg/kg,在规定安全间隔期3种样品上的松脂酸铜残留量均小于0.1 mg/kg。使用本分析方法能有效检测3种果蔬实际样品中的松脂酸铜残留,满足3种样品中松脂酸铜残留分析的需求。
3 结论
松脂酸铜是松脂酸和铜的络合物,加入盐酸后变为松脂酸,利用高分辨质谱法测定经盐酸衍生后的松脂酸铜,经验证确定测定对象为松脂酸。结合相关文献,已有研究得出合成松脂酸铜[15]以Cu(OH)2为铜源,添加甲酸,可以制得松脂酸铜。同时,也有利用HPLC检测松脂酸[16-18],以及松脂酸铜转化成为松脂酸后进行测定[9]的研究,进一步证明实验测定对象为松脂酸。
对松脂酸铜前处理实验条件进行优化,利用高效液相色谱仪进行检测,设置0.1%冰醋酸-乙腈为流动相,体积比为20∶80,建立了松脂酸铜的分析方法。样品经4 mol/L盐酸和石油醚提取,超声10 min,蒸干后用乙腈定容,方可上机进行检测,运用外标法计算松酯酸铜残留量,该方法的准确度、精确度和灵敏度均符合残留检测要求。实验结果表明,松脂酸在0.1~2.0 mg/L的线性范围内,相关系数R2>0.996;根据回收率实验,在火龙果、豇豆和杧果基质中,添加质量浓度为0.4、1.0、4.0 mg/kg时,上述果蔬基质的添加回收率均在77%~108%,说明待测物松脂酸铜在果蔬中分析方法的准确度满足检测分析的需求。
[1] 吴朝波, 任承才, 朱明军, 等.春雷霉素与松脂酸铜复配防治槟榔叶斑病的效果研究[J].中国农技推广, 2021, 37(6):91-96.
WU C B, REN C C, ZHU M J, et al.Study on the effect of the combination of chunleimycin and copper rosin acid on prevention and treatment of areca leaf spot [J].China Agricultural Technology Extension, 2021, 37(6):91-96.
[2] 叶火春, 冯岗, 杨佳何, 等.吡唑醚菌酯与嘧菌环胺、松脂酸铜复配对杧果蒂腐病菌的毒力增效[J].热带农业科学, 2016, 36(10):37-42.
YE H C, FENG G, YANG J H, et al.Synergistic interaction of the mixtures of pyraclostrobin with cyprodinil or copper abietate on mango stem end rot caused by Botryodiplodia theobroma pat[J].Chinese Journal of Tropical Agriculture, 2016, 36(10):37-42.
[3] 江一红, 全金成, 谭炳林.不同药剂组合防治沃柑溃疡病田间效果评价[J].南方园艺, 2019, 30(6):12-14.
JIANG Y H, QUAN J C, TAN B L.Evaluation of field effect of different combinations of reagents on the prevention and treatment of citrus ulcer disease [J].Southern Horticulture, 2019, 30(6):12-14.
[4] 孙萍. 浅谈松脂酸铜在蟹田防治水稻病毒病应用效果[J].现代农业, 2018(9):20-21.
SUN P.Brief discussion on the application effect of copper abietate in the prevention and treatment of rice virus disease in crab fields [J].Modern Agriculture, 2018(9):20-21.
[5] KADLIKOVA K, VACLAVIKOVA M, HALESOVA T, et al.The investigation of honey bee pesticide poisoning incidents in Czechia[J].Chemosphere, 2021, 263:128056.
[6] 杨德毅, 刘莉, 李依岚, 等.高效液相色谱测定柑橘中松脂酸铜残留量的不确定度评定[J].农产品质量与安全, 2018(5):74-79.
YANG D Y, LIU L, LI Y L, et al.Uncertainty evaluation of rosin acid copper residue in citrus by HPLC[J].Quality and Safety of Agro-Products, 2018(5):74-79.
[7] 钟世欢, 陈青俊, 王京, 等.QuEChERS-HPLC测定柚类果实中柠檬苦素类化合物[J].食品与发酵工业, 2022, 48(4):261-265.
ZHONG S H, CHEN Q J, WANG J, et al.Determination of limonins in pomelo fruits by QuEChERS-HPLC[J].Food and Fermentation Industries, 2022, 48(4):261-265.
[8] 钮怡清. 高效液相色谱法检测辣椒、花椒粉中五种合成色素[J].食品与发酵工业, 2021, 47(24):256-260.
NIU Y Q.Determination of five kinds of synthetic pigments in chili powder and paprika powder by HPLC[J].Food and Fermentation Industries, 2021, 47(24):256-260.
[9] 林琎, 周艳明, 范维娣, 等.高效液相色谱法分析23%松脂酸铜水乳剂[J].现代农药, 2016, 15(5):40-41;51.
LIN J, ZHOU Y M, FAN W D, et al.Analysis of songzhisuantong 23% EW by HPLC[J].Modern Agrochemicals, 2016, 15(5):40-41;51.
[10] MITANI K, FUJIOKA M, UCHIDA A, et al.Analysis of abietic acid and dehydroabietic acid in food samples by in-tube solid-phase microextraction coupled with liquid chromatography-mass spectrometry[J].Journal of Chromatography A, 2007, 1 146(1):61-66.
[11] 陈安珍, 沙启营, 单秀明, 等.跌打片中松香酸的HPLC和HPLC-MS/MS检测方法研究[J].中成药, 2013, 35(9):1 940-1 942.
CHEN A Z, SHA Q Y, SHAN X M, et al.Determination of abietic acid in Dieda tablets by HPLC and HPLC-MS/MS[J].Chinese Traditional Patent Medicine, 2013, 35(9):1 940-1 942.
[12] 王忠合, 李晓婷, 胡文梅, 等.超高效液相色谱-高分辨质谱法测定肉类特征肽[J].食品与发酵工业, 2021, 47(18):258-266.
WANG Z H, LI X T, HU W M, et al.Determination of peptide markers of meat species by ultra-high pressure liquid chromatography coupled with high resolution mass spectrometry[J].Food and Fermentation Industries, 2021, 47(18):258-266.
[13] YANG B, YING Y, ZOU J, et al.Comprehensive characterization and quantification of multiple components in Dan-Huang-Qu-Yu capsule using a multivariate data processing approach based on microwave-assisted extraction with UHPLC and Q Exactive quadrupole-orbitrap high-resolution mass spectrometry[J].Journal of Separation Science, 2019, 42(11):2 069-2 079.
[14] ZUO L H, ZHONG Q Y, WANG Z H, et al.Simultaneous determination and pharmacokinetic study of twelve bioactive compounds in rat plasma after intravenous administration of Xuebijing injection by UHPLC-Q-Orbitrap HRMS[J].Journal of Pharmaceutical and Biomedical Analysis, 2017, 146:347-353.
[15] 马慧颖, 王金兰, 王丹, 等.松脂酸铜的合成[J].齐齐哈尔大学学报(自然科学版), 2019, 35(3):68-70.
MA H Y, WANG J L, WANG D, et al.Study on derivation of pine resin from Pinus sylvestris var.mongolica[J].Journal of Qiqihar University (Natural Science Edition), 2019, 35(3):68-70.
[16] 王英锋, 魏小燕.HPLC测定枫香脂碱提物中脱氢松香酸和松香酸的含量[J].中国中药杂志, 2013, 38(1):57-59.
WANG Y F, WEI X Y.Determination of dehydroabietic acid and abietic acid in aqueous alkali extract of Liquidambaris resina by HPLC[J].China Journal of Chinese Materia Medica, 2013, 38(1):57-59.
[17] 李富贤, 米彩峰, 石会丽.RP-HPLC测定清毒素胶囊中松香酸的含量[J].中国中药杂志, 2008, 33(9):1 086-1 087.
LI F X, MI C F, SHI H L.Determination of rosmarinic acid in clear toxin capsules by RP-HPLC [J].China Journal of Chinese Materia Medica, 2008, 33(9):1 086-1 087.
[18] 南丹, 蒋丽丹, 蔡秋香, 等.30%松脂酸钠水乳剂农药的RP-HPLC分析[J].广州化工, 2012, 40(6):99-100;119.
NAN D, JIANG L D, CAI Q X, et al.Analysis of 30% sodium abietate aqueous emulsion biopesticide by RP-HPLC[J].Guangzhou Chemical Industry, 2012, 40(6):99-100;119.