卤制品是我国的传统食品,种类丰富、口味独特、食用方便,深受人们喜爱,卤汁是卤制品最重要的载体。湘派卤汁(下文均简称卤汁)通常是在不人为添加防腐剂、护色剂等情况下,将数十种中药材、菜籽油和动物骨架等熬煮成浓汤与调味料按比例混合熬制而成[1-2]。卤汁成分复杂,含有脂肪、蛋白质、NaCl、氨基酸、有机酸、糖类及香料成分[3-4],在卤制品的风味形成中起决定性作用。在业界普遍以“百年传承,老卤为珍”的理念下,卤汁在实际生产过程中一般被反复循环使用,周期从十几天到上百天不等,每次卤制时卤制品中的可溶性营养和风味物质会迁移到卤汁中[5-7]。此外,卤汁在生产加工、反复使用过程中,可能因操作管理不规范、储存不当滋生霉菌,进而产生真菌毒素,增加卤制品的食品安全风险[8-9]。
真菌毒素是产毒真菌在一定条件下产生的次生代谢产物[10],对人和动物的肝肾、生殖系统具有毒性损害作用,可以诱发人和动物产生各种急性或慢性疾病具有“三致效应”[11-12]。根据卤汁的各种原料,如食用油、香辛料等中真菌毒素污染状况调查发现[13-15],在种植、生产、储存、加工和流通环节均可能因运输条件不当或储存环境不适而造成不同程度的真菌毒素污染[16]。一直以来,老卤汁类产品的企业标准大部分都是按照GB 31644—2018《食品安全国家标准 复合调味料》制定[17],但其中没有相关真菌毒素含量限定要求,为更好控制市场卤制品质量,进一步提高卤汁安全性,开发快速、灵敏、准确的多种真菌毒素同步检测方法十分必要。
目前,常见的真菌毒素检测手段有:薄层色谱(thin layer chromatography, TLC)、酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)、高效液相色谱-荧光检测(high performance liquid chromatography-fluorescence detection, HPLC-FLD)、液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)等[18]。其中,TLC法虽然样品前处理快速方便,但灵敏度低、重现性较差;ELISA法一般用于定性筛查检测,且假阳性率高,无法作为确证实验[19];HPLC-FLD法常用于检测具有类似化学性质或单一的真菌毒素[10],但定性能力不足,难以完成对多种真菌毒素同步检测;相较而言,LC-MS/MS技术具有选择性强、灵敏度高、定量定性分析能力强等优点,是多种毒素同步检测的最佳方法[20-21]。卤汁是一种十分复杂的油水混合物基质,其中存在大量脂肪、蛋白质、氨基酸等物质,以及可能存在的其他待测物之间相互干扰易造成基质效应,成为卤汁中多种真菌毒素同步检测的主要障碍。
本研究以卤汁为研究对象,发现常规真菌毒素前处理过程相对繁琐,易因步骤过多而造成目标毒素损失严重,从而回收率降低。通过优化样品前处理提取和净化方法,采用同位素内标法校正样品基质干扰,建立黄曲霉毒素B1(aflatoxin B1, AFB1),黄曲霉毒素B2(aflatoxin B2, AFB2),黄曲霉毒素G1(aflatoxin G1, AFG1),黄曲霉毒素G2(aflatoxin G2, AFG2),伏马毒素B1(fumonisin B1, FB1),T-2毒素(trichothecenes, T-2),HT-2毒素(系T-2毒素代谢产物),玉米赤霉烯酮(zearalenone, ZEN),赭曲霉毒素(ochratoxin A, OTA),脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)等10种湘派卤汁常见真菌毒素同步检测的液相色谱-串联质谱法。为休闲卤制品行业中真菌毒素定量检测及政府相关职能部门提供技术支持,保障居民食用健康、安全的卤制品。
1 材料与方法
1.1 仪器与设备
LC-30AD高效液相色谱仪,日本岛津公司;API4000QTRAP质谱仪,美国AB Sciex公司;SB-5200DTD超声波清洗器,宁波新芝生物科技股份有限公司;VELOCITY18R型台式冷冻离心机,澳大利亚Dynamica公司;HYQ-3110涡旋混匀器,苏州捷美电子有限公司。
1.2 材料与试剂
甲醇、乙腈(均为色谱纯),上海阿拉丁生化科技股份有限公司;乙酸(色谱纯),天津市科密欧化学试剂有限公司;黄曲霉毒素标准品(AFB1、AFB2、AFG1、AFG2),呕吐毒素标准品(DON),T-2毒素标准品(T-2),HT-2毒素标准品(HT-2),赭曲霉毒素标准品A(OTA),玉米赤霉烯酮标准品(ZEN),青岛普瑞邦生物工程有限公司;10种真菌毒素同位素标准品,坛墨质检科技股份有限公司;实验用卤汁样品取自湖南本地卤制品公司、小作坊或农贸市场,取样后于低温冰箱保存。
1.3 实验条件
1.3.1 10种真菌毒素混合标准溶液和标准曲线制作
标准储备液:分别准确称取10种真菌毒素1 mg(精确至0.01 mg)于称量瓶中,加入适量甲醇溶液溶解,转移到10 mL容量瓶定容至刻度,配制成10种各为100 μg/mL真菌毒素标准储备液,将溶液转移至试剂瓶中,在-20 ℃下密封保存,有效期1年。
混合标准工作液:分别吸取100 μg/mL标准储备液各1 mL于10 mL容量瓶中,稀释配制成10 μg/mL的标准溶液,混匀,转移至试剂瓶,避光密封储存于-20 ℃冰箱中,有效期半年。
混合同位素内标工作液:准确吸取250 μL 10种同位素内标于同一容量瓶中,加甲醇定容至刻度,混匀,转移至试剂瓶在-20 ℃下密封保存,有效期半年。
标准曲线工作溶液:准确移取适量混合标准工作溶液和混合同位素内标工作液,用甲醇配制成10、20、50、100、200 ng/mL的混合标准工作溶液,于4 ℃保存,有效期7 d。
1.3.2 样品前处理
以卤汁为例,取2 mL卤汁试样于15 mL离心管中,均加入100 μL内标混合工作液,分别加入10 mL V(乙腈)∶V(水)∶V(乙酸)=84∶15∶1提取液,涡旋振荡3 min,超声波提取25 min,4 ℃、8 000 r/min离心10 min,在-20 ℃下冷冻35 min,分离上清液,取上层清液1 mL于已提前加入1 mL水的5 mL离心管中稀释净化,涡旋混匀,高速离心10 min,取上清液过0.22 μm滤膜上机待测。
1.3.3 色谱条件
色谱柱:Venusil ASB-C18 (2.1 mm×100 mm×3 μm),进样量3.0 μL,柱温40 ℃,流速0.5 mL/min;流动相:A为纯甲醇,B为一级水,梯度洗脱条件如表1所示。
表1 梯度洗脱程序
Table 1 Gradient elution procedure
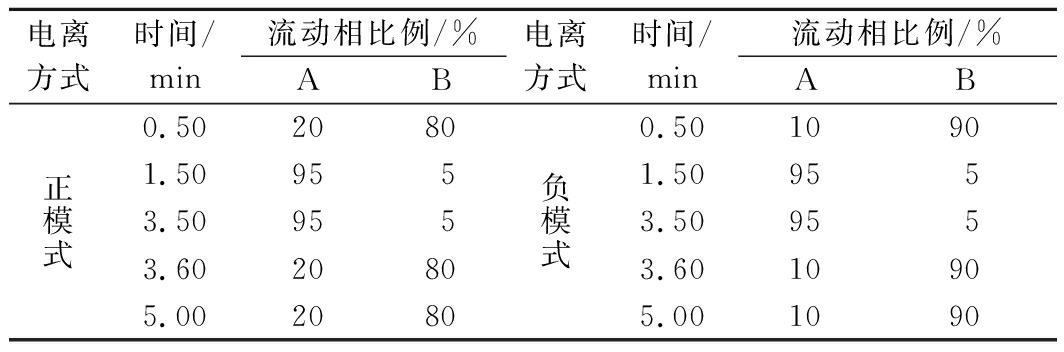
电离方式时间/min流动相比例/%AB电离方式时间/min流动相比例/%AB正模式0.5020801.509553.509553.6020805.002080负模式0.5010901.509553.509553.6010905.001090
1.3.4 质谱条件
电喷雾离子源(electron spray ionization,ESI),离子源温度500 ℃;(正模式)气帘气:35 psi,气体1:55 psi,气体2:55 psi;离子喷雾电压:(正模式)+5 500 V/(负模式)-4 500 V;(负模式)气帘气:35 psi,气体1:65 psi,气体2:65 psi;采用多反应监测(multiple reaction monitoring,MRM)模式进行检测,其他质谱参数见表2。
表2 质谱条件参数
Table 2 Mass spectrometry condition parameters

编号真菌毒素名称采集模式去簇电压/V离子对(m/z)碰撞能量/V1AFB1ESI+120313.3/285.1*,313.3/24133/52213C17-AFB1ESI+120330/255*,330/30150/353AFB2ESI+125315.2/287.2*,315.2/259.235/41.9413C17-AFB2ESI+125332/303*,332/27325/285AFG1ESI+150329.2/243.3*,329.2/283.338/35613C17-AFG1ESI+150346/257*,346/29925/257AFG2ESI+146331.2/245*,331.2/25741/45813C17-AFG2ESI+146348.3/259*,348.3/30130/279FB1ESI+128722.2/334.5*,722.2/352.553.8/52.21013C34-FB1ESI+60756.5/374.4*,756.5/356.448/5111HT-2ESI+68442.3/263.1*,442.3/215.119/191213C22-HT-2ESI+40464.3/278*,464.3/200.320/2013T-2ESI+75484.3/245.1*,484.3/215.220/291413C24-T-2ESI+70508.2/322*,508.2/260.117.5/16.815OTAESI+50404.3/239*,404.3/358.333/211613C20-OTAESI+57424.4/250.2*2017DONESI--70294.9/137.7*,294.9/264.7-26/-171813C15-DONESI--16310.3/279*,310/145-12/-1419ZENESI--106317.4/130.9*,317.4/175.2-41/-34.12013C18-ZENESI--50355.1/185.1*-50
注:*为定量离子
2 结果与讨论
2.1 真菌毒素的分离优化
本研究通过优化流动相洗脱梯度,优化质谱离子源以及各真菌毒素的碰撞能和去簇电压等参数,可大幅减少卤汁复杂基质在目标毒素检测过程中其他物质的干扰,并以期获得最佳的检测灵敏度和分离效率。结合10种目标真菌毒素的结构性质差异,在正、负电离模式下进行母离子扫描,设置扫描范围为200~800 u,在相同浓度条件的检测中确定不同模式下化合物的响应值。优化结果表明,DON、ZEN在负模式下响应强度较明显,其他化合物在正模式下灵敏度较高,MRM色谱图如图1和图2所示。

a-AFB1;b-AFB2;c-AFG1;d-AFG2;e-FB1;f-HT-2;g-T-2;h-OTA
图1 八种真菌毒素混标的正模式MRM色谱图(100 ng/mL)
Fig.1 Positive mode MRM chromatogram of eight mycotoxins mixed standards (100 ng/mL)
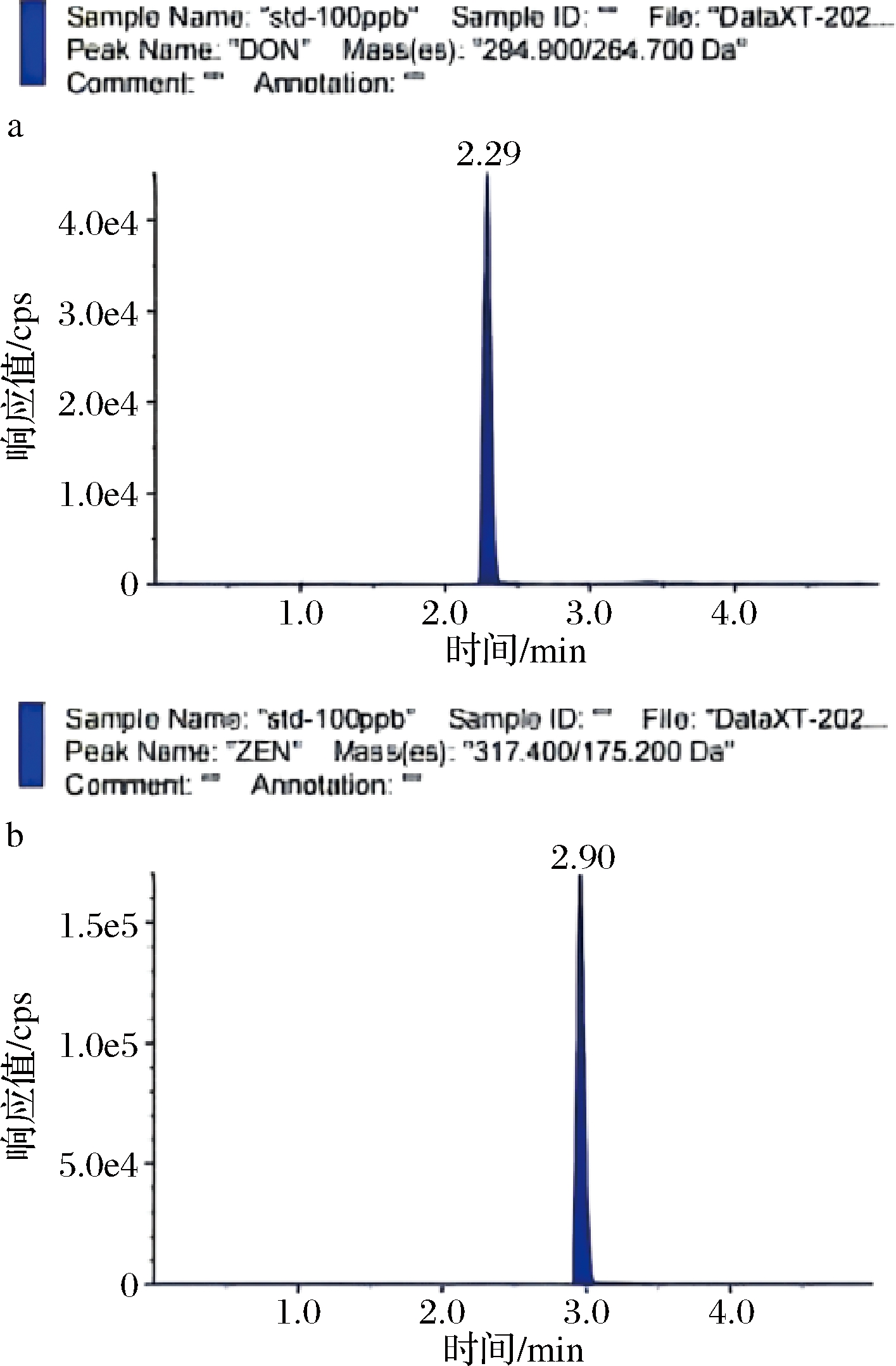
a-DON;b-ZEN
图2 两种真菌毒素混标的负模式MRM色谱图(100 ng/mL)
Fig.2 Negative mode MRM chromatogram of two mycotoxins mixed standards (100 ng/mL)
2.2 前处理方法优化
为有效提高目标真菌毒素在卤汁和菜籽油基质中的提取效率,在流动相一定的基础上综合考量10种真菌毒素的极性差异,使用不同有机相及不同比例的提取液进行提取。以卤汁基质为例,分别考察常用10 mL甲醇、10 mL乙腈、10 mL V(甲醇)∶V(水)=98∶2、10 mL V(乙腈)∶V(水)=98∶2和10 mL V(乙腈)∶V(水)∶V(乙酸)=84∶15∶1提取液进行提取,发现在本实验中,用甲醇、乙腈、V(甲醇)∶V(水)=98∶2和V(乙腈)∶V(水)=98∶2等4种提取液处理时,基质中大量除目标待测物外的物质被提取液中高比例的有机溶剂提取出,造成检测灵敏度降低;其次,大部分真菌毒素的回收率也无法满足要求。经过优化,使用V(乙腈)∶V(水)∶V(乙酸)=84∶15∶1提取液时,对非极性较大的化合物(如赭曲霉毒素、黄曲霉毒素等)和对极性较大的化合物(如伏马毒素等)提取效果均较好,同时各目标真菌毒素的加标回收率为78.6%~107.3%。综合考虑,在卤汁、菜籽油基质中以V(乙腈)∶V(水)∶V(乙酸)=84∶15∶1为前处理提取液,10种真菌毒素均具有良好的提取效果。
2.3 基质效应
基质效应能直接影响检测结果的准确度,在高效液相色谱-串联质谱分析时是必须考察的因素[22]。本研究采用溶剂标准曲线和基质标准曲线斜率考察目标毒素在卤汁和菜籽油中的信号增强或抑制的程度。基质效应按公式(1)计算:
(1)
式中:SSE,基质效应;K1,空白基质配制的标准曲线的斜率;K2,纯溶剂标准曲线斜率。
SSE<0.8,表现为基质抑制效应;0.8
2.4 方法学验证
按1.3.1配制的系列混合标准工作液进行分析,除空白对照组实验结果,以目标分析物峰面积与相应内标物峰面积的比值为纵坐标(Y)、相应目标分析物的质量浓度(μg/L)为横坐标(X)绘制标准曲线。线性范围、回归方程和相关系系数(R2)见表3。通过目标物在3倍信噪比(S/N=3)和10倍信噪比(S/N=10)下对应的峰面积计算浓度,并确定各目标物的方法检出限(limit of detection,LOD)和定量限(limit of quantification,LOQ),结果表明10种真菌毒素在线性范围内线性关系良好,R2>0.998 5。
表3 十种真菌毒素的线性关系、检出限、定量限
Table 3 Linear relationships, LOD, and LOQ of the ten mycotoxins
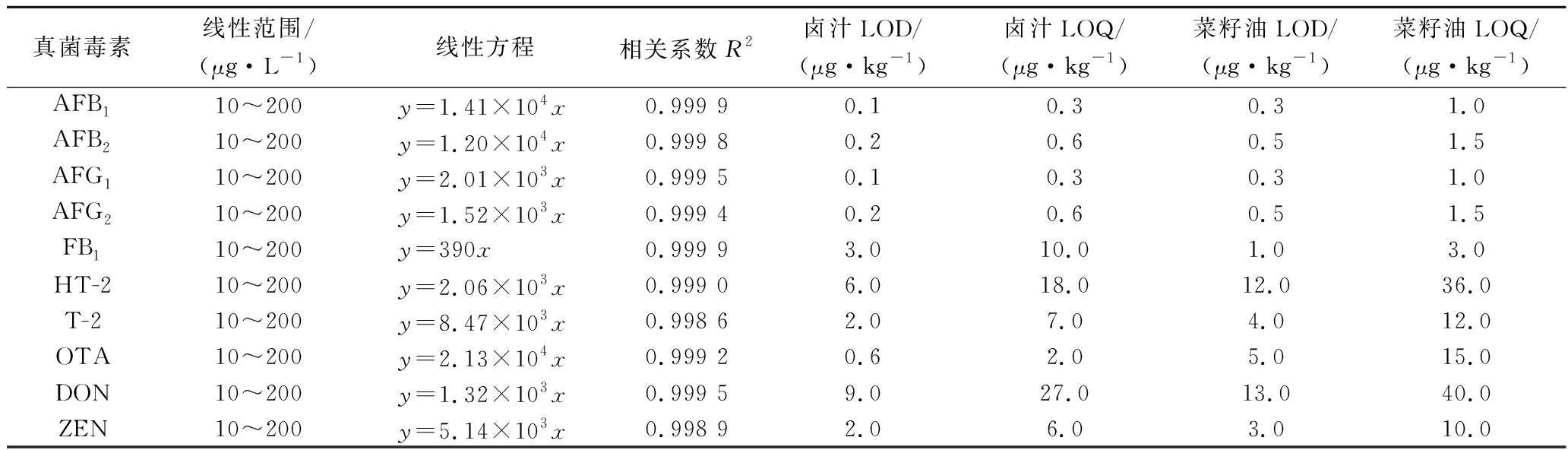
真菌毒素线性范围/(μg·L-1)线性方程相关系数R2卤汁LOD/(μg·kg-1)卤汁LOQ/(μg·kg-1)菜籽油LOD/(μg·kg-1)菜籽油LOQ/(μg·kg-1)AFB110~200y=1.41×104x0.999 9 0.10.30.31.0AFB210~200 y=1.20×104x0.999 80.20.60.51.5AFG110~200y=2.01×103x0.999 50.10.30.31.0AFG210~200y=1.52×103x0.999 40.20.60.51.5FB110~200y=390x0.999 93.010.01.03.0HT-210~200y=2.06×103x0.999 06.018.012.036.0T-210~200y=8.47×103x0.998 62.07.04.012.0OTA10~200y=2.13×104x0.999 20.62.05.015.0DON10~200 y=1.32×103x0.999 59.027.013.040.0ZEN10~200 y=5.14×103x0.998 92.06.03.010.0
选取卤汁、菜籽油2类空白基质样品,进行低、中、高3个浓度水平加标实验,按1.3.2处理样品,每个加标水平平行测定6次,计算6次加标实验的平均回收率以及相对标准偏差(relative standard deviation,RSD)。由表4可以看出,本方法回收率和精密度结果良好,回收率为78.6%~107.3%,RSD<15%,符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》的要求,适用于卤汁中10种真菌毒素的日常检测。
表4 十种真菌毒素加标回收率及精密度(n=6)
Table 4 The spiked recoveries and precision of 10 mycotoxins (n=6)

真菌毒素卤汁菜籽油添加量/(μg·kg-1)回收率/%RSD/%添加量/(μg·kg-1)回收率/%RSD/%AFB10.387.43.0192.912.10.6103.211.32104.58.31.598.79.7597.78.4AFB20.695.414.01.587.63.51.298.68.2392.18.53.0102.69.47.594.98.2AFG10.386.23.5193.99.60.692.76.8294.25.31.590.49.5584.92.2AFG20.687.87.41.591.58.51.296.18.2388.76.43.086.96.57.595.58.3FB11091.68.9384.08.92096.29.7696.27.350102.07.71593.06.4HT-21893.24.63694.510.63691.010.17292.46.09090.35.218090.14.4T-2798.34.21290.16.91492.87.124100.87.63591.55.66094.19.0OTA2104.07.81590.97.2495.95.930107.39.31086.47.47598.17.2DON2798.07.64078.63.45483.810.88099.78.713579.510.220087.110.6ZEN695.89.41097.86.612101.05.72097.78.83089.15.75088.17.3
2.5 实际样品测定
应用建立的方法,对选取的20份实际样品连续进样检测,结果如表5,其中卤汁中有1份AFB1检出,检出率为7.14%,含量为0.46 μg/kg,3种真菌毒素AFB1、OTA和ZEN在菜籽油中分别有2、1、2份检出,检出率分别为33.3%、16.7%、33.3%,含量范围分别为0.36~0.47 μg/kg、0.59 μg/kg、4.28~5.06 μg/kg,其他毒素均未检出。菜籽油中有多种真菌毒素检出但都尚属较低剂量,这与其他研究结论大致一致,出现此现象原因可能是检测的多数样本来自小作坊式土法压榨,其加工工艺粗糙、卫生安全意识淡薄;此外南方地区高温潮湿,在菜籽油原料收割、加工和储存过程中易导致霉菌生长繁殖,受真菌毒素污染风险高[25-26]。在湘派卤汁中首次检测出AFB1,这与陈浩等[2]研究结果不一致,分析原因可能是卤汁熬完后在反复卤制使用过程中一般温度控制在90 ℃上下[1],AFB1耐高温、性质稳定、不易裂解;另外导致该现象的原因可能是熬制卤汁的原材料(如菜籽油、香辛料等)的加入,由于许多香辛料隶属于中药材,和菜籽油一样从原料种植、采收到贮藏极易受到真菌毒素的侵害发生霉变不便察觉[27],在中药材中现已有多种真菌毒素被检出[28-29]。因此为确保休闲卤制品的安全,保障消费者健康,对卤汁生产加工和贮藏过程进行真菌毒素的检测和监管显得尤为重要。
表5 卤汁、菜籽油实际样品检测结果
Table 5 The actual sample test results of brine and canola oil
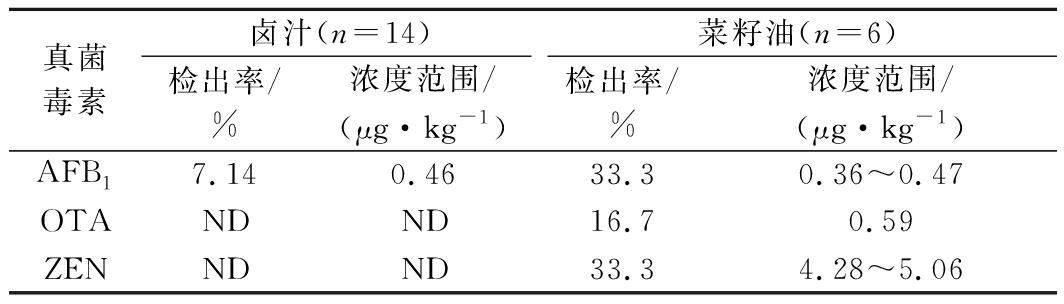
真菌毒素卤汁(n=14)菜籽油(n=6)检出率/%浓度范围/(μg·kg-1)检出率/%浓度范围/(μg·kg-1)AFB17.140.4633.30.36~0.47OTANDND16.70.59ZENNDND33.34.28~5.06
注:ND-未检出
3 结论
本研究通过优化前处理提取液和直接提取稀释净化的快速前处理方法,并采用LC-MS/MS检测和同位素内标定量分析,建立了卤汁中10种真菌毒素同步检测方法。经方法学验证及实际样品检测,回收率、灵敏度、检出限等均满足方法学要求;该方法前处理简单、灵敏度好、回收率高且检测成本低,适用于卤汁中多种真菌毒素的快速检测和精准定量。
[1] 伍涛, 彭希林, 赵良忠, 等.湘派豆干及卤汁在卤制过程中的变化规律[J].食品与发酵工业, 2021, 47(19):146-154.
WU T, PENG X L, ZHAO L Z, et al.Variation law of Xiangpai dried tofu and brine during marinating process[J].Food and Fermentation Industries, 2021, 47(19):146-154.
[2] 陈浩, 杨莹, 赵良忠, 等.湘派卤汁循环使用安全监测及预警模型的构建[J].食品与发酵工业, 2020, 46(21):181-187.
CHEN H, YANG Y, ZHAO L Z, et al.The safety monitoring and early-warning model construction for Xiangpai brine recycling[J].Food and Fermentation Industries, 2020, 46(21):181-187.
[3] 成亚斌, 黄凯信, 宋贤良, 等.不同卤制次数的盐焗鸡卤汁中的营养成分变化规律[J].食品与发酵工业, 2014, 40(3):129-133.
CHENG Y B, HUANG K X, SONG X L, et al.The nutrition change in the brine of water-boiled salted chicken with different marinating times[J].Food and Fermentation Industries, 2014, 40(3):129-133.
[4] LIU Y, XU X L, ZHOU G H.Changes in taste compounds of duck during processing[J].Food Chemistry, 2007, 102(1):22-26.
[5] 刘登勇, 刘欢, 张庆永, 等.反复卤煮过程中扒鸡卤汤物理及感官特性变化分析[J].食品科学, 2017, 38(11):116-121.
LIU D Y, LIU H, ZHANG Q Y, et al.Changes in physical and sensory characteristics of Dezhou braised chicken brine during repeated braising[J].Food Science, 2017, 38(11):116-121.
[6] 邵俊锋, 李波, 陆炀, 等.基于主成分分析法的盐水鹅老卤风味强度评价模型的构建[J].食品与发酵工业, 2020, 46(14):262-268.
SHAO J F, LI B, LU Y, et al.Construction of evaluation model for flavor intensity of salted goose aged brine based on principal component analysis[J].Food and Fermentation Industries, 2020, 46(14):262-268.
[7] 肖凌云.武冈卤制品产业发展现状及HACCP体系应用研究[D].长沙:湖南农业大学, 2015.
XIAO L Y.The development status of thick gravy-food in Wugang and the application of HACCP system[D].Changsha:Hunan Agricultural University, 2015.
[8] 杜垒, 谢伟, 徐幸莲, 等.复卤前后盐水鸭老卤基本成分与安全指标变化[J].食品科学, 2009, 30(13):101-104.
DU L, XIE W, XU X L, et al.Changes of main components of old brine used in production of water-boiled salted duck and determination of safety indexes before and after rebrining[J].Food Science, 2009, 30(13):101-104.
[9] 吴俊师, 刘巧瑜, 陈俊文, 等.重复卤制对卤汁品质的影响[J].中国调味品, 2021, 46(7):70-75.
WU J S, LIU Q Y, CHEN J W, et al.Effect of repeated marinating on the quality of marinade[J].China Condiment, 2021, 46(7):70-75.
[10] 何卓霖, 李子琨, 穆蕾, 等.同位素内标-高效液相色谱-串联质谱法同时测定小麦和玉米中19种真菌毒素[J].中国粮油学报, 2022, 37(7):150-157.
HE Z L, LI Z K, MU L, et al.Simultaneous determination of isotope internal standard-high performance liquid chromatography-tandem mass spectrometry 19 mycotoxins in wheat and corn[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(7):150-157.
[11] DEMISSIE N.A review of aflatoxin:Occurrence, prevention, and gaps in both food and feed safety[J].Novel Techniques in Nutrition & Food Science, 2018, 1(3):35-43.
[12] YANG C, SONG G, LIM W.Effects of mycotoxin-contaminated feed on farm animals[J].Journal of Hazardous Materials, 2020, 389:122087.
[13] 杨帅, 杨永坛, 穆蕾, 等.液相色谱-串联质谱同时测定食用植物油中的多种真菌毒素[J].中国食品学报, 2021, 21(5):309-316.
YANG S, YANG Y T, MU L, et al.Simultaneous detection of multi-mycotoxins in edible oil using liquid chromatography tandem mass spectrometry[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):309-316.
[14] 胡佳哲, 赖宇红, 陈浩桉.中药材中常见真菌毒素污染状况及分析方法研究进展[J].海峡药学, 2019, 31(1):1-5.
HU J Z, LAI Y H, CHEN H A.Research progress of the pollution status and analysis methods of common fungal toxins in Chinese medicinal herbs[J].Strait Pharmaceutical Journal, 2019, 31(1):1-5.
[15] 韦芳, 廖晓芳, 刘晓菲, 等.中药材等复杂基质中真菌毒素检测的前处理技术研究新进展[J].中国中药杂志, 2018, 43(17):3 431-3 443.
WEI F, LIAO X F, LIU X F, et al.Research progress of pretreatment technology for mycotoxin detection in Chinese materia medica and complex matrices[J].China Journal of Chinese Materia Medica, 2018, 43(17):3 431-3 443.
[16] 管卓龙, 卢跃鹏, 侯靖, 等.高效液相色谱-串联质谱法同时测定蒸肉粉中6种真菌毒素[J].食品科技, 2021, 46(5):295-300.
GUAN Z L, LU Y P, HOU J, et al.Determination of 6 mycotoxin contaminants in rice flour for steamed pork by high performance liquid chromatography-tandem mass spectrometry[J].Food Science and Technology, 2021, 46(5):295-300.
[17] 刘新, 张凤兵, 王鸿, 等.基于主成分分析和聚类分析的老卤汁产品品质评价[J].食品科技, 2020, 45(3):274-278.
LIU X, ZHANG F B, WANG H, et al.Evaluation of marinades quality based on principal component analysis and hierarchical cluster analysis[J].Food Science and Technology, 2020, 45(3):274-278.
[18] 吴红涛, 李萌萌, 关二旗, 等.四极杆-轨道阱液质联用法同时检测玉米中四种真菌毒素[J].食品与发酵工业, 2022,48(24):245-251.
WU H T, LI M M, GUAN E Q, et al.Simultaneous determination of four mycotoxins in maize by Quadrupole-Orbitrap LC-MS[J].Food and Fermentation Industries, 2022,48(24):245-251.
[19] 徐洪文, 朱瑜, 徐华, 等.高效液相色谱法测定食用植物油中6种真菌毒素[J].中国油脂, 2020, 45(11):77-83.
XU H W, ZHU Y, XU H, et al.Detection of six mycotoxins in edible vegetable oil by high performance liquid chromatography[J].China Oils and Fats, 2020, 45(11):77-83.
[20] WALL-MART NEZ H A, PASCARI X, RAMOS A J, et al.Frequency and levels of mycotoxins in beer from the Mexican market and exposure estimate for deoxynivalenol mycotoxins[J].Mycotoxin Research, 2019, 35(2):207-216.
NEZ H A, PASCARI X, RAMOS A J, et al.Frequency and levels of mycotoxins in beer from the Mexican market and exposure estimate for deoxynivalenol mycotoxins[J].Mycotoxin Research, 2019, 35(2):207-216.
[21] GONZ LEZ-JART
LEZ-JART N J M, ALFONSO A, RODR
N J M, ALFONSO A, RODR GUEZ I, et al.A QuEChERS based extraction procedure coupled to UPLC-MS/MS detection for mycotoxins analysis in beer[J].Food Chemistry, 2019, 275:703-710.
GUEZ I, et al.A QuEChERS based extraction procedure coupled to UPLC-MS/MS detection for mycotoxins analysis in beer[J].Food Chemistry, 2019, 275:703-710.
[22] 王权帅, 孙卫明.同位素内标-超高效液相色谱-串联质谱法同时测定板栗中16种真菌毒素[J].食品科技, 2021, 46(11):307-313.
WANG Q S, SUN W M.Simultaneous determination of 16 kinds of mycotoxins in chestnut using isotope internal standard-high performance liquid chromatography-tandem mass spectrometry[J].Food Science and Technology, 2021, 46(11):307-313.
[23] 苏萌, 艾连峰.液相色谱-串联质谱基质效应及其消除方法[J].食品安全质量检测学报, 2014(2):511-515.
SU M, AI L F.Matrix effects and elimination methods of liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety & Quality, 2014(2):511-515.
[24] FRENICH A G, ROMERO-GONZ LEZ R, G
LEZ R, G MEZ-PÉREZ M L, et al.Multi-mycotoxin analysis in eggs using a QuEChERS-based extraction procedure and ultra-high-pressure liquid chromatography coupled to triple quadrupole mass spectrometry[J].Journal of Chromatography A, 2011, 1218(28):4 349-4 356.
MEZ-PÉREZ M L, et al.Multi-mycotoxin analysis in eggs using a QuEChERS-based extraction procedure and ultra-high-pressure liquid chromatography coupled to triple quadrupole mass spectrometry[J].Journal of Chromatography A, 2011, 1218(28):4 349-4 356.
[25] 孙嘉笛, 徐洪文, 徐一达, 等.食用植物油中黄曲霉毒素和赭曲霉毒素的污染状况及特征分析[J].中国油脂, 2022, 47(9):35-43.
SUN J D, XU H W, XU Y D, et al.Analysis of contamination status and characteristics of aflatoxin and ochratoxin in edible vegetable oils[J].China Oils and Fats, 2022, 47(9):35-43.
[26] 吴宇, 叶金, 张冰, 等.稳定同位素稀释-超高效液相色谱-串联质谱法快速测定植物油中16种真菌毒素[J].分析化学, 2018, 46(6):975-984.
WU Y, YE J, ZHANG B, et al.A fast analytical approach for determination of 16 kinds of mycotoxins in vegetable oils using stable isotope dilution and ultra high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2018, 46(6):975-984.
[27] 李峻媛, 万丽, 杨美华.真菌毒素限量标准及其在中药中的研究进展[J].中草药, 2011, 42(3):602-609.
LI J Y, WAN L, YANG M H.Limit standard of mycotoxins and advances in studies on its application in Chinese materia medica[J].Chinese Traditional and Herbal Drugs, 2011, 42(3):602-609.
[28] YANG M H, CHEN J M, ZHANG X H.Immunoaffinity column clean-up and liquid chromatography with post-column derivatization for analysis of aflatoxins in traditional Chinese medicine[J].Chromatographia, 2005, 62(9-10):499-504.
[29] ROMAGNOLI B, MENNA V, GRUPPIONI N, et al.Aflatoxins in spices, aromatic herbs, herb-teas and medicinal plants marketed in Italy[J].Food Control, 2007, 18(6):697-701.