乳酸菌可产多种抑菌活性物质,已被研究报道的主要有:乳酸、乙酸、苯乳酸、细菌素、reuterin、reutericyclin[1]等。细菌素是某些细菌分泌的一类具有抗菌生物活性的多肽或蛋白质类物质,它在较低浓度下具有很强的抗菌活性,且因其安全、无毒、易被人体消化,不产生耐药性,添加至食品中不会对感官品质造成影响等特性,显示了细菌素在食品保鲜方面的巨大潜力[2-5]。目前研究最为深入的细菌素是乳酸链球菌素(Nisin),它作为食品添加剂已被50多个国家授权使用,但因其抑菌谱窄、pH耐受性较差使其应用受限[6-7]。RASHEED等[8]从发酵乳杆菌BZ532(Lactobacillus fermentum BZ532)中分离出新型细菌素LF-BZ532,对多种食品病原菌具有广谱抑菌活性。AN等[9]从植物乳杆菌M1-UVs300 (Lactobacillus plantarum M1-UVs300)中分离出新型细菌素M1-UVs300,对革兰氏阳性菌、革兰氏阴性菌具有广谱抗菌活性;HU等[10]分离出Lactobacillus alimentarius FM-MM4细菌素对细菌及酵母菌具有广谱抗菌活性。GAO等[11]分离到一株新型的抑菌广谱、且对热和低pH表现出抗性的Ⅱa类细菌素(Garviecin LG34)产生菌;辛维岗等[12]分离出细菌素LSP01,对大肠杆菌(Escherichia coli)、福氏志贺氏菌(Shigella flexneri)和金黄色葡萄球菌(Staphylococcus aureus)等12株致病菌具有良好的抑制效果,且对热和pH表现出良好抗性。
细菌素被认为是一种潜在的生物防腐剂,到目前为止,已被发现的细菌素有数百余种,但真正商业化的只有Nisin和pediocin PA-1,其余仅限于实验研究[13-14]。不同细菌素抑菌效率和抑菌特性各有不同,且同一细菌素在不同条件下抑菌活性有所不同,不同的外部环境也会影响细菌素的结构、性质和抑菌效果。因此,寻找新型细菌素并探究其抑菌稳定性,对其后续研究及应用具有极其重要的意义。
课题组此前从新鲜牛粪中分离鉴定出Lactobacillus plantarum C010,并初步确定可产细菌素[15]。试验在前期L.plantarum C010液体发酵工艺优化及诱导调控作用提高细菌素产量研究基础上[16],采用硫酸铵沉淀法、有机试剂萃取法和pH吸附解吸法粗提L.plantarum C010所产细菌素,并通过Sephadex G-25、Sephadex LH-20凝胶层析结合半制备高效液相色谱进一步纯化,对其结构和理化稳定性进行分析,以期为植物乳杆菌C010所产细菌素的分离提取、开发应用提供数据基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株
试验菌株:L.plantarum C010由课题组从新鲜牛粪中自行分离鉴定保存,所用培养基为MRS培养基。
指示菌:革兰氏阴性细菌韩国假单胞菌PS1(Pseudomonas koreensis PS1)、革兰氏阳性细菌梭状芽孢杆菌J4(Bacillus fusiformis J4)均为课题组从腐败冷却猪肉中自行分离保存的特定优势腐败菌株[17],所用培养基为LB培养基。
1.1.2 仪器
Agilent 1260 Infinity Ⅱ半制备型液相色谱,Agilent 1260分析型高效液相色谱,中国安捷伦科技有限公司;Bruker DRX-500MHz核磁共振光谱仪,布鲁克德国Bruker公司。
1.2 实验方法
1.2.1 L.plantarum C010发酵液的制备
将活化后的L.plantarum C010种子液以2%(体积分数)的接种量接入新鲜MRS培养基中,37 ℃下静置培养至生长稳定期,即为L.plantarum C010发酵液。取3 000 mL发酵液于6 000 r/min离心10 min,去沉淀,保留无细胞上清液用0.22 μm无菌滤膜抽滤后于-20 ℃冷藏备用。
1.2.2 L.plantarum C010产细菌素初步提取及比较
采用硫酸铵沉淀法、有机试剂萃取法和pH吸附解析法从L.plantarum C010发酵液中初步提取细菌素:(1)硫酸铵沉淀法:将上述上清液50 mL加入不同含量的硫酸铵中,使硫酸铵终饱和度分别为40%、50%、60%、70%、80%和90%,盐析12 h后离心,所得沉淀用1 mL pH 6.0磷酸缓冲液溶解;(2)有机试剂萃取法:①有机试剂的选择:将上述上清液50 mL分别与乙酸乙酯、正丁醇、无水乙醇、甲醇、三氯甲烷以1∶1(体积比)萃取,所得萃取液于合适温度下旋干并用1 mL pH 6.0磷酸缓冲液溶解,同时将50 mL上清液旋蒸至1 mL作为对照组;②抽提比例的优化:选取较优有机试剂与发酵上清液分别以1∶1、2∶1、3∶1和 4∶1 (体积比)进行萃取,所得萃取液旋干并用1 mL pH 6.0的磷酸缓冲液溶解;(3)pH吸附解析法:参照顾雅昕等[14]方法并加以修改。将上述发酵液50 mL于70 ℃水浴30 min,以杀死活性细胞及钝化酶活力,用NaOH溶液分别调pH至5.5、5.8、6.1、6.4、6.7、7.0,磁力搅拌1 h使细菌素充分吸附在细胞膜表面,6 000 r/min离心10 min去除菌体,用pH 7.0磷酸缓冲液充分洗涤菌体,用HCl溶液将pH分别调至1.6、1.7、1.8、1.9、2.0、2.1解析1 h,离心所得上清液经冷冻干燥得到粗提粉末,用1 mL pH 6.0磷酸缓冲液溶解;(4)粗提细菌素抑菌活性的检测:将上述粗提品分别以P.koreensis PS1、B.fusiformis J4为指示菌,采用牛津杯双层琼脂扩散法测定不同处理下粗提细菌素的抑菌效果,用十字交叉法测定其抑菌圈直径。每个处理重复3次。
1.2.3 L.plantarum C010产细菌素的分离纯化
将2 mL抑菌效果较好的粗品经0.22 μm微膜过滤,以pH 6.0磷酸缓冲液为流动相上样于葡聚糖凝胶Sephadex G-25层析柱(直径1.6 cm×柱高60 cm)中,自动收集各馏分,以P.koreensis PS1为指示菌测定抑菌活性,所得具有活性的馏分旋干后用80%(体积分数,下同)甲醇等体积复溶,用Sephadex LH-20层析柱(直径1.6 cm×柱高120 cm)进一步纯化,以80%色谱级甲醇为流动相,自动收集各馏分,按上述方法验证活性后,将具有活性的馏分用紫外分光光度计在波长190~700 nm进行扫描,其最大吸收峰作为HPLC的检测波长。
1.2.4 半制备高效液相色谱纯化
将经过Sephadex LH-20纯化得到的活性组分用0.22 μm微膜过滤,用岛津半制备液相LC-20AR色谱Venusil XBP C18柱进一步纯化。制备条件为:A液:含0.1%(体积分数,下同)甲酸的水;B液:含0.1%甲酸的乙腈;上样量0.5 mL,检测波长215 nm,流速1 mL/min,洗脱程序为:0~20 min,流动相B 0%~60%, 20~25 min,流动相B 60%~100%,25~30 min,流动相B保持100%,收集具有抑菌活性的液相色谱洗脱组分,所得活性洗脱组分重新上样于高效液相色谱,检测其纯度并于冷冻干燥后置于-80 ℃冰箱储存。
1.2.5 细菌素纯度及分子质量的检测
将半制备高效液相色谱收集得到的具有抑菌活性的组分用HPLC检验纯度[9]。样品经0.22 μm微膜过滤,用安捷伦1260高效液相色谱ZORBX Eclipse Plus C18检测,检测条件为:A液:含0.1%(体积分数,下同)三氟乙酸的水;B液:含0.1%三氟乙酸的乙腈;上样量0.1 mL,检测波长215 nm,流速1 mL/min,洗脱程序为:0~20 min,流动相B 0%~60%,20~25 min,流动相B 60%~100%,25~30 min,流动相B保持100%。
1.2.6 细菌素的结构鉴定
采用DFS快原子轰击离子源质谱仪对该单一活性组分进行分子量测定,电轰击电离模式(electron ionization mass spectrometry,EI-MS)检测,并用Bruker DRX-500MHz核磁共振光谱仪进一步解析其结构。
1.2.7 细菌素理化稳定性测定
热稳定性实验:将提纯样品粉末用去离子水复溶后于60、80、100 ℃水浴60 min,121 ℃处理20 min,待温度恢复至室温检测抑菌活性。
pH稳定性实验:将提纯样品粉末用去离子水复溶后,用1 mol/L HCl溶液分别将pH值调至3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0,并以不调pH的溶液为阴性对照,同等pH值的HCl溶液为阳性对照,37 ℃下处理测定其抑菌活性。
酶解稳定性实验:将提纯样品粉末用去离子水复溶后调至胰蛋白酶、胃蛋白酶、过氧化氢酶、脂肪酶、淀粉酶和蛋白酶K等的最适pH,加入终质量浓度为2 mg/mL的酶,于最适温度下反应2 h,调回pH检测抑菌活性。
2 结果与分析
2.1 L.plantarum C010产细菌素的粗提结果
试验采用3种不同方法对L.plantarum C010产细菌素进行粗提,通过双层琼脂平板扩散法以冷却猪肉特定致腐菌P.koreensis PS1和B.fusiformis J4为指示菌进行抑菌活性检测。
由表1、表2可知,在硫酸铵盐析法中,随着溶解度的升高,抑菌效果增强,在饱和度为80%时抑菌效果最佳。在有机试剂萃取法中,乙酸乙酯和正丁醇提取活性物质对特定致腐菌P.koreensis PS1、B.fusiformis J4的抑菌效果接近于上清浓缩液,显著高于甲醇、乙醇和三氯甲烷。但正丁醇沸点大于乙酸乙酯,不利于后期有机试剂的旋转蒸发,之后进一步将乙酸乙酯和发酵上清液按不同体积比进行萃取。V(乙酸乙酯)∶V(上清液)=4∶1时,提取的活性物质抑菌效果最佳。乙酸乙酯萃取时会伴随棕褐色物质的聚沉,推测为杂质蛋白,但不影响对该细菌素的萃取,萃取效率较高。
表1 L.plantarum C010发酵液硫酸铵和有机试剂提取细菌素的抑菌效果
Table 1 Antibacterial effect of bacteriocin from L.plantarum C010 by saturated ammonium sulfate and ethyl acetate extraction

硫酸铵饱和度/%抑菌圈直径/mmP.koreensis PS1B.fusiformis J4有机试剂抑菌圈直径/mmP.koreensis PS1B.fusiformis J4上清液--上清浓缩液38.23±0.64a42.85±0.26a40-11.45±1.64b甲醇25.9±0.7d27.96±1.14c50-11.52±1.47b乙醇26.38±0.56d27.63±1.9c60-11.42±2.21b乙酸乙酯35.49±0.48b36.02±1.49b7012.56±0.65b13.12±1.01ab三氯甲烷22.44±1e23.48±2.14d8014.7±0.97a15.72±0.72a正丁醇33.88±0.95c37.42±0.94b9014.67±1.06a14.21±1.25ab乙酸乙酯∶上清液(体积比)0∶138.23±0.64b42.85±0.26a1∶135.49±0.48c36.02±1.49c2∶137.53±0.25b39.54±0.56b3∶136±0.59c39.57±0.18b4∶142.13±0.54a42.93±0.12a
注:同列不同字母表示差异显著(P<0.05)(下同)、“-”代表不具有抑菌活性
如表2所示,在吸附解析中,利用单因素变量法优化吸附和解析pH时,当吸附pH为6.7、解析pH为1.8时提取活性物质抑菌效果最佳,但该法提取效率仍低于乙酸乙酯萃取法。因此,在L.plantarum C010发酵上清液细菌素提取中,乙酸乙酯萃取优于pH吸附解析和硫酸铵沉淀法。DÜNDAR等[18]对屎肠球菌(Enterococcus faecium) W3细菌素提取过程中,pH吸附解吸法得到的样品活性为原上清液活性的16%,约是硫酸铵沉淀法的4倍。顾雅昕等[14]对发酵乳杆菌LBM97所产细菌素提取进行比较,发现硫酸铵沉淀法、乙酸乙酯抽提法和pH吸附解吸法均能获得目的蛋白,且pH吸附解吸法得到的细菌素样品表现出最稳定的抑菌活性。可见不同菌种发酵液中细菌素的适宜提取方法存在差异,这可能与细菌种属以及存在环境的差异有关,也可能与细菌素本身的理化性质如分子质量大小、亲疏水性等的差异有关。
表2 L.plantarum C010发酵液pH吸附解析提取细菌素抑菌效果
Table 2 Antibacterial effect of bacteriocin from L.plantarum C010 by pH adsorption/desorption
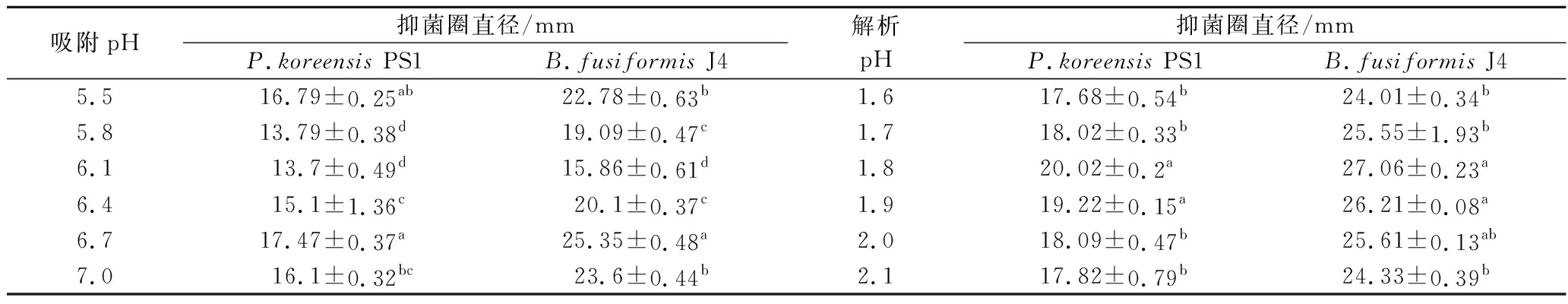
吸附pH抑菌圈直径/mmP.koreensis PS1B.fusiformis J4解析pH抑菌圈直径/mmP.koreensis PS1B.fusiformis J45.516.79±0.25ab22.78±0.63b1.617.68±0.54b24.01±0.34b5.813.79±0.38d19.09±0.47c1.718.02±0.33b25.55±1.93b6.113.7±0.49d15.86±0.61d1.820.02±0.2a27.06±0.23a6.415.1±1.36c20.1±0.37c1.919.22±0.15a26.21±0.08a6.717.47±0.37a25.35±0.48a2.018.09±0.47b25.61±0.13ab7.016.1±0.32bc23.6±0.44b2.117.82±0.79b24.33±0.39b
2.2 L.plantarum C010产细菌素的凝胶层析
发酵上清液经乙酸乙酯萃取后,经Sephadex G-25凝胶得到的各馏分对特定致腐菌P.koreensis PS1进行抑菌活性检测,在22~26管收集液中具有明显的抑菌活性(图1-a);将这些收集液合并再经Sephadex LH-20凝胶层析,测得第17~22管之间的层析组分液均具有较强抑菌活性(图1-b)。该抑菌活性组分液在波长215 nm处有明显的紫外吸收峰,故选取215 nm作为高效液相色谱纯化检测波长。
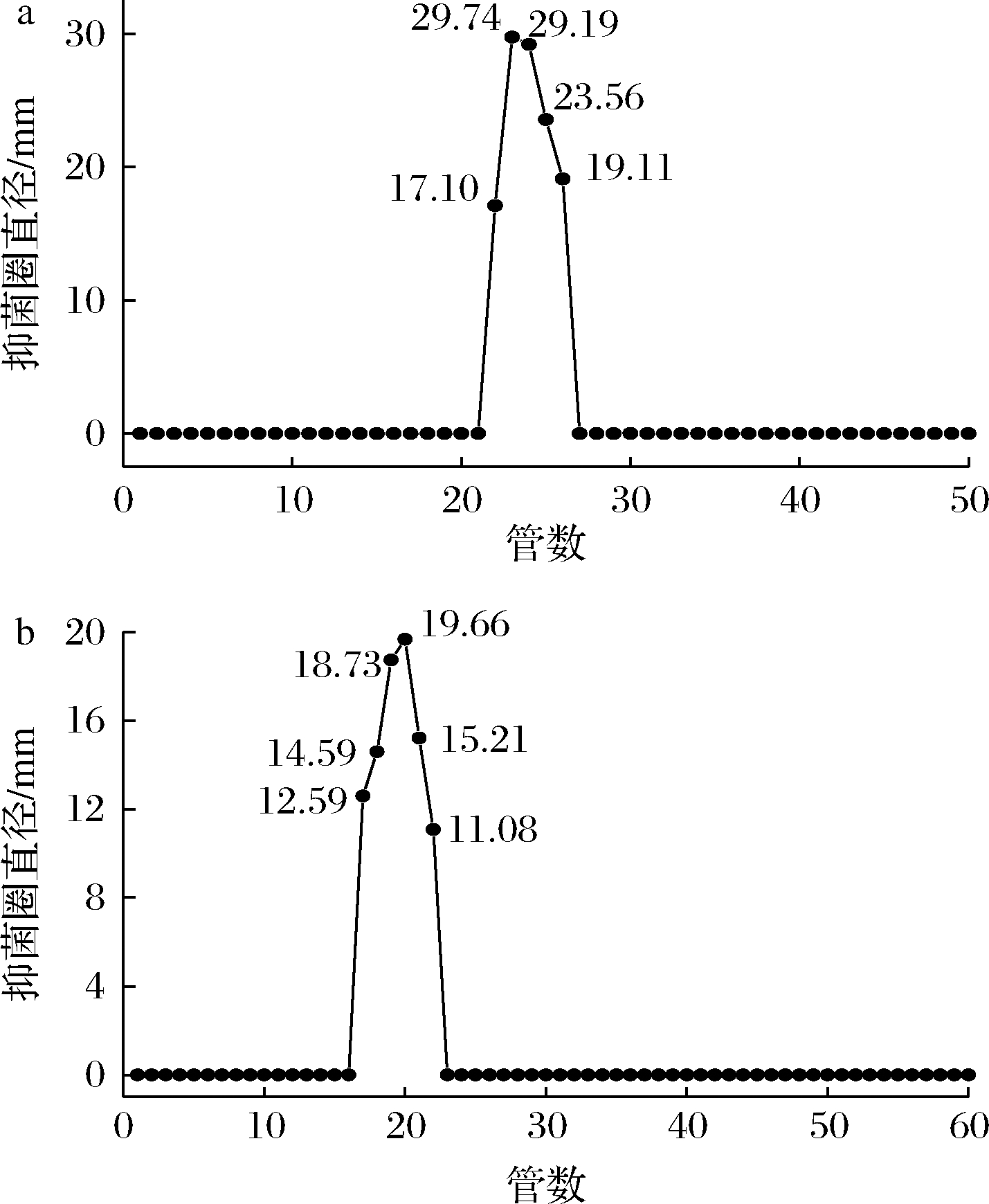
a-G-25层析洗脱曲线;b-LH-20层析洗脱曲线
图1 Sephadex层析曲线
Fig.1 The elution curve of Sephadex
2.3 L.plantarum C010产细菌素的半制备高效液相色谱纯化
反相高效液相色谱是纯化细菌素的高效方法,据前人[8,19-20]报道采用该方法纯化得到了细菌素。由图2可知,在L.plantarum C010发酵上清液抑菌活性组分液中仍存在多种物质,但仅在5.894 min的收集液具有较强抑菌活性,其对特定致腐菌P.koreensis PS1和B.fusiformis J4抑菌圈直径分别为15.12和18.46 mm,故选择该组分进行下一步纯化。
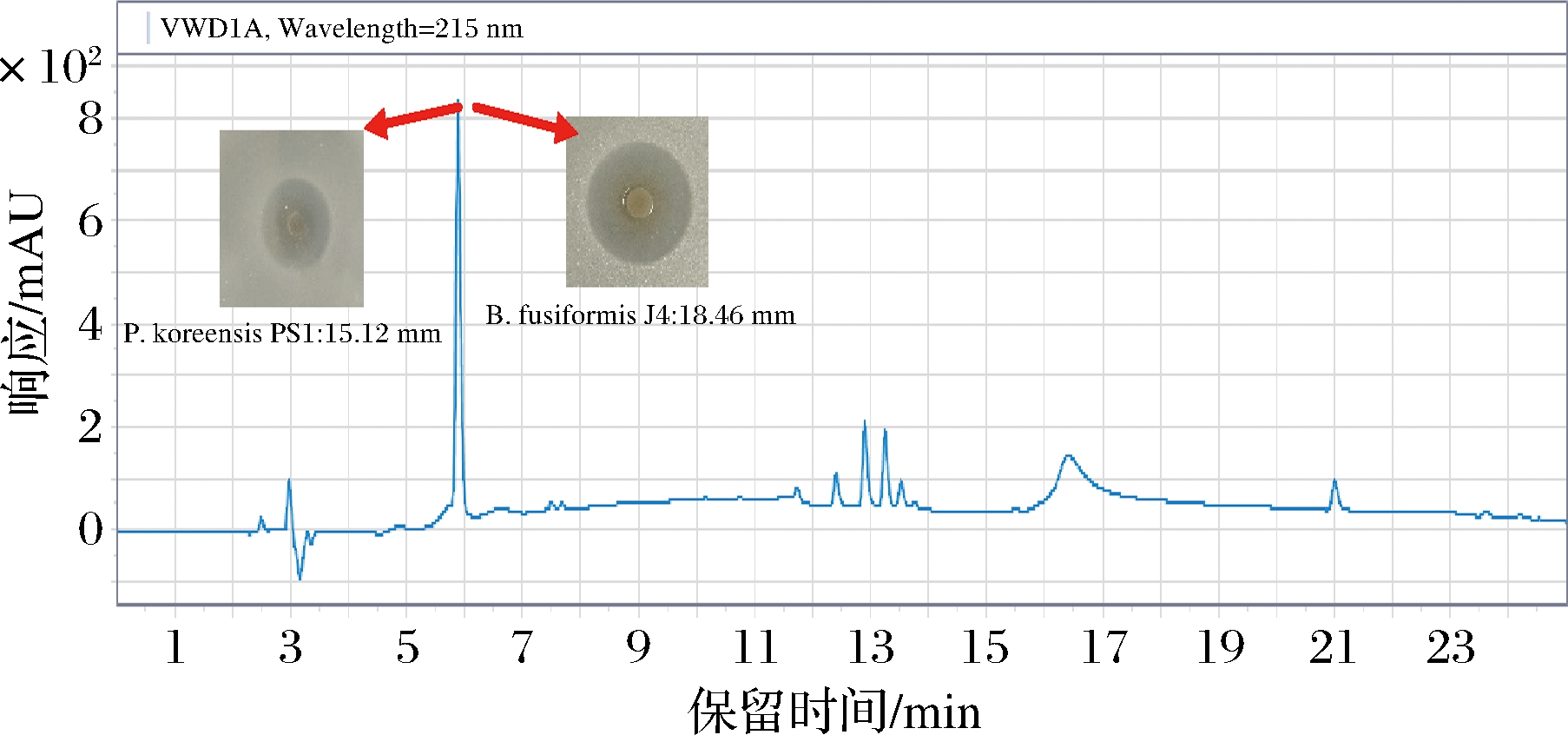
图2 L.plantarum C010抑菌活性组分的半制备高效液相色谱图
Fig.2 Semi-preparative HPLC graph of antibacterial active components from L.plantarum C010
2.4 L.plantarum C010产细菌素的纯度及分子质量检测
将经半制备高效液相色谱纯化得到的抑菌活性组分液经HPLC检验纯度达90%以上,将上述纯化得到的单一抑菌活性组分物质经EI质谱分析,得出该组分物质分子质量为260.116 1 Da(图3)。
核磁共振图谱(nuclear magnetic resonance spectroscopy,NMR)分析数据如下:1H NMR (500 MHz, Methanol-d4) δ 7.34~7.17 (m,5H),4.48 (td,J=5.1,1.9 Hz,1H),4.36 (ddd,J=11.7,5.9,1.9 Hz,1H),4.27 (t,J=4.8 Hz,1H),3.79~3.64 (m,1H),3.16 (t,J=4.6 Hz,2H),2.10~2.01 (m,1H),1.36 (ddd,J=12.9,11.7,4.6 Hz,1H),1.04~0.87 (m,1H).13C NMR (126 MHz,MeOD) δ 171.24,167.08,137.38,131.00,129.46,128.06,68.51,58.32,57.59,55.23,38.86,37.98。结合NMR谱推测分子式为C14H16N2O3。经查阅,该核磁共振图谱与文献[21]基本一致,该化合物鉴定为环(L-苯丙氨酰-反式-4-羟基-L-脯氨酸[Cyclo(L-Phe-trans-4-hydroxy-L-Pro])二肽[22],命名为细菌素Plantarum C010。按分子质量大小可以将其划分为Ⅰ类细菌素。该细菌素虽然早在2000年被发现[23],但是关于它的抑菌活性的研究较少;常见于内生放线菌、分歧杆菌、链霉菌等菌属中[21],但首次从乳酸菌属中分离提取得到该物质。如ERAM等[24]明确指出Cyclo (L-Phe-trans-4-hydroxy-L-Pro)二肽具有抑菌活性,但未做深入研究。KHALIL等[25]从澳大利亚浅水海滩的细菌中得到该物质,且具有抑真菌活性。LEE等[26]从海洋细菌灰链霉菌中提取的该物质具有抗HL-60癌细胞活性。
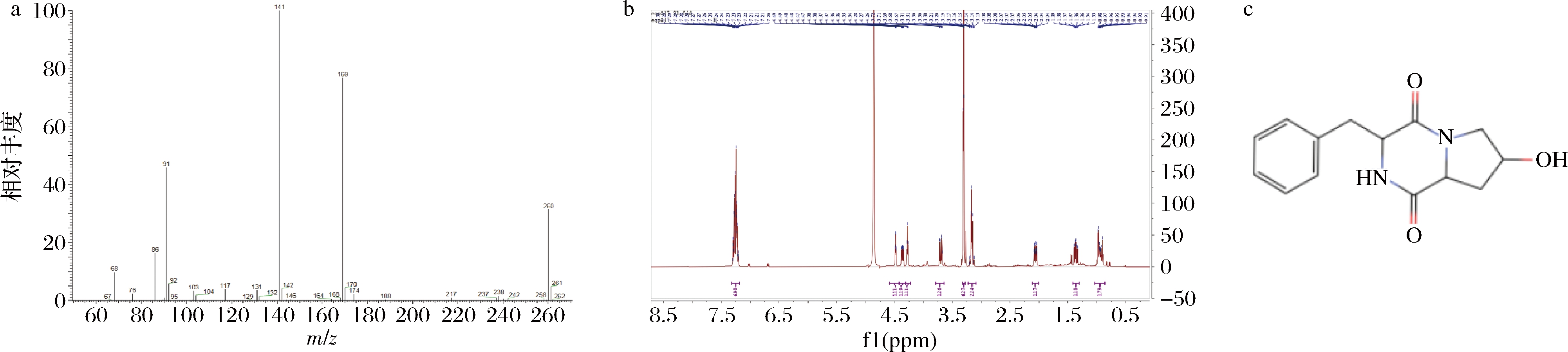
a-EI质谱图;b-核磁共振1H谱图;c-结构式
图3 L.plantarum C010细菌素EI质谱图、1H NMR图谱及化学结构式
Fig.3 EI mass spectra, 1H NMR spectrum and chemical structural formula of bacteriocin from L.plantarum C010
2.5 细菌素Plantarum C010理化稳定性分析结果
目前,已关于Cyclo (L-Phe-trans-4-hydroxy-L-Pro)二肽的研究报道,其理化稳定性的研究甚少,且不同细菌素抑菌效率和抑菌特性各有不同,同一细菌素在不同条件下抑菌活性也有所不同,不同外部环境也会影响细菌素的结构、性质和抑菌效果。故细菌素的抑菌稳定性在很大程度上决定了其实际应用价值。因此,探究细菌素在环境中的稳定性对其后续研究及应用具有极其重要的意义。
表3结果表明,细菌素Plantarum C010在不同温度处理下对B.fusiformis J4抑菌活性没有表现出显著性差异,而在121 ℃处理20 min条件下对P.koreensis PS1抑菌活性略有下降,但相较于CK组仍然保持95%以上抑菌活性,说明该细菌素具有较强的耐热稳定性。
表3 L.plantarum C010产细菌素抑菌稳定性
Table 3 Bacteriostatic stability of bacteriocin from L.plantarum C010
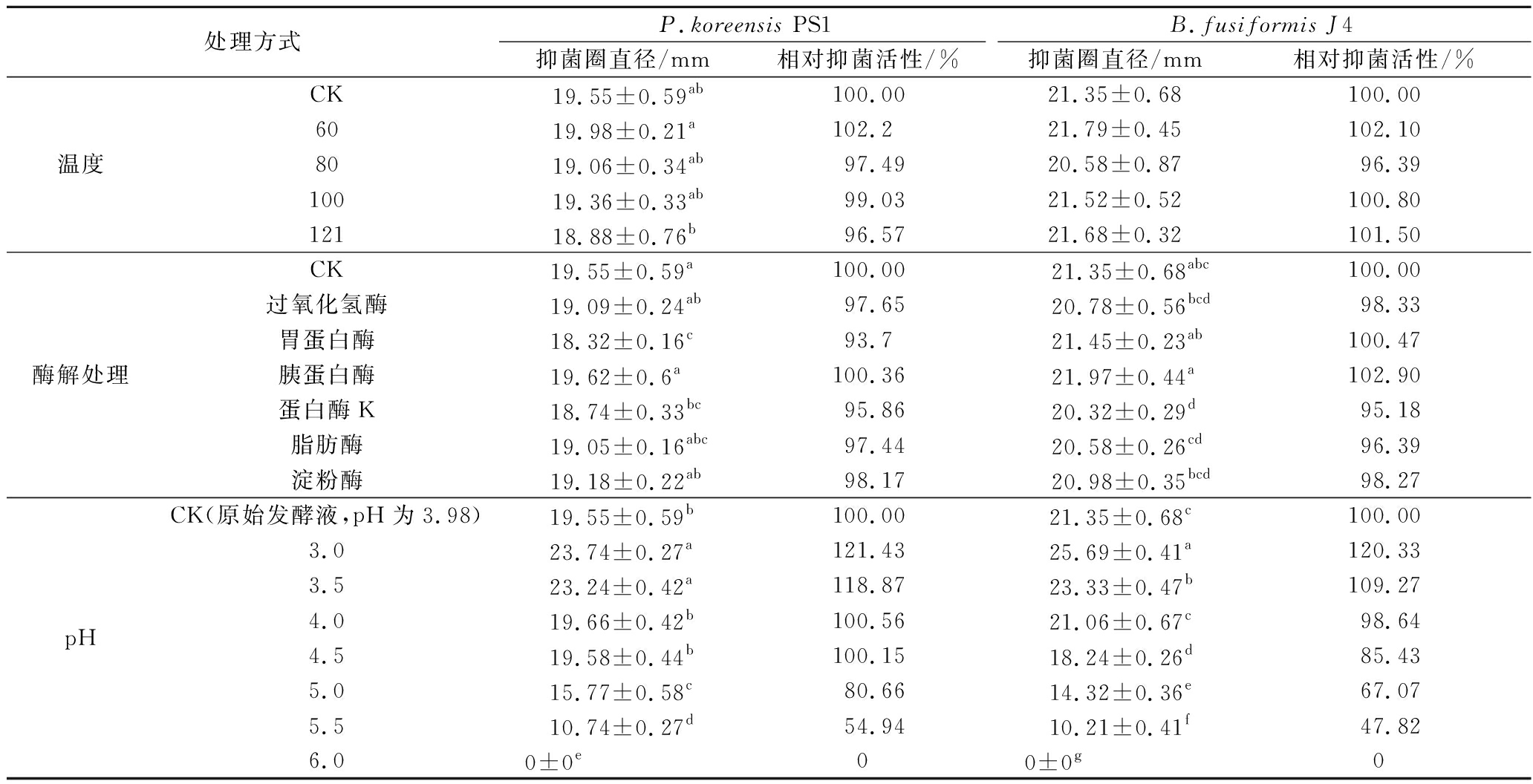
处理方式P.koreensis PS1B.fusiformis J4抑菌圈直径/mm相对抑菌活性/%抑菌圈直径/mm相对抑菌活性/%温度CK19.55±0.59ab100.0021.35±0.68100.006019.98±0.21a102.221.79±0.45102.108019.06±0.34ab97.4920.58±0.8796.3910019.36±0.33ab99.0321.52±0.52100.8012118.88±0.76b96.5721.68±0.32101.50酶解处理CK19.55±0.59a100.00 21.35±0.68abc100.00过氧化氢酶19.09±0.24ab97.6520.78±0.56bcd98.33胃蛋白酶18.32±0.16c93.721.45±0.23ab100.47胰蛋白酶19.62±0.6a100.3621.97±0.44a102.90蛋白酶K18.74±0.33bc95.8620.32±0.29d95.18脂肪酶19.05±0.16abc97.4420.58±0.26cd96.39淀粉酶19.18±0.22ab98.1720.98±0.35bcd98.27pHCK(原始发酵液,pH为3.98)19.55±0.59b100.0021.35±0.68c100.003.023.74±0.27a121.4325.69±0.41a120.333.523.24±0.42a118.8723.33±0.47b109.274.019.66±0.42b100.5621.06±0.67c98.644.519.58±0.44b100.1518.24±0.26d85.435.015.77±0.58c80.6614.32±0.36e67.075.510.74±0.27d54.9410.21±0.41f47.826.00±0e0 0±0g0
在细菌素耐受pH试验中,同等pH下的盐酸对P.koreensis PS1和B.fusiformis J4均没有抑菌活性,说明不是酸引起的抑菌作用,而是细菌素产生的抑菌效果。由表3可知,在pH为3.0~5.5时,细菌素具有较强抑菌活性,当pH在5.0~6.0时,抑菌活性显著减弱甚至失活。
在细菌素酶解试验中,利用胰蛋白酶、胃蛋白酶、过氧化氢酶、脂肪酶、淀粉酶和蛋白酶K分别处理纯化后的细菌素,对P.koreensis PS1和B.fusiformis J4抑菌活性均无明显改变(表3)。这与EL-GENDY等[27]所研究的细菌素enterocin OS13β一样耐高温和具有多重酶等特性,说明该细菌素不具有大分子蛋白质属性,或者说是一种不具有某些特异性酶切位点的小肽类化学物质。
综上所述,本研究从植物乳杆菌C010发酵上清液中分离纯化的细菌素Plantarum C010,具有较好的热稳定性,这可能与Cyclo (L-Phe-trans-4-hydroxy-L-Pro)二肽的环形结构有关,使其相对于简单二肽类化合物的稳定性更强。其次,当pH>5.5时,环二肽失活可能由于羟脯氨酸中的羧基发生化学反应形成酯,导致二肽的环型结构被破坏,活性相应降低甚至失活。此外,与近年来的新型小分子肽细菌素[8-12]相比,该Cyclo (L-Phe-trans-4-hydroxy-L-Pro)二肽细菌素对上述6种酶均具有较强的耐受性,也使其具有更好的应用潜力。
3 结论
本研究采用3种不同提取方法对L.plantarum C010所产细菌素的提取效果进行比对分析,提取效率为:乙酸乙酯>吸附解析>硫酸铵盐析;采用“三步法”分离纯化L.plantarum C010细菌素:乙酸乙酯萃取、Sephadex凝胶层析、半制备高效液相色谱,获得单一抑菌活性组分物质,经质谱和核磁共振解析发现该物质是分子质量为260.116 1 Da的Cyclo (L-Phe-trans-4-hydroxy-L-Pro)二肽类化合物,命名为细菌素Plantarum C010,并首次发现于植物乳杆菌属。目前,该细菌素的抗菌特性研究较少,仅证实了对真菌和癌细胞有抑制作用。本研究证实了该细菌素对革兰氏阳性细菌B.fusiformis J4和革兰氏阴性细菌P.koreensis PS1均具有较强的抑制活性,且耐热性强,在121 ℃处理20 min对特定致腐菌P.koreensis PS1和B.fusiformis J4抑菌活性仍为96.57%和101.5%;该细菌素在pH 3.0~5.0时,具有较强抑菌活性,但在pH>5.0时抑菌活性显著下降甚至失活;经过氧化氢酶、脂肪酶、淀粉酶及蛋白酶等处理该细菌素抑菌活性无明显改变。该结果丰富了植物乳杆菌所产抗菌活性产物的多样性,同时,为L.plantarum C010所产细菌素的分离纯化及保鲜应用提供理论基础和数据支持。
[1] HU M Z, ZHAO H Z, ZHANG C, et al.Purification and characterization of plantaricin 163, a novel bacteriocin produced by Lactobacillus plantarum 163 isolated from traditional Chinese fermented vegetables[J].Journal of Agricultural and Food Chemistry, 2013, 61(47):11 676-11 682.
[2] WORAPRAYOTE W, MALILA Y, SORAPUKDEE S, et al.Bacteriocins from lactic acid bacteria and their applications in meat and meat products[J].Meat Science, 2016, 120:118-132.
[3] BAPTISTA R C, HORITA C N, SANT’ANA A S.Natural products with preservative properties for enhancing the microbiological safety and extending the shelf-life of seafood:A review[J].Food Research International, 2020, 127:108762.
[4] COTTER P D, ROSS R P, HILL C.Bacteriocins:A viable alternative to antibiotics?[J].Nature Reviews Microbiology, 2013, 11(2):95-105.
[5] LEE S Y, YIM D G, DA YOUNG LEE, et al.Overview of the effect of natural products on reduction of potential carcinogenic substances in meat products[J].Trends in Food Science & Technology, 2020, 99:568-579.
[6] CINTAS L M, CASAUS M P, HERRANZ C, et al.Review:bacteriocins of lactic acid bacteria[J].Food Science and Technology International, 2001, 7(4):281-305.
[7] CINTAS L M, CASAUS P, FERN NDEZ M F, et al.Comparative antimicrobial activity of enterocin L50, pediocin PA-1, nisin A and lactocin S against spoilage and foodborne pathogenic bacteria[J].Food Microbiology, 1998, 15(3):289-298.
NDEZ M F, et al.Comparative antimicrobial activity of enterocin L50, pediocin PA-1, nisin A and lactocin S against spoilage and foodborne pathogenic bacteria[J].Food Microbiology, 1998, 15(3):289-298.
[8] RASHEED H A, TUOHETI T, ZHANG Y Z, et al.Purification and partial characterization of a novel bacteriocin produced by bacteriocinogenic Lactobacillus fermentum BZ532 isolated from Chinese fermented cereal beverage (Bozai)[J].LWT, 2020, 124:109113.
[9] AN Y, WANG Y, LIANG X Y, et al.Purification and partial characterization of M1-UVs300, a novel bacteriocin produced by Lactobacillus plantarum isolated from fermented sausage[J].Food Control, 2017, 81:211-217.
[10] HU Y X, LIU X L, SHAN C J, et al.Novel bacteriocin produced by Lactobacillus alimentarius FM-MM4 from a traditional Chinese fermented meat Nanx Wudl:Purification, identification and antimicrobial characteristics[J].Food Control, 2017, 77:290-297.
[11] GAO Y R, LI D P, LIU S, et al.Garviecin LG34, a novel bacteriocin produced by Lactococcus garvieae isolated from traditional Chinese fermented cucumber[J].Food Control, 2015, 50:896-900.
[12] 辛维岗, 江宇航, 陈诗雨, 等.滇池金线鲃肠道产细菌素细菌的筛选鉴定及细菌素LSP01的抑菌作用[J].微生物学通报, 2022, 49(1):242-255.
XIN W G, JIANG Y H, CHEN S Y, et al.Screening and identification of bacteriocin-producing bacteria in the intestines of Sinocyclocheilus grahami in Dianchi and the antibacterial effect of bacteriocin LSP01[J].Microbiology China, 2022, 49(1):242-255.
[13] SIDOOSKI T, BRANDELLI A, BERTOLI S L, et al.Physical and nutritional conditions for optimized production of bacteriocins by lactic acid bacteria:A review[J].Critical Reviews in Food Science and Nutrition, 2019, 59(17):2 839-2 849.
[14] 顾雅昕, 乔柱, 郭行, 等.发酵乳杆菌LBM97所产细菌素提取方法的优化及比较[J].食品与发酵工业, 2020, 46(19):111-116.
GU Y X, QIAO Z, GUO X, et al.Optimization and comparison of extraction methods of bacteriocin produced by Lactobacillus fermentum LBM97[J].Food and Fermentation Industries, 2020, 46(19):111-116.
[15] DAI J Y, FANG L M, ZHANG M M, et al.Isolation and identification of new source of bacteriocin-producing Lactobacillus plantarum C010 and growth kinetics of its batch fermentation[J].World Journal of Microbiology & Biotechnology, 2022, 38(4):67.
[16] 方利敏. 产细菌素乳酸菌的筛选鉴定及其细菌素合成的培养优化及诱导作用研究[D].南昌:江西农业大学, 2021.
FANG L M.Isolation and identification of bacteriocin-producing lactic acid bacteria and study on their culture optimization and induction of bacteriocin synthesis[D].Nanchang:Jiangxi Agricultural University, 2021.
[17] 黄林, 陈全胜, 张燕华, 等.冷却猪肉优势腐败菌分离鉴定及致腐能力测定[J].食品科学, 2013, 34(1):205-209.
HUANG L, CHEN Q S, ZHANG Y H, et al.Isolation, identification and spoilage capability of dominant spoilage bacteria in chilled pork[J].Food Science, 2013, 34(1):205-209.
[18] DÜNDAR H, ATAKAY M, ÇELIKB ÇAK Ö, et al.Comparison of two methods for purification of enterocin B, a bacteriocin produced by Enterococcus faecium W3[J].Preparative Biochemistry & Biotechnology, 2015, 45(8):796-809.
ÇAK Ö, et al.Comparison of two methods for purification of enterocin B, a bacteriocin produced by Enterococcus faecium W3[J].Preparative Biochemistry & Biotechnology, 2015, 45(8):796-809.
[19] ZHANG Y, YANG J M, LIU Y, et al.A novel bacteriocin PE-ZYB1 produced by Pediococcus pentosaceus zy-B isolated from intestine of Mimachlamys nobilis:Purification, identification and its anti-listerial action[J].LWT, 2020, 118:108760.
[20] 徐栋, 王晓琪, 王月姣, 等.植物乳杆菌LZ222细菌素的分离纯化及其特性[J].中国食品学报, 2018, 18(12):157-163.
XU D, WANG X Q, WANG Y J, et al.Characterization and purification of a bacteriocin produced by Lactobacillus plantarum LZ222[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(12):157-163.
[21] ZHOU H, YANG Y B, YANG X Q, et al.A new cyclic tetrapeptide from an endophytic Streptomyces sp.YIM67005[J].Natural Product Research, 2014, 28(5):318-323.
[22] BERTINETTI B, PE A N, CABRERA G.An antifungal tetrapeptide from the culture of Penicillium canescens[J].Chemistry & Biodiversity, 2009, 6(8):1 178-1 184.
A N, CABRERA G.An antifungal tetrapeptide from the culture of Penicillium canescens[J].Chemistry & Biodiversity, 2009, 6(8):1 178-1 184.
[23] JIANG Z, BOYD K G, MEARNS-SPRAGG A, et al.Two diketopiperazines and one halogenated phenol from cultures of the marine bacterium, Pseudoalteromonas luteoviolacea[J].Natural Product Letters, 2000, 14(6):435-440.
[24] ERAM D, ARTHIKALA M K, MELAPPA G, et al.Alternaria species:Endophytic fungi as alternative sources of bioactive compounds[J].Italian Journal of Mycology, 2018, 47:40-54.
[25] KHALIL Z G, CRUZ-MORALES P, LICONA-CASSANI C, et al.Inter-Kingdom beach warfare:Microbial chemical communication activates natural chemical defences[J].The ISME Journal, 2019, 13(1):147-158.
[26] LEE J H, ZHANG C, KO J Y, et al.Evaluation on anticancer effect against HL-60 cells and toxicity in vitro and in vivo of the phenethyl acetate isolated from a marine bacterium Streptomyces griseus[J].Fisheries and Aquatic Sciences, 2015, 18(1):35-44.
[27] EL-GENDY A O, BREDE D A, ESSAM T M, et al.Purification and characterization of bacteriocins-like inhibitory substances from food isolated Enterococcus faecalis OS13 with activity against nosocomial enterococci[J].Scientific Reports, 2021, 11:3795.