发酵食品因具有促进人体健康、特殊风味和便于储藏等优点而深受消费者喜爱。然而, 在其加工过程中, 因微生物代谢活动可产生和蓄积氨基甲酸乙酯、亚硝酸盐和生物胺等有害物质。其中,生物胺作为一类具有生物活性的低分子质量、极性或半极性含氮有机化合物,广泛存在于发酵豆制品、酒精饮料、乳制品等发酵食品中,是食品细菌性腐败的重要化学标志物。值得注意的是,由于生物、化学和物理等条件的影响,生物胺的产生难以杜绝或抑制,且生物胺一旦形成则难以被破坏。因此,生物胺不仅降低发酵食品的品质, 还影响消费者身体健康,已然成为发酵食品面临的严峻安全问题[1]。目前,对于食品中生物胺的形成机制及其检测已有较成熟的理论方法, 但对于如何抑制或清除食品中生物胺却仍缺乏有效措施。为此,基于发酵食品行业对抑制或消除生物胺的迫切需求, 本文在详尽阐明当前发酵食品中生物胺生理特性、形成机制及其影响因素的基础上,重点阐述了食品中生物胺检测技术及其防控策略等方面的研究进展, 以期为降低食品中生物胺产生的风险、提升发酵食品的品质和安全性、促进发酵食品行业的健康发展提供理论技术参考。
1 生物胺的生理特性
生物胺按其化学结构可分为脂肪胺(腐胺、精胺和亚精胺等)、芳香胺(酪胺、苯乙胺等)和杂环胺(组胺、色胺);而根据氨基数量可分为多胺类(精胺、亚精胺)和单胺类(酪胺、色胺)[2]。此外,按其来源还可分为内源性和外源性生物胺,而外源性生物胺是发酵食品中生物胺类风险物质的主要来源,包括色胺、2-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺等,其中组胺和酪胺毒性最大, 与食品的安全性也最为相关[3]。
1.1 生物胺的生理活性及毒性作用
生物有机体内存在微量内源性生物胺,可作为多种活性物质、生物碱、核苷酸、蛋白质等前体物,具有生长调节、神经传递、炎症介质等功能,是生物细胞的重要组成部分。在正常生理条件下,食物中的生物胺可被小肠黏膜上胺氧化酶(如单胺氧化酶和二胺氧化酶)迅速分解, 因此摄入适量生物胺不会对人体产生危害。然而, 当特定酶功能失调或摄入高浓度生物胺时, 未被降解的生物胺则进入血液循环, 进而对不同器官产生毒性作用, 危害人体健康。如表1所示,食用高组胺发酵食物可引发炎症相关疾病, 如克罗恩病、溃疡性结肠炎、结肠肿瘤等;而过量摄入酪胺则引起高血压、头痛、出汗和瞳孔扩张等不良反应。值得注意的是,虽腐胺、尸胺等生物胺毒性较小,但却能与亚硝酸盐反应生成亚硝胺,且还可结合二胺氧化酶以降低其解毒能力,进而协同增加组胺和酪胺的毒性作用[4]。
表1 生物胺的生理活性及在不同食品中的限量标准
Table 1 Biological activities of biogenic amines and the maximum limits in different foods
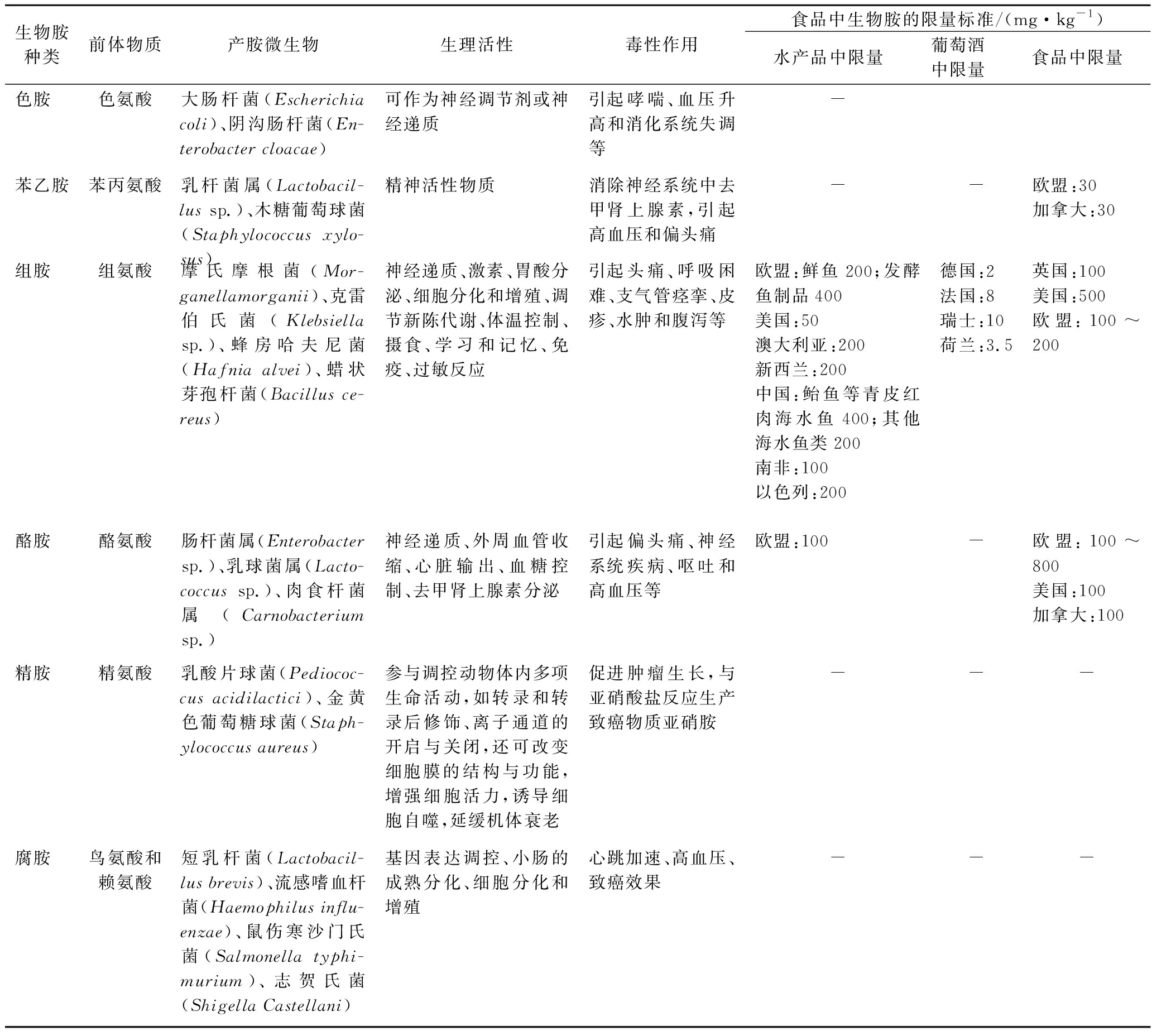
生物胺种类前体物质产胺微生物生理活性毒性作用食品中生物胺的限量标准/(mg·kg-1)水产品中限量葡萄酒中限量食品中限量色胺色氨酸大肠杆菌(Escherichia coli)、阴沟肠杆菌(En-terobacter cloacae)可作为神经调节剂或神经递质引起哮喘、血压升高和消化系统失调等-苯乙胺苯丙氨酸乳杆菌属(Lactobacil-lus sp.)、木糖葡萄球菌(Staphylococcus xylo-sus)精神活性物质消除神经系统中去甲肾上腺素,引起高血压和偏头痛--欧盟:30加拿大:30组胺组氨酸摩氏摩根菌(Mor-ganellamorganii)、克雷伯氏菌(Klebsiella sp.)、蜂房哈夫尼菌(Hafnia alvei)、蜡状芽孢杆菌(Bacillus ce-reus)神经递质、激素、胃酸分泌、细胞分化和增殖、调节新陈代谢、体温控制、摄食、学习和记忆、免疫、过敏反应引起头痛、呼吸困难、支气管痉挛、皮疹、水肿和腹泻等欧盟:鲜鱼200;发酵鱼制品400美国:50澳大利亚:200新西兰:200中国:鲐鱼等青皮红肉海水鱼400;其他海水鱼类200南非:100以色列:200德国:2法国:8瑞士:10荷兰:3.5英国:100美国:500欧盟:100~200酪胺酪氨酸肠杆菌属(Enterobacter sp.)、乳球菌属(Lacto-coccus sp.)、肉食杆菌属(Carnobacterium sp.)神经递质、外周血管收缩、心脏输出、血糖控制、去甲肾上腺素分泌引起偏头痛、神经系统疾病、呕吐和高血压等欧盟:100-欧盟:100~800美国:100加拿大:100精胺精氨酸乳酸片球菌(Pediococ-cus acidilactici)、金黄色葡萄糖球菌(Staph-ylococcus aureus)参与调控动物体内多项生命活动,如转录和转录后修饰、离子通道的开启与关闭,还可改变细胞膜的结构与功能,增强细胞活力,诱导细胞自噬,延缓机体衰老促进肿瘤生长,与亚硝酸盐反应生产致癌物质亚硝胺---腐胺鸟氨酸和赖氨酸短乳杆菌(Lactobacil-lus brevis)、流感嗜血杆菌(Haemophilus influ-enzae)、鼠伤寒沙门氏菌(Salmonella typhi-murium)、志贺氏菌(Shigella Castellani)基因表达调控、小肠的成熟分化、细胞分化和增殖心跳加速、高血压、致癌效果---
注:“-”文献中未有报道
1.2 生物胺的限量标准
鉴于生理和毒理学效应,生物胺已然成为发酵食品行业中潜在的公共卫生问题。2011年,欧洲食品安全局通过收集大量欧洲人群生物胺暴露风险数据,结合风险评估,发现对正常人来说,通常每人每餐25~50 mg的组胺暴露量、不超过600 mg的酪胺暴露量不会对人体带来健康风险;而奥地利风险分析数据表明,饮食中色胺的摄入不会对健康个体产生不利的健康影响,但该评估没有综合考虑摄入生物胺的综合作用。此外,由于不同生物胺毒性差异较大、不同生物胺之间相互作用,难以通过控制生物胺总量评估其毒性,且不同种族、地域和国家人群对生物胺敏感性不同,因此难以建立统一的生物胺毒性衡量标准。目前,对生物胺限量主要集中在水产品和葡萄酒中,而涉及的生物胺主要为组胺和酪胺(表1)。例如,美国食品药品监督管理局规定,水产品中组胺及酪胺最高限量分别为50和100 mg/kg,其他食品中组胺的最高限量为50 mg/kg;而我国GB 2733—2015规定鲐鱼、金枪鱼等高组胺鱼类组胺含量应低于40 mg/100 g,其他海水鱼类中组胺含量应低于20 mg/100 g。对于葡萄酒中组胺最高限量的设定,瑞士和澳大利亚的最高限量标准为10 mg/L,而德国的最高限量标准为2 mg/L。然而,我国尚未建立白酒、黄酒等传统酒中生物胺含量的限量标准。因此,科学开展不同类型食品中生物胺的风险评估研究,有针对性地实施食品风险管理措施,能够降低食品中生物胺摄入风险、推动食品行业的健康发展。
1.3 发酵食品中生物胺含量的研究进展
酒类食品作为人们关注的重点,不同的酒类所含的生物胺也有所不同,比如张敬等[5]测定了市面上12种黄酒样品中的生物胺,结果表明,黄酒中总生物胺平均值为78.3 mg/L,远高于葡萄酒和啤酒中的总生物胺平均值。而曹利瑞等[6]则是通过三氯乙酸提取酒中的总生物胺,并利用丹磺酰氯进行柱前衍生化,测定了黄酒中9种生物胺,对5个黄酒样品进行了测定,其总生物胺的含量在6.741~161.48 mg/L。有关白酒中总生物胺平均值则未见权威性的报道。温永柱等[7]通过液液微萃取结合高效液相色谱,动态分析了白酒固态酒醅中的生物胺含量,随着酒醅发酵的不断进行,生物胺的总量前20 d随着发酵时间的延长而不断增加,随后逐渐开始下降,发酵60 d时酒醅中的生物胺含量达到11.78 mg/kg。葡萄酒由于葡萄品种以及酿造方式等条件的不同,尤其是葡萄酒在酒精发酵后还会进行苹果酸-乳酸发酵,导致大量的微生物为了中和酸性环境而产生生物胺。邓玉杰等[8]通过测定新疆不同地区的葡萄酒中的生物胺发现,即便是同一地区所产的葡萄酒,其生物胺的组成和含量也有所不同,其中新疆和田地区葡萄酒的总生物胺含量最少为37.16 mg/L,吐鲁番地区所产葡萄酒的总生物胺最高为335.18 mg/L。啤酒的发酵原料为麦芽,并加入少许的酒花通过液态发酵而成。所以啤酒中的生物胺主要是由富含氨基酸的麦芽产生,栾光辉等[9]通过反相高效液相色谱法,测定了不同种类啤酒中的8种生物胺,结果发现,不同种类的啤酒的生物胺整体含量接近,总量为4.21~10.59 mg/L。
奶酪则是乳制品中主要含有生物胺的产品。且不同品种奶酪中生物胺的种类和含量也不同。通常来说发酵成熟的奶酪中的生物胺含量是未发酵成熟奶酪的10~2 000倍。比如刚开始发酵的蓝纹奶酪中的生物胺几乎无法检测,但发酵成熟的蓝纹奶酪中的酪胺和组胺的含量高达1 585.4和920 mg/kg[10]。
酱油是我国消费量极高的发酵调味品,但目前国内外还未出台有关酱油中生物胺的限量标准。但有部分学者对酱油中生物胺进行了研究,邹阳等[11]通过测定10种市售的酱油的生物胺含量,其中酪胺含量为0~650.14 μg/mL,组胺含量为2.23~228.79 μg/mL,腐胺含量为0~555.51 μg/mL,苯乙胺含量为0~340.05 μg/mL,尸胺含量为0~109.22 μg/mL,色胺含量为0~25.79 μg/mL,亚精胺含量为2.31~34.87 μg/mL,精胺含量为0~31.28 μg/mL。朱帅等[12]则是对11种市售酱油中组胺的含量,发现不同酱油的组胺含量差距较大,11种酱油样品中组胺含量为0~147.1 mg/kg。
1.4 生物胺的形成机制
除原料中含有少量生物胺外,大部分生物胺产生于食品的加工、储存等过程中,其形成途径:(1)醛酮类化合物的氨基化和转氨基作用;(2)氨基酸脱羧酶的脱羧作用,即以5-磷酸吡哆醛为辅酶,微生物来源的氨基酸脱羧酶催化游离氨基酸脱羧基形成相应胺类,且不同氨基酸脱羧酶催化形成不同类型生物胺或同一氨基酸脱羧酶可催化几种氨基酸的脱羧作用。例如,组胺是组氨酸通过组氨酸脱羧酶脱羧而形成,而酪胺是通过酪氨酸脱羧酶水解而形成等(图1)。其中,基于微生物来源的氨基酸脱羧酶催化形成的生物胺是食品中生物胺产生的主要原因,且生物胺浓度与产胺微生物的种类及数量呈正相关性。例如,葡萄球菌、弧菌、肺炎克雷伯菌和假单胞菌是产组胺菌;芽孢杆菌和肉食杆菌是产酪胺菌;而大肠杆菌和阿氏肠杆菌是产腐胺菌等(表1)。同时,微生物脱羧通路激活的生理机制也已然解析,即:(1)抵抗酸胁迫,微生物在酸性环境中通过脱羧作用产生生物胺以提高细胞内外pH;(2)获取能量,脱羧过程可激活与膜相关的质子运动力为细胞补充能量。
因此,食品中生物胺的形成与积累需具备3个条件:(1)存在合成氨基酸脱羧酶的微生物;(2)充足的游离氨基酸;(3)适合微生物生长繁殖、氨基酸脱羧酶合成及催化反应的理化条件。此外,食品中生物胺的积累浓度受多种因素影响, 如pH、水分活度、原料基质组成、发酵体系中微生物种类及发酵时间和温度、储藏温度和时间等。例如,原料质量显著影响生物胺的形成,一方面,原料中微生物的种类和数量直接影响生物胺的形成;另一方面,原料中蛋白质、碳水化合物等营养组分可为生物胺的形成提供前体物和反应场所;而增加酸度虽可抑制微生物生长,但低pH值环境也为细菌合成更多氨基酸脱羧酶提供了胁迫条件,二者共同作用决定产品中生物胺的含量。因此,基于生物胺形成途径的多样性和影响因素及其相互作用的复杂性,导致不同品种之间、同种食品之间生物胺含量存在较大差异性[13],通过监控发酵食品中生物胺含量的变化过程,全面评估不同因素对生物胺产生和积累的影响, 进而发展有效控制生物胺的加工策略。
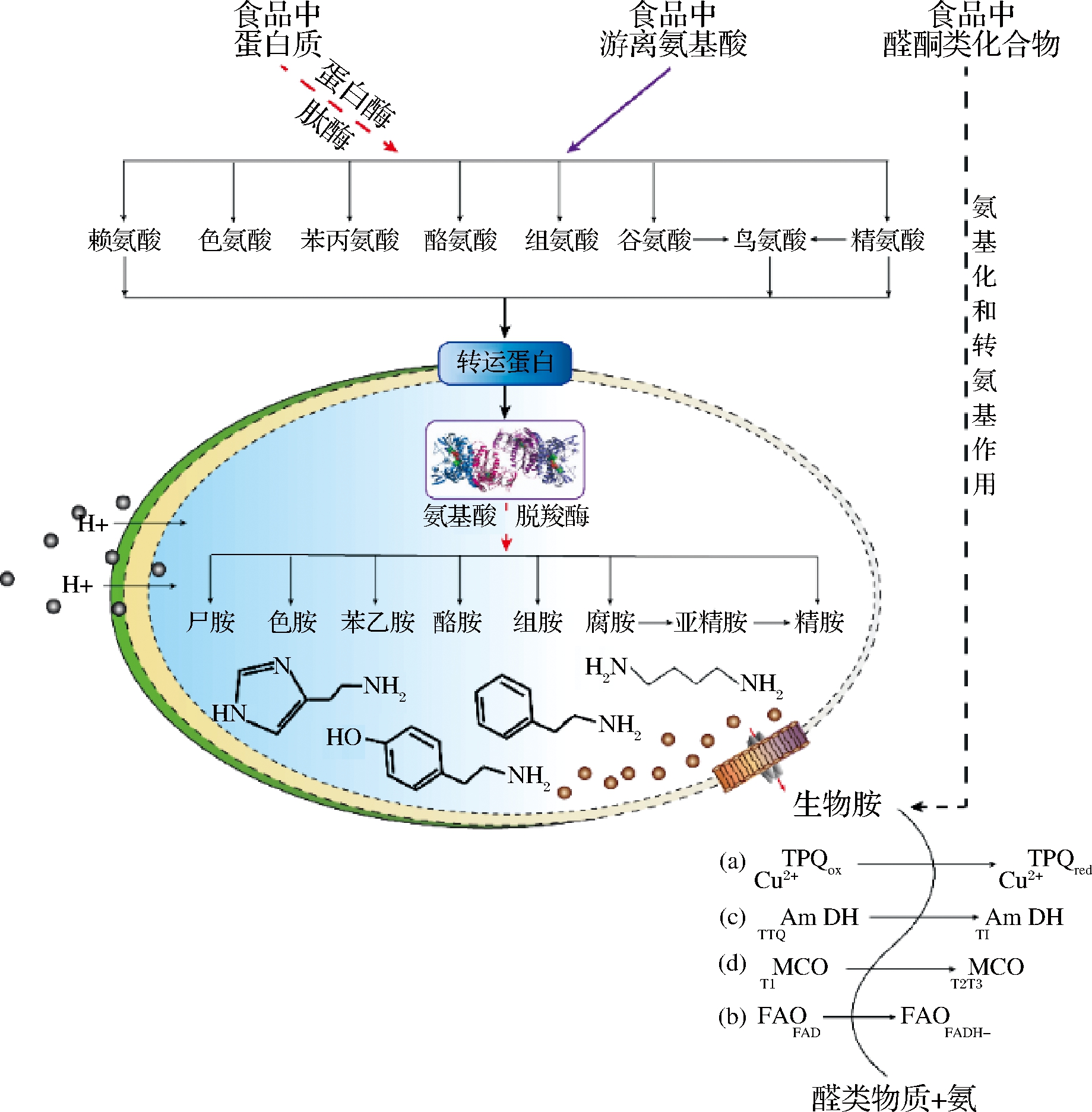
图1 食品中生物胺的形成途径及其防控措施示意图[14]
Fig.1 Schematic diagram of biogenic amines formed by amino acid decarboxylase, amination and transamination, and biological amines control measures
a, 含铜氧化酶降解生物胺的反应机理:(Cu(II)TPQox为未结合底物的含铜胺氧化酶(CAO),此时2,4,5-三羟基苯丙氨酸醌(TPQ)为氧化型;Cu(II)TPQred为结合底物的CAO,此时TPQ为氧化型);b, 含黄素胺氧化酶(FAO)降解生物胺反应机理(FAO作用于仲胺时才有氨生产); c, 以色氨酸-色氨酸醌(TTQ)为辅基的胺脱氢氨酶(Am DH)降解生物胺反应机制(TI:I型铜); d, 多铜氧化酶降解 生物反应机理(T1:I型铜;T2,T3:三铜耦合中心)
2 食品中生物胺的测定方法
2.1 间接检测技术
间接检测技术即通过测定产胺菌数量实现生物胺浓度的快速分析,主要包括:(1)微生物学法:基于产胺菌的生理特性,利用选择性培养基,如借助酸碱指示剂溴甲酚紫与代谢产物生物胺的显色反应鉴定产胺菌。然而,微生物的其他碱性代谢产物也可发生显色反应而造成假阳性结果。同时由于生物胺在一定条件下可以呈现出不同的颜色现象,从而实现对生物胺的定量分析。PATANGE等[15]利用咪唑与β-苯基重氮磺酸盐的相互作用,建立了一种可以测定鲭科鱼中组胺含量的比色定量法,检出限为15 mg/kg,检测范围:10~600 mg/kg。为此,在利用选择性培养基鉴定产胺菌的基础上,结合比色法可实现对生物胺的定性和定量分析。(2)分子生物学法。基于微生物中氨基酸脱羧酶基因的保守性原理,设计脱羧酶基因引物,利用PCR检测脱羧酶而实现产胺菌的快速检测。然而,单一 PCR 只能检测一种产胺菌,而借助多重 PCR技术可实现多种产胺菌的快速检测。例如,基于数据库中不同产胺菌的蛋白质组序列比对,选择保守结构域设计引物而建立多重 PCR方法,可实现4种生物胺(组胺、酪胺、腐胺和尸胺)产胺菌的同时鉴定[16]。值得注意的是,产胺菌的存在与生物胺含量无线性相关,间接检测技术只能实现生物胺的定性或半定量测定,但该方法却能实现对发酵体系中产胺微生物过程状态的监控,在生物胺水平达到污染控制水平之前检测到产胺菌的存在。
2.2 直接检测技术
2.2.1 生物胺的前处理方法
食品中生物胺存在游离态和结合态 2种形式, 而生物胺的检测一般仅关注游离态生物胺。然而,食品中生物胺含量较低且存在基质干扰,为此需对样品进行提取、净化和衍生等前处理以提高检测灵敏度。其中,生物胺的提取方法有:①酸提取法,如盐酸和高氯酸[17];②有机溶剂提取法,如三氯乙酸、甲醇、乙醇、乙酸乙酯、乙腈等[18]。然而,基于上述方法获得的生物胺提取液中仍残留大量其他干扰性杂质,仍需结合净化步骤实现更好的除杂效果。目前,净化方法包括:(1)液-液萃取法,其效果受溶剂类型、萃取时间、搅拌方式等因素的影响[19],且存在操作复杂、溶剂消耗量大、后富集时间长、易发生乳化等缺点[20]。为此,基于液-液萃取法发展的液相微萃取[21]、分散液液微萃取[22]、涡旋辅助-表面活性剂-液液微萃取[23]和盐析辅助液液萃取[24]等方法已被广泛应用于食品中生物胺的萃取净化[25];(2)固相萃取法,具有不产生乳化、提取效率高、重现性好和灵敏度高等特点,适合样品中痕量组分富集和大批量操作, 但也存在溶剂消耗量大、耗时较长和操作复杂等缺点。为此,基于固相萃取法的改性新技术,固相微萃取、分子印迹固相萃取、气体扩散微萃取和基质辅助固相分散萃取等技术已被广泛应用于果汁、葡萄酒、金枪鱼、肉制品等食品中生物胺的萃取[26]。此外,因生物胺无紫外吸收和荧光效应,需对其进行衍生化处理后才可借助紫外或荧光检测器进行色谱检测,而常用衍生剂包括邻苯二甲醛、丹磺酰氯、苯甲酰氯、二硝基苯甲酰氯和1,2-萘醌-4-磺酸盐等。其中,丹磺酰氯和苯甲酰氯为柱前衍生剂,所形成的衍生物相对较稳定,但却与酚类、脂肪醇等基质中活泼氢反应,因此对样品前处理要求较高;而邻苯二醛为柱后衍生剂,只能与初级生物胺发生衍生反应,且衍生物稳定性较差,常与2-巯基乙醇同时使用[27]。
2.2.1.1 基于色谱法检测生物胺
色谱法是利用不同生物胺与固定相和流动相之间作用力(分配、吸附、离子交换等)的差别进行多次平衡, 使各组分达到相互分离后, 结合各类检测器进行分析, 为生物胺的常用检测方法,包括高效液相色谱法、毛细管电泳法、气相色谱法、薄层色谱法、离子色谱法等[28]。如表2所示,不同色谱方法各具优劣势,如毛细管电泳法具有高效、快速等特点,但对被测样品要求较高;而气相色谱法虽具分离能力好、灵敏度高等优点,但对非挥发胺则需衍生化以降低化合物极性和提高其挥发性,进而导致气相色谱法在生物胺检测中具有一定的局限性[29]。值得注意的是,高效液相色谱是分析检测食品中生物胺最为有效、应用最为广泛的方法,具有分离效率和准确性高、分析速度快、稳定性和重现性好、能够实现大批量样品检测等特点,但却存在衍生操作繁琐、耗时较长等不足。近年来,基于高效液相色谱与质谱、飞行时间质谱法、四极杆/静电场轨道阱高分辨质谱等联用技术已然被应用于复杂基质中生物胺的检测,联用技术通常不需要衍生处理即可对生物胺进行准确的定性和定量分析,同时还可提供丰富的物质结构信息[30]。例如,陈召桂等[31]建立液相色谱-质谱(LC-MS/MS)联用技术检测腐乳中9种生物胺的方法,即样品经5%三氯乙酸水溶液提取后,利用LC-MS/MS进行定量分析,结果表明9种生物胺在质量浓度为10~200 ng/mL内线性相关系数R2>0.999,检出限为0.03 mg/kg,定量限为0.1 mg/kg,回收率在85%~101%,相对标准偏差在0.9%~4.8%[31]。
表2 不同生物胺检测方法的比较分析
Table 2 Comparison analysis of different biogenic amine detection methods
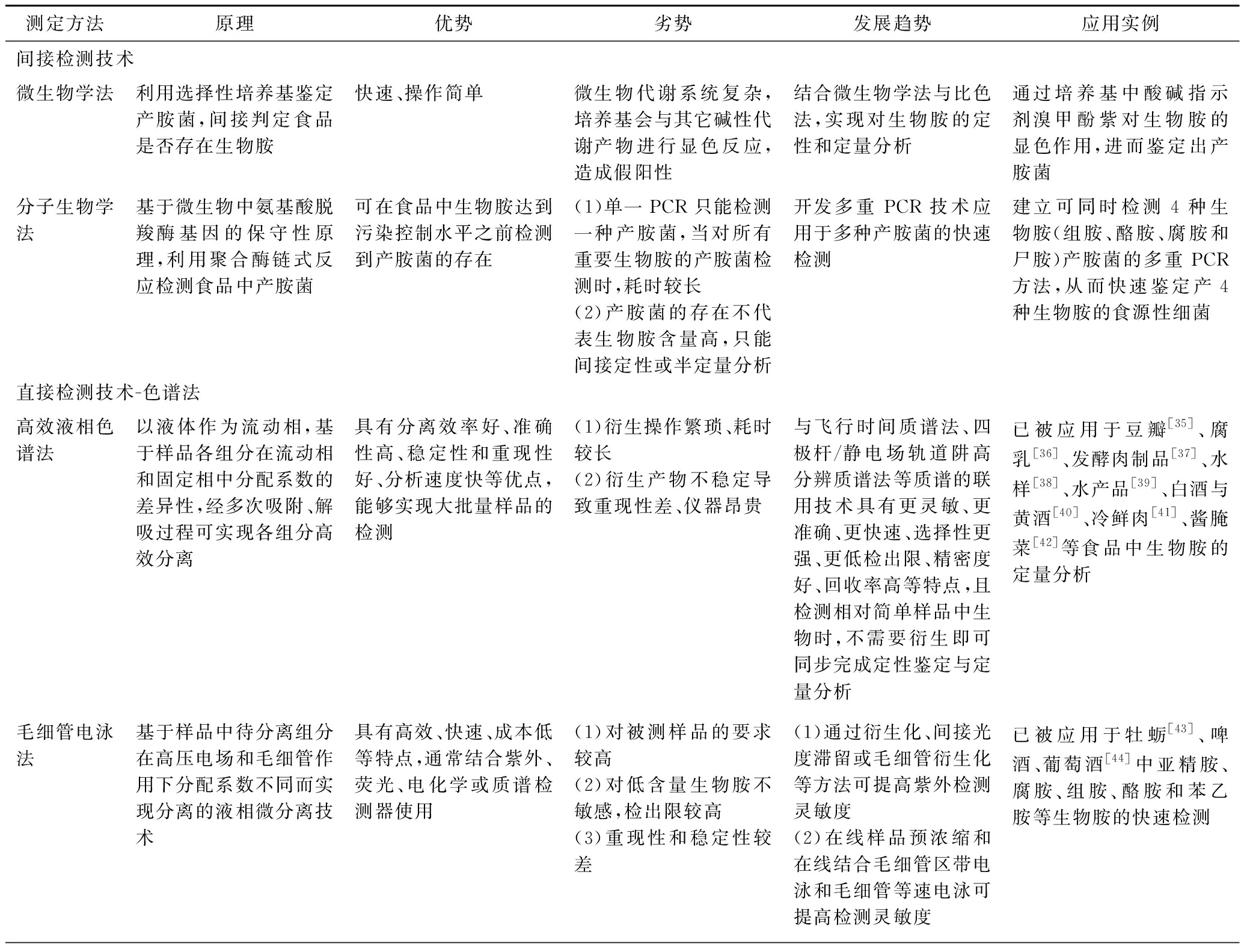
测定方法原理优势劣势发展趋势应用实例间接检测技术微生物学法利用选择性培养基鉴定产胺菌,间接判定食品是否存在生物胺快速、操作简单微生物代谢系统复杂,培养基会与其它碱性代谢产物进行显色反应,造成假阳性结合微生物学法与比色法,实现对生物胺的定性和定量分析通过培养基中酸碱指示剂溴甲酚紫对生物胺的显色作用,进而鉴定出产胺菌分子生物学法基于微生物中氨基酸脱羧酶基因的保守性原理,利用聚合酶链式反应检测食品中产胺菌可在食品中生物胺达到污染控制水平之前检测到产胺菌的存在(1)单一 PCR 只能检测一种产胺菌,当对所有重要生物胺的产胺菌检测时,耗时较长(2)产胺菌的存在不代表生物胺含量高,只能间接定性或半定量分析开发多重 PCR技术应用于多种产胺菌的快速检测建立可同时检测4种生物胺(组胺、酪胺、腐胺和尸胺)产胺菌的多重 PCR方法,从而快速鉴定产4种生物胺的食源性细菌直接检测技术-色谱法高效液相色谱法以液体作为流动相,基于样品各组分在流动相和固定相中分配系数的差异性,经多次吸附、解吸过程可实现各组分高效分离具有分离效率好、准确性高、稳定性和重现性好、分析速度快等优点,能够实现大批量样品的检测(1)衍生操作繁琐、耗时较长(2)衍生产物不稳定导致重现性差、仪器昂贵与飞行时间质谱法、四极杆/静电场轨道阱高分辨质谱法等质谱的联用技术具有更灵敏、更准确、更快速、选择性更强、更低检出限、精密度好、回收率高等特点,且检测相对简单样品中生物时,不需要衍生即可同步完成定性鉴定与定量分析已被应用于豆瓣[35]、腐乳[36]、发酵肉制品[37]、水样[38]、水产品[39]、白酒与黄酒[40]、冷鲜肉[41]、酱腌菜[42]等食品中生物胺的定量分析毛细管电泳法基于样品中待分离组分在高压电场和毛细管作用下分配系数不同而实现分离的液相微分离技术具有高效、快速、成本低等特点,通常结合紫外、荧光、电化学或质谱检测器使用(1)对被测样品的要求较高(2)对低含量生物胺不敏感,检出限较高(3)重现性和稳定性较差(1)通过衍生化、间接光度滞留或毛细管衍生化等方法可提高紫外检测灵敏度(2)在线样品预浓缩和在线结合毛细管区带电泳和毛细管等速电泳可提高检测灵敏度已被应用于牡蛎[43]、啤酒、葡萄酒[44]中亚精胺、腐胺、组胺、酪胺和苯乙胺等生物胺的快速检测
续表2

测定方法原理优势劣势发展趋势应用实例间接检测技术气相色谱法通过气液或气固相互运动过程中物质在两相之间分配系数的差异达到分离物质的目的常用于分析挥发性胺,分离能力好、灵敏度和准确度高(1)对非挥发胺,需衍生化以降低化合物极性,以改善化合物在色谱柱中的驻留(2)仪器昂贵、操作费时,不适合大批量样品检测基于气相色谱串联质谱法实现对啤酒、葡萄酒中生物胺的定量分析检测[45]被应用于鱼和鱼制品、肉制品等食品中生物胺的分析测定[46]薄层色谱法利用生物胺与其它物质对吸附剂的吸附能力和分配系数不同使混合物在固定相上得以分离,根据样品比移值与对照物的比移值确定生物胺含量处理样品量大、分离速度快、设备简易、操作简单、成本低(1)仅为定性和半定量的分析方法(2)准确度和精度不高、重复性差(3)定量分析需将样品萃取衍生后,借助荧光检测器进行定量分析基于对图像采集和分析系统的改进,可有效克服仅能定性不能定量的弱点可应用于鱼与鱼制品、红酒中生物胺的快速测定 离子色谱法基于离子交换能力或组分选择性系数的差异达到分离目的的一种分离技术分析过程简单、快速、选择性好、重现性高、无需衍生化检测结果受样品中其他阳离子(如金属离子)的干扰已被应用于黄酒、果汁、啤酒、凤尾鱼、奶酪、葡萄酒和意大利腊肠中生物胺的检测[47]直接检测技术-生物传感器法基于酶联免疫的生物传感器基于抗原与抗体的特异性反应实现目标产物定性与定量分析的方法,常用的生物识别元素有抗体、核酸适配体、肽、分子印迹聚合物等灵敏度高、特异性强、样品前处理简单快速(1)生物胺分子质量小,制备的生物识别元素灵敏度不高且制备过程耗时耗力(2)难以对不同生物胺进行同时分析,检测易出现交叉反应(3)仅适用于组胺、且低含量的测定制备具有高灵敏度、特异性强的生物胺识别元素仍是目前的研究趋势。因此,将生物胺衍生化后制备生物识别元素或结合纳米材料等物质增强信号可提高灵敏度将组胺衍生化,制备出相应抗体以提高特异性和灵敏度,并结合间接竞争酶联免疫吸附法测定鱼、虾和贝类中组胺含量基于酶促反应的生物传感器将酶的选择性与目标分析物的鉴定结合起来,将生物催化反应的产物量直接转化为光、电信号从而实现生物胺快速和准确的检测分析快速、方便、灵敏度较高、可在线检测存在酶的固定化不稳定和催化效率低等问题,进而影响传感器的稳定性和灵敏度研制新型固定化膜和更高效的催化物质并将其用于制备生物传感器,实现固定化酶的更稳定和更高的反应效率基于胺与腐胺氧化酶或二胺氧化酶的酶促反应产物H2O2可与鲁米诺试剂反应发光的原理制成2种光学生物传感器检测鱼肉等食品中腐胺,检出限分别为 0.8和1.3 mg/L[48]基于酸碱度变化的比色生物传感器利用生物胺的碱性性质进行产品生物胺的定性和定量比色传感器是最直接和直观的检测方法,简便快速、准确因颜色分辨率低等问题,该方法只能提供定性和半定量信息,且灵敏度和特异性较低、检出限较高根据酸碱度变化引起其他变化(能量转移或结构变化等)从而提供生物胺的定性和定量信息。同时,将基于酸碱度变化导致颜色变化与数学模型偶联进一步提高该技术的灵敏度和准确度设计一种由 20 种不同的壳聚糖纳米颗粒-染料/醋酸纤维素组成的比色条形码检测鱼肉、鸡肉和牛肉中的生物胺等新鲜度指标。当条形码暴露于不同浓度生物胺时,条形码会根据酸碱度改变颜色
2.2.1.2 基于生物传感器检测生物胺
以抗原、抗体、酶等物质为生物探针,将其固定在石墨、琼脂糖、醋酸纤维素膜等基质上,利用其与生物胺的特异性反应,通过换能器将反应结果输出为可定量的物理、化学信号而实现对生物胺的定性和定量分析。根据特异性反应原理,可将生物传感器分为:(1)基于免疫识别的生物传感器,即以生物胺为抗原,基于生物识别元素(如抗体、核酸适配体、肽、分子印迹聚合物等)与抗原的特异性反应实现对生物胺的定性与定量分析。然而,生物胺分子质量较小,基于直接与蛋白偶联制备抗原所产生的抗体特异性较差。为此,通过将组胺衍生化,进而制备出可特异性识别组胺衍生物的抗体以提高检测特异性和灵敏度,并结合间接竞争酶联免疫吸附法测定鱼、虾和贝类中组胺含量,检出限可降低至 0.1 ng/mL,回收率提高至98.9%~130.1%[32]。类似的,利用荧光标记的组胺衍生物作为配体和组胺在溶液中共同竞争分子印迹聚合物结合位点的原理,通过测量荧光强度实现金枪鱼罐头中组胺的定量分析,检出限可达111 ng/mL[33]。(2)基于酶促反应的生物传感器,通过将酶选择性与目标分析物鉴定结合,将反应产物量直接转化为光、电信号而实现生物胺快速和准确的检测, 具有特异性高、低成本、小型化、可重复利用、速度快、可在线检测等优点。例如,将变性血红蛋白固定在黏土-纳米金复合材料修饰的电极表面,以戊二醛作为交联剂固定二胺氧化酶,通过测定电流值确定尸胺浓度,使尸胺检出限达1.500 8×10-4 ng/mL[34]。然而,基于酶促反应的生物传感器在材料选择、制作成本、重复利用等方面仍存许多不足,如酶电极的稳定性及酶的固定化技术仍需改进,且目标酶存在保存成本高、催化效率低、不能反复使用等问题,进而影响传感器的稳定性和灵敏度。(3)基于酸碱度变化的比色生物传感器,即基于酸碱性敏感的指示剂导致颜色变化检测分析生物胺,但却存在颜色分辨率低、且只能提供定性和半定量信息、灵敏度和特异性较低等缺点。为此,基于酸碱度变化而引起其他变化(能量转移或结构变化等)可实现比色传感器的定性和定量分析。例如,将pH敏感型染料溴甲酚紫采用吸附法固定在多孔聚乳酸基质上制成比色传感器,并与以氧化石墨烯作为基底的激光解吸电离质谱联用建立双重检测平台实现生物胺的定性和定量分析,即生物胺使比色传感器由黄色变成紫色,而激光解吸电离质谱通过相对分子质量对生物胺进行定量分析,可使腐胺和尸胺的检出限分别达到 6.170 5×10-3和4.48×10-6 ng/mL。
综上所述,基于色谱法检测生物胺已然成为应用最为广泛的分析方法,但却存在仪器昂贵、操作费时等缺点,不适合大批量样品检测;而基于生物传感技术检测生物胺同样存在生物识别元素灵敏度低、制备过程耗时耗力等不足。因此,开发精密度好、准确度高、低成本、操作简便、高通量的检测方法仍是生物胺检测技术的发展趋势,而如何实现快速准确、高灵敏度和特异性检测生物胺仍是食品领域面临的难题。
3 生物胺的控制与去除
生物胺具有很强的稳定性,超声、微波、加热均不能破坏已产生的生物胺,因此生物胺一旦生成,很难消除。对于发酵食品,一些产胺微生物是食品发酵的常见菌群,进而导致难以杜绝或抑制生物胺的产生[49]。基于食品中生物胺的形成机理,精准控制产品中生物胺含量的策略包括:(1)降低前体物氨基酸水平;(2)抑制腐败微生物的生长[50];(3)选育合成生物胺降解酶或不能合成氨基酸脱羧酶的发酵剂;(4)添加生物胺降解酶等[51]。因此,针对发酵食品生产加工过程中生物胺积累等问题,常采取物理、化学和生物等防控措施以实现预防生物胺的形成、降低食品中生物胺含量,进而解决生物胺引起的食品安全问题。
3.1 物理防控策略
物理防控策略是根据生物胺形成机制及其影响因素以调控微生物生长,进而抑制生物胺的形成,主要包括气调保鲜、辐照、超高压及γ射线处理等技术,具有操作简单、方便、易于实现、且不损失产品营养及不破坏质地、风味等优点, 但需相应设备、能耗大,导致其在应用中存在一定的局限性[52]。其中,辐照杀菌利用物理射线直接或间接破坏微生物的核糖核酸、蛋白质、酶、细胞膜等抑制生物胺的产生;高压和超声处理则通过破坏甚至杀死微生物、钝化酶活性以减少生物胺的产生[53];而气调包装和真空包装通过抑制微生物生长及相关酶活性, 从而降低生物胺的形成。例如,在利用辐照技术处理海捕大管鞭虾,发现辐照技术可抑制生物胺的生成,且效果随辐照剂量和生物胺种类不同有所差异,辐射强度为5 k Gy时即可对生物胺产生抑制作用,但却无法消除已生成的生物胺[53]。因此,物理防控策略可有效预防或抑制产胺菌的生长繁殖而降低生物胺的积累,但却无法降低已有生物胺的浓度。
3.2 化学防控策略
化学防控策略是在食品加工过程中通过涂抹、浸泡及添加某些化合物(糖类、食盐等)、食品添加剂(如柠檬酸、琥珀酸、山梨酸钾)或天然活性物质[54](如乳酸链球菌素、壳聚糖、茶多酚等)抑制微生物生长和降低脱羧酶活性,进而减少生物胺的生成。例如,外源添加适量玫瑰多酚可有效提高乳酸菌的生长速度和丰富度,且降低产胺菌脱羧酶的代谢能力,进而抑制发酵制品中腐败菌的生长和生物胺的生成,提高发酵食品的品质及其安全性[54]。虽化学防控策略成本较低,但因外源物质的添加可能导致掩盖食品独特风味、改变食品营养成分、食品添加剂超标、天然提取物性质不稳定等问题,制约化学防控策略在发酵食品行业的使用与发展。
3.3 生物防控策略
生物防控策略通过影响产胺菌的生长、添加生物胺降解酶、抑制氨基酸脱羧反应等策略有效降低生物胺的生成量,具有保持产品原有风味、稳定产品质量、安全可靠等优点,已然成为目前食品行业降低生物胺含量最有前景的一种方法。目前,常用的生物防控技术包括:(1)发酵菌群结构改良。选育具有生物胺降解活性或不具有氨基酸脱羧酶活性的微生物作为发酵菌剂,并在食品发酵过程中接种适合的单一或复合发酵剂,通过影响不同微生物菌群间相互作用而抑制产胺菌的生长和生物胺的形成。例如,刘彩霞等[55]将产酸能力强且能够降解生物胺的植物乳杆菌 14-2-1接种于浸米起始阶段,可使群落结构中植物乳杆菌占比由传统工艺的 0.95%升至 79.52%,进而使生物胺质量浓度降低93.84%。(2)选育不能合成氨基酸脱羧酶活性的菌株作为发酵剂。类似的,从豆瓣酱样品中筛选生物胺降解菌株,结果表明乳酸片球菌M- 28 在盐质量浓度为0~90 g/L 时对组胺和酪胺均具有较高的降解率,最高降解率分别达到89.02% 和31.49%;而在最适温度条件下对组胺和酪胺降解率分别为65.51%和28.06%;在最适 pH条件下对组胺和酪胺的降解率分别为62.73%和23.78%[56]。(2) 外源添加生物胺降低酶。目前,已报道可催化生物胺降解的酶主要有胺氧化酶、胺脱氢酶和多铜氧化酶。其中,胺氧化酶催化生物胺氧化脱氨为氨、醛和过氧化氢;胺脱氢酶催化生物胺脱氢生成醛。值得注意的是,不同的生物胺降解酶对生物胺的特异性和催化效率均存在差异性,如胺氧化酶和胺脱氢酶可特异性催化某一种生物胺的分解,对非最适底物的生物胺催化效率极低或没有催化活性;而多铜氧化酶对生物胺的底物特异性不强,但可催化多种生物胺的氧化分解。此外,谷氨酰胺转胺酶可催化转酰基反应, 导致蛋白质(或多肽)之间发生共价交联而抑制游离氨基酸的脱羧反应。例如,YERLIKAYA等[57]研究发现加入 2 g/kg谷氨酰胺转胺酶能较好地抑制微生物的生长,进而显著降低产品中组胺、腐胺、尸胺、酪胺等生物胺含量,实现改善鲭鱼的品质和货架期的目的。然而,生物防控策略需要针对不同发酵食品而选育不同发酵剂,且需对菌种和发酵产品进行安全、质量等综合评估,需大量的前期研究工作。因此,基于生物胺与微生物菌群、微生物代谢调控的关联机制,借助适应性进化、诱变选育、酶工程及代谢工程等策略实现菌种或菌群的改良,选育性能更为优良、鲁棒性强、催化能力强、代谢能力强的发酵菌剂,为进一步精确控制发酵食品中生物胺的含量提供技术支撑。
3.4 其他防控策略
此外,通过多种工艺集合的方式来对发酵全过程进行控制,如优化原料预处理方式、发酵过程温度、NaCl浓度、pH 值、供氧量及添加剂等,全方位实现发酵制品中生物胺去除。例如在不同贮藏温度(在-18~30 ℃)下鲐鱼中8种生物胺含量的变化,结果表明在-18 ℃下贮存6个月,整鱼中组胺含量由1.93 mg/kg增长至13.45 mg/kg,生物胺总量为81.14 mg/kg,在0 ℃贮藏12 d,组胺含量为407.52 mg/kg,而在30 ℃贮藏1 d,整鱼的组胺含量达到3 996.56 mg/kg,远超国家标准。类似的,含高浓度食盐的渗透压会大大增加,产胺菌不能进行正常的代谢繁殖,进而有效减少生物胺的富集。但高盐食品不满足于人们对健康饮食的要求,能够抑制生物胺产生的同时找到安全的食盐添加量至关重要。
4 结论
近年来,发酵食品因具有促进健康、特殊风味和便于储藏等优点而深受消费者喜爱,导致其消费量逐年增加,且逐渐成为一种流行趋势。然而,发酵食品的加工过程是由多系统共同作用(发酵菌剂及微生物菌群结构、发酵条件、原料产地、环境条件等),其工艺复杂,进而难以控制微生物的代谢性能及其代谢产物的形成,导致发酵食品面临严峻的品质和安全问题。其中,因其生理和毒理学效应,生物胺已然成为发酵食品行业中一个潜在的公共卫生问题。更为重要的是,基于生物胺形成途径多样性和影响因素及其相互作用的复杂性,导致不同品种之间、同种食品之间生物胺含量存在较大差异性。
因此,加强全面解析发酵食品中生物胺的形成机理(如发酵食品不同加工工艺中微生物菌群结构和生物胺的变化规律、探究微生物菌群结构与生物胺形成的关联机制及其构效关系),及影响因素的基础上,发展精密度好、准确度高、低成本、操作简便、高通量的检测方法, 实现发酵食品中生物胺含量变化过程的实时监控,进而全面评估不同因素对生物胺产生和积累的影响, 为发展生物胺的控制策略提供理论和实践指导。然而,对于生物胺的控制,应综合利用物理、化学和生物防控策略的技术,如适当降低发酵温度、改变体系渗透压、选育安全高效发酵菌株、添加适合生物胺抑制剂等策略,发挥其协同效应从而有效控制生物胺的形成,改善发酵食品中生物胺的积累,降低生物胺产生的风险,进而提升发酵食品的品质和安全性,促进发酵食品行业的健康发展。
[1] ALVAREZ M A, MORENO-ARRIBAS M V.The problem of biogenic amines in fermented foods and the use of potential biogenic amine-degrading microorganisms as a solution[J].Trends in Food Science & Technology, 2014, 39(2):146-155.
[2] 王德宝, 赵丽华, 袁倩, 等.发酵肉制品中生物胺种类及其影响因素分析研究[J].食品工业, 2014, 35(8):228-231.
WANG D B, ZHAO L H, YUAN Q, et al.The analysis and study of the types and influence factors of biogenic amines in fermented meat products[J].The Food Industry, 2014, 35(8):228-231.
[3] KIM M K, MAH J H, HWANG H J.Biogenic amine formation and bacterial contribution in fish, squid and shellfish[J].Food Chemistry, 2009, 116(1):87-95.
[4] REGUBALAN B, ANANTHANARAYAN L.Investigation of biogenic amines content in fermented idli batter during storage[J].Journal of Food Science and Technology, 2019, 56(4):1 775-1 784.
[5] 张敬, 赵树欣, 薛洁, 等.发酵型饮料酒中生物胺含量的调查与分析[J].食品与发酵工业, 2012, 38(6):165-170.
ZHANG J, ZHAO S X, XUE J, et al.Investigation and analysis of the content of biogenic amines in fermented alcoholic beverage[J].Food and Fermentation Industries, 2012, 38(6):165-170.
[6] 曹利瑞, 熊智强, 朱松, 等.黄酒酿造过程中产生物胺菌株的筛选及其特性研究[J].中国食品学报, 2018, 18(6):68-75.
CAO L R, XIONG Z Q, ZHU S, et al.Screening of strains producing biogenic amines and its characteristics during the Chinese rice wine formation[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(6):68-75.
[7] 温永柱, 范文来, 徐岩, 等.白酒中5种生物胺的HPLC定量分析[J].食品工业科技, 2013, 34(7):305-308.
WEN Y Z, FAN W L, XU Y, et al.Quantification for 5 selected biogenic amines in Chinese liquor by HPLC[J].Science and Technology of Food Industry, 2013, 34(7):305-308.
[8] 邓玉杰, 马雪蕾, 张凯婷, 等.新疆不同地区生产的葡萄酒中八种生物胺含量的测定[J].中国酿造, 2016, 35(7):171-174.
DENG Y J, MA X L, ZHANG K T, et al.Determination of eight kinds of biogenic amines content in wine from Xinjiang different regions[J].China Brewing, 2016, 35(7):171-174.
[9] 栾光辉, 刘春凤, 李崎.不同啤酒生物胺含量的比较[J].食品与发酵工业, 2013, 39(1):176-180.
LUAN G H, LIU C F, LI Q.The comparison of biogenic amine content in different beers[J].Food and Fermentation Industries, 2013, 39(1):176-180.
[10] FERN NDEZ M, Z
NDEZ M, Z
 IGA M.Amino acid catabolic pathways of lactic acid bacteria[J].Critical Reviews in Microbiology, 2006, 32(3):155-183.
IGA M.Amino acid catabolic pathways of lactic acid bacteria[J].Critical Reviews in Microbiology, 2006, 32(3):155-183.
[11] 邹阳, 赵谋明, 赵海锋.高效液相色谱法同时测定酱油中的8种生物胺[J].现代食品科技, 2012, 28(5):570-573.
ZOU Y, ZHAO M M, ZHAO H F.Simultaneous determination of 8 kinds of biogenic amines in soy sauce by HPLC[J].Modern Food Science and Technology, 2012, 28(5):570-573.
[12] 朱帅, 张水锋, 郑仕剑, 等.高效液相色谱法测定酱油中组胺的含量[J].食品安全质量检测学报, 2021, 12(4):1 574-1 579.
ZHU S, ZHANG S F, ZHENG S J, et al.Determination of histamine in soy sauce by high performance liquid chromatography[J].Journal of Food Safety & Quality, 2021, 12(4):1 574-1 579.
[13] FRAQUEZA M J, ALFAIA C M, BARRETO A S.Biogenic amine formation in Turkey meat under modified atmosphere packaging with extended shelf life:Index of freshness[J].Poultry Science, 2012, 91(6):1 465-1 472.
[14] MOINARD C, CYNOBER L, DE BANDT J P.Polyamines:metabolism and implications in human diseases[J].Clinical Nutrition, 2005, 24(2):184-197.
[15] PATANGE S B, MUKUNDAN M K, KUMAR K A.A simple and rapid method for colorimetric determination of histamine in fish flesh[J].Food Control, 2005, 16(5):465-472.
[16] DE LAS RIVAS B, MARCOBAL A, CARRASCOSA A V, et al.PCR detection of foodborne bacteria producing the biogenic amines histamine, tyramine, putrescine, and cadaverine[J].Journal of Food Protection, 2006, 69(10):2 509-2 514.
[17] 陆永梅, 董明盛, 吕欣, 等.高效液相色谱法测定黄酒中生物胺的含量[J].食品科学, 2006, 27(1):196-199.
LU Y M, DONG M S, LV X, et al.Biogenic amines contents in rice wine by HPLC[J].Food Science, 2006, 27(1):196-199.
[18] 谷凤霞, 王婷, 李宪臻, 等.柱前衍生-HPLC法测定啤酒中生物胺及其形成规律研究[J].食品与发酵工业, 2015, 41(9):168-173.
GU F X, WANG T, LI X Z, et al.Determination of biogenic amines in beer by HPLC with pre-column dansylation and study on its forming regularity[J].Food and Fermentation Industries, 2015, 41(9):168-173.
[19] 温永柱, 范文来, 徐岩.GC-MS法定性白酒中的多种生物胺[J].酿酒, 2013, 40(1):38-41.
WEN Y Z, FAN W L, XU Y.Identification of a variety of biogenic amines by GC-MS method in China’s liquor[J].Liquor Making, 2013, 40(1):38-41.
[20] 范文来, 王栋.近10年我国传统饮料酒白酒和黄酒品质安全研究现状与展望[J].食品安全质量检测学报, 2019, 10(15):4 811-4 829.
FAN W L, WANG D.Current practice and future trends of alcoholic beverages safety of China traditional Baijiu and Huangjiu in recent decades[J].Journal of Food Safety & Quality, 2019, 10(15):4 811-4 829.
[21] SAAID M, SAAD B, ALI A S M, et al.In situ derivatization hollow fibre liquid-phase microextraction for the determination of biogenic amines in food samples[J].Journal of Chromatography A, 2009, 1216(27):5 165-5 170.
[22] JIA S D, RYU Y, KWON S W, et al.An in situ benzoylation-dispersive liquid-liquid microextraction method based on solidification of floating organic droplets for determination of biogenic amines by liquid chromatography-ultraviolet analysis[J].Journal of Chromatography A, 2013, 1 282:1-10.
[23] DONTHUAN J, YUNCHALARD S, SRIJARANAI S.Vortex-assisted surfactant-enhanced-emulsification liquid-liquid microextraction of biogenic amines in fermented foods before their simultaneous analysis by high-performance liquid chromatography[J].Journal of Separation Science, 2014, 37(21):3 164-3 173.
[24] RAMOS R M, VALENTE I M, RODRIGUES J A.Analysis of biogenic amines in wines by salting-out assisted liquid-liquid extraction and high-performance liquid chromatography with fluorimetric detection[J].Talanta, 2014, 124:146-151.
[25] FRANCISCO K C A, BRAND O P F, RAMOS R M, et al.Salting-out assisted liquid-liquid extraction with dansyl chloride for the determination of biogenic amines in food[J].International Journal of Food Science & Technology, 2020, 55(1):248-258.
O P F, RAMOS R M, et al.Salting-out assisted liquid-liquid extraction with dansyl chloride for the determination of biogenic amines in food[J].International Journal of Food Science & Technology, 2020, 55(1):248-258.
[26] CHANG Q Y, ZANG X H, WU T, et al.Use of functionalized covalent organic framework as sorbent for the solid-phase extraction of biogenic amines from meat samples followed by high-performance liquid chromatography[J].Food Analytical Methods, 2019, 12(1):1-11.
[27] SENTELLAS S, N
 EZ
EZ  , SAURINA J.Recent advances in the determination of biogenic amines in food samples by (U)HPLC[J].Journal of Agricultural and Food Chemistry, 2016, 64(11):7 667-7 678.
, SAURINA J.Recent advances in the determination of biogenic amines in food samples by (U)HPLC[J].Journal of Agricultural and Food Chemistry, 2016, 64(11):7 667-7 678.
[28] 易丽娟, 赵晓娟, 白卫东.食品中生物胺检测方法的研究进展[J].食品研究与开发, 2016, 37(14):197-201.
YI L J, ZHAO X J, BAI W D.Research progress in determination methods of biogenic amines in food[J].Food Research and Development, 2016, 37(14):197-201.
[29] 王芳, 罗敏, 陶文波, 等.固相萃取-气相色谱法测定腌肉中5种生物胺[J].理化检验-化学分册, 2018, 54(5):512-515.
WANG F, LUO M, TAO W B, et al.GC determination of 5 bioamines in bacon with solid phase extraction[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2018, 54(5):512-515.
[30] JAIN A, VERMA K K.Strategies in liquid chromatographic methods for the analysis of biogenic amines without and with derivatization[J].TrAC Trends in Analytical Chemistry, 2018, 109:62-82.
[31] 陈召桂, 郑国建, 朱玲琳.液相色谱-串联质谱法测定腐乳中的生物胺[J].中国酿造, 2020, 39(12):160-163.
CHEN Z G, ZHENG G J, ZHU L L.Determination of biogenic amine in sufu by LC-MS/MS[J].China Brewing, 2020, 39(12):160-163.
[32] 袁利鹏, 刘波.间接竞争酶联免疫吸附测定水产品中的组胺残留[J].现代食品科技, 2019, 35(7):291-295.
YUAN L P, LIU B.Determination of histamine residues in aquatic products by indirect competitive enzyme-linked immunosorbent assay[J].Modern Food Science and Technology, 2019, 35(7):291-295.
[33] MATTSSON L, XU J J, PREININGER C, et al.Competitive fluorescent pseudo-immunoassay exploiting molecularly imprinted polymers for the detection of biogenic amines in fish matrix[J].Talanta, 2018, 181:190-196.
[34] 张敏, 吴俊铨, 姚嘉文, 等.基于变性血红蛋白和二胺氧化酶的生物传感器检测马鲛鱼中的尸胺[J].食品科学, 2020, 41(18):288-295.
ZHANG M, WU J Q,YAO J W, et al.Determination of cadaverine in mackerel by biosensor based on unfolded hemoglobin and diamine oxidase[J].Food Science, 2020, 41(18):288-295.
[35] 黄玉坤, 宋亚宁, 陈芳, 等.基于响应面法优化柱前衍生-高效液相色谱法分析传统郫县豆瓣中8种生物胺[J].西华大学学报(自然科学版), 2020, 39(6):61-71.
HUANG Y K, SONG Y N, CHEN F, et al.Analysis for eight biogenic amines in traditional Pixian broadbean by a precolumn derivatization-HPLC method based on response surface optimization[J].Journal of Xihua University (Natural Science Edition), 2020, 39(6):61-71.
[36] 李大伟, 李丹丹, 梁静静, 等.高效液相色谱法测定市售腐乳中生物胺的含量[J].食品研究与开发, 2018, 39(16):120-124;129.
LI D W, LI D D, LIANG J J, et al.Determination of biogenic amines in commercially sufu by high performance liquid chromatography[J].Food Research and Development, 2018, 39(16):120-124;129.
[37] 张殿伟, 高月宇, 王金菊, 等.高效液相色谱法分析发酵肉制品中生物胺[J].食品与发酵工业, 2019, 45(9):256-261.
ZHANG D W, GAO Y Y, WANG J J, et al.Determination of biogenic amines in fermented meats by HPLC[J].Food and Fermentation Industries, 2019, 45(9):256-261.
[38] 刘薇, 倪沁颜, 李浩宽, 等.高效液相色谱-荧光法检测水质中生物胺的方法研究[J].福建分析测试, 2020, 29(1):1-6.
LIU W, NI Q Y, LI H K, et al.Determination of biogenic amines in water by HPLC-FLD[J].Fujian Analysis & Testing, 2020, 29(1):1-6.
[39] 李素媛, 喻玺, 黄龙, 等.一种新的柱前衍生RP-HPLC法测定渔产品中的生物胺[J].湖北农业科学, 2020, 59(1):145-148.
LI S Y, YU X, HUANG L, et al.Determination of biogenic amines in aquatic products by a new pre-column derivatization RP-HPLC method[J].Hubei Agricultural Sciences, 2020, 59(1):145-148.
[40] 刘慧琳, 赵源, 张瑛, 等.白酒和黄酒中生物胺的高效液相色谱分析法[J].中国食品学报, 2020, 20(8):248-254.
LIU H L, ZHAO Y, ZHANG Y, et al.Determination of biogenic amines in Baijiu and Chinese rice by high performance liquid chromatography[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(8):248-254.
[41] 何丽姗, 涂凤琴, 陈丹, 等.一种快速衍生法测定冷鲜肉中的生物胺[J].食品科技, 2019, 44(5):329-334.
HE L S, TU F Q, CHEN D, et al.A rapid derivatization method for the determination of biogenic amines in cold fresh meat[J].Food Science and Technology, 2019, 44(5):329-334.
[42] 李梅, 汪冬冬, 唐垚, 等.中国市售酱腌菜中生物胺含量分析[J].食品与发酵工业, 2021, 47(14):271-278.
LI M, WANG D D, TANG Y, et al.Analysis of the biogenic amines content in Chinese pickles[J].Food and Fermentation Industries, 2021, 47(14):271-278.
[43] AN D, CHEN Z Q, ZHENG J C, et al.Determination of biogenic amines in oysters by capillary electrophoresis coupled with electrochemiluminescence[J].Food Chemistry, 2015, 168:1-6.
[44] DANIEL D, DOS SANTOS V B, VIDAL D T R, et al.[J].Journal of chromatography, A:Including electrophoresis and other separation methods, 2015, 1 416:121-128.
[45] P OTKA-WASYLKA J, SIMEONOV V, NAMIE
OTKA-WASYLKA J, SIMEONOV V, NAMIE NIK J.An in situ derivatization-dispersive liquid-liquid microextraction combined with gas-chromatography-mass spectrometry for determining biogenic amines in home-made fermented alcoholic drinks[J].Journal of Chromatography A, 2016, 1 453:10-18.
NIK J.An in situ derivatization-dispersive liquid-liquid microextraction combined with gas-chromatography-mass spectrometry for determining biogenic amines in home-made fermented alcoholic drinks[J].Journal of Chromatography A, 2016, 1 453:10-18.
[46] LI C H, JIANG X, HOU X D.Dielectric barrier discharge molecular emission spectrometer as gas chromatographic detector for amines[J].Microchemical Journal, 2015, 119:108-113.
[47] 宋卫得, 许美玲, 高尧华, 等.离子色谱法同时测定果汁中20种有机胺、生物胺和阳离子[J].分析试验室, 2020, 39(5):590-595.
SONG W D, XU M L, GAO Y H, et al.Simultaneous determination of twenty organic amine, biogenic amines and cations in fruit juice by ion chromatography[J].Chinese Journal of Analysis Laboratory, 2020, 39(5):590-595.
[48] OMANOVIC-MIKLICANIN E, VALZACCHI S.Development of new chemiluminescence biosensors for determination of biogenic amines in meat[J].Food Chemistry, 2017, 235:98-103.
[49] FADDA S, VIGNOLO G, OLIVER G.Tyramine degradation and tyramine/histamine production by lactic acid bacteria and Kocuria strains[J].Biotechnology Letters, 2001, 23:2 015-2 019.
[50] LORENZO C, BORDIGA M, PÉREZ- LVAREZ E P, et al.The impacts of temperature, alcoholic degree and amino acids content on biogenic amines and their precursor amino acids content in red wine[J].Food Research International, 2017, 99:328-335.
LVAREZ E P, et al.The impacts of temperature, alcoholic degree and amino acids content on biogenic amines and their precursor amino acids content in red wine[J].Food Research International, 2017, 99:328-335.
[51] 邓红梅. 传统中式香肠中产生物胺氧化酶菌对生物胺影响的研究[D].石河子:石河子大学,2012.
DENG H M, Effect of biogenic amine oxidase on biogenic amines in traditional Chinese sausages[D].Shihezi:Shihezi University, 2012.
[52] GEORGET E, SEVENICH R, REINEKE K, et al.Inactivation of microorganisms by high isostatic pressure processing in complex matrices:A review[J].Innovative Food Science & Emerging Technologies, 2015, 27:1-14.
[53] 相兴伟, 邵宏宏, 郝云彬, 等.辐照对贮藏过程中大管鞭虾生物胺形成的影响[J].中国食品学报, 2018, 18(1):176-183.
XIANG X W, SHAO H H, HAO Y B, et al.The effect of irradiation on the formation of biogenic amines in Solenocera melantho during storage[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(1):176-183.
[54] ZHANG Q Q, JIANG M, RUI X, et al.Effect of rose polyphenols on oxidation, biogenic amines and microbial diversity in naturally dry fermented sausages[J].Food Control, 2017, 78:324-330.
[55] 刘彩霞, 刘双平, 徐岳正, 等.乳酸菌强化技术降低黄酒浸米过程生物胺的积累[J].中国食品学报, 2021, 21(5):166-173.
LIU C X, LIU S P, XU Y Z, et al.Reducing biogenic amines accumulation in rice socking process of Huangjiu based on enhancing technique of Lactobacillus[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):166-173.
[56] 赵佳迪, 单万祥, 钮成拓, 等.豆瓣酱生物胺降解菌株的筛选、鉴定及其降解特性研究[J].食品与发酵工业, 2020, 46(9):64-72.
ZHAO J D, SHAN W X, NIU C T, et al.Screening, identification and biogenic amines-degrading bacteria from Doubanjiang[J].Food and Fermentation Industries, 2020, 46(9):64-72.
[57] YERLIKAYA P, GOKOGLU N, UCAK I, et al.Suppression of the formation of biogenic amines in mackerel mince by microbial transglutaminase[J].Journal of the Science of Food and Agriculture, 2015, 95(11):2 215-2 221.