乙醛(CH3CHO)是乙醇的代谢物,广泛存在于众多食品、环境[1]和过量饮酒者体内[2]。大量的细胞和动物实验研究发现,高剂量(40~1 000 μmol/L)的乙醛会对哺乳动物细胞产生较高毒性、诱变性以及致癌性[3-4]。此外,乙醛还会毒害乙醇生产过程中的微生物,使其无法正常生长,继而使乙醇产量降低[5-8]。世界卫生组织下属的国际癌症研究机构已把乙醛列为Ⅰ类致癌物[9]。
乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)是广泛存在于人和动物的肝脏细胞、植物细胞和微生物细胞中的一种氧化还原酶,可在NAD(P)+存在的条件下催化乙醛脱氢生成乙酸[2]。目前,工业化的ALDH主要从动物的胰腺、肝脏或肝细胞线粒体中提取,由于来源少,提取难度大,产量较低,成本较高,因此尚未得到广泛应用[10-11]。研究发现,微生物ALDH来源丰富,学者们采用测定酶活性的方式获取产ALDH的微生物。目前虽然已从法尔凯干酵母[12]、雪峰干酵母[13]、酿酒酵母[14]、陆生伊萨酵母[15]菌等众多微生物细胞中提取到ALDH,但酶活性普遍较低。由于通过测定酶活性来筛选产ALDH的微生物这种方式工作量大且效率低,所以较难筛选到产高活性ALDH的微生物。醛脱氢酶抑制剂(双硫仑)能够通过抑制ALDH活性来抑制以乙醇为主要碳源的产ALDH微生物的生长,而产生较高活性ALDH的微生物因ALDH活性只受到部分抑制而能够利用乙醇继续生长。通过调整双硫仑的浓度初步分离出一部分产较高活性ALDH的微生物,再以测定酶活性的方式确定最终结果,2种方法结合使用则能更高效并精确地筛选到产高活性ALDH的微生物菌株[5,15-18]。
本研究以双硫仑抗性筛选结合酶活性测定的方式从葡萄样品中筛选出产高活性ALDH的微生物,采用超声波破碎法提取出ALDH并通过硫酸铵分级沉淀和DEAE-Sephacel阴离子交换层析将ALDH分离纯化,研究该酶的最适反应温度、最适反应pH、热稳定性、pH稳定性、金属离子的影响、底物特异性和动力学,为食品和环境中的乙醛降解奠定基础。
1 材料与方法
1.1 样品与培养基
样品:无锡自然葡萄园的土壤和葡萄。
无碳培养基(g/L):(NH4)2SO4 5,KH2PO4 1,NaCl 0.1,MgSO4·7H2O 0.5,CaCl2 0.1,酵母粉 0.1,121 ℃灭菌15 min[5,19]。
双硫仑培养基(g/L):无碳培养基,琼脂粉20,无水乙醇20,不同浓度的双硫仑。无水乙醇和双硫仑试剂经0.22 μm微孔滤膜过滤除菌。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(g/L):酵母粉10,蛋白胨20,葡萄糖20,115 ℃灭菌30 min。
1.2 主要试剂及仪器
辅酶NAD+、酵母菌通用PCR引物[NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)、NL4(5′-GGTCCGTGTTTCAAGACGG-3′)],生工生物工程(上海)股份有限公司;双硫仑,上海麦克林生化科技有限公司;三羟甲基氨基甲烷、40%乙醛溶液、KCl、β-巯基乙醇、(NH4)2SO4,国药集团化学试剂有限公司;DNA Marker和2×Taq DNA Polymerase,大连宝生物工程有限公司。
B00 N-900 N超声波细胞破碎仪,上海版诺生物科技有限公司;SYNERGY/H1酶标仪,美国BioTek公司;PCR仪、凝胶成像仪,美国Bio-Rad公司;AKTA蛋白纯化仪、阴离子交换柱,美国通用电器;GC-2030AF气相色谱仪,日本岛津公司。
1.3 菌株的分离与筛选
1.3.1 初筛
称取10 g葡萄园土壤和新鲜葡萄,分别制成土壤悬液和葡萄汁液,用无菌生理盐水将两者梯度稀释,分别吸取100 μL,10-4、10-5和10-6稀释度的土壤悬液和葡萄汁液涂布于含0.5、1.0、1.5、2.0、2.5、3.0、3.5、4 mg/L双硫仑的无碳培养基平板,于30 ℃培养4~5 d后将含最高浓度双硫仑平板上的单菌落挑出并划线分离,保存于YPD斜面培养基[5, 19]。
1.3.2 复筛
将初筛得到的菌株在YPD固体培养基平板上划线活化,挑取单菌落接种于5 mL YPD液体培养基中,于30 ℃,220 r/min恒温摇床中过夜培养,以体积分数1%的接种量接入50 mL YPD液体培养基中,在30 ℃、220 r/min恒温摇床中振荡培养48 h。取3 mL发酵液于8 000 r/min离心5 min后收集全部菌体,用PBS(pH 7.4)洗涤并重悬菌体后进行超声波破碎(开4 s,关5 s,工作时间20 min),12 000 r/min离心3 min,取上清液测定酶活力[5]。
将Tris-HCl(pH 9.2)、辅酶NAD+、乙醛、KCl、β-巯基乙醇和超纯水按照表1 ALDH活力测定体系中的添加量提前混匀,在35 ℃条件下温浴10 min后加入ALDH,迅速使用酶标仪检测340 nm下吸光度值的变化量,每隔1 min读取1次吸光度值,总反应时间为5 min,根据每分钟吸光度值的变化量计算出ALDH的酶活力[20]。
表1 ALDH活力测定体系
Table 1 Enzyme activity assay system of ALDH

组分体积/μL1 mol/L Tris-HCl(pH 9.2)3020 mmol/L NAD+30100 mmol/L 乙醛203 mol/L KCl101 mmol/L β-巯基乙醇3酶10水197
酶活力定义:在35 ℃下,1 min在340 nm下吸光度值发生0.001的数量变化定义为1个活力单位。ALDH的酶活力按公式(1)(2)计算[21]:
酶活力![]()
(1)
比酶活力![]()
(2)
1.4 产ALDH菌株的鉴定
1.4.1 菌株菌落及细胞形态
根据产生菌的菌落和菌体形态、繁殖方式可以进行菌种初步分类鉴定[5, 22]。
1.4.2 菌株ITS rRNA序列的PCR扩增与序列测定
使用酵母ITS rRNA的通用引物进行PCR扩增,扩增体系为:2×Taq DNA聚合酶12.5 μL,10 μmol/L NL1和NL4各1 μL,菌液1 μL,水9.5 μL,混匀后即离心;PCR程序为:94 ℃ 3 min,预变性;94 ℃ 30 s,变性;55 ℃ 30 s,退火;72 ℃ 1 min,延伸;由变性到延伸设定为34个循环;72 ℃延伸10 min后反应终止[5]。经琼脂糖凝胶电泳检测后将PCR产物送至上海生工测序。
1.4.3 ITS rRNA序列比对及系统发育树构建
将菌株的ITS rRNA序列上传至GenBank进行BLAST比对,筛选出与待鉴定菌株ITS rRNA序列同源性较高的序列,利用MEGA 7.0软件以距离矩阵法中的Neighbor-Joining构建系统发育树[5]。
1.5 ALDH的分离纯化
1.5.1 硫酸铵分级沉淀
在冰浴条件下,将粗酶液置于磁力搅拌器上,一边搅拌一边缓慢加入硫酸铵粉末至饱和度依次达到35%、45%、55%、60%、70%、80%,分别于4 ℃静置2 h,10 000 r/min离心20 min后收集分级沉淀,将沉淀溶于2 mL缓冲液A(pH 7.4,含0.01 mol/L磷酸钾缓冲液,体积分数3%的甘油,0.1 mol/L海藻糖,1 mmol/L二硫苏糖醇)中并在相同的缓冲液中透析脱盐,测定沉淀中的ALDH活力和蛋白质含量,确定使ALDH沉淀的最佳硫酸铵浓度范围。
1.5.2 DEAE-Sephacel阴离子交换层析
DEAE-Sephacel层析柱(2.6 cm×9 cm)预先用缓冲液A平衡,柱床体积为50 mL。取10 mL经脱盐处理的酶液上样于该柱,用缓冲液A和缓冲液B(缓冲液A、1 mol/L NaCl)分段洗脱,收集活性ALDH并经缓冲液A透析脱盐后浓缩至一定体积,经SDS-PAGE分析后确定最佳洗脱盐浓度。
1.6 ALDH的酶学性质研究
1.6.1 ALDH的最适反应温度及热稳定性
为探究ALDH的最适反应温度,分别测定反应体系在不同温度(30、40、50、60、70、80、90 ℃)下的酶活力,以检测到的最高酶活力为100%,计算各温度下的相对酶活力。将ALDH在不同温度下保温120 min后,计算各温度下的剩余酶活力,以未处理组的酶活力为100%[20]。
1.6.2 ALDH的最适反应pH及pH稳定性
为探究ALDH的最适反应pH,将酶活力测定体系的 Tris-HCl(pH 9.2)和水替换成不同pH梯度(pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0)的广泛缓冲液,其他条件不变,分别测定不同pH条件下的ALDH活性,以检测到的最高酶活力为100%,计算各pH条件下的相对酶活力。将酶液在不同pH缓冲液中保存2 h后,测定剩余酶活力,以未处理组的酶活力为100%。
1.6.3 金属离子对ALDH的影响
向酶的反应体系中加入浓度为5 mmol/L的金属离子(Na+、K+、NH4+、Ca2+、Co2+、Ni2+、Cu2+、Ba2+、Mg2+、Mn2+、Zn2+),以检测到的最高酶活力为100%,计算ALDH的相对酶活力,以未添加金属离子检测到的酶活力为对照。
1.6.4 ALDH的底物特异性研究
底物特异性是在最适反应温度和pH条件下,将酶活力测定体系中的乙醛替换成等浓度的甲醛、丙醛、正丁醛、戊二醛、丙酮醛、苯甲醛、水杨醛,其他条件不变,分别测定乙醛脱氢酶的活力性,以检测到的最高酶活力为100%,计算相对酶活力。
1.6.5 酶动力学常数的测定
将乙醛稀释成不同浓度(0.2~5.0 mmol/L),将辅酶NAD+稀释成不同浓度(0.1~2.0 mmol/L),将ALDH纯酶液分别加入到不同浓度底物和辅酶NAD+中,测定反应初速,并绘制底物浓度和反应速度,以及辅酶NAD+浓度和反应速度之间的散点图,再利用Origin 2021对各个数据点使用米氏方程展开非线性拟合至收敛,求得最大反应速度(Vmax)和米氏常数(Km),并进一步计算催化常数Kcat及催化效率Kcat/Km[20, 23]。
1.7 乙醛降解实验
1.7.1 乙醛标准曲线的绘制
精密配制不同质量浓度的乙醛标准溶液(5、10、15、20、25 mg/L)并加入到20 mL的顶空瓶中,在75 ℃下水浴加热30 min,用2 mL注射器均匀吸取出1 mL液上气体,迅速注入气相色谱进行检测[5]。以峰面积y对乙醛浓度x作线性回归,方程为y=7 090.48x-3 774.2(R2=0.997 7)。
1.7.2 样品处理和顶空进样条件
样品处理:将提取到的ALDH粗酶液加入到装有酶反应混合液[1 mol/L Tris-HCl(pH 9.2),20 mmol/L 辅酶NAD+,100 mmol/L乙醛,3 mol/L KCl,1 mmol/L巯基乙醇]的20 mL的顶空瓶中,加水至终体积为3 mL,立即用铝帽密封并置于35 ℃的水浴锅反应2 h,然后沸水浴10 min将ALDH灭活,以不加辅酶NAD+的体系为对照。
顶空进样条件:将装有3 mL样品的顶空瓶经75 ℃水浴加热30 min,用2 mL注射器吸取2 mL液上气体,迅速注入气相色谱分析乙醛含量的变化。
1.7.3 色谱操作条件
色谱分析柱:HP-INNOWAX毛细管柱(30 m×0.25 mm×0.5 μm);柱温40 ℃恒温5 min,以5 ℃/min的速度升温至150 ℃,然后按20 ℃/min增至250 ℃,约保持2 min后结束分析;检测器200 ℃;进样口200 ℃;高纯N2(载气)流速1.2 mL/min;分流比设为25∶1;H2 40 mL/min,空气400 mL/min,N2 45 mL/min[5, 24]。
1.7.4 数据分析和处理
按上述条件检测并根据外标法计算样品中的乙醛含量,设置3次平行实验,取平均值,按公式(3)计算乙醛降解率(%):
乙醛降解率![]()
(3)
式中:ρ0,对照反应中的乙醛质量浓度,mg/L;ρ,酶催化反应结束后剩余的乙醛质量浓度,mg/L。
2 结果与分析
2.1 产ALDH菌株的筛选
由图1可知,涂满新鲜葡萄汁液的双硫仑平板上生长了许多菌落,且随着双硫仑浓度的提高,平板上的菌落逐渐减少,直到含有4.0 mg/L双硫仑的平板上不再有菌落生长。将含3.5 mg/L双硫仑的平板上的单菌落划线分离后进行摇瓶发酵,由表2可知,共有6株菌产生较高活性的ALDH,其中菌株CT-20产生的ALDH活性最高,为13.26 U/mL,故选择菌株CT-20作为下一步研究对象。

图1 双硫仑平板筛选产ALDH菌株
Fig.1 Screening of ALDH-producing strains by disulfiram plates
表2 不同菌株ALDH活性
Table 2 ALDH activity of different strains
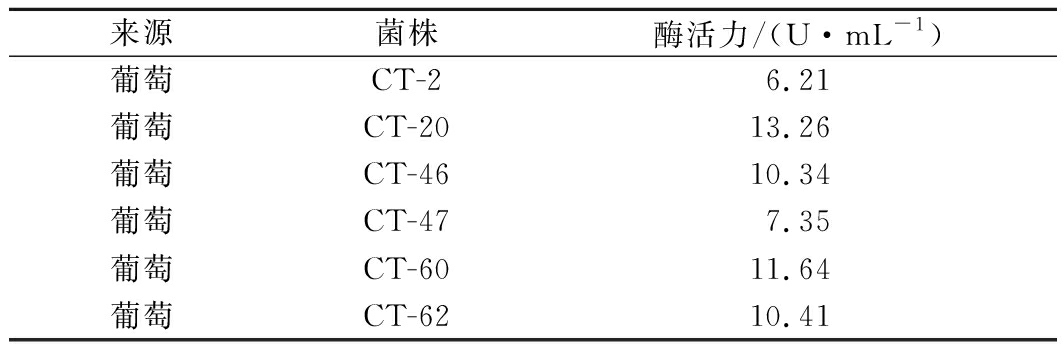
来源菌株酶活力/(U·mL-1)葡萄CT-26.21葡萄CT-2013.26葡萄CT-4610.34葡萄CT-477.35葡萄CT-6011.64葡萄CT-6210.41
2.2 菌株的初步鉴定
2.2.1 菌株的形态特征
观察菌株CT-20在YPD固体培养基和双硫仑固体培养基上的生长形态,发现CT-20在YPD这样营养充分的培养基上培养48 h后呈现微白色,圆形凸起状,表面光滑且湿润,质地比较均一,易挑取的状态,如图2-a所示;在双硫仑培养基这样营养匮乏的恶劣条件下,菌落边缘长出明显的假菌丝,如图2-b;在光学显微镜下,CT-20呈短卵形或球形,直径在4~6 μm,具有典型的酵母细胞形态特征,同时可观察出该菌较明显的出芽生殖特征,如图2-c所示。

a-YPD培养基菌落形态;b-双硫仑培养基菌落形态;c-显微镜下细胞形态
图2 菌株CT-20的分离与鉴定
Fig.2 Isolation and identification of strain CT-20
2.2.2 菌株ITS rRNA 序列分析
对菌株CT-20的ITS rRNA序列进行扩增,得到了全长为585 bp的基因序列,将该序列上传至GenBank数据库中(登录号为OM373101),通过BLAST检索GenBank中的全部核酸序列并进行分析和比对,基于ITS rRNA基因序列构建菌株CT-20的系统发育树如图3所示,该菌株与Candida tropicalis MYA-3404序列具有99.65%的相似性,结合菌株的形态特征最终判断菌株CT-20为热带假丝酵母,将其命名为Candida tropicalis LBBE-W1。其产生的乙醛脱氢酶命名为CTALDH(Candida tropicalis aldehyde dehydrogenase)。

图3 基于ITS rRNA序列的菌株CT-20的系统发育树
Fig.3 Phylogenetic tree of strain CT-20 based on ITS rRNA sequences
2.3 ALDH CTALDH的分离纯化
2.3.1 硫酸铵分级沉淀
硫酸铵具有溶解度较大、温度系数偏小、对大多数蛋白活性影响较小等特点,常被用于蛋白质的初步纯化。分别测定饱和度在0%~35%,35%~45%,45%~55%,55%~60%,60%~70%,70%~80%之间析出的沉淀中的CTALDH活性和蛋白含量(以粗酶液的酶活力和总蛋白质含量为100%),确定最佳硫酸铵盐析范围。由图4-a可知,当硫酸铵饱和度在0%~35%和35%~45%时,沉淀中显示出很高的活性,分别达到粗酶液酶活力的31.7%和33.91%,蛋白质含量分别为粗酶液总蛋白质含量的4%和9%;当硫酸铵饱和度>45%时,沉淀中的CTALDH活力仅为粗酶液酶活力的5%左右,蛋白质含量约为粗酶液总蛋白质含量的24%,因此选择在0%~45%的硫酸铵饱和度下沉淀出的蛋白质做进一步纯化。

a-硫酸铵分级沉淀中酶活力和蛋白质含量与硫酸铵饱和度的关系;b-DEAE-阴离子交换层析SDS-PAGE分析
图4 CTALDH的分离纯化
Fig.4 Seperation and purification of CTALDH
注:M-Marker;泳道1-CTALDH纯酶;泳道2-CTALDH粗酶
2.3.2 DEAE-Sephacel阴离子交换层析
将脱盐处理后的硫酸铵沉淀蛋白上样于DEAE-Sephacel柱进行阴离子交换层析,收集洗脱液,通过酶活力测定发现ALDH活性主要集中在0.3~0.4 mol/L NaCl梯度洗脱范围内,将0.4 mol/L NaCl洗脱得到的洗脱液经3 kDa、10 kDa和30 kDa超滤管过滤并浓缩后进行SDS-PAGE鉴定,结果如图4-b,泳道1中显示出一条分子质量约为55 kDa的单一条带,经计算得出CTALDH的比酶活力为181.17 U/mg,是目前报道的酶活力最高的天然ALDH(Issatchenkia terricola XJ-2来源)的5.8倍[11, 24]。
2.4 CTALDH的酶学性质研究
2.4.1 CTALDH的最适反应温度及热稳定性
温度可以通过影响酶蛋白的构象、酶与底物、激活剂和抑制剂的亲和力而影响酶的反应速度。微生物来源的ALDH的最适反应温度一般在35~60 ℃[24],由图5-a可知,CTALDH纯酶的最适反应温度为60 ℃,当温度>80 ℃,活性急剧下降,在90 ℃时几乎失去了全部活性。由图5-b可知,当温度<50 ℃时,该酶具有较好的热稳定性;当温度为60 ℃时,仅孵育60 min酶活力便出现明显降低;当温度>70 ℃时,酶活力则迅速降低。
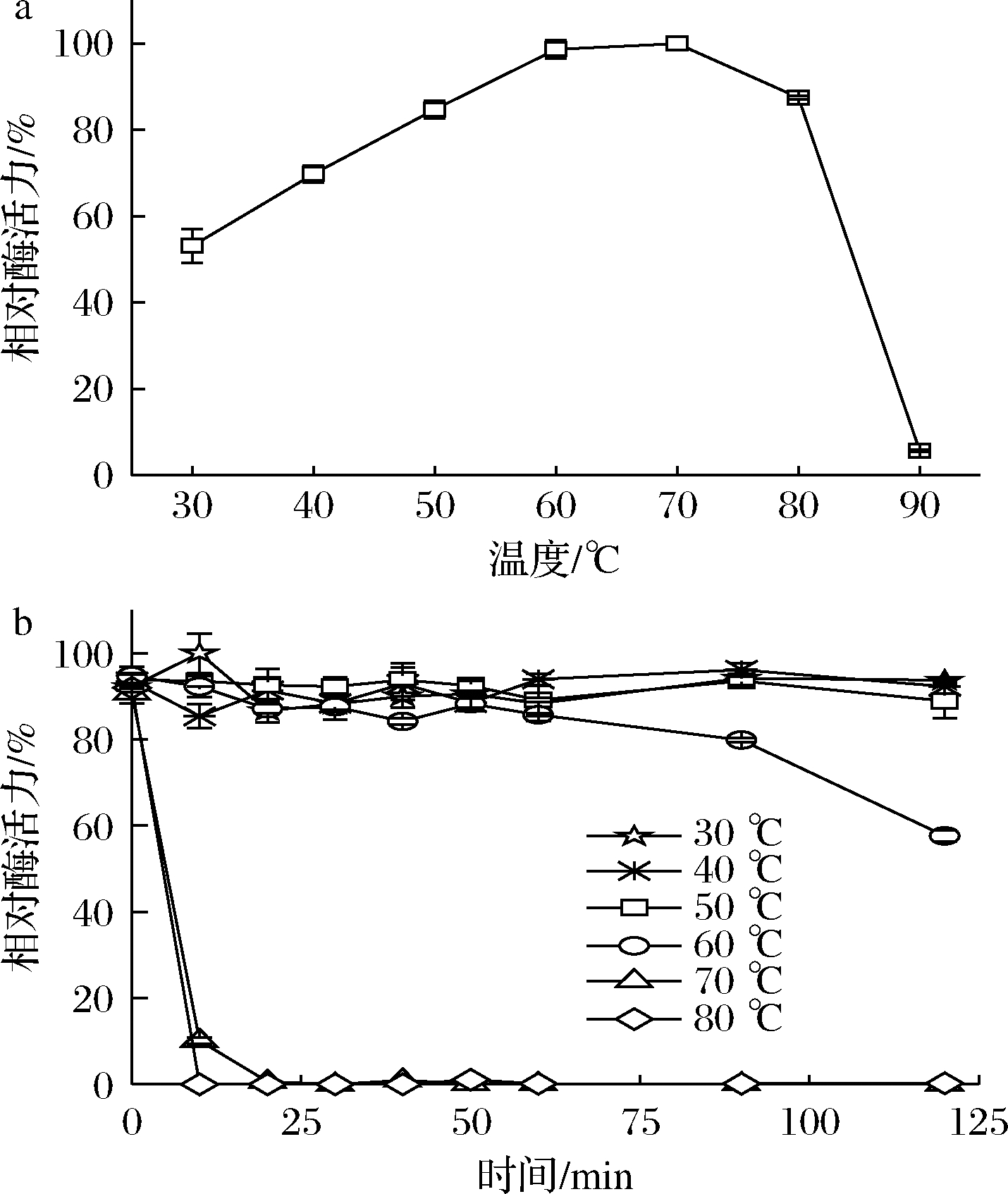
a-最适反应温度;b-热稳定性
图5 温度对CTALDH的酶活力和稳定性的影响
Fig.5 Effect of temperature on the activity and stability of CTALDH
2.4.2 CTALDH的最适反应pH及pH稳定性
pH通过影响酶的构象和底物的带电状态而影响酶和底物的亲和力,继而影响酶的催化反应速度。由图6-a可知,CTALDH纯酶对酸性环境高度敏感,当pH<6.0时,酶活力随着pH值的增加而提高,但均低于50%;当pH值达到9.0时,酶活力最高;当pH>9.0时,酶活力迅速降低。CTALDH在弱碱性环境中活性最高,在强酸性和强碱性环境中迅速失活,这与大部分微生物来源的ALDH的最适反应pH相似。由图6-b可知,CTALDH在pH 7.0~9.0孵育120 min具有较好的稳定性,ALDH酶活力保留了80%以上;当pH>5.0或pH<9.0时,CTALDH迅速失去活性。
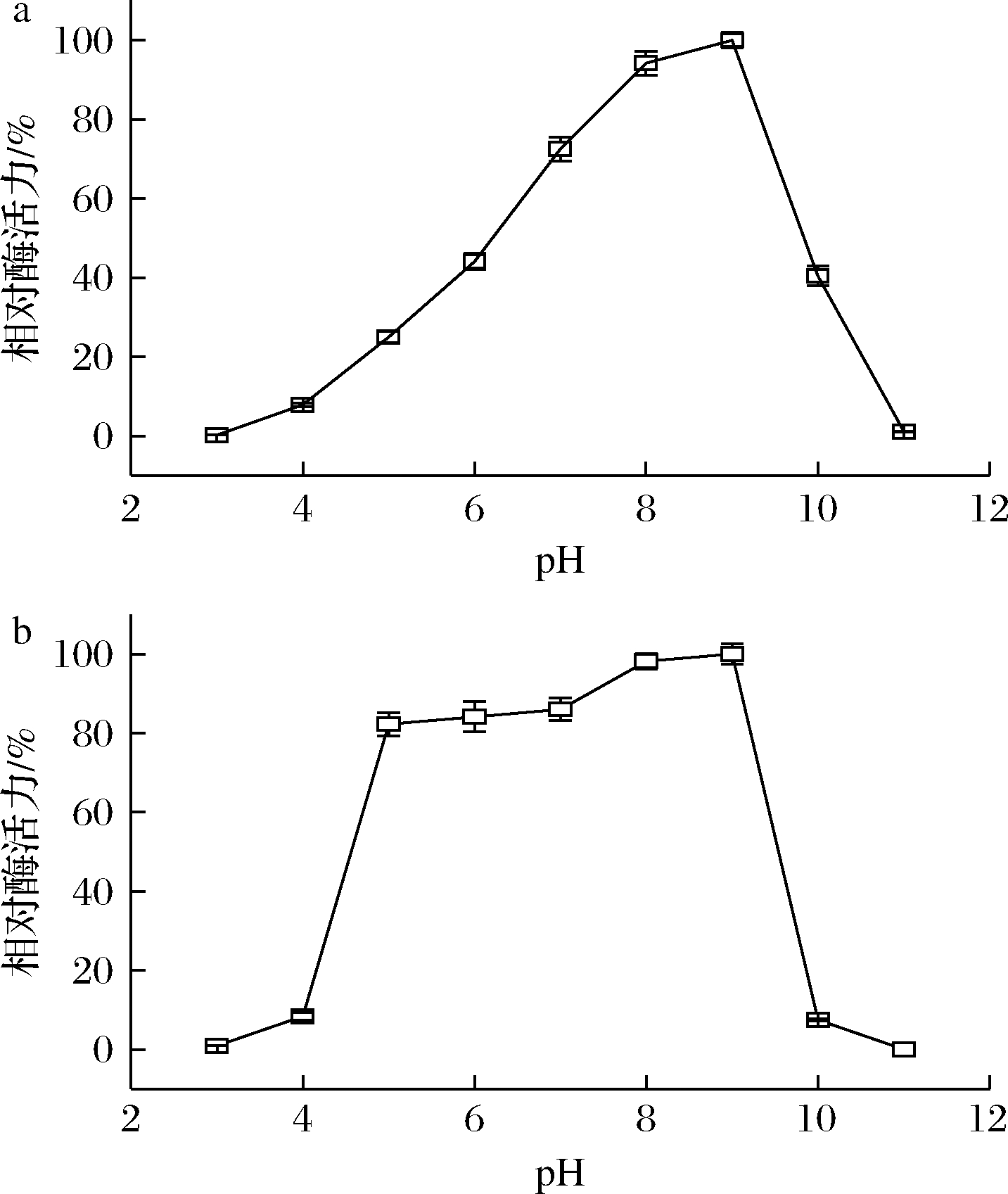
a-最适反应pH;b-pH稳定性
图6 pH对CTALDH的酶活力和稳定性的影响
Fig.6 Effect of pH value on activity and stability of CTALDH
2.4.3 金属离子对CTALDH的影响
金属离子通过与酶结合可以稳定酶的最佳活性构象,提高与底物的亲和力,从而对酶活力起到激活作用,也可能影响到酶的必需基团或活性部位而抑制酶活力[25]。由图7可知,金属离子Na+、K+、Ba2+对CTALDH纯酶的活性具有明显促进作用,金属离子Ni2+、Cu2+和Mn2+对CTALDH活性具有较强烈的抑制作用。
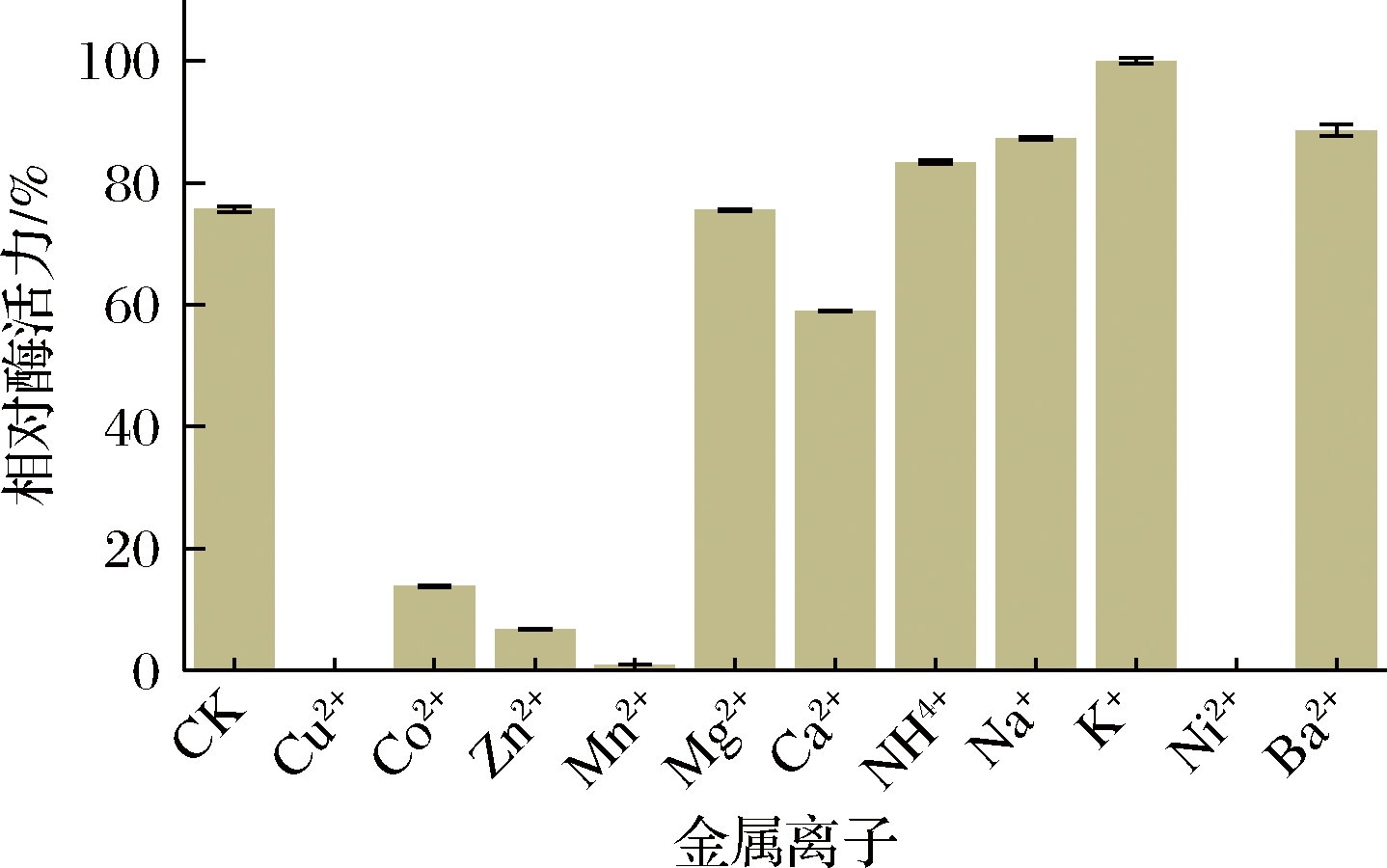
图7 金属离子对CTALDH的影响
Fig.7 Effect of metal ions on CTALDH
2.4.4 CTALDH的底物特异性
为了考察CTALDH对底物的特异性,选择7种底物替代乙醛进行研究。结果如图8所示,CTALDH对甲醛、戊二醛、水杨醛具有较低的活性,对乙醛表现出最高的活性,这一结果表明CTALDH具有较狭窄的底物特异性,乙醛是其最适底物。
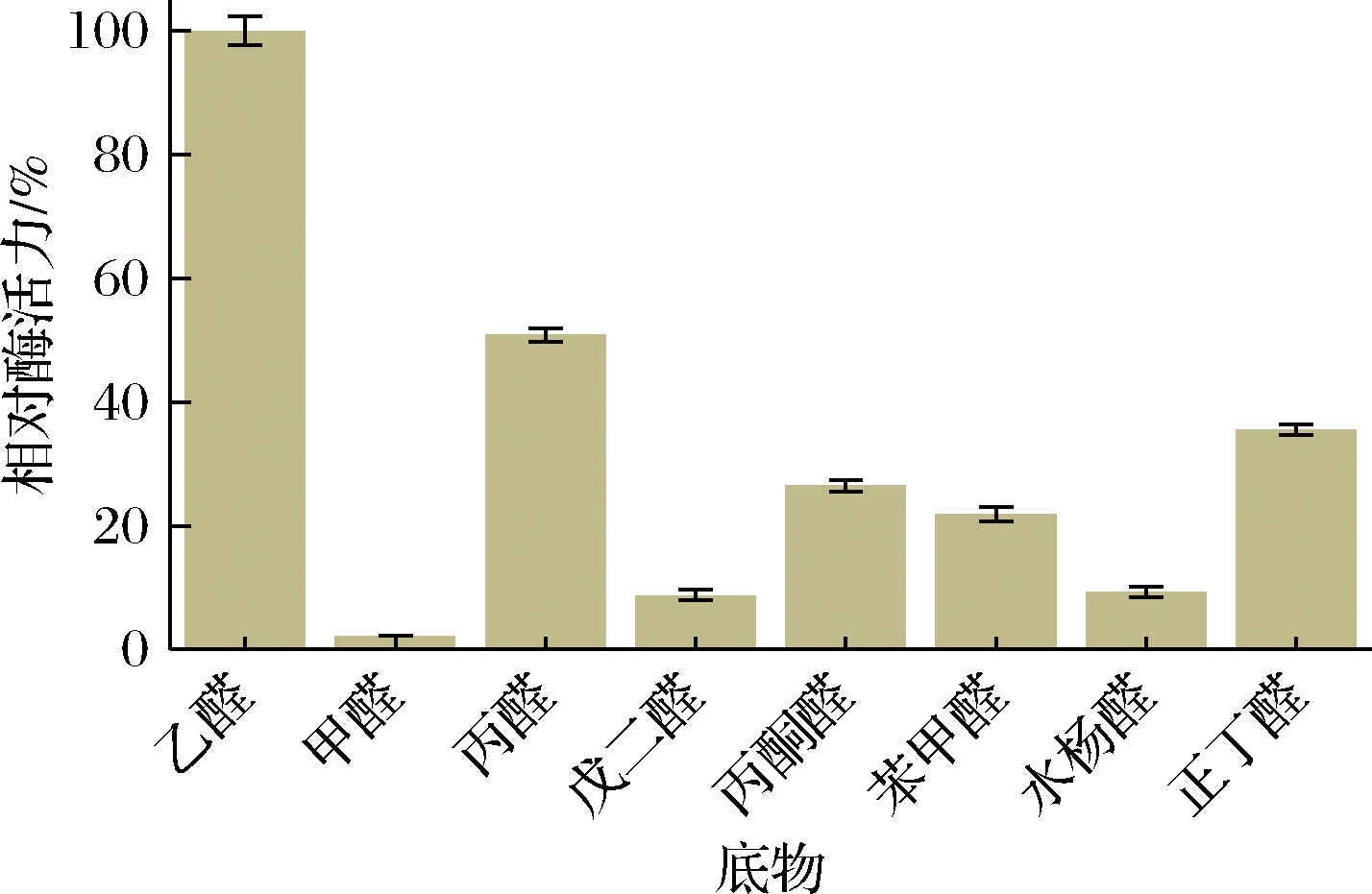
图8 CTALDH的底物特异性
Fig.8 Substrate specificity of CTALDH
2.4.5 酶动力学常数的测定
通过酶的动力学研究,可推断该酶促反应的机理。Vmax值随酶浓度的差异而改变,米氏常数Km值则是酶的另一种特性常量,它由酶反应的固有特性而决定,并因外部条件如pH、温度、离子强度等的影响而出现不同变化[20-21]。将纯化的CTALDH添加到具有不同底物浓度(0.20~5.0 mmol/L)和不同浓度辅酶NAD+(0.10~2.00 mmol/L)的酶反应液中,可以计算得出CTALDH作用于底物乙醛时的米氏常数Km为13.35 mmol/L、最大速度Vmax为156.36 U/mg;辅酶NAD+的米氏常数Km为1.34 mmol/L,最大速度Vmax为36.91 U/mg。CTALDH的催化常数Kcat为130.3/s,催化效率Kcat/Km为9.76 L/(mmol·s)。
2.5 乙醛降解结果
利用顶空气相色谱测定CTALDH催化反应后乙醛的残余量,已知乙醛标准品的出峰时间为6.23 min[5],由图9可知,酶反应液中的乙醛峰面积(B)与其对照(A)比较明显减小,表明菌株C. tropicalis LBBE-W1产生的CTALDH具有良好的乙醛降解能力。通过乙醛标准曲线方程计算出CTALDH对乙醛的降解效率达到95.12%,这与姚正颖[24]在E.coli JM109中表达的I.terricola XJ-2来源的ALDH乙醛降解能力同处于较高水平。
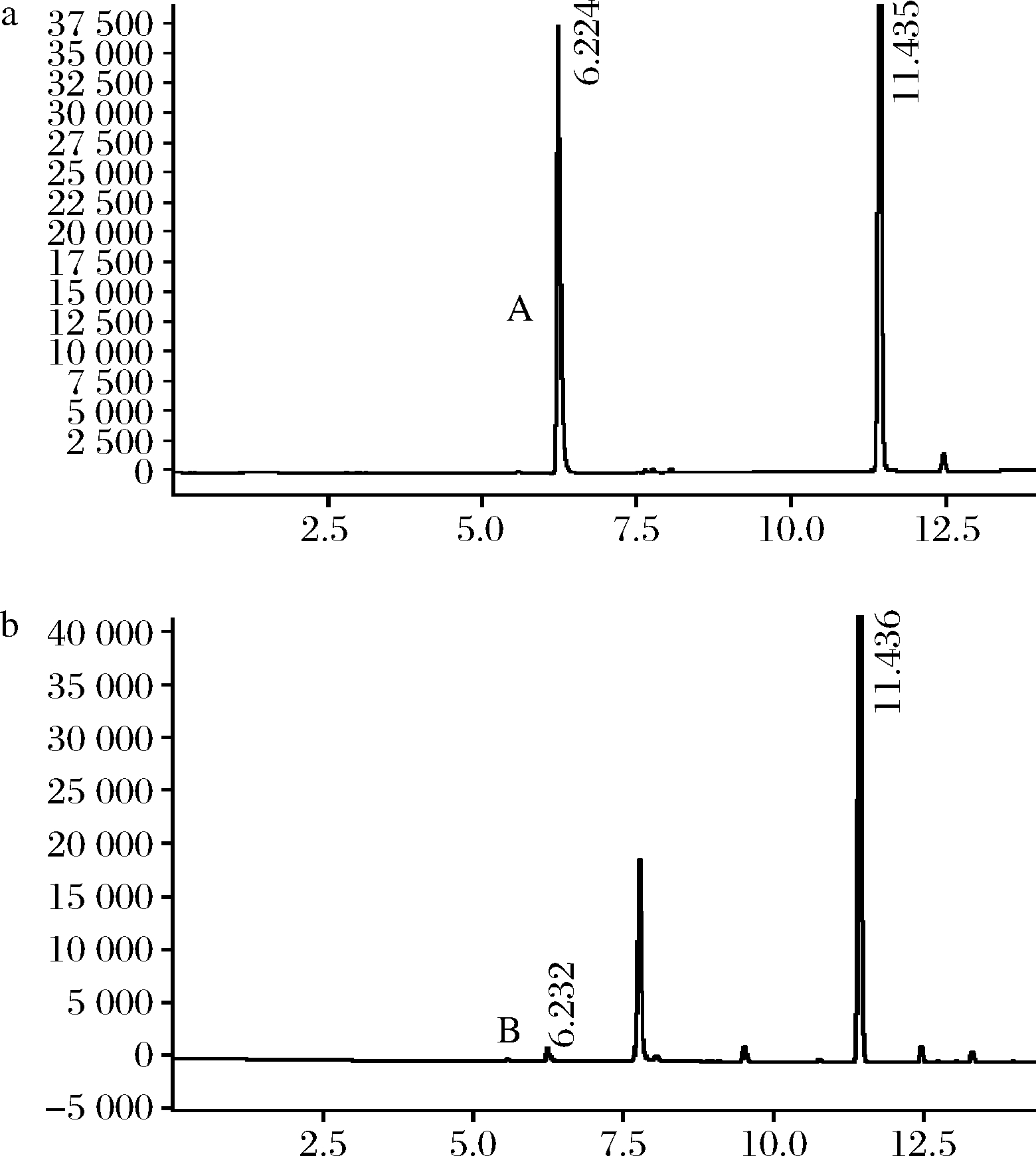
a-空白对照乙醛峰;b-CTALDH反应后的乙醛峰
图9 乙醛降解图
Fig.9 Acetaldehyde degradation diagram
3 结论
本研究分离到1株酵母菌株Candida tropicalis LBBE-W1,其产生的CTALDH活力为13.26 U/mL,比酶活力为181.17 U/mg。CTALDH的最适反应温度为60 ℃,最适反应pH为8.0~9.0。该酶在30~50 ℃和pH 5.0~9.0条件下具有较好的稳定性。金属离子Na+、K+、Ba2+均对CTALDH活性具有促进作用,而Ni2+、Cu2+、Mn2+则对其具有明显的抑制作用,乙醛是CTALDH的最适底物。CTALDH作用底物乙醛和辅酶NAD+的米氏常数Km分别为13.35 mmol/L和1.34 mmol/L、最大反应速度Vmax分别为156.36 U/mg和36.91 U/mg;CTALDH的催化常数Kcat为130.3/s,催化效率Kcat/Km为9.76 L/(mmol·s)。CTALDH 在2 h内乙醛降解率达到95.12%,在乙醛降解领域具有较大的潜力。
[1] LACHENMEIER D W, KANTERES F, REHM J.Carcinogenicity of acetaldehyde in alcoholic beverages:Risk assessment outside ethanol metabolism[J].Addiction (Abingdon, England), 2009, 104(4):533-550.
[2] 曹婳. 改造益生大肠杆菌降解乙醇和乙醛以减轻过度饮酒小鼠机体损伤[D].兰州:兰州大学, 2021.
CAO H.Genetically encoded probiotic Nissle 1917 to alleviate alcohol-induced acute mice body injury[D].Lanzhou:Lanzhou University, 2021.
[3] MIZUMOTO A, OHASHI S, HIROHASHI K, et al.Molecular mechanisms of acetaldehyde-mediated carcinogenesis in squamous epithelium[J].International Journal of Molecular Sciences, 2017, 18(9):1943.
[4] LYU Y B, ZHONG L, LIU Y N, et al.Protective effects of Lactococcus lactis expressing alcohol dehydrogenase and acetaldehyde dehydrogenase on acute alcoholic liver injury in mice[J].Journal of Chemical Technology & Biotechnology, 2018, 93(5):1 502-1 510.
[5] 张娟, 陈坚, 汪冉, 等.一株乙醛脱氢酶高产菌株的分离与鉴定:CN113046252B[P].2022-07-05.
ZHANG J, CHEN J, WANG R, et al.Isolation and characterization of a high-producing strain of acetaldehyde dehydrogenase:CN113046252A[P].2022-07-05.
[6] MANOW R, WANG C, GARZA E, et al.Expression of acetaldehyde dehydrogenase (aldB) improved ethanol production from xylose by the ethanologenic Escherichia coli RM10[J].World Journal of Microbiology & Biotechnology, 2020, 36(4):59.
[7] O’GRADY I, ANDERSON A, O’SULLIVAN J.The interplay of the oral microbiome and alcohol consumption in oral squamous cell carcinomas[J].Oral Oncology, 2020, 110:105011.
[8] WANG W J, WANG C G, XU H X, et al.Aldehyde dehydrogenase, liver disease and cancer[J].International Journal of Biological Sciences, 2020, 16(6):921-934.
[9] SEITZ H K, STICKEL F.Acetaldehyde as an underestimated risk factor for cancer development:Role of genetics in ethanol metabolism[J].Genes & Nutrition, 2010, 5(2):121-128.
[10] 吴桂英. 酿酒酵母产乙醇脱氢酶和乙醛脱氢酶的研究[D].武汉:武汉工程大学, 2007.
WU G Y.Study on alcohol dehydrogenase and aldehydedehydrogenase from Saccharomyces cerevisiae[D].Wuhan:Wuhan Institute of Technology, 2007.
[11] LU J, LYU Y B, LI M T, et al.Alleviating acute alcoholic liver injury in mice with Bacillus subtilis co-expressing alcohol dehydrogenase and acetaldehyde dehydrogenase[J].Journal of Functional Foods, 2018, 49:342-350.
[12] 杨伟伟, 高秀峰, 包海生, 等.法尔凯干酵母乙醛脱氢酶的提取和纯化研究[J].酿酒科技, 2010(6):32-34.
YANG W W, GAO X F, BAO H S, et al.Extraction and purification of aldehyde dehydrogenase from faerkai dry active yeast[J].Liquor-Making Science & Technology, 2010(6):32-34.
[13] 陈贵佺. 雪峰干酵母中乙醛脱氢酶提取及其酶学性质研究[D].广州:华南理工大学, 2012.
CHEN G Q.Studies on the extraction of ALDH from Xuefeng dry yeast and enzymatic properties of the ALDH[D].Guangzhou:South China University of Technology, 2012.
[14] 周百灵, 高秀峰, 吴晓婷, 等.酿酒酵母胞浆中乙醛脱氢酶的提取和研究[J].酿酒科技, 2009(6):28-30.
ZHOU B L, GAO X F, WU X T, et al.Extraction of and research on cytosolic aldehyde dehydrogenase from Saccharomyces cerevisiae[J].Liquor-Making Science & Technology, 2009(6):28-30.
[15] YAO Z Y, ZHANG C, LU F X, et al.Gene cloning, expression, and characterization of a novel acetaldehyde dehydrogenase from Issatchenkia terricola strain XJ-2[J].Applied Microbiology and Biotechnology, 2012, 93(5):1 999-2 009.
[16] XU X, NIU C T, LIU C F, et al.Unraveling the mechanisms for low-level acetaldehyde production during alcoholic fermentation in Saccharomyces pastorianus lager yeast[J].Journal of Agricultural and Food Chemistry, 2019, 67(7):2 020-2 027.
[17] 许鑫. 基于增变因子选育低乙醛啤酒酵母及机制解析[D].无锡:江南大学, 2020.
XU X.Application of perturbation factor for breeding lager yeast with lower acetaldehyde production and related mechanisms analysis[D].Wuxi:Jiangnan University, 2020.
[18] 刘春凤. 啤酒酿造酵母M14低产乙醛的研究[D].无锡:江南大学, 2019.
LIU C F.Research of brewing yeast M14 with low acetaldehyde production[D].Wuxi:Jiangnan University, 2019.
[19] 沈楠. 低产乙醛啤酒酵母的选育[D].无锡:江南大学, 2013.
SHEN N.Screening of brewer’s yeast of low acetaldehyde production[D].Wuxi:Jiangnan University, 2013.
[20] 豆欣喜, 张明, 林材, 等.乙醛脱氢酶的克隆表达及其酶学性质[J].食品与发酵工业, 2018, 44(4):22-28.
DOU X X, ZHANG M, LIN C, et al.Expression and enzymatic properties of acetaldehyde dehydrogenase[J].Food and Fermentation Industries, 2018, 44(4):22-28.
[21] 豆欣喜. 人源ALDH2基因在酿酒酵母中的表达及其酶学性质研究[D].无锡:江南大学, 2018.
DOU X X.Expression of human ALDH2 gene in Saccharomyces cerevisiae and study on its enzymatic properties[D].Wuxi:Jiangnan University, 2018.
[22] GUZ S.The yeasts:A Taxonomic Study, 5th edition [J].Library Journal, 2011, 136(18):108-108.
[23] 周冠宇, 李江华, 彭政, 等.定点突变提高枯草芽孢杆菌角蛋白酶的低温催化活性[J].微生物学通报, 2022, 49(1):1-13.
ZHOU G Y, LI J H, PENG Z, et al.Improving the low-temperature activity of Bacillus subtilis keratinase by site-directed mutagenesis[J].Microbiology China, 2022, 49(1):1-13.
[24] 姚正颖. Issatchenkia terricola XJ-2乙醛脱氢酶的纯化和性质及其基因的克隆与表达[D].南京:南京农业大学, 2011.
YAO Z Y.Purification, characterization, gene cloning and expression of acetaldehyde dehydrogenase from Issatchenkia terricola strain XJ-2[D].Nanjing:Nanjing Agricultural University, 2011.
[25] LIU Y C, TANG Y Q, KENJI K.Application of OMICS technology in construction of Saccharomyces cerevisiae strains for ethanol production[J].China Biotechnology, 2014, 34:118-128.