根据世界卫生组织统计,心血管疾病是造成目前全球人口的主要死因之一,每年有1 700多万人因此死亡[1]。同时预测心血管疾病将继续成为人类死亡的主要原因。到2030年,全球近2 300万人将死于以心脏病、中风为主的心血管疾病[2]。
高脂血症以总胆固醇、甘油三酯和低密度脂蛋白水平升高以及高密度脂蛋白水平降低为特征,是引起动脉粥样硬化和心血管疾病发展的重要危险因素,严重威胁人类的健康[3]。有报告称,血清胆固醇>5.2 mmol/L,患冠状动脉心脏疾病的风险则会增加35%,同时,降低血清中胆固醇水平的1%,可以将患心脑血管疾病的风险降低2%~3%[4]。
合理饮食和适量运动有助于降低体内血脂水平,但药物治疗必不可少。尽管他汀类、贝特类、烟酸类等临床常用药物是治疗高脂血症最快捷的途径[5],但是大多数化学合成的降脂药物都存在使血清转氨酶升高、造成肝毒性等不良反应,需长期服用药物,费用较高,病情易反复[6]。鉴于此,开发安全、可靠、经济的降血脂功能性食品对降低心血管疾病的患病率尤为重要。目前研究表明,一些发酵乳制品内的乳酸菌具有一定的降血脂作用,研究发现乳酸菌在体内使胆固醇的含量降低1%,心血管疾病的发病率可降低2%~3%[7]。PEREIRA等[8]发现分离自人体肠道中的乳酸菌和双歧杆菌具有胆固醇同化作用。酸奶和发酵豆奶中的双歧杆菌也被证实对高血脂症有缓解作用。我国青藏高原地区传统发酵牦牛酸乳由于独特的气候环境以及传统的发酵工艺,其中蕴含着丰富的乳酸菌资源,且富有独特的生理学特性。DING等[10]研究表明,从我国青藏高原传统发酵牦牛乳中分离出的乳酸菌菌株比其他报道乳制品中分离出的乳酸菌具有更高的降胆固醇活性,这种差异可能是由于在中国青藏高原高脂肪浓度的发酵牦牛奶经过长时间的自然选择所致。因此,传统发酵牦牛酸乳成为筛选具有降血脂水平乳酸菌的宝库。
本研究立足于青藏高原传统发酵乳制品中分离纯化出来的乳酸菌菌株,从中筛选出具有降胆固醇功能的益生乳酸菌,测定其体外胆固醇清除率、生长性能、发酵性能、耐酸耐胆盐能力、表面疏水性及耐药性,以期筛选出有开发潜力并可用于功能性发酵乳生产的乳酸菌,为工业化生产奠定理论基础。
1 材料与方法
1.1 材料与试剂
实验中使用的乳酸菌菌株为本实验室自主分离鉴定得到;嗜热链球菌(Streptococcus thermophilus) CHR Hansen YOFLEX Mild 1.0;保加利亚乳杆菌(Lactobacillus bulgaricus) CHR Hansen YOFLEX Mild 1.0。原料乳(蛋白含量3.2%,脂肪含量4.0%,总固形物12%),收购于当地牧场。
胆固醇,Solarbio公司;牛胆盐,上海Sigma-Aldrich公司;MRS培养基,广东环凯微生物科技有限公司;所有分离用有机溶剂,国产分析纯。
1.2 仪器与设备
T6新世纪紫外可见分光光度计、PT-3502C全波长酶标分析仪,北京普天新桥技术有限公司;LD5-2A超净工作台,上海一恒科技有限公司。
1.3 实验方法
1.3.1 胆固醇降解率的测定
参照贺珊珊等[11]的方法加以改进。配制200 g/L的胆固醇胶束溶液,溶液中V(吐温-80)∶V(无水乙醇)=1∶5,80 ℃水浴加热15 min,用微孔滤膜过滤除菌备用。向MRS肉汤培养基中添加2.0 g/L的牛胆盐和1.0 g/L的蔗糖脂肪酸酯,混匀后121 ℃灭菌15 min,冷却备用。将上述制备的胆固醇胶束溶液加入到MRS培养基中,使培养基中胆固醇的终质量浓度为1 g/L,即为高胆固醇培养基(MRS-CHOL培养基)。将活化后的乳酸菌按1×108 CFU/mL的接种量接种至MRS-CHOL培养基中,37 ℃培养24 h后,4 000 r/min离心10 min,取上清液。以胆固醇氧化酶法测定总胆固醇,胆固醇通过胆固醇酯酶、胆固醇氧化酶、过氧化物酶的作用最终形成红色醌化合物。以去除胆固醇的MRS-CHOL培养基为实验空白对照,分别在96孔板上向酶液中加入1%(体积分数)的待测样品上清液、实验空白对照液、未接菌的MRS-CHOL培养基上清液、5.17 mmol/L胆固醇标品和蒸馏水,37 ℃孵育10 min,用酶标仪在510 nm下测定各孔光密度值,每个样品平行测定3次。
待测菌株对胆固醇的降解率的计算如公式(1)和公式(2)所示:
c(胆固醇)![]()
(1)
式中:c(胆固醇),胆固醇浓度,mmol/L;A1,待测样品的吸光度;A2,实验空白对照的吸光度;A3,胆固醇标品的吸光度;A4,蒸馏水的吸光度。
胆固醇降解率![]()
(2)
式中:c0,MRS-CHOL培养基中的胆固醇浓度,mmol/L;c1,待测样品上清液中的胆固醇浓度,mmol/L。
1.3.2 活菌数的测定
参照GB 4789.35—2016《食品安全国家标准食品 微生物学检验 乳酸菌检验》的方法检测培养基和发酵乳中的乳酸菌活菌数,每个样本平行测定3次。
1.3.3 乳酸菌耐酸性测定
参照HUANG等[12]的方法并进行微调。制备含8 g/L胃蛋白酶的无菌PBS并将其pH分别调至4.0、3.5、2.5、2.0、1.5。乳酸菌活化3代以上,以3%(体积分数,下同)接种量分别接种至不同pH梯度的酸性环境中37 ℃静置培养3 h,测定乳酸菌活菌数。每个样品平行测定3次,菌株存活率的计算如公式(3)所示。
菌株存活率![]()
(3)
式中:a,初始活菌数,CFU/mL;b,处理后活菌数,CFU/mL。
1.3.4 乳酸菌胆盐耐受性测定
参照HUANG等[12]的方法并进行微调。制备含1 g/L胰蛋白酶的无菌PBS(pH 8.0),并分别添加1.0、2.0、3.0、4.0、5.0 g/L的牛胆盐。菌种活化3代以上,以3%接种量分别接种至不同胆盐浓度的环境中37 ℃静置培养4 h,按1.3.2的方法测定乳酸菌活菌数。每个样品平行测定3次,菌株存活率的计算同1.3.3公式(3)。
1.3.5 乳酸菌表面疏水性测定
参照SADISHKUMAR等[13]的方法并进行微调。将乳酸菌发酵液在4 ℃、10 000 r/min离心3 min,弃去上清液,收集菌体沉淀。用无菌PBS(pH=7.4)洗涤菌体沉淀2次,重悬于无菌PBS中,调节菌发酵液的光密度值(OD600)为(0.8±0.05)。取2 mL菌发酵液与2 mL二甲苯混匀,室温静置30 min,分离两相。吸取下层水相,在OD600下测定光密度值。每个样品平行测定3次,菌体表面疏水率(cell-surface hydrophobicity, CSH)的计算如公式(5)所示。
(5)
式中:A0,菌发酵液的吸光度;A1,下层水相的吸光度。
1.3.6 乳酸菌耐药性测定
参照董春阳[14]的方法并进行微调。用生理盐水调节乳酸菌MRS发酵液的光密度值(OD600)为(0.1±0.02)。将菌液均匀涂布于MRS固体培养基表面,分区编号并将抗生素纸片(干燥)贴到涂布后的培养基表面,37 ℃下倒置培养24~48 h。用精确度为1 mm的直尺测量抑菌圈的直径并记录。依据各类抗生素作用机制的不同,分别选取青霉素类的青霉素、头孢类的头孢唑啉、氨基糖苷类的庆大霉素、大环内酯类的四环素、酰胺醇类的氯霉素、喹诺酮类的氧氟沙星这6种常见的抗生素。参照CLSI M100《抗菌药物敏感性试验执行标准2017》,判读菌株对抗生素的耐药性。
2 结果与分析
2.1 具有降胆固醇能力乳酸菌的筛选及鉴定
从青海收集100多份自然发酵的牦牛乳(包括曲拉、发酵乳、发酵奶油、鲜牦牛乳),从中分离出乳酸菌200株。临床试验证明了L.rhamnosus grx10(保藏编号为CGMCC No:2526)具有良好的降血脂能力[15]。筛选出21株菌,其体外胆固醇清除率均超过选定标准菌株L.rhamnosus grx10(63.14%),其中有6株菌的胆固醇清除率>70%。分析发现,YD-4胆固醇清除率显著性(P<0.05)高于Q3-7及之后17株菌,G150~G050间的9株菌胆固醇清除率差异均不显著(P>0.05)。对清除率较高的6株菌YD-4[(74.21%±1.58)%]、G150[(72.96±2.37)%]、Q2-3[(72.54±1.64)%]、G055[(71.96±1.22)%]、Q3-7[(70.69±2.09)%]、Q1-1[(70.475±1.14)%]进行菌种鉴定。
将16S rDNA基因序列分析技术用于细菌的系统分类及鉴定,可以鉴定出筛选菌株与已知序列菌株之间的远近关系[16]。利用BLAST在GenBank核酸序列数据库中对筛选出的6株菌株的16S rDNA基因序列进行检索比对,对鉴定后的菌株重新命名,并从GenBank数据库中选取9种已收录的外源菌株基因序列构建系统发育树,结果如表2和图1所示。


图1 Neighbor-Joining法构建菌株系统发育树
Fig.1 Construction of phylogenetic tree of strains by Neighbor-Joining method
由表2可知,LF-HF04与Lactobacillus fermentum strain CIP 102980的同源性达到100%,LD-G150与Lactobacillus delbrueckii subsp.Bulgaricus 3286的序列相似度最高达到100%,LF-Q2-3与Lactobacillus fermentum strain CIP 102980的同源性为99.93%,LB-G055与Lactobacillus buchneri CQ95-2-1-1-2的相似度为100%,LP-Q3-7与Lactobacillus plantarum MG5355的序列相似度为100%,ST-Q1-1与Streptococuss thermophilus strain 3290的同源性为100%。这6株菌与GenBank数据库中已知乳酸菌的16S rDNA D1/D2区域序列高于99%的同源性,鉴定结果有效[17]。
因为本研究的目的为筛选可食用益生菌菌株,根据《可用于食品的益生菌菌种名单》,Lactobacillus buchneri -G055不在名单之内,将其删除,选择剩余的5株菌株进行进一步的菌种性能实验。其中发酵乳杆菌LF-HF04的胆固醇降解率最高可达74.21%。
从图1可知,所筛选菌株的亲缘关系与BLAST序列比对结果一致,LP-Q2-3、LF-HF04均为发酵乳杆菌,LP-Q3-7为植物乳杆菌,LD-G150为保加利亚乳杆菌,ST-Q1-1为嗜热链球菌。
2.2 筛选乳酸菌的性能研究
具有优良性能的乳酸菌需要满足实际生产中对于乳酸菌生长代谢特性多方面的需要,且适应胃肠道的低pH环境、高渗透压的胆盐环境等特性是益生菌成功定植并发挥益生功能的前提[18]。因此,本实验以菌株生长能力、耐酸性、胆盐耐受力、抗药性及细胞表面疏水性作为评价指标,进行潜在益生性能的筛选研究,并用凝乳试验初步判断菌株的发酵能力,对从发酵乳制品中筛选能用于实际生产需要的具有降血脂功能的乳酸菌具有重要意义。
2.2.1 乳酸菌的生长性能
筛选出的5株菌在MRS培养基中的生长曲线如图2所示,5株乳酸菌在MRS液体培养基中的生长性能良好,生长曲线均为规则的S型曲线。在测定时间24 h内经历了适应期、对数生长期和稳定期。5种菌株进入对数生长期的时间相近,约为1.5 h;LF-HF04、LD-G150、Q1-1进入稳定期的时间约为7.5 h,LF-Q2-3、LP-Q3-7进入稳定期的时间约为8.5 h;4株菌株在稳定期均持续较长时间。进入稳定期后可达到的最大活菌量:LF-HF04>LF-Q2-3>LP-Q3-7>LD-G150>ST-Q1-1,绘制标准曲线计算得LF-HF04在24 h时的活菌数可达7.22×108 CFU/mL。
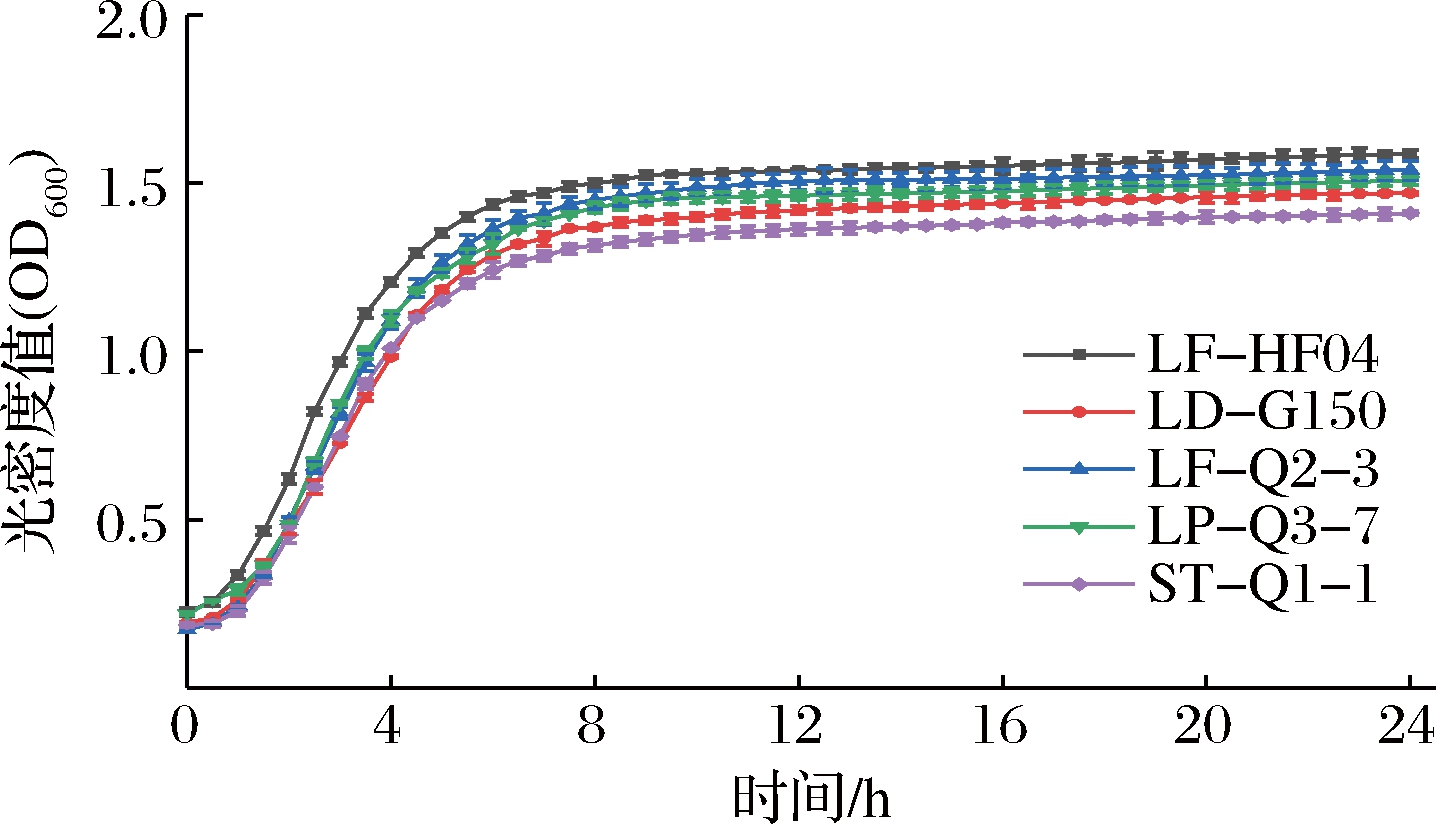
图2 乳酸菌的生长曲线
Fig.2 Growth curve of lactic acid bacteria
2.2.2 乳酸菌的发酵性能
产酸能力是乳酸菌发酵过程中的重要性能,乳酸菌产酸的快慢影响酸奶的组织结构和品质[19]。根据国标GB 19302—2010《食品安全国家标准 发酵乳》中对发酵乳的酸度要求(>70 °T),将筛选出的5株乳酸菌在巴氏杀菌牛乳中发酵,测定酸度达到70 °T所用时间,结果如图3所示。

图3 乳酸菌的产酸性能
Fig.3 Acid production performance of lactic acid bacteria
根据图3可知,2株发酵乳杆菌LF-HF04和LF-Q2-3的发酵性能最好,分别在11.5 和13.5 h时可使发酵乳的酸度达到70 °T。有研究表明,发酵乳杆菌为发酵乳制品中的优势菌株,具有良好的发酵能力[20-21]。其余3株乳酸菌均需要20 h左右其发酵乳酸度才能达到70 °T,植物乳杆菌LP-Q3-7的发酵乳在24.5 h酸度达到70 °T,所用时间最长。这可能是因为植物乳杆菌为植物源乳酸菌,在乳基中的生长性能和产酸能力较差,使得发酵时间较长[22]。由于这5株乳酸菌的单菌发酵时间较长,工厂生产时成本较高,且易造成产品污染,在实际运用时需要采用商业菌种混合发酵,以满足生产中对活菌总数和发酵周期等的需求。
2.2.3 菌株的耐酸和胆盐耐受能力
益生菌作为正常肠道菌群的一员,在摄入后从口腔到肠道传送的过程中,必须克服口腔、胃部(高酸性、胃蛋白酶)和消化道上端(胆盐、胰酶)等部位的不良环境,才能对宿主发挥有益功效。因此,良好的人体胃肠道环境抗逆能力已经成为评价益生菌的重要性质和指标,在一定程度上反映乳酸菌在真实胃肠道环境中的实际存活能力。同时多数研究表明,在胆盐存在的条件下,乳酸菌才能更好地吸收胆固醇,所以筛选的降胆固醇乳酸菌必须具有对胆盐的耐受性[23]。
5株菌分别在pH为1.5、2.0、2.5、3.0、3.5、4.0的环境中处理3 h的生长和存活情况如图4-a所示,牛胆盐浓度为1.0、2.0、3.0、4.0、5.0 g/L的环境中处理4 h后的生长和存活状况,耐胆盐实验结果如图4-b所示。

a-耐酸性;b-胆盐耐受性
图4 乳酸菌的耐酸耐胆盐能力
Fig.4 Acid and bile salt tolerance of lactic acid bacteria
从图4-a中可知,在pH<2.0时,所有菌株均不能存活,在pH为2.0~4.0时,菌株存活率与环境pH的增加呈正相关。在pH 4.0的环境中处理3 h后,5株菌存活率均大于70%,LF-HF04的存活率最高为97.65%,显著高于其他4株菌(P<0.05)。在pH 2.5时,LD-G150和LP-Q3-7的存活率下降至低于20%,其他3株均保持在45%以上的存活率,LF-Q2-3存活率最高为56.28%,显著高于其他4株菌(P<0.05)。
从图4-b可知,乳酸菌的存活率与环境中胆盐含量呈负相关。1 g/L的胆盐处理4 h后,LF-HF04、LD-G150及LF-Q2-3的存活率在90%以上,LP-Q3-7的存活率最低为64.84%。相较于其他4株乳酸菌,LP-Q3-7对胆盐的耐受性最差,整体存活率最低,在含有3 g/L牛胆盐的人工肠液中处理4 h后,存活率已降到了28.38%,其他4株菌的存活率均保持在50%以上。在胆盐5 g/L时,5株乳酸菌均表现出不同程度的耐受性:LF-HF04(53%)>ST-Q1-1(42.27%)>LF-Q2-3(28.18%)>LD-G150(18.67%)>LP-Q3-7(17.03%),LF-HF04、ST-Q1-1、LF-Q2-3差异显著(P<0.05),LD-G150和LP-Q3-7差异不显著(P>0.05)。
正常人的胃液pH 1.5~4.5,其pH值因食物结构不同而波动。通常人体胃液pH≈3.0,空腹和食用酸性食品可达1.5,食用碱性食物可达4~5,且食物(尤其是流体)通过胃的时间相对较短,一般1~2 h[24]。LF-Q2-3、LF-HF04和ST-Q1-1具备相对好的耐酸性,能够保证在进食非酸性食品时,有一定数量的活菌体顺利通过胃酸环境到达肠道内。通过胃液后存活的菌株将在小肠的上部遇到胆盐,故对胆盐具有抗性是它能够在肠道中生长、存活、发挥功效的一个重要指标[25]。MARTEAU等[26]认为人体内正常的胆盐浓度为0.3%~0.5%,同时食物通过肠道的时间一般为4~16 h。LF-HF04、LF-Q2-3、LD-G150和ST-Q1-1均具有较强的耐胆盐能力。综合而言,LF-HF04菌株对酸性环境和胆盐具有良好的耐受性,预测在实际胃和肠道上端环境中能顺利通过并存活下来。
2.2.4 乳酸菌表面疏水性
乳酸菌在胃肠道中的黏附和定植是其在人体内表现益生功效的先决条件。有研究证明细菌表面疏水性与其对肠道上皮细胞的黏附力存在一定的正相关性[27-28]。菌体表面疏水性是影响乳酸菌黏附性的内在因素,被广泛地作为评价乳酸菌黏附性能的重要指标。采用碳烃化合物粘着法测定不同菌株的疏水性差异,5株菌的表面疏水性如图5所示。
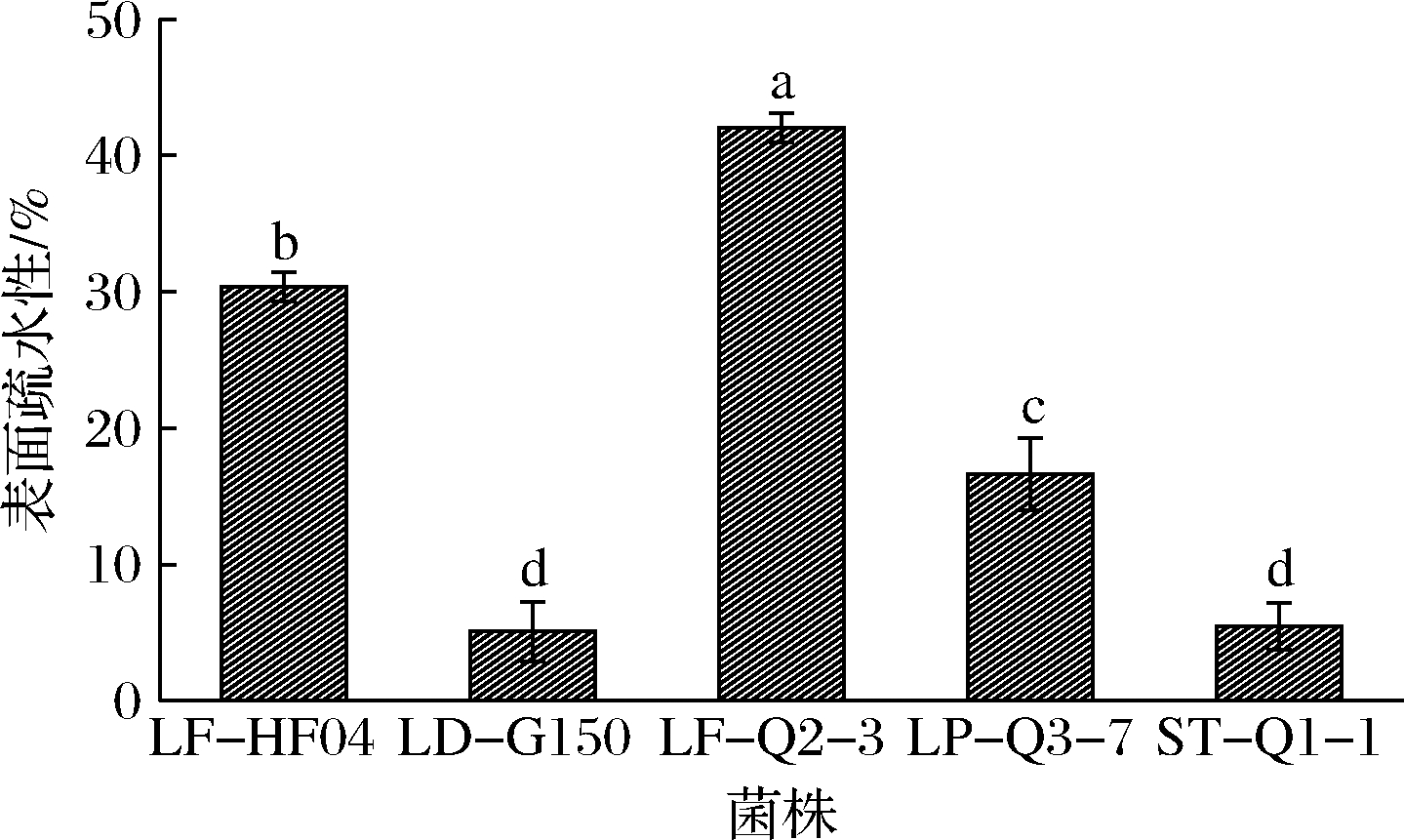
图5 乳酸菌的表面疏水性
Fig.5 Surface hydrophobicity of lactic acid bacteria
当CSH>50%时为高度疏水,当20%
2.2.5 对抗生素的耐药性
乳酸菌的耐药性大致可分为2种,即天然性耐药和获得性耐药。大多数乳酸菌对氨基糖苷类、氟喹诺酮类、糖肽类以及磺胺类等抗生素具有天然耐药性,天然性耐药基因很少传播。然而,由于畜牧及水产养殖行业中抗生素的滥用导致获得性耐药基因在细菌中出现并传播,乳酸菌中的获得性耐药基因可能会转移到人体胃肠道的微生物菌群甚至是致病菌中,存在潜在安全隐患[29-30]。因此,筛查乳酸菌的抗生素耐药性并评估其安全性具有重要意义。
本实验从6类常用抗生素中分别选择了具有代表性的6种抗生素,对所筛选的5株乳酸菌进行了纸片扩散法药敏试验,以期为筛选出的乳酸菌被用于功能性食品生产的安全性提供理论依据。由表3可知,ST-Q1-1对多种抗生素具有耐药性,其余4株菌对绝大多数抗生素敏感。分析认为ST-Q1-1多重耐药性的原因:一方面,可能是抗生素的滥用导致生牛乳中抗生素的残留,使乳酸菌从外界获得耐药基因;另一方面可能是由于抗生素的选择性压力,使乳酸菌发生基因突变产生耐药基因。所有受试菌株均对庆大霉素敏感,这可能与庆大霉素能很好地通过细菌的细胞膜有关[31-32]。有3株菌对氧氟沙星耐药,研究指出乳酸菌对氟哇诺酮类抗生素有天然耐药性[33]。LF-HF04的抑菌圈直径整体上大于另外4株受试菌,且对这6种抗生素均表现为敏感,初步判断其不具有可传播的耐药基因。
表3 抑菌圈直径及抗性结果 单位:mm
Table 3 Bacteriostatic circle diameter and resistance results

菌株编号抗生素(用量)氯霉素(30 μg)氧氟沙星(5 μg)四环素(30 μg)青霉素(10 μg)头孢唑林(30 μg)庆大霉素(10 μg)LF-HF0447.5(S)24.0(S)21.0(S)29.5(S)42.0(S)31.5(S)LD-G15031.5(S)6.0(R)23.0(S)52.0(S)34.0(S)29.0(S)LF-Q2-343.0(S)9.5(R)21.0(S)49.0(S)19.0(S)35.0(S)LP-Q3-732.0(S)13.0(I)18.0(I)37.0(S)9.0(R)40.0(S)ST-Q1-114.0(R)9.5(R)12.0(R)28.0(R)8.5(R)32.0(S)
注:抗生素敏感等级:R为耐药,I为中度敏感,S为敏感
3 结论与讨论
本研究从青海发酵牦牛乳中筛选出200株乳酸菌,有21株菌株胆固醇清除率高于选定标准菌株grx10(63.14%),其中LF-HF04的胆固醇清除率最高(74.21%)。所筛5株菌株生长性能良好,在MRS培养基中培养24 h,菌体浓度均稳定在108 CFU/mL;使发酵乳的酸度达到70 °T所用时间范围为11.5~24.5 h,其中LF-HF04和LF-Q2-3在乳中的产酸性能更好,分别在发酵11.5和13.5 h时酸度达到70 °T。5株菌株在pH为3.0的环境下处理3 h均能存活,说明这5株菌能在进食非酸性食品时通过胃液进入小肠,其中LF-HF04和LF-Q2-3的耐酸性更好;5株菌株在3.0~5.0 g/L胆盐下处理4 h后均能存活,且活菌数均达到106CFU/mL,说明5株菌株能够通过小肠存活下来,其中LF-HF04和ST-Q1-1对胆盐的耐受性更强。5株菌株的表面疏水性范围在5.09%~42.01%,菌株LF-Q2-3和LF-HF04疏水性较强,分别为42.01%和30.37%。5株菌株中ST-Q1-1具有多重耐药性,LF-HF04的抑菌圈直径整体上大于另外4株受试菌,且对6类常用抗生素敏感,初步判断其安全性较好。
综上所述,发酵乳杆菌LF-HF04的各项性能优良,可作为开发降胆固醇功能性乳制品和微生态制剂的潜力菌株,有广阔的应用前景。
[1] MOODIE D S.The global burden of cardiovascular disease[J].Congenital Heart Disease, 2016, 11(3):213.
[2] NAPOLI C, CRUDELE V, SORICELLI A, et al.Primary prevention of atherosclerosis:A clinical challenge for the reversal of epigenetic mechanisms? [J].Circulation, 2012, 125(19):2 363-2 373.
[3] 刘连亮, 吴聪俊, 苗亮, 等.竹叶黄酮和决明子复配与维生素C、E协同调节高脂血症大鼠脂代谢及抗氧化应激的研究[J].现代食品科技, 2014(11):12-16;22.
LIU L L, WU C J, MIAO L, et al.Regulation of lipid metabolism and oxidative stress by bamboo leaf flavonoid and cassia seed compound associated with ascorbyl palmitate and vitamin E succinate in hyperlipidemia rats[J].Modern Food Science and Technology, 2014(11):12-16;22.
[4] AL-SHERAJI S H, ISMAIL A, MANAP M Y, et al.Hypocholesterolaemic effect of yoghurt containing Bifidobacterium pseudocatenulatum G4 or Bifidobacterium longum BB536[J].Food Chemistry, 2012, 135(2):356-361.
[5] 李犁, 杜晓红, 张建瑞, 等.调血脂药物的临床应用现状与研究进展[J].基层医学论坛, 2012, 16(25):3 360-3 362.
LI L, DU X H, ZHANG J R, et al.Research progress and clinical application of lipid-regulatory drugs[J].The Medical Forum, 2012, 16(25):3 360-3 362.
[6] 刘梅林. 常用调脂药物的分类、用途及主要副作用(续3)[J].中国循环杂志, 2010, 25(1):69-70.
LIU M L.Classification, use and main side effects of commonly used lipid regulating drugs (Continued 3)[J].Chinese Circulation Journal, 2010, 25(1):69-70.
[7] PARK Y H, KIM J G, SHIN Y W, et al.Effects of Lactobacillus acidophilus 43121 and a mixture of Lactobacillus casei and Bifidobacterium longum on the serum cholesterol level and fecal sterol excretion in hypercholesterolemia-induced pigs[J].Bioscience, Biotechnology, and Biochemistry, 2008, 72(2):595-600.
[8] PEREIRA D I, GIBSON G R.Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human gut[J].Applied and Environmental Microbiology, 2002, 68(9):4 689-4 693.
[9] ABD EL-GAWAD I A, EL-SAYED E M, HAFEZ S A, et al.The hypocholesterolaemic effect of milk yoghurt and soy-yoghurt containing bifidobacteria in rats fed on a cholesterol-enriched diet[J].International Dairy Journal, 2005, 15(1):37-44.
[10] DING W R, SHI C, CHEN M, et al.Screening for lactic acid bacteria in traditional fermented Tibetan yak milk and evaluating their probiotic and cholesterol-lowering potentials in rats fed a high-cholesterol diet[J].Journal of Functional Foods, 2017, 32:324-332.
[11] 贺珊珊, 鲍志宁, 林伟锋, 等.一种含有胆固醇胶束的培养基溶液的制备方法:CN108795767A[P].2018-11-13.
HE S S, BAO Z N, LIN W F, et al. A preparation method of culture medium solution containing cholesterol micelles: CN108795767A[P]. 2018-11-13.
[12] HUANG Y, ADAMS M C.In vitro assessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria[J].International Journal of Food Microbiology, 2004, 91(3):253-260.
[13] SADISHKUMAR V, JEEVARATNAM K.In vitro probiotic evaluation of potential antioxidant lactic acid bacteria isolated from idli batter fermented with Piper betle leaves[J].International Journal of Food Science & Technology, 2017, 52(2):329-340.
[14] 董春阳. 广州市售酸奶中乳酸菌的药物敏感性分析[D].广州:华南理工大学, 2013.
DONG C Y.Antimicrobial susceptibility testing of lactic acid bacteria isolated from yoghurts in Guangzhou[D].Guangzhou:South China University of Technology, 2013.
[15] 顾瑞霞, 朱小红, 杨振泉, 等.具有降胆固醇及抑菌能力的鼠李糖乳杆菌grx10及其制备方法,用途:CN101328470A[P].2008-12-24.
GU R X, ZHU X H, YANG Z Y, et al.Lactobacillus rhamnosus grx10 with cholesterol lowering and bacteriostatic ability and its preparation method and application:CN101328470A[P].2018-12-24.
[16] WEI G F, PAN L, DU H M, et al.ERIC-PCR fingerprinting-based community DNA hybridization to pinpoint genome-specific fragments as molecular markers to identify and track populations common to healthy human guts[J].Journal of Microbiological Methods, 2004, 59(1):91-108.
[17] 杨吉霞, 张利玲, 蒋厚阳, 等.眉山泡菜中乳酸菌的分离鉴定[J].食品科学, 2015, 36(17):158-163.
YANG J X, ZHANG L L, JIANG H Y, et al.Isolation and identification of lactic acid bacteria in pickled vegetables from Meishan City[J].Food Science, 2015, 36(17):158-163.
[18] 贺珊珊, 鲍志宁, 林伟锋, 等.降胆固醇和耐酸耐胆盐益生菌的筛选研究[J].现代食品科技, 2019, 35(8):198-206;219.
HE S S, BAO Z N, LIN W F, et al.Screening of cholesterol-reducing probiotics and its acid and bile salt tolerance[J].Modern Food Science and Technology, 2019, 35(8):198-206;219.
[19] CHAMPAGNE C P, GOMES DA CRUZ A, DAGA M.Strategies to improve the functionality of probiotics in supplements and foods[J].Current Opinion in Food Science, 2018, 22:160-166.
[20] 剧柠. 西藏,新疆和云南地区传统发酵乳制品中乳杆菌的生物多样性研究[D].呼和浩特:内蒙古农业大学, 2009.
JU N.Biodiversity of lactobacilli from traditional fermented milk in Tibet, Xinjiang and Yunnan of China[D].Hohhot:Inner Mongolia Agricultural University, 2009.
[21] AIRIDENGCAICIKE, CHEN X, DU X H, et al.Isolation and identification of cultivable lactic acid bacteria in traditional fermented milk of Tibet in China[J].International Journal of Dairy Technology, 2010, 63(3):437-444.
[22] 华宝珍, 李莎, 徐爱才, 等.植物乳杆菌ST-Ⅲ脱脂乳的发酵工艺优化[J].农业工程学报, 2014, 30(11):276-284.
HUA B Z, LI S, XU A C, et al.Optimization of fermentation process in skim milk with ST-Ⅲ Lactobacillus plantarum[J].Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(11):276-284.
[23] DAMBEKODI P C, GILLILAND S E.Incorporation of cholesterol into the cellular membrane of Bifidobacterium longum[J].Journal of Dairy Science, 1998, 81(7):1 818-1 824.
[24] 赵瑞香, 李元瑞, 孙俊良, 等.嗜酸乳杆菌在模拟胃肠环境中抗性的研究[J].微生物学通报, 2002, 29(2):35-38.
ZHAO R X, LI Y R, SUN J L, et al.Studies on the antagonistic properties of Lactobacillus acidophilus in the imitative gastroenteric environment[J].Microbiology China, 2002, 29(2):35-38.
[25] 刘绒梅, 田圆圆, 耿琦, 等.四川稻城传统干酪中乳酸菌的分离鉴定及功能研究[J].中国测试, 2017, 43(12):58-62.
LIU R M, TIAN Y Y, GENG Q, et al.Isolation, identification and functional properties of lactic acid bacteria derived from traditional cheese in Daocheng, Sichuan[J].China Measurement & Test, 2017, 43(12):58-62.
[26] MARTEAU P, MINEKUS M, HAVENAAR R, et al.Survival of lactic acid bacteria in a dynamic model of the stomach and small intestine:Validation and the effects of bile[J].Journal of Dairy Science, 1997, 80(6):1 031-1 037.
[27] KRAVTSOV E G, YERMOLAYEV A V, ANOKHINA I V, et al.Adhesion characteristics of Lactobacillus is a criterion of the probiotic choice[J].Bulletin of Experimental Biology and Medicine, 2008, 145(2):232-234.
[28] KOTZAMANIDIS C, KOURELIS A, LITOPOULOU-TZANETAKI E, et al.Evaluation of adhesion capacity, cell surface traits and immunomodulatory activity of presumptive probiotic Lactobacillus strains[J].International Journal of Food Microbiology, 2010, 140(2-3):154-163.
[29] CAMPEDELLI I, MATHUR H, SALVETTI E, et al.Genus-wide assessment of antibiotic resistance in Lactobacillus spp[J].Applied and Environmental Microbiology, 2019, 85(1):e01738-e01718.
[30] PLESSAS S, NOUSKA C, KARAPETSAS A, et al.Isolation, characterization and evaluation of the probiotic potential of a novel Lactobacillus strain isolated from Feta-type cheese[J].Food Chemistry, 2017, 226:102-108.
[31] DANIELSEN M, WIND A.Susceptibility of Lactobacillus spp.to antimicrobial agents[J].International Journal of Food Microbiology, 2003, 82(1):1-11.
[32] EGERV RN M, DANIELSEN M, ROOS S, et al.Antibiotic susceptibility profiles of Lactobacillus reuteri and Lactobacillus fermentum[J].Journal of Food Protection, 2007, 70(2):412-418.
RN M, DANIELSEN M, ROOS S, et al.Antibiotic susceptibility profiles of Lactobacillus reuteri and Lactobacillus fermentum[J].Journal of Food Protection, 2007, 70(2):412-418.
[33] LIU C, ZHANG Z Y, DONG K, et al.Antibiotic resistance of probiotic strains of lactic acid bacteria isolated from marketed foods and drugs[J].Biomedical and Environmental Sciences, 2009, 22(5):401-412.