大曲又称块曲或砖曲,是以生小麦粉为主要原料(或配以大麦、豌豆为辅料),经过自然接种,在人工控制温度和湿度的条件下培育而成[1]。其富含多种微生物、酶类和挥发性风味物质,是白酒酿造过程中的糖化发酵剂、生香剂。研究表明,大曲的品质直接影响着白酒的产量、质量和酒体风格,是生产传统固态酿造大曲酒的重要物质保障[2],故有“曲乃酒之骨”之称。
大曲作为白酒酿造的糖化发酵剂和生香剂,其独特的“包包”结构,使之具有更大的比表面积和孔隙度[3]。研究表明,大曲不同部位之间的水分、酸度、发酵力、酯化力、糖化力、液化力、微生物群落结构和风味物质的组成都具有明显差异[4]。邓长阳等[5]对大曲表层和曲心的真菌群落结构进行了研究,发现大曲表层的微生物主要以根霉菌和毛霉菌为主,而在曲心中以嗜热真菌、嗜热子囊菌、曲霉菌和毕赤酵母为主。JIN等[6]发现酱香型大曲中的真菌群落趋向于随机分布,而细菌群落中乳杆菌主要分布在表层,芽孢杆菌主要分布在曲心。近年来,随着白酒酿造行业机械化的发展,茅台、泸州老窖、四特酒等酒企也开始采用机械压制大曲[7]。由于机械压曲替代了传统的压曲方式,可能会改变大曲的比表面积、孔隙度等特性,从而影响大曲的品质。目前,基于传统质量评价体系的机制大曲和人工大曲品质差异的研究已有报道[8],但关于机制大曲和人工大曲不同部位之间微生物群落差异及其影响因素的研究较少。
本研究以成品(贮存90 d)机制大曲和人工大曲为研究对象,采用高通量测序技术解析机制大曲和人工大曲曲块不同部位的微生物多样性,并探究2种大曲微生物多样性差异的影响因素,为进一步剖析大曲品质的内在驱动因素、改进机械制曲工艺、提升大曲质量提供参考依据。
1 材料与方法
1.1 材料与试剂
样本:机制和人工大曲成品曲,由四川某白酒生产企业提供。
实验试剂:葡萄糖、CuSO4·5H2O、酒石酸钾钠、NaOH、浓HCl、乙酸、乙酸钠、可溶性淀粉、己酸、无水乙醇、浓H2SO4、甲醛、酪蛋白、L-酪氨酸(均为分析纯),成都市科龙化工试剂厂;福林酚(分析纯),上海麦克林生化科技有限公司;FastDNA Spin Kit for Soil试剂盒,美国MP Biomedicals。
1.2 仪器与设备
PHS-25CW型pH计,上海般特仪器制造有限公司;PX124ZH/E电子天平,奥豪斯仪器(常州)有限公司;DHG-9013A电热鼓风干燥箱,上海善志仪器设备有限公司;5424离心机,德国艾本德股份公司;Nanodrop ONE超微量分光光度计,广州仪涛科学仪器有限公司。
1.3 实验方法
1.3.1 取样方法及样品前处理
取样方法:随机选取2个机制大曲贮存库房和2个人工大曲贮存库房,每个库房取6组大曲,共24块大曲,取样点的设置参考周天慈等[9]的方法。
分样方法:将大曲表面至1 cm厚的区域作为表层,大曲曲坯中心向外3 cm的区域作为坯心,大曲曲包中心向外3 cm的区域作为包心,剩余部分作为大曲中层。
样品前处理:分别将2种大曲表层、中层、坯心和包心的样品粉碎过20目筛并混合均匀,采用四分法将各部位的样品分别浓缩至300 g,并将样本在-20 ℃保藏备用,高通量测序的样本于-80 ℃保藏。样本信息见表1。
表1 样品信息表
Table 1 Informaiton of the Daqu samples

大曲种类取样部位样品编号机制大曲表层JP中层JZ坯心JX包心JB人工大曲表层CP中层CZ坯心CX包心CB
1.3.2 理化生化指标的测定
大曲水分、酸度、淀粉含量、液化力、糖化力、酯化力、氨基酸态氮、酒化力的测定参考QB/T 4257—2011《酿酒大曲通用分析方法》;还原糖的测定采用斐林试剂法[1];酸性蛋白酶活力的测定参考GB/T 28715—2012《饲料添加剂酸性、中性蛋白酶活力的测定 分光光度法》。
1.3.3 大曲总DNA的提取
采用FastDNA Spin Kit for Soil试剂盒提取大曲中微生物的基因组DNA,提取方法按照试剂盒提供的操作方法进行。
1.3.4 PCR扩增
使用超微量分光光度计检测提取DNA的质量,满足Illumina HiSeq平台测序的要求后,使用引物ITS1F/ITS2R扩增真菌的内部转录间隔区(ITS1);使用引物338F/806R扩增细菌16S rRNA的V3~V4高变区。
扩增程序:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共30个循环,最后72 ℃延伸10 min。
扩增体系:4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL上游引物(5 μmol/L),0.8 μL下游引物(5 μmol/L),0.2 μL rTaq聚合酶,0.2 μL BSA,10 ng模板DNA,补ddH2O至20 μL。扩增产物送至上海美吉生物医药科技有限公司进行测序。
1.4 数据处理及分析
使用SPSS 23软件对理化生化指标数据进行显著性分析。微生物多样性分析在上海美吉生物云平台(https://cloud.majorbio.com/)进行。使用SIMCA 14.1对微生物进行偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)。使用TBtools绘制核心微生物热图。最后使用Canoco5对核心微生物和理化生化指标进行冗余分析。
2 结果与分析
2.1 大曲曲块不同部位理化生化指标差异性分析
大曲的理化生化指标是衡量大曲发酵是否成熟的重要指标,在一定程度上能够反映大曲质量的优劣。对机制大曲和人工大曲曲块不同部位的理化生化指标进行检测,结果见表2、表3。
由表2、表3可知,机制大曲表层的水分显著高于中层、坯心和包心,人工大曲则是表层、包心的水分显著高于中层、坯心,与文献[10]的报道不一致,原因可能与储存环境的湿度有关,且2种大曲各部位水分的变化趋势并不一致,人工大曲包心水分含量较高,可能与人工拌料不均匀有关。机制大曲表层的酸度显著低于其他部位,而人工大曲表层、中层的酸度显著低于坯心、包心,可能是由于表层氧气充足,不利于富集产酸微生物[11],且表层更有利于有机酸的挥发。经分析发现,人工大曲坯心和包心的酸度均达到1.40 mmol/10 g以上,可能是由于在发酵过程中这2个部位“高温微氧”的环境更适合产酸微生物的生长和代谢[12]。机制和人工大曲的糖化力、液化力均为表层显著高于坯心、包心,可能是由于表层的O2丰富,富集了曲霉、根霉和芽孢杆菌等产糖化酶和液化酶的功能微生物。而且机制大曲中层的糖化力和液化力也较高,分别为42.70和0.23 U/g,可能是中层O2较为丰富,而且水分和温度也适合这些微生物的繁殖和代谢。同时发现机制和人工大曲坯心和包心的还原糖含量均显著高于表层和中层,可能是由于还原糖既可被微生物利用还可转化为其他物质[13]。而淀粉含量在2种大曲的各部位均不具有规律。2种大曲表层的酸性蛋白酶活力显著低于其他部位,可能是由于中层、坯心和包心相较于表层在发酵过程中的温度更高,容易富集嗜热真菌等具有分泌耐高温的酸性蛋白酶的微生物有关[14]。而大曲中的氨基酸态氮的变化规律并没有与酸性蛋白酶呈现较好的一致性。2种大曲中层的酯化力均显著高于其他部位,分别为13.21和 12.34 U/g,原因可能是中层的微环境比较适宜曲霉、芽孢杆菌等酯化能力较强的微生物生长。机制大曲各部位的酒化力差异不显著,人工大曲表层的酒化力显著高于其他部位,可能是因为人工踩曲有较好的提浆效果[15],表层的水分分布状态更适合产酒精酵母的生长与繁殖。
表2 机制大曲和人工大曲曲块不同部位理化指标值
Table 2 Physicochemical indexes values in different parts of mechanical and artificial Daqu
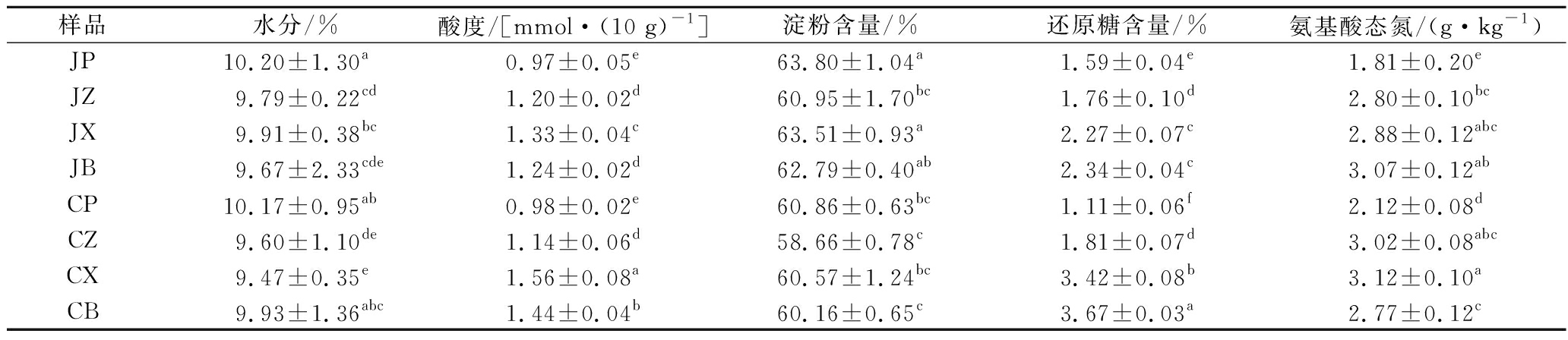
样品水分/%酸度/[mmol·(10 g)-1]淀粉含量/%还原糖含量/%氨基酸态氮/(g·kg-1)JP10.20±1.30a0.97±0.05e63.80±1.04a1.59±0.04e1.81±0.20eJZ9.79±0.22cd1.20±0.02d60.95±1.70bc1.76±0.10d2.80±0.10bcJX9.91±0.38bc1.33±0.04c63.51±0.93a2.27±0.07c2.88±0.12abcJB9.67±2.33cde1.24±0.02d62.79±0.40ab2.34±0.04c3.07±0.12abCP10.17±0.95ab0.98±0.02e60.86±0.63bc1.11±0.06f2.12±0.08dCZ9.60±1.10de1.14±0.06d58.66±0.78c1.81±0.07d3.02±0.08abcCX9.47±0.35e1.56±0.08a60.57±1.24bc3.42±0.08b3.12±0.10aCB9.93±1.36abc1.44±0.04b60.16±0.65c3.67±0.03a2.77±0.12c
注:方差结果表示为“平均值±标准误”。所有理化指标以绝干计,同列标注的不同字母表示差异性显著(P<0.05)(下同)
表3 机制大曲和人工大曲曲块不同部位生化指标值
Table 3 Biochemical indexes values in different parts of mechanical and artificial Daqu

样品糖化力/(U·g-1)液化力/(U·g-1)酯化力/(U·g-1)酒化力/%voL酸性蛋白酶活力/(U·g-1)JP89.56±1.02a0.28±0.08a9.05±0.12d11.75±0.25bc40.20±0.98dJZ42.70±2.32c0.23±0.12a13.21±0.38a12.20±0.80ab53.92±2.94cJX28.15±4.21d0.13±0.11b8.99±0.71d11.10±1.10bc91.18±4.90aJB23.95±1.11ef0.14±0.06b8.51±0.09e10.50±0.10bc56.86±3.92cCP85.05±2.19b0.25±0.12a9.64±0.12c13.65±0.35a52.94±1.96cCZ22.10±1.96f0.13±0.13b12.34±0.33b10.60±0.10bc91.19±2.94aCX25.35±3.36e0.13±0.05b9.29±0.10cd10.20±0.20c73.53±2.94bCB23.55±0.94ef0.14±0.09b9.27±0.08cd11.70±0.10bc92.16±1.96a
2.2 大曲曲块不同部位微生物多样性分析
2.2.1 基于OTU的多样性指数分析
利用IIIumina MiSeq测序技术对机制大曲和人工大曲曲块不同部位真菌和细菌的群落进行解析,结果如表4所示。在机制大曲中,表层真菌的Shannon指数、Ace指数和Chao指数最高,分别为3.66、118.38和115.87,而坯心则是细菌的Shannon指数、Ace指数和Chao指数最高,分别为2.17、180.15和180.74。表明在机制大曲中,表层的真菌多样性最丰富,坯心的细菌多样性最丰富。在人工大曲中,表层真菌和细菌的Shannon指数最高,分别为2.72和1.82,而包心真菌和细菌的Ace指数、Chao指数最高,真菌为96.14和94.54,细菌为106.43和107.54。表明人工大曲表层真菌和细菌的物种多样性比其他部位丰富,但是,包心真菌和细菌的群落丰富度最高。
通过对比2种大曲各部位的多样性指数,可以发现,机制大曲表层真菌的Shannon指数、Ace指数和Chao指数均高于人工大曲表层,坯心真菌的Shannon指数和包心真菌的Ace指数、Chao指数也高于人工大曲坯心和包心。同时发现,机制大曲表层细菌的Shannon指数低于人工大曲表层,Ace指数和Chao指数高于人工大曲,中层真菌的Shannon指数、Ace指数和Chao指数均低于人工大曲,而中层细菌的Shannon指数、Ace指数和Chao指数均高于人工大曲,坯心和包心细菌的Shannon指数、Ace指数、Chao指数均高于人工大曲。此外,2种大曲各部位真菌和细菌的Coverage指数均达到了99.90%以上,表明本次的测序结果深度足够,能够反映出样品中微生物群落结构的真实情况。
表4 机制大曲和人工大曲曲块不同部位微生物群落多样性指数
Table 4 The microbial diversity index in different parts of mechanical Daqu and artificial Daqu
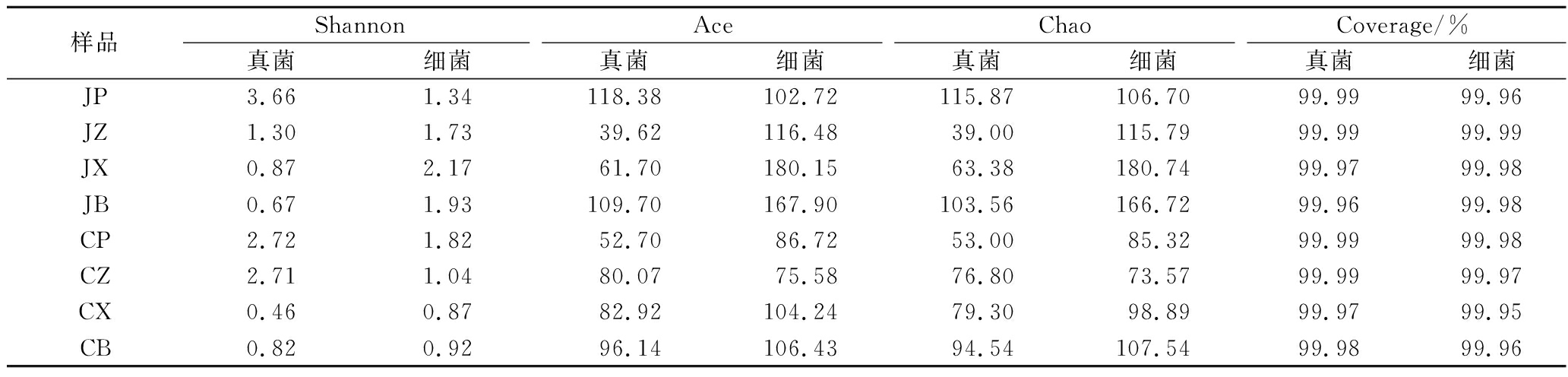
样品ShannonAceChaoCoverage/%真菌细菌真菌细菌真菌细菌真菌细菌JP3.661.34118.38102.72115.87106.7099.9999.96JZ1.301.7339.62116.4839.00115.7999.9999.99JX0.872.1761.70180.1563.38180.7499.9799.98JB0.671.93109.70167.90103.56166.7299.9699.98CP2.721.8252.7086.7253.0085.3299.9999.98CZ2.711.0480.0775.5876.8073.5799.9999.97CX0.460.8782.92104.2479.3098.8999.9799.95CB0.820.9296.14106.4394.54107.5499.9899.96
2.2.2 大曲曲块不同部位微生物群落结构分析
为了进一步探究2种大曲曲块不同部位微生物的群落结构,利用IIIumina MiSeq测序技术平台对2种大曲不同部位的微生物进行属水平上的分类学分析,结果如图1所示。

a-真菌;b-细菌
图1 机制和人工大曲曲块不同部位微生物群落结构(属水平)
Fig.1 Microbial community structure in different parts of mechanical and artificial Daqu
由图1-a可知,在机制大曲中,JZ、JX、JB中相对丰度>5%的优势真菌均为曲霉属(Aspergillus)和嗜热真菌属(Thermomyces),其相对丰度总和分别为84.65%、99.66%、97.28%;而JP的优势真菌为曲霉属、嗜热真菌属和伊萨酵母属(Issatchenkia),其相对丰度总和为49.05%。因此,机制大曲JZ、JX、JB的真菌构成具有较大的相似性,而JP与JZ、JX、JB的真菌的构成有较大的差异性。在人工大曲中,CP的优势真菌为unclassified_f_Dipodascaceae、地霉菌属(Geotrichum)、曲霉属和嗜热真菌属,其相对丰度总和为76.58%;CZ中的优势真菌属为unclassified_f_Dipodascaceae、地霉菌属、unclassified_f_Metschnikowiaceae、嗜热真菌属和双足囊菌属(Dipodascus),其相对丰度总和为86.99%;CX与CB的优势真菌均为嗜热真菌属,其相对丰度分别为91.74%、85.68%。因此,人工大曲CP与CZ的真菌构成具有较大的相似性,CX与CB的真菌构成具有较大的相似性,而CP、CZ与CX、CB的真菌构成具有较大的差异性。从2种大曲不同部位的优势真菌的组成来看,其共有优势真菌仅有嗜热真菌属。由此表明,机制大曲与人工大曲真菌类群构成具有较大差异,原因可能与机械压曲方式下大曲孔隙度较为紧密,从而导致了2种大曲微环境的差异,影响微生物的生长与繁殖,使微生物在曲块不同部位的分布特征呈现差异性。
由图1-b可知,在机制大曲中,JP相对丰度>5%的优势细菌为芽孢杆菌属(Bacillus),其相对丰度为88.78%;JZ的优势细菌为高温放线菌属和芽孢杆菌属,其相对丰度总和为92.36%;JX的优势细菌为葡萄球菌属(Staphylococcus)、高温放线菌属、泛菌属(Pantoea),其相对丰度总和为76.32%;JB的优势细菌为葡萄球菌属和高温放线菌属,其相对丰度总和为78.38%,其中葡萄球菌属在JX和JB中的相对丰度分别为57.49%、7.35%。因此,机制大曲JP与JZ的细菌构成较为相似,JX与JB的细菌构成有较大差异。人工大曲中,CP、CZ、CX和CB的优势细菌均为高温放线菌属和芽孢杆菌属,其相对丰度总和分别为95.75%、98.96%、98.86%、98.54%。因此,人工大曲CP、CZ、CX、CB的细菌构成具有较高的相似性。由此表明,机制大曲各部位细菌类群的构成具有较大差异,而人工大曲细菌类群构成具有较高的相似性,可能是因为机制大曲的曲块内部微环境差异较大;而人工大曲的通气状况相对较好,细菌的抗逆性、适应性较强,因此,人工大曲中细菌类群在各部位的分布状况较为一致。
2.2.3 大曲曲块不同部位微生物群落差异分析
对机制大曲和人工大曲曲块不同部位的真菌和细菌群落进行PLS-DA,结果如图2所示。

a-真菌PLS-DA;b-细菌PLS-DA;c-差异真菌;d-差异细菌
图2 机制大曲和人工大曲曲块不同部位微生物群落的差异(属水平)
Fig.2 Differences in microbial communities in different parts of mechanical and artificial Daqu
由图2-a和图2-b可知,2种大曲各部位样本均处于95% Hotelling-T2的椭圆内,说明本次分析的样本中不存在异常值。由图2-a可知,JZ、JX和JB的真菌类群聚为一簇,而JP的真菌类群则独为一簇;CP和CZ的真菌类群聚为一簇,CX和CB的真菌类群聚为一簇。表明机制大曲JZ、JX和JB的真菌组成相似度高,而JP与这3个部位的相似度较低。人工大曲CP与CZ、CX与CB真菌组成的相似度高,而CP、CZ与CX、CB真菌组成的相似度较低。由图2-b可知,JP和JZ的细菌类群聚为一簇,JX和JB的细菌类群各自独为一簇;CP、CZ、CX、CB的细菌类群聚为一簇。以上结果表明JP与JZ的细菌组成相似度高,与JX和JB的细菌组成相似度较低,而人工大曲各部位细菌的组成均较为相似。
为了进一步解析机制大曲和人工大曲的差异微生物,利用Wilcoxon秩和检验对机制大曲和人工大曲的微生物组成做基于相对丰度的差异显著性检验,结果如图2-c、图2-d所示。在属水平上,机制大曲和人工大曲中共检测到显著差异的真菌和细菌各15种(P<0.05)。从2种大曲的差异真菌来看(图2-c),曲霉属和青霉属(Penicillium)在机制大曲中的相对丰度显著高于人工大曲,而地霉菌属、复膜孢酵母属、双足囊菌属等13种真菌在人工大曲中的相对丰度显著高于机制大曲。其中,除曲霉属、unclassified_f_Dipodascaceae、地霉菌属、复膜孢酵母属、双足囊菌属、unclassified_f_Metschnikowiaceae、威克汉姆酵母属以外,其余的微生物的相对丰度均低于1%。研究发现,复膜孢酵母属可以产生α-淀粉酶和蛋白酶等多种水解酶;威克汉姆酵母属具有较强的产乙酸乙酯的能力[16],这2种微生物均是大曲中重要的功能性微生物,对白酒酿造具有重要作用。
从2种大曲的差异细菌来看(图2-d),葡萄球菌属、氧芽孢杆菌属、克雷伯氏菌属等12种细菌在机制大曲中的相对丰度显著高于人工大曲,而高温放线菌属和Planifilum在人工大曲中的相对丰度显著高于机制大曲。其中,除高温放线菌属和葡萄球菌属外,其余微生物的相对丰度均低于1%,高温放线菌属具有耐高温、生长快的特点,其产生的蛋白酶和纤维素酶,是白酒酿造中重要的功能微生物[17];葡萄球菌属在浓香型大曲中常被检测到,但其在白酒酿造中的作用有待进一步研究[3,6]。
2.3 大曲曲块不同部位核心微生物群落变化规律
当某种微生物的平均相对丰度>1%,且至少在一个样本中出现时,该微生物被认为是核心微生物[18]。由IIIumina MiSeq平台测序结果可得,机制和人工大曲曲块不同部位的核心微生物分别有31和16种,并对2种大曲各部位核心微生物的分布做热图分析,结果如图3所示。

a-机制大曲;b-人工大曲
图3 机制大曲和人工大曲曲块不同部位核心微生物热图(属水平)
Fig.3 Heatmaps of core microbes in different parts of mechanical and artificial Daqu
由图3-a可知,机制大曲中平均相对丰度较高的核心微生物有曲霉属(28.03%)、嗜热真菌属(51.84%)、高温放线菌属(28.29%)、伊萨酵母属(3.29%)、芽孢杆菌属(40.72%)、葡萄球菌属(16.43%)和泛菌属(2.59%)。其中,曲霉属、嗜热真菌属、高温放线菌属、泛菌属和葡萄球菌属主要分布在JX和JB中,而伊萨酵母属和芽孢杆菌属主要分布在JP和JZ中。由图3-b可知,在人工大曲中平均相对丰度较高的核心微生物有unclassified_f_Dipodascaceae(22.57%)、地霉菌属(10.10%)、嗜热真菌属(48.13%)、丝孢酵母属(1.43%)、双足囊菌属(2.21%)、unclassified_f_Metschnikowiaceae(2.93%)、芽孢杆菌属(11.55%)、高温放线菌属(86.47%)。其中unclassified_f_Dipodascaceae、地霉菌属、丝孢酵母属、双足囊菌属、unclassified_f_Metschnikowiaceae和芽孢杆菌属主要分布在CP和CZ中,而嗜热真菌属和高温放线菌属主要分布在CX和CB中。在这些核心微生物中,曲霉属、嗜热真菌属、高温放线菌属、芽孢杆菌属、复膜孢酵母属、伊萨酵母属、假丝酵母属和根毛霉属等是大曲中的主导菌群[19-20],这些菌群的存在有利于提升大曲的发酵性能。
整体来看,2种大曲中的核心微生物的组成及其分布规律具有一定的相似性,其中,嗜热真菌属、高温放线菌属、葡萄球菌属等核心微生物主要分布在坯心和包心中,而芽孢杆菌属、伊萨酵母属、地霉菌属、根毛霉属、丝孢酵母属、威克汉姆酵母属等微生物主要分布在表层和中层,可能是由于坯心和包心具有透气性差、不易散热等特点,导致其微环境中氧气缺乏、温度较高,因而,这些部位成为耐温、抗逆、兼性需氧微生物的优势区。
2.4 两种大曲曲块核心微生物群落影响因素分析
利用冗余分析法分别分析2种大曲中核心微生物与理化生化指标之间的相关性,探究大曲中影响核心微生物群落结构的因素,结果如图4所示。
由图4-a可知,在机制大曲中,嗜热真菌属和高温放线菌属与酸度和氨基酸态氮呈正相关;泛菌属和曲霉属与还原糖呈正相关;伊萨酵母属、假丝酵母属、根毛霉属和芽孢杆菌属与液化力、糖化力和酒化力呈正相关。表明在机制大曲中,嗜热真菌属和高温放线菌属主要受酸度和氨基酸态氮的影响;泛菌属和曲霉属主要受还原糖的影响;液化力、糖化力和酒化力主要受伊萨酵母属、假丝酵母属、根毛霉属和芽孢杆菌属的协同影响。由图4-b可知,在人工大曲中,曲霉属与淀粉含量呈正相关;嗜热真菌属和高温放线菌属与酸度、还原糖、氨基酸态氮呈正相关,而unclassified_f_Dipodascaceae、地霉菌属和双足囊菌属则与酸度、还原糖和氨基酸态氮呈负相关;丝孢酵母属、威克汉姆酵母属、芽孢杆菌属和复膜孢酵母属与水分、液化力、糖化力和酒化力呈正相关。表明在人工大曲中,曲霉属主要受淀粉的影响;嗜热真菌属、高温放线菌属、unclassified_f_Dipodascaceae、地霉菌属和双足囊菌属主要受酸度、还原糖和氨基酸态氮的影响。

a-机制大曲;b-人工大曲
图4 核心微生物与理化生化指标冗余分析图
Fig.4 Redundancy analysis of core microbes and physicochemical and biochemical indexes
注:红色箭头代表理化生化指标,蓝色箭头代表核心微生物,二者之间的夹角代表相关性(锐角:正相关;钝角:负相关;直角:无相关性)
经分析发现,在2种大曲中,复膜孢酵母属和伊萨酵母属均与酸度、还原糖和氨基酸态氮呈负相关;高温放线菌属则与氨基酸态氮呈正相关,可能与该菌属能够产生耐高温的蛋白酶有关[17];嗜热真菌属与酸度呈正相关,可能是该菌属与代谢产酸有关;芽孢杆菌属与酸度呈负相关,可能与高酸度能抑制芽孢杆菌属的繁殖有关[21]。此外,芽孢杆菌属和根毛霉菌属与糖化力和液化力呈正相关,可能与这2种菌属能产液化酶和糖化酶有关;酒化力与伊萨酵母属、威克汉姆酵母属和假丝酵母属呈正相关,可能是这些酵母具备代谢产生乙醇的能力有关。
3 结论
本研究对成品机制大曲和人工大曲表层、中层、坯心和包心的理化生化指标、微生物群落结构及其差异进行了研究,并对2种大曲核心微生物的分布规律及其影响因素进行了分析。结果表明,除酸度、还原糖、氨基酸态氮、酸性蛋白酶活力等是机制大曲和人工大曲各部位主要存在差异的理化生化指标,其余指标变化规律较为一致。微生物群落结构分析表明,2种大曲各部位的微生物群落组成具有一定的差异,其中,主要的差异真菌为曲霉属、unclassified_f_Dipodascaceae、地霉菌属、复膜孢酵母属、unclassified_f_Metschnikowiaceae和双足囊菌属;主要的差异细菌为高温放线菌属和葡萄球菌属。2种大曲核心微生物的组成及其分布规律具有一定的相似性,其中,嗜热真菌属、高温放线菌属、泛菌属和芽孢杆菌属主要分布在大曲的坯心和包心,而芽孢杆菌属、地霉菌属、双足囊菌属、复膜孢酵母属、伊萨酵母属和假丝酵母属主要分布在表层和中层。冗余分析结果表明,嗜热真菌属和高温放线菌属与酸度、还原糖和氨基酸态氮等环境因子呈正相关,而unclassified_f_Dipodascaceae、地霉菌属和双足囊菌属与酸度、还原糖和氨基酸态氮呈负相关;糖化力、液化力和酒化力则与芽孢杆菌属、根毛霉属、丝孢酵母属、复膜孢酵母属、伊萨酵母属和假丝酵母属呈正相关。
本次研究仅是初步揭示了机制与人工大曲各部位间理化生化指标、微生物群落结构的差异性,由于样本相对较少,还需扩大样本数,深入分析2种大曲的品质区别。针对大曲微生物与理化生化特性的相关性分析,主要基于数学模型进行统计分析,有待进一步实验验证。本次研究是以成品大曲为对象,而表征大曲品质的理化生化特性与制曲过程中的微生物群落及其演替紧密联系,因此,还需结合制曲过程微生物群落及变化规律进行深度分析。大曲中影响微生物群落分布和演替的因素众多,还需对制曲原料、微环境条件、环境微生物等影响因素进一步研究,为成品大曲的质量控制和提升奠定基础。
[1] 沈怡方. 白酒生产技术全书[M].北京:中国轻工业出版社,1998:50-80.
SHEN Y F.Liquor Production Technology Book[M].Beijing:China Light Industry Press, 1998:50-80.
[2] 敖宗华, 陕小虎, 沈才洪, 等.国内主要大曲相关标准及研究进展[J].酿酒科技, 2010(2):104-108.
AO Z H, SHAN X H, SHEN C H, et al.Domestic related quality standards of Daqu & its research progress[J].Liquor-Making Science & Technology, 2010(2):104-108.
[3] 张倩, 韩保林, 李子健, 等.浓香型白酒包包曲微生物种群多样性及形成机制[J].食品与发酵工业, 2021, 47(18):99-106.
ZHANG Q, HAN B L, LI Z J, et al.Diversity and formation mechanism of the microflora in strong flavor Baijiu Baobaoqu[J].Food and Fermentation Industries, 2021, 47(18):99-106.
[4] 杨勇, 李燕荣, 姜雷,等.中高温大曲曲块部位间生化指标的差异及变化规律[J].食品与发酵工业,2019,45(19):73-78.
YANG Y,LI Y R, JIANG L, et al.Study on the difference and change regulation of biochemical indices between parts of medium and high temperature Daqu[J].Food and Fermentation Industries, 2019,45(19):73-78.
[5] 邓长阳, 黎婷玉, 刘文汇, 等.襄阳地区中高温大曲曲皮和曲心真菌多样性解析[J].中国酿造, 2021, 40(6):65-69.
DENG C Y, LI T Y, LIU W H, et al.Fungal diversity in surface and center of medium-high temperature Daqu in Xiangyang area[J].China Brewing, 2021, 40(6):65-69.
[6] JIN Y, LI D Y, AI M, et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Research International, 2019, 121:422-432.
[7] 蒋思峡. 传统与机械化酱香大曲的菌群结构分析[D].贵阳:贵州大学, 2017.
JIANG S X.The analysis of microfloras on traditional and mechanized Mao-Tai flavor Daqu[D].Guiyang:Guizhou University, 2017.
[8] 林培, 章肇敏, 吴生文, 等.人工踩曲与机械制曲对大曲培养的差异性分析[J].酿酒科技, 2012(4):70-71;75.
LIN P, ZHANG Z M, WU S W, et al.Analysis of the difference between artificial starter-making and mechanical starter-making during Daqu culture[J].Liquor-Making Science & Technology, 2012(4):70-71;75.
[9] 周天慈, 孙佳, 朱雨婕, 等.中高温大曲制作过程中火圈真菌菌群演替规律及其风味功能[J].微生物学通报, 2021, 48(11):4 178-4 189.
ZHOU T C, SUN J, ZHU Y J, et al.Fungal community succession and flavor function in fire cycle during the production of medium-high temperature Daqu[J].Microbiology China, 2021, 48(11):4 178-4 189.
[10] 明红梅, 陈晓旭, 刘清斌, 等.泸型大曲曲表与曲心理化生化特性的对比研究[J].湖北农业科学, 2015, 54(6):1 445-1 447;1 451.
MING H M, CHEN X X, LIU Q B, et al.Comparative studies on physicochemical and biochemical indicators between surface and inner about Luzhou Laojiao Daqu[J].Hubei Agricultural Sciences, 2015, 54(6):1 445-1 447;1 451.
[11] 侯建光, 郭富祥, 樊建辉, 等.夏季仰韶陶香型中高温大曲曲表和曲心指标动态演变的研究[J].酿酒科技, 2016(3):88-90;99.
HOU J G, GUO F X, FAN J H, et al.Dynamic change in physiochemical indexes of daqu surface & daqu core of Yangshao pottery-flavor medium-high-temperature daqu in summer[J].Liquor-Making Science & Technology, 2016(3):88-90;99.
[12] 胡晓龙, 王康丽, 牛广杰, 等.基于高通量测序技术的中温大曲中微生物群落多样性解析[J].轻工学报, 2019, 34(4):21-29.
HU X L, WANG K L, NIU G J, et al.Analysis of microbial community diversity in medium temperature Daqu based on high-throughput sequencing technology[J].Journal of Light Industry, 2019, 34(4):21-29.
[13] 张文学, 岳元媛, 向文良, 等.浓香型白酒酒醅中化学物质的变化及其规律性[J].四川大学学报(工程科学版), 2005, 37(4):44-48.
ZHANG W X, YUE Y Y, XIANG W L, et al.Changes and rules of chemical composition in the fermented grains of Chinese strong aromatic spirits[J].Journal of Sichuan University (Engineering Science Edition), 2005, 37(4):44-48.
[14] 姚灿, 李国友, 张彬, 等.中高温大曲中嗜热真菌的分离鉴定及其酶活性测定[J].酿酒, 2019, 46(5):32-35.
YAO C, LI G Y, ZHANG B, et al.Isolation and identification of thermophilic fungi from moderate/high-temperature Daqu and determination of enzyme activity[J].Liquor Making, 2019, 46(5):32-35.
[15] 简晓平, 施永祥, 王涛, 等.机制大曲和人工大曲生物、理化指标比较分析[J].酿酒科技, 2014(1):55-58.
JIAN X P, SHI Y X, WANG T, et al.Comparative analysis of biological and physiochemical indexes of artificial Daqu and machine-made daqu[J].Liquor-Making Science & Technology, 2014(1):55-58.
[16] 李静心, 王艳丽, 何宏魁, 等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业, 2018, 44(12):52-59.
LI J X, WANG Y L, HE H K, et al.High-throughput sequencing revealed fungal community structures at high temperature Daqu and medium temperature Daqu[J].Food and Fermentation Industries, 2018, 44(12):52-59.
[17] 罗小叶. 酱香型大曲高温放线菌的特性研究[D].贵阳:贵州大学, 2017.
LUO X Y.Research on characteristics of Thermoactinomyces in Moutai-flavor Daqu[D].Guiyang:Guizhou University, 2017.
[18] HU X, DU H, REN C, et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Applied and Environmental Microbiology, 2016, 82(8):2 506-2 515.
[19] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature daqu with different colors[J].Frontiers in Microbiology, 2020, 11:588117.
[20] XIE M W, LV F X, MA G X, et al.High throughput sequencing of the bacterial composition and dynamic succession in Daqu for Chinese sesame flavour liquor[J].Journal of the Institute of Brewing, 2020, 126(1):98-104.
[21] GUAN T W, LIN Y J, CHEN K B, et al.Physicochemical factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese strong-flavor Baijiu[J].Frontiers in Microbiology, 2020, 11:2090.