无花果(Ficus carica L.),为植物桑科(Moraceae)榕属(Ficus)多年生木本果树[1],具有独特的“由内而外”结构的水果,花序托果实的果肉呈囊状,顶端有一个小孔,小花团聚在内壁上,在外部不可见,因而将其称为“无花果”[2]。新鲜时果实皮薄而嫩,成熟时多汁而甜,而且富含矿物质、维生素、糖类、黄酮类等物质,还含有苯甲醛、补骨脂素、佛手柑内酯等多种活性物质成分,可起到抗氧化、抗衰老、抗痉挛、抗病毒、抗炎以及潜在的抗癌活性和降低患心血管疾病的风险[3-4]。无花果因其营养价值、良好的风味且易腐烂、难以贮存而适合加工成无花果酒。无花果酒是指以无花果为原料,将其破碎后利用酵母菌将糖转化为酒精等产物,再经陈酿后成为酒质醇厚芳香、酒体清亮透明的果酒产品。
无花果酒外观清澈悦目,香气浓郁协调,含有多种对人体有益的生物活性成分。但无花果酒酿制后易出现高级醇含量偏高的现象,酒体刺激而不够饱满,需要进行陈酿以促进酒体的饱满。本实验以高级醇类物质、挥发性风味物质和有机酸类物质含量为主要评价指标,找到无花果酒的最佳陈酿期,在此基础上系统研究陈酿期无花果酒的品质变化规律,为无花果酒的研究提供理论依据,对无花果酒的工业化生产具有重要意义。
1 材料与方法
1.1 实验材料
1.1.1 材料与试剂
布朗瑞克新鲜无花果,采自四川威远县;市售酵母KD,法国马丁威兰特公司;食品级蔗糖,市售;食品级焦亚硫酸钾,浙江一诺生物科技有限公司。
NaOH、葡萄糖、磷酸、体积分数30% H2O2、NaCl、NaCO3、KCl、HCl、甲醇、无水乙醇、乙腈、磷酸、环己酮(均为色谱纯),成都市科隆化学品有限公司;乙酸正丁酯、正丙醇、异丁醇、正丁醇、异戊醇、正戊醇、苯乙醇(均为标准品),上海晶纯生化科技有限公司;苹果酸、柠檬酸、酒石酸、乳酸、草酸、丁二酸、叔戊醇(均为标准品),阿拉丁。
1.1.2 仪器与设备
SHP生化恒温培养箱,北京中兴伟业仪器有限公司;HDP-9082型电热恒温培养箱,上海一恒科学仪器有限公司;DZKW-D-4型电热恒温水浴锅,北京市永光明医疗仪器厂;超声清洗机,昆山洁力美超声仪器有限公司;U3000液相色谱仪,美国Thermo公司;7890A/59750气相色谱-质谱联用仪,7890B气相色谱仪;美国Agilent Technologies公司。
1.2 实验方法
1.2.1 无花果酒的酿制
参考蒋成等[5]的方法,并稍作修改。新鲜无花果经清洗后,去梗打浆,用食品级焦亚硫酸钾将SO2质量浓度调为80 mg/kg,用蔗糖调整糖度为23°Brix。各取800 mL无花果汁于1 000 mL磨砂广口瓶中,分别接入质量分数0.03%酵母KD(酵母在质量分数5%糖水中37 ℃时活化30 min),于20 ℃发酵15 d。进行倒罐后于20 ℃继续后发酵10 d,分离酒脚即得到原酒。
1.2.2 无花果酒的酿制
将1.2.1得到的无花果酒罐装到250 mL玻璃瓶中装满密封,置于温度为10 ℃、湿度为70%~80%、隔光的保鲜柜中,每隔30 d取出3瓶进行指标测定。
1.2.3 理化指标测定
酒精度、总干浸出物、总酸采用GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行测定。酒精度采用GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》进行测定。
1.2.4 挥发性风味物质的测定
参照ZHU等[6]的方法,采用顶空固相微萃取(solid-phase microextraction, SPME)结合GC-MS进行无花果酒中挥发性风味物质的测定。以环己酮为内标。
色谱条件:采用30 m×0.250 mm的HP-5MS色谱柱,初始温度为40 ℃,保持时间1 min,以5 ℃/min升至70 ℃,再以2 ℃/min升至120 ℃,以8 ℃/min升至160 ℃,再以6 ℃/min升至250 ℃,保持1 min,载气为He,流速为1.2 mL/min,不分流,进样口温度为260 ℃。
质谱条件:电离方式EI,电离电压70 eV,灯丝流量0.25 mA,连接杆温度280 ℃,电子倍增器电压为1 500 V,扫描范围为30~350 AMU,离子源温度250 ℃。
定性、定量分析:使用NIST11谱库对未知挥发性化合物谱图进行比对,选取匹配度≥70%的物质作为有效的挥发性风味物质,结合相关资料进行分析鉴定,并采用内标法进行半定量分析。
1.2.5 有机酸含量的测定
参照GB/T 32783—2016《蓝莓酒》,并略作修改。色谱条件:色谱柱为美国Zorbax Eclipse Plus C18 (4.6 mm×250 mm, 5 μm);柱温30 ℃;进样体积10 μL;紫外检测波长214 nm。洗脱条件:0~5 min,0.1%磷酸水溶液95%,流速0.5 mL/min;5~8 min,0.1%磷酸水溶液95%,流速0.3 mL/min;8~15 min,0.1%磷酸水溶液40%,流速0.3 mL/min;15~25 min,0.1%磷酸水溶液95%,流速0.5 mL/min。以此方法所制标准曲线见表1。
表1 有机酸标准曲线表
Table 1 Organic acid standard curve table
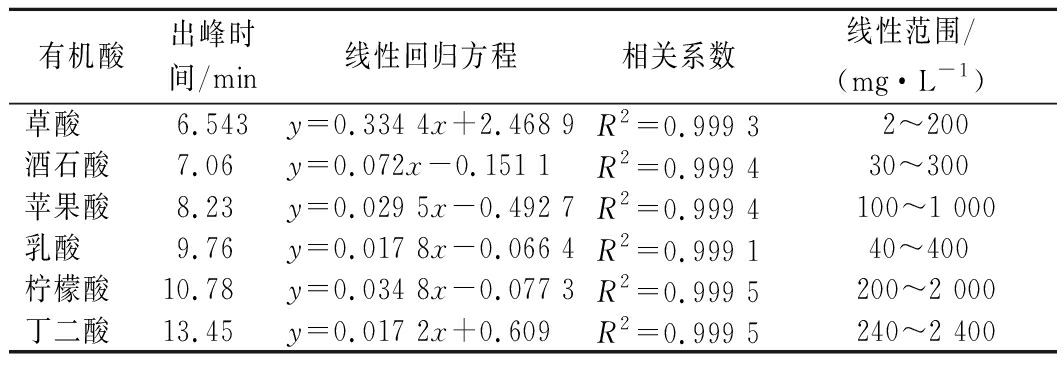
有机酸出峰时间/min线性回归方程相关系数线性范围/(mg·L-1)草酸6.543y=0.334 4x+2.468 9R2=0.999 3 2~200酒石酸7.06y=0.072x-0.151 1R2=0.999 430~300苹果酸8.23y=0.029 5x-0.492 7R2=0.999 4 100~1 000乳酸9.76y=0.017 8x-0.066 4R2=0.999 140~400柠檬酸10.78y=0.034 8x-0.077 3R2=0.999 5 200~2 000丁二酸13.45y=0.017 2x+0.609R2=0.999 5 240~2 400
1.2.6 高级醇含量的测定
参考蒋成等[5]的方法,采用气相色谱/氢火焰离子检测器(gas chromatography-flame ionization detector, GC-FID)。以乙酸正丁酯为内标,配制正丙醇、正丁醇、异丁醇、正戊醇、异戊醇和苯乙醇标准溶液。
色谱条件:采用30 m×0.250 mm的HP-INNOWAX色谱柱,初始温度为40 ℃,保持时间4 min,以3.5 ℃/min升至170 ℃,再以20 ℃/min升至200 ℃,保持10 min;进样量为1 μL;分流比50∶1;分流流量50 mL/min;空气流量400 mL/min;H2流量30 mL/min;尾吹气流量25 mL/min。
甲醇测定采用GB 5009.266—2016《食品中甲醇的测定》进行测定。按照以上方法所制标准曲线见表2。
表2 醇类物质标准曲线表
Table 2 Standard curve table of alcohols
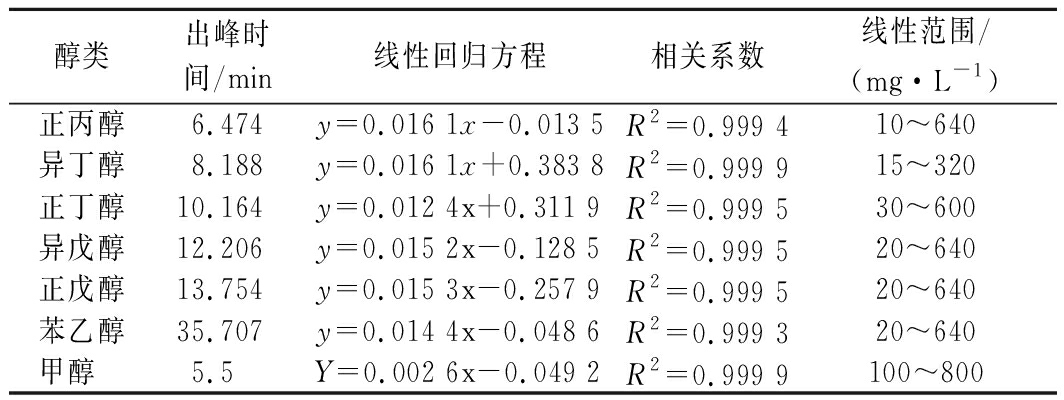
醇类出峰时间/min线性回归方程相关系数线性范围/(mg·L-1)正丙醇6.474y=0.016 1x-0.013 5R2=0.999 410~640异丁醇8.188y=0.016 1x+0.383 8R2=0.999 915~320正丁醇10.164y=0.012 4x+0.311 9R2=0.999 530~600异戊醇12.206y=0.015 2x-0.128 5R2=0.999 520~640正戊醇13.754y=0.015 3x-0.257 9R2=0.999 520~640苯乙醇35.707y=0.014 4x-0.048 6R2=0.999 320~640甲醇 5.5Y=0.002 6x-0.049 2R2=0.999 9100~800
1.2.7 Kramer 感官顺位评定
参照桑苇等[7]的方法,并略作修改。品评员进行Kramer感官品评,得到随机排序编号的样品后,按照喜好程度将样品先大致分为上、中、下3组,再在3组组内进行比较排序,确定所有样品喜好顺序。
1.2.8 实验数据统计分析
实验至少重复3次,结果表示为平均值±标准差,采用SPSS 24软件对数据进行显著性分析,采用Origin 8.5和TBtools软件作图。
2 结果与分析
2.1 不同陈酿时间的无花果酒的基础指标分析
如表3所示,不同陈酿时间的无花果酒在酒精度、总浸出物和总酸中存在显著性差异(P<0.05)。其中,陈酿0个月时无花果酒的酒精度最高(13.26%vol),而陈酿9个月时酒样酒精度较低(11.55%vol),且酒精度随着陈酿时间的增加而减少,这与曾竟蓝[8]的研究类似,可能是陈酿过程中醇与酸缓慢反应生成酯,增加了果酒的陈酿香[9]。本实验的无花果酒总浸出物含量均大于NY/T 1508—2017《绿色食品 果酒》中规定的12 g/L,其中,陈酿0个月时无花果酒的总浸出物含量最低(21.60 g/L),9个月时较高(23.63 g/L),随着陈酿时间的延长总浸出物含量呈现上升趋势。陈酿0个月的无花果酒的总酸含量最高(5.1 g/L),陈酿3个月的酒样总酸含量最低(4.88 g/L),随着陈酿时间的增加总酸含量呈现先下降后上升的趋势,这与周雪燕等[10]对冰葡萄酒的研究类似。
表3 不同陈酿时间酒样的基础指标
Table 3 Basic indicators of wine samples at different ages
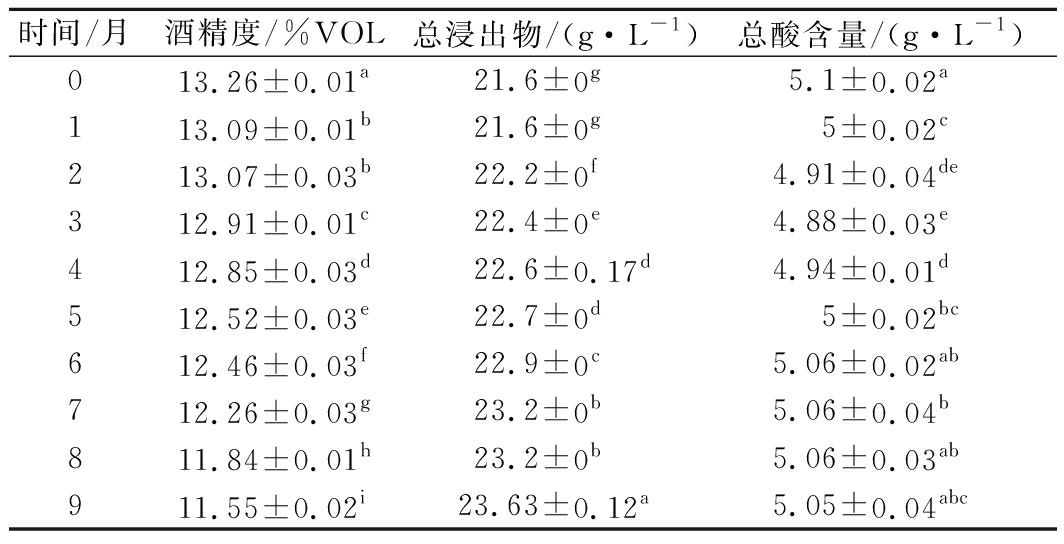
时间/月酒精度/%VOL总浸出物/(g·L-1)总酸含量/(g·L-1)013.26±0.01a21.6±0g5.1±0.02a113.09±0.01b21.6±0g5±0.02c213.07±0.03b22.2±0f4.91±0.04de312.91±0.01c22.4±0e4.88±0.03e412.85±0.03d22.6±0.17d4.94±0.01d512.52±0.03e22.7±0d5±0.02bc612.46±0.03f22.9±0c5.06±0.02ab712.26±0.03g23.2±0b5.06±0.04b811.84±0.01h23.2±0b5.06±0.03ab911.55±0.02i23.63±0.12a5.05±0.04abc
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
2.2 不同陈酿时间的无花果酒醇类物质含量分析
本实验的无花果酒中检测出了正丙醇、正丁醇、异戊醇和苯乙醇。陈酿0个月时高级醇总量最高(641.88 mg/L),随着陈酿时间的增加,高级醇总量显著下降,在陈酿9个月时较低(363.49 mg/L),而高级醇含量<400 mg/L时,能赋予果酒典型的香气[11]。正丙醇、正丁醇、异戊醇的含量都随着陈酿时间的增加而呈现下降趋势,其中,异戊醇含量下降最多,陈酿9个月(219.61 mg/L)较0个月(384.6 mg/L)时下降了42.90%,正丙醇下降了19.89%(由45.29 mg/L下降到了36.28 mg/L),正丁醇下降了47.46%(由131.1 mg/L下降到了68.88 mg/L)。正丙醇有轻微的醚味和较重的苦味[12],下降会使酒中的苦味略微减弱。异戊醇有强烈的冲辣感[12],因而陈酿后的无花果酒会较为柔和。高级醇含量下降的原因可能是转化为相应醛类及酸类物质[13],如异丁醇、异戊醇可以转化形成乙酸酯[14]。
苯乙醇的香味独特,具有玫瑰香、紫罗兰香、茉莉花香等多样风味[15]。在陈酿过程中,苯乙醇的含量呈现下降的趋势,陈酿9个月时的酒样苯乙醇含量较低(38.73 mg/L),陈酿1个月时含量最高(87.63 mg/L)。
甲醇具有一定的毒性,不同陈酿时间酒样的甲醇含量均小于GB/T 15037—2006《葡萄酒》规定的400 mg/L。由图1可知,未陈酿的酒样甲醇含量最高(375.3 mg/L),随着陈酿时间的增加含量呈现显著下降趋势,陈酿9个月时(271.79 mg/L)较未陈酿时下降了27.58%。这可能是陈酿过程中甲醇转化为了甲酸[16]。

a-醇类;b-甲醇;c-有机酸
图1 不同陈酿时间无花果酒的醇类物质含量、有机酸含量
Fig.1 Alcohol content and organic acid content in FIG wine with different aging time
注:不同小写字母代表差异显著(下同)
2.3 不同陈酿时间的无花果酒有机酸含量分析
在本实验的无花果酒中能检测到的有机酸有草酸、酒石酸、苹果酸、乳酸、柠檬酸和丁二酸。就整体而言,陈酿0个月时有机酸的总量最低(3 682.48 mg/L),随着陈酿时间的延长有机酸含量呈显著上升趋势,以陈酿9个月时较高(4 193.78 mg/L)(图1-c),可能是陈酿过程中醛类物质逐渐氧化而生成酸[8],这与BAIANO等[17]的研究结果相似。苹果酸在有机酸中占比最高,为36.50%~44.72%,陈酿0个月时苹果酸含量最低(1 344.01 mg/L),随着陈酿时间的延长显著升高,陈酿9个月时较高(1 875.53 mg/L)。此外,草酸、乳酸、柠檬酸和丁二酸均随着陈酿时间的增加而呈现先上升后下降的趋势,乳酸含量的下降可能是和乙醇作用生成乳酸乙酯[18]。其中,草酸、乳酸和柠檬酸含量在陈酿5个月时达到最大值(分别为54.91、1 089.12和751.96 mg/L),丁二酸含量在陈酿4个月时达到最大值(367.41 mg/L)。酒石酸含量在陈酿0个月时最低(231.22 mg/L),其含量随着陈酿时间的增加呈现上升趋势,陈酿9个月时含量较高(258.99 mg/L),酒石酸含量的变化可能与酒石酸络合物的形成与解聚有关系。
2.4 不同陈酿时间的无花果酒挥发性风味物质含量及热图分析
不同陈酿时间无花果酒的挥发性风味物质含量见电子增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.030394)。利用TBtools得到不同陈酿时间的无花果酒的挥发性风味物质中气味活性值(odor activity value, OAV)>1的挥发性风味物质的热图(图2)。X轴为不同的陈酿时间,Y轴为挥发性风味物质的名称。样品中挥发性物质含量越高颜色越红,含量越低颜色越绿,红色的圆形图案越大,OAV越大,绿色的圆形图案越大,OAV越小。不同陈酿时间无花果酒OAV>1的挥发性风味物质含量见电子增强出版附表2。
通过对比10种样品可知,OAV最大的物质为辛酸乙酯,具有花果、杏子香气[19],其含量随着陈酿时间的增加而呈现显著增加的趋势,在陈酿9个月时OAV达到20 109.08,为无花果酒最主要的挥发性风味物质。其次,OAV较大的物质为正己酸乙酯、乙酸异戊酯、十四酸乙酯、DL-2-羟基己酸乙酯、香茅醇和大马士酮,这些为无花果酒中重要的风味物质。其中,己酸乙酯提供青苹果样的香气[20],乙酸异戊酯赋予果酒成熟香蕉的气味[21],大马士酮赋予果酒花香及浆果香[21],香茅醇拥有玫瑰香、甜香、柑橘香[21]。随着陈酿时间的增加,乙酸异戊酯的含量呈现上升趋势,在陈酿9个月时较大(10 631.59 μg/L)。随着陈酿时间的增加,正己酸乙酯的含量呈现先下降后上升的趋势,在陈酿0个月时为最大值(17 917.47 μg/L)。大马士酮、香茅醇和十四酸乙酯均在陈酿9个月时较大(分别为10 561.83、5 936.61和3 240.08 μg/L)。另外,在无花果酒中OAV稍大的物质为乙酸苯乙酯、癸酸乙酯、丁二酸二乙酯、2-甲基肉豆蔻酸甲酯、乙基异戊基琥珀酸酯、苯乙醇和D-柠檬烯,这些物质在无花果酒中的风味也很重要。其中,乙酸苯乙酯赋予果酒以玫瑰花香[21],癸酸乙酯具有菠萝水果香、花香、甜香等[21],苯乙醇具有玫瑰香、紫罗兰香、茉莉花香等多样风味[15],D-柠檬烯具有花香、甜香、柠檬香和柑橘香等香味[21]。在陈酿过程中,乙酸苯乙酯和癸酸乙酯含量随着陈酿时间的增加而增加,在陈酿9个月时较大(分别为11 281.48和17 623.91 μg/L)。随着陈酿时间的增加,丁二酸二乙酯和苯乙醇的含量呈现先下降后上升的趋势,在陈酿9个月时较大(分别为21 217.09和193 194.87 μg/L)。D-柠檬烯的含量也在陈酿9个月时较大(2 528.52 μg/L)。总体而言,陈酿时间的延长对无花果酒的风味有积极的影响。
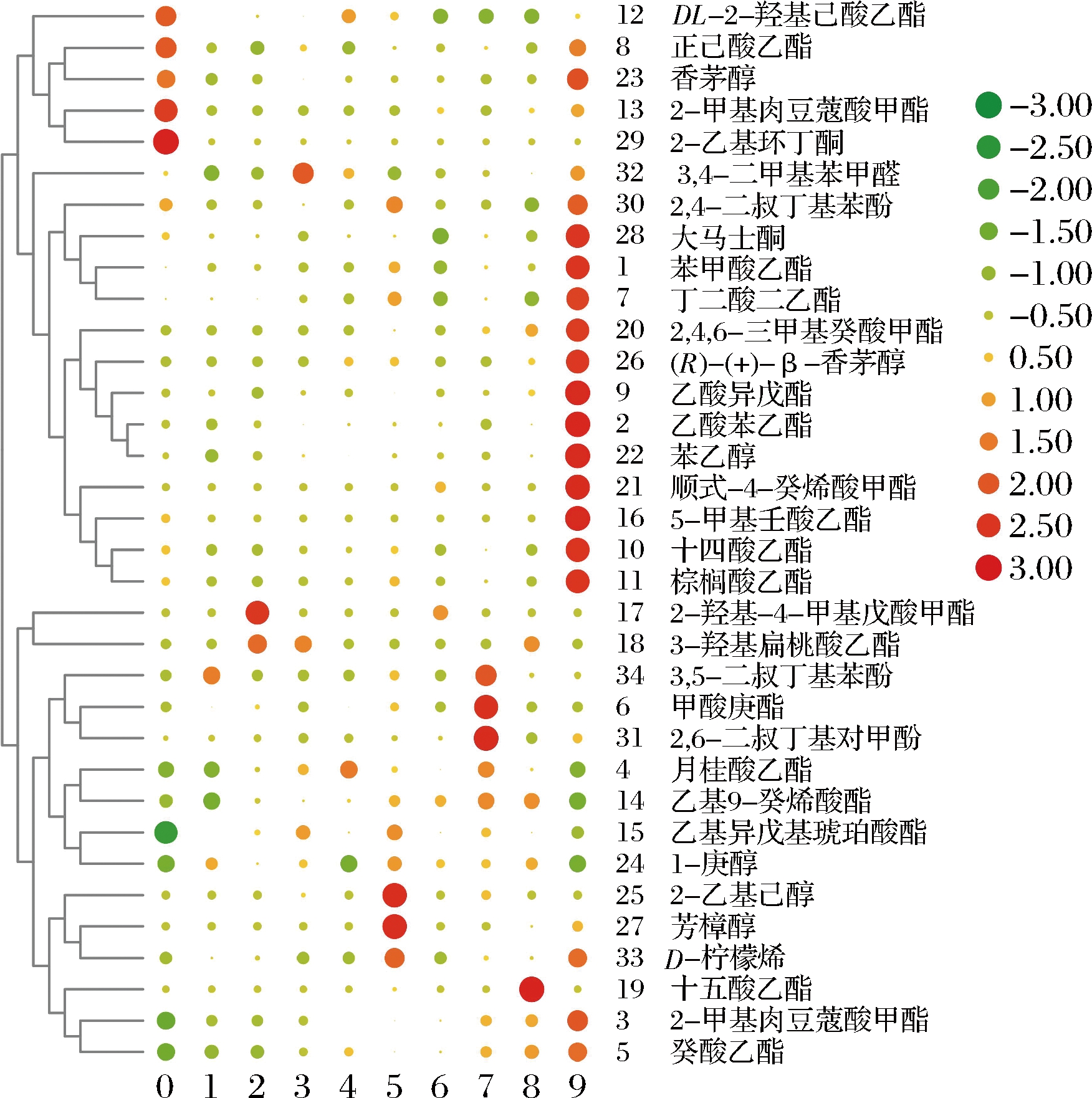
图2 OAV>1的挥发性风味物质的热图
Fig.2 Heat map of volatile flavor substance with OAV>1
2.5 不同陈酿时间的无花果酒电化学指标分析
pH值代表H+在溶液中的浓度,图3-a是不同陈酿时间无花果酒pH值的变化情况。随着陈酿时间的增加,无花果酒的pH值呈现轻微下降的趋势,在陈酿9个月时较小(3.76)。
电导率反映了单位体积溶液中离子总数的多少,由图3-b可知,未陈酿的无花果酒的初始电导率为1 678 μs/cm,随着陈酿时间的增加,无花果酒的电导率值不断增加,在陈酿9个月时较大(1 747 μs/cm)。这说明在陈酿过程中某些物质发生了一定的氧化及离子化,导致酒体离子化程度升高,电导率值因此而升高,而电导率的升高可促使果酒更快的达到平衡状态,这与杨星[22]和张斌[23]的研究结果类似。

a-pH;b-电导率;c-溶解氧;d-氧化还原电位
图3 不同陈酿时间无花果酒的电化学指标
Fig.3 Electrochemical indexes of FIG wine with different aging time
溶解氧指酒体中溶解的分子态氧,控制好溶解氧值可以提高果酒的风味和品质。由图3-c可以看出,未陈酿的无花果酒的溶解氧值最大(4.76 mg/L),随着陈酿时间的增加,溶解氧值显著下降,在陈酿9个月时较小(3.59 mg/L),这与张斌[23]对白兰地陈酿的研究结果类似。这说明,随着陈酿时间的延长,无花果酒中发生了氧化反应,氧化反应消耗了无花果酒中的溶解氧,这也与电导率值的升高相互印证。在陈酿后期,溶解氧值的变化幅度较小,这也说明无花果酒的整体状态逐渐趋于平衡状态。
氧化还原电位值反映溶液中各种物质的综合氧化能力或还原能力的一个状态参数,电位为正表示溶液显示出一定的氧化性,为负显示出还原性[24]。如图3-d所示,不同陈酿时间的无花果酒的氧化还原电位值都为正数,说明无花果酒显示出氧化性。未陈酿的无花果酒氧化还原电位值最高(206.9 mV),随着陈酿时间的增加,氧化还原电位值显著下降,在陈酿9个月时较小(192.1 mV),也与张斌[23]的研究结果类似。这说明无花果酒的氧化性随着陈酿时间的增加而逐渐降低,说明酒体在逐渐达到氧化还原电位的平衡状态,与溶解氧值和电导率值的变化相互印证。
2.6 不同陈酿时间的无花果酒的Kramer感官顺位评定分析
12名感官品评员对不同陈酿时间的10个无花果酒样品的风味优劣进行Kramer感官评定,结果如表4所示。
表4 Kramer感官顺位评定结果排序
Table 4 Ranking of Kramer sensory placement results
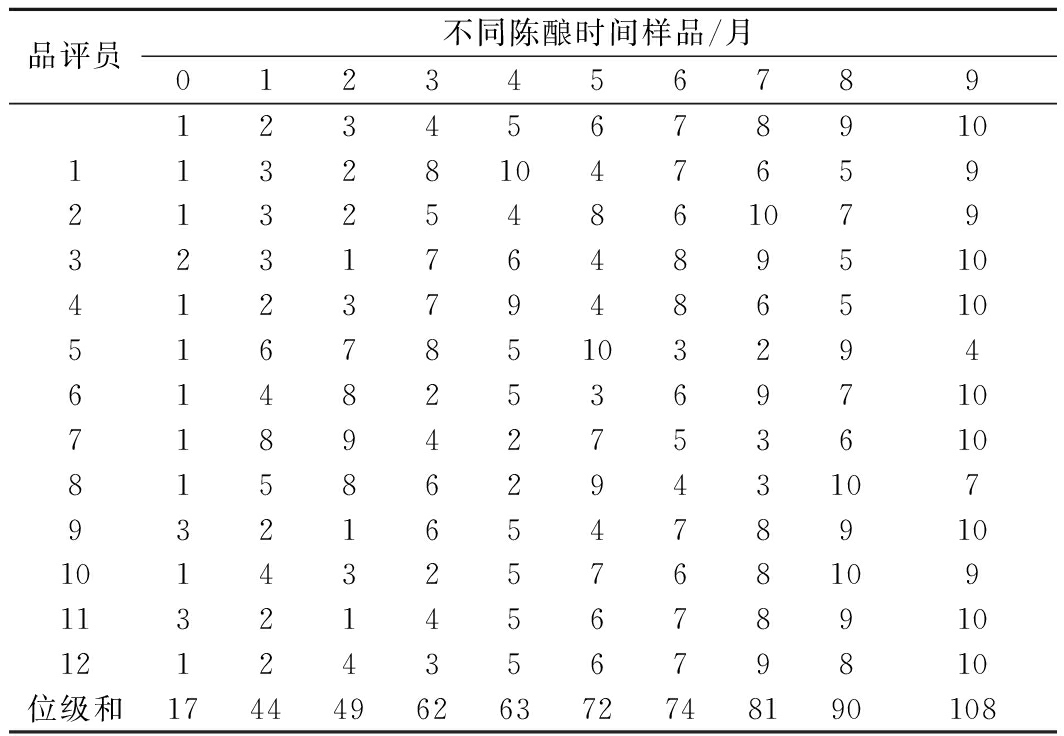
品评员不同陈酿时间样品/月012345678912345678910113281047659213254861079323176489510412379486510516785103294614825369710718942753610815862943107932165478910101432576810911321456789101212435679810位级和174449626372748190108
由表4可知,12名品评员对10个酒样进行排序,无相同位级。由表5可知,在1%显著性水平下,上段为36~96,下段为43~89。上段中,Rimax=96<R9月=108,Rimin=36>R0月=17,所以在1%显著水平,10个样品间有显著性差异。在下段中,43<R1月<R2月<R3月<R4月<R5月<R6月<R7月<89,R9月>R8月>89,R0月<43,10个样品可划分为3组,即0;1、2、3、4、5、6、7;8、9,组内各样品无显著性差异。因此,陈酿8个月和9个月的样品感官风味较优。
表5 Kramer 感官顺位评定显著水平临界值
Table 5 The critical level of significance was assessed by Kramer sensory alignment

各显著水平下的临界值1%显著水平5%显著水平上段36~9641~91下段43~8950~82
3 结论
不同陈酿时间对无花果酒的理化指标、高级醇、有机酸、挥发性风味物质、电化学指标和感官风味等均有显著影响。陈酿至9个月的无花果酒外观清澈悦目,口味柔和,酒体不刺激,香气浓郁协调。
陈酿9个月时,无花果酒的高级醇含量为363.49 mg/L<400 mg/L,较未陈酿下降了43.37%,能赋予果酒积极的醇类风味;无花果酒的有机酸含量为4 193.78 mg/L,较未陈酿下降了12.14%,且有草酸、酒石酸、苹果酸、乳酸、柠檬酸和丁二酸6种有机酸,赋予无花果酒爽口、协调的口感;陈酿9个月时酒样中赋予无花果酒花香、甜香、果香等风味的辛酸乙酯、大马士酮、香茅醇、己酸乙酯和乙酸异戊酯等物质含量都较未陈酿时有所上升。因而,陈酿9个月时无花果酒的风味、口感和典型性都较未陈酿酒样高。另外,根据Kramer感官顺位评定的结果,得出陈酿第8个月和9个月时的无花果酒感官风味优于未陈酿的酒样。
在陈酿后期尤其是陈酿9个月时,与陈酿初期相比,pH值较小(3.76);电导率值较大(1 747 μs/cm);溶解氧值较小(3.59 mg/L);氧化还原电位值较小(192.1 mV),这些说明无花果酒正在趋于平衡状态,陈酿期中第9个月时的无花果酒酒体稳定性优于未陈酿的酒样。
本实验比较了不同陈酿时间对无花果酒品质的影响,揭示了陈酿期品质变化的规律,与未陈酿相比,陈酿后的无花果酒整体的口感和风味有了提升,酒体也趋于稳定,为无花果酒的工业化提供了一定的理论支持。
[1] 颜碧玉. 种一株历史悠久的无花果树[J].花卉, 2017(1):50-51.
YAN B Y.Plant an old fig tree[J].Flowers, 2017(1):50-51.
[2] 沈元月. 我国无花果发展现状、问题及对策[J].中国园艺文摘, 2018, 34(2):75-78;122.
SHEN Y Y.Current situation, problems and solutions of fig development in China[J].Chinese Horticulture Abstracts, 2018, 34(2):75-78;122.
[3] SOLOMON A, GOLUBOWICZ S, YABLOWICZ Z, et al.Antioxidant activities and anthocyanin content of fresh fruits of common fig (Ficus carica L.)[J].Journal of Agricultural and Food Chemistry, 2006, 54(20):7 717-7 723.
[4] VINSON J A, ZUBIK L, BOSE P, et al.Dried fruits:Excellent in vitro and in vivo antioxidants[J].Journal of the American College of Nutrition, 2005, 24(1):44-50.
[5] 蒋成, 付云云, 杨云洁, 等.不同酵母对无花果酒高级醇、氨基酸的影响研究[J].食品与发酵工业, 2018, 44(11):147-153.
JIANG C, FU Y Y, YANG Y J, et al.Effects of different yeasts on advanced alcohols and amino acids of fig wine[J].Food and Fermentation Industries, 2018, 44(11):147-153.
[6] ZHU J C, WANG L Y, XIAO Z B, et al.Characterization of the key aroma compounds in mulberry fruits by application of gas chromatography-olfactometry(GC-O), odor activity value(OAV), gas chromatography-mass spectrometry(GC-MS) and flame photometric detection(FPD)[J].Food Chemistry, 2018, 245:775-785.
[7] 桑苇, 唐柯, 徐岩, 等.黑曲霉β-葡萄糖苷酶对葡萄酒酶解增香调控及香气物质的影响[J].食品与发酵工业, 2015, 41(5):8-13.
SANG W, TANG K, XU Y, et al.Effects of β-glucosidase from Aspergillus niger on flavoring regulation and aroma compounds of wine[J].Food and Fermentation Industries, 2015, 41(5):8-13.
[8] 曾竟蓝. 柑橘发酵酒陈酿过程的品质变化规律及催陈方法研究[D].长沙:湖南农业大学, 2019.
ZENG J L.Study on quality changes and accelerating aging method of citrus fermented wine during aging process[D].Changsha:Hunan Agricultural University, 2019.
[9] 兰玉倩, 薛洁, 江伟, 等.黄酒陈酿过程中主要成分变化的研究[J].中国酿造, 2011, 30(5):165-170.
LAN Y Q, XUE J, JIANG W, et al.Changes of the main components in the process of rice wine aging[J].China Brewing, 2011, 30(5):165-170.
[10] 周雪燕, 陈宇, 林可, 等.‘美乐’和‘威代尔’冰酒在贮藏过程中理化性质和挥发性风味物质的动态变化[J].食品科学, 2021, 42(2):200-211.
ZHOU X Y, CHEN Y, LIN K, et al.Dynamic changes in the physicochemical properties and the volatile flavor compounds in ‘Merlot’and ‘Vidal’ icewines during storage[J].Food Science, 2021, 42(2):200-211.
[11] LONGO R, CAREW A, SAWYER S, et al.A review on the aroma composition of Vitis vinifera L.Pinot noir wines:Origins and influencing factors[J].Critical Reviews in Food Science and Nutrition, 2021, 61(10):1 589-1 604.
[12] 孙时光. 桑椹果酒发酵过程中高级醇的控制研究[D].宜宾:四川轻化工大学, 2019.
SUN S G.Study on control of higher alcohols during fermentation process in mulberry wine[D].Yibin:Sichuan University of Science & Engineering, 2019.
[13] BURIKOV S, DOLENKO T, PATSAEVA S, et al.Raman and IR spectroscopy research on hydrogen bonding in water-ethanol systems[J].Molecular Physics, 2010, 108(18):2 427-2 436.
[14] PROCOPIO S, QIAN F, BECKER T.Function and regulation of yeast genes involved in higher alcohol and ester metabolism during beverage fermentation[J].European Food Research and Technology, 2011, 233(5):721-729.
[15] 陈亮, 危晴, 辛秀兰, 等.不同酵母发酵对猕猴桃果酒香气成分的影响[J].食品研究与开发, 2015, 36(5):100-106.
CHEN L, WEI Q, XIN X L, et al.Effect of different yeast for kiwi wine aroma components[J].Food Research and Development, 2015, 36(5):100-106.
[16] 陈思妘. 酒精发酵中高级醇的形成途径及影响因素[J].食品与发酵工业, 1981, 7(1):76-81.
CHEN S Y.Formation pathway and influencing factors of higher alcohols in alcohol fermentation [J].Food and Fermentation Industries, 1981, 7(1):76-81.
[17] BAIANO A, MENTANA A, QUINTO M, et al.The effect of in-amphorae aging on oenological parameters, phenolic profile and volatile composition of Minutolo white wine[J].Food Research International, 2015, 74:294-305.
[18] 王晓丹, 班世栋, 胥思霞, 等.浓香型大曲中酶系与白酒品质的关系研究[J].中国酿造, 2014, 33(1):44-47.
WANG X D, BAN S D, XU S X, et al.Relationship between enzyme system and liquor quality in Luzhou-flavor Daqu[J].China Brewing, 2014, 33(1):44-47.
[19] 冯隽野, 李佳启, 王萍.野生蓝靛果发酵过程中品质变化及挥发性物质分析[J].现代食品科技, 2018, 34(11):111-118.
FENG J Y, LI J Q, WANG P.Quality changes and analysis of volatile compounds of Lonicera caerulea L.during fermentation[J].Modern Food Science and Technology, 2018, 34(11):111-118.
[20] G MEZ-M
MEZ-M GUEZ M J, CACHO J F, FERREIRA V, et al.Volatile components of Zalema white wines[J].Food Chemistry, 2007, 100(4):1 464-1 473.
GUEZ M J, CACHO J F, FERREIRA V, et al.Volatile components of Zalema white wines[J].Food Chemistry, 2007, 100(4):1 464-1 473.
[21] 曹建宏. 霞多丽营养系品种葡萄与葡萄酒香气成分的研究[D].杨凌:西北农林科技大学, 2006.
CAO J H.Study on aroma components for clones of chardonnay grape and wine[D].Yangling:Northwest A & F University, 2006.
[22] 杨星. 酒类陈酿过程中分子缔合及电化学参数变化研究[D].广州:华南理工大学, 2011.
YANG X.Research on the molecular hydrogen bonding and electrochemistry properties variations during wine aging[D].Guangzhou:South China University of Technology, 2011.
[23] 张斌. 电场对橡木桶陈酿白兰地酒的影响及其作用机理研究[D].广州:华南理工大学, 2012.
ZHANG B.Study on the mechanism and effects of electric field treatments on brandy aging in oak barrel[D].Guangzhou:South China University of Technology, 2012.
[24] 洪妍, 郭秋梅, 董铁有, 等.ORP的测量及数显ORP标定的原理[J].河南科技大学学报(自然科学版), 2006, 27(1):18-20;2.
HONG Y, GUO Q M, DONG T Y, et al.ORP measuring mechanism and calibration standards and principles for digital ORP meters[J].Journal of Henan University of Science & Technology (Natural Science), 2006, 27(1):18-20;2.