瓜氨酸是一种天然的非蛋白质α-氨基酸,存在于植物[1]、哺乳动物[2]和微生物[3]中。作为一种重要的功能性氨基酸,其在人体代谢中参与“NO循环”生成重要的信号分子NO[4];另一方面,还参与“尿素循环”消除增加中枢神经系统功能障碍的有害氨[5]。研究表明,瓜氨酸不被肝脏或肠道精氨酸酶分解,并能绕过肝脏摄取和降解[6],同时还是精氨酸酶的抑制剂[7],因此,瓜氨酸在提高精氨酸的生物利用度和NO产量方面比精氨酸更加有效[8],被应用于治疗代谢综合征[9]、心血管疾病[10]、勃起功能障碍[11]以及提高运动表现力[7]和抗氧化[12]等方面,作为一种有吸引力的药物营养素,瓜氨酸能潜在的解决许多与生活方式或者与年龄有关的疾病,故被广泛应用于食品、医药和保健品领域。
目前,瓜氨酸可通过天然植物提取、化学合成、微生物发酵和微生物酶法等方法进行生产[13]。酶法转化因条件温和、转化率高、环境友好和下游分离纯化简便等优势而成为研究热点[14]。精氨酸脱亚胺酶(arginine deiminase,ADI, EC 3.5.3.6)作为生产瓜氨酸的关键酶,不可逆地催化精氨酸水解为瓜氨酸和氨,至今,已有许多不同微生物来源的ADI被报道,包括支原体(Mycoplasma arginini)、乳酸球菌(Lactococcus lactis ssp.Lactis)、盐杆菌(Halobacterium salinarium)、恶臭假单胞菌(Pseudomonas putida)、烟曲霉(Aspergillus fumigatus)、变形假单胞菌(Pseudomonas plecoglossicida)等[3]。大多ADI的最适温度在37~60 ℃,来源于L.lactis subsp. lactis的ADI最稳定,在50 ℃的半衰期为90 min[15];而来源于L.lactis的突变体酶活力最高,为195.7 U/mg[14]。应用ADI进行瓜氨酸的工业化生产不仅希望ADI具有较高的催化活力进行高效转化;还希望ADI有较好的热稳定性适配工业生产需要,因为反应在较高温度下进行可以增加底物的溶解度和生物利用度、提高反应速度、减少中温菌污染[16]。除了用于制备瓜氨酸,由于ADI具备消耗精氨酸的能力,还用于治疗外源性精氨酸依耐性癌细胞,如肝癌、黑色素瘤等营养缺陷型癌细胞,但在临床应用上也存在半衰期短和免疫原性等问题[17]。
为了获得具有目的性质的酶,除了进行新酶筛选外,对现存的酶进行蛋白质工程改造也是一种有效的手段。蛋白质工程是一种基于重组DNA技术进而改变蛋白质氨基酸序列的方法,能改造天然酶使其具有所需功能[18]。近年来,出现的许多酶工程策略,包括定向进化、理性设计、计算机辅助设计等方式,其中使用计算机辅助酶的理性设计是研究的一大热点[19]。ADI的定向进化研究较多,鲜少利用理性设计改善其热稳定性的报道,CAI等[13]利用HoTMuSiC预测的氨基酸温度因子(B-factor)进行了来源于Enterococcus faecalis SK23.001的ADI定点突变,得到的2个单点突变体F269Y以及G292P在45 ℃下的半衰期较原始酶分别提高了3.4倍和5.6倍,双点组合突变体F269Y/G292P半衰期提高了5.9倍。HotSpot Wizard网页服务器可自动识别热点用于提高酶的稳定性、催化活性和底物特异性的非保守氨基酸,这些氨基酸可分为基于序列的保守但不相同的残基和共同进化残基以及基于三维结构的热点,已成功应用于许多酶的改造[20]。在前期研究中,本实验室克隆表达了来源于奥氏嗜热盐丝菌的精氨酸脱亚胺酶(H-ADI),通过酶学性质鉴定后发现该酶的热稳定性有待进一步提升,因此,本研究基于三维结构分析和HotSpot Wizard在线服务器,对来源于奥氏嗜热盐丝菌的H-ADI进行热稳定性改造,并将突变体应用于瓜氨酸的实际生产。
1 材料与方法
1.1 材料与试剂
大肠杆菌E.coli DH5α、E.coli BL21(DE3)及带有目的基因的重组质粒pET-28a(+)-H-ADI均保藏于本实验室。
液体LB培养基(g/L):氯化钠10、胰蛋白胨10、酵母提取物5,调节pH至7.0,121 ℃高压蒸汽灭菌20 min。
蛋白分子质量标准、上样缓冲液(5×)、分离胶缓冲液、浓缩胶缓冲液,雅酶(上海)生物医药科技公司;核酸染料(4S Green Plus)、IPTG、咪唑(C3H4 N2)、琼脂糖,生工生物(上海)工程有限公司;核酸Marker、2×PrimeSTAR Max Premix、Q.cut Dpn I、Q.cut Buffer(10×)、限制性内切酶,宝生物(TaKaRa)有限公司;质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒,诺唯赞(南京)生物科技有限公司;Ni-NTA亲和层析填料,通用电气医疗(GE Healthcare)公司;其他分析纯及以上试剂,国药集团化学有限公司。
1.2 仪器与设备
Aminex HPX-87column型蛋白电泳仪、T100型PCR仪,德国Eppendorf有限公司;DYY-68型蛋白电泳仪,美国Bio-Rad公司;ZCZY-CS8型恒温培养摇床、DNP-9082型恒温培养箱,上海知楚仪器有限公司;GI54DWS型立式高压灭菌锅,厦门致微仪器有限公司;高效液相色谱系统、VWD检测器,美国Agilent公司;Nano DSC差式扫描量热仪,美国Waters公司。
1.3 实验方法
1.3.1 精氨酸脱亚胺酶的同源建模及突变位点选择
奥氏嗜热盐丝菌来源的H-ADI的NCBI登录号为WP_012635610.1,选取氨基酸同源性大于30%且已解析晶体结构的蛋白序列作为模板提高建模的准确性。应用SWISS-MODEL在线建模服务器对来源于奥氏嗜热盐丝菌的H-ADI进行三维结构预测,使用PROCHECK服务器检测模型质量。此外,将H-ADI的蛋白序列提交至HotSpot Wizard在线服务器进行预测,再结合结构分析之后,选择了G65N、E81D、F111L、N142L、T180Y、V187T、A190P、T215Y、A231L、Q255M这10突变位点。采用简便的QuikChangeTM法进行定点突变,引物序列如表1所示。
表1 突变位点引物设计
Table 1 Primer design for mutation sites

注:小写字母加下划线为突变位点
引物序列(5'-3')G65N-FTGATAATaacGTAGAGGTTTTATATCTGCAT-GAATTAGCG65N-RCCTCTACgttATTATCACGTAACGTTTGTGCGAE81D-FGCCATTCAGgatGATGAAATCCGCAAGAAATT-TATCG E81D-RTCATCatcCTGAATGGCTTCAGCGGCTAATTCF111L-FGGAGTACctgGCAGATATGGACAACGAGACACTTF111L-RTATCTGCcagGTACTCCTTTAAGACTTGACGTGCCN142L-FGTTGCTAGTTTGctgGATATGGTTGAAGAGGAC-TATCCGTN142L-RTCcagCAAACTAGCAACCTTCTCAATAGCGGG T180Y-FTGCGTtatGAAACTCGCAATCGCGAGGTAATCT180Y-RGCGAGTTTCataACGCATGTGATTAAGCGTGATACCV187T-FTCGCGAGaccATCTTTGCCGAATATATCTTCTCGTV187T-RCAAAGATggtCTCGCGATTGCGAGTTTCTGTAA190P-FGAGGTAATCTTTccgGAATATATCTTCTCGTAC-CATCCGA190P-RTCcggAAAGATTACCTCGCGATTGCGAGTTTCT215Y-FtatTCTATCGAGGGAGGAGACGAGTTGATTTTT215Y-RCCTCCCTCGATAGAataAGTCTCGTTACGATCAAAC-CAGAAA231L-FGGTGTTActgATGGGAATCAGCGAGCGTACTGA231L-RTTCCCATcagTAACACCTTATCGCTCAAAATCAACQ255M-FACTGATGGCatgCCGTTCGAGACAATCTTAGCATTQ255M-RAACGGcatGCCATCAGTGAAGATATTGCGTGC
1.3.2 突变菌株构建
以实验室前期构建的重组质粒pET-28a(+)-H-ADI为模板,进行全质粒PCR扩增,PCR反应体系为模板质粒1 μL,上游引物2 μL,下游引物2 μL,Primer STAR Max 25 μL,ddH2O 20 μL。
PCR条件设置:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,循环30次;72 ℃继续延伸3 min;4 ℃保存。扩增产物在37 ℃条件下用Dpn Ⅰ消化2 h去除甲基化的模板质粒,然后转化至大肠杆菌E.coli DH5α进行质粒扩增,卡那霉素抗性固体平板进行阳性转化子筛选,测序成功的突变质粒转化至表达宿主E.coli BL21(DE3)获得突变重组菌株。
1.3.3 突变体的纯化表达
挑取在卡那霉素抗性(Kan 50 μg/mL)固体平板生长的野生型和突变型E.coli BL21(DE3)工程菌株单菌落于5 mL液体培养基,37 ℃,200 r/min培养12 h后按2%的接种量转接至200 mL液体培养基(Kan 50 μg/mL),在37 ℃,200 r/min培养至OD600值为0.5~0.6,添加终浓度为0.5 mmol/L的IPTG,在28 ℃,200 r/min下培养6 h诱导目的蛋白表达,于6 000 r/min,4 ℃离心5 min收集菌体。
15 mL细胞裂解液(50 mmol/L Na2HPO4·12H2O-NaH2PO4·2H2O,100 mmol/L NaCl,pH 7.0)重悬菌体后置于冰盒中,在超声破碎机(功率200 W,开1 s停2 s)持续破碎20 min,然后于4 ℃,8 000 r/min离心5 min收集上清液,即粗酶液;将粗酶液上样Ni-NTA亲和层析柱后用上样缓冲液液(50 mmol/L Na2HPO4·12H2O-NaH2PO4·2H2O,500 mmol/L NaCl,pH 7.0)除去未结合的蛋白,再用杂蛋白洗脱液(50 mmol/L Na2HPO4·12H2O-NaH2PO4·2H2O,500 mmol/L NaCl,50 mmol/L咪唑,pH 7.0)去除结合较弱的杂蛋白,最后用洗脱缓冲液(50 mmol/L Na2HPO4·12H2O-NaH2PO4·2H2O,500 mmol/L NaCl,500 mmol/L咪唑,pH 7.0)洗脱得到目的蛋白。分离纯化后的酶溶液置于透析袋中于4 ℃条件下透析3次,透析液隔6 h更换1次。首先在50 mmol/L磷酸缓冲液(pH 7.0,含10 mmol/L EDTA·2Na)中透析1次去除金属离子,再在50 mmol/L磷酸缓冲液(pH 7.0)透析2次。
采用SDS-PAGE测定蛋白亚基分子质量和纯度;此外,采用Lowry法测定突变体酶的蛋白浓度,使其在后续实验中保持添加量相同。
1.3.4 酶活力测定
酶反应体系:总体积为1 mL,500 μL 100 g/L L-精氨酸(pH 6.5),0.05 mg重组酶,剩余体积用50 mmol/L pH 6.5的磷酸盐缓冲液补足。反应体系放入55 ℃恒温水浴锅反应10 min,转化完成后迅速将其沸水浴10 min。灭活后的反应液置于12 000 r/min下离心5 min,取适量上清液进行产物瓜氨酸的浓度测定。
酶活定义(1 U):在反应测定条件下,以L-精氨酸作为底物,每分钟水解催化精氨酸生成1 μmol瓜氨酸所需的酶量。
参照JIANG等[21]的检测方法对产物瓜氨酸进行测定。
1.3.5 重组酶的热稳定性研究
将酶液分别在45、50、55 ℃ 3个温度下恒温水浴,每间隔30 min取出相应体积保温后的酶液按1.3.4中的条件测定其残余酶活力,将未经保温(0 h)的H-ADI重组酶的酶活力设定为100%。
1.3.6 重组酶的变性温度测定
将酶液质量浓度稀释至1 mg/mL,在0.84×105 Pa条件下对酶液和透析液脱气处理10 min,加入样品,注意不要引入气泡,设定设备运行参数为在10~100 ℃扫描且以1 ℃/min的速率进行程序升温,压力为0.3 MPa。测定结果使用Nano-Analyze进行处理和分析,采用Two-State Scaled模型对其进行拟合后得到重组酶Tm值。
1.3.7 重组酶的结构分析
同源建模后的三维结构采用Pymol进行可视化,DNAMAN软件用于核酸和蛋白序列比对。
1.3.8 重组酶的分子动力学模拟
在软件Gromacs中能量最小化后,在328 K以15 ns的速率展开分子动力学模拟,并采用gmx rmsf程序计算模拟过程中原子偏离平衡位置的均涨落方根(root mean square fluctuation,RMSF),进而了解突变氨基酸对蛋白结构产生的影响。
1.3.9 瓜氨酸的生产
以100 g/L的精氨酸为底物(pH 6.5),加入5 g/L诱导后的湿菌体,在55 ℃下进行转化生产,定时取样测定产物瓜氨酸的含量。
1.3.10 数据处理分析
每个实验均设置3个平行反应,所有测量数据使用Excel和Origin进行处理分析和图表绘制。
2 结果与分析
2.1 突变位点选择及突变体构建
选取已解析晶体结构且氨基酸同源性最高(62.59%)的来源于Streptococcus pyogenes的ADI(PDB:4BOF)作为模板,得到了H-ADI的三维结构,PROCHECK服务器检测模型质量,如图1-a所示,拉氏构象图结果表明90.3%的氨基酸处于红色的完全允许区,图1-b Errat程序结果表明H-ADI三维结构的总体质量得分为92.327%,因此,该同源建模的结构已经比较接近其真实结构。
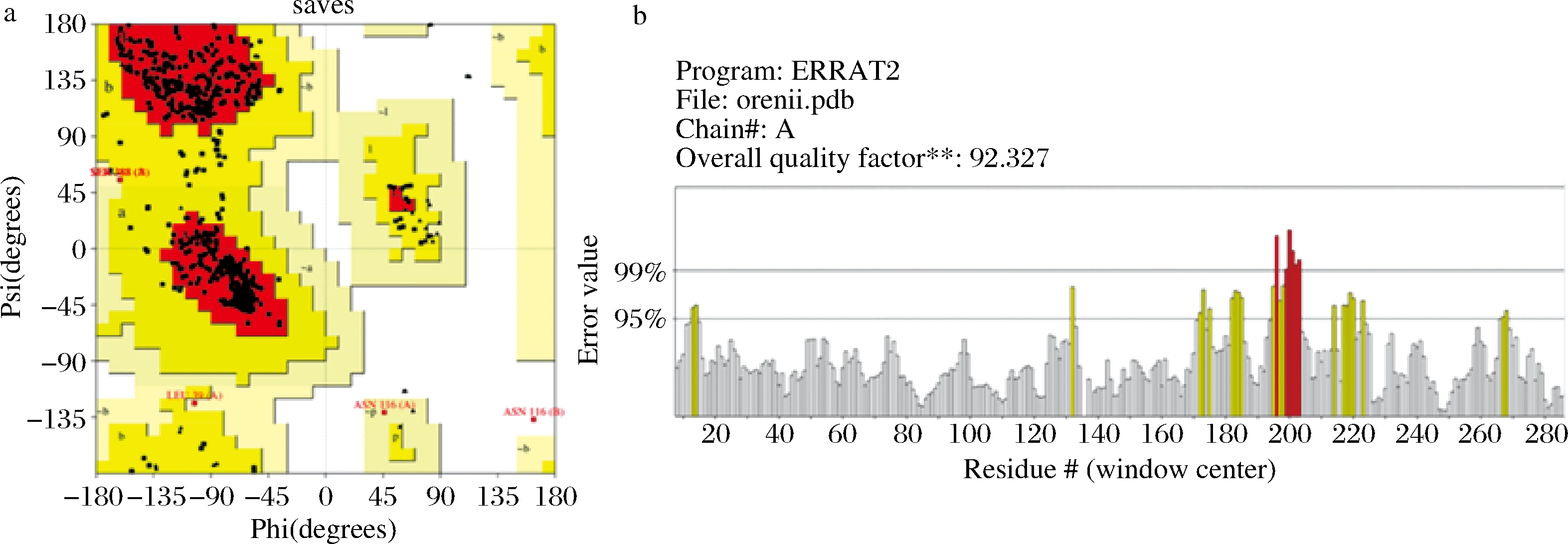
a-拉氏构象图;b-Errat评价
图1 H-ADI的拉氏构象图和Errat评价结果
Fig.1 Ramachandran plot and Errat result of H-ADI modeling structure
HotSpot Wizard服务器能将输入的序列与资源库序列进行比对,由于酶在进化过程中也趋向于在同一位点保持相同的氨基酸,所以位于柔性区域或者最常出现在特定位置的非保守氨基酸可能会影响整个蛋白质的稳定性[20]。将获得的三维结构上传到HotSpot Wizard在线服务器,识别与结构灵活性、序列一致性或共进化相关的氨基酸残基进行热稳定性突变热点的预测;此外,将预测突变位点结合三维结构过滤可能的有害位点。
以重组质粒pET-28a(+)-H-ADI为模板,进行定点突变。将测序成功的突变体转化至E.coli BL21(DE3),经诱导表达和分离纯化后,所有突变体酶均成功表达,在相同上样量情况下条带粗细无明显差异,表明突变体的表达量基本一致;此外,条带单一且与野生型一致,亚基大小在47 kDa。
2.2 突变体酶活力和变性温度
测定突变酶的蛋白浓度后,添加与野生酶相同酶量进行酶活力测定;此外,将各个H-ADI的浓度稀释到相同浓度进行差示扫描量热分析(differential scanning calorimetry,DSC)测定进而确定其变性温度,结果如表2所示。突变体E81D、F111L、N142L、T215Y以及Q255M相较野生型来说,酶活力都有小幅度提高,但是Tm值较野生酶分别下降了1.27、1.27、0.63、0.2、3.55 ℃;G65N、V187T和A231L的酶活力和变性温度都没有提高,只有T180Y和A190P的Tm值分别提高了2.5、1.96 ℃,其有序叠加组合突变体T180Y/A190P的Tm值提高了5.26 ℃,但三者的酶活力分别下降为野生酶的91.36%、80.53%和78.41%。
表2 H-ADI及其突变体的相对酶活和Tm值
Table 2 The relative activities and Tm values of H-ADI and mutations
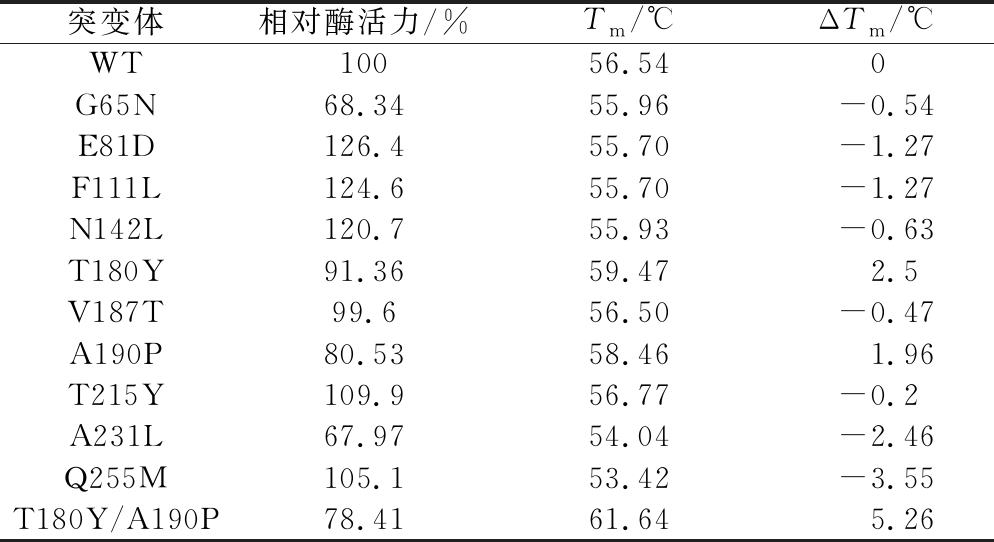
突变体相对酶活力/%Tm/℃ΔTm/℃WT10056.540G65N68.3455.96-0.54E81D126.455.70-1.27F111L124.655.70-1.27N142L120.755.93-0.63T180Y91.3659.472.5V187T99.656.50-0.47A190P80.5358.461.96T215Y109.956.77-0.2A231L67.9754.04-2.46Q255M105.153.42-3.55T180Y/A190P78.4161.645.26
2.3 正向突变体的热稳定性
对Tm值提高的2个单点及其组合突变进行最适温度以及温度稳定性的测定,结果见图2,单点突变体T180Y和A190P的最适温度相比野生型没有提高,而双点组合突变体T180Y/A190P最适温度提高了5 ℃,说明两点叠加的效果存在加和效应。此外,在50 ℃条件下对这3个正向突变体的温度稳定性进行测定,相比于野生型在50 ℃保温180 min后只有原始酶活力的25%,突变体在50 ℃保温180 min后的残余酶活力均有不同的提高,T180Y、A190P分别能保持55%、48%的相对酶活力,而双点组合突变体能保持66.8%的酶活力,说明定点突变提升了H-ADI的热稳定性。
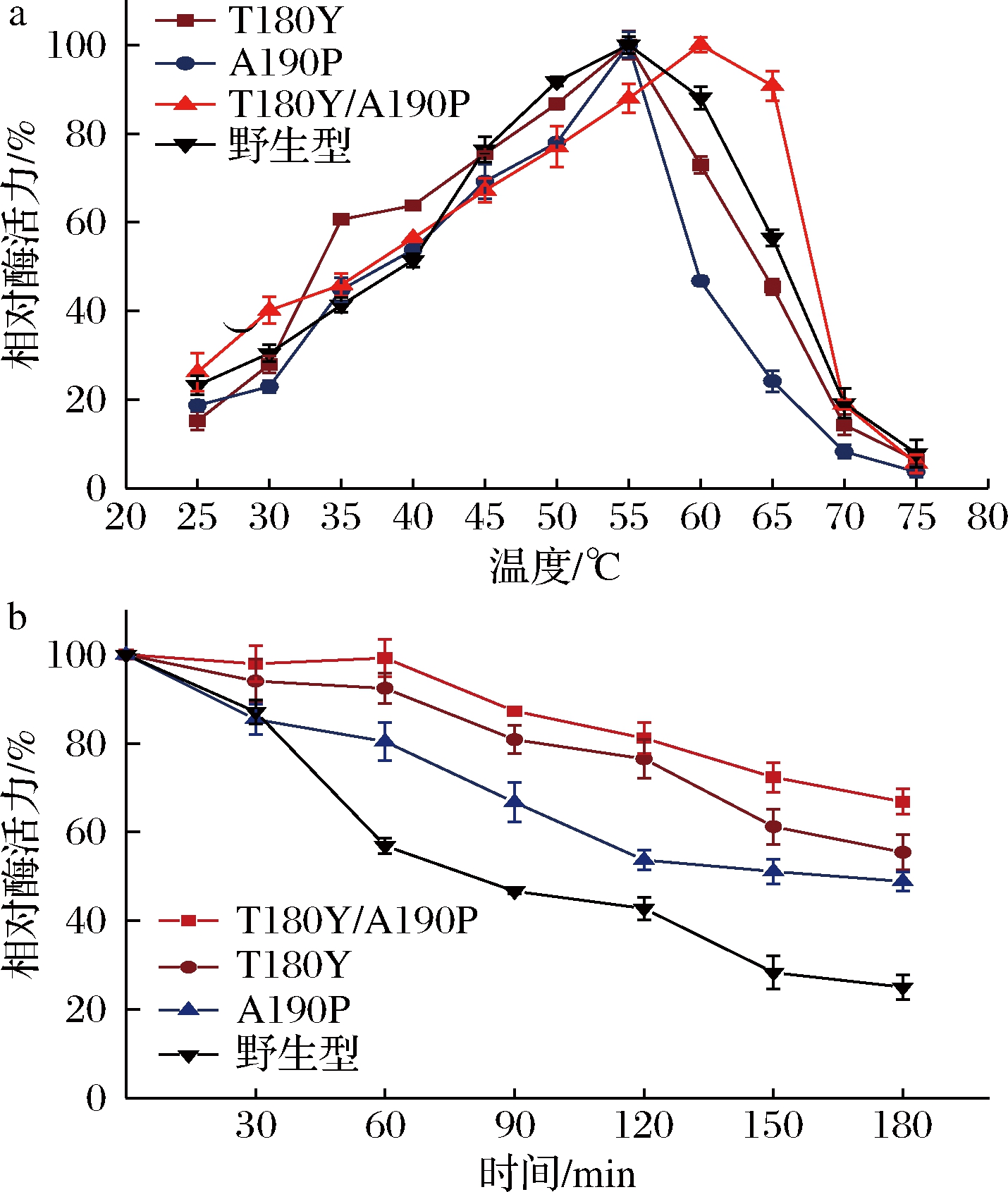
a-最适温度;b-温度稳定性
图2 正向突变体的最适温度和温度稳定性
Fig.2 The optimum temperature and thermostability of positive mutations
2.4 精氨酸脱亚胺酶的分子动力学模拟
RMSF指的是原子在模拟体系中在平衡时间点偏离平均位置的幅度,代表原子自由运动的程度进而表征某个蛋白区域的柔性,RMSF数值越大代表该位置的氨基酸柔性越大,该区域的稳定性越差[22]。借助同源建模获得复合突变体T180Y/A190P的三维模拟结构;将野生型H-ADI和突变体T180Y/A190P在328 K以15 ns的速率展开分子动力学模拟,整个轨迹的RMSF如图3所示。野生型和突变型的大部分氨基酸RMSF值都小于0.4,但位于125~150位氨基酸的RMSF值都达到了0.8,说明该部分的氨基酸柔性较其他区域较大,而该区域正好是H-ADI三维结构中的五螺旋束结构域。不同来源的ADI在该螺旋束结构域的序列和长度有很大变化,但该部分基本是由芳香族和疏水侧链构成的疏水核心,其作用还不清晰[23]。此外,野生型的RMSF值整体高于或接近于突变体,但也出现了突变体RMSF值高于野生型的区域和位点,而180位点和190位点刚好位于该区域;因此,表明这2个位点的突变导致蛋白在该区域的柔性降低、刚性增强从而使其具有更高的热稳定性。

图3 野生型H-ADI和突变体的RMSF分析
Fig.3 RMSF analysis of wide-type H-ADI and mutation
2.5 突变位点分析
有研究为了探索影响蛋白热稳定性的因素,对大量同源的嗜热和中温蛋白的氨基酸类型进行数据统计,发现Arg、Glu和Tyr由于其结构特征在嗜热蛋白表面出现的频率较高[24]。此外,大多数蛋白质含有许多小的空腔,这些空腔可以由更大的残基来填充进而增强蛋白质的稳定性[25]。对H-ADI而言,180位点位于其结构表面(图4),实验结果表明由Thr变化为Tyr增强了其的稳定性,从该位点的三维表面结构可以看出,Tyr的侧链基团相较于Thr较大,填充了相邻的一个表面空穴,因而可能加强了H-ADI的稳定性。此外,芳香环作用也是蛋白质稳定性的重要驱动力,主要包括芳香环和阳离子(带正电的Lys、Arg和His)之间的作用(阳离子-π)或者芳香环之间的相互作用(π-π),芳香环和阳离子间的相互作用是一种强的非共价键合力[26],突变后的Tyr与空间位置与较近的Arg269可能存在阳离子-π的相互作用而提高了其热稳定性。但另一方面,180位点位于与底物进出相关的loop环上,突变为Tyr后较大的侧链集团以及与Arg269位点形成的非共价键合力降低了loop环的柔性进而降低了该酶的催化活力。
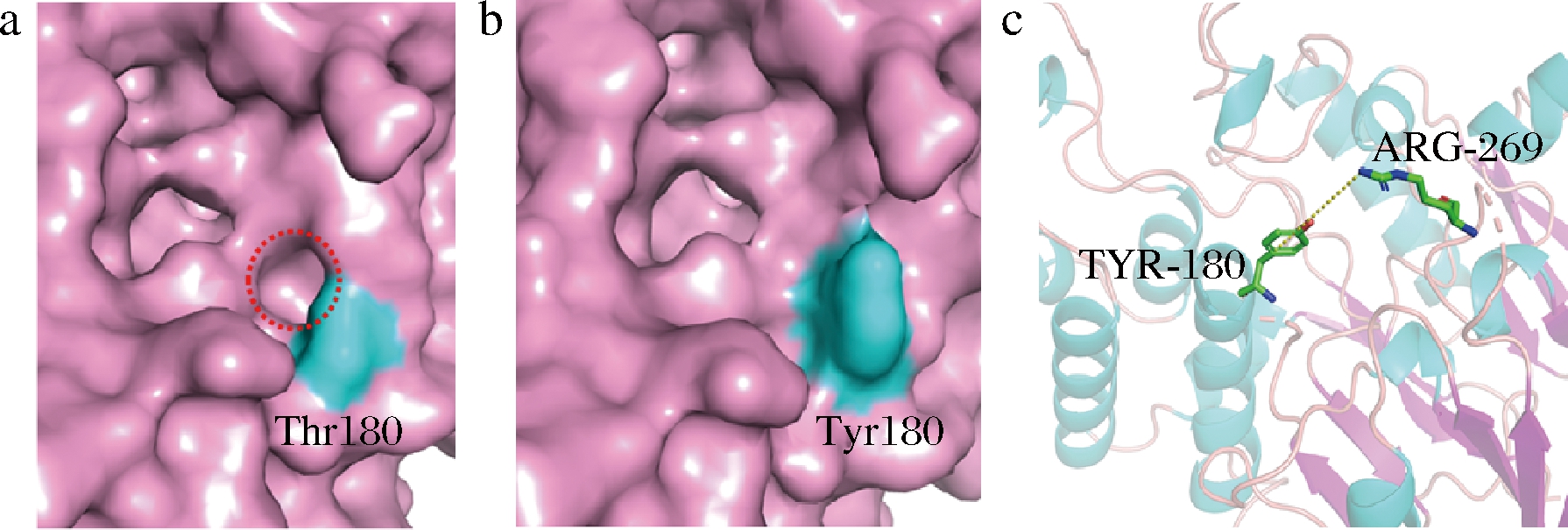
a-H-ADI 180位氨基酸突变前结构;b-H-ADI 180位氨基酸突变后结构;c-H-ADI 180位突变后氨基酸与相邻269位氨基酸的芳香环作用
图4 H-ADI突变体T180Y的结构分析
Fig.4 Structural analysis of H-ADI T180Y mutant
环状亚氨基酸是Pro特有的结构,其具有的吡咯环结构使其具有较好的刚性结构;根据结构和统计分析,在β转角的第2个位置和α-螺旋N1的Pro偏好位置进行Pro取代能增强酶的稳定性[27]。此外,还有研究表明因为Pro在氨基基团少1个H原子,且不能形成α螺旋所需的φ角,所以α螺旋中基本不出现Pro[28]。在H-ADI的190位点,Ala突变为Pro提高了该H-ADI热稳定性,值得注意的是该位点位于α螺旋的中间位置(图5-a)。在另一个研究中,来自penicillium verruculosum的内切葡聚糖酶的脯氨酸理性设计突变中,最稳定的突变体S308P在70 ℃下的半衰期相较野生酶提高了4倍,并且该位点也位于α螺旋的中间结构[29]。借助DynaMut服务器[30]评估该突变位点对H-ADI的稳定性影响,结构表明从Ala突变为Pro后,增加了与相邻氨基酸残基之间的疏水相互作用和极性相互作用(图5-b);此外,该突变体的折叠自由能(ΔΔG)为5.19 kJ/mol,证明该突变有利于增强H-ADI的稳定性。
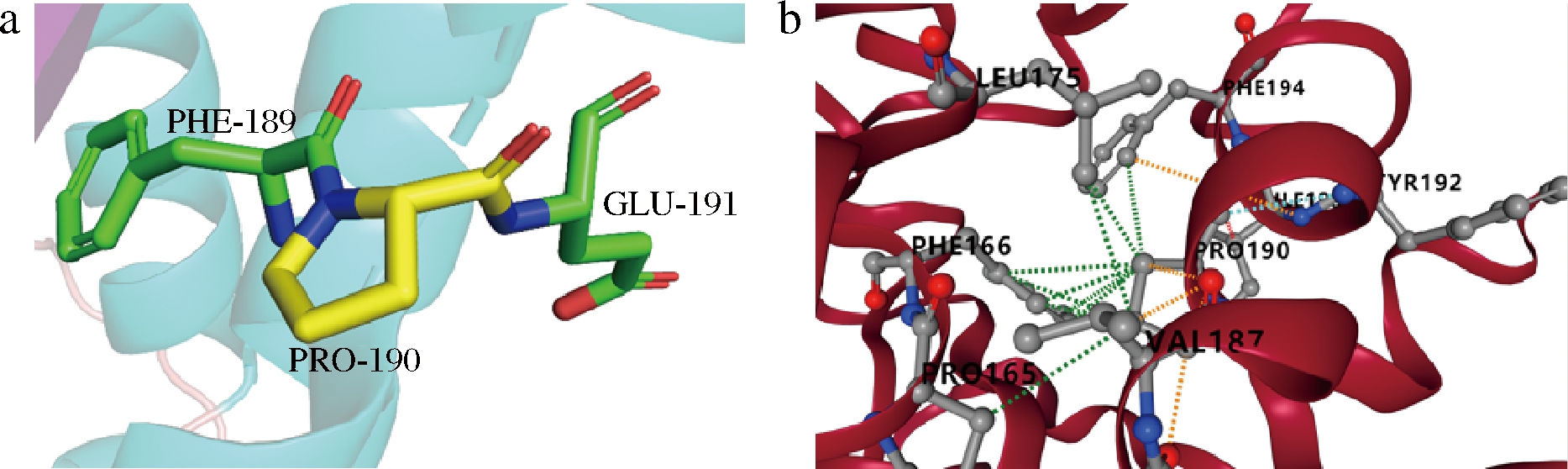
a-H-ADI 190位氨基酸突变后的结构分析;b-与相邻氨基酸的相互作用
图5 H-ADI突变体A190P的结构分析
Fig.5 Structural analysis of H-ADI A190P mutant
2.6 瓜氨酸的生产
诱导后的湿菌体按照5 g/L加入100 g/L的精氨酸反应体系中,55 ℃下进行转化生产,结果如图6所示。

图6 野生型和突变型生产瓜氨酸
Fig.6 The production of citrulline between wide-type and mutants
突变体和野生型均在转化开始的2 h内快速生成产物瓜氨酸,随着反应时间的延长,转化过程趋于平缓。单点突变体T180Y与野生型的瓜氨酸转化过程相似,但T180Y的产量比野生型高了2 g/L,而A190P突变体的转化速率和产物生成量均低于野生型,可能是因为A190P的比酶活力只有野生型的80.53%,而变性温度只提高了1.96 ℃,在实际生产过程中影响不大。通过有序叠加获得的双点突变体T180Y/A190P在前1 h的转化速率比野生型高12.5%,并且瓜氨酸最终产量也比野生型高5 g/L。SONG等[14]将来源于L.lactis的ADI异源表达于大肠杆菌工程菌,通过易错PCR得到了酶活提高的突变体FMME106,在50 ℃的条件下进行转化生产,FMME106相较于野生型提高了14.2%的产量,且最初的反应速率也提高了21.4%;另一方面,FMME106在8 h转化后瓜氨酸产量达到了45 g/L,而H-ADI以及突变体在55 ℃进行8 h转化后,瓜氨酸的产量达到了50~60 g/L。总的来说,在工业生产过程中,由于酶会处于一定的温度进行长时间的生产,所以较好的热稳定性能保持较高的酶活力持续进行转化,使得产物的产量提高;因此,热稳定性改造对于工业酶具有重要意义。
3 结论
通过理性设计获得了来源于奥氏嗜热盐丝菌的3个热稳定性提高的突变体T180Y、A190P和T180Y/A190P,其酶活力为野生型的91.36%、80.53%和78.41%,变性温度(Tm)较野生酶分别提高了2.5、1.96、5.26 ℃,T180Y和A190P的最适温度与野生酶相同,而T180Y/A190P的最适温度提高了5 ℃。在50 ℃下保温180 min后,T180Y、A190P和T180Y/A190P残余酶活力分别提高了30%、23%和41.8%。三维结构分析表明表面空穴填充和芳香环作用是T180Y热稳定性增强的可能原因,而A190P则可能是由于脯氨酸的吡咯环刚性结构以及空间相邻残基之间的疏水作用增强了其热稳定性。将获得的突变体应用于瓜氨酸生产,T180Y/A190P的瓜氨酸产量和生产速率均优于野生型。该研究为其他微生物来源的工业酶以及酶的理性改造提供了思路和参考。
[1] HARTMAN J, WEHNER T, MA G Y, et al.Citrulline and arginine content of taxa of Cucurbitaceae[J].Horticulturae, 2019, 5(1):22-33.
[2] CURIS E, NICOLIS I, MOINARD C, et al.Almost all about citrulline in mammals[J].Amino Acids, 2005, 29(3):177-205.
[3] HAN R Z, XU G C, DONG J J, et al.Arginine deiminase:Recent advances in discovery, crystal structure, and protein engineering for improved properties as an anti-tumor drug[J].Applied Microbiology and Biotechnology, 2016, 100(11):4 747-4 760.
[4] LUIKING Y C, ENGELEN M P K J, DEUTZ N E P.Regulation of nitric oxide production in health and disease[J].Current Opinion in Clinical Nutrition and Metabolic Care, 2010, 13(1):97-104.
[5] VAN DE POLL M C, SOETERS P B, DEUTZ N E, et al.Renal metabolism of amino acids:Its role in interorgan amino acid exchange[J].The American Journal of Clinical Nutrition, 2004, 79(2):185-197.
[6] BREUILLARD C, CYNOBER L, MOINARD C.Citrulline and nitrogen homeostasis:An overview[J].Amino Acids, 2015, 47(4):685-691.
[7] MORITA M, HAYASHI T, OCHIAI M, et al.Oral supplementation with a combination of L-citrulline and L-arginine rapidly increases plasma L-arginine concentration and enhances NO bioavailability[J].Biochemical and Biophysical Research Communications, 2014, 454(1):53-57.
[8] SUZUKI T, MORITA M, HAYASHI T, et al.The effects on plasma L-arginine levels of combined oral L-citrulline and L-arginine supplementation in healthy males[J].Bioscience Biotechnology and Biochemistry, 2017, 81(2):372-375.
[9] KUDO M, YOSHITOMI H, MOMOO M, et al.Evaluation of the effects and mechanism of L-citrulline on anti-obesity by appetite suppression in obese/diabetic KK-Ay mice and high-fat diet fed SD rats[J].Biological & Pharmaceutical Bulletin, 2017, 40(4):524-530.
[10] MALINSKI T, PAWOUD H.Vitamin D3, L-arginine, L-citrulline, and antioxidant supplementation enhances nitric oxide bioavailability and reduces oxidative stress in the vascular endothelium-Clinical implications for cardiovascular system[J].Pharmacognosy Research, 2020, 12(1):17-23.
[11] SHIOTA A, HOTTA Y, KATAOKA T, et al.Oral L-citrulline supplementation improves erectile function in rats with acute arteriogenic erectile dysfunction[J].The Journal of Sexual Medicine, 2013, 10(10):2 423-2 429.
[12] ALLERTON T D, PROCTOR D N, STEPHENS J M, et al.L-citrulline supplementation:Impact on cardiometabolic health[J].Nutrients, 2018, 10(7):921.
[13] CAI X, JIANG H Y, ZHANG T, et al.Thermostability and specific-activity enhancement of an arginine deiminase from Enterococcus faecalis SK23.001 via semirational design for L-citrulline production[J].Journal of Agricultural and Food Chemistry, 2018, 66(33):8 841-8 850.
[14] SONG W, SUN X, CHEN X L, et al.Enzymatic production of L-citrulline by hydrolysis of the guanidinium group of L-arginine with recombinant arginine deiminase[J].Journal of Biotechnology, 2015, 208:37-43.
[15] KIM J E, JEONG D W, LEE H J.Expression, purification, and characterization of arginine deiminase from Lactococcus lactis ssp lactis ATCC 7962 in Escherichia coli BL21[J].Protein Expression and Purification, 2007, 53(1):9-15.
[16] HAKI G D,RAKSHIT S K.Developments in industrially important thermostable enzymes:A review[J].Bioresource Technology, 2003, 89(1):17-34.
[17] ZHANG Y, CHUNG S F, TAM S Y, et al.Arginine deprivation as a strategy for cancer therapy:An insight into drug design and drug combination[J].Cancer Letters, 2021, 502:58-70.
[18] HAN H W, LING Z M, KHAN A, et al.Improvements of thermophilic enzymes:From genetic modifications to applications[J].Bioresource Technology, 2019, 279:350-361.
[19] XIONG W, LIU B, SHEN Y J, et al.Protein engineering design from directed evolution to de novo synthesis[J].Biochemical Engineering Journal, 2021, 174:108096.
[20] BENDL J, STOURAC J, SEBESTOVA E, et al.HotSpot Wizard 2.0:Automated design of site-specific mutations and smart libraries in protein engineering[J].Nucleic Acids Research, 2016, 44(W1):W479-W487.
[21] JIANG H Y, HUANG K, MU W M, et al.Characterization of a recombinant arginine deiminase from Enterococcus faecalis SK32.001 for L-citrulline production[J].Process Biochemistry, 2018, 64:136-142.
[22] LIU J F, WEI B B, CHE C C, et al.Enhanced stability of manganese superoxide dismutase by amino acid replacement designed via molecular dynamics simulation[J].International Journal of Biological Macromolecules, 2019, 128:297-303.
[23] DAS K, BUTLER G H, KWIATKOWSKI V, et al.Crystal structures of arginine deiminase with covalent reaction intermediates:Implications for catalytic mechanism[J].Structure, 2004, 12(4):657-667.
[24] YOKOTA K, SATOU K J, OHKI S Y.Comparative analysis of protein thermostability:Differences in amino acid content and substitution at the surfaces and in the core regions of thermophilic and mesophilic proteins[J].Science and Technology of Advanced Materials, 2006, 7(3):255-262.
[25] BUENO M, CREMADES N, NEIRA J L, et al.Filling small, empty protein cavities:Structural and energetic consequences[J].Journal of Molecular Biology, 2006, 358(3):701-712.
[26] WU H, CHEN Q M, ZHANG W L, et al.Overview of strategies for developing high thermostability industrial enzymes:Discovery, mechanism, modification and challenges[J].Critical Reviews in Food Science and Nutrition, 2021.https://doi.org/10.1080/10408398.2021.1970508.
[27] XU Z, CEN Y K, ZOU S P, et al.Recent advances in the improvement of enzyme thermostability by structure modification[J].Critical Reviews in Biotechnology, 2020, 40(1):83-98.
[28] KUBYSHKIN V, DAVIS R, BUDISA N.Biochemistry of fluoroprolines:The prospect of making fluorine a bioelement[J].Beilstein Journal of Organic Chemistry, 2021, 17:439-460.
[29] DOTSENKO A S, PRAMANIK S, GUSAKOV A V, et al.Critical effect of proline on thermostability of endoglucanase Ⅱ from Penicillium verruculosum[J].Biochemical Engineering Journal, 2019, 152:107395.
[30] RODRIGUES C H M, PIRES D E V, ASCHER D B.DynaMut2:Assessing changes in stability and flexibility upon single and multiple point missense mutations[J].Protein Science, 2021, 30(1):60-69.