海湾扇贝(Argopecten irradians),又称大西洋海湾扇贝,属于软体动物门,含有丰富的蛋白质、活性多糖、长链多不饱和脂肪酸等营养成分,是我国重要的海洋贝类资源之一[1]。据报道,扇贝多糖具有抗肿瘤[2]、提高免疫力[3]、抗氧化[4]等活性,已经成为重要的功能食品资源。扇贝的加工方式很多,有干贝柱、冷冻贝柱、即食贝柱等,虽然加工产品不同,但在扇贝加工的第一步通常都要煮制处理。现阶段,在扇贝的加工过程中,对煮制条件的控制不是很严格,关于煮制条件对扇贝营养成分的影响也鲜有报道。
营养是评价水产品品质的重要指标,水产品加工过程中的糖类组分在物理、化学和生物等因素作用下,会发生分子结构、化学组成以及功能特性的变化,进而影响其在人体内的消化吸收特性。多糖和蛋白质热加工能够发生美拉德反应[5-6],多糖中金属离子的含量和种类也会影响多糖的结构和活性[7-8]。因此,研究不同煮制加工条件对扇贝柱多糖结构和消化吸收的影响,可以为高品质高营养的扇贝加工提供理论依据。
1 材料与方法
1.1 材料与试剂
海湾扇贝柱,玉洋集团有限公司;碱性蛋白酶、胃蛋白酶,天津诺奥酶生产力促进有限公司;胰酶(食品级)、Dextran Blue 2000、Dextran T-10、Dextran T-70、Dextran T-500、DMEM,北京索莱宝科技有限公司;L-鼠李糖、L-岩藻糖、D-氨基葡萄糖、D-葡萄糖、D-半乳糖、D-葡萄糖醛酸、D-甘露糖、D-阿拉伯糖、D-半乳糖醛酸、氨基半乳糖,美国Sigma公司;KBr粉末(光谱纯),天津市大茂化学试剂厂;碱性磷酸酶(alkaline phosphatase,ALP)测定试剂盒,南京建成生物科技有限公司。
1.2 仪器与设备
354-00771酶标仪,LabSystems公司;GL-21M恒温离心机,湖南湘仪公司;傅里叶变换红外光谱仪,北京瑞利分析仪器公司;L-2000液相,日本日立公司;TU-1080紫外-可见光分光光度计,上海奥析科学仪器有限公司;Agilent高效液相色谱仪;电阻仪,北京金工鸿泰科技有限公司;精密pH计,上海市精密科学仪器有限责任公司。
1.3 实验方法
1.3.1 扇贝多糖的提取
将扇贝柱加2倍体积的水和贝柱质量0%、1.5%、3%和4.5%的NaCl,煮制6 min,捞出晾凉后,按贝柱肉与水1∶3(g∶mL)的比例进行匀浆,加入碱性蛋白酶酶解(pH 9.5、2%加酶量、55 ℃酶解4 h),等电点沉蛋白(pH 5.0),离心,取上清液加入3倍体积的乙醇,醇沉24 h。取沉淀,采用胃蛋白酶二次酶解(pH 2.0、2%加酶量、37 ℃酶解4 h),醇沉,冻干,得到4种扇贝多糖CSPA(0% NaCl)、CSPB(1.5% NaCl)、CSPC(3% NaCl)和CSPD(4.5% NaCl)。
1.3.2 扇贝多糖的纯度测定
采用苯酚-浓硫酸法测定扇贝多糖的总糖含量。多糖纯度计算如公式(1)所示:
多糖纯度![]()
(1)
式中:M0,样品溶液中葡萄糖质量,mg;N,样品溶液稀释倍数;M,干燥的扇贝多糖的质量,mg。
1.3.3 红外光谱测定
将扇贝柱多糖样品在105 ℃烘箱里烘干至恒重后取2 mg,然后取烘干的KBr粉末200 mg,混合研磨均匀后压成透明薄片,在傅里叶变换红外光谱仪上扫描4 000~400 cm-1红外光谱吸收值,然后对多糖的结构进行分析。
1.3.4 刚果红实验
根据JIA等[9]的方法并稍作改动。准确称取2.0 mg干燥的扇贝多糖样品,用1.0 mL去离子水溶解后加入100 μmol/L刚果红试剂。然后依次加入0、0.05、0.1、0.15、0.2、0.3、0.4 mol/L NaOH溶液,用紫外扫描仪扫描400~600 nm下的紫外吸收。
1.3.5 单糖组成分析
参考范三红等[10]的方法并稍作改进。通过PMP柱前衍生化单糖,经高效液相色谱分离检测。取样品2 mg加入1 mL 2 mol/L 三氟乙酸(trifluoroacetic acid,TFA)加入经110 ℃水解8 h后,取400 μL样品加入450 μL 0.3 mol/L NaOH和450 μL 0.5 mol/L NaOH PMP衍生剂,充分振荡,70 ℃衍生30 min,冷却至室温后加入450 μL 0.3 mol/L HCl 中和,加入1 mL氯仿,充分振荡,弃去有机相,重复萃取3次,过0.22 μm膜,置于样品瓶,待进样。
色谱条件:色谱柱为La Chorm C18,流动相A为15%(体积分数)乙腈+0.05 mol/L磷酸缓冲液,流动相B为40%(体积分数)乙腈+0.05 mol/L磷酸缓冲液,时间梯度:0~15~60 min;浓度梯度:A相90%~70%~70%,B相10%~30%~30%;流速0.9 mL/min;进样体积:20 μL;检测波长:250 nm;检测温度:25 ℃。
1.3.6 分子质量的测定
参考何晋浙等[11]的方法。取标准葡聚糖(分子质量为2 000、500、70、10 kDa)和多糖样品分别配成2%的溶液,过0.22 μm膜后进样检测。
色谱条件:色谱柱为TSKgel-G500PWXL,蒸发光检测器,柱温为常温,流动相为超纯水,流速0.5 mL/min。以色谱峰的保留时间tR为横坐标,以lg MW为纵坐标绘制标准曲线。
1.3.7 扫描电镜
参照吴丽萍等[12]的方法并略做改进。取适量多糖样品,镀上导电金粉后将其放置于S-3400 N扫描电镜下观察。工作条件:加速电压15 kV,观测倍数选用5 000倍。
1.3.8 扇贝多糖的模拟消化
参考闵芳芳等[13]的方法并稍作改进。
模拟胃液消化过程:取模拟胃液和扇贝多糖溶液混匀,于150 r/min,37 ℃的摇床中进行消化,在1 h、4 h分别取出1组,调pH 7.0,4 800×g离心10 min,取上清液得到样液进行实验。模拟肠液:取模拟胃液中消化6 h的多糖离心管,调pH 7.0,加6 mL体外模拟肠消化液,充分混匀后在150 r/min,37 ℃的摇床中消化,然后分别在2、5 h取出一组进行实验。取模拟消化后的样液进行还原糖和分子质量的测定。
胃电解质溶液:3.10 g氯化钠,1.10 g氯化钾,0.15 g氯化钙,0.60 g碳酸氢钠溶于1.00 L去离子水中。
体外模拟胃液:135.00 mg 胃蛋白酶加入180.00 mL胃电解质溶液中,将其混合均匀,再用1.00 mol/L HCl调pH 2.0。
肠电解质溶液:5.40 g氯化钠,0.65 g氯化钾,0.33 g氯化钙溶于1.00 L去离子水中。
7 g/100mL胰酶:7.00 g胰酶溶于100.00 mL水,4 800×g离心10 min,取上清液待用。
体外模拟肠液:取90.00 mL胰酶溶液(7 g/100mL)加入90.00 mL肠电解质溶液,混合均匀,再用1.00 mol/L碳酸氢钠调pH 7.0。
1.3.9 Caco-2 细胞单层细胞实验
将冻存的细胞复苏在培养瓶中,放入37 ℃、5% CO2恒温培养箱中培养并传代。参考DENG等[14]的MTT方法通过二甲基亚砜能够溶解被活细胞线粒体中的琥珀酸脱氢酶还原的水不溶性的蓝色结晶,可以间接反映活细胞的数量,从而反映扇贝多糖对Caco-2细胞的增殖作用。将细胞接种于Transwell小室内侧,外侧加入完全培养液,放培养箱中培养21 d。根据每天对Transwell小室中各个孔的形态学观察、电阻的测量以及第1、5、10、15、20天每个孔的AP侧和BL侧的碱性磷酸酶测定来判定Caco-2 细胞造模的完整性。最后通过细胞跨膜转运实验[15]的表观渗透系数判断Caco-2 细胞对扇贝多糖的吸收情况。
2 结果与分析
2.1 四种扇贝多糖的纯度和提取率
由表1可知,不同NaCl添加量煮制扇贝所提取多糖的纯度是先增加后减小,CSPC(3% NaCl)组分的纯度最大,可能随着盐浓度升高,更多的盐溶性蛋白溶解到蒸煮液中,扇贝中的蛋白质含量降低,从而提取的多糖纯度较高。当盐浓度过高时(4.5% NaCl),与盐溶性蛋白结合在一起的糖蛋白也溶解到蒸煮液中,致使贝柱中的多糖含量下降,提取到的多糖纯度降低。因此,扇贝煮制加工时,加2倍水,NaCl添加量为鲜贝柱质量3%时,所提取的扇贝多糖纯度最高。
表1 不同NaCl添加量煮制扇贝多糖的纯度(煮制时间6 min)
Table 1 The purity of polysaccharides extracted from scallops cooked with differente NaCl dosage (cooking time 6 min)
注:相同字母表示各组分之间差异不显著(P>0.05)
组别CSPA(0% NaCl)CSPB(1.5% NaCl)CSPC(3% NaCl)CSPD(4.5% NaCl) 纯度/%47.50±0.91a52.77±2.39a55.50±2.01a48.22±1.77a
2.2 红外光谱图分析
4种扇贝多糖的红外光谱图比较相似,峰形和峰位差异不大。由图1可见,在3 300~3 400 cm-1出现一个较强的吸收谱带,是由O—H产生的伸缩振动峰;在2 900~3 000 cm-1出现一个较为明显的峰,该峰为C—H伸缩振动峰;在1 650~1 700 cm-1出现一个C![]() O的伸缩振动峰,在1 300~1 500 cm-1出现较小的C—H弯曲振动峰;1 000~1 200 cm-1出现C—O—C(糖环)的伸缩振动峰;847 cm-1左右处存在α-构型糖苷键的特征吸收峰,说明扇贝多糖为α-构型具有吡喃糖环的多糖[16]。
O的伸缩振动峰,在1 300~1 500 cm-1出现较小的C—H弯曲振动峰;1 000~1 200 cm-1出现C—O—C(糖环)的伸缩振动峰;847 cm-1左右处存在α-构型糖苷键的特征吸收峰,说明扇贝多糖为α-构型具有吡喃糖环的多糖[16]。
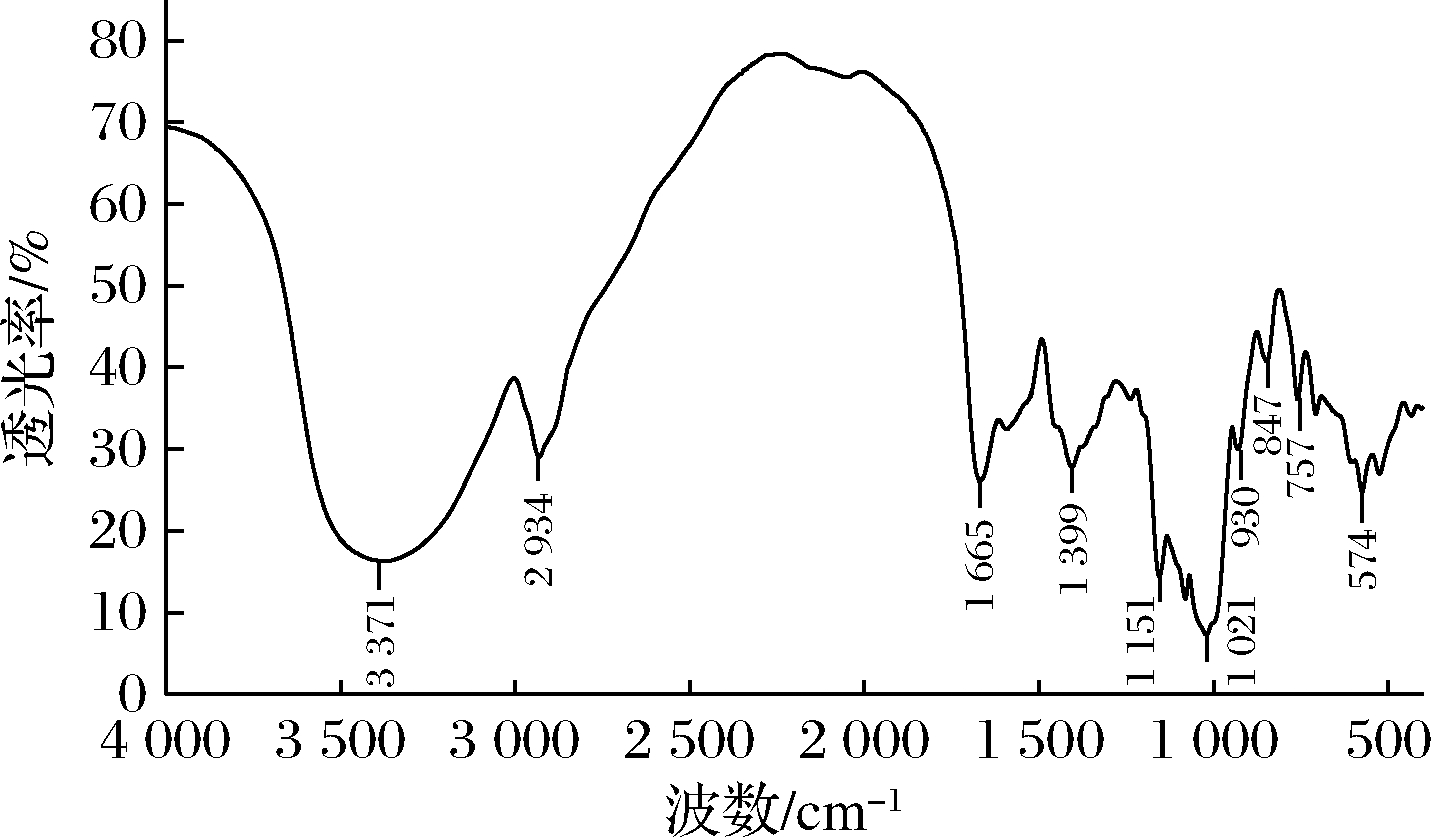
图1 CSPC(3% NaCl)扇贝多糖红外光谱图
Fig.1 Infrared spectra of scallop polysaccharides CSPC (3% NaCl)
2.3 刚果红实验分析
刚果红与具有三螺旋结构的多糖形成稳定的络合物,在弱碱性溶液中络合物的最大吸收波长增大,而在强碱性溶液中络合物的最大吸收波长减小[17]。通过NaOH浓度变化时溶液最大吸收波长的变化,可以判断多糖样品是否具有3股螺旋结构[18]。
在不同NaOH浓度时,刚果红试剂的最大吸收波长以及刚果红试剂与扇贝多糖作用后的最大吸收波长变化情况如图2所示。由图2可知,随着NaOH浓度由低到高增加,扇贝多糖与刚果红试剂作用后,它们的最大吸收波长发生了特征性变化。由此表明4种扇贝多糖均具有3股螺旋结构。

图2 不同NaCl添加量煮制扇贝多糖在不同碱性环境下的最大吸收波长
Fig.2 maximum absorption wavelengths of polysaccharides extracted from scallops cooked with different NaCl dosage under different alkaline environments
2.4 单糖组成分析
由表2可知,扇贝多糖均可检测出:甘露糖、氨基葡萄糖、氨基半乳糖、葡萄糖和阿拉伯糖。除CSPC(3% NaCl)以外,其余扇贝多糖均可检测出:鼠李糖、葡萄糖醛酸、半乳糖和岩藻糖。CSPC(3% NaCl)扇贝多糖的纯度最高,单糖组成中葡萄糖的占比也最高,这与曹倩倩[19]的研究结果比较一致,高纯度的扇贝柱多糖(91.91%)是以糖原形式存在,单糖组成中只检测到葡萄糖,而扇贝内脏多糖的单糖组成比较丰富。另外3种多糖,可能由于多糖纯度略低,因此单糖组成的种类更加丰富。
表2 不同NaCl添加量煮制扇贝多糖中各单糖所占比例
Table 2 Proportion of monosaccharides in polysaccharides extracted from scallops cooked with different NaCl dosage
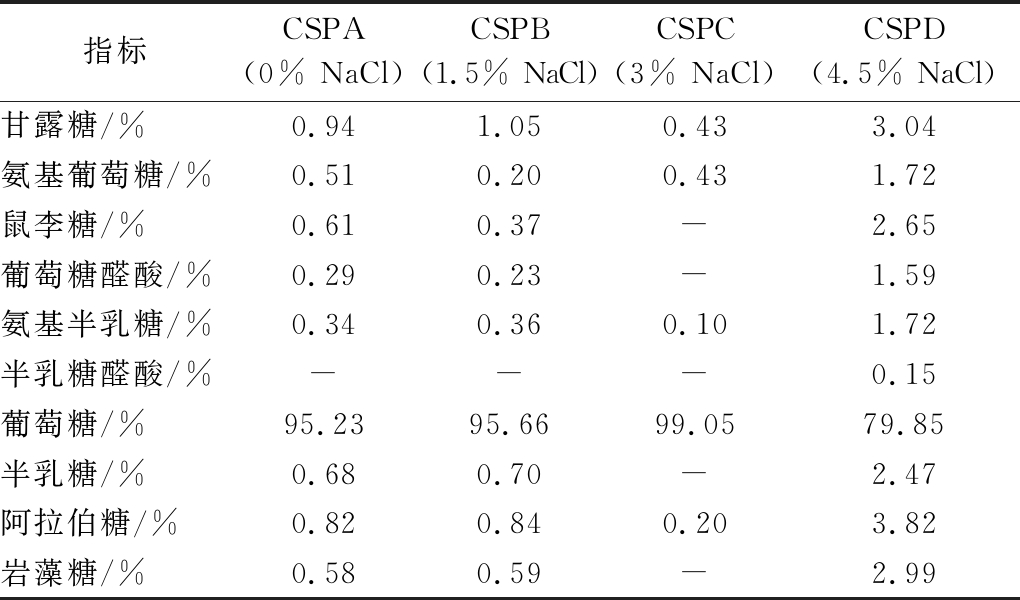
注:-表示不含有(下同)
指标CSPA(0% NaCl)CSPB(1.5% NaCl)CSPC(3% NaCl)CSPD(4.5% NaCl)甘露糖/%0.941.050.433.04氨基葡萄糖/%0.510.200.431.72鼠李糖/%0.610.37-2.65葡萄糖醛酸/%0.290.23-1.59氨基半乳糖/%0.340.360.101.72半乳糖醛酸/%---0.15葡萄糖/%95.2395.6699.0579.85半乳糖/%0.680.70-2.47阿拉伯糖/%0.820.840.203.82岩藻糖/%0.580.59-2.99
2.5 分子质量分析
不同NaCl添加量的4种扇贝多糖均只显示一个大峰,出峰时间基本一致,以纯度较高的CSPC(3% NaCl)图谱为例,保留时间在8.148 min,代入标准曲线(y=-0.229 8x+8.544 3)可得分子质量在2 000 kDa以上。
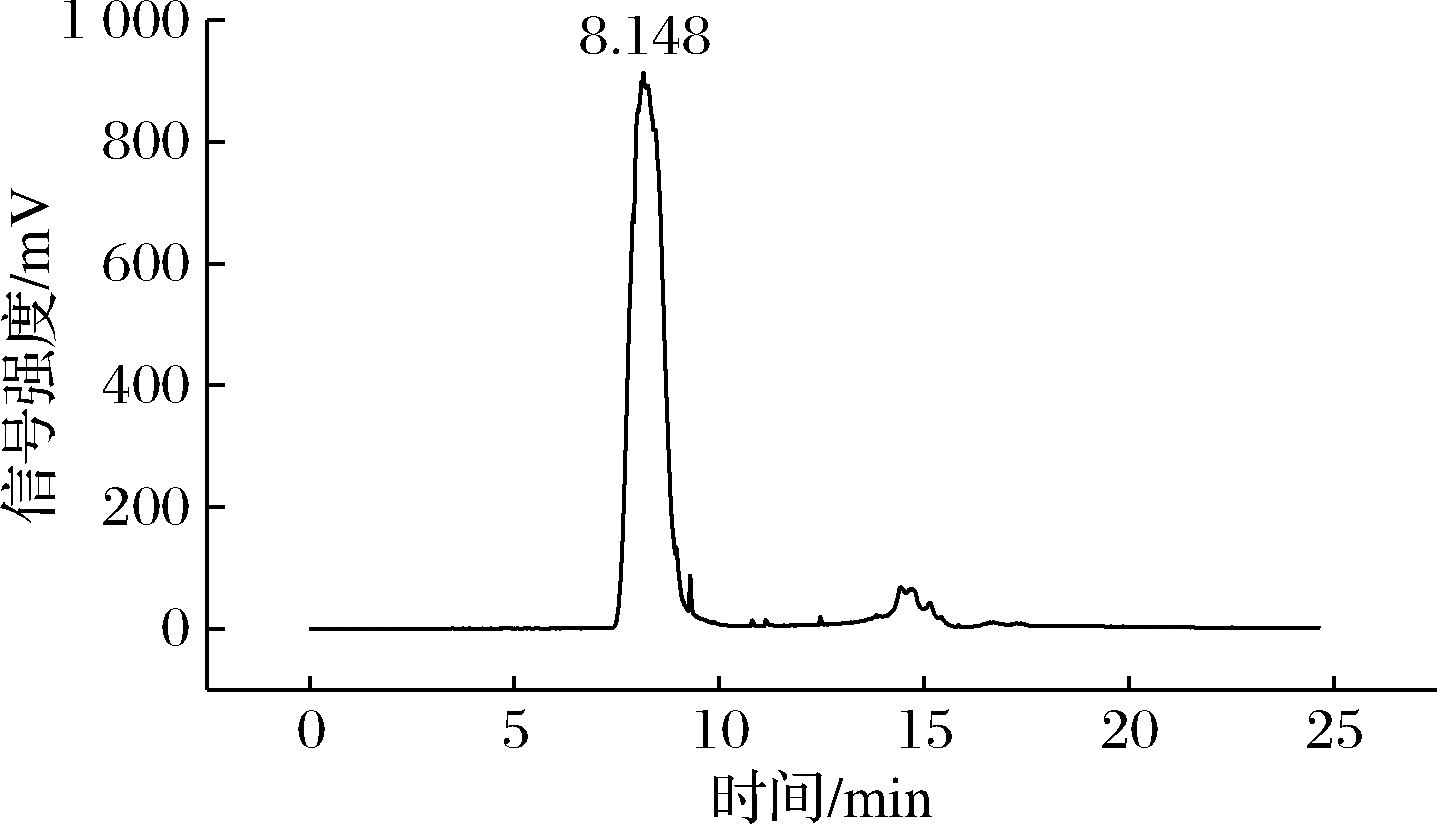
图3 CSPC(3% NaCl)扇贝多糖分子质量
Fig.3 CSPC (3% NaCl, cooking time 6 min) molecular weight of scallop polysaccharide
2.6 电镜分析
图4为不同NaCl添加量扇贝多糖放大5 000倍的扫描式电子显微镜(scanning electron microscope,SEM)图片。多糖CSPC(3% NaCl)的表面为粗糙的片层空洞结构,粗糙的表面会使比表面积的增加,有助于提高多糖在水中的溶解性[20],CSPA(0% NaCl)、CSPB(1.5% NaCl)和CSPD(4.5% NaCl)的扇贝多糖呈块状,表面相对光滑。多糖显微组织和表面的差异,与它们的物理性质有一定相关性,可能是由于样品纯度差异造成的[21]。

a-CSPA(0% NaCl);b-CSPB(1.5% NaCl);c-CSPC(3% NaCl);d-CSPD(4.5% NaCl)
图4 不同NaCl,添加量煮制扇贝所提取多糖的扫描电镜图
Fig.4 SEM images of polysaccharides extracted from scallops cooked with different amounts of NaCl
2.7 扇贝多糖的体外模拟消化分析
由表3可知,随着消化时间的不断延长,不同NaCl添加量的扇贝多糖样品在模拟胃液和模拟肠液中的还原糖含量变化不大,没有显著差异(P>0.05)。
表3 不同NaCl添加量扇贝所提取多糖在体外模拟消化后还原糖含量分析
Table 3 Analysis of reducing sugar content of polysaccharides extracted from scallops cooked with different NaCl dosage after simulated digestion in vitro
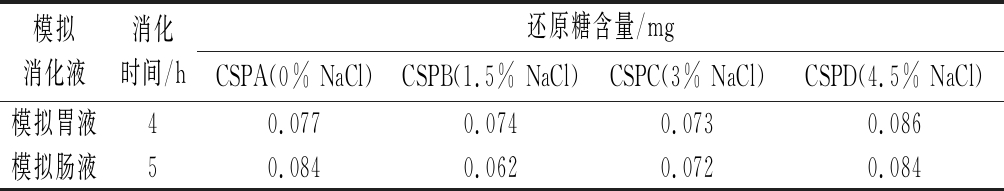
模拟消化液消化时间/h还原糖含量/mgCSPA(0% NaCl)CSPB(1.5% NaCl)CSPC(3% NaCl)CSPD(4.5% NaCl)模拟胃液40.0770.0740.0730.086模拟肠液50.0840.0620.0720.084
由表4可知,扇贝多糖CSPA(0% NaCl)、CSPB(1.5% NaCl)、CSPC(3% NaCl)经模拟胃液消化后都出现3个峰,分子质量都小于2 000 kDa,说明4种扇贝多糖经过胃肠液消化后,都能被部分降解,但降解程度不同。扇贝多糖CSPC(3% NaCl)消化产物中的小分子质量多糖占比最大,消化效果最好,而扇贝多糖CSPD(4.5% NaCl)经模拟胃液消化后,90%以上的多糖分子质量都在1 600 kDa,消化效果最差。HU等[22]研究发现多糖糖苷键的断键一定会增加多糖还原糖的含量。4种多糖经过模拟消化后,还原糖的含量增加并不多,说明多糖分子质量的降低主要是由于多糖聚合物的解聚和聚合物分子链的共价键断裂[23],结合电镜的分析结果,CSPC(3% NaCl)的比表面积更大,有利于消化液的作用,所以消化效果最好。本研究模拟消化液中的胰酶含有胰淀粉酶,其酶切位点为葡聚糖的α1,4-糖苷键,CSPD(4.5% NaCl)中葡萄糖的占比最小,胰淀粉酶的酶切位点较少,所以消化效果不好。
表4 不同NaCl添加量所提取多糖在体外模拟胃液消化后的分子质量分析
Table 4 molecular weight analysis of polysaccharides extracted from scallops cooked with different amounts of salt after simulated gastric juice digestion in vitro

多糖样品峰1分子质量/Da峰1面积占比/%峰2分子质量/Da峰2面积占比/%峰3分子质量/Da峰3面积占比/%CSPA(0% NaCl)1.580×10672.405.491×10415.201.982×10412.40CSPB(1.5% NaCl)1.611×10668.804.558×10412.501.594×10418.70CSPC(3% NaCl)1.751×10653.602.684×10418.901.177×10427.50CSPD(4.5% NaCl)1.686×10691.30----
2.8 扇贝多糖的体内吸收分析
2.8.1 扇贝多糖对Caco-2细胞活力的影响
图5为扇贝多糖CSPC(3% NaCl)质量浓度分别为2、4、6、8、10 mg/mL时对Caco-2细胞活力的影响。由图5可知在培养过程中加入不同浓度的扇贝多糖溶液与空白对照组(只加培养基)相比,对Caco-2细胞的生长几乎没有影响(P>0.05),由此可见,扇贝多糖对Caco-2细胞没有毒性。
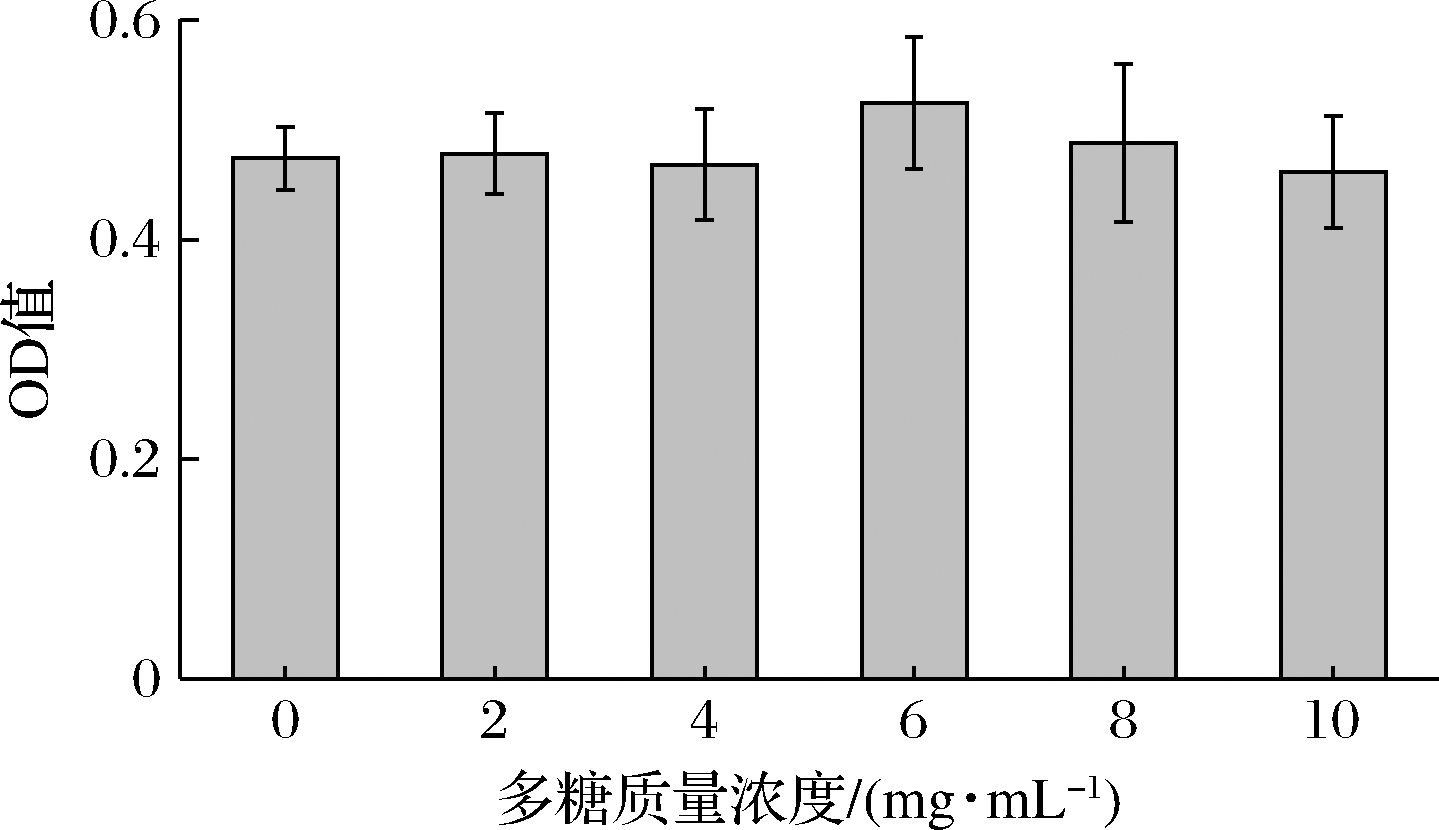
图5 扇贝多糖CSPC(3% NaCl)对Caco-2细胞活力的影响
Fig.5 Effect of scallop polysaccharide CSPC (3% NaCl) on the viability of Caco-2 cells
2.8.2 Caco-2 细胞单层完整性检验结果
本实验采用了细胞的形态学观察(光学显微镜)、细胞跨膜电阻(transepithelial electrical resistance,TEER)测量值以及碱性磷酸酶测量3种方法对Caco-2细胞的完整性以及紧密性进行检测。
2.8.2.1 Caco-2 细胞的形态学观察
Caco-2细胞接种于Transwell小室上层的聚碳脂膜上后,胞开始沉降贴壁,由球形变为梭形,展开并开始不断地与周围细胞进行融合,生长成片。当Caco-2细胞在Transwell小室中培养4~5 d时,细胞边缘清晰,细胞间可清楚的看见连接边缘。培养15~21 d时,细胞间已经完全融合,形成了致密的单层细胞膜。Caco-2细胞刚接种于Transwell小室未贴壁时、培养第1、5、10、15、20天的显微镜下状态如图6所示。

a-刚接种到Transwell小室时;b-培养1 d时;c-培养5 d时;d-培养10 d时;e-培养15 d时;f-培养20 d时
图6 Caco-2细胞在Transwell小室中的生长状态
Fig.6 The growth status of Caco-2 cells in Transwell
2.8.2.2 Caco-2细胞的TEER值结果
确定Caco-2细胞的单层致密完整性可通过测定细胞的TEER值。当电阻值大于200 Ω/cm2时可以说明此时细胞已经处于单层致密完整[24]。
由图7可知,随着培养时间的延长,Caco-2细胞在Transwell小室中的跨膜电阻值不断增加,在20 d时达到290 Ω/cm2,说明细胞已经形成了致密的单层细胞膜。
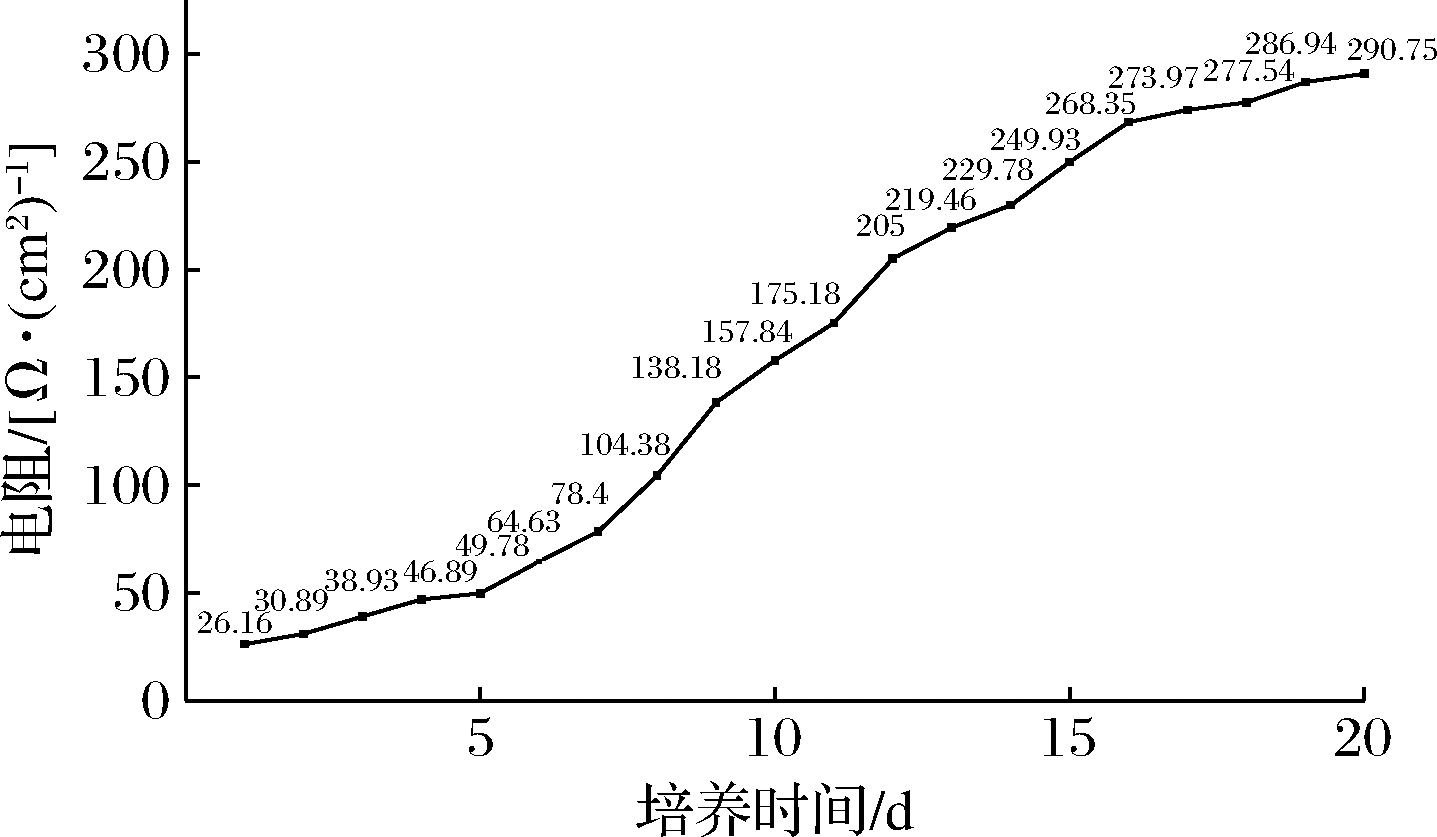
图7 Caco-2细胞21 d的TEER值变化
Fig.7 The TEER value of Caco-2 cells changed at 21 days
2.8.2.3 Caco-2细胞的碱性磷酸酶活性
由表5可知,随着Caco-2细胞在Transwell小室中培养时间的延长,肠腔侧(AP侧)与基底侧(BL侧)的碱性磷酸酶的活力比值也逐渐增加。到第20天时比值为6.78,与第1天的比值1.05相比增加了6倍左右。说明随着细胞的生长,肠腔侧(AP侧)和基底侧(BL侧)的碱性磷酸酶分布不均匀,出现明显的极化现象,可以进行后续的转运实验。
表5 Caco-2细胞肠腔侧与基底侧碱性磷酸酶的活力比值
Table 5 Alkaline phosphatase activity ratio of intestinal cavity side and basal side of Caco-2 cells

培养时间/d碱性磷酸酶活力比值11.0551.20102.76154.64206.78
2.8.3 扇贝多糖的跨膜转运实验结果
在通常情况下,当表观渗透系数的值大于1×10-4时说明药物可以被完全吸收,当表观渗透系数的值小于1×10-7时说明药物不能被吸收[25]。
由表6可知,扇贝多糖CSPC(3% NaCl)从AP侧到BL侧的表观渗透系数为6.24×10-5;BL侧到AP侧的表观渗透系数为5.03×10-5。结果表明,扇贝多糖能被部分吸收,且吸收作用大于外排作用。
表6 扇贝多糖CSPC(3% NaCl)的表观渗透系数
Table 6 Apparent permeability coefficient of polysaccharide extracted from scallop cooked with 3% NaCl

组别CSPC(3% NaCl)AP侧→BL侧6.24×10-5BL侧→AP侧5.03×10-5
3 结论
适当的煮制条件下(添加3%NaCl、煮制6 min),扇贝多糖的纯度最高,为55.50%。不同NaCl添加量的扇贝多糖结构比较相似,但单糖组成有明显差异,CSPC(3% NaCl)中主要成分是葡萄糖(99.05%),其余扇贝多糖也是葡萄糖为主(79.85%~95.66%),但可检测出鼠李糖、葡萄糖醛酸、半乳糖和岩藻糖。在体外模拟胃肠消化实验中,CSPC(3% NaCl)的消化效果最好。Caco-2细胞模拟小肠吸收实验显示,扇贝多糖能被部分吸收,且吸收作用大于外排作用。
[1] CHI C, ZHANG C Y, LIU J D, et al.Effects of marine toxin domoic acid on innate immune responses in bay scallop Argopecten irradians[J].Journal of Marine Science and Engineering, 2019, 7(11):407.
[2] 李雪梅, 李丽梅, 陈辉, 等.海湾扇贝多糖的纯化、分离及抗肿瘤活性研究[J].中国食品学报, 2016, 16(7):121-127.
LI X M, LI L M, CHEN H, et al.Purification, separation and antitumor activity evaluation of polysaccharides from bay scallop[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(7):121-127.
[3] 苏运聪. 扇贝多糖提取方式及活性的研究[D].石家庄:河北科技大学, 2014.
SU Y C.Study on the scallops polysaccharide extraction methods and activity[D].Shijiazhuang:Hebei University of science and technology, 2014.
[4] 冯丁丁, 李楠, 高雨, 等.虾夷扇贝裙边多糖提取物细胞抗氧化活性的研究[J].食品科技, 2017, 42(4):188-193.
FENG D D, LI N, GAO Y, et al.Cellular antioxidant activity of polysaccharide from the skirt of Patinopecten yessoensis[J].Food Science and Technology, 2017, 42(4):188-193.
[5] 依胜男, 芦晶, 逄晓阳, 等.热处理对牛乳美拉德反应程度及挥发性成分的影响[J].食品科学, 2021, 42(14):9-15.
YI S N, LU J, PANG X Y, et al.Effect of heat treatment on Maillard reaction degree and volatile components of milk[J].Food Science, 2021, 42(14):9-15.
[6] 裴继伟, 丁连坤, 李丽, 等.牡蛎酶解液-葡萄糖美拉德反应前后体系的溶解特性及氨基酸组成分析[J].食品与发酵工业, 2019, 45(20):93-99.
PEI J W, DING L K, LI L, et al.Solubility and amino acids composition of enzymatic oyster hydrolysate after Maillard reaction[J].Food and Fermentation Industries, 2019, 45(20):93-99.
[7] 钱怡霖, 汪东风, 范明昊, 等.多糖中金属离子对其抗氧化活性及抗肿瘤活性的影响[J].中国食品学报, 2020, 20(2):52-60.
QIAN Y L, WANG D F, FAN M H, et al.Effects of metal ions in polysaccharides on their antioxidant activity and antitumor activity[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(2):52-60.
[8] 郭意明. 鲍鱼性腺多糖的结构及其与金属离子相互作用的研究[D].大连:大连工业大学, 2018.
GUO Y M.Study on structure of abalone gonad (Haliotis discus Hannai ino) polysaccharide and its interactions with metal ions[D].Dalian:Dalian Polytechnic University, 2008.
[9] JIA R B, LI Z R, WU J, et al.Physicochemical properties of polysaccharide fractions from Sargassum fusiforme and their hypoglycemic and hypolipidemic activities in type 2 diabetic rats[J].International Journal of Biological Macromolecules, 2020, 147:428-438.
[10] 范三红, 贾槐旺, 张锦华, 等.羊肚菌多糖纯化、结构分析及抗氧化活性[J].食品与发酵工业, 2020, 46(3):65-71.
FAN S H, JIA H W, ZHANG J H, et al.Purification, structural analysis and antioxidant activity of polysaccharides from Morchella esculenta[J].Food and Fermentation Industries, 2020, 46(3):65-71.
[11] 何晋浙, 蔡如繁, 孙培龙.南极海茸多糖结构及其单糖组分的分析[J].食品与发酵工业, 2014, 40(3):196-200.
HE J Z, CAI R F, SUN P L.The analysis of polysaccharide structure and monosaccharide constituents from the Durvillaea antarctica[J].Food and Fermentation Industries, 2014, 40(3):196-200.
[12] 吴丽萍, 董康珍, 楚文靖, 等.微波改性对燕麦麸膳食纤维结构及功能性质的影响[J].中国食品学报, 2021, 21(9):30-37.
WU L P, DONG K Z, CHU W J, et al.Effects of microwave modification on the structure and functional properties of oat bran dietary fiber[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(9):30-37.
[13] 闵芳芳, 聂少平, 万宇俊, 等.青钱柳多糖在体外消化模型中的消化与吸收[J].食品科学, 2013, 34(21):24-29.
MIN F F, NIE S P, WAN Y J, et al.In vitro digestion and absorption of polysaccharide from Cyclocarya paliurus leaves[J].Food Science, 2013, 34(21):24-29.
[14] DENG C, SHANG J, FU H, et al.Mechanism of the immunostimulatory activity by a polysaccharide from Dictyophora indusiata[J].International Journal of Biological Macromolecules, 2016, 91:752-759.
[15] CHEN L, LU X G, LIANG X, et al.Mechanistic studies of the transport of peimine in the Caco-2 cell model[J].Acta Pharmaceutica Sinica.B, 2016, 6(2):125-131.
[16] 顾欣, 高涛, 刘梦雅, 等.梁平柚柚皮多糖的提取、结构解析及抗氧化能力研究[J].食品与发酵工业, 2021, 47(7):137-145.
GU X, GAO T, LIU M Y, et al.Optimization of extraction technology, structure analysis and antioxidant activity of polysaccharides from Liangping pomelo peel[J].Food and Fermentation Industries, 2021, 47(7):137-145.
[17] DOU Z M, CHEN C, FU X.The effect of ultrasound irradiation on the physicochemical properties and α-glucosidase inhibitory effect of blackberry fruit polysaccharide[J].Food Hydrocolloids, 2019, 96:568-576.
[18] GUO X, KANG J, XU Z, et al.Triple-helix polysaccharides:Formation mechanisms and analytical methods[J].Carbohydrate Polymers, 2021, 262:117962.
[19] 曹倩倩. 扇贝糖原硫酸酯的制备及生物活性研究[D].大连:大连工业大学, 2011.
CAO Q Q.Sulfate modification and bioactivity of scallop muscle glycogen[D].Dalian:Dalian Polytechnic University, 2011.
[20] XU Y, CUI Y, WANG X, et al.Purification, characterization and bioactivity of exopolysaccharides produced by Lactobacillus plantarum KX041[J].International Journal of Biological Macromolecules, 2019, 128:480-492.
[21] KANAMARLAPUDI S L R K, MUDDADA S.Characterization of exopolysaccharide produced by Streptococcus thermophilus CC30[J].BioMed Research International, 2017, 2017:4201809.
[22] HU J L, NIE S P, MIN F F, et al.Artificial simulated saliva, gastric and intestinal digestion of polysaccharide from the seeds of the Plantago asiatica L.[J].Carbohydrate Polymers, 2013, 92(2):1 143-1 150
[23] CHEN J, LIANG R H, LIU W, et al.Degradation of high-methoxyl pectin by dynamic high pressure microfluidization and its mechanism[J].Food Hydrocolloids, 2012, 28(1):121-129.
[24] XIANG Q F, ZHANG W J, LI Q, et al.Investigation of the uptake and transport of polysaccharide from Se-enriched Grifola frondosa in Caco-2 cells model[J].International Journal of Biological Macromolecules, 2020, 158:1 330-1 341.
[25] 刘建平. 生物药剂学与药代动力学[M].人民卫生出版社, 2012.
LIU J P.Biopharmaceutics and Pharmacokinetics[M].People′s Health Publishing House, 2012.