海藻是重要的海洋食物资源,主要分为红藻、褐藻、绿藻和蓝藻四大类,其中红藻和褐藻是常见的药食两用植物,药理研究表明,红藻具有解暑、治疗咳嗽、高血压、支气管炎等功效,褐藻有抗糖尿病和预防心血管疾病等作用[1-3]。坛紫菜(Porphyra haitanensis)是一种高蛋白、高纤维、低热值和低脂肪的红藻,具有抗氧化、抗癌、预防贫血病、胃溃疡、甲状腺肿等作用[4-5]。海带(Laminaria japonica)和裙带菜(Undaria pinnatifida)是常见的褐藻,常被加工成美食,且海带和裙带菜在调节免疫、抗氧化、抗肿瘤、降血脂、降血糖等方面有显著的效果[6-8]。但目前在坛紫菜、海带和裙带菜的研究以多糖、果胶和维生素为主,关于酚类的研究较少。
酚类化合物是植物中主要的活性次级代谢产物,根据存在形式又分为游离酚和结合酚。游离酚易溶于水或极性溶剂,主要存在于细胞的液泡之中,常规浸提的酚以游离酚为主,结合酚常常通过共价键和离子键与纤维素、蛋白、木质素等大分子紧密结合,需通过酸法、碱法或酶法破坏连接键才能释放[9]。目前已知的结合酚主要为酚酸类,其次为黄酮类化合物,在蔬菜、谷物和豆类中均含有丰富的结合酚,如红藜麦中结合酚的总酚和总黄酮含量达4.72 mg/g[以没食子酸当量(gallic acid equivalent,GAE)计]和1.72 mg/g[以芦丁当量当量(rutin equivalent,RE)]计,为对应游离酚的2.75和1.35倍[10];绿豆皮中结合酚含量也达到37.64 mg/g[以阿魏酸当量(ferulic acid equivalents,FAE)计][11]。前期研究报道,裙带菜、马尾藻等7种藻类的游离和结合酚在胃肠道消化被进一步释放,且结合酚的总酚含量和抗氧化能力总体上高于游离酚[12]。同时,ONS等[13]发现波西多尼亚海草藻叶中结合酚的总酚和总黄酮含量达407.00 mg GAE/g 和94.40 mg/g[以槲皮素当量(quercetin equivalent,QE)计],是对应游离酚的1.24和2.11倍,且结合酚具有更好的抗氧化活性。
我们前期比较了海带、石花菜、裙带菜和坛子菜中结合酚的含量和抗氧化活性,发现海带、坛子菜和裙带菜结合酚具有较好的抗氧化活性。因此,本研究分别采用溶剂萃取法和碱法提取海带、坛子菜和裙带菜中的游离酚和结合酚,然后采用紫外分光光度法比较提取物中的总酚和总黄酮含量;采用Fe3+还原能力实验、DPPH自由基和ABTS阳离子自由基清除能力实验评价其抗氧化活性;通过α-葡萄糖苷酶、酪氨酸酶和乙酰胆碱酯酶活性抑制能力实验评价其在预防和缓解糖尿病、色素沉着和神经疾病方面的应用潜力,旨在为海带、坛子菜和裙带菜的高值化利用提供理论基础。
1 材料与方法
1.1 材料与试剂
海带、坛紫菜和裙带菜产自威海市,无水乙醇、浓盐酸、乙酸乙酯、福林酚等,天津市大茂化学试剂厂。DPPH自由基、ABTS阳离子自由基、槲皮素、没食子酸、维生素C、曲酸、4-硝基苯基-β-D-葡萄糖酸(4-nitrophenyl β-D-glucopyranoside,pNPG),上海源叶生物科技有限公司;左旋多巴、加兰他敏,北京索莱宝科技有限公司;α-葡萄糖苷酶、酪氨酸酶、乙酰胆碱酯酶、二硫代二硝基苯甲酸[5,5′-dithio bis-(2-nitrobenzoic acid),DTNB]、碘代硫化胆碱、阿卡波糖,Sigma试剂有限公司。
1.2 仪器与设备
RV10型旋蒸仪,德国艾卡仪器设备有限公司;Synergy H1型酶标仪,美国Bio Tek公司;MINI-7G-190917014型离心机,上海迈皋科学仪器有限公司。
1.3 实验方法
1.3.1 样品制备
海藻游离酚的提取:将海带、坛紫菜和裙带菜粉碎,各取50 g用1 000 mL 70%(体积分数)乙醇溶液浸提24 h,过滤取上清液,重复提取3次,合并上清液。浓缩干后用少量水溶解,然后加入到预先活化的AB-8大孔吸附树脂柱子中静态吸附12 h,先用蒸馏水洗脱除去未吸附的糖、蛋白和盐等,再用80%(体积分数)乙醇洗脱,收集滤液,浓缩干后得到游离酚提取物。
海藻结合酚的提取:将提取游离酚后的海藻残渣加入到三角瓶中,倒入3倍体积的4 mol/L NaOH溶液,无氧条件下避光反应3 h后,迅速用12 mol/L的盐酸调节pH为2.0,并用乙酸乙酯萃取,重复萃取3次,浓缩冻干即为结合酚提取物[14]。
1.3.2 总酚含量的测定
采用Folin- Ciocalteu法测定海藻样品的总酚含量[15]。取50 μL样品或没食子酸溶液、200 μL 70%乙醇与1.0 mL 10% Folin-Ciocalteu试剂混匀,反应5 min后加入750 μL 20%(质量分数)的Na2CO3溶液室温避光反应30 min,最后于765 nm处测吸光值,以70%乙醇代替样液为空白对照,蒸馏水代替Na2CO3溶液为样品空白。重复3次,以没食子酸浓度为横坐标,以吸光度为纵坐标,绘制标准曲线(Y=0.004 2X-0.004 1,R2=0.996 8),结果以每克干物质中GAE的含量(mg GAE/g)表示。
1.3.3 总黄酮含量的测定
参照赵国玲等[16]的方法测定海藻样品中的总黄酮含量。取100 μL样品与100 μL 2%(质量分数)AlCl3·6H2O溶液于96孔酶标板中反应15 min,然后测其在430 nm处的吸光值,用70%乙醇溶液代替AlCl3·6H2O的反应体系为空白对照,以槲皮素为标准品绘制标准曲线(Y=0.020 2X-0.001 8,R2=0.999 9),结果以每克干物质中QE的含量(mg QE/g)表示。
1.3.4 DPPH自由基清除能力测定
参照PEDRO等[17]的方法测定样品的DPPH自由基清除能力。取100 μL适宜浓度的海藻样品与100 μL 0.15 mmol/L DPPH自由基溶液室温避光反应30 min后,采用酶标仪测其在517 nm处的吸光值,100 μL蒸馏水与100 μL DPPH自由基溶液的反应体系为控制组,100 μL样品或蒸馏水和100 μL 乙醇的体系分别为样品空白组和空白组。以维生素C为阳性对照,实验重复3次,DPPH自由基清除率计算如公式(1)所示:
清除率![]()
(1)
式中:Ac为控制组吸光值,Ab为空白组吸光值,As为样品组吸光值,Aj为样品空白组吸光值,结果用IC50值表示。
1.3.5 ABTS阳离子自由基清除能力测定
参照陈洪彬等[18]的方法测定海藻样品的ABTS阳离子自由基清除能力。配制含有2.45 mmol/L过硫酸钾和7 nmol/L ABTS的ABTS阳离子自由基母液,使用前稀释为734 nm下的吸光值为0.70±0.20的工作液。取100 μL海藻样品与100 μL ABTS阳离子自由基工作液于酶标板上混匀,避光反应6 min后测其在734 nm下的吸光值,维生素C作为阳性对照,实验重复3次。ABTS阳离子自由基清除率计算参照公式(1),实验结果用IC50值表示。
1.3.6 铁离子还原能力测定
参照邢慧颖等[19]的方法测定海藻样品的铁离子还原能力。取0.3 mL适宜浓度的样品或阳性对照品维生素C(2 mg/mL)与0.3 mL 1%(质量分数)的铁氰化钾溶液混合,50 ℃反应20 min后加入0.3 mL 10%(质量分数)的三氯乙酸溶液,10 min后加入0.6 mL去离子水和0.12 mL 0.1%(质量分数)氯化铁,摇匀后取200 μL上清液于96孔酶标板中测其在700 nm处的吸光值,反应液中以0.12 mL蒸馏水代替0.1%的氯化铁做空白组,吸光值越大表明还原能力越强。
1.3.7 α-葡萄糖苷酶抑制活性测定
参照前期方法[15]测定样品的α-葡萄糖苷酶活性抑制能力。50 μL样品和50 μL(0.2 U/mL)α-葡萄糖苷酶反应10 min,加入50 μL pNPG 37 ℃下孵育30 min后加入100 μL Na2CO3溶液终止反应,并测其在405 nm处的吸光值。PBS替代样品为控制组(Ac)、PBS代替pNPG的反应体系为样品空白组(Aj)。以阿卡波糖为阳性对照,实验重复3次。抑制率参照公式(1)计算,结果以IC50表示。
1.3.8 酪氨酸酶抑制活性测定
参照JESUMANI等[20]的方法测定样品抑制酪氨酸酶的能力。50 μL样品和50 μL酪氨酸酶(100 U/mL)室温反应15 min,加入50 μL左旋多巴(2.5 mmol/L),室温反应10 min后于475 nm处测定吸光值。反应液中以PBS替代样品为控制组(Ac)、PBS代替左旋多巴为样品空白组(Aj)、PBS替代样品和酪氨酸酶为空白组(Ab)。曲酸作为阳性对照,实验重复3次,酪氨酸酶抑制率参照公式(1)计算,结果用IC50表示。
1.3.9 乙酰胆碱酯酶抑制活性测定
参照PEDRO等[17]的方法评价样品的乙酰胆碱酯酶抑制能力。取50 μL样品与125 μL 3 mmol/L DTNB(用0.1 mol/L pH 7.0 PBS配制)和25 μL 0.3 U/mL乙酰胆碱酯酶(20 mmol/L,pH 7.5 Tris-HCl溶液配制)混匀室温反应15 min,然后加入25 μL 5.0 mmol/L碘代硫化胆碱反应10 min,最后测定反应体系在412 nm处的吸光值。同时设置控制组(Ac)、空白组(Ab)和样品空白组(Aj),以加兰他敏为阳性对照,实验重复3次。乙酰胆碱酯酶抑制率参照公式(1),结果用IC50表示。
1.4 数据分析
采用SPSS 22.0软件中的单因素方差分析对数据进行统计分析,结果以平均值±标准差![]() 表示,所有图形采用Origin 2019软件绘制。
表示,所有图形采用Origin 2019软件绘制。
2 结果与分析
2.1 总酚含量
海带、坛紫菜和裙带藻干原料中游离酚和结合酚含量见表1。总体来说,3种海藻中的结合酚含量均高于游离酚,其中坛紫菜结合酚中的总酚含量最高,为863.53 μg GAE/g DW,其次为裙带菜和海带结合酚,含量分别为819.67、692.05 μg GAE/g DW。同时,坛紫菜也具有最高的游离酚含量,总酚含量为409.45 μg GAE/g DW,海带中的游离酚含量最低,为27.99 μg GAE/g DW。KANG等[21]报道表明海带中游离酚的含量为120 μg GAE/g DW,略高于本研究中游离酚含量,但显著低于结合酚含量。这可能是因为海藻的产地、采集季节和提取方式不同所致。不同海藻中总酚含量比较研究表明,海藻品种和提取方式是影响其总酚含量的重要因素[22]。
2.2 总黄酮含量
3种海藻游离酚和结合酚中的总黄酮含量如表1所示,不同样品间的总黄酮含量存在显著性差异(P<0.05),海带和坛紫菜结合酚中的总黄酮含量均高于游离酚,但裙带菜游离酚中的总黄酮含量高于结合酚。裙带菜游离酚的总黄酮含量最高,为49.31 μg QE/g DW,约为海带游离酚中的8倍(6.25 μg QE/g DW),其次为海带和裙带菜结合酚,含量分别为38.06、34.18 μg QE/g DW(P>0.05),但在坛紫菜游离多酚提取物中未检测出黄酮类化合物。
表1 海带、坛紫菜、裙带菜游离和结合酚提取物的总酚和总黄酮含量
Table 1 Contents of total phenolics and total flavonoids in the extracts of free and bound phenolics of L.japonica, P.haitanensis, and U.pinnatifida

注:同列右上角不同字母a~d表示数据间存在显著性差异(P<0.05);N.D.表示在最大测定浓度下未能检测到总黄酮
样品指标总酚含量/(μg GAE·g-1 DW)总黄酮含量/(μg QE·g-1 DW)海带结合酚692.05±26.70b38.06±1.34b游离酚27.99±1.23d6.25±1.47d坛紫菜结合酚863.53±0.47a16.95±0.69c游离酚409.45±5.0 bN.D.裙带菜结合酚819.67±2.67a34.18±2.94b游离酚124.24±0.65c49.31±1.06a
2.3 DPPH自由基清除能力
如图1所示,3种海藻的游离酚和结合酚提取物的DPPH自由基清除能力均随着样品浓度的增加而不断增强,呈现出显著的剂量效应。由表2可知,海带结合酚提取物的DPPH自由基清除能力最强,IC50值为401.19 μg/mL,裙带菜结合酚提取物次之;海带和裙带菜游离酚提取物的活性最弱(P>0.05)。3种海藻结合酚提取物的DPPH自由基清除能力均显著强于游离酚提取物,这与其总酚含量变化趋势是一样的,但所有样品的DPPH自由基清除能力均低于维生素C(表2)。海带游离酚提取物的DPPH自由基清除能力与汪群等[6]报道一致,IC50均大于2.0 mg/mL,但坛紫菜游离酚提取物的DPPH自由基清除能力低于赵国玲等[16]报道的结果。DPPH自由基与总酚含量相关性系数为0.896,表明多酚可能在其中起到主要的作用。
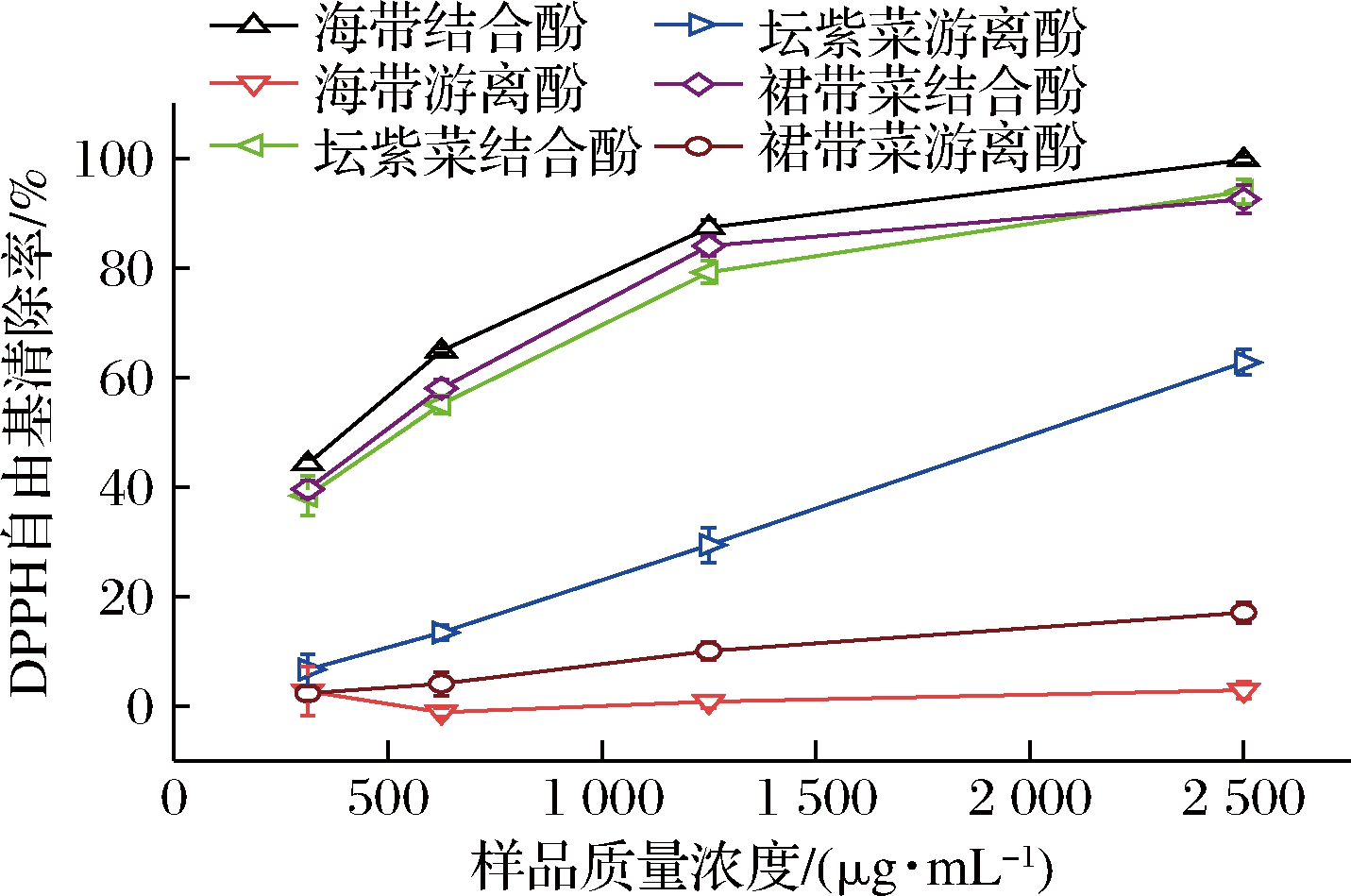
图1 海带、坛紫菜、裙带菜游离和结合酚提取物的DPPH自由基清除能力
Fig.1 DPPH radical scavenging capacity of free and bound phenolics extracts from L.japonica, P.haitanensis, and U.pinnatifida
表2 海带、坛紫菜、裙带菜游离和结合酚提取物抗氧化和酶抑制能力的半抑制浓度 单位:μg/mL
Table 2 Semi-inhibitory concentrations of free and bound phenolics extracts from L.japonica, P.haitanensis, and U.pinnatifida on antioxidant and enzyme inhibitory capacity
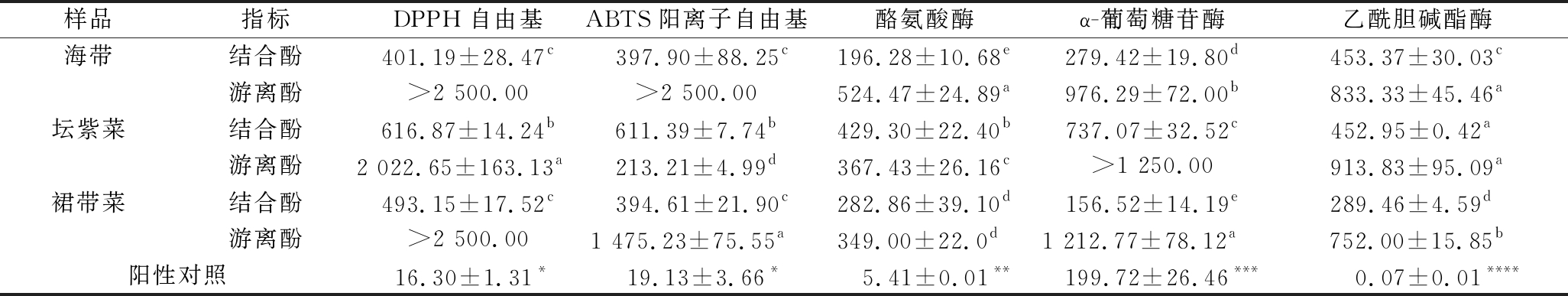
注:每列右上角的不同字母(a~e)表示数据间存在显著性差异(P<0.05);*表示阳性对照维生素C;**表示阳性对照曲酸;***表示阳性对照阿卡波糖;****表示阳性对照加兰他敏
样品指标DPPH自由基ABTS阳离子自由基酪氨酸酶α-葡萄糖苷酶乙酰胆碱酯酶海带结合酚401.19±28.47c 397.90±88.25c196.28±10.68e279.42±19.80d453.37±30.03c游离酚>2 500.00>2 500.00524.47±24.89a976.29±72.00b833.33±45.46a坛紫菜结合酚616.87±14.24b611.39±7.74b429.30±22.40b737.07±32.52c452.95±0.42a 游离酚2 022.65±163.13a 213.21±4.99d367.43±26.16c>1 250.00913.83±95.09a裙带菜结合酚493.15±17.52c 394.61±21.90c282.86±39.10d156.52±14.19e289.46±4.59d 游离酚>2 500.001 475.23±75.55a 349.00±22.0d 1 212.77±78.12a 752.00±15.85b阳性对照 16.30±1.31* 19.13±3.66* 5.41±0.01** 199.72±26.46*** 0.07±0.01****
2.4 ABTS阳离子自由基清除能力
如图2和表2所示,3种海藻酚提取物均能显著清除ABTS阳离子自由基,且不同海藻样品的活性与其浓度有明显的量效关系。坛紫菜游离酚提取物的ABTS阳离子自由基清除能力最强,是对应结合酚的2.86倍,可能含有较多的具有ABTS阳离子自由基清除能力的酚类化合物。陈洪彬等[18]也发现坛紫菜游离酚具有很强的ABTS阳离子自由基清除能力,IC50值达16.07 μg/mL,总酚含量为6.91 mg GAE/g。海带和裙带菜结合酚提取物的ABTS阳离子自由基的清除能力均显著高于对应的游离酚提取物,但海带和裙带菜结合酚提取物清除ABTS阳离子自由基的IC50值无显著性差异(P>0.05)。阳性对照维生素C对ABTS阳离子自由基清除能力远高于3种海藻提取物,其IC50达19.13 μg/mL。相关性分析表明,ABTS阳离子自由基清除能力与总酚含量呈正相关而与总黄酮含量呈负相关,相关系数分别为0.36和-0.438。
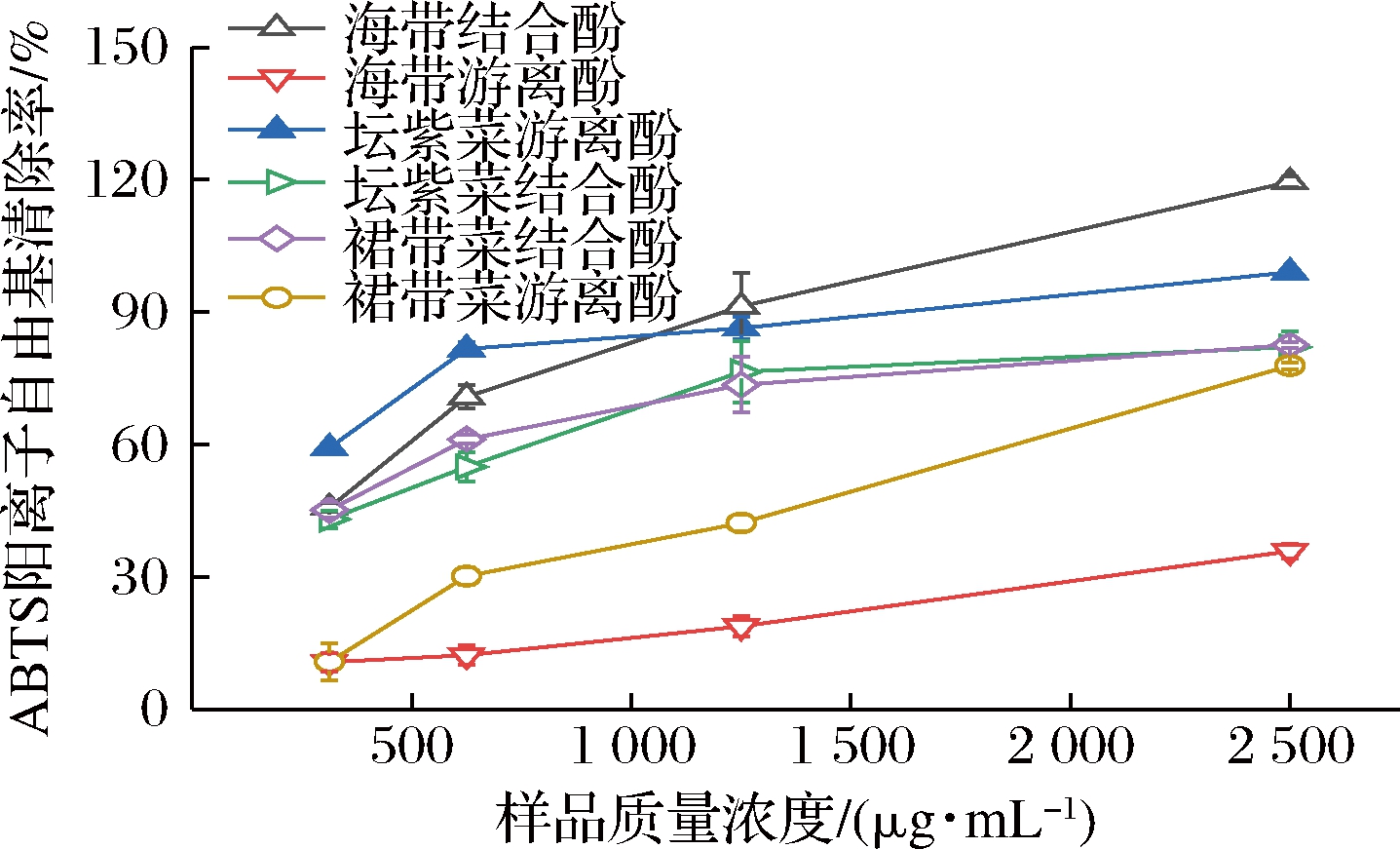
图2 海带、坛紫菜、裙带菜游离和结合酚提取物的ABTS阳离子自由基清除能力
Fig.2 ABTS cationic radical scavenging ability of free and bound phenolics extracts from L.japonica, P.haitanensis, and U.pinnatifida
2.5 铁离子还原能力
吸光值越高则表示海藻游离和结合酚提取物的铁离子还原能力越强。由图3可知,3种海藻结合酚提取物的铁离子还原能力显著强于游离酚提取物,结合酚提取物的吸光值为0.319~0.302,游离酚提取物的吸光值为0.021~0.123。海带和裙带菜结合酚提取物的Fe3+还原能力无显著性差异(P>0.05),吸光值均为0.319,坛紫菜游离酚提取物的铁离子还原能力分别是海带和裙带菜游离酚提取物的5.85和1.78倍,这可能与其有更高的总酚含量有关。赵国玲等[16]也报道坛紫菜游离酚组分具有铁离子还原能力,且在1.5 g/L质量浓度下吸光值可达0.50。但3种藻类多酚提取物的铁离子还原能力均低于维生素C。
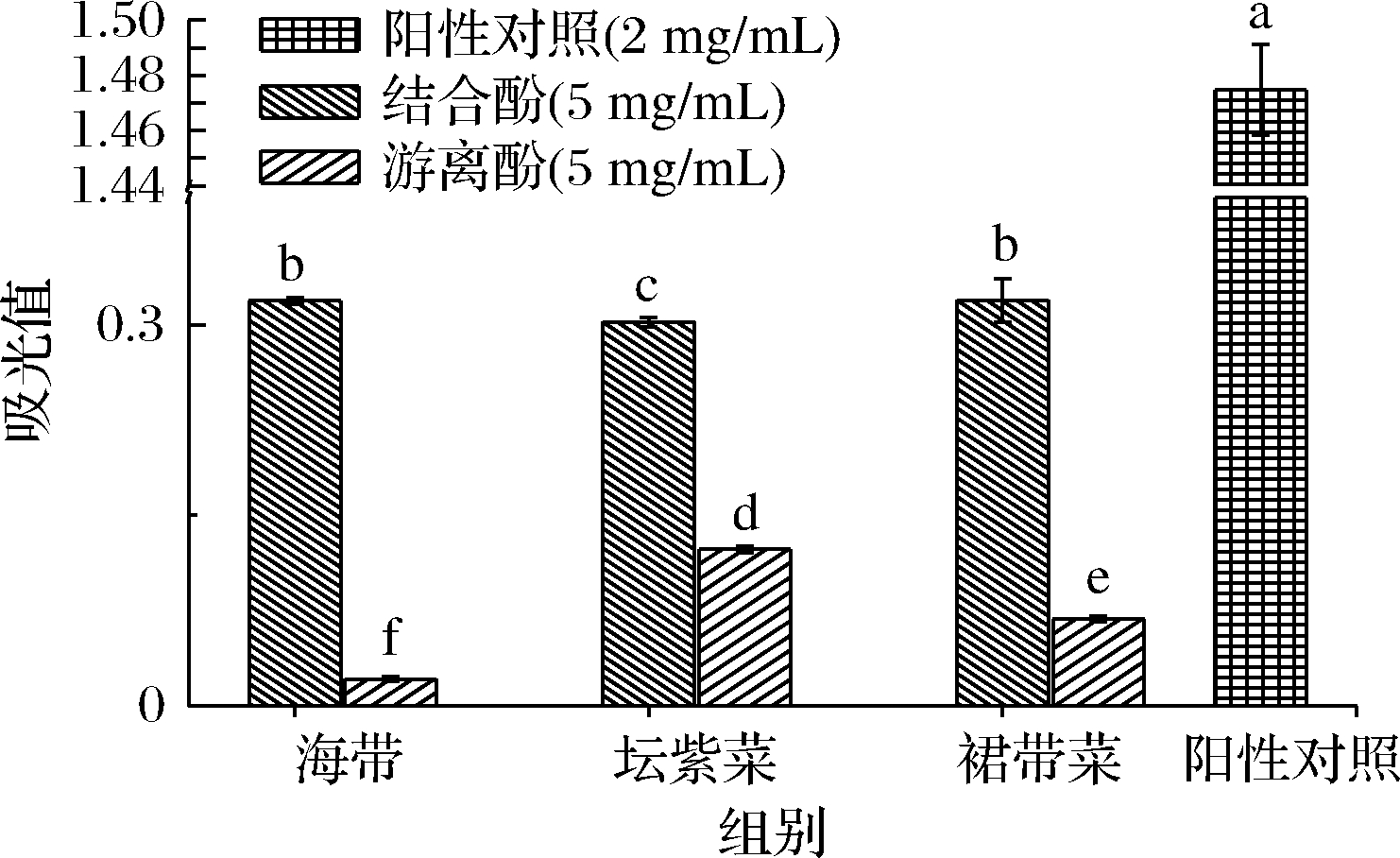
图3 海带、坛紫菜、裙带菜游离和结合酚提取物的铁离子还原能力
Fig.3 Iron ion reducing capacity of free and bound phenolics extracts from L.japonica, P.haitanensis, and U.pinnatifida
注:上标不同字母a~f表示数据间存在显著性差异(P<0.05)
2.6 α-葡萄糖苷酶抑制活性
α-葡萄糖苷酶是一种重要的糖苷键水解酶,能水解蔗糖、麦芽糖等寡糖为可吸收的单糖,研究发现,抑制α-葡萄糖苷酶的活性能改善餐后和空腹血糖水平,达到预防和治疗糖尿病的效果。临床上用的α-葡萄糖苷酶抑制剂如阿卡波糖有肠胃胀气、腹泻等副作用,而天然来源的α-葡萄糖苷酶抑制剂有高效、低毒和副作用小等优势,是目前糖尿病领域研究的热点和重点[23]。因此,测定海带、坛紫菜、裙带菜游离和结合酚的α-葡萄糖苷酶活性抑制能力可评估其在降血糖方面的应用潜力。
如图4和表2所示,3种海藻多酚提取物均有α-葡萄糖苷酶抑制能力,且结合酚提取物的活性显著高于游离酚提取物,其中裙带菜结合酚提取物的α-葡萄糖苷酶抑制能力最强,其IC50值为156.52 μg/mL,略低于阿卡波糖(199.72 μg/mL)。裙带菜和海带结合酚提取物的活性是对应游离酚提取物的7.75和3.49倍。以上结果表明,3种海藻结合酚提取物,尤其是裙带菜提取物,是α-葡萄糖苷酶抑制剂的优质来源。KANG等[21]研究发现海带多酚提取物对α-葡萄糖苷酶抑制活性的IC50值大于8 mg/mL,显著高于我们的研究,且其总酚含量与其活性呈高度的相关性。α-葡萄糖苷酶抑制活性与总酚和总黄酮含量的相关系数分别为0.239和-0.669,表明其与总酚呈正相关,而与总黄酮为负相关。
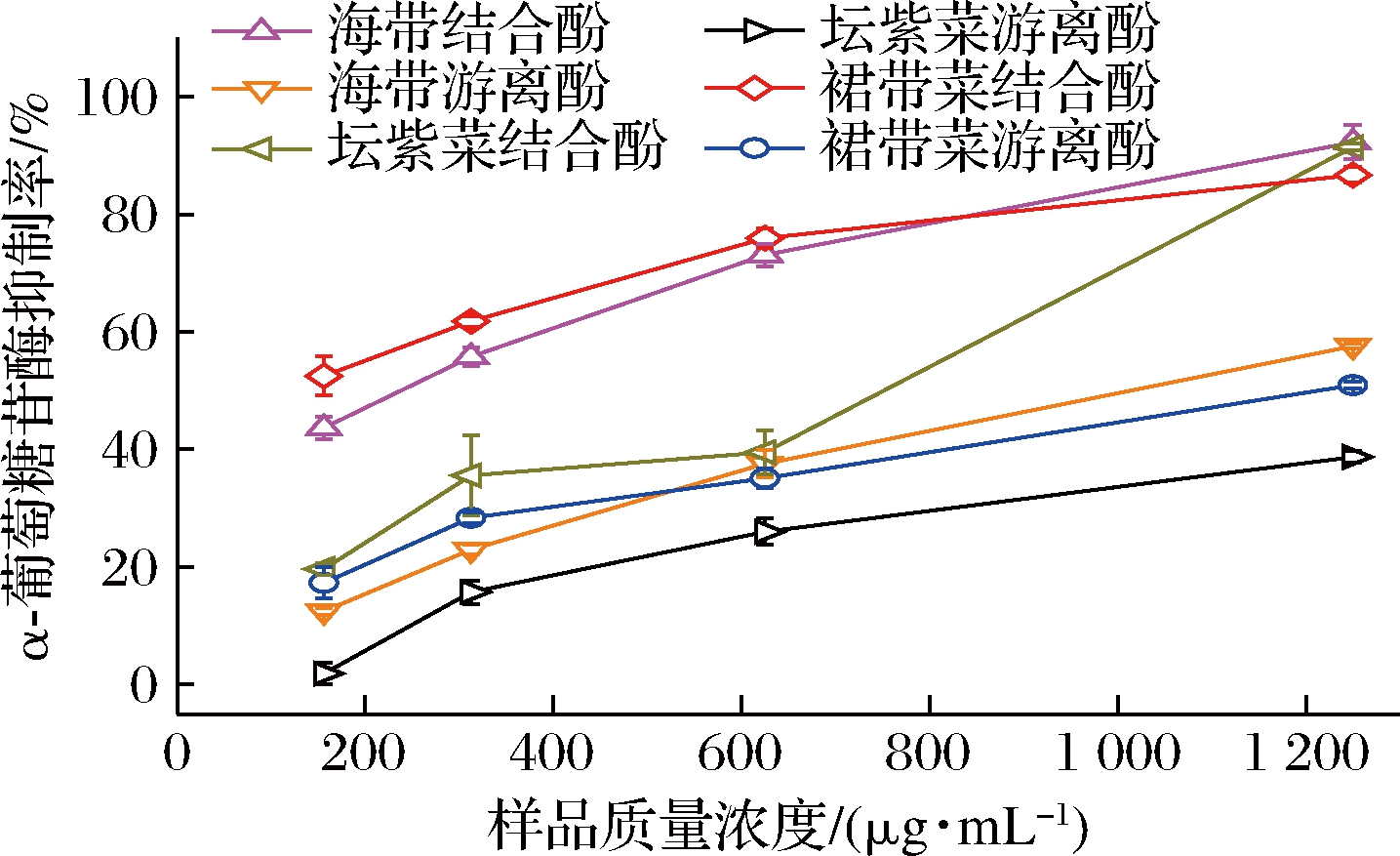
图4 海带、坛紫菜、裙带菜游离和结合酚提取物的α-葡萄糖苷酶抑制能力
Fig.4 α-Glucosidase inhibition of free and bound phenolics extracts from L.japonica, P.haitanensis, and U.pinnatifida
2.7 酪氨酸酶抑制能力
酪氨酸酶是人体中黑色素合成的重要酶,抑制其活性可减少老年斑、雀斑、黄褐斑及皮肤恶性黑色素肿瘤等疾病的发生率,常见的酪氨酸酶抑制剂,如曲酸、氢醌等虽然可达到美白、祛斑等目的,但长期使用会产生皮炎、皮肤过敏甚至皮肤癌等副作用[24]。因此,分析3种海藻游离和结合酚提取物的酪氨酸酶抑制活性可评估其在皮肤病治疗方面的应用价值。如图5和表2所示,3种海藻游离和结合酚提取物对酪氨酸酶的抑制能力均随着浓度的增加而增加,呈现出剂量效应,但活性均低于阳性对照品曲酸,在结合酚提取物中,不同海藻结合酚提取物的酪氨酸酶抑制活性差异显著,海带结合酚提取物的IC50值最低,为196.28 μg/mL,表明其酪氨酸酶抑制活性最强。3种海藻游离酚提取物的IC50值为367.43~524.47 μg/mL,坛紫菜和裙带菜游离酚提取物的酪氨酸酶抑制能力无显著性差异(P>0.05)。以上结果表明海带结合酚提取物作为酪氨酸酶抑制剂的开发潜力最大,这可能与其富含阿魏酸[25]、香草酸[26]等活性成分有关[27]。相关性分析表明,酪氨酸酶抑制能力与总酚含量显著相关。
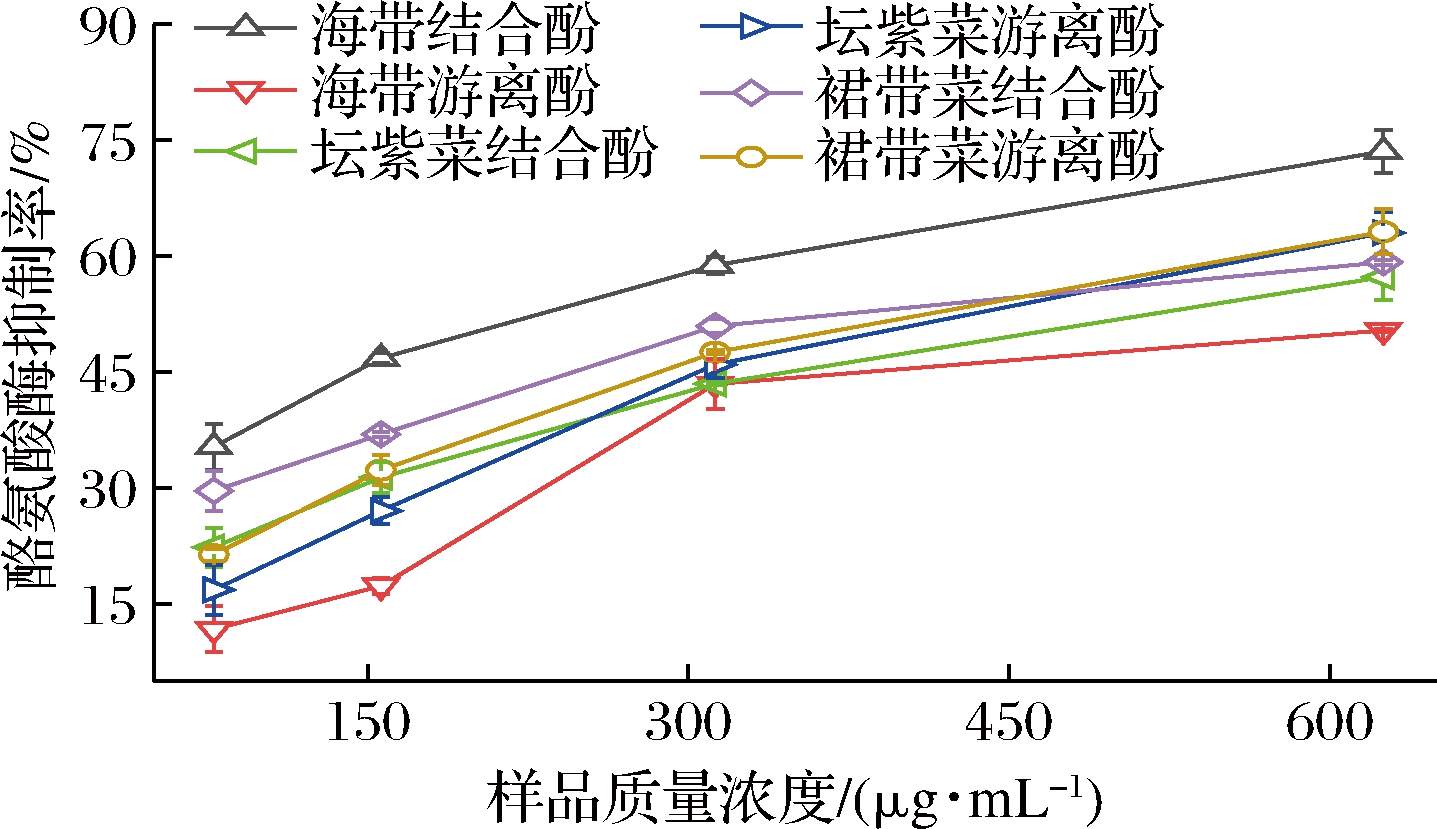
图5 海带、坛紫菜、裙带菜游离和结合酚提取物的酪氨酸酶抑制能力
Fig.5 Tyrosinase inhibition of free and bound phenolics extracts of L.japonica, P.haitanensis, and U.pinnatifida
2.8 乙酰胆碱酯酶抑制能力
乙酰胆碱酯酶是神经传导过程中的关键酶,通过水解乙酰胆碱为胆碱和乙酸来阻断神经信号传递,抑制其活性能预防老年性痴呆等神经性疾病的发生[24]。因此,测定海带、坛紫菜、裙带菜游离和结合酚提取物的乙酰胆碱酯酶抑制活性可评估其在治疗和预防神经类疾病药物方面的作用。由图6和表2可知,3种海藻游离和结合酚提取物抑制乙酰胆碱酯酶的IC50值的顺序为坛紫菜游离酚提取物(913.83 μg/mL)>海带游离酚提取物(833.33 μg/mL)>裙带菜游离酚提取物(752.00 μg/mL)>海带结合酚提取物(453.37 μg/mL)>坛紫菜结合酚提取物(452.95 μg/mL)>裙带菜结合酚提取物(289.46 μg/mL)。3种海藻结合酚提取物的乙酰胆碱酯酶抑制活性显著强于游离酚,其中裙带菜结合酚提取物的乙酰胆碱酯酶抑制能力最强。裙带菜游离酚和结合酚提取物的乙酰胆碱酯酶活性强于PEDRO等[17]报道的裙带菜酶解产物(IC50,1 000 μg/mL)。乙酰胆碱酯酶抑制能力与总酚和总黄酮含量的相关系数分别为0.623和0.962,表明酚酸和黄酮均对裙带菜、坛子菜和海带的乙酰胆碱酯酶抑制能力有贡献。
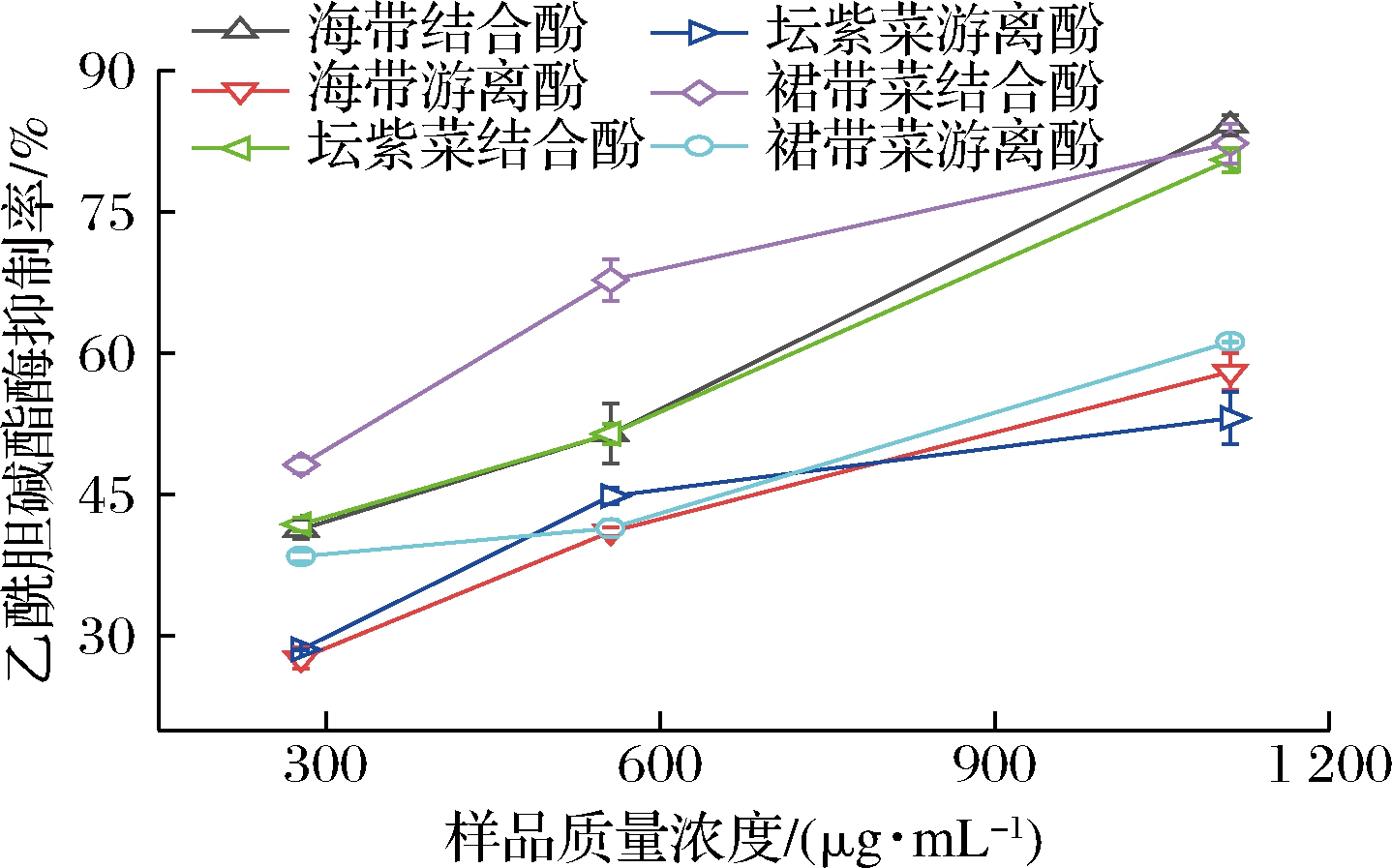
图6 海带、坛紫菜、裙带菜游离和结合酚提取物的乙酰胆碱酯酶抑制活性
Fig.6 Acetylcholinesterase inhibitory activity of free and bound phenolics extracts from L.japonica, P.haitanensis, and U.pinnatifida
3 结论
3种海藻原料中结合酚的总酚含量显著高于游离酚。除裙带菜外,3种海藻原料中结合酚中的总黄酮含量均高于游离酚。抗氧化实验证明,坛紫菜游离酚提取物的ABTS阳离子自由基清除能力最强;海带和裙带菜结合酚提取物的DPPH自由基清除能力和铁离子还原能力显著强于其他海藻酚组分。酶抑制实验表明,海带结合酚提取物的酪氨酸酶抑制能力最强;裙带菜结合酚提取物的α-葡萄糖苷酶和乙酰胆碱酯酶的抑制能力更具优势。酚类组分是3种海藻提取物中主要的DPPH自由基、酪氨酸酶和乙酰胆碱酯酶抑制成分,黄酮是3种海藻提取物中α-葡萄糖苷酶抑制成分。综上所述,相比于其他两种海藻,海带作为抗氧化剂和酪氨酸酶抑制剂的开发潜力更大,且裙带菜是α-葡萄糖苷酶和乙酰胆碱酯酶抑制剂的最优质原料来源,具有开发治疗与其相关疾病的健康食品的潜力。
[1] GABBIA D, DE MARTIN S. Brown seaweeds for the management of metabolic syndrome and associated diseases[J]. Molecules (Basel, Switzerland), 2020, 25(18):4182.
[2] LEANDRO A, PEREIRA L, GONÇALVES A M M.Diverse applications of marine macroalgae [J].Marine Drugs, 2019, 18(1):17.
[3] 张仪欣, 佟长青, 李伟.褐藻生物活性物质研究现状 [J].农产品加工, 2019(14):78-80;83.
ZHANG Y X, TONG C Q, LI W.The studies of bioactive substances from brown algae[J].Farm Products Processing, 2019(14):78-80;83.
[4] 杨贤庆, 黄海潮, 潘创,等.紫菜的营养成分、功能活性及综合利用研究进展 [J].食品与发酵工业, 2020, 46(5):306-313.
YANG X Q, HUANG H C, PAN C, et al.Advances on nutrient components, biological activities and comprehensive utilization of Porphyra[J].Food and Fermentation Industies, 2020, 46 (5):306-313.
[5] 江涛, 费帆, 方婷.紫菜生物活性成分及其应用研究进展 [J].食品研究与开发, 2021, 42(21):162-167.
JIANG T, FEI F, FANG T.Research progress on the bioactive components of Porphyra and its application[J].Food Research and Development, 2021, 42 (21):162-167.
[6] 汪群,雷思佳,付慧娟,等.海带多酚提取工艺优化及抗氧化性研究[J].深圳职业技术学院学报,2021,20(1):36-41.
WANG Q, LEI S J, FU H J, et al. Optimization of extraction technique of polyphenols from Laminaria japonica and its antioxidant activity[J]. Journal of Shenzhen Polytechnic, 2021, 20(1):36-41.
[7] 刘剑波. 我国裙带菜加工利用技术研究进展 [J].河北渔业, 2021(3):42-44;46.
LIU J B.Research on processing and utilization technology of Undaria pinnatifida in China [J].Hebei Fisheries, 2021(3):42-44;46.
[8] WANG L, PARK Y J, JEON Y J, et al.Bioactivities of the edible brown seaweed, Undaria pinnatifida:A review [J].Aquaculture, 2018, 495:873-880.
[9] WANG Z Y, LI S Y, GE S H, et al.Review of distribution, extraction methods, and health benefits of bound phenolics in food plants [J].Journal of Agricultural and Food Chemistry, 2020, 68(11):3 330-3 343.
[10] ZHANG Y, BAI B, YAN Y, et al.Bound polyphenols from red quinoa prevailed over free polyphenols in reducing postprandial blood glucose rises by inhibiting α-glucosidase activity and starch digestion[J].Nutrients, 2022, 14(4):728.
[11] ZHENG Y T, LIU S, XIE J H, et al.Antioxidant, α-amylase and α-glucosidase inhibitory activities of bound polyphenols extracted from mung bean skin dietary fiber [J].LWT, 2020, 132:109943.
[12] HUANG Z T, CHEN Q Q, HU K X, et al.Effects of in vitro simulated digestion on the free and bound phenolic content and antioxidant activity of seven species of seaweeds [J].International Journal of Food Science and Technology, 2021, 56(5):2 365-2 374.
[13] ONS K, MOHAMED N M, THIERRY M, et al.In vitro evaluation of antioxidant activities of free and bound phenolic compounds from Posidonia oceanica (I.) Delile leaves [J].African Journal of Biotechnology, 2011, 10(16):3 176-3 185.
[14] SUN S W, HUANG S Q, SHI Y N, et al.Extraction, isolation, characterization and antimicrobial activities of non-extractable polyphenols from pomegranate peel [J].Food Chemistry, 2021, 351:129232.
[15] 张露, 刘鹏飞, 涂宗财, 等.香榧不同部位提取物的抗氧化和酶抑制活性比较分析 [J].食品科学, 2018, 39(10):78-83.
ZHANG L, LIU P F, TU Z C, et al.Comparison of antioxidant activity and enzyme inhibitory activity of different plant parts of Torreya grandis cv.merrillii[J].Food Science, 2018, 39 (10):78-83.
[16] 赵国玲, 刘承初, 谢晶, 等.坛紫菜不同溶剂组分的抗氧化活性 [J].食品科学, 2010, 31(17):186-191.
ZHAO G L, LIU C C, XIE J, et al.Antioxidant effects of the soxhlet extraction product from Porphyra haitanensis and its different solvent-soluble fractions[J].Food Science, 2010, 31 (17):186-191.
[17] PEDRO B, GUEDES L, ANDRÉ R, et al.Undaria pinnatifida (U.pinnatifida) bioactivity:Antioxidant, gastro-intestinal motility, cholesterol biosynthesis and liver cell lines proteome [J].Journal of Functional Foods, 2021, 83:104567.
[18] 陈洪彬, 宋露露, 金瑾萱, 等.坛紫菜多酚提取工艺及体外抗氧化与抑菌活性研究 [J].食品与机械, 2018, 34(9):157-161.
CHEN H B, SONG L L, JIN J X, et al.The extraction process of polyphenols from Porphyra haitanensis and their antioxidant and antimicrobial activities in vitro[J].Food and Machinery, 2018, 34 (9):157-161.
[19] 邢慧颖, 黄莉, 丁波, 等.体外消化对不同极性植物多酚的抗氧化能力及生物利用度的影响 [J].食品与发酵工业, 2020, 46(16):70-77.
XING H Y, HUANG L, DING B, et al.Effects of in vitro digestion on antioxidant activity and bioavailability of plant polyphenols with different polarities[J].Food and Fermentation Industries, 2020, 46 (16):70-77.
[20] JESUMANI V, DU H, PEI P B, et al.Comparative study on skin protection activity of polyphenol-rich extract and polysaccharide-rich extract from Sargassum vachellianum [J].PLoS One, 2020, 15(1):e0227308.
[21] KANG S Y, KIM E, KANG I, et al.Anti-diabetic effects and anti-inflammatory effects of Laminaria japonica and Hizikia fusiforme in skeletal muscle:In vitro and in vivo model [J].Nutrients, 2018, 10(4):491.
[22] MACHU L, MISURCOVA L, AMBROZOVA J V, et al.Phenolic content and antioxidant capacity in algal food products [J].Molecules(Basel, Switzerland), 2015, 20(1):1 118-1 133.
[23] DIRIR A M, DAOU M, YOUSEF A F, et al.A review of alpha-glucosidase inhibitors from plants as potential candidates for the treatment of type-2 diabetes [J].Phytochemistry Reviews, 2022,21(4):1 049-1 079.
[24] QU Y W, ZHAN Q, DU S B, et al.Catalysis-based specific detection and inhibition of tyrosinase and their application [J].Journal of Pharmaceutical Analysis, 2020, 10(5):414-425.
[25] KANLAYAVATTANAKUL M, LOURITH N.Biologically active phenolics in seed coat of three sweet Tamarindus indica varieties grown in thailand [J].Advanced Science, Engineering and Medicine, 2012, 4(6):511-516.
[26] CHOU T H, DING H Y, HUNG W J, et al.Antioxidative characteristics and inhibition of alpha-melanocyte-stimulating hormone-stimulated melanogenesis of vanillin and vanillic acid from origanum vulgare [J].Experimental Dermatology, 2010, 19(8):742-750.
[27] SHEN P, GU Y, ZHANG C X, et al.Metabolomic approach for characterization of polyphenolic compounds in Laminaria japonica, Undaria pinnatifida, Sargassum fusiforme and Ascophyllum nodosum [J].Foods(Basel, Switzerland), 2021, 10(1):192.