桃(Prunus persica L.Batsch)属于蔷薇科,品种繁多,在我国多分布于江苏、福建、浙江等省。由于桃果实汁多味美,营养价值高,深受广大消费者喜爱。但桃果实一般成熟于高温多雨的夏季,采后呼吸作用旺盛,极不耐贮,一般采后2~3 d就可腐烂变质[1]。近年来,国内外已有对水蜜桃果实采后贮藏保鲜技术的大量研究,包括物理性(如低温保鲜、热处理保鲜、辐射保鲜和减压保鲜)、化学性[如1-甲基环丙烯(1-methylcyclopropene, 1-MCP)、植物生长调节剂]及生物保鲜方法等(如微生物拮抗剂、天然提取物)[2]。但是以上方法或因潜在食品安全风险,或在实际应用推广方面成本较高、技术不完善等原因,都存在一定局限性。因此,探索可行、高效、低成本的采后处理方法,延长桃果实贮藏期,具有重要意义。
苏州碧螺春茶是我国的传统十大名茶之一,因其独特的芳香及悠久的历史享誉国内外,汤色嫩绿,香气淡雅,滋味鲜醇,被誉为“茶中仙子”,具有较高经济价值[3]。碧螺春茶一般于清明前开采,且开采期较短,只采其嫩芽制作,老叶因掺有茶碎末与杂质,且影响口感往往被废弃。而近几年,茶树老叶中丰富的多酚物质受到广泛关注[4-6],其抗氧化、防辐射、抗炎抑菌等多种生物学功能显著,且安全无毒,在食品工业、日用品、医药中有诸多应用。
茶多酚稳定性较差,容易氧化,采用复合保鲜技术可提高保鲜效果,延长果蔬货架期,如茶多酚与溶菌酶的复合保鲜[7-8]。溶菌酶是一种天然蛋白质,且安全无毒,能够水解细菌中的多糖使细胞壁破裂,从而抑制细菌增长。然而,目前缺乏茶树老叶茶多酚保鲜效果的研究,也未见茶树老叶茶多酚与其他保鲜剂复合处理的报道。因此,本研究旨在探讨碧螺春老叶多酚在果蔬保鲜中的效果,并研究茶多酚与溶菌酶的复合保鲜是否存在协同作用,通过本研究的开展,既能充分开发碧螺春经济及利用价值,又能开发一种安全无毒的食品保鲜方法,为桃果实保鲜技术的提升奠定基础。
1 材料与方法
1.1 材料与试剂
‘白凤’桃于常熟当地购买;乙醇、没食子酸、福林酚、Na2CO3、芦丁标品、NaNO2、AlCl3、NaOH、KCl、HCl、醋酸钠、醋酸、FeSO4、水杨酸、愈创木酚、H2O2、磷酸盐缓冲液(phosphate buffer saline,PBS)、EDTA、Met、硝基四氮唑蓝(nitroblue tetrazolium,NBT)、维生素B2等均为分析纯。
1.2 仪器与设备
Therm高速冷冻离心机,南京康维达生物科技有限公司;紫外分光光度计,上海科晓科学仪器有限公司;数显恒温水浴锅,上海坤诚科学仪器有限公司。
1.3 实验方法
1.3.1 碧螺春老叶多酚提取及施用浓度筛选
参照![]() 等[9]和ZHOU等[10]的方法提取老叶中茶多酚,用提取液稀释不同浓度梯度,以相同浓度的维生素C作为阳性对照,测定不同浓度下茶多酚对羟自由基清除能力,确定清除羟自由基的最佳提取浓度,作为老叶多酚施用浓度。
等[9]和ZHOU等[10]的方法提取老叶中茶多酚,用提取液稀释不同浓度梯度,以相同浓度的维生素C作为阳性对照,测定不同浓度下茶多酚对羟自由基清除能力,确定清除羟自由基的最佳提取浓度,作为老叶多酚施用浓度。
1.3.2 桃果实原材料及处理
‘白凤’桃果实于7月份常熟当地采购,挑选约8成熟、大小均一、无病虫害及明显机械损伤的桃果实运回实验室,采摘当天设置为D0。分别用1.25 mg/mL老叶多酚溶液(实验确定的最佳浓度),1.25 mg/mL茶多酚+0.1%溶菌酶溶液室温下浸泡10 min,蒸馏水浸泡作为对照, 晾干后贮藏于室温下(25±1) ℃ 6 d,分别在第2、4、6天取样(D2、D4、D6),去皮、切成小块并研磨,经离心处理后用于各项指标的测定。所有样品均设3个平行实验。
1.3.3 失重
3种不同处理的桃果实各选择9个,分别于第0、2、4、6天测定果实质量。失重(Δn)计算如公式(1)所示:
Δn/g=贮藏前果重-贮藏后果重
(1)
1.3.4 多酚的提取测定
称取2 g新鲜桃果实样品进行研磨,加入10 mL体积分数为80%乙醇溶液提取多酚,10 000×g离心10 min取上清备用。配制0.1 mg/mL的没食子酸,分别取50、100、200、300、400、500 μL没食子酸标准品做标准曲线,同时,取200 μL多酚提取液于试管中,每只试管加入2 mL体积分数10%福林酚静置5 min,然后加入2 mL质量分数为6%的Na2CO3,75 ℃水浴10 min后冷却。于725 nm处测定吸光值,同体积的提取液作空白,每个样品做3组平行。
1.3.5 黄酮的测定
配制0.2 mg/mL的芦丁标准品,分别吸取100、200、400、600、800 μL于每支试管,用于标曲测定。测定每组样品时,吸取2 mL多酚提取液于新试管中,加入0.3 mL质量分数为5% NaNO2溶液,摇匀后静置6 min,再加入0.3 mL质量分数为10% AlCl3溶液,摇匀并静置6 min,然后加入4 mL质量分数为10% NaOH溶液静置15 min,每支试管定容至 10 mL。于510 nm处测定吸光值,同体积的提取液作为空白。
1.3.6 花青素的测定
2支试管各取1 mL多酚提取液,分别加入 3 mL KCl缓冲液(0.025 mol/L pH 1.0)与3 mL 醋酸钠缓冲液(0.4 mol/L pH 4.5),分别于520、700 nm处测定吸光值。花青素含量计算如公式(2)所示:
花青素含量/[mg·(100g)-1干物质]=[(A520-A700)pH 1.0-![]()
(2)
式中:Mw为花青素-3-葡萄糖苷的分子质量(C15H11O6 449.2 g/mol);DF为稀释倍数;ε为消光系数(26 900);m为样品质量,g。
1.3.7 羟自由基清除率的测定
于每支试管中依次加入3 mL蒸馏水,100 μL FeSO4溶液(0.02 mol/L), 45 μL双氧水(0.15%)生成羟自由基,然后加入0.5 mL多酚提取液并混匀,最后加入1 mL水杨酸(8 mmol/L)显色。反应30 min后于510 nm处测吸光值,用同体积提取液代替多酚作为对照,羟自由基清除率计算如公式(3)所示:
羟自由基清除率![]()
(3)
1.3.8 DPPH自由基清除率的测定
取0.1 mL多酚提取液于试管中,加入2.5 mL 0.2 mmol/L的DPPH乙醇溶液摇匀,黑暗中孵育30 min,于517 nm处测吸光度。取同体积提取液代替多酚提取物作对照,DPPH自由基清除率计算如公式(4)所示:
DPPH自由基清除率![]()
(4)
1.3.9 过氧化物酶(peroxidase,POD)活性测定
称取2 g新鲜桃果实样品于冰上进行研磨,加入6 ml PBS(50 mmol/L pH 7.8)提取酶,4 ℃下10 000×g离心10 min,取上清酶液并保存于4 ℃冰箱备用。
取0.4 mL酶液,加入2 mL醋酸缓冲液(50 mmol/L pH 5.4)和1 mL愈创木酚(0.25%,体积分数),然后加入0.05 mL H2O2(3%,体积分数)启动反应。立即置于紫外分光光度计中于460 nm处测定吸光值,每30 s记录1次数值,反应共5 min,每分钟吸光度变化0.01为1个酶活单位。
1.3.10 超氧化物歧化酶(superoxide dismutase,SOD)活性测定
取0.03 mL酶提取液,加入3 mL的反应体系中(50 mmol/L pH 7.8 PBS、0.1 mmol/L EDTA、13 mmol/L Met、75 μmol/L NBT、2 μmol/L核黄素)。另取3个试管,加入20 μL的超纯水代替酶提取液,作为对照组。将测定组与对照组放在4 000 lx强度的光照下反应30 min,用等体积的超纯水代替酶液作为空白组放在暗室中反应作为空白组。反应完成后在560 nm处测定吸光值。SOD活力计算如公式(5)所示:
SOD活力![]()
(5)
式中:A0为对照组的吸光度;A为测定组的吸光度;V为样品的总体积,mL;Vs为测定所用酶液体积,mL;t为反应时间,h;m为样品质量,g。
1.3.11 过氧化氢酶(catalase,CAT)活性测定
取2.6 mL PBS(50 mmol/L pH 7.8),加入0.4 mL酶液,摇匀,然后加入50 μL H2O2(3%)作启动反应,于240 nm处测吸光值,每30 s记录1次数值,观察吸光值变化,反应共5 min。每组样品做3个平行。
2 结果与分析
2.1 碧螺春老叶多酚施用浓度筛选
果蔬细胞中,线粒体是产生ATP的主要场所,通过有氧呼吸将氧气转化为水最终产生ATP,以维持机体基本的生命活动。然而,在电子传递过程中,在线粒体复合物Ⅰ和复合物Ⅲ处会由于电子泄露导致活性氧(reactive oxygen species,ROS)的产生。羟自由基是ROS的一员,若在果蔬细胞内累积过多,会对植物组织不断侵袭,造成果蔬的衰老。而多酚具有羟自由基清除能力,高清除能力利于果蔬的后期贮存,延缓衰老。因此,本实验以碧螺春老叶多酚对羟自由基的清除能力为指标,测定不同多酚浓度下羟自由基清除能力的变化,确定最佳的施用浓度。
如图1所示,碧螺春老叶多酚显示出较强的羟自由基清除能力,且随着多酚浓度的升高,清除能力迅速提高,当多酚质量浓度为1.25 mg/mL时,羟自由基清除率达到92.95%。此后多酚浓度再提高,羟自由基清除能力基本趋于平缓。因此,本实验确定用于桃果实保鲜的老叶多酚的最佳施用质量浓度为1.25 mg/mL。
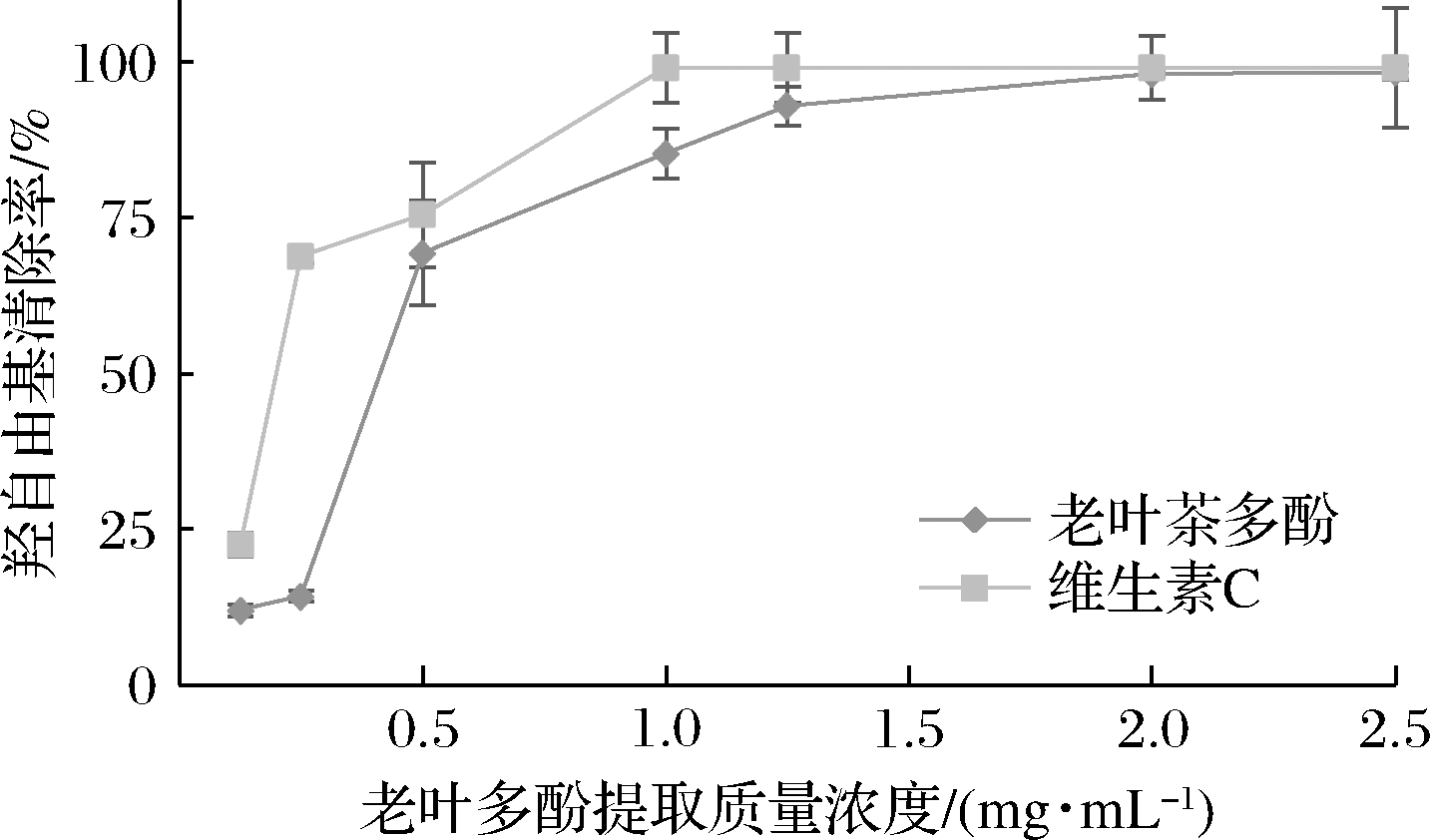
图1 老叶多酚最佳施用浓度的确定
Fig.1 Determination of optimum application concentration of polyphenols in Biluochun old leaves
2.2 桃果实的失重
果蔬皆为活的有机体,在采后贮藏阶段,蒸腾作用、呼吸作用以及其他代谢活动仍然会继续进行,这些生理活动严重影响着果蔬表观和质量。其中,果蔬蒸腾作用的直接表现为质量的下降、果实软化等。本研究中,桃果实采后贮藏期间的图片如图2所示,在贮藏期内,桃果实色泽进一步转红。由于贮藏期只有6 d,且各组桃果实转红明显,因此,仅从外观不能很明显的看出不同处理组之间的区别,因此要结合其他生理、生化指标综合讨论采后处理对桃果实品质的影响。桃果实在贮藏过程中的失重变化如图3所示,对照组桃果实质量下降最为迅速,茶多酚处理组次之,茶多酚和溶菌酶处理组质量下降最慢。说明茶多酚可很好地维持桃果实在贮藏期间重量变化,减少水分的散失,茶多酚和溶菌酶结合处理对于维持桃果实的重量表现出协同作用,有效延缓桃果实的失重。

图2 桃果实采后贮藏期间图片
Fig.2 Photograph of the commercial peach fruit after harvest
2.3 SOD活性的变化
桃属于呼吸跃变型果实,在采后仍经历着新陈代谢活动,呼吸作用会引起细胞壁降解、果实软化、单糖含量增加、挥发性物质的累积等,直接影响着果实的商品特性。果蔬采后随着呼吸作用的进行,线粒体在氧化磷酸化产生能量过程中,内部的呼吸链会发生电子泄露,形成ROS。ROS会直接攻击细胞内的蛋白质、核酸等大分子物质,引起机体代谢的紊乱,影响细胞的代谢和细胞凋亡。植物细胞内部还存在着抗氧化体系,包括抗氧化酶类和非抗氧化酶类,抵制ROS的侵害。其中,SOD、CAT和POD等是植物中常见的抗氧化酶。呼吸作用产生的超氧阴离子自由基在细胞内部不稳定,会在SOD的作用下转化为H2O2,而H2O2会进一步在CAT和POD等酶的作用下转化为H2O,降低ROS对细胞的侵害。
本研究中,桃果实的SOD活性在贮藏过程中呈现总体持续上升的趋势(如图3所示),说明在室温贮存期间桃果实面临较强的氧化应激反应,造成果实内部ROS累积。处理组的桃果实SOD活性明显高于对照组,说明多酚提取液刺激了SOD酶活,提高了桃果实的抗氧化活性,及时清除处理组中桃果实产生的ROS,延缓了果实的成熟。而溶菌酶的添加对于果实SOD酶活的提高没有显著的作用。
2.4 CAT活性的变化
在桃果实贮藏期间,CAT酶活呈现持续降低的趋势,如图3所示,而多酚提取液很好地维持了其较高的酶活,提高了果实的抗氧化能力。值得注意的是,不同于对SOD酶活的影响,溶菌酶与多酚的复合处理在提升CAT酶活方面显著优于对照组、茶多酚组,表现出较高的协同效果,有效清除桃果细胞内部产生的H2O2,延缓果实的衰老。
2.5 POD活性的变化
如图3所示,在贮藏期间,对照组的POD活性迅速升高,在第2天出现峰值,随后在贮藏期间下降,所有组中的POD活性总体呈现先上升后下降的趋势。其中,茶多酚和溶菌酶复合处理对桃果实POD活提升效果最佳,提高桃果实过氧化物酶的活性,可增强清除自由基的能力,延缓果实衰老。类似的研究结果在西蓝花保鲜中也有报道, 李长亮等[11]采用1-MCP和溶菌酶结合处理研究新鲜西蓝花保鲜,发现1-MCP+溶菌酶有效提高西蓝花过氧化物酶的活性、感官品质和总酚含量,延长了贮藏期。
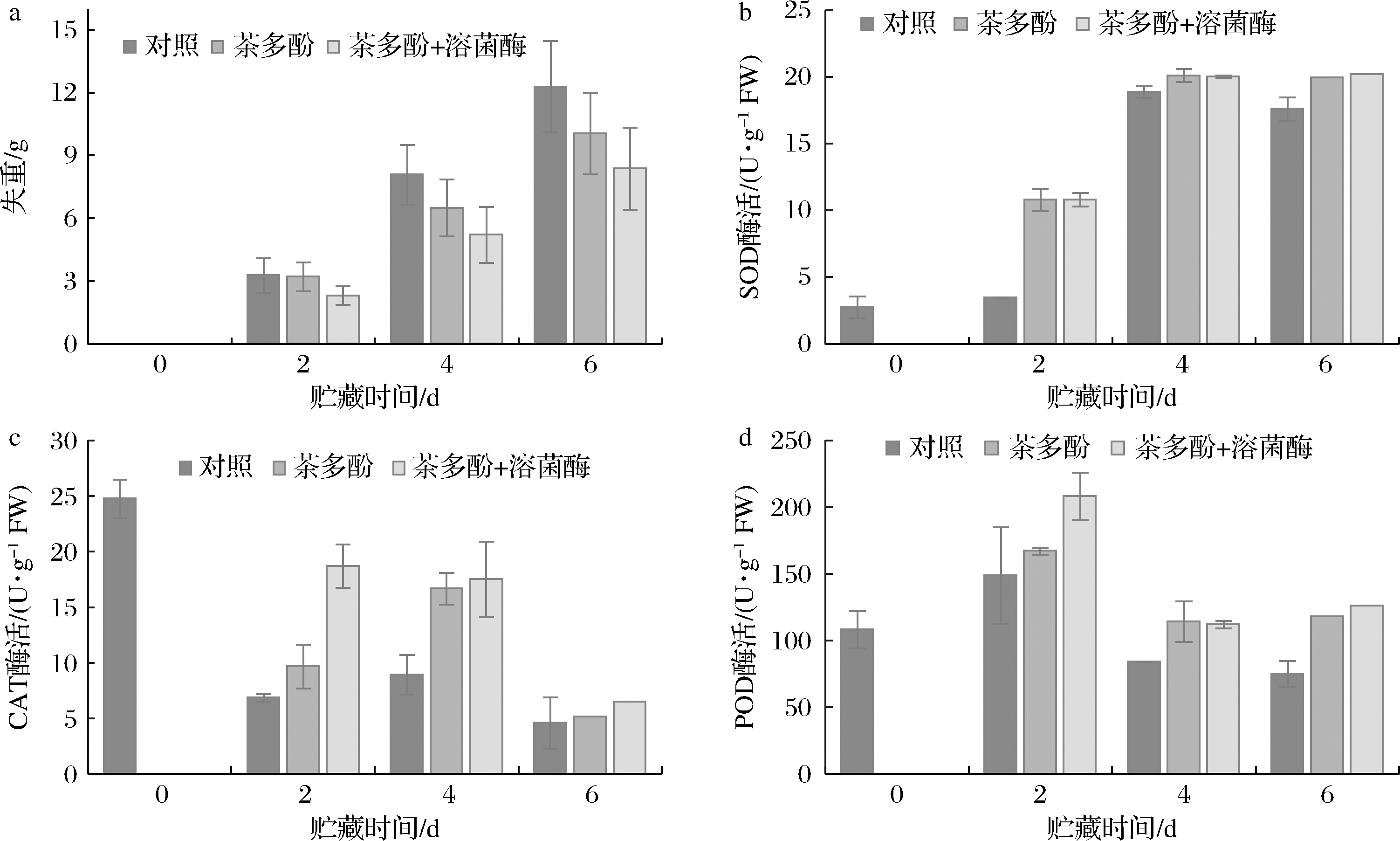
a-失重;b-SOD酶活;c-CAT酶活;d-POD酶活
图3 不同处理对桃果实的酶活及失重的影响
Fig.3 Effect of different treatments on enzymic activities and weight loss of peach fruit
2.6 总酚、花青素和黄酮含量的变化
酚类物质是由含有1个或多个羟基的苯环组成的高分子化合物,其广泛存在于植物体内,是植物体内重要的次生代谢物。果蔬体内的酚类物质决定着果蔬的色泽、口感、营养和芳香等[12],具有多种生物活性,可行使不同的功能,包括植物抗毒素[13]、吸引授粉、积累色素、抗氧化、防紫外线等[14]。类黄酮物质因其极强的抗氧化潜力,可作为重要的抗氧化剂,还扮演着氢供体、金属螯合和单线态氧猝灭剂等角色[15]。类黄酮物质包括黄酮类、花色素、黄烷酮类等等,其含量的高低直接影响着果蔬的着色和抗氧化性能。
本实验中,桃果实贮藏期间多酚和黄酮含量总体呈现先下降后上升的趋势(图4),该结果与前人在李子[16]、桃子[17]研究中一致,黄酮物质的变化与多酚趋势类似,这种规律在之前的研究中也有报道[17-18]。2个处理组对多酚和黄酮含量均未表现出明显的影响,与对照组含量区别不大。然而,处理组明显提高了桃果实花青素的含量,且茶多酚处理组中花青素含量最高,利于桃果实后期果色的稳定。
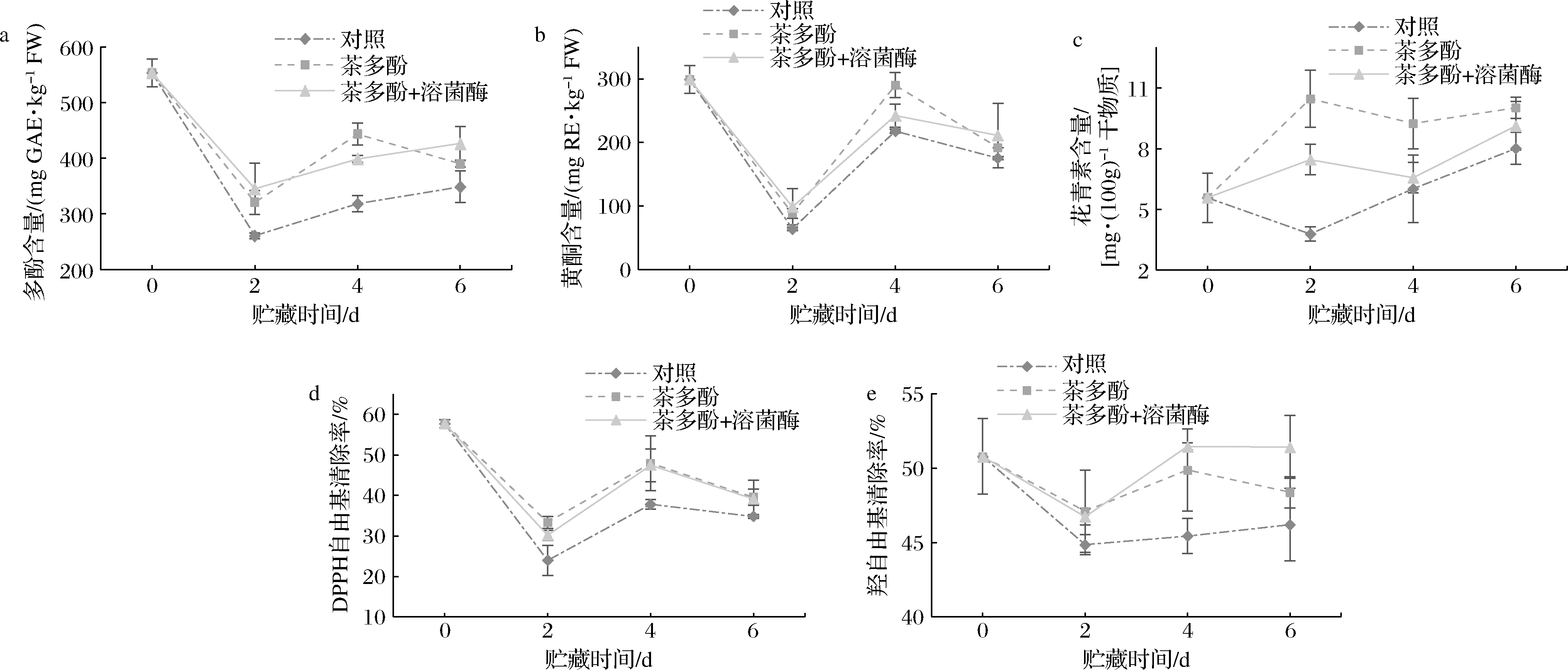
a-多酚含量;b-黄酮含量;c-花青素含量;d-DPPH自由基清除率;e-羟自由基清除率
图4 总酚、花青素、黄酮的含量及DPPH自由基、羟自由基清除率
Fig.4 Total phenols, anthocyanins, and flavonoids contents, DPPH and hydroxyl radical scavenging rates
2.7 DPPH自由基、羟自由基清除率的变化
酚类物质结构上含有苯环和取代羟基,可以为其他物质提供氢原子或者电子,还原金属离子。酚类物质自身可以释放出亲和性强的氢质子,可以将高活性的自由基失活或将其转化为稳定的化合物。测定多酚清除能力的方法有很多,大体可以分为2种:第一种是测定多酚物质清除植物体内羟自由基、超氧阴离子自由基、过氧化氢等自由基的能力,本研究中测定羟自由基清除能力的原理是利用FeSO4-H2O2的反应,体系中产生的羟自由基与染色剂水杨酸反应产生颜色,加入酚类粗提液会去除体系中的自由基,使得紫色会变浅。另一种方法是清除体外人工合成自由基的活性,应用最多的是DPPH自由基。DPPH是一种稳定的自由基,易溶于醇并且显紫色,但是当加入酚类提取液时,DPPH自由基会被酚类清除使紫色变浅,反应灵敏,成为测定酚类清除活性的有效工具。
本实验中,在桃果实贮藏期间,DPPH自由基和羟自由基清除率均呈现先下降后上升的趋势,分别在第0天和第4天表现出峰值,2种自由基清除率的总体变化趋势与总酚含量变化相似,因此推测清除率的变化与酚类物质含量有关。此外,处理组的DPPH自由基和羟自由基清除率均明显高于对照组,说明老叶多酚的处理明显提高了桃果实自由基清除能力,维持细胞的内稳态。值得注意的是,DPPH自由基清除能力跟桃果实的总酚含量变化趋势一致,据此推测桃果实的DPPH自由基清除能力受总酚含量的影响。而羟自由基清除能力变化趋势与总酚含量差别较大,碧螺春老叶多酚与溶菌酶的结合处理呈现出最强的羟自由基清除活性,但是该组中桃果实的总酚含量却没有表现出最高,由此推测羟自由基清除能力可能与某几种单酚物质有关,与总酚含量的关联不像DPPH自由基清除率那样密切,类似的结果在之前的研究中也曾得出[17]。
3 结论
本研究测定了碧螺春老叶茶多酚对桃果实采后贮藏期间成熟衰老的影响,实验前期测定不同浓度多酚提取液对羟自由基的清除效果,确定最佳适用质量浓度为1.25 mg/mL。实验结果表明,碧螺春老叶多酚处理能激活桃果实SOD、CAT、POD的活性,提高总酚、花青素的含量,增强多酚对DPPH自由基和羟自由基的清除能力。DPPH自由基的清除能力可能与桃果实总酚含量有关,而羟自由基的清除能力可能与某种或某几种单酚物质有关,与总酚含量关联不大。溶菌酶的添加对于抑制桃果实失重、提高CAT、POD活性以及羟自由基清除能力方面表现出协同作用。
[1] 孙佳丽. 我国水蜜桃保鲜技术研究进展[J].浙江农业科学, 2020, 61(8):1 553-1 555;1 633.
SUN J L.Research progress on fresh keeping technology of Prunus persica in China[J].Journal of Zhejiang Agricultural Sciences, 2020, 61(8):1 553-1 555;1 633.
[2] 曾玲珍, 肖烟云, 林河通, 等.不同浓度1-MCP处理对“朝霞”水蜜桃果实的保鲜效应[J].保鲜与加工, 2021, 21(1):25-32.
ZENG L Z, XIAO Y Y, LIN H T, et al.Effects of different concentrations of 1-methylcyclopropene(1-MCP) treatments on keeping qualities of harvested ‘Zhaoxia’ peach fruits[J].Storage and Process, 2021, 21(1):25-32.
[3] 季小明, 李金珠, 徐元元, 等.碧螺春茶树单株的选择研究[J].安徽农业科学, 2012,40(13):7 678-7 680;7 717.
JI X M, LI J Z, XU Y Y, et al.Research on individual selection of Biluochun tea[Camellia sinensis (L.) O.Ktze.][J].Journal of Anhui Agricultural Sciences, 2012,40(13):7 678-7 680;7 717.
[4] 徐思珍. 茶树粗老叶及茶末为原料提取茶多酚可行性研究[J].云南农业, 2014(7):42-43.
XU S Z.Feasibility study on extracting tea polyphenols from crude old tea leaves and tea powder[J].Yunnan Agriculture, 2014(7):42-43.
[5] 赵鸿杰, 罗昭润, 丁岳炼, 等.金花茶老叶和嫩叶营养成分分析[J].内蒙古农业大学学报(自然科学版), 2016, 37(5):52-56.
ZHAO H J, LUO Z R, DING Y L, et al.Old leaves and tender leaves nutritional composition analysis of Camellia nitidissima[J].Journal of Inner Mongolia Agricultural University (Natural Science Edition), 2016, 37(5):52-56.
[6] 马春霓. 水提法和醇提法提取茶树老叶的茶多酚[J].农村经济与科技, 2017, 28(14):33.
MA C N.Extraction of tea polyphenols from old tea leaves of tea plant by water extraction and alcohol extraction methods[J].Rural Economy and Science-Technology, 2017, 28(14):33.
[7] 李慧娟, 程佶星, 蔡美丽, 等.茶多酚在食品保鲜中的应用研究进展[J].现代食品, 2021, 27(11):17-21;33.
LI H J, CHENG J X, CAI M L, et al.Research progress in the application of tea polyphenols in food[J].Modern Food, 2021, 27(11):17-21;33.
[8] 王晓. 茶多酚研究应用现状及其发展前景展望[J].化工管理, 2018(23):157-158.
WANG X.Research and application status and development prospect of tea polyphenols development prospect[J].Chemical Enterprise Management, 2018(23):157-158.
[9] ![]() D D,
D D, ![]() et al.Phenolic compounds and biopotential of grape pomace extracts from Prokupac red grape variety[J].LWT, 2021, 138:110739.
et al.Phenolic compounds and biopotential of grape pomace extracts from Prokupac red grape variety[J].LWT, 2021, 138:110739.
[10] ZHOU D D, LI R, ZHANG H, et al.Hot air and UV-C treatments promote anthocyanin accumulation in peach fruit through their regulations of sugars and organic acids[J].Food Chemistry, 2020, 309:125726.
[11] 李长亮, 李翠红, 魏丽娟, 等.1-MCP和溶菌酶对西兰花的采后保鲜效果[J].甘肃农业科技, 2021, 52(5):45-49.
LI C L, LI C H, WEI L J, et al.Effect of 1-MCP and lysozyme on fresh-keeping of broccoli[J].Gansu Agricultural Science and Technology, 2021, 52(5):45-49.
[12] NACZK M, SHAHIDI F.Phenolics in cereals, fruits and vegetables:Occurrence, extraction and analysis[J].Journal of Pharmaceutical and Biomedical Analysis, 2006, 41(5):1 523-1 542.
[13] POPA V I, DUMITRU M, VOLF I, et al.Lignin and polyphenols as allelochemicals[J].Industrial Crops & Products, 2008, 27(2):144-149.
[14] TOM S-BARBERAN F A, FERRERES F, GIL M I.Antioxidant phenolic metabolites from fruit and vegetables and changes during postharvest storage and processing[J].Studies in Natural Products Chemistry, 2000, 23:739-795.
S-BARBERAN F A, FERRERES F, GIL M I.Antioxidant phenolic metabolites from fruit and vegetables and changes during postharvest storage and processing[J].Studies in Natural Products Chemistry, 2000, 23:739-795.
[15] TSAO R, YANG R.Optimization of a new mobile phase to know the complex and real polyphenolic composition:Towards a total phenolic index using high-performance liquid chromatography[J].Journal of Chromatography A, 2003, 1 018(1):29-40.
[16] HUAN C, XU Q H, SHEN S L, et al.Effect of benzothiadiazole treatment on quality and anthocyanin biosynthesis in plum fruit during storage at ambient temperature[J].Journal of the Science of Food and Agriculture, 2021, 101(8):3 176-3 185.
[17] WU X Q, AN X J, YU M L, et al.1-Methylcyclopropene treatment on phenolics and the antioxidant system in postharvest peach Sombined with the liquid chromatography/mass spectrometry technique[J].Journal of Agricultural and Food Chemistry, 2018, 66(25):6 364-6 372.
[18] LIU X Y, JI D C, CUI X M, et al.p-Coumaric acid induces antioxidant capacity and defense responses of sweet cherry fruit to fungal pathogens[J].Postharvest Biology and Technology, 2020, 169:111297.