浓香型白酒以己酸乙酯、乙酸乙酯、乳酸乙酯、丁酸乙酯为主体香,具有“窖香浓郁、甘冽清爽、饮后尤香、回味悠长”的风格特征,这与浓香型白酒采用“泥窖固态发酵,续糟配料,混蒸混烧”的独特酿造工艺有关。浓香型白酒酿造是一个开放式、多菌共同发酵的过程。参与酿造的微生物主要来源于环境、大曲、窖泥和酒醅等[1]。刘宇等[2]从浓香型白酒酿造环境中分离筛选了3株酵母,分别为发酵毕赤酵母、汉斯德巴氏酵母、卡斯特瑙氏酵母,通过纯培养,发现发酵毕赤酵母具有高产乙酸乙酯的特点。可见,酿造环境中的微生物与浓香型白酒风格的形成密切相关。
近年来,业内学者针对白酒酿造环境微生物进行了相关研究,如,黎瑶依等[3]对茅台镇酱香型白酒酿造环境中真菌菌群多样性进行分析,发现不同轮次酿造环境样品中真菌组成相似度较高,但其各轮次标志性真菌属存在差异。随着传统白酒酿造机械化的发展,围绕机械化酿造白酒的研究逐渐增多。王欢等[4]对酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性分析发现,芽孢杆菌属(Bacillus)、乳酸杆菌属(Lactobacillus)和鞘氨醇单胞菌属(Sphingomonas)在不同轮次堆积发酵核心微生物菌群中具有重要的生物学调控作用。目前,环境微生物的研究,主要聚焦在探索酿造时空环境微生物群落结构的特征,少有文献报道酿造车间不同酿造区域中环境微生物群落结构变化。随着机械化酿造设备在白酒行业的应用和逐步推广,机械化酿造方式下环境微生物的分布特征及其与传统酿造方式下环境微生物的相似相异性等,将成为研究的热点。
本次研究以机械化与传统酿造方式下酿造车间环境区域微生物为研究对象,采用高通量测序技术结合数学软件统计分析,对比两种方式下环境微生物群落结构差异性,以期发现酿造车间不同环境区域微生物群落结构的特征,进一步探明机械化酿造方式对环境微生物的影响,从环境微生物的角度为白酒酿造机理提供理论依据,从而提升白酒品质,促进白酒产业转型升级。
1 材料与方法
1.1 材料与试剂
1.1.1 样品及采集方法
环境样本,采集自四川某白酒企业机械化酿造方式、传统酿造方式的酿造车间环境区域的灰尘。机械化白酒酿造车间的拌料、上甑、打量水,机械设备完成,传统白酒酿造车间对应环节,人工操作。样品采集后立即装袋密封,24 h内运回实验室分析,采集样品均在-80 ℃密封保存、备用。
按照酿造车间内的环境区域进行划分,具体环境区域划分及样本情况:浓香型白酒酿造车间内四周墙面区域,因与各酿造环节相距较远,作为非酿造区域的代表,样本编码:机械墙面区域样品:JFN,传统墙面区域样品:CFN,拌料、蒸馏及堆糟环节周围的环境代表酿造非核心区域,样本编码:机械上甑区域样品:JHF,传统上甑区域样品:CHF;摊晾和入窖环节周围的环境代表酿造核心区域,样本编码:机械摊晾区域样品:JHN_T,传统摊晾区域样品:CHN_T,机械窖池区域样品:JHN_J,传统窖池区域样品:CHN_J。
1.1.2 试剂
FastDNA® Spin Kit For Soil,美国MPbio;PBS、引物合成,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
PX124ZH/E型电子分析天平,奥豪斯仪器(常州)有限公司;JE1201型电子天平,上海浦春计量仪器有限公司;YX-24HPD型手提式蒸汽灭菌锅,江阴滨江医疗设备;Vortex-2型旋涡混匀仪,上海沪析实业有限公司;SW-CJ-IFD型洁净工作台,苏州市金净净化设备科技有限公司;DW-HL678型超低温冷冻储存箱,中科美菱低温科技股份有限公司;MiSeq测序仪,美国Illumina公司。
1.3 实验方法
1.3.1 样品总DNA提取
提取步骤参见FastDNA® Spin Kit For Soil的操作说明。
1.3.2 PCR扩增
PCR引物:真菌引物使用ITS1F/ITS2R(5′-CTTGGTCATTTAGAGGAAGTAA-3′/5′-GCTGCGTTCTTC-ATCGATGC-3′),细菌16S rRNA基因引物使用338F/806R(5′-ACTCCTACGGGAGGCAGCAG-3′/5′-GGACTACHVGGGTWTCTAAT-3′)。
PCR扩增程序:95 ℃预变性 3 min,27次循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),然后72 ℃稳定延伸10 min,最后在10 ℃下直到反应停止。
PCR反应体系:细菌:4 μL 5×FastPfu缓冲液,2 μL dNTPs(2.5 mmol/L),0.8 μL上游引物(5 μmol/L),0.8 μL下游引物(5 μmol/L),0.4 μL FastPfu DNA聚合酶,0.2 μL牛血清蛋白,10 ng模板DNA,ddH2O补足至20 μL。真菌:2 μL 10×FastPfu缓冲液,2 μL dNTPs(2.5 mmol/L),0.8 μL上游引物(5 μmol/L),0.8 μL下游引物(5 μmol/L),0.2 μL rTaq聚合酶,0.2 μL牛血清蛋白,10 ng模板DNA,ddH2O补足至20 μL。
1.3.3 Illumina MiSeq测序
利用Illumina公司的MiSeq PE300平台对细菌和真菌序列进行测序分析,上海美吉生物医药科技有限公司。
1.4 数据与图像处理
采用WPS 2021和IBM SPSS 26进行数据计算与分析。基于Illumina MiSeq测序平台绘制群落结构柱形图、微生物热图、Venn图等。
2 结果与分析
2.1 不同酿造方式下酿造车间的环境微生物多样性分析
本研究利用Illumina MiSeq测序技术平台对在不同酿造方式下酿造车间6组环境样本的微生物(真菌、细菌)在OTU水平上进行多样性指数分析,结果如表1所示。
表1 不同酿造方式下酿造车间的环境微生物α多样性指数
Table 1 The alpha diversity index of environmental microorganisms in the brewing workshop under different brewing methods
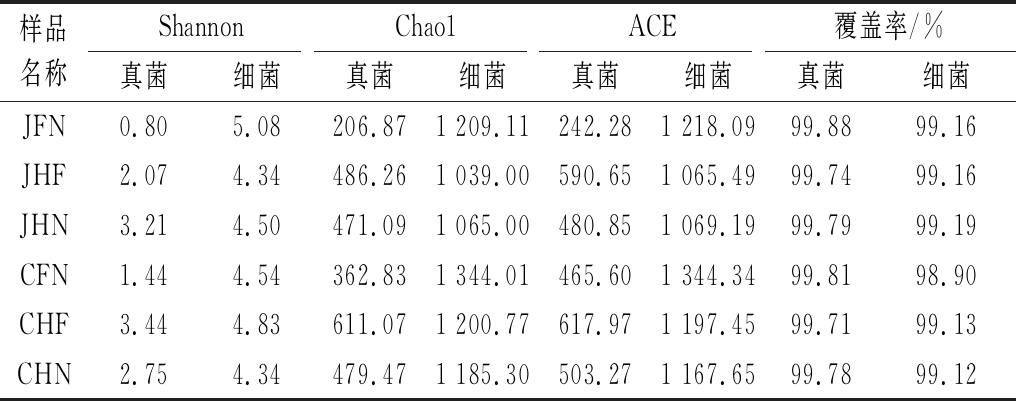
样品名称ShannonChao1ACE覆盖率/%真菌细菌真菌细菌真菌细菌真菌细菌JFN0.805.08206.871 209.11242.281 218.0999.8899.16JHF2.074.34486.261 039.00590.651 065.4999.7499.16JHN3.214.50471.091 065.00480.851 069.1999.7999.19CFN1.444.54362.831 344.01465.601 344.3499.8198.90CHF3.444.83611.071 200.77617.971 197.4599.7199.13CHN2.754.34479.471 185.30503.271 167.6599.7899.12
由表1可知,从各个区域微生物类群来看,细菌的Shannon值、Chao1值和ACE值均高于真菌,说明各个区域中细菌类群比真菌类群更加丰富,原因可能是细菌类群的存活条件相较于真菌类群来说,它具有更好的抗逆性、适应性等[5]。从机械化与传统酿造方式相同区域对比来看,除了Shannon指数的部分数据规律有所区别外,真菌、细菌的Shannon值、Chao1值和ACE值均是传统高于机械化,说明从整体上来看传统酿造区域的微生物种类更加丰富且分布较为均匀。从3组机械化酿造方式下不同区域的样本来看,真菌的Shannon值在酿造核心区最高,说明机械化酿造方式真菌种类在酿造核心区更丰富,原因可能是酿造核心区的摊晾环节会添加富含真菌的大曲,大曲微生物与环境微生物相互影响[6]。
2.2 不同酿造方式下酿造车间的环境微生物群落结构分析
为了进一步分析在机械化与传统酿造方式下酿造车间各个区域的环境微生物群落结构,利用Illumina MiSeq测序技术平台得到在属水平上的微生物群落结构情况。在属水平上,由于相对丰度<0.01的物种较多,因此本研究将样品中相对丰度<0.01的物种归为一类(others)以及其他物种(相对丰度≥0.01)分成为不同的类,绘制群落结构柱形图,结果见图1。

a-真菌;b-细菌
图1 不同酿造方式下各个区域环境微生物基于属水平的群落结构分布图
Fig.1 Community structure distribution map of environmental microorganisms based on genus level in each region under different brewing methods
采用高通量测序技术从不同酿造方式下浓香型白酒酿造车间的6组环境样本中共检测到8个真菌门,28个真菌纲,65个真菌目,159个真菌科,331个真菌属;31个细菌门,82个细菌纲,222个细菌目,411个细菌科,982个细菌属。
由图1-a可知,从机械化酿造方式不同区域3组样本来看,在JFN区域样本中相对丰度排前2种的是枝孢菌属(Cladosporium)、未分类-畸形球菌科(unclassified_f__Teratosphaeriaceae),其相对丰度占比总和为95.09%;在JHF区域样本中相对丰度排前2种的是枝孢菌属、节担菌属(Wallemia),其相对丰度占比总和为79.40%;而在JHN区域样本中相对丰度排前6种的是未分类-畸形球菌科、枝孢菌属、新葫芦科菌属(Neocucurbitaria)、丝孢酵母属(Trichosporon)、曲霉属(Aspergillus)、节担菌属,其相对丰度占比总和为57.00%。这些真菌属的相对丰度均>5%,为各区域的优势菌属。从构成百分比来看,JFN、JHF、JHN区域样本中真菌类群所占构成比例之间均有一定差异。从传统酿造方式不同区域3组样本来看,在CFN区域样本中相对丰度排前2种的是曲霉属、未分类-畸形球菌科,其相对丰度占比总和为88.25%;在CHF区域样本中相对丰度排前4种的是丝核菌属(Rhizoctonia)、曲霉属、未分类-葫芦科(unclassified_f__Cucurbitariaceae)、枝孢菌属,其相对丰度占比总和为53.48%;而在CHN区域样本中相对丰度排前6种的是未分类-子囊菌门(unclassified_p__Ascomycota)、柯达酵母属(Kodamaea)、节担菌属、曲霉属、丝孢酵母属、未分类-双足菌科(unclassified_f__Dipodascaceae),其相对丰度占比总和为72.85%。这些真菌属的相对丰度均>5%,为各区域的优势菌属。从构成百分比来看,CFN、CHF、CHN区域样本中所占构成比例之间均有一定差异。经分析发现,两种酿造方式下酿造车间环境区域共有的优势菌属仅有枝孢菌属、未分类-畸形球菌科、节担菌属、曲霉属、丝孢酵母属,但相同环境区域真菌类群构成具有较大差异。因此,两种酿造方式下各环境区域真菌群落结构呈现不同的构成特征,而且各区域真菌类群构成占比具有较为明显的变化,其主要原因可能是真菌类群之间相互竞争、协同,以及各区域营养条件、环境因素的不同,造成微生物类群此消彼长,从而改变各环境区域真菌群落结构。
由图1-b可知,从机械化酿造方式不同区域3组样本来看,在JFN区域样本中相对丰度排前4种的是风疹菌属(Rubellimicrobium)、奇异球菌属(Deinococcus)、norank_f_norank_o_Chloroplast、葡萄球菌属(Staphylococcus);在JHF区域样本中相对丰度排前2种的是考克氏菌属(Kocuria)、砷球菌属(Arsenicicoccus);而在JHN区域样本中相对丰度排3种的是考克氏菌属、短杆菌属(Brachybacterium)、棒状杆菌属(Corynebacterium)。这些细菌属的相对丰度均>5%,为各区域的优势菌属。从构成百分比来看,考克氏菌属、棒状杆菌属、芽孢杆菌属等共有21种细菌属分别在JFN、JHF、JHN区域样本中构成占比总和均在50%~60%,说明机械化酿造方式不同区域细菌群落结构具有很大的相似性。从传统酿造方式不同区域3组样本来看,在CFN区域样本中相对丰度排前3种的是芽孢杆菌属、Methylobacterium-Methylorubrum、嗜热放线菌属(Thermoactinomyces);在CHF区域样本中相对丰度排前5种的是norank_f_JG30-KF-CM45、Nakamurella、Micropruina、unclassified_f__Nocardiaceae、Microlunatus;而在CHN区域样本中相对丰度排前3种的是魏斯氏菌属(Weissella)、棒状杆菌属、乳酸杆菌属。这些细菌属的相对丰度均>5%,为各区域的优势菌属。从构成百分比来看,魏斯氏菌属、乳酸杆菌属、棒状杆菌属等共有22种细菌属分别在CFN、CHF、CHN区域样本中构成占比总和均在50%~60%,说明传统酿造方式不同区域细菌群落结构具有很大的相似性。经分析发现,两种酿造方式下酿造车间环境区域共有的优势菌属只有棒状杆菌属。因此,两种酿造方式下各环境区域细菌群落结构呈现相似的构成特征,说明机械酿造方式和传统酿造方式的各环境区域的细菌类群具有较好的稳定性,与细菌类群的抗逆性、适应性较强有关;而两种酿造方式相同环境区域细菌类群构成具有较大差异,除与真菌类群一样,受到微生物相互作用、营养及环境条件的影响以外,还可能与传统酿造车间是开放式环境,各区域细菌类群受糟醅和大曲微生物影响较大[7]。
2.3 不同酿造方式下酿造车间的环境微生物群落变化分析
为了深入分析机械化与传统酿造方式环境微生物群落的变化,进一步将酿造车间非酿造区、酿造非核心区及酿造核心区(摊晾、窖池区域)进行统计分析。利用Illumina MiSeq测序技术平台得到在属水平上丰度前30的微生物群落Heatmap图,如图2所示,图中颜色越接近红色表示相对丰度越高,颜色越接近绿色表示相对丰度越低。

a-真菌;b-细菌
图2 不同酿造方式下下各个环境样品中微生物在属水平上的Heatmap图
Fig.2 Heatmap of microorganisms at the genus level in each environmental sample under different brewing methods
由图2-a可知,在真菌属水平上,从机械化酿造方式不同区域来看,JHN_T区域中有17种相对丰度>1%的微生物,但在JFN、JHF及JHN_J区域中分别对应有2、7、9种相对丰度>1%的微生物。JHN_T区域中相对丰度较高的真菌属分别有新葫芦科菌属、嗜热子囊菌属(Thermoascus)、德巴利氏酵母属(Debaryomyces)、嗜热真菌属(Thermomyces)等。嗜热子囊菌属在JFN、JHF、JHN_T、JHN_J区域中相对丰度分别为0.004 2%、0.008 5%、6.00%、0.17%,该菌属是大曲和酒醅中的优势微生物,能够产蛋白酶、淀粉酶等多种酶类,对白酒产香具有促进作用[8]。可以认为,机械化酿造方式摊晾区域真菌类群种类较多且丰度较高,原因可能是机械化酿造车间处于半开放式的环境,摊晾区域的环境微生物受到大曲微生物的影响较大。经分析发现,还有一些微生物在窖池区域中的相对丰度最高,如节担菌属、丝孢酵母属、曲霉属、Apiotrichum等。丝孢酵母属在JFN、JHF、JHN_T、JHN_J区域中相对丰度分别为0.002 1%、0.39%、6.90%、12.38%,该菌属能够代谢产生多元醇,使白酒具备醇甜味[9]。曲霉属在JFN、JHF、JHN_T、JHN_J区域中相对丰度分别为0.27%、1.38%、3.64%、12.65%,该菌属是大曲和糟醅中的重要微生物,并能够在酒醅发酵中代谢产生白酒呈香呈味的重要风味物质或者风味前体物质[10]。除此之外,枝孢菌属在JFN、JHF区域中相对丰度均较高,分别为80.19%、72.20%,而在JHN_T、JHN_J区域中相对丰度分别为20.60%、0.53%。有研究发现[11],枝孢菌属在自然界中广泛存在,尤其是墙面区域最容易富集,对于白酒酿造的影响,还有待进一步研究。从传统酿造方式不同区域来看,CFN区域中只有5种相对丰度>1%的微生物,但在CHF、CHN_T、CHN_J区域中分别对应有15、13、13种相对丰度>1%的微生物。CHF、CHN_T、CHN_J 3个区域中相对丰度较高的真菌属有丝孢酵母属、嗜热子囊属、假丝酵母属(Candia)等共13种,这些真菌属在JHN_T区域中也有检测到。其中,丝孢酵母属在CHF、CHN_T、CHN_J区域中相对丰度分别为4.22%、2.71%、8.18%,但在CFN区域中相对丰度为0.12%。柯达酵母属在CFN、CHF、CHN_T、CHN_J区域中相对丰度分别为0.002 1%、0.021%、37.49%、0.15%,该菌属是一类能够对生物胺进行降解的菌株[12],在机械化酿造方式下各区域的相对丰度均<1%。可以认为,传统酿造方式的酿造核心区、非核心区域的真菌类群相对丰度均较高,原因可能是传统酿造车间处于开放式的环境,大曲、糟醅微生物与环境微生物相互影响,且该区域环境条件、营养状况适于真菌类群的生长和繁殖。
由图2-b可知,在细菌属水平上,从机械化酿造方式不同区域来看,JFN、JHF、JHN_T、JHN_J区域中相对丰度>1%的微生物均衡分布,分别对应有12、13、15、15种细菌属。JFN、JHF、JHN_T、JHN_J 4个区域中至少有两个区域相对丰度均较高的细菌属有考克氏菌属、短杆菌属、Knoellia、魏斯氏菌属等共15种。其中,Knoellia在JFN、JHF、JHN_T、JHN_J区域中的相对丰度均较高,分别为1.25%、1.62%、4.87%、1.96%。可以认为,细菌类群因耐受性、适应性更强,在机械化酿造方式的车间环境区域内较为稳定。魏斯氏菌属在JFN、JHF、JHN_T、JHN_J区域中相对丰度分别为0.19%、1.24%、0.22%、1.53%,该属能够代谢产乳酸、乙酸等有机酸类物质,并有助于乳酸乙酯的生成和酒体风味的形成[13]。除此之外,棒状杆菌属只在JHN_J区域中相对丰度最高为10.44%,而在JFN、JHF、JHN_T区域中的相对丰度分别为0.78%、0.17%、0.13%,该菌属可通过糖酵解途径,利用二羟酸脱水酶、转氨酶等酶的作用形成L-异亮氨酸,进一步代谢产生酒体中的风味物质[14]。乳酸杆菌属只在JHN_J区域中相对丰度最高为3.77%,而在JFN、JHF、JHN_T区域中的相对丰度分别为0.47%、0.30%、0.39%,该菌属是酒醅中的优势菌属,主要代谢产生乳酸,在发酵体系中经生化反应合成多种呈香呈味物质,如乳酸乙酯[15]。从传统酿造方式不同区域来看,CFN、CHF、CHN_T、CHN_J区域中相对丰度>1%的微生物分布较为均衡,在CFN、CHF、CHN_T、CHN_J区域中分别对应有10、13、12、12种相对丰度>1%细菌属,主要集中在CHF、CHN_T两个区域。CFN、CHF、CHN_T、CHN_J 4个区域中相对丰度较高的细菌属有考克氏菌属、Microbacterium、双鱼属(Piscicoccus)、魏斯氏菌属等共12种。考克氏菌属在CHF、CHN_T区域中的相对丰度均较高,分别为1.76%、3.24%,但在CFN、CHN_J区域中的相对丰度分别为0.36%、0.75%,该菌属具有较强的产酸能力,并且利于合成白酒中乙酸乙酯等关键香气物质[16]。因此,传统酿造方式不同区域细菌类群在CHF、CHN_T两个区域相对丰度较高,其原因主要是受糟醅、大曲细菌类群的影响及其微生物之间相互作用。经研究发现,芽孢杆菌属在CFN、CHN_J区域中相对丰度均较高,分别为30.87%、1.18%,而在CHF、CHN_T区域中相对丰度分别为0.21%、0.72%,该菌属具有很好的耐热性质,是一类能够代谢产生吡嗪类化合物菌株,而吡嗪类化合物是白酒中具有重要作用的风味物质。高温放线菌属只在CFN区域中相对丰度最高为4.95%,而在CHF、CHN_T、CHN_J区域中相对丰度分别为0.007%、0.55%、0.07%,该菌属是大曲中重要的核心功能细菌微生物,有较强的耐高温特性,具有产高温淀粉酶、蛋白酶等能力[17]。
2.4 不同酿造方式下酿造车间的环境微生物差异性分析
为了对比分析机械化与传统酿造方式不同区域的环境微生物,利用Illumina MiSeq测序技术平台将各个区域的微生物进行统计分析获得Venn图。LEfSe统计方法分析两种酿造方式酿造核心区的差异微生物,并结合Wilcoxon秩和检验对环境区域的2组样品的差异微生物相对丰度进行评价,结果如图3、图4所示。
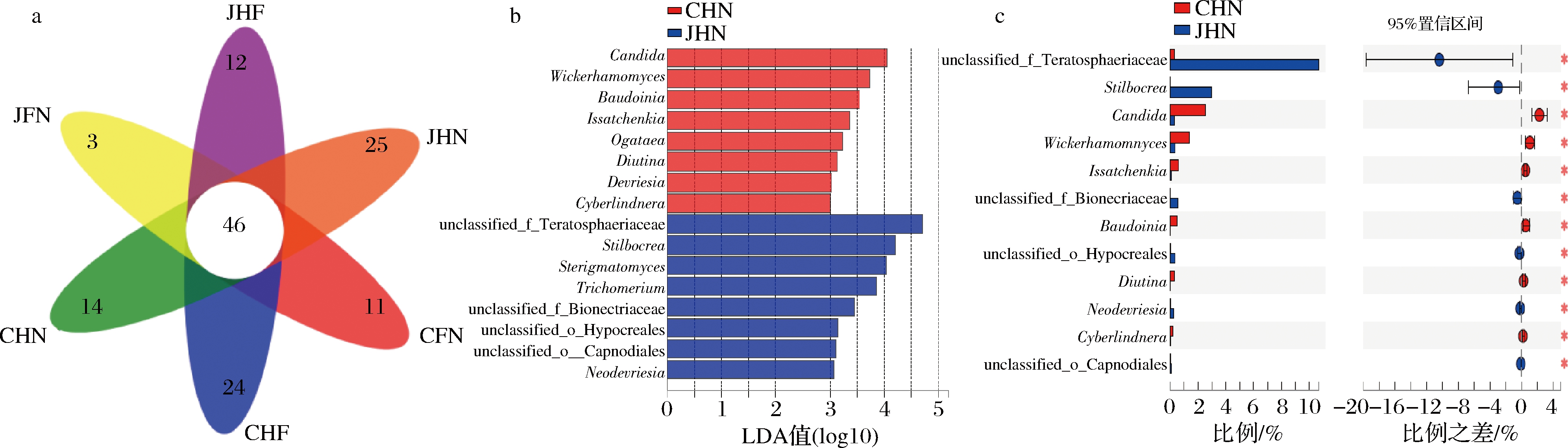
a-Venn图;b-LDA柱形图;c-两组比较秩和检验条形图
图3 真菌Venn图、真菌LDA柱形图、真菌两组比较秩和检验条形图
Fig.3 Fungal Venn diagram, fungal LDA histogram, fungal rank sum test bar graph comparing two groups
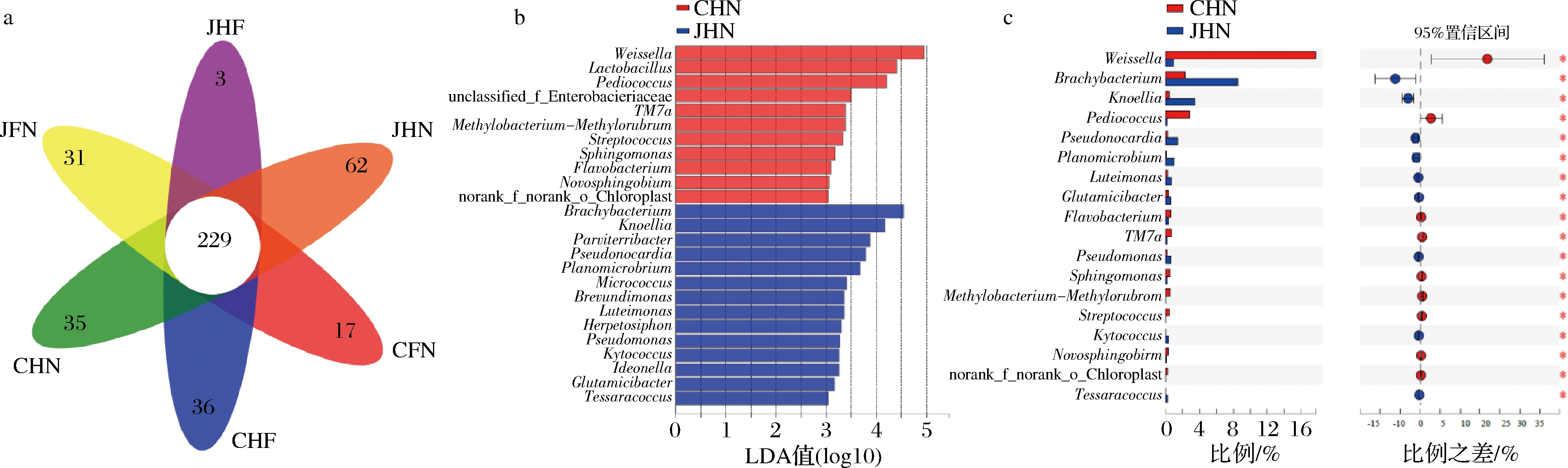
a-Venn图;b-LDA柱形图;c-两组比较秩和检验条形图
图4 细菌Venn图、细菌LDA柱形图、细菌两组比较秩和检验条形图
Fig.4 Bacterial Venn diagram, bacterial LDA histogram, bacterial rank sum test bar graph comparing two groups
由图3-a可知,机械化与传统酿造方式不同区域共有真菌属达46种,其共有真菌属在各环境区域的真菌属种类中占比为13.90%。从机械化与传统酿造方式相同区域对比来看,机械化酿造方式酿造核心区具有仅在该区域检出Septoria、Cercophora、Funbolia等共25种特有真菌属,传统酿造方式酿造核心区具有Butlerelfia、Paraboeremia、Corynespora等共14种特有真菌属。机械化与传统酿造方式核心酿造区分别检出的特有微生物均是文献报到的酿造环境中不常见且相对丰度较低的真菌类群。因此,机械化与传统酿造方式核心区域真菌种类具有较大差异,主要原因可能是两种方式下酿造核心区域环境条件及营养状况存在差异,以及与微生物之间的相互作用有关。由图3-b、图3-c可知,机械化与传统酿造方式酿造核心区两组环境样品中在真菌属水平上共检测出16种(LDA>3)差异微生物,其中未分类-畸形球菌科、Neodevriesia、未分类-煤炱目(unclassified_o_Capnodiales)、unclassified_o__Hypocreales、unclassified_f__Bionectriaceae共6种差异真菌相对丰度均是机械化酿造方式显著高于传统酿造方式(P<0.05);假丝酵母属、威克汉姆酵母属(Wickerhamomyces)、伊萨酵母属(Issatchenkia)、石竹菌属(Baudoinia)、Diutina、Cyberlindnera共6种差异真菌相对丰度均是传统酿造方式显著高于机械化酿造方式(P<0.05)。这些真菌差异微生物中,除了未分类-畸形球菌科、Stilbocrea、假丝酵母属、威克汉姆酵母属外,其余真菌类群相对丰度均<1%。两种酿造方式酿造核心区中共检测到多种酵母菌,如假丝酵母属、威克汉姆酵母属及伊萨酵母属等,均为大曲功能微生物[18]。威克汉姆酵母属在白酒发酵过程具有发酵力和产香能力,其代谢产生的苯乙醇具有玫瑰花香[19]。
由图4-a可知,机械化与传统酿造方式不同区域共有细菌属达229种,其共有细菌属在各环境区域的细菌属种类中占比为23.32%。从机械化与传统酿造方式相同区域对比来看,机械化酿造方式酿造核心区具有Geovibrio、Tenggerimyces、Tistlia等共62种特有细菌属,传统酿造方式酿造核心区具有Pelosinus、Anaerococcus、Pricia等共35种特有细菌。机械化与传统酿造方式核心酿造区分别检出的特有微生物均是文献报到的酿造环境中不常见且相对丰度较低的细菌类群。因此,机械化与传统酿造方式核心区域细菌种类具有一定差异,主要原因可能是细菌类群的环境应答[20]以及与真菌类群的相互作用有关。由图4-b、图4-c可知,机械化与传统酿造方式酿造核心区两组环境样品中在细菌属水平上共检测出25种(LDA>3)差异微生物。其中短杆菌属、Knoellia、Pseudonocardia、扁菌属(Planomicrobium)、黄体单胞菌属(Luteimonas)、谷氨酸杆菌属(Glutamicibacter)、假单胞菌属(Pseudomonas)、Kytococcus、球菌属(Tessaracoccus)共9种差异细菌相对丰度均是机械化酿造方式显著高于传统酿造方式(P<0.05)。魏斯氏菌属、片球菌属(Pediococcus)、黄杆菌属(Flavobacterium)、链球菌属(Streptococcus)、TM7a、Sphingomonas、Novosphingoium、Methylobacterium-Methylorubrum及norank_f_norank_o_chloroplast共9种差异细菌相对丰度均是传统酿造方式显著高于机械化酿造方式(P<0.05)。两种酿造方式酿造核心区细菌差异微生物中,除了魏斯氏菌属、短杆菌属、诺氏菌属、片球菌属、假单胞菌属外,其余细菌类群相对丰度均<1%。其中,短杆菌属等微生物对白酒酿造具有重要作用,该菌属产酯化酶、过氧化氢酶等多种酶类,可以为白酒酿造提供酶类,产生丰富的风味物质[21]。
综上所述,机械化与传统酿造方式不同区域共有微生物所占比例是细菌高于真菌。可以初步分析,由于机械化酿造方式对于环境因子的改变以及微生物的相互作用等原因,导致了真菌类群在种类和相对丰度上具有一定差异,而对于细菌类群也有一定影响,如枝孢菌属、风疹菌属、顶孢属(Acremonium)、副球菌属(Paracoccus)等微生物,而传统酿造方式下在连续的白酒生产过程中微生物得以不断驯化和富集,如曲霉属、魏斯氏菌属、假丝酵母属、醋酸杆菌属(Acetobacter)等微生物。同时还发现,丝孢酵母属、嗜热子囊属、考克氏菌属等与白酒酿造相关的微生物在机械化酿造方式下得以富集。但是,白酒生产是一个开放、连续的生产过程,由于稻壳、粮食的不断补充,导致车间内外的微生物交换,并且因空气流动等原因各环节之间微生物又相互影响,而这些微生物的适应性较强,使得传统酿造方式下自然富集的微生物难以形成绝对优势。因此,连续的白酒生产过程有利于酿造功能菌属的富集,进而对白酒生产产生影响。
3 结论
采用高通量测序技术对机械化与传统酿造方式酿造车间的非酿造区、酿造非核心区、酿造核心区的环境微生物进行检测并利用测序平台分析,共检测出8个真菌门、331个真菌属;31个细菌门、982个细菌属。从微生物多样性分析结果来看,不同酿造方式的酿造车间内环境微生物种类较为丰富但有一定差异,可能与传统酿造的开放式环境有关;从两种酿造方式不同区域的微生物群落构成分析,真菌类群构成呈现不同的特征,而细菌类群构成呈现相似的特征;两种酿造方式的相同区域微生物群落构成比较,发现真菌类群构成具有一定差异性,而细菌群落构成具有较大的差异性。通过对两种酿造方式下不同区域微生物类群的变化情况分析,发现机械化酿造车间环境中真菌类群主要集中在摊晾区域,而细菌类群在所有区域中均衡分布;传统酿造车间环境中真菌类群在酿造非核心区及酿造核心区(摊晾区域、窖池区域)相对丰度较高,而细菌类群在所有区域分布较为均衡,但主要集中在酿造非核心区、酿造核心区的摊晾区域。经机械化与传统酿造方式环境微生物的差异分析,发现两种酿造方式所有区域共有46种真菌属,其中枝孢菌属、未分类-畸形球菌科、节担菌属、曲霉属、丝孢酵母属为共有优势微生物;共有229种细菌属,其中棒状杆菌属为共有优势微生物。从酿造核心区差异微生物分析结果来看,机械化酿造方式酿造核心区具有Septoria、Cercophora、Funbolia等共25种特有真菌属,且具有Geovibrio、Tenggerimyces、Tistlia等共62种特有细菌属;传统酿造方式酿造核心区具有Butlerelfia、Paraboeremia、Corynespora等共14种特有真菌属,且具有Pelosinus、Anaerococcus、Pricia等共35种特有细菌属。这些核心酿造区分别检出的特有微生物,均是酿造环境中不常见且相对丰度较低的微生物类群。可以初步分析,由于机械化操作方式对于环境因子的改变以及微生物的相互作用等原因,导致了真菌类群在种类和相对丰度上具有一定差异,而对于细菌类群也有一定影响,如枝孢菌属、风疹菌属、顶孢属(Acremonium)、副球菌属(Paracoccus)等微生物,以及与白酒酿造相关的微生物,如丝孢酵母属、嗜热子囊属、考克氏菌属等,而传统酿造方式下在连续的白酒生产过程中微生物得以不断驯化和富集,如曲霉属、魏斯氏菌属、假丝酵母属、醋酸杆菌属(Acetobacter)等微生物。
本次研究以机械化和传统酿造方式下各环境区域采集的灰尘为环境样本,未有涉及空气微生物等环境样本的研究。采集的样本数量、样本区域,还需进一步拓展。研究中发现的一些微生物,如枝孢菌属、Knoellia、Kytococcus等微生物对于白酒酿造的影响,有待进一步解析。研究中检测到的Fusicolla、假单胞菌属等微生物,在其他香型白酒的酿造环境中也有发现,这些微生物与白酒酒体风格特征形成的关联,还有待进一步研究。今后,研究中发现的环境微生物,特别是差异性菌属,对于酿造区域环境的应答特性、迁移规律以及对白酒酿造的影响,还需进一步深入分析和跟踪研究。
[1] 李丽, 赵盈盈, 曾娟, 等.传统固态发酵白酒的酿酒微生物区系研究概况[J].酿酒科技, 2014(5):79-83.
LI L, ZHAO Y Y, ZENG J, et al. A review of the research on microflora in liquor-making by traditional solid fermentation[J]. Liquor-Making Science & Technology, 2014(5):79-83.
[2] 刘宇, 管桂坤, 万自然, 等.浓香型白酒酿造环境中酵母的筛选及其组合发酵特性[J].酿酒科技, 2021(10):140-144.
LIU Y, GUAN G K, WAN Z R, et al. Screening of yeasts in the production environment of Nongxiang Baijiu and their combined fermentation characteristics[J]. Liquor-Making Science & Technology, 2021(10):140-144.
[3] 黎瑶依, 胡小霞, 黄永光.茅台镇酱香型白酒酿造环境中真菌菌群多样性分析[J].食品科学, 2021, 42(18):164-170.
LI Y Y, HU X X, HUANG Y G. Analysis of the diversity of fungal flora in Maotai-flavor liquor brewing environment in Maotai town[J]. Food Science, 2021, 42(18):164-170.
[4] 王欢, 席德州, 黄永光, 等.酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性分析[J].食品科学, 2020, 41(2):188-195.
WANG H, XI D Z, HUANG Y G, et al. Bacterial community structure and diversity in different stacking fermentation rounds in mechanized Maotai-flavor liquor brewing[J]. Food Science, 2020, 41(2):188-195.
[5] 姜雪薇, 马大龙, 臧淑英, 等.高通量测序分析大兴安岭典型森林土壤细菌和真菌群落特征[J].微生物学通报, 2021, 48(4):1 093-1 105.
JIANG X W, MA D L, ZANG S Y, et al. Characteristics of soil bacterial and fungal community of typical forest in the Greater Khingan Mountains based on high-throughput sequencing[J]. Microbiology China, 2021, 48(4):1 093-1 105.
[6] 张霞, 雷学俊, 刘芳, 等.五粮液车间空气中的特征酵母菌及其挥发性风味物质分析[J].食品与发酵工业, 2021, 47(17):242-249.
ZHANG X, LEI X J, LIU F, et al. Typical yeasts in workshop air of Wuliangye and main flavor compounds[J]. Food and Fermentation Industries, 47(17):242-249.
[7] 陈蒙恩, 赵聪, 韩素娜, 等.基于高通量测序的陶融型大曲微生物群落结构分析[J].食品科学, 2021, 42(8):106-113.
CHEN M G, ZHAO C, HAN S N, et al. High-throughput sequencing reveals the microbial community structure in Taorong-type Daqu[J]. Food Science, 2021, 42(8):106-113.
[8] 郭敏, 黄永光, 邱树毅, 等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造, 2017, 36(5):146-151.
GUO M, HUANG Y G, QIU S Y, et al. Application of high-throughput sequencing in microbial diversity of Moutai-flavor Baijiu[J]. China Brewing, 2017, 36(5):146-151.
[9] 王晓丹, 白晓燕, 朱国军, 等.产多元醇酵母对酱香型白酒发酵的强化应用[J].食品工业, 2021, 42(2):162-166.
WANG X D, BAI X Y, ZHU G J, et al. Application of yeast producing polyhydric alcohol in Moutai-flavour liquor and spirits fermentation[J]. The Food Industry, 2021, 42(2):162-166.
[10] 吴树坤, 谢军, 卫春会, 等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学, 2019, 40(14):144-152.
WU S K, XIE J, WEI C H, et al. Comparison of microbial community structure of starter cultures (Daqu) for Luzhou-flavor liquor in different regions of Sichuan[J]. Food Science, 2019, 40(14):144-152.
[11] 相里加雄, 曹苗文, 杨凯环, 等.清香型白酒不同酿造工艺下环境微生物群落结构差异[J].酿酒, 2022, 49(1):118-123.
XIANGLI J X, CAO M W, YANG K H, et al. Differences in environmental microbial community structure of lightflavor Baijiu under different fermenting technologies[J]. Liquor Making, 2022, 49(1):118-123.
[12] 曾玉雪, 罗惠波, 余东, 等.浓香型大曲中降解生物胺菌株的筛选及应用[J].食品与发酵工业, 2021, 47(8):145-151.
ZENG Y X, LUO H B, YU D, et al. Screening and application of biogenic amines degrading strain derived from Luzhou-flavor Daqu[J]. Food and Fermentation Industries, 2021, 47(8):145-151.
[13] BA-AKDAH M A, SATHEESH S.Characterization and antifouling activity analysis of extracellular polymeric substances produced by an epibiotic bacterial strain Kocuria flava associated with the green macroalga Ulva lactuca[J].Acta Oceanologica Sinica, 2021, 40(4):107-115.
[14] 张春林. 泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学, 2012.
ZHANG C L.The relationship between quality, microorganisms and flavour components of Luzhou Laojiao Daqu[D].Wuxi:Jiangnan University, 2012.
[15] 韩兴林, 崔磊, 常强, 等.浓香白酒发酵过程中酒醅微生物结构分析[J].酿酒, 2021, 48(1):81-86.
HAN X L, CUI L, CHANG Q, et al. Structural analysis for microorganisms in fermented grains of Chinese strong-flavor Baijiu fermentation[J]. Liquor Making, 2021, 48(1):81-86.
[16] HU Y L, LEI X Y, ZHANG X M, et al.Characteristics of the microbial community in the production of chinese rice-flavor Baijiu and comparisons with the microflora of other flavors of Baijiu[J].Frontiers in Microbiology, 2021, 12:673670.
[17] 冯慧军, 翟磊, 程坤, 等.高温放线菌属研究进展[J].食品与发酵工业, 2017, 43(11):257-261.
FENG H J, ZHAI L, CHENG K, et al. The research advance of genus Thermoactinomyces[J]. Food and Fermentation Industries, 2017, 43(11):257-261.
[18] 谭崇尧, 徐军.高通量测序法对不同地域浓香型大曲微生物结构的分析[J].酿酒科技, 2018(9):118-122.
TAN C Y, XU J. Analysis of microbial structure of Nongxiang Daqu from different regions by high-throughput sequencing[J]. Liquor-Making Science & Technology, 2018(9):118-122.
[19] LIU P L, XIONG X M,WANG S, et al.Population dynamics and metabolite analysis of yeasts involved in a Chinese miscellaneous-flavor liquor fermentation[J].Annals of Microbiology, 2017, 67(8):553-565.
[20] 赵鹏宇, 白雪, 燕平梅, 等.华北落叶松林土壤细菌群落结构与表型的环境异质性响应[J].林业科学, 2021, 57(7):101-110.
ZHAO P Y, BAI X, YAN P M, et al. Responses of soil bacterial community structure and phenotype to soil heterogeneity in Larix principis-rupprechtii forest[J]. Scientia Silvae Sinicae, 2021, 57(7):101-110.
[21] 刘小丹, 董继胜, 姬铁强, 等.一种来源于Brachybacterium sp.DB5的α-半乳糖苷酶克隆及性质研究[J].生物技术进展, 2015, 5(4):310-314.
LIU X D, DONG J S, JI T Q, et al. Studies on the gene cloning and its characterization of α-galactosidases from Brachybacterium sp. DB5[J]. Current Biotechnology, 2015, 5(4):310-314.