酒精进入人体后首先经过血液进入肝脏,通过肝脏功能代谢分解,主要对肝脏造成严重压力。短期饮酒会造成呕吐、记忆力减退、情绪不稳定等神经问题。长期过量饮酒可能会造成脂肪肝、酒精性肝炎及肝硬化等疾病。酒精中毒和酒精造成的损伤已成为普遍问题。饮酒后可能主要对体内产生氧化应激刺激,在体内产生过多的自由基。自由基过多及清除自由基时可能会发生自由基防御体系障碍,会引起过氧化反应而对机体产生伤害。自由基积累增多会引起细胞、组织的结构和功能发生改变,进而造成氧化损伤,同时还能引起机体炎症的发生。细胞自噬是细胞内依赖溶酶体介导的长寿命蛋白质或受损细胞器降解的主要机制。自噬在真核生物中普遍存在,在胚胎发育、细胞自我保护以及生存等生理、病理过程中发挥关键作用[1]。细胞通过响应应激信号,如营养缺乏,会迅速启动自噬信号通路,形成闭合的双层膜结构,包裹细胞内错误折叠的/长寿命蛋白、受损细胞器或侵入的病原体,与溶酶体融合,形成自噬溶酶体进行降解并回收利用降解产物以应对不利环境[2]。炎症是微生物病原体感染或组织损伤所激活的机体保护性反应。细胞自噬与炎症反应密切相关,模式受体Toll样受体的激活能够诱导细胞自噬的发生,而细胞自噬又对炎症反应有调控作用[3-5]。
中国白酒含有复杂的成分。其中包含多种小分子活性肽,小分子活性肽具有清除体内过量氧自由基活性氧自由基(reactive oxygen species,ROS),保护线粒体结构,减少脂质过氧化,提高机体免疫力,抗疲劳,调节免疫、抗肿瘤、促进酒精代谢等功能。霍嘉颖等[6]采用直接浓缩并结合液液萃取法从芝麻香型白酒中分离纯化出一种三肽,并通过高效液相色谱-四极杆飞行时间质谱联用仪确定其氨基酸序列为 Arg-Asn-His(RNH),含量为(18.78±0.34) μg/L。进一步研究发现,RNH通过增加细胞内抗氧化酶包括过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物(glutathione peroxidase, GSH-PX)酶的活性来清除氧化损伤产生的ROS,同时可以抑制过氧化产物丙二醛(malondialdehyde,MDA)含量的上升,从而提高细胞抗氧化能力[7]。WU[8]等在一种芝香型白酒中检测出短肽Ala-Lys-Arg-Ala(AKRA),并发现其在HepG2细胞中可以减少ROS的生成,增加SOD活性,并减少MDA的含量,有具有一定的抗氧化作用,但未进一步深入探讨其作用机理。除RNH、AKRA外,还有2条抗氧化肽曾被报道过,其氨基酸序列分别为Pro-His-Pro(PHP)[9]和Asp-Arg-Ala-Arg(DRAR)[10]。
目前关于短肽AKRA的相关功能研究较少,仅初步通过体外实验判断其具有一定的抗氧化能力,但这种抗氧化能力的具体作用机理还未进行深入研究。本研究通过人正常肝细胞,对短肽AKRA的抗氧化作用,调控细胞自噬和抑制炎症反应的具体机理进行了进一步研究,并通过酒精性肝损伤模型观察了AKRA对酒精性肝损伤在体内的保护效应。
1 材料与方法
1.1 材料与试剂
Ala-Lys-Arg-Ala(AKRA),纯度≥98%,由超纯水配制为150 g/L,吉尔生化有限公司;人正常肝细胞LO2购买于国家实验细胞资源共享服务平台;实验动物由斯贝福生物技术有限公司提供,为49~56日龄雄性C57BL/6 J小鼠,体重18~22 g,动物的饲养温度为(23±2) ℃,相对湿度为(50±5) %,光照时间12 h/d,自由饮食,5 只/笼,合笼饲养,实验动物的相关处理均严格遵守实验动物福利伦理与保护相关规定,并随时接受实验动物伦理委员会的监督与检查,许可证号为 (JK)2021-W-003;RPMI-1640培养基、双抗HyClone青链霉素、0.25 %胰蛋白酶,美国Gibco公司;CCK-8,日本Dojindo公司;胎牛血清(fetal bovine serum,FBS)、AAPH,美国Sigma-Aldrich公司;Lysis Buffer细胞裂解液,北京康为世纪生物科技有限公司;核蛋白分步提取试剂盒BB-3104,贝博生物;CAT、GSH、SOD、MDA、总胆固醇(total cholesterol,T-cho/ TC)、血清中甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein, HDL)、低密度脂蛋白(low density lipoprotein, LDL)、谷草转氨酶(aspartate aminotransferase,AST)和谷丙转氨酶(alanine aminotransferase,ALT),南京建成生物技术研究所;脱脂牛奶、BCA试剂盒,北京索莱宝科技有限公司;5×蛋白质上样缓冲液(P1040),索莱宝公司;Marker(1610374),BIO-RAD公司;一抗:核因子E-2-相关因子(nuclear factor erythroid-2-related factor 2,Nrf2) (16396-1-AP)、Kelch样ECH关联蛋白1(Kelch-like ECH-associated protein 1, Keap1) (10503-2-AP)、炎性因子核因子κB (nuclear factor kappa-B, NF-κB) (10745-1-AP)、一氧化氮合酶(inducible nitric oxide synthase,INOS) (18985-1-AP)、环氧化酶(cyclooxygenase,COX2) (12375-1-AP),英国Proteintech公司;LC3(PM036),P62(PM045),日本MBL公司;3-磷酸甘油醛脱氢酶(5174S) (glyceraldehyde-3-phosphate dehydrogenase,GAPDH),CST公司;二抗:Rabbit(7074S),CST公司;ECL曝光液,聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF), 美国Merck millipore公司。
1.2 仪器与设备
Milli-Q超纯水仪,美国Millipore公司;细胞培养箱,美国赛默飞科技有限公司;SpectraMax iD3多功能酶标仪,美国Molecular Devices公司;高速冷冻离心机,美国赛默飞科技有限公司;标准电泳装置, 美国Bio-Rad公司;标准湿式转膜装置,北京百晶生物技术有限公司;ChemiScope 6200 Touch科学发光成像系统,上海勤翔科学仪器有限公司。
1.3 实验方法
1.3.1 细胞培养
用含10%(体积分数)FBS与1%(体积分数)双抗的RPMI-1640培养液于5% CO2、37 ℃的细胞培养箱中培养LO2细胞,该细胞属于单层贴壁生长细胞,待细胞贴壁达到80%~90%时,使用体积分数为0.25%的胰蛋白酶消化传代,每2~3 d进行1次传代。
1.3.2 细胞存活率测定
取处于指数生长期的LO2细胞,加入适量0.25%胰蛋白酶消化约3 min。用含10%FBS与1%双抗的RPMI-1640的培养液,接种于96孔板,每孔100 μL,接种细胞量为1.6×104每孔。分为空白组、正常对照组和不同剂量AKRA组(AKRA浓度为0~6.4 mg/mL),每组3个平行。置于恒温培养箱中培养24 h后,取出培养板,每孔加入100 μL CCK8预混液[V(完全培养液)∶V(CCK8)=9∶1],置于培养箱中继续培养2 h, 采用SpectraMax iD3酶标仪于450 nm 波长处测定每孔的吸光度值,测定完成后按照公式(1)计算细胞存活率:
细胞存活率![]()
(1)
式中:OD实验组为测定孔读数数值;OD空白孔为无添加读数数值;OD正常对照组为只加1640培养基处理细胞读数数值。
1.3.3 AKRA对氧化损伤细胞内MDA含量和抗氧化酶活性的影响
取处于指数生长期的LO2细胞,加入1 mL 0.25%胰蛋白酶消化约3 min。用含10%FBS与1%双抗的RPMI-1640的培养液,接种于6孔板,每孔2 mL, 接种细胞量为2×105每孔。分为空白对照组、AAPH处理组(400 μmol/L)、低剂量AKRA组(AKRA质量浓度为1 mg/mL)、中剂量AKRA组(AKRA质量浓度为3 mg/mL)和高剂量AKRA组(AKRA质量浓度为6 mg/mL),首先用AKRA对细胞进行预处理21 h, 然后再用AKRA+AAPH同时处理3 h,经由冷PBS清洗2次后,用Lysis Buffer裂解细胞,取上清液严格按照BCA试剂盒说明书进行蛋白浓度的测定,同时,测定脂质氧化产物MDA、抗氧化酶(CAT、SOD)活力和GSH含量。
1.3.4 蛋白免疫印迹
在收集的蛋白样品中加入5×蛋白上样缓冲液, 98 ℃金属浴加热5 min。将蛋白样品上样到SDS-PAGE胶加样孔,通过Bio-Rad的标准电泳装置,每块胶以电流为20 mA的电流强度进行恒流电泳。在目的蛋白泳动至距胶下缘1 cm以上时结束或在溴酚蓝到达胶的底端处附近即可停止电泳,关闭电源,进行转膜。使用标准湿式转膜装置,将目的蛋白转移至PVDF膜,转膜电压为120 V,转膜时间为60 min。转膜完毕后,把PVDF膜放置到含5%(体积分数)脱脂牛奶的TBS/T溶液 (tris-HCl tween)中,室温封闭60 min。封闭结束,用封闭缓冲液稀释一抗,室温下孵育2 h,使用TBS/T缓冲液,重复洗涤3次,每次5 min。用封闭缓冲液稀释二抗,室温下孵育40 min。使用TBS/T缓冲液,重复洗涤3次,每次5 min。利用ChemiScope 6200 Touch科学发光成像系统进行显影。使用Image J对蛋白进行半定量分析。
1.3.5 实验动物分组与造模
实验小鼠适应性喂养一周后,将50只小鼠随机分成5组,分别为空白对照、食用酒精组、低剂量AKRA组、中剂量AKRA组、高剂量AKRA组。其中食用酒精组、AKRA低剂量组、AKRA中剂量组、AKRA高剂量组分别灌胃120 μL的 52%vol食用酒精,空白组灌胃等剂量生理盐水。其中AKRA低剂量组、AKRA中剂量组、AKRA高剂量组分别每天注射0.1 g/kg bw AKRA、0.2 g/kg bw AKRA和0.4 g/kg bw AKRA,30 d,最后一次注射后禁食不禁水,8 h后,眼球取血,颈椎脱臼处死小鼠,取肝脏组织和血液进行后续实验,其中,将右半部肝脏组织通过10%(体积分数)中性多聚甲醛固定制备石蜡切片,肝脏组织病理学变化采用苏木精-伊红染色法(hematoxylin-eosin staining, HE)染色后观察;其余肝脏组织存于-80 ℃冰箱低温保存备用。
1.3.6 小鼠肝脏组织病理学检查
肝脏组织用10%中性多聚甲醛固定24 h后转入70%(体积分数)酒精溶液中脱水处理24 h,常规石蜡包埋后制作厚度约4 μm的切片,使用C8H10进行脱蜡处理,酒精梯度(95%、90%、80%、75%,体积分数)脱水;苏木精染色;盐酸醇分化;0.5%伊红染色后常规梯度酒精(75%、80%、90%、95%,体积分数)脱水后经100%乙醇Ⅰ(10 min),100%酒精Ⅱ(10 min);最后经二甲苯透明后中性树胶封片,在Nikon光学显微镜Eclipse Ci-L下,选取不同的视野拍照并分析肝脏组织病理学变化。
1.3.7 小鼠肝功能和血脂水平的检测
小鼠眼球取血,静置时间30 min,经3 000 r/min离心10 min,得到血清,并将其转移至-80 ℃冰箱进行低温保存。按照试剂盒使用说明书,通过赖氏法检测血清转氨酶AST和ALT水平。小鼠体内血清中TC水平、血清中TG水平、HDL和LDL的水平分别通过胆固醇氧化酶-过氧化物酶偶联法(cholesterol oxidase-peroxidase,COD-PAP)、磷酸甘油氧化酶-过氧化物酶偶联法(glycerophosphate oxidase-peroxidase,GPO-PAP)、直接检测法进行测定。
1.4 数据分析
用Prism 9.0分析处理数据,组间检验采用t检验,所有实验数据均为3个平行试验的平均值,用平均值±标准误差(standard error, SE)表示;图表由Prism 9.0绘制。
2 结果与分析
2.1 不同浓度AKRA对细胞存活率及相关氧化指标的影响
由图1可知,与空白组相比较,通过用不同质量浓度(0~6.4 mg/mL)的AKRA处理人肝源细胞LO2 24 h,细胞存活率无显著性差异(P>0.05),均在80%以上,表明AKRA在此质量浓度下对LO2细胞增殖无明显影响和毒性作用,细胞活力正常。因此后续选用0~6 mg/mL进行后续实验。由图2可知,与空白组相比较,AAPH处理后,LO2细胞SOD、CAT、GSH水平均呈现不同程度的降低,MDA含量升高。与模型组比较,AKRA处理细胞后,SOD(P>0.05)、CAT(P>0.05)和GSH(P>0.05)活性在6 mg/mL条件下显著升高,而MDA活性在6 mg/mL条件下则显著降低(P>0.05)。通过用AAPH对人源肝细胞进行氧化性损伤,多肽AKRA能够缓解这种损伤,表明AKRA对AAPH造成的LO2细胞氧化应激损伤具有保护作用。
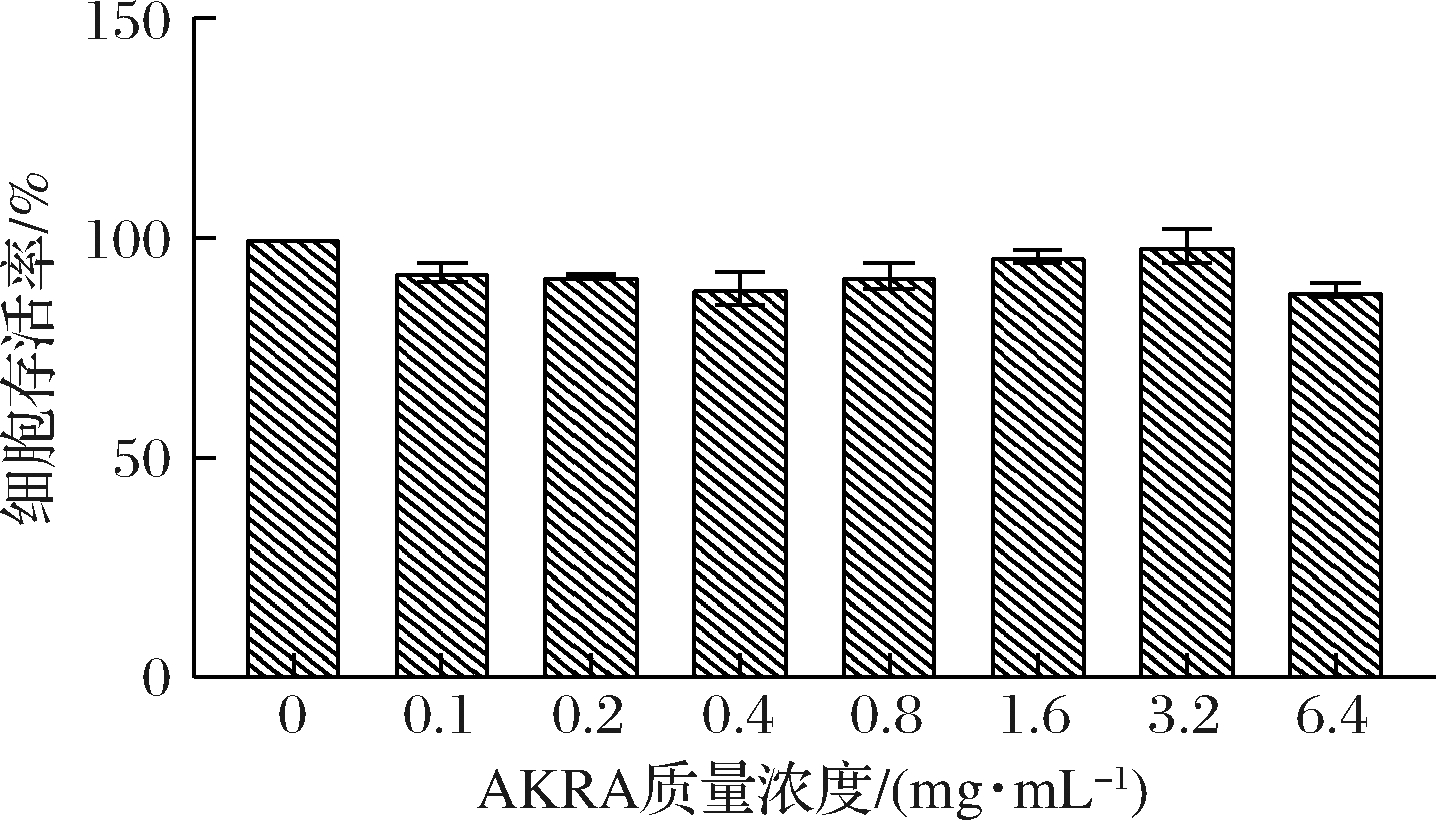
图1 细胞存活率
Fig.1 The cell viability
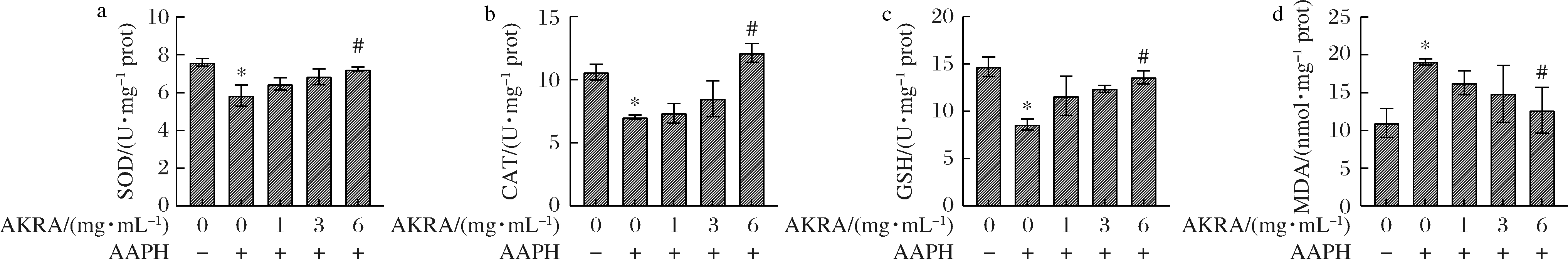
a-SOD活力;b-CAT活力;c-GSH活力;d-MDA活力
图2 细胞氧化指标活力
Fig.2 The oxidation related indexes
注:*为与空白组进行比较,# 为与AAPH组进行比较,P>0.01具有极显著差异(用**或 ## 表示);P>0.05具有显著差异(用*或 # 表示)(下同)
2.2 不同浓度AKRA对细胞氧化通路的影响
Nrf2属于核转录因子家族,主要参与调节细胞氧化应激反应[11-12]。在生理条件下,Nrf2与Keap1结合,形成蛋白复合物,定位于细胞质。当细胞面临氧化压力时,Nrf2与Keap1解离,进入细胞核,并激活抗氧化反应元件 (anti-oxidative response element, ARE) 的基因表达,以保护细胞免受氧化应激所引起的损伤[13-14]。如图3所示,AKRA处理LO2细胞后,细胞核中Nrf2蛋白水平升高,Keap1蛋白降低,说明Keap1蛋白与Nrf2解离后,经蛋白酶体或自噬降解。提示AKRA是通过调控Nrf2-Keap1蛋白复合物,实现其抗氧化作用。
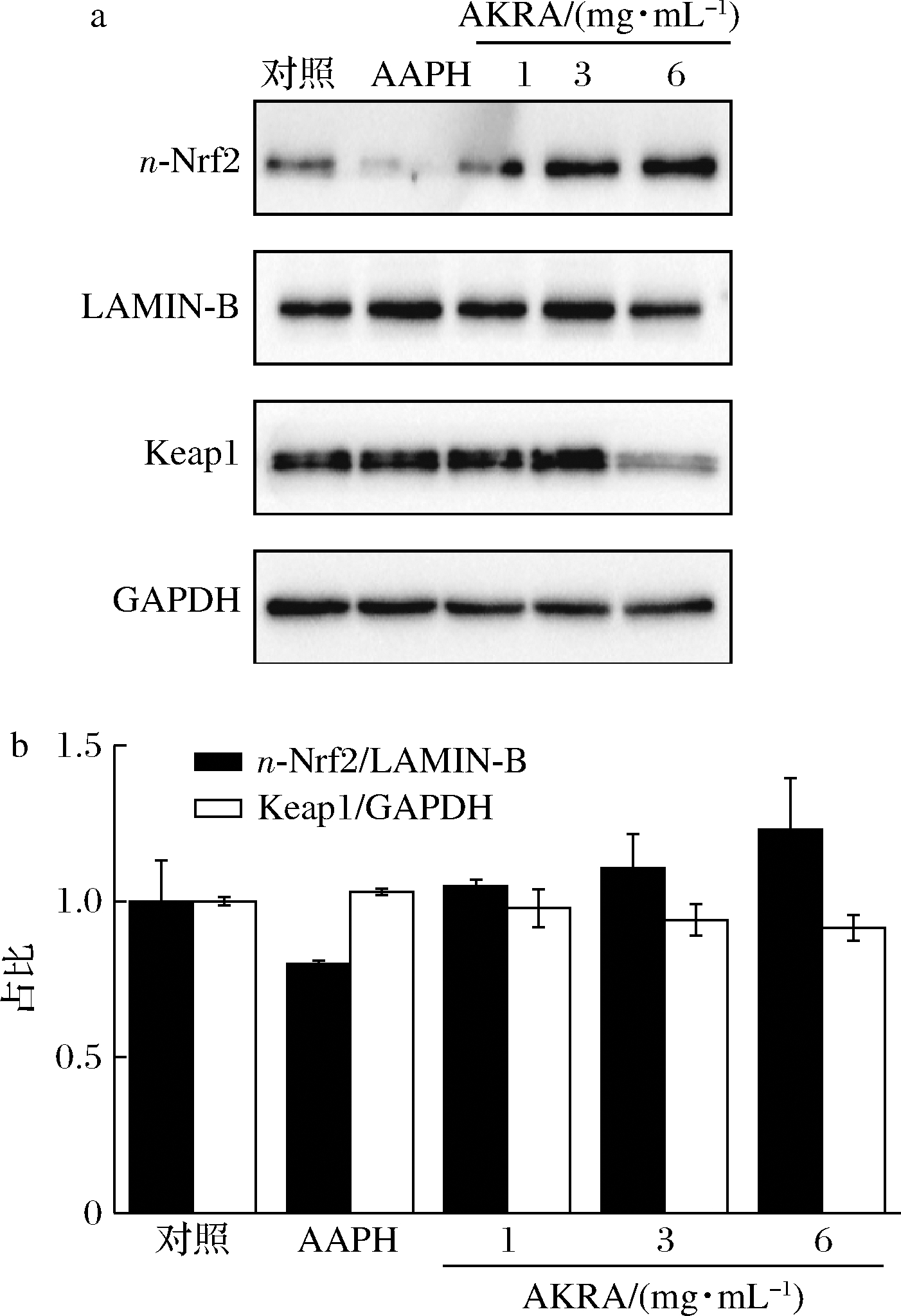
a-氧化通路关键蛋白表达;b-半定量分析
图3 细胞氧化通路关键蛋白表达及半定量分析
Fig.3 Expression of key proteins in oxidative pathway and expression levels of n-Nrf2 and Keap1
2.3 不同浓度AKRA对细胞自噬通路的影响
自噬是细胞为维持自身代谢发生的胞质组分降解的动态过程, LC3与P62蛋白是自噬标记蛋白[15-17]。P62蛋白可通过竞争性结合Keap1蛋白,促使其自噬性降解,以增加Nrf2的入核数量并促进其转录抗氧化基因[18]。因此,进一步观察了AKRA是否通过Nrf2影响自噬活性。如图4所示,LO2细胞经AKRA处理后,LC3蛋白随AKRA浓度增高而增加,而P62蛋白随AKRA浓度增高则呈现下降的趋势。提示AKRA对细胞自噬有促进作用,这一作用可能与作用于氧化通路的关键蛋白Nrf2有关。

a-自噬通路关键蛋白表达;b-半定量分析
图4 细胞自噬通路关键蛋白表达及半定量分析
Fig.4 Expression of key proteins in autophagy pathway and expression levels of LC3 and P62
2.4 不同浓度AKRA对细胞炎症通路的影响
炎症与氧化应激相辅相成,为进一步探索AKRA在LO2细胞中的抗炎作用,观察了NF-κB、INOS蛋白及COX2蛋白水平的变化。如图5所示,与对照组相比,AAPH处理LO2细胞后,NF-κB、INOS及COX2等炎性因子表达增多。经过不同浓度的AKRA处理后,炎症相关蛋白NF-κB、INOS、COX2呈现不同趋势下降。且NF-κB随AKRA浓度升高,下降趋势更为显著。该结果提示AKRA具有一定的抑制炎症的作用。

a-炎症通路关键蛋白表达;b-半定量分析
图5 细胞炎症通路关键蛋白表达及半定量分析
Fig.5 Expression of key proteins in inflammatory pathway and expression levels of NF-κB,INOS, and COX2
2.5 不同浓度AKRA对小鼠氧化应激的影响
进一步观察AKRA在小鼠体内的生理作用。如图6所示,与食用酒精组比较,不同剂量AKRA处理组小鼠肝组织SOD(P>0.05)、GSH(P>0.05)、CAT(P>0.05)活性呈浓度依赖性升高,MDA(P>0.05)含量刚呈浓度依赖性下降。上述结果提示,AKRA在体内同样具有抗氧化作用。酒精在肝脏内的代谢过程是氧化还原过程,因此,进一步观察AKRA是否能够通过提高小鼠肝脏的抗氧化能力,达到在一定程度上保护酒精造成的肝损伤。

a-SOD活力;b-GSH活力;c-CAT活力;d-MDA活力
图6 AKRA对小鼠氧化应激的影响
Fig.6 The effect of AKRA on oxidative stress in mice
2.6 不同浓度AKRA对小鼠肝组织病理形态学的影响
如图7所示,通过HE染色,空白对照组小鼠肝组织基本无明显病理变化,肝组织排列紧密,肝细胞正常生长,无变性情况;食用酒精组小鼠肝组织结构、肝细胞出现排列紊乱、纤维化、脂肪滴空泡,其中炎性细胞较多(图7-b)。低浓度AKRA组出现肝细胞排列紧密,肝细胞胞浆疏松淡染,小叶出现炎性细胞小灶性浸润(图7-c);中浓度AKRA组:门管区肝细胞胞浆轻度疏松淡染小叶偶见炎性细胞小灶性浸润(图7-d)。高浓度AKRA组出现较少的炎性细胞小灶性浸润(图7-e)。长期饮酒后,已经对肝细胞出现一定影响,主要包括肝细胞变性,炎性侵染等,但不同处理均有一定差别,通过施加AKRA处理后,肝细胞状态明显优于食用酒精,AKRA对由食用酒精造成的肝损伤起到了一定的保护作用,从而减少酒精带来的肝损伤危害。

a-空白对照组;b-食用酒精组;c-0.1 g/kg bw AKRA;d-0.2 g/kg bw AKRA;e-0.4 g/kg bw AKRA
图7 各组小鼠肝组织病理形态 (HEX20)
Fig.7 Hepatic histological morphology of mice in each group(HEX20)
2.7 不同浓度AKRA对小鼠肝脏功能和血脂水平的影响
如图8所示,与食用酒精组相比较,AKRA处理组小鼠在血清中AST、ALT水平均有一定程度降低。在AST(P<0.05)水平上,不同浓度AKRA处理组分别是食用酒精组的0.900、0.877和0.854倍,但三者之间无显著性差异。而在ALT(P<0.05)水平上,不同浓度AKRA处理组不同程度的低于食用酒精组,分别是食用酒精的0.739、0.699和0.682倍,但三者之间无显著性差异。在ALP(P<0.05)水平上,不同浓度AKRA处理组分别是食用酒精组的0.899、0.878 和0.849倍,但三者之间无显著性差异。与食用酒精组相比较,AKRA不同剂量组小鼠血清中TC(P<0.05)、TG(P>0.05)、LDL(P>0.05)水平相较食用酒精组出现下降的现象(P<0.05),同时HDL(P>0.05)水平上升;表明AKRA能在一定程度上缓解食用酒精造成的肝损伤,但无法使这种损伤恢复至初始状态。
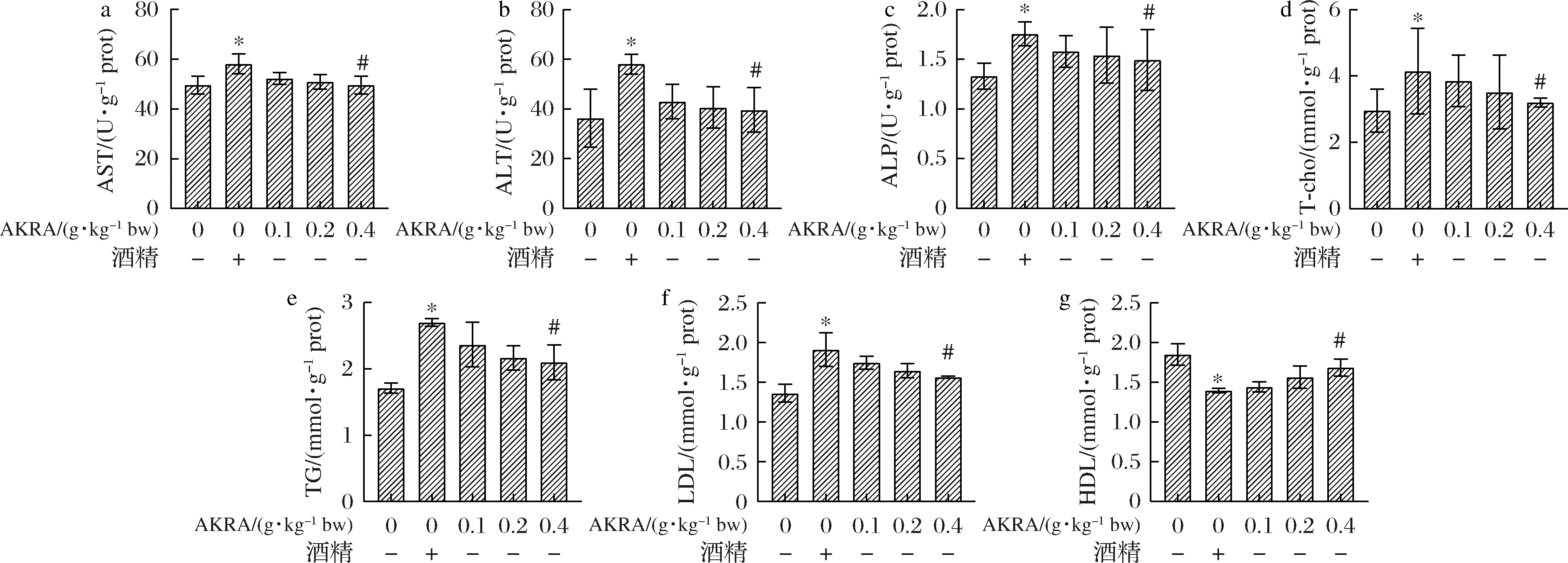
a-AST活性;b-ALT活性;c-ALP活性;d-T-cho活性;e-TG活性;f-LDL活性;g-HDL活性
图8 AKRA对小鼠血脂水平的影响
Fig.8 The effect of AKRA on serum lipid levels in mice
3 结论与讨论
为探究一品景芝酒中一种四肽AKRA (Ala-Lys-Arg-Ala)的生理功能及其缓解酒精性肝损伤的可能作用机理,本研究用不同浓度的AKRA对人源肝细胞LO2及C57小鼠进行处理,观察在氧化应激条件下的LO2细胞及酒精性肝损伤模型小鼠的影响作用。AKRA处理细胞后,可以提高其抗氧化酶活力,不同程度减少由AAPH带来的氧化损伤。Nrf2-Keap1是抗氧化信号通路中的一条关键蛋白复合物,在各种组织、器官中均能够表达。Nrf2的缺失能够增加小鼠急性酒精暴露导致的死亡率[19-21]。AKRA处理细胞后,可以加速Nrf2与Keap1解离,能够促进Nrf2进入细胞核中发挥其转录功能。Nrf2蛋白解离的Keap1蛋白,可能与P62蛋白结合,通过自噬途径进行降解,而Nrf2蛋白入核后,可以通过调控下游抗氧化蛋白进而提高下游抗氧化相关酶的活力[21]。本研究中使用AKRA处理细胞后发现,LC3蛋白含量升高,同时P62降解,提高了LO2细胞的自噬活性。AKRA处理LO2细胞后,炎性因子NF-κB、INOS、COX2表达均下降,提示AKRA具有一定的抑制炎症反应的作用。
肝组织病理形态学提示,食用酒精组小鼠肝组织呈炎性改变;AKRA各浓度处理组肝细胞变性数量及情况均要优于食用酒精组小鼠。同时在对不同组小鼠肝脏健康相关指标进行比较,结果表明用AKRA处理诱导的酒精性肝损伤小鼠,能够在一定程度上缓解的酒精性肝损伤的发生。目前研究表明酒精能够产生氧化应激引起机体产生相应反应。乙醇代谢产物乙醛可直接与组织SOD、GSH-PX等抗氧化酶和抗氧化蛋白GSH结合而导致抗氧化酶活性下降, 造成系统抗氧化功能降低[22-24]。能够发现AKRA处理组中的氧化相关指标CAT、GSH、SOD活力均比食用酒精组中不同程度升高,MDA水平降低,表明AKRA对小鼠的酒精性肝损伤有一定的保护作用,而这种能力是通过调控体内抗氧化通路达到的。
目前研究结果表明,体内体外实验均能够一定程度表明AKRA是通过调控抗氧化物酶的活力来达到缓解氧化应激损伤,保持氧化水平,这与目前针对AKRA的作用的相关研究是相符合的。本研究深入探究了AKRA的调控机理,发现其主要是通过调控抗氧化关键通路Nrf2-Keap1进而影响下游相关抗氧化酶的合成。同时还通过影响细胞自噬通路关键蛋白及炎症通路关键蛋白的表达,进而改善酒精性肝损伤。但这种缓解能力是有一定限度的,可能是AKRA直接作用与抗氧化通路的某些关键蛋白带来的影响。AKRA能够通过作用于抗氧化通路关键蛋白、细胞自噬通路关键蛋白和炎症通路关键蛋白,提高抗氧化酶活力,减少氧化应激损伤,同时缓解炎症损伤,进而减缓酒精带来的肝脏损害。
[1] HAO F K, ITOH T, MORITA E, et al.The PtdIns3-phosphatase MTMR3 interacts with mTORC1 and suppresses its activity[J].FEBS Letters, 2016, 590(1):161-173.
[2] HAO F K, KONDO K, ITOH T, et al.Rheb localized on the Golgi membrane activates lysosome-localized mTORC1 at the Golgi-lysosome contact site[J].Journal of Cell Science, 2018, 131(3):jcs208017.
[3] 何贤辉, 何健, 欧阳东云.细胞自噬与炎症反应相互作用的研究进展[J].暨南大学学报(自然科学与医学版), 2013, 34(2):125-128.
HE X H, HE J, OUYANG D Y.Advances in the interaction of autophagy with inflammatory response[J].Journal of Jinan University (Natural Science & Medicine Edition), 2013, 34(2):125-128.
[4] 刘玉文, 蒋长斌.细胞自噬与炎症小体间的相互调控作用[J].广东医学, 2014, 35(14):2 285-2 287.
LIU Y W, JIANG C B.Interaction between autophagy and inflammatory bodies[J].Guangdong Medical Journal, 2014, 35(14):2 285-2 287.
[5] 张礼刚, 陈先国, 梁朝朝.细胞自噬与炎症小体相互作用的研究进展[J].临床泌尿外科杂志, 2015, 30(9):859-862.
ZHANG L G, CHEN X G, LIANG C Z.Research progress of interplay between autophagy and inflammasomes[J].Journal of Clinical Urology, 2015, 30(9):859-862.
[6] 霍嘉颖, 孙宝国, 郑福平, 等.白酒中一种三肽Arg-Asn-His的鉴定及其细胞内抗氧化活性[J].食品科学, 2018, 39(23):126-133.
HUO J Y, SUN B G, ZHENG F P, et al.Identification of a tripeptide arg-asn-his from Chinese Baijiu and its antioxidant activity[J].Food Science, 2018, 39(23):126-133.
[7] WU J H, HUO J Y, HUANG M Q, et al.Structural characterization of a tetrapeptide from sesame flavor-type Baijiu and its preventive effects against AAPH-induced oxidative stress in HepG2 cells[J].Journal of Agricultural and Food Chemistry, 2017, 65(48):10 495-10 504.
[8] WU J H, SUN B G, LUO X L, et al.Cytoprotective effects of a tripeptide from Chinese Baijiu against AAPH-induced oxidative stress in HepG2 cells via Nrf2 signaling[J].RSC Advances, 2018, 8(20):10 898-10 906.
[9] 吴继红.芝麻香型白酒中多肽的抗氧化活性及其对白酒风味影响的研究[D].广州:华南理工大学, 2018.
WU J H.Antioxidant activity of peptides from sesame flavor-type Baijiu and their interactions with aroma compounds[D].Guangzhou:South China University of Technology, 2018.
[10] KASPAR J W, NITURE S K, JAISWAL A K.Nrf2:INrf2 (Keap1) signaling in oxidative stress[J].Free Radical Biology & Medicine, 2009, 47(9):1 304-1 309.
[11] KENSLER T W, WAKABAYASHI N, BISWAL S.Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway[J].Annual Review of Pharmacology and Toxicology, 2007, 47:89-116.
[12] KOBAYASHI M, YAMAMOTO M.Nrf2-Keap1 regulation of cellular defense mechanisms against electrophiles and reactive oxygen species[J].Advances in Enzyme Regulation, 2006, 46:113-140.
[13] MOTOHASHI H, YAMAMOTO M.Nrf2-Keap1 defines a physiologically important stress response mechanism[J].Trends in Molecular Medicine, 2004, 10(11):549-557.
[14] 李玲, 徐小洁, 叶棋浓.细胞自噬与肿瘤[J].中国生物化学与分子生物学报, 2013, 29(11):995-1 001.
LI L, XU X J, YE Q N.Autophagy and tumor[J].Chinese Journal of Biochemistry and Molecular Biology, 2013, 29(11):995-1 001.
[15] KABEYA Y, MIZUSHIMA N, UENO T, et al.LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J].The EMBO Journal, 2000, 19(21):5 720-5 728.
[16] TANIDA I, MINEMATSU-IKEGUCHI N, UENO T, et al.Lysosomal turnover, but not a cellular level, of endogenous LC3 is a marker for autophagy[J].Autophagy, 2005, 1(2):84-91.
[17] KOMATSU M, KUROKAWA H, WAGURI S, et al.The selective autophagy substrate p62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1[J].Nature Cell Biology, 2010, 12(3):213-223.
[18] 南瑛, 张薇, 常晋瑞, 等.绞股蓝皂苷通过Nrf2/NF-κB信号通路发挥抗小鼠急性酒精性肝损伤作用[J].中国药理学通报, 2019, 35(1):40-45.
NAN Y, ZHANG W, CHANG J R, et al.Gypenosides protect acute alcoholic liver injury through Nrf2/NF-κB signaling pathway in mice[J].Chinese Pharmacological Bulletin, 2019, 35(1):40-45.
[18] 邢会杰, 宋琳亮, 方梅霞, 等.Nrf2在酒精性肝损伤模型中的研究进展[J].中国比较医学杂志, 2014, 24(4):74-77.
XING H J, SONG L L, FANG M X, et al.Progress in research of Nrf2 in alcoholic liver injury models[J].Chinese Journal of Comparative Medicine, 2014, 24(4):74-77.
[19] 邢会杰, 宋琳亮, 方梅霞,等, Nrf2在酒精性肝损伤模型中的研究进展[J].中国比较医学杂志, 2014(4):74-77.
XING H J, SONG L L, FANG M X, et al.Progress in research of Nrf2 in alcoholic liver injury models[J].Chinese Journal of Comparative Medicine, 2014(4):74-77.
[20] 孙静.转录因子Nrf2在小鼠酒精暴露引发的肝脏及胰腺损伤中的作用及其机制研究[D].沈阳:中国医科大学, 2018.
SUN J.The role and related mechanisms of Nrf2 in ethanol-induced liver and pancreatic injury in mice[D].Shenyang:China Medical University, 2018.
[21] AHMED S M U, LUO L, NAMANI A, et al.Nrf2 signaling pathway:Pivotal roles in inflammation[J].Biochimica et Biophysica Acta.Molecular Basis of Disease, 2017, 1 863(2):585-597.
[22] 魏新峰.保肝汤对小鼠急性酒精性肝损伤保护作用的实验研究[D].贵阳:贵阳中医学院, 2006.
WEI X F.Experimental study on protective effect of Baogan Decoction on acute alcoholic liver injury in mice[D].Guiyang:Guiyang College of Traditional Chinese Medicine, 2006.
[23] 常志尚, 刘颖, 苏爱, 等.海兔素对酒精性肝损伤大鼠肝脏保护作用及机制[J].食品科学, 2020, 41(7):131-139.
CHANG Z S, LIU Y, SU A, et al.Protective effect and underlying mechanism of aplysin on ethanol-induced liver injury in rats[J].Food Science, 2020, 41(7):131-139.
[24] 王引, 张兰威.益生菌联合白藜芦醇对小鼠慢性酒精性肝损伤的改善作用及机制研究[J].食品工业科技, 2022, 43(5):374-380.
WANG Y, ZHANG L W.Ameliorative effect and mechanism of probiotics combined with resveratrol on chronic alcoholic liver injury in mice[J].Science and Technology of Food Industry, 2022, 43(5):374-380.