石榴,为石榴科石榴属的浆果,在我国具有悠久的栽培历史[1]。我国现有石榴种质资源230余个[2],目前主要是鲜食或榨汁,每年都会产生大量的石榴皮, 这些石榴皮只有很小一部分被作为药用,其余大多被丢弃,造成了石榴皮的严重浪费。石榴皮多糖(polysaccharides from pomegranate peel, PPP)是石榴皮中的一种活性成分,目前PPP的提取方法主要有水提醇沉法[3]、微波辅助提取法[4]、超声波辅助提取法[5]和酶辅助提取法[6],对于内部沸腾法提取PPP的研究还未见报道。内部沸腾法是指先用少量低沸点有机溶剂充分浸润原料,然后再加入高温度的提取剂使低沸点的有机溶剂发生内部沸腾引起对流扩散,从而使有效成分快速溶出进入溶液中的一种提取方法[7]。该方法具有操作简单、省时高效、产物杂质少等优点[8]。
随着生活水平的提高,高血脂症发病率越来越高。高血脂症的临床表现是高水平的总胆固醇、甘油三酯、低密度脂蛋白和低水平的高密度脂蛋白胆固醇,其易诱导发生脂肪肝、动脉粥样硬化和心血管等疾病[9-10]。因此,迫切需要一些有效、安全的口服药物来控制和治疗高血脂症及其并发症。然而,一些研究表明控制和治疗高脂血症的传统药物价格昂贵且有副作用[11]。因此,开发天然低价的降脂药物已成为医学领域的热门话题。目前,已有研究表明多糖具有一定的降血脂能力[12],但对于PPP的生理活性研究多集中在抗氧化[13]、免疫[14]、保肝[15]等方面,尚未见关于PPP降血脂活性的报道。
因此,本文以石榴皮为原料,对内部沸腾法提取PPP的工艺进行优化,得到最佳工艺参数,同时,研究PPP对胆固醇酯酶和胰脂肪酶的抑制能力、结合胆酸盐的能力,探究PPP的体外降脂活性,为开发天然无毒副作用的降脂功能食品提供理论依据,为石榴皮资源的综合利用提供新思路。
1 材料与方法
1.1 材料与试剂
粉红石榴(陕西咸阳)购于陕西西安回民街,石榴皮干燥粉碎后过60目筛,于密封袋中密封保存,备用。
无水乙醇、氯仿、月桂酸-4-硝基苯酯均为分析纯,天津市富宇精细化工有限公司;单糖标品,上海源叶生物科技有限公司;甘氨胆酸钠、牛磺胆酸钠均为分析纯,天津市科密欧化学试剂有限公司;胰蛋白酶、胃蛋白酶均为分析纯,北京奥博星生物科技有限公司;胰脂肪酶、乙酸钠、胆固醇酯酶、4-硝基苯丁酸酯均为分析纯,西安市晶博生物科技有限公司;乙腈、磷酸二氢钾、三乙胺、三氟乙酸均为色谱级,美国赛默飞世尔公司。
1.2 仪器与设备
LGJ-10型真空冷冻干燥机,巩义市予华仪器有限公司;RE301旋转蒸发仪,雅马拓科技贸易(上海)有限公司;HH-S4电热恒温水浴锅,北京科伟永兴仪器有限公司;SC-3 610低速离心机,安徽中科中佳科学仪器有限公司;THZ-4恒温振荡器,苏州培英设备有限公司;PHS-3C型精密pH计,上海雷磁仪器厂;Multisacn Go酶标仪、高效液相色谱仪,美国赛默飞世尔公司。
1.3 实验方法
1.3.1 石榴皮粗多糖的提取工艺
石榴皮粗多糖提取工艺如下:
石榴皮干粉→乙醇解吸→热水浸提→抽滤→二次提取→合并提取液→旋蒸浓缩→冷冻干燥
1.3.2 石榴皮粗多糖得率计算
石榴皮粗多糖得率的计算如公式(1)所示:
(1)
式中:R,石榴皮粗多糖得率;m1,石榴皮粗多糖的质量,g;m2,石榴皮粉末的质量,g。
1.3.3 单因素试验
选择乙醇体积分数(50%、60%、70%、80%、90%、100%)、液料比(20∶1、25∶1、30∶1、35∶1、40∶1、45∶1, mL∶g)、提取温度(75、80、85、90、95、100 ℃)、提取时间(20、30、40、50、60、70 min)进行单因素试验,并进行3次重复试验。
1.3.4 响应面设计试验
由单因素试验的结果,进行响应面优化试验。
1.3.5 单糖组成的HPLC分析
PPP用3 mol/L的三氟乙酸溶液水解。将含有100 μL已水解多糖样品和单糖混标、200 μL 1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)(0.5 mol/L)、300 μL NaOH溶液(0.3 mol/L)的混合液置于70 ℃恒温水浴中反应1 h,反应结束后加入300 μL HCl溶液(0.3 mol/L)终止反应,氯仿萃取后,过膜备用。HPLC的色谱条件为:Thermo U-3000 HPLC系统,C18色谱柱(4.6 mm×250 mm,5 μm,Venusil,美国)在35 ℃下进行高效液相色谱试验分析样品单糖组成。流动相A为乙腈(色谱级),流动相B为3.3 mmol/L KH2PO4+3.9 mmol/L三乙胺+10%乙腈水溶液,流速为1.0 mL/min,进样量为10 μL。洗脱梯度为:在0、5、15、25、30、40 min时流动相B的比例分别为98%、98%、91%、88%、86%、99%[16]。
1.3.6 PPP对胆固醇酯酶的影响
1.3.6.1 PPP对胆固醇酯酶抑制率的测定
根据文献方法[17]稍作修改。将4-硝基苯基丁酸酯(4-nitrophenyl butyrate,PNPB)预先溶解在乙腈中,配制成4 mmol/L的溶液,-20 ℃保存备用,所有反应均在含有牛磺胆酸钠(5.16 mmol/L)、NaCl(0.1 mol/L)的磷酸缓冲溶液(0.1 mol/L,pH=7.0)中进行。试管中加入1 mL缓冲液、50 μL胆固醇酯酶(500 U、20 μg/mL)、50 μL PPP溶液(5、10、15、20、25、30 mg/mL)和20 μL PNPB,在25 ℃下反应30 min,于405 nm处测定吸光值。对照组用超纯水代替PPP,PPP对胆固醇酯酶的抑制率计算如公式(2)所示:
抑制率![]()
(2)
式中:A,PPP存在时酶活性;A0,PPP不存在时酶活性。
1.3.6.2 PPP对胆固醇酯酶抑制类型的测定
固定PNPB底物浓度为4 mmol/L,PPP浓度IC50值(25.00 mg/mL)不变,加入不同质量浓度胆固醇酯酶溶液(0.1、0.2、0.3、0.4、0.5 mg/mL),按1.3.6.1中的体系进行反应,25 ℃反应10 min,于405 nm处测定吸光值,作抑制类型图,判断反应的可逆型。固定胆固醇酯酶质量浓度为0.25 mg/mL,PPP浓度为IC50值不变,改变底物PNPB浓度(0.5、1、2、3、4 mmol/L),按1.3.6.1中的体系进行反应,25 ℃反应10 min,反应结束后于405 nm处测定吸光值,作Lineweaver-Burk双倒数曲线图,确定抑制类型。
1.3.7 PPP结合胆酸盐试验
取1 mL各质量浓度PPP(5、10、15、20、25 mg/mL)于50 mL离心管中,加入1 mL 0.01 mol/L的HCl溶液、3 mL 10 mg/mL的胃蛋白酶溶液,37 ℃下恒温振荡1 h,模拟胃消化;然后加入4 mL胰脂肪酶溶液,调节pH至6.3,37 ℃恒温振荡1 h,模拟肠道消化。然后分别向其中加入4 mL的胆酸盐溶液,于37 ℃恒温振荡20 min,结束后4 000 r/min 离心20 min,取2.5 mL上清液于试管中,加入7.5 mL体积分数为60% H2SO4溶液,70 ℃水浴加热20 min,冷却至室温后于387 nm处测吸光值,PPP与各胆酸盐的结合率计算如公式(3)所示[18]:
胆酸盐结合率![]()
(3)
1.3.8 PPP对胰脂肪酶的抑制试验
1.3.8.1 PPP对胰脂肪酶抑制率的测定
根据文献方法[19]稍作修改。0.8 mg/mL的月桂酸-4-硝基苯酯溶液由5 mmol/L的乙酸钠溶液(含1%Trition X-100)配制,在96孔板中加入60 μL的胰脂肪酶、60 μL PBS缓冲液、20 μL的各梯度浓度的PPP溶液和80 μL的月桂酸-4-硝基苯酯,37 ℃反应30 min,于405 nm测定吸光值。对照组用PBS缓冲液代替胰脂肪酶,按照公式(2)计算PPP对胰脂肪酶的抑制率。
1.3.8.2 PPP对胰脂肪酶抑制类型的测定
固定月桂酸-4-硝基苯酯底物质量浓度为0.8 mg/mL,PPP浓度为IC50值(9.46 mg/mL)不变,加入不同浓度胰脂肪酶溶液(2、4、6、8、10 mg/mL),按1.3.8.1中的体系进行反应,37 ℃反应10 min,反应结束后于405 nm处测定吸光值,作抑制类型图,判断反应的可逆型。固定胰脂肪酶浓度为10 mg/mL,PPP浓度为IC50值不变,改变底物月桂酸-4-硝基苯酯浓度(0.2、0.4、0.6、0.8 mmol/L),按1.3.8.1中的体系进行反应,37 ℃反应10 min,反应结束后于405 nm处测定吸光值,作Lineweaver-Burk双倒数曲线图,确定抑制类型。
2 结果与分析
2.1 单因素试验结果
图1呈现了乙醇体积分数、料液比、提取温度和提取时间的单因素试验结果。分析PPP的提取率随各单因素不同水平的变化规律并综合考虑,选择乙醇解吸浓度为90%、液料比(mL∶g)为40∶1、提取温度为95 ℃、提取时间为60 min作为最佳条件,并在乙醇体积分数80%~100%、液料比(mL∶g)35∶1~45∶1、提取温度90~100 ℃、提取时间50~70 min的条件下进行响应面试验。
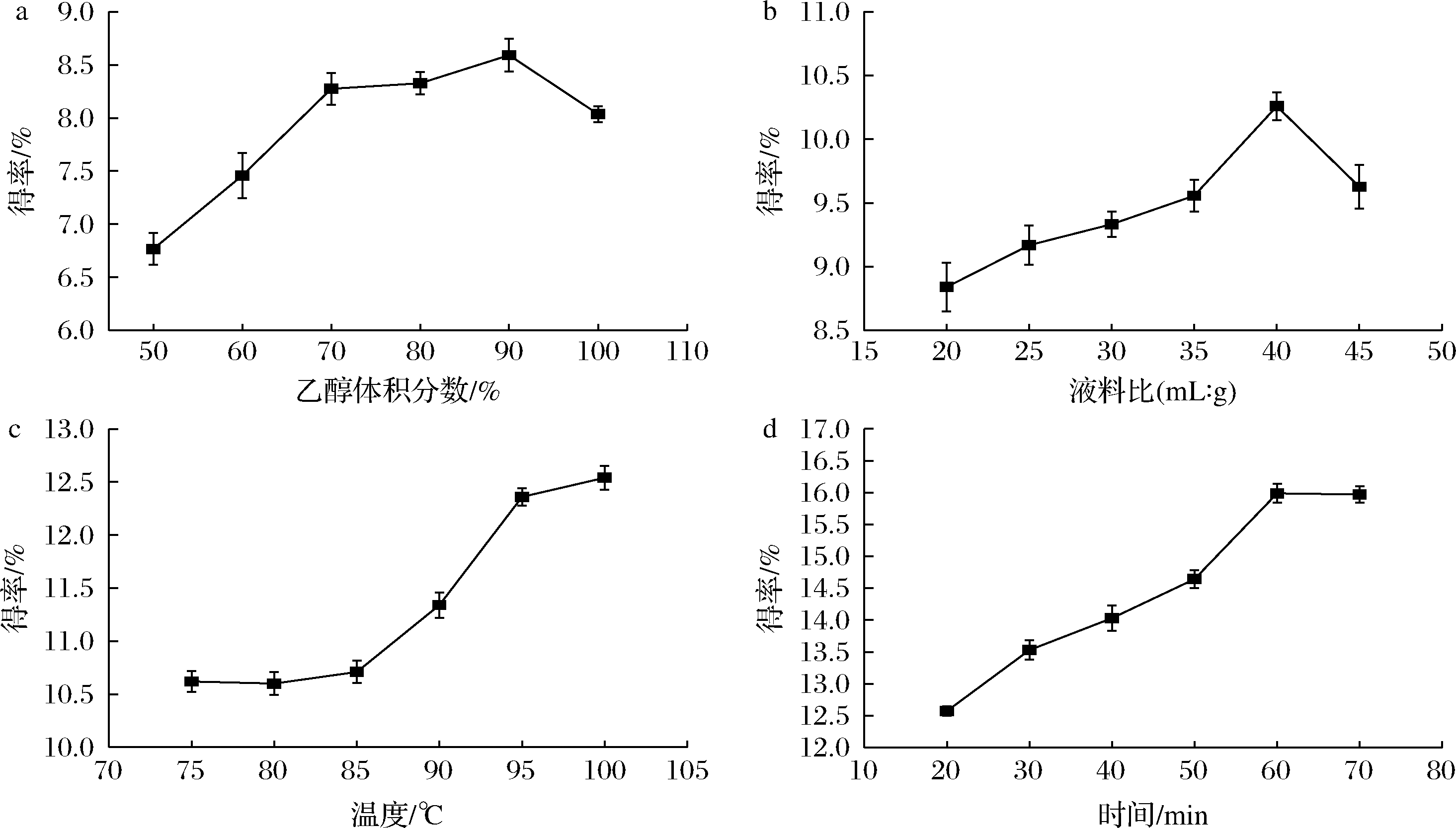
a-乙醇体积分数;b-液料比;c-温度;d-时间
图1 不同提取因素对PPP得率的影响
Fig.1 Effect of different extraction variables on the yield of PPP
2.2 响应面试验结果
表1为本试验响应面设计的因素水平。
表1 响应面设计试验因子与水平
Table 1 Variables and levels in response surface design

水平因素乙醇体积分数/%液料比(mL∶g)提取温度/℃提取时间/min-18035∶1905009040∶19560110045∶110070
根据表1响应面试验因子水平表,对乙醇体积分数、液料比、提取温度、提取时间4个因素的交互作用对PPP得率的影响进行了试验,试验结果如表2所示。
通过Expert Design软件对表2中的数据进行多元回归拟合,得到如下回归方程:Y=16.07-0.068X1+0.61X2+1.37X3+0.27X4+0.31X1X2-0.021X1X3+0.092X1X4-0.016X2X3+0.069X2X4+8.750×10-3X3X4-0.25X12-0.81X22-0.98X32-0.82X42。
表2 响应面试验结果
Table 2 Experimental results of response surface design analysis

序号X1(乙醇体积分数)X2(液料比)X3(提取温度)X4(提取时间)Y(得率)/%1-100-115.302-110015.71310-1013.284000015.955-101016.326000016.037-10-1013.248-100115.229100-114.9910-1-10014.38110-10-113.5412001115.8613110016.041400-1113.1715010115.35160-11015.3917001-115.1418000016.4619101016.28200-10114.2121100115.28220-1-1012.8623000015.95241-10013.4825000015.9926011016.0427010-114.402801-1013.582900-1-112.49
对回归模型进行方差分析,如表3所示。
表3 响应面试验的方差分析
Table 3 The variance analysis of response surface test
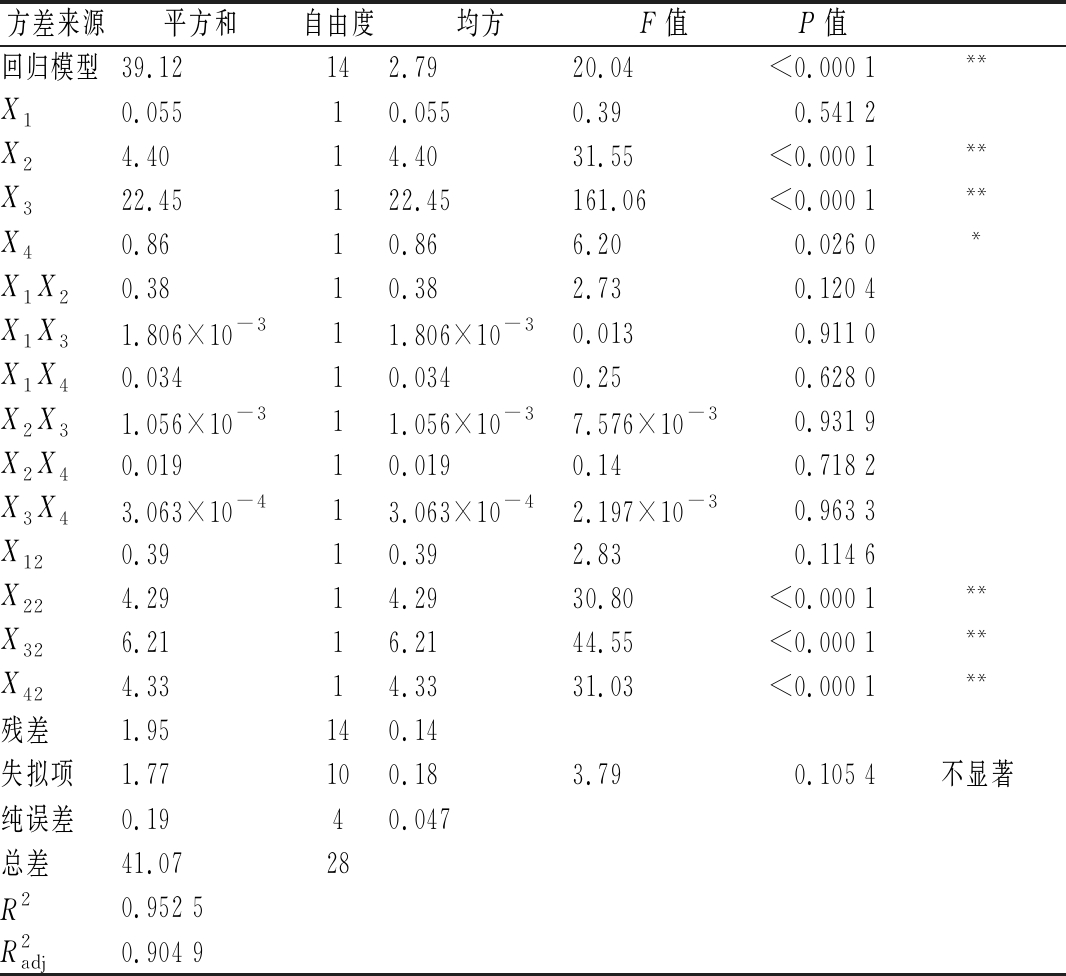
注:*为显著性差异(P<0.05), **为极显著差异(P<0.01)
方差来源平方和自由度均方F值P值回归模型39.12142.7920.04<0.000 1**X10.05510.0550.390.541 2X24.4014.4031.55<0.000 1**X322.45122.45161.06<0.000 1**X40.8610.866.200.026 0*X1X20.3810.382.730.120 4X1X31.806×10-311.806×10-30.0130.911 0X1X40.03410.0340.250.628 0X2X31.056×10-311.056×10-37.576×10-30.931 9X2X40.01910.0190.140.718 2X3X43.063×10-413.063×10-42.197×10-30.963 3X120.3910.392.830.114 6X224.2914.2930.80<0.000 1**X326.2116.2144.55<0.000 1**X424.3314.3331.03<0.000 1**残差1.95140.14失拟项1.77100.183.790.105 4不显著纯误差0.1940.047总差41.0728R20.952 5R2adj0.904 9
由表3可知,此回归模型具有高度的显著性(P<0.01),失拟项不显著,表明该回归方程可以预测试验中PPP的得率。同时,R2为![]() 为0.904 9,表明模型拟合度良好。由方差分析表可以得出,因素X2、X3对PPP的得率有极显著的影响(P<0.01),因素X4对PPP的得率有显著影响(P<0.05),X22、X32、X42对PPP的得率有极显著的影响(P<0.01),X1X2、X1X3、X1X4、X2X3、X2X4、X3X4对PPP的得率无显著影响(P>0.05)。各因素对PPP得率的影响大小依次为X3(提取温度)>X2(液料比)>X4(提取时间)>X1(乙醇体积分数)。
为0.904 9,表明模型拟合度良好。由方差分析表可以得出,因素X2、X3对PPP的得率有极显著的影响(P<0.01),因素X4对PPP的得率有显著影响(P<0.05),X22、X32、X42对PPP的得率有极显著的影响(P<0.01),X1X2、X1X3、X1X4、X2X3、X2X4、X3X4对PPP的得率无显著影响(P>0.05)。各因素对PPP得率的影响大小依次为X3(提取温度)>X2(液料比)>X4(提取时间)>X1(乙醇体积分数)。
由图2可知,乙醇体积分数和提取温度、液料比和提取温度、液料比和提取时间、提取温度和提取时间的交互作用的响应面3D图曲面变化较陡峭,表明它们的交互作用对PPP的得率有一定的影响,但结合方差分析结果来看,其作用不显著。

图2 各因素的交互作用对PPP得率影响的响应面图
Fig.2 Response surface for the effect of the interaction of various factors on the yield of PPP
通过Design-Expert 软件分析,得到了内部沸腾法提取PPP的最佳条件为:乙醇溶液体积分数为91.2%,提取温度为98.5 ℃,提取时间为61.9 min,液料比为41.95∶1(mL∶g),在此条件下,PPP得率的理论值为16.689 9%。根据实际情况,将提取条件调整为:乙醇溶液体积分数91%,提取温度96 ℃,提取时间62 min,液料比42∶1(mL∶g),实际得率为(16.32±0.21)% (n=3),接近预测值,说明该模型可以较好的预测PPP的实际得率。
2.3 单糖组成分析
由图3所示,根据各单糖标准品的保留时间可以确定PPP的单糖种类,根据峰面积确定每种单糖在相应多糖中所占的百分比。经计算,PPP由9种单糖组成,分别是5.57%的甘露糖、2.41%的鼠李糖、4.21%的葡萄糖醛酸、26.10%的半乳糖醛酸、1.74%的葡萄糖、2.20%的木糖、4.40%的半乳糖、16.86%的阿拉伯糖和36.51%的岩藻糖。

1-甘露糖;2-核糖;3-鼠李糖;4-葡萄糖醛酸;5-半乳糖醛酸;6-葡萄糖;7-木糖;8-半乳糖;9-阿拉伯糖;10-岩藻糖
a-单糖混标;b-PPP
图3 十种单糖混标与PPP PMP衍生物的HPLC色谱图
Fig.3 HPLC chromatograms of PMP derivatives of 10 mixed monosaccharides and PPP
2.4 PPP对胆固醇酯酶抑制作用
2.4.1 PPP对胆固醇酯酶抑制率的测定
胆固醇酯酶可以将胆固醇酯水解成游离胆固醇和脂肪酸[20],通过抑制胆固醇酯酶活性,可以减少机体对胆固醇的吸收,达到降脂目的。由图4可知,PPP对胆固醇酯酶的抑制率随着PPP浓度的增加而增加,表明PPP对胆固醇酯酶有较好的抑制效果。通过SPSS软件对试验数据进行分析,得出PPP对胆固醇酯酶的半抑制浓度IC50=25.00 mg/mL。

图4 PPP对胆固醇酯酶的抑制率
Fig.4 Inhibitory rate of PPP on cholesterol esterase
2.4.2 PPP对胆固醇酯酶作用的抑制类型
酶的抑制作用分为可逆性抑制和不可逆抑制,可逆性抑制又分为竞争性抑制、非竞争性抑制和反竞争性抑制,通过Lineweaver-Burk双倒数曲线可以直观地判断可逆抑制类型。当含有抑制剂的曲线和不含抑制剂的曲线相交于纵轴,则为竞争性抑制;当2条曲线相交于横轴,为非竞争性抑制;当2条直线平行时,则为反竞争性抑制[21]。由图5-a可知,2条直线相交于原点,且加入PPP后直线斜率变小,表明PPP对胆固醇酯酶的抑制类型为可逆性抑制,PPP与胆固醇酯酶以非共价键结合导致酶活力降低。由图5-b可知,对照组和PPP组2条直线相交于横轴,且加入PPP后vmax(最大反应速率)减小,Km基本不变,说明石榴多糖对胆固醇酯酶的抑制类型为非竞争性抑制,PPP和底物可以同时结合在胆固醇酯酶上,形成酶-底物-抑制剂三元复合物,使胆固醇酯酶活性降低。

a-抑制类型;b-可逆性抑制Lineweaver-Burk曲线
图5 PPP对胆固醇酯酶作用的抑制类型
Fig.5 Inhibitory types of PPP on cholesterol esterase
2.5 PPP结合胆酸盐试验结果
机体内的胆固醇主要是以胆汁酸的形式排出体外,而胆汁酸一般都以盐及结合型的形式存在,PPP通过其形成的黏性网络吸附胆酸盐,加快了胆汁酸的排泄,促进了胆固醇向胆汁酸转化的过程,减少了机体内的胆固醇含量,从而达到降脂的效果[22]。如图6所示,随着PPP浓度的增加,PPP对胆酸盐的结合率呈现先增加后稳定的趋势,在PPP质量浓度为0~15 mg/mL时,结合率迅速增加,在多糖质量浓度为15 mg/mL时,两种胆酸盐的结合率均达到最大,甘氨胆酸钠和牛磺胆酸钠的最大结合率可分别达到40.09%和34.90%。
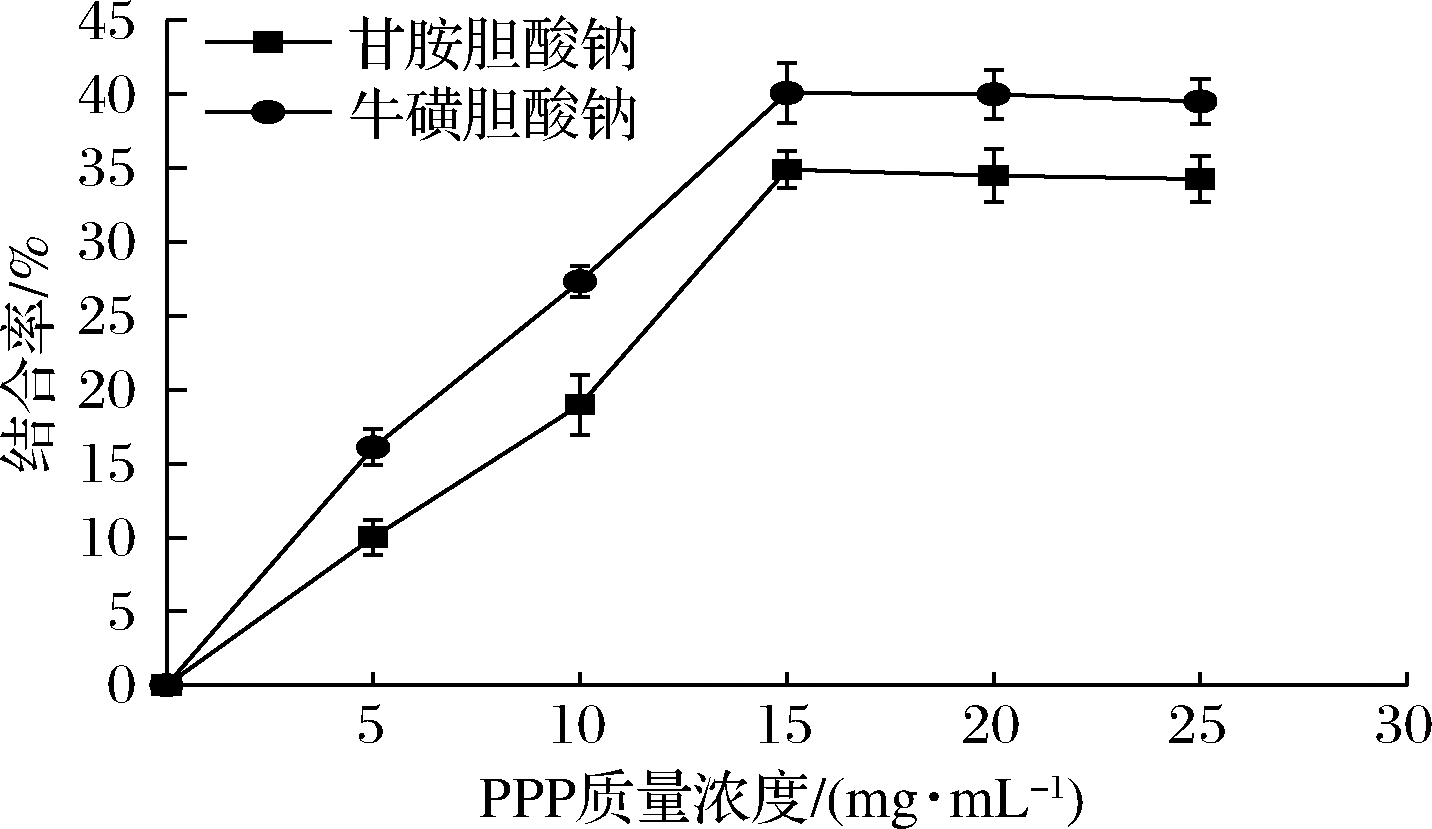
图6 PPP添加量对胆酸盐结合率的影响含量
Fig.6 Effect of PPP addition on binding rate of cholate
2.6 PPP对胰脂肪酶的抑制作用
2.6.1 PPP对胰脂肪酶的抑制率
胰脂肪酶可以将脂肪水解成游离脂肪酸和单酰甘油酯[23],通过抑制胰脂肪酶活性,可以减少机体对脂肪的吸收,达到降脂目的。由图7可知,PPP对胰脂肪酶的抑制率随着PPP浓度的增加而增加,最后趋于稳定,表明PPP对胰脂肪酶有较好的抑制效果。通过SPSS软件对试验数据进行分析,得出PPP对胰脂肪酶的半抑制浓度IC50=9.46 mg/mL。

图7 PPP对胰脂肪酶的抑制率
Fig.7 Inhibitory rate of PPP on pancreatic lipase
2.6.2 PPP对胰脂肪酶作用的抑制类型
由图8-a可知,2条直线相交于原点,且加入PPP后直线斜率变小,表明PPP对胰脂肪酶的抑制类型为可逆性抑制,PPP与胰脂肪酶以非共价键结合导致酶活力降低。由图8-b可知,2条直线相交于纵轴,加入PPP后vmax基本不变,Km增大,说明石榴多糖对胰脂肪酶的抑制类型为竞争性抑制,PPP与胰脂肪酶的活性中心进行可逆性结合,与底物竞争同一部位,妨碍底物和酶的结合,减少胰脂肪酶的作用机会,从而降低了酶的活性。

a-抑制类型;b-可逆性抑制Lineweaver-Burk曲线
图8 PPP对胰脂肪酶作用的抑制类型
Fig.8 Inhibitory types of PPP on pancreatic lipase
3 结论
本文以石榴皮为原料,通过内部沸腾法提取PPP,得到PPP的最佳提取条件为:乙醇溶液体积分数91%,液料比(mL∶g)为42∶1,提取时间62 min,提取温度96 ℃,在最佳条件下,PPP的平均得率为(16.32±0.21)%(n=3),此方法操作简单且PPP的得率高。高效液相色谱结果表明,PPP主要由岩藻糖(36.51%)、半乳糖醛酸(26.10%)、阿拉伯糖(16.86%)组成,除此之外还含有少量的甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、木糖和半乳糖。体外降脂试验结果显示,PPP对胆固醇酯酶和胰脂肪酶均具有较好的抑制作用,对胆酸盐也具有一定的结合能力,表明PPP具有一定的体外降脂活性,后期还需要对PPP的体内降脂活性进行进一步的研究,开发天然低价的降脂药物,从而有利于石榴皮资源的综合开发利用。
[1] 赵玉洁. ‘突尼斯软子’石榴遗传转化体系建立及转化ICE1基因的研究[D].郑州:河南农业大学, 2017.
ZHAO Y J.Establishment of genetic transformation system and transformed ICE1 gene into ‘tunisia soft-seed’ pomegranate[D].Zhengzhou:Henan Agricultural University,2017.
[2] 杜国强. 临潼石榴深加工产业现状及问题对策研究[D].邯郸:河北工程大学, 2017.
DU G Q.The research of the current problems and countermeasures of pomegranate deep processing industry in Lintong[D].Handan:Hebei University of Engineering,2017.
[3] 陈龙. 石榴皮多糖的制备、鉴定及其抗氧化活性研究[D].南京:南京农业大学, 2012.
CHEN L.Study on preparation and antioxidant acitivity of pomegranate peel polysaccharides[D].Nanjing:Nanjing Agricultural University,2012.
[4] 李云,朱彩平,张扬,等.微波辅助提取石榴皮多糖工艺优化及其免疫调节作用研究[J].天然产物研究与开发, 2018, 30(6):1 015-1 020;1 077.
LI Y, ZHU C P, ZHANG Y, et al.Microwave assisted extraction and immunomodulatory effects of pomegranate peel polysaccharide[J].Natural Product Research and Development, 2018,30(6):1 015-1 020;1 077.
[5] ZHU C P, ZHAI X C, LI L Q, et al.Response surface optimization of ultrasound-assisted polysaccharides extraction from pomegranate peel[J].Food Chemistry, 2015,177:139-146.
[6] LI Y, ZHU C P, ZHAI X C, et al.Optimization of enzyme assisted extraction of polysaccharides from pomegranate peel by response surface methodology and their anti-oxidant potential[J].Chinese Herbal Medicines, 2018, 10(4):416-423.
[7] 李建凤,廖立敏.桂花树叶多糖提取及抗氧化活性研究[J].食品研究与开发,2020,41(20):156-161.
LI J F, LIAO L M.Extraction and antioxidant activity of polysaccharides from Osmanthus fragrans leaves[J].Food Research and Development, 2020, 41(20):156-161.
[8] 杨财容,苟丽萍,叶美金,等.内部沸腾法提取茶树菇多糖的工艺探究[J].生物化工,2019,5(4):86-91.
YANG C R, GOU L P, YE M J, et al.Study on extraction of polysaccharide from Agrocybe aegerita by inner ebullition method[J].Biological Chemical Engineering,2019,5(4):86-91.
[9] CHU L L, YANG L C, LIN L Z, et al.Chemical composition, antioxidant activities of polysaccharide from Pine needle (Pinus massoniana) and hypolipidemic effect in high-fat diet-induced mice[J].International Journal of Biological Macromolecules, 2019, 125:445-452.
[10] CHEN Z Z, XIE Y D, SHAO L H, et al.5-(4-Hydroxyphenyl)-3h-1,2-dithiole-3-thione-based fibrates as potential hypolipidemic and hepatoprotective agents[J].Bioorganic & Medicinal Chemistry Letters, 2018, 28(23-24):3 787-3 792.
[11] ZHAO H J, LI S S, ZHANG J J, et al.The antihyperlipidemic activities of enzymatic and acidic intracellular polysaccharides by Termitomyces albuminosus[J].Carbohydrate Polymers, 2016, 151:1 227-1 234.
[12] 樊溢. 铁皮石斛多糖体内外降糖降脂功能初探[D].太原:山西大学, 2018.
FAN Y.Preliminary study on the function of hypoglycemic and hypolipidemic of Dendrobium officinale polysaccharides in vivo and in vitro[D].Taiyuan:Shanxi University, 2018.
[13] 李左龙. 石榴皮多糖免疫与抗氧化活性初步研究[D].乌鲁木齐:新疆农业大学,2013.
LI Z L.Preliminary study on immune and antioxidant activity of pomegranate rind the polysaccharide[D].Urumqi:Xinjiang Agricultural University, 2013.
[14] WU Y, ZHU C P, ZHANG Y, et al.Immunomodulatory and antioxidant effects of pomegranate peel polysaccharides on immunosuppressed mice[J].International Journal of Biological Macromolecules, 2019,137:504-511.
[15] ZHAI X C, ZHU C P, ZHANG Y, et al.Chemical characteristics, antioxidant capacities and hepatoprotection of polysaccharides from pomegranate peel[J].Carbohydrate Polymers, 2018, 202:461-469.
[16] 张扬. 平菇多糖的磷酸化修饰及其结构、肝保护作用的研究[D].西安:陕西师范大学, 2019.
ZHANG Y.Study on phosphorylation modification, structure and liver protection of Pleurotusostreatus polysaccharide[D].Xi′an:Shaanxi Normal University, 2019.
[17] 龚受基,滕翠琴,梁东姨,等.六堡茶茶褐素体外降脂功效研究[J].茶叶科学,2020,40(4):536-543.
GONG S J, TENG C Q, LIANG D Y, et al.In vitro study on hypolipidemic effects of theabrownins in Liupao tea[J].Journal of Tea Science,2020,40(4):536-543.
[18] 纪秀凤,刘海春,吕长鑫,等.红树莓籽原花青素提取及其结合胆酸盐能力评价[J].食品研究与开发,2019,40(7):90-97.
JI X F, LIU H C, LYU C X, et al.Extraction of proanthocyanidin from red raspberry seed and evaluation of its capacities of binding bile salts[J].Food Research and Development,2019,40(7):90-97.
[19] 张静,米佳,禄璐,等.黑果枸杞花色苷提取物对胰脂肪酶活性的影响[J].食品科学, 2020, 41(5):8-14.
ZHANG J, MI J, LU L, et al.Effect of anthocyanins extract from Lycium ruthenicum Murr.fruit on pancreatic lipase activity[J].Food Science,2020,41(5):8-14.
[20] 朱维,邹波,葛珍珍,等.柿单宁的体外降胆固醇作用[J].食品科学, 2016, 37(9):71-76.
ZHU W, ZOU B, GE Z Z, et al.Cholesterol-lowering effect of persimmon tannin in vitro[J].Food Science, 2016, 37(9):71-76.
[21] 李艳敏,郁书怀,仝艳军,等.裙带菜α-葡萄糖苷酶抑制活性肽的制备[J].食品工业科技, 2020,41(20):127-134.
LI Y M, YU S H, TONG Y J, et al.Preparation of α-glucosidase inhibitory peptides derived from sea mustard[J].Science and Technology of Food Industry, 2020,41(20):127-134.
[22] 林沛纯,谌素华,郑素丽.亨氏马尾藻岩藻聚糖的提取及体外吸附胆酸盐的作用[J].食品工业科技,2020,41(17):58-61;67.
LIN P C,CHEN S H, ZHENG S L.Extraction of fucoidan from Sargassum henslowianum and its binding effect on binding bile salts in vitro[J].Science and Technology of Food Industry, 2020,41(17):58-61;67.
[23] 黄睿. 柑橘类黄酮分光测定法比较及其抗氧化与胰脂肪酶抑制功效评价[D].杭州:浙江大学, 2019.
HUANG R.Comparison of spectrophotometry of Citrus flavonoids and evaluation of their antioxidant and pancreatic lipase inhibitory activities[D].Hangzhou:Zhejiang University, 2019.