青梅果含有多种有机酸、矿物质、维生素、多酚、黄酮等物质,具有浓郁的香气和突出的特征风味,是酿造养生果酒的良好原料[1]。青梅果酒不仅具有良好的口感与独特的风味,同时能有效保留青梅中的营养与活性成分[2-3],成为亚洲地区深受欢迎的发酵酒。
酵母菌是果酒生产最为关键的因素,对其品质至关重要。目前,国内青梅果酒酿造主要采用葡萄酒酿造酵母,将其用于青梅发酵时不能较好地适应青梅汁的高酸环境,导致青梅果酒发酵时间长、酒体单薄、风味不足、缺乏典型性[4]。因此,筛选优良青梅果酒酿造专用酵母是提高其品质的关键。目前,国内外有关青梅果酒酿造专用酵母的研究较少,且大多以青梅自然发酵液或者青梅果实作为菌种分离源。赵玲燕[5]从青梅发酵液中分离出100株酵母,通过三级筛选获得1株产酒精和发酵能力较好的青梅酿酒酵母;王辉等[6]从大肉青梅自然发酵液中分离出1株能耐受pH 3.0和葡萄糖质量浓度为400 g/L且可产生良好香气的酵母菌。然而,目前尚未见这些酵母菌用于青梅果酒生产的报道。糖渍能够抑制青梅的杂菌生长和部分代谢酶的活性,同时还能保留青梅特有的香气,降低有机酸含量,是制备青梅露和保留青梅风味的有效方法,也是获取青梅野生酵母的重要途径。本研究从糖渍青梅液和青梅果皮中分离出10株野生酵母菌,通过形态学观察和发酵特性研究筛选出6株酵母菌,采用26S rDNA序列分析对其进行鉴定,并探讨了其耐受乙醇、葡萄糖和低pH的能力,以期获得具有良好发酵性能的青梅果酒专用酵母,为优质青梅果酒的生产提供重要保障。
1 材料与方法
1.1 材料与仪器
糖渍青梅液是成都大邑种植的新鲜青梅洗净、沥水后称重,分别加入其质量30%、40%、50%的白砂糖,密封后分别于室温下放置至白砂糖完全溶解;YPD固体培养基、YPD液体培养基,青岛海博生物技术有限公司;无水葡萄糖、无水乙醇等,国产分析纯试剂。
GHP-9080隔水式培养箱,上海一恒科学仪器有限公司;UV-6000PC紫外可见分光光度计,上海元析仪器有限公司;ZHWY-1102C恒温培养振荡器,上海智城分析仪器制造有限公司。
1.2 实验方法
1.2.1 酵母菌分离纯化
将1 mL糖渍青梅液以10倍梯度稀释法稀释至10-3~10-7,取0.1 mL稀释液于YPD固体培养基上,涂布均匀后28 ℃下培养2 d。观察菌落形态后挑取表面光滑湿润、中间隆起的具有典型酵母菌形态特征的单个菌落进行平板划线,纯化培养2次后显微镜下观察其菌体形态、形状、繁殖方式,然后进行保藏。
1.2.2 酵母菌筛选
(1)产气性能测定:在含有杜氏小管的YPD液体培养基中加入分离出的酵母菌,分别于28 ℃下培养24、48 h观察杜氏管中出现气体的情况[7]。
(2)产乙醇、产香和发酵能力测定:按照2%(体积分数)的接种量(菌液浓度为107 CFU/mL),将分离菌株接种于100 mL YPD液体培养基(葡萄糖质量浓度调整为260 g/L),28 ℃下振荡(100 r/min)发酵8 d,测定发酵液的酒精度[7],评价发酵液的香气,并参照GB/T 10345—2022《白酒分析方法》测定其总酯含量[8],相同条件下以未调整葡萄糖的YPD液体培养基进行发酵力测定,发酵过程中每隔12 h测定1次质量,直至第8天。以发酵时间(x,min)为横坐标,CO2质量损失(y,g)为纵坐标,绘制发酵力曲线[7]。
1.2.3 酵母菌分子生物学鉴定
在北京擎科生物科技有限公司完成。采用通用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)进行26S rDNA扩增并测序。将测序结果在 NCBI 数据库中与已知序列进行同源比对分析,并采用MEGA 7.0软件绘制系统发育树。
1.2.4 酵母菌耐受性测定
参照李亚辉等[7]的方法对筛选酵母菌的耐受性进行测定,并稍作修改。调整YPD液体培养基中乙醇的体积分数(4%、6%、8%、10%、12%),葡萄糖的质量浓度(300、350、400、450、500 g/L)和pH(2.5、2.7、2.9、3.1、3.3、3.5),按照1.2.2(2)方式接种,于28 ℃下振荡(150 r/min)发酵48 h,在600 nm下测定发酵液的OD值,分别以不添加乙醇、葡萄糖、乳酸的YPD培养基为空白对照。
1.3 数据处理
每一实验平行测定3次,实验结果以![]() 表示。采用单因素方差分析(ANOVA)和Duncan多范围检验确定数据之间的显著差异(P<0.05)。利用Origin Pro 2021绘图。
表示。采用单因素方差分析(ANOVA)和Duncan多范围检验确定数据之间的显著差异(P<0.05)。利用Origin Pro 2021绘图。
2 结果与分析
2.1 酵母菌的筛选
2.1.1 形态观察
对分离纯化后得到的酵母菌进行形态观察和显微镜镜检后除去重复菌株,共筛选出10株酵母菌,编号为J1~J10,其菌落形态和细胞形态分别见表1和图1。10株菌的菌落形态相似,多为疏松状、圆形、突起、湿润、光滑的典型酵母菌落形态,但其菌落颜色、边缘规则程度和挑起性却不尽相同。细胞形态均为出芽繁殖,形状分椭圆形和圆形两种。
表1 分离酵母菌的菌落形态和细胞形态
Table 1 Colony and cell morphology of isolated yeast strains

菌株菌落形态细胞形态J1疏松状、小圆形、突起、湿润、黄色、边缘不规则、光滑、不易挑起椭圆形,有芽体J2疏松状、小圆形、突起、湿润、白色、边缘不规则、光滑、不易挑起椭圆形,有芽体J3疏松状、圆形、突起、湿润、白色、边缘规则、光滑、易挑起椭圆形,有芽体J4疏松状、圆形、突起、湿润、亮白色、边缘规则、粗糙、易挑起椭圆形,有芽体J5疏松状、圆形、突起、湿润、黄白色、边缘不规则、光滑、易挑起椭圆形,有芽体J6疏松状、圆形、突起、湿润、白色、边缘不规则、光滑、易挑起椭圆形,有芽体J7疏松状、圆形、突起、湿润、乳白色、边缘规则、光滑、易挑起圆形,有芽体J8疏松状、圆形、突起、湿润、乳白色、边缘规则、光滑、易挑起圆形,有芽体J9疏松状、圆形、突起、湿润、白色、边缘规则、光滑、易挑起圆形,有芽体J10疏松状、圆形、突起、较湿润、白色、边缘不规则、光滑、易挑起椭圆形,有芽体

图1 分离酵母菌的细胞形态
Fig.1 Cell morphology of isolated yeast trains
2.1.2 产气性能
10株菌的产气能力见表2。可以看出,除J1外,发酵48 h后其余9株菌的发酵液均出现产气,表明这些菌株生长和发酵速率快,因此选择该9株菌进入后续的筛选实验。
表2 酵母菌产气能力
Table 2 Gas production capacity of yeast trains

注:“-”表示杜氏小管中无气体;“+”表示杜氏小管中充满气体
发酵时间/h产气情况菌株数(编号)24-4(J1、J2、J4、J5)+6(J3、J6、J7、J8、J9、J10)48-1(J1)+9(J2、J3、J4、J5、J6、J7、J8、J9、J10)
2.1.3 产酒能力
9株菌发酵8 d后所得发酵液的酒精度差异较大(表3)。其中,J7、J8和J9产乙醇能力极强,显著高于其他6株菌(P<0.05),其发酵液的酒精度均高于10%vol;J3、J4、J5和J10有一定的产乙醇能力,其发酵液的酒精度均超过4.5%vol;但J2和J6产乙醇能力较差,其发酵液的酒精度均低于4%vol。
表3 九株酵母菌的产酒与产香能力及其发酵液的香气
Table 3 Ethanol and aroma production capacities of 9 yeast strains and the aroma of their fermentation liquids
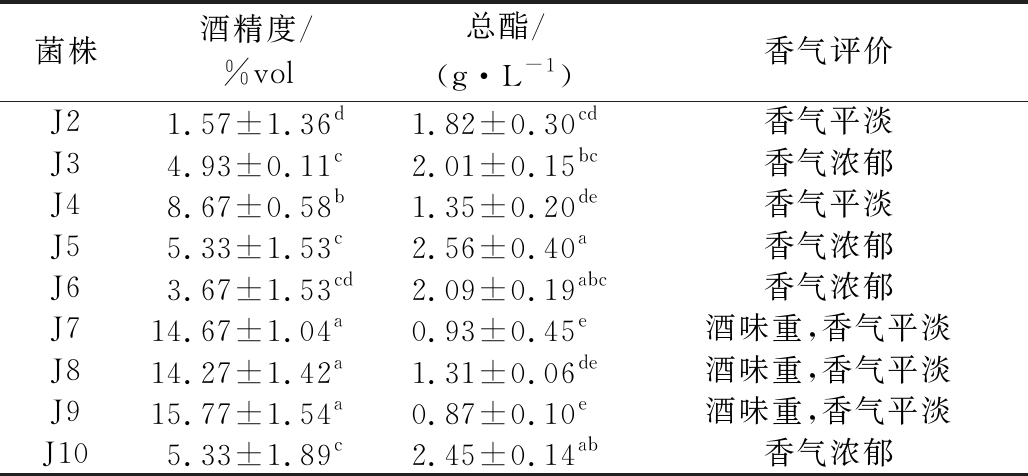
注:同一列中不同小写字母表示差异显著(P<0.05)(下同)
菌株酒精度/%vol总酯/(g·L-1)香气评价J21.57±1.36d1.82±0.30cd香气平淡J34.93±0.11c2.01±0.15bc香气浓郁J48.67±0.58b1.35±0.20de香气平淡J55.33±1.53c2.56±0.40a香气浓郁J63.67±1.53cd2.09±0.19abc香气浓郁J714.67±1.04a0.93±0.45e酒味重,香气平淡J814.27±1.42a1.31±0.06de酒味重,香气平淡J915.77±1.54a0.87±0.10e酒味重,香气平淡J105.33±1.89c2.45±0.14ab香气浓郁
2.1.4 产香能力
酵母菌在发酵过程中产生的风味物质大多以酯类形式存在。9株菌均具有一定的产香能力,其发酵液的总酯含量和香气见表3。其中,J3、J5、J6和J10的产酯能力明显高于其他5株菌(P<0.05),以J5的产酯能力最高(2.56 g/L),其发酵液的总酯含量均超过2 g/L,且香气浓郁。其余5株菌的产酯能力较低,J7和J9发酵液的总酯含量仅为0.93 g/L和0.87 g/L,且香气平淡。由于青梅果酒发酵菌的选育需要综合考虑其产酒和产香能力,因此淘汰产酒和产香能力均差的J2和J4。将筛选后得到的7株菌分为两大类,即产乙醇能力强菌株(J7、J8、J9)和产酯能力强菌株(J3、J5、J6、J10),分别测定其发酵力。
2.1.5 发酵力
酵母菌可利用糖进行发酵,并产生大量的CO2和乙醇,故CO2质量损失的多少可用于判断菌株发酵能力的强弱[9]。产乙醇能力强菌株的发酵力如图2所示。在发酵前36 h,J7、J8、J9发酵液的CO2产生量均随发酵时间延长而增加,第36 h时达到最大,CO2质量损失分别为3.52、3.21、3.49 g,说明此时菌株处于对数生长期,开始大量繁殖;36 h后随着发酵时间的延长,CO2产生量逐渐下降;第132 h时,3株菌发酵力基本相当,CO2几乎无质量损失,表明132 h后所有菌株已完成发酵。
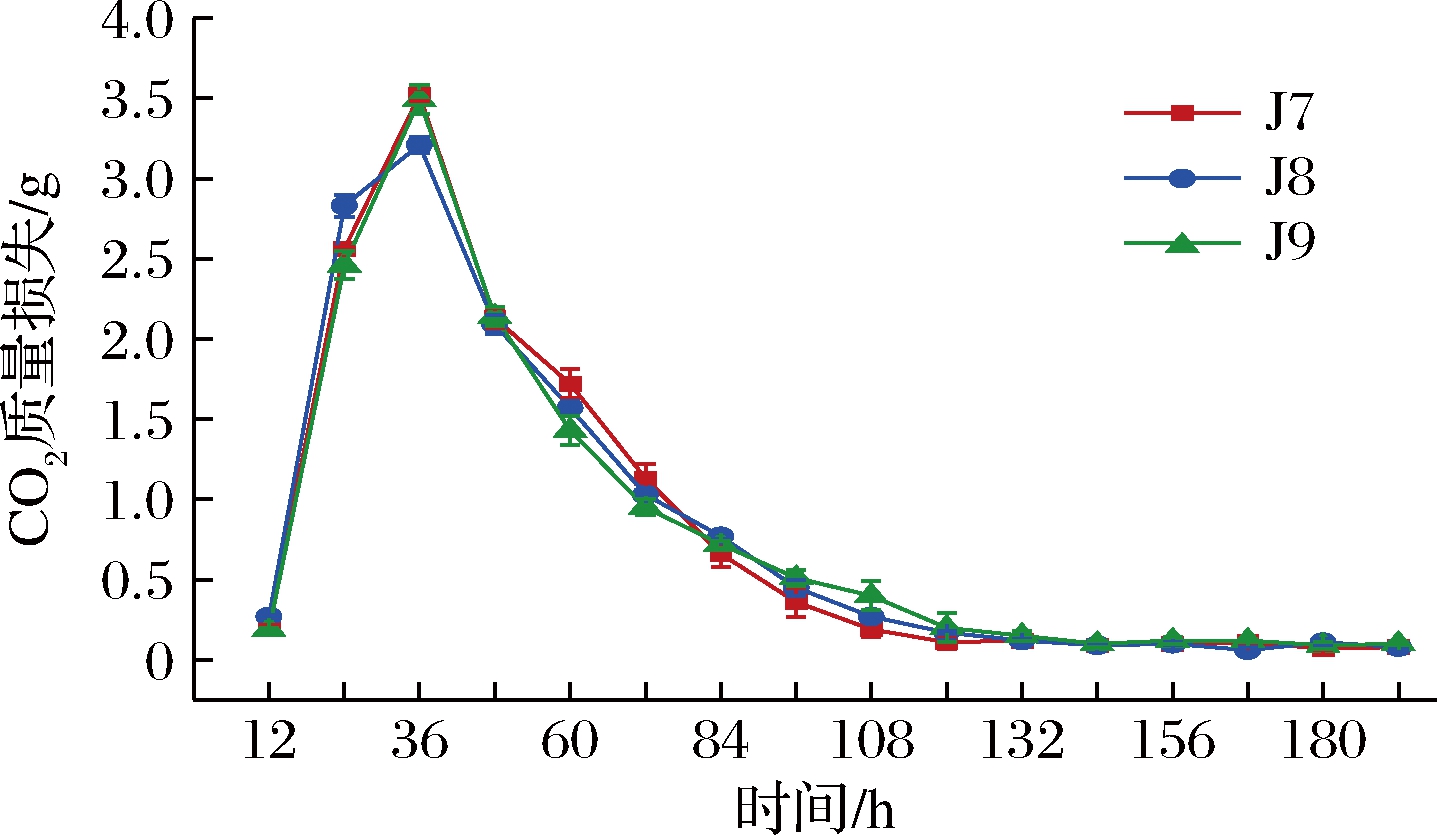
图2 产乙醇能力强菌株的发酵力
Fig.2 Fermentation capacity of strains with strong ethanol-producing ability
产酯能力强菌株的发酵力如图3所示。在发酵前24 h,J3、J5、J6、J10发酵液的CO2产生量均随发酵时间的延长而增加,第24 h时达到最大,CO2质量损失分别为1.21、0.97、1.18、1.16 g,表明此时菌株进入发酵旺盛期;24 h后随着发酵时间的延长,CO2产生量逐渐下降,第180 h时,4株菌发酵力基本相当,CO2几乎无质量损失,说明180 h后所有菌株已完成发酵。该4株菌的起酵时间较上述3株产乙醇菌提前了12 h,且CO2产生量普遍较低,这可能是产酯菌与产乙醇菌隶属于不同酵母菌种,具有不同的适宜生长条件、代谢特点和发酵能力[10]。产乙醇菌的生长能力更强,对发酵底物利用更充分,能够释放出更多的CO2。可利用此特性将该2种不同类型酵母菌分别接种进行青梅果酒发酵。综合以上结果,淘汰发酵力较弱的J5(CO2质量损失<1 g),选择其余6株菌进行后续的分子生物学鉴定和耐受性实验。
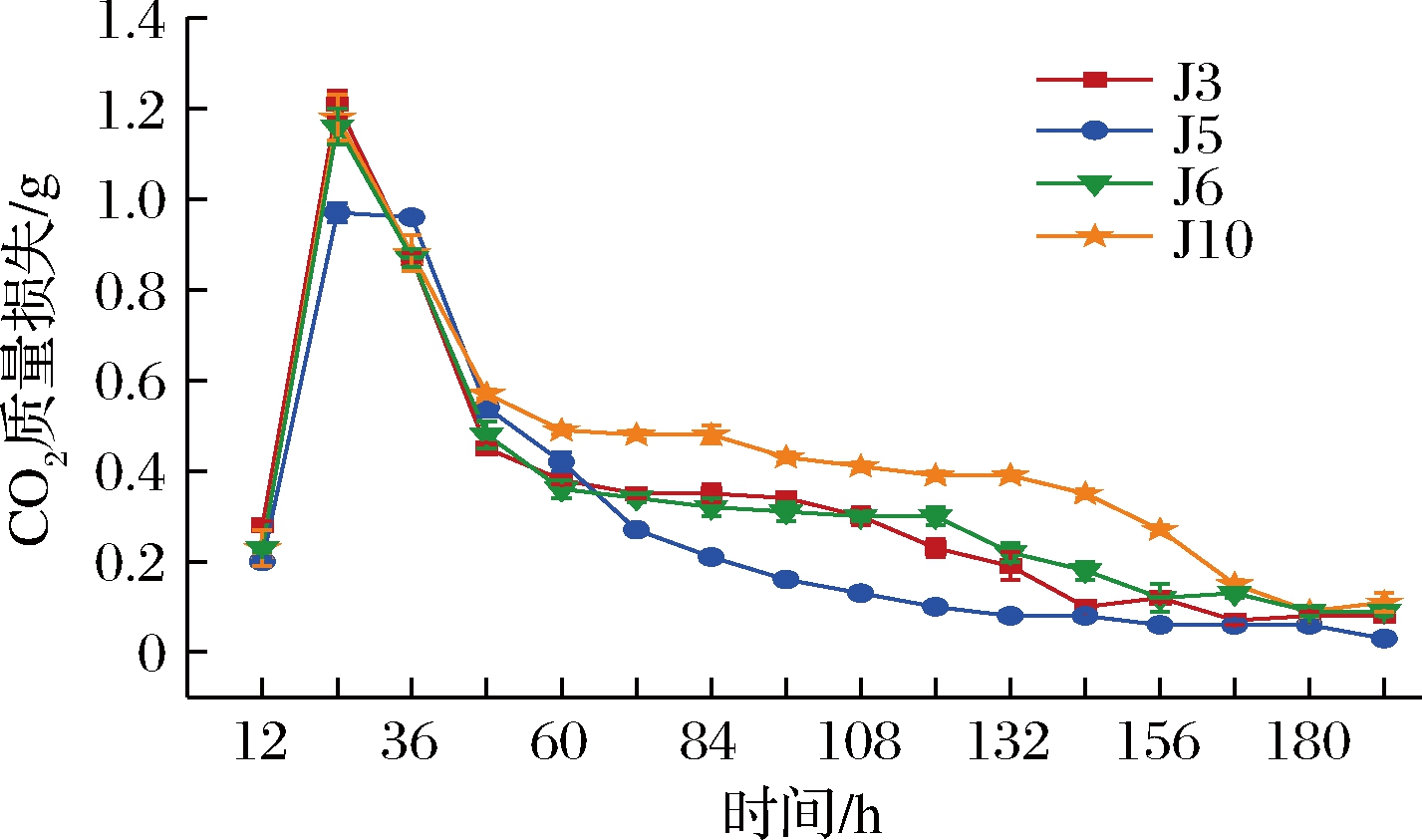
图3 产酯能力强菌株的发酵力
Fig.3 Fermentation capacity of strains with strong ester-producing ability
2.2 筛选菌株的鉴定
对6株菌DNA分别进行提取和PCR扩增后得到其电泳图(图4)。全部菌株的DNA片段长度在500~750 bp左右,其基因序列长度符合酵母菌理论预期[11]。用MEGA软件处理同源菌株基因得到6株菌的系统发育树(图5)。J7、J8和J9与酿酒酵母的同源性较高,J3、J6和J10与葡萄汁有孢汉逊酵母同源性较高。因此,确定前3株菌为酿酒酵母,后3株菌为葡萄汁有孢汉逊酵母。

图4 酵母菌 PCR扩增电泳图
Fig.4 PCR amplified electrophoresis map of yeast strains
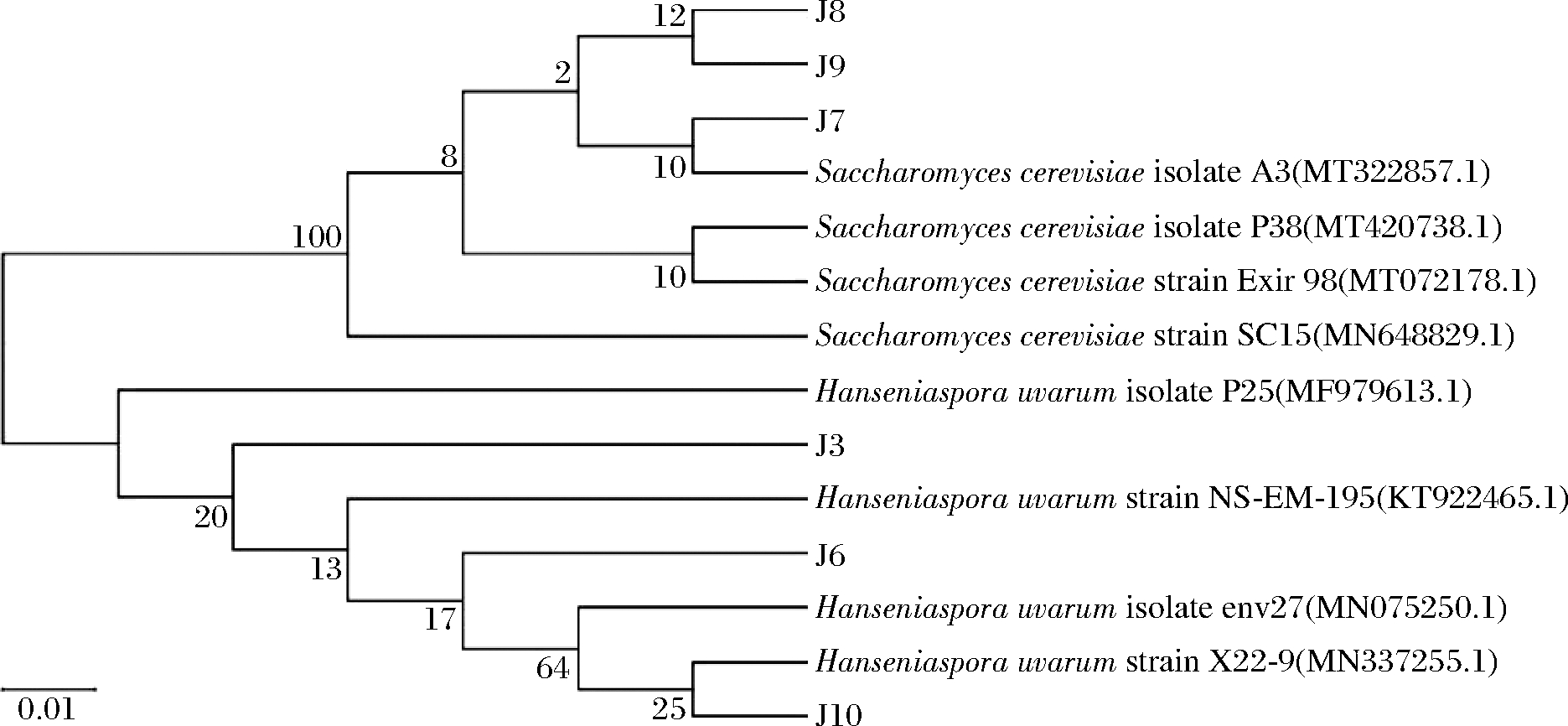
图5 六株酵母菌的系统发育树
Fig.5 Phylogenetic tree of six yeast strains
2.3 酵母菌的耐受性
2.3.1 乙醇耐受性
高浓度乙醇可抑制酵母菌细胞的生长和活力,影响其发酵效果[12]。6株酵母菌的乙醇耐受性见表4。随着乙醇体积分数增加,6株菌的耐受能力逐渐减弱,且3株酿酒酵母对乙醇的耐受能力明显强于3株葡萄汁有孢汉逊酵母(P<0.05),以J7和J8的耐受性最强,它们在10%乙醇中仍可生长旺盛。耐乙醇能力强的菌株可使发酵更完全,从而提高发酵酒的酒精度[13]。虽然3株酿酒酵母在高于10%乙醇中耐受能力减弱,但在YPD培养基发酵中产生酒精度超过10%vol,说明其适应性驯化能力较强,这种类型酵母可通过采用基因转录调节方式提高其乙醇耐受性[14]。葡萄汁有孢汉逊酵母的生长受到高体积分数乙醇的显著抑制,J3、J6和J10分别在8%、6%和8%乙醇条件下生长受到抑制。随着发酵的进行,培养基中营养物质缺乏和乙醇含量增加对非酿酒酵母生长的抑制作用更加明显,这与冯文倩等[15]关于葡萄汁有孢汉逊酵母对乙醇的耐受结果相似。本研究中筛选出的6株菌对乙醇的耐受能力高于从青梅自然发酵液中筛选得到的酵母菌[6]。
表4 六株酵母菌的乙醇耐受性
Table 4 Ethanol tolerance of six yeast strains

菌株不同体积分数乙醇发酵液的OD值空白对照4%6%8%10%12%J32.41±0.01b2.11±0.02d1.72±0.02b0.15±0.04b0.04±0.01d0.03±0.01eJ62.41±0.01b2.09±0.02d0.08±0.03c0.05±0.01c0.05±0.01d0.03±0.01cJ72.43±0.02b2.39±0.01b2.37±0.01a2.30±0.02a1.79±0.14b0.11±0.02abJ82.49±0.01a2.44±0.01a2.44±0.01a2.34±0.02a2.02±0.10a0.12±0.05aJ92.43±0.03b2.42±0.01ab2.42±0.02a2.30±0.02a0.36±0.08c0.07±0.01bcJ102.49±0.05a2.22±0.03c1.73±0.09b0.08±0.02c0.05±0.01d0.04±0.01c
2.3.2 葡萄糖耐受性
葡萄糖是酵母菌发酵的动力能源,但其浓度过高则会抑制酵母菌的生长,优良酵母菌株应具备较高的葡萄糖耐受能力[16]。6株酵母菌的葡萄糖耐受性见表5。6株菌均能耐受400 g/L葡萄糖,且3株酿酒酵母在<400 g/L葡萄糖中的生长能力明显强于3株葡萄汁有孢汉逊酵母(P<0.05),以J7的耐受能力最强。这是因为酿酒酵母细胞能充分利用葡萄糖进行生长繁殖,产生更多的乙醇[17]。酿酒酵母J7、J8和J9对葡萄糖的耐受能力随其质量浓度的增加先增大后减弱,在初始葡萄糖为300 g/L时耐受性最强;产酯酵母J3、J6和J10对葡萄糖的耐受能力随其质量浓度的增加持续减弱。造成该两种类型酵母对葡萄糖耐受能力变化趋势不同的原因在于外部环境的渗透压对两种酵母细胞代谢酶活性抑制的临界条件不同[18]。然而,当初始葡萄糖为450 g/L时,3株酿酒酵母均表现出明显的生长抑制,其生长能力显著低于葡萄汁有孢汉逊酵母(P<0.05)。这可能是因为酿酒酵母在高糖条件下发酵更加彻底,将糖分转化为更多的酒精,从而抑制其生长。当初始葡萄糖为500 g/L时,6株菌均不具备生长能力。
表5 六株酵母菌的葡萄糖耐受性
Table 5 Glucose tolerance of six yeast strains
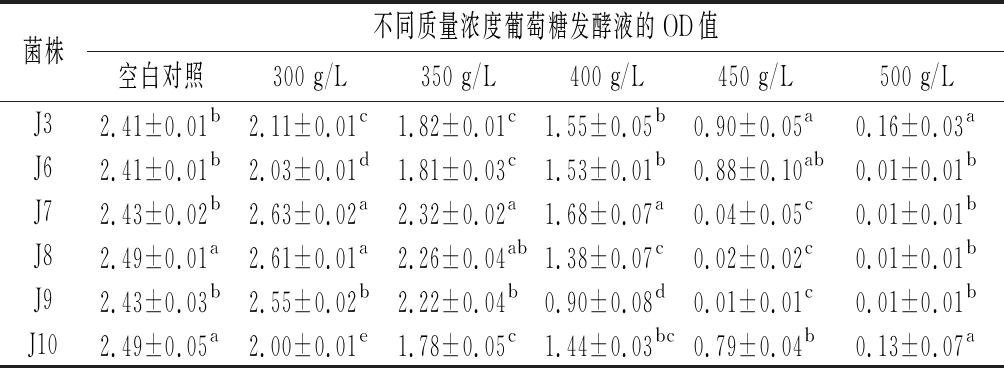
菌株不同质量浓度葡萄糖发酵液的OD值空白对照300 g/L350 g/L400 g/L450 g/L500 g/LJ32.41±0.01b2.11±0.01c1.82±0.01c1.55±0.05b0.90±0.05a0.16±0.03aJ62.41±0.01b2.03±0.01d1.81±0.03c1.53±0.01b0.88±0.10ab0.01±0.01bJ72.43±0.02b2.63±0.02a2.32±0.02a1.68±0.07a0.04±0.05c0.01±0.01bJ82.49±0.01a2.61±0.01a2.26±0.04ab1.38±0.07c0.02±0.02c0.01±0.01bJ92.43±0.03b2.55±0.02b2.22±0.04b0.90±0.08d0.01±0.01c0.01±0.01bJ102.49±0.05a2.00±0.01e1.78±0.05c1.44±0.03bc0.79±0.04b0.13±0.07a
2.3.3 低pH耐受性
酸胁迫是果酒发酵过程中最常见的不利条件之一。一般情况下,酿酒酵母最适生长pH为3.8~6.0,极少数用于果酒发酵的酵母菌可能具有耐受pH 3.2的环境条件[19-20]。因此,筛选可耐受低pH环境的酵母菌是青梅果酒酿造的关键[2]。6株菌的低pH耐受性见表6。在pH为3.3~3.5时,6株菌均能正常生长(OD600<2.0),但其耐受能力有所差异。其中,J3、J7、J9和J10耐受能力明显高于J6和J8(P<0.05),以J7耐受能力最强;当pH<3.3时,6株菌的耐受能力均随着pH降低逐渐减弱;当pH为2.9时,J3、J6、J7、J8和J9仍可正常生长,以J9和J6的生长最为旺盛,但J10表现出明显的生长抑制(P<0.05,0.5
表6 六株酵母菌的低pH耐受性
Table 6 Low pH tolerance of six yeast strains
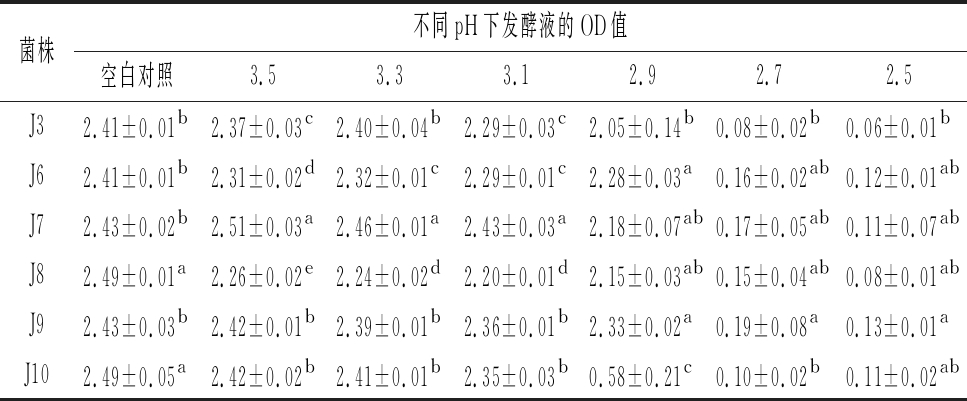
菌株不同pH下发酵液的OD值空白对照3.53.33.12.92.72.5J32.41±0.01b2.37±0.03c2.40±0.04b2.29±0.03c2.05±0.14b0.08±0.02b0.06±0.01bJ62.41±0.01b2.31±0.02d2.32±0.01c2.29±0.01c2.28±0.03a0.16±0.02ab0.12±0.01abJ72.43±0.02b2.51±0.03a2.46±0.01a2.43±0.03a2.18±0.07ab0.17±0.05ab0.11±0.07abJ82.49±0.01a2.26±0.02e2.24±0.02d2.20±0.01d2.15±0.03ab0.15±0.04ab0.08±0.01abJ92.43±0.03b2.42±0.01b2.39±0.01b2.36±0.01b2.33±0.02a0.19±0.08a0.13±0.01aJ102.49±0.05a2.42±0.02b2.41±0.01b2.35±0.03b0.58±0.21c0.10±0.02b0.11±0.02ab
3 结论
本研究从糖渍青梅液和新鲜青梅果皮中分离出青梅野生酵母菌,并探讨了其发酵特性。通过菌落形态和细胞形态观察筛选出10株不同形态的酵母菌,编号为J1~J10;通过比较菌株的产气、产酒和产香能力及发酵力获得6株具备优良性能的酵母菌,分别为J3、J6、J7、J8、J9、J10;26S rDNA测序鉴定为酿酒酵母(J7、J8、J9)和葡萄汁有孢汉逊酵母(J3、J6、J10)。6株酵母菌具备较好的耐受能力,能耐受4%(体积分数)、400 g/L葡萄糖和pH 3.1的环境条件,且酿酒酵母对乙醇的耐受能力强于葡萄汁有孢汉逊菌,但其对葡萄糖耐受能力低于后者。整体而言,本研究筛选获得的6株酵母菌具备良好的发酵性能和较好的生长特性与耐受能力,经过驯化后有望成为优质青梅果酒酿造菌种。
[1] 刘功德, 苏艳兰, 黄富宇, 等.青梅的功能价值及加工研究进展[J].农业研究与应用, 2018, 31(4):1-8.
LIU G D, SU Y L, HUANG F Y, et al.Function value and processing research progress of Prunus mume[J].Agricultural Research and Application, 2018, 31(4):1-8.
[2] TIAN T T, SUN J Y, WU D H, et al.Objective measures of greengage wine quality:From taste-active compound and aroma-active compound to sensory profiles[J].Food Chemistry, 2021, 340:128179.
[3] ZHENG X H, ZHANG M, FANG Z X, et al.Effects of low frequency ultrasonic treatment on the maturation of steeped greengage wine[J].Food Chemistry, 2014, 162:264-269.
[4] TIAN T T, WU D H, NG C T, et al.A multiple-step strategy for screening Saccharomyces cerevisiae strains with improved acid tolerance and aroma profiles[J].Applied Microbiology and Biotechnology, 2020, 104(7):3 097-3 107.
[5] 赵玲燕. 青梅果酒高效性能酵母筛选及其复合酵母发酵工艺研究[D].贵阳:贵州大学, 2020.
ZHAO L Y.Screening of high-efficient yeasts in Green Plum Wine and study on fermentation technology of compound yeasts[D].Guiyang:Guizhou University, 2020.
[6] 王辉, 袁婷玉, 白卫东, 等.青梅自然发酵液中酵母菌的分离鉴定及特性研究[J].食品科技, 2021, 46(8):16-21.
WANG H, YUAN T Y, BAI W D, et al.Isolation, identification and characteristics of yeast from plum natural fermentation broth[J].Food Science and Technology, 2021, 46(8):16-21.
[7] 李亚辉, 梁颖, 王英, 等.枸杞内生酵母菌的筛选及其发酵特性研究[J].中国酿造, 2019, 38(4):121-125.
LI Y H, LIANG Y, WANG Y, et al.Screening and fermentation performances of endogenous yeast from wolfberry[J].China Brewing, 2019, 38(4):121-125.
[8] 卢延想, 梁慧珍, 陈鹏, 等.高温大曲中产香酵母的筛选及特征香气分析[J].食品研究与开发, 2021, 42(11):167-174.
LU Y X, LIANG H Z, CHEN P, et al.Screening and characteristic aroma analysis of aroma-producing yeasts in high-temperature Daqu[J].Food Research and Development, 2021, 42(11):167-174.
[9] 张丽, 卢红梅, 陈莉, 等.酱香型大曲贮存过程中发酵性能变化的研究[J].现代食品科技, 2017, 33(9):231-237.
ZHANG L, LU H M, CHEN L, et al.Study on changes in the biochemical properties of Maotai-flavor Daqu during storage[J].Modern Food Science and Technology, 2017, 33(9):231-237.
[10] LAI Y T, HSIEH C W, LO Y C, et al.Isolation and identification of aroma-producing non-Saccharomyces yeast strains and the enological characteristic comparison in wine making[J].LWT, 2022, 154:112653.
[11] 赵雪平, 温雅娇, 李正英, 等.内蒙古乌海地区果园及发酵醪液中酿酒酵母菌的筛选[J].食品与发酵工业, 2020, 46(11):178-183.
ZHAO X P, WEN Y J, LI Z Y, et al.Screening of Saccharomyces cerevisiae from orchards and fermentation mash in Wuhai Inner Mongolia[J].Food and Fermentation Industries, 2020, 46(11):178-183.
[12] YANG Y J, XIA Y J, LIN X N, et al.Improvement of flavor profiles in Chinese rice wine by creating fermenting yeast with superior ethanol tolerance and fermentation activity[J].Food Research International, 2018, 108:83-92.
[13] 李玉花. 山西葡萄产区酿酒酵母的优选与鉴定及其共发酵特性分析[D].呼和浩特:内蒙古农业大学, 2021.
LI Y H.Selection and identification of Saccharomyces cerevisiae in Shanxi Grape production area and analysis of its co-fermentation characteristics[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[14] HONG M E, LEE K S, YU B J, et al.Identification of gene targets eliciting improved alcohol tolerance in Saccharomyces cerevisiae through inverse metabolic engineering[J].Journal of Biotechnology, 2010, 149(1-2):52-59.
[15] 冯文倩, 王倩, 刘延琳, 等.低产乙醇本土有孢汉逊酵母的筛选及酿造特性[J].食品与发酵工业, 2021, 47(21):9-17.
FENG W Q, WANG Q, LIU Y L, et al.Screening and oenological properties of Hanseniaspora strains with low ethanol yield[J].Food and Fermentation Industries, 2021, 47(21):9-17.
[16] 冯莉, 陈雪, 李丽, 等.5株克鲁维毕赤酵母的酿造学特性[J].中国食品学报, 2018, 18(12):66-73.
FENG L, CHEN X, LI L, et al.The enology characteristics of five strains of Pichia kluyveri[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(12):66-73.
[17] GSCHAEDLER A, I IGUEZ-MU
IGUEZ-MU OZ L E, FLORES-FLORES N Y, et al.Use of non-Saccharomyces yeasts in cider fermentation:Importance of the nutrients addition to obtain an efficient fermentation[J].International Journal of Food Microbiology, 2021, 347:109169.
OZ L E, FLORES-FLORES N Y, et al.Use of non-Saccharomyces yeasts in cider fermentation:Importance of the nutrients addition to obtain an efficient fermentation[J].International Journal of Food Microbiology, 2021, 347:109169.
[18] WANG B S, TAN F L, CHU R C, et al.The effect of non-Saccharomyces yeasts on biogenic amines in wine[J].Trends in Food Science & Technology, 2021, 116:1 029-1 040.
[19] DZIALO M C, PARK R, STEENSELS J, et al.Physiology, ecology and industrial applications of aroma formation in yeast[J].FEMS Microbiology Reviews, 2017(S1), 41:95-128.
[20] ZHANG M M, ZHANG K Y, MEHMOOD M A, et al.Deletion of acetate transporter gene ADY2 improved tolerance of Saccharomyces cerevisiae against multiple stresses and enhanced ethanol production in the presence of acetic acid[J].Bioresource Technology, 2017, 245(Pt B):1 461-1 468.