Ⅱ型糖尿病是一种主要表现为胰岛素抵抗或分泌不足而导致患者血糖显著升高的慢性内分泌代谢疾病,患者各组织可因此受损,严重危害着居民健康并带来沉重的医疗负担[1]。
近年来ω-3系列多不饱和脂肪酸在Ⅱ型糖尿病方面的作用日益引起人们的重视[2],其中源于海洋的二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahexaenoic acid, DHA)对Ⅱ型糖尿病的干预报道尚存在争议。有研究表明摄入鱼油的Ⅱ型糖尿病患者胰岛素敏感性和空腹血糖水平无变化,但低密度脂蛋白胆固醇和血清甘油三酯水平上升[3-5]。而MOSTAD等[6]发现鱼油会导致Ⅱ型糖尿病患者血糖上升,胰岛素敏感性降低,增加脂肪组织中ω-3系列多不饱和脂肪酸含量。此外,抗性麦芽糊精作为一种新型的非黏性膳食纤维,有助于维持血液和脂质分布,由于对人体健康的有益作用而引起广泛的关注[7]。LI等[8]研究发现,超重男性连续12周每日摄入 34 g抗性麦芽糊精可显著降低体内所有葡萄糖标志物包括空腹血糖水平、糖化血红蛋白及糖化血清白蛋白水平,并降低胰岛素和胰岛素抵抗,后两者与ALIASGHARZADEH等[9]研究一致。据报道抗性麦芽糊精可显著影响肠道菌群组成。BAER等[10]研究表明,每天摄入25~50 g抗性麦芽糊精可以呈剂量依赖性方式增加数种肠道菌的数量,如双歧杆菌、拟杆菌、毛螺菌科、粪球菌和梭状芽孢杆菌等。而机体肠道微生态变化与Ⅱ型糖尿病的发生发展密切相关[11-12]。
尽管在过去十年关于n-3不饱和脂肪酸的应用有了有效的经验证据,但其在临床上的使用或联合使用(例如联合益生菌、益生元、饮食/生活方式使用)在特定背景下预防和改善Ⅱ型糖尿病及其并发症的效果方面目前证据尚不清晰且结果不一[13],且对糖尿病患者肠道菌群的影响缺乏数据。因此,本文用EPA/DHA联合麦芽糊精(maltodextrin,MED)饲喂糖尿病SD大鼠,检测EPA/DHA和抗性麦芽糊精联合使用对糖尿病大鼠空腹血糖、脏器指数及脏器脂类蓄积以及肠道菌群的影响,为EPA/DHA的联合应用提供初步供理论依据。
1 材料与方法
1.1 实验材料
SD大鼠(SPF级)购于安徽医科大学实验动物中心(生产许可证scxk(皖)2017-001)。
1.2 实验试剂
EPA、DHA联合MED(含DHA 8.8%、EPA 12.5%和MED 70%,均为质量分数),上海麦克林生化科技有限公司;链脲佐菌素(streptozocin,STZ),Sigma-Aldrich生物公司;液相色谱所用流动相试剂、标准品(98%)等,上海麦克林生化科技有限公司。
1.3 仪器与设备
FA220 4B电子分析天平,上海佑科仪器仪表有限公司;高效液相色谱备有SPD-20A紫外可见检测器,岛津企业管理(中国)有限公司;ROCHE罗氏血糖仪(家用活力型),罗氏诊断产品(上海)有限公司。
1.4 实验方法
1.4.1 Ⅱ型糖尿病大鼠模型的建立
10.0 mg/mL STZ溶液的配制参考克迎迎[14]的方法。各实验组大鼠(3周龄)饲喂高脂高糖饲料,期间自由饮水。喂养28 d后,禁食12 h,模型组按40 mg/kg BW剂量腹腔注射STZ,正常对照组则注射等量柠檬酸盐缓冲液。禁食12 h尾端采血测血糖,血糖值≥11.1 mmol/L即为造模成功。
1.4.2 动物分组及实验设计
SD大鼠共30只,每组雌雄各半。分组为正常对照组(CK组,6只),糖尿病组(STZ组),MED低/中/高剂量组(分别记为MED 1/2/3组),STZ和MED组每组选取造模成功的SD大鼠6只。MED 1/2/3组灌胃剂量分别为0.25、0.50、1.0 g/(kg·d);STZ组和CK组灌胃生理盐水,连续灌胃28 d,期间每天记录各组大鼠体重、饮水量、空腹血糖等状况。灌胃结束后乙醚麻醉大鼠并解剖,心脏取血用于血脂分析,摘取心、肝、脾、肺、肾器官称重。无菌取结肠内粪便用于肠道菌群分析。
1.4.3 空腹血糖浓度测定
禁食不禁水12 h后尾静脉取血,按罗氏测糖仪使用说明书检测大鼠血糖。
1.4.4 脏器系数测定
将1.4.2所取得的各内脏器官称重记录,按公式(1)计算各脏器系数:
脏器系数![]()
(1)
1.4.5 脂类分布测定
取0.3 g器官组织样品,加3.0 mL氯仿甲醇溶液[V(氯仿)∶V(甲醇)=1∶2]研磨2 min,加入1.0 mL的氯仿研磨30 s,加入1.0 mL水研磨30 s。吸取下层1.0 mL于EP管中,水浴挥干溶剂并烘干至恒重,称取质量m2,按公式(2)计算各器官组织脂类蓄积量:
脂类蓄积量![]()
(2)
式中,mEP管为EP管的质量;m样品为所取器官组织样品的质量;n为稀释倍数2。
1.4.6 肠道菌群16S rDNA扩增子测序及分析
该实验委托天根生化科技有限公司。根据所扩增的16S区域特点,构建小片段文库,基于Illumina测序平台对该文库进行双末端测序,得到双端测序reads。采用CTAB或十二烷基硫酸钠(sodium dodecyl sulfate,SDS)方法对样本的基因组DNA进行提取,以稀释后的基因组DNA为模板;根据测序区域的选择,使用带Barcode的特异引物进行PCR。PCR反应条件见表1。
表1 PCR反应条件
Table 1 PCR reaction conditions
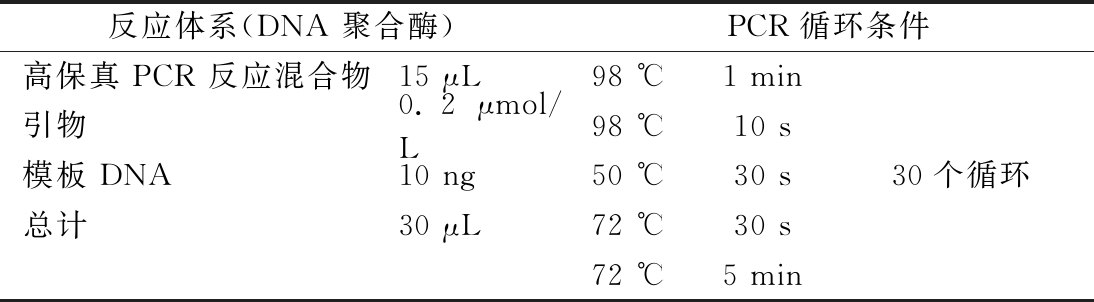
反应体系(DNA 聚合酶)PCR循环条件高保真 PCR 反应混合物15 μL98 ℃1 min引物0.2 μmol/L98 ℃10 s模板 DNA10 ng50 ℃30 s30个循环总计 30 μL72 ℃30 s 72 ℃5 min
将1×loading buffer(含SYBR green)与PCR产物等量混合,在2%琼脂糖凝胶上进行电泳检测。选择主带亮度在400~450 bp的样品进行进一步实验。根据PCR产物浓度进行等浓度混样,并使用TIANgel Purification Kit (TIANGEN Biotech)进行纯化,纯化产物用于制备Illumina DNA文库。使用TIANSeq快速DNA文库构建试剂盒(illumina平台)(TIANGEN Biotech)构建测序文库,构建好的文库经过Qubit定量和Agient2100文库检测,合格后,使用Illumina平台进行PE250 bp测序,得到250 bp的双端测序reads。通过对reads拼接过滤,序列去噪或者操作分类单元(operational taxonomic units,OTUs)分组,并进行物种注释及丰度分析,揭示样品的物种构成,并进行各组间的比对考察受试物对SD大鼠肠道菌群的影响。
1.4.7 血液有机酸的测定
大鼠血液处理:200 μL血液与600 μL 0.7 mol/L偏磷酸混旋30 s。在-4 ℃冷却沉淀10 min后,12 000×g离心15 min,过0.22 μm水系膜。
液相色谱条件:Ultimate AQ-C18上海月旭(Welch)液相色谱柱(250 mm×4.6 mm,5 μm),检测波长210 nm;柱温25 ℃;流速0.7 mL/min;进样体积20 μL。流动相A为10 mmol/L pH 2.5磷酸二氢钾,流动相B为乙腈。丙酸、丁酸、正戊酸、异戊酸、新戊酸、酒石酸流动相条件为0~40 min,5% B;40~45 min,5%~30%;45~60 min,30% B;60~65 min, 30%~5% B;65~70 min, 5% B。
1.5 统计分析
各样本检测数据结果表示为平均值±标准偏差,利用SPSS进行单因素方差分析(IBM SPSS Statistics 20.0,Duncan test)。对测序原始数据进行拼接、过滤,得到有效数据,基于有效数据按照QIIME2 dada2分析流程或Vsearch的分析流程进行序列去噪或OTU聚类,随后再进行物种分类分析。根据去噪或者聚类结果,对每个序列做物种注释,对去重序列扩增子序列变体(amplicon sequence variants,ASVs)或OTUs进行丰度、Alpha多样性等分析以得到样本内物种丰富度/均匀度信息等,并比较不同样品在物种多样性方面的相似程度。扩增子的注释结果还可以利用PICRUST软件相应的功能数据库相关联,对其KEGG等数据库进行相关分析。通过偏最小二乘判别分析(partial least-squares discrimination analysis,PLS-DA)探究不同样本或组别间群落结构的差异。物种注释部分利用R语言工具绘制成样品各分类学水平下的群落结构图。
2 结果与分析
2.1 MED对大鼠饮水量的影响
由图1可知,STZ组大鼠饮水量明显超过CK组,出现糖尿病的多饮症状。除第7天外,MED组大鼠饮水量均显著低于STZ组(P<0.05),说明MED灌胃可一定程度上缓解糖尿病所引起的多饮症状,但不同组别间无显著差异(除第13天和第25天外,P<0.05)。

图1 MED对SD大鼠水摄入量的影响
Fig.1 Effect of MED on water intake of SD mice
注:不同大写字母表示同一组别不同时间差异显著(P<0.05);不同小写字母表示不同组别同一时间差异显著(P<0.05)(图2同)
2.2 MED对大鼠空腹血糖的影响
由图2可知,STZ组大鼠空腹血糖值明显高于CK组,出现显著高血糖症状(P<0.05),说明造模成功。灌胃后MED组大鼠血糖虽有降低但仍>11.1 mmol/L。MED1和MED3组在灌胃前期短时间内对血糖升高有缓解趋势,但后期效果不明显;MED2组后期降血糖效果较其他MED剂量组好,但均无统计学意义。

图2 MED对SD大鼠空腹血糖的影响
Fig.2 Effect of MED on fasting blood glucose of SD mice
2.3 MED对大鼠脏器系数的影响
由图3可知,大鼠注射STZ后各器官脏器系数均显著或非显著增高。脏器系数增大,表示脏器充血、水肿或增生肥大等。在灌胃MED后,各MED组对于糖尿病引起的肝脏系数和肾脏系数增大有一定的缓解作用。中剂量MED对于糖尿病导致的大鼠各器官脏器系数增大有一定的改善作用。康黎等[15]的实验证明了EPA对于糖尿病引起的心脏脏器系数增大问题有所改善,张敏芳等[16]的实验证明了EPA对于糖尿病引起的肾脏脏器系数增大问题有积极作用。
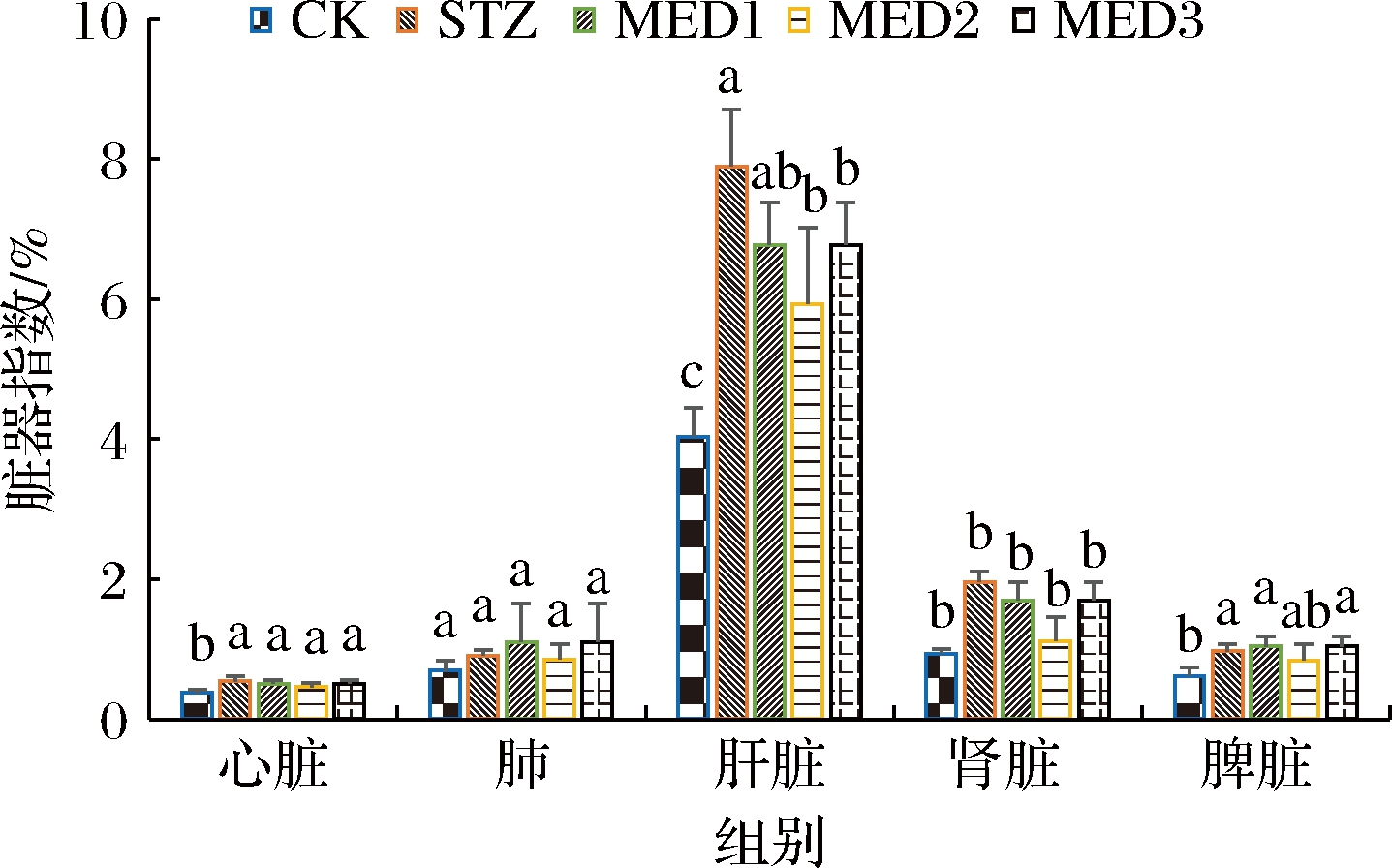
图3 MED对SD大鼠脏器指数的影响
Fig.3 Effect of MED on visceral coefficient of SD mice
注:不同小写字母表示差异显著(P<0.05)(图4同)
2.4 MED对大鼠脂类分布的影响
由图4可知,STZ组的平均脂类蓄积量均高于或显著高于CK组,可能是糖尿病引起大鼠体内脂质代谢紊乱有关[17]。MED组各器官脂类蓄积量均高于或显著高于STZ组,且MED组各器官脂类蓄积量在脾脏、肾脏和肝脏中呈一定的剂量依赖性关系。MED不仅无法减缓糖尿病引起的脂质蓄积量增长,反而加剧了这种变化,这可能与MED中含有的ω-3系列不饱和脂肪酸EPA/DHA引起的脂类代谢紊乱有关[2]。
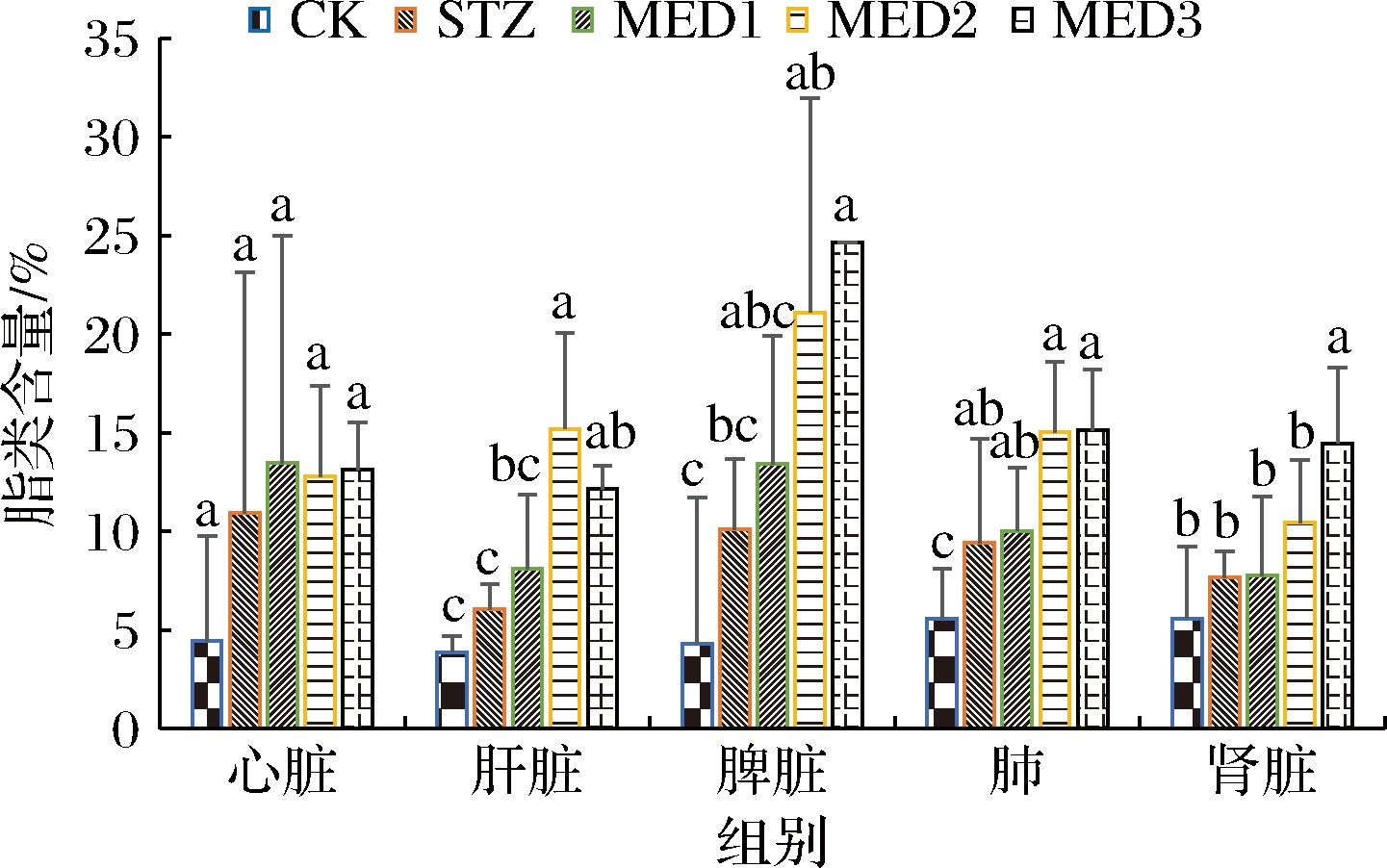
图4 MED对SD大鼠脂分布的影响
Fig.4 Effect of MED on lipids distribution of SD mice
2.5 MED对大鼠肠道菌群的影响
2.5.1 Alpha多样性分析
Alpha多样性反映的是样本内的微生物群落多样性,通过对单个样品的多样性分析可以反映样本内的物种丰度及物种多样性。Alpha多样性衡量指标有Chao1、Ace、Shannon、Simpson,见图5。Chao1和Ace指数衡量物种丰度即物种数量的多少。Shannon和Simpson指数用于衡量物种多样性,受样品群落中物种丰度和物种均匀度的影响。相同物种丰度的情况下,群落中各物种具有越大的均匀度,则认为群落具有越大的多样性,Shannon指数和Simpson指数值越大,说明样品的物种多样性越高[18]。由图5-a、图5-b可知,和CK组相比,STZ组Chao1和Ace指数有降低,而MED2和MED3组可显著提高该指数(P<0.05),说明中高MED可改善糖尿病引起的肠道菌群物种数量的降低。由图5-c可知,中高剂量MED可改善糖尿病引起的肠道菌群物种多样性的降低(P<0.05)。

a-α多样性分析Chao1指数;b-α多样性分析Ace指数;c-α多样性分析Shannon指数;d-α多样性分析Simpson指数
图5 α多样性分析指数箱线图
Fig.5 Boxplots of α-diversity index
注:*表示差异显著(P<0.05)
2.5.2 物种注释及相关分析
将所测得的序列与微生物参考数据库来进行对比得到每个物种分类信息,生成不同分类水平上的物种丰度表,并绘制各处理组在属水平的相对丰度柱形累加图(图6),取丰度水平前10的菌属统计。
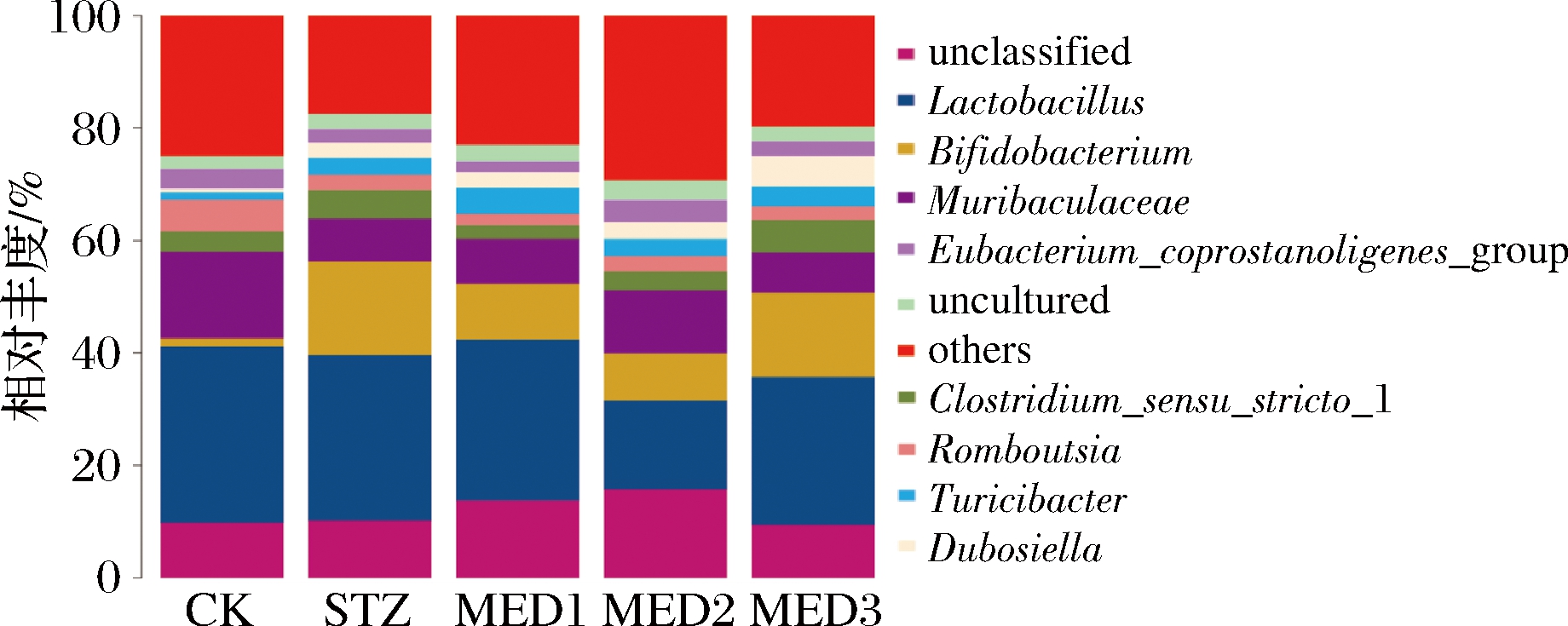
图6 属水平上各组肠道菌群物种相对丰度柱形累加图
Fig.6 Histogram of relative abundance of the main gut bacteria in each group at genus level
STZ组与CK组相比,乳杆菌属的相对丰度略有减少;双歧杆菌属的相对丰度有显著增加(P<0.05);Muribaculaceae的相对丰度明显减少(P<0.05)。各MED组与STZ组相比,各处理实验组双歧杆菌属的相对丰度都有较为显著的减少(P<0.05),因此认为MED可以有效改善糖尿病大鼠双歧杆菌属的相对丰度至正常水平。MED1和MED2组Muribaculaceae的相对丰度相较于STZ组有所增加,因此一定程度上改善糖尿病大鼠Muribaculaceae的相对丰度。
于斌等[19]通过与健康人群比对后发现糖尿病患者肠道双歧杆菌属显著增加,乳酸杆菌属显著减少,且患者肠道内的菌群多样性有降低趋势,说明糖尿病会使得肠道菌群的种属产生差异。李彩凤[20]对多位糖尿病患者和同期相同数量的健康人员的肠道菌群变化进行研究,结果显示,糖尿病组Muribaculaceae、乳酸杆菌数量则低于健康组。而本文亦发现糖尿病大鼠的Muribaculaceae和乳酸杆菌属相对丰度低于健康组,该结论与本文所得结论一致。有研究表明肠道菌群失调和糖尿病的发生、发展关系密切,给予糖尿病患者口服乳酸杆菌4周后,发现患者胰岛素敏感性较治疗前明显改善[21]。推测MED能在一定程度上提高大鼠肠道Muribaculaceae和乳酸杆菌属丰度,改善糖尿病治疗效果。
2.5.3 PLS-DA
由图7-a基于物种丰度的PLS-DA得出,MED2更显著区别于其他MED处理组,且区别于STZ组,说明MED中剂量对糖尿病大鼠肠道菌群在物种丰度方面产生特定影响;由图7-b可知,MED2组在功能丰度方面区别于对照组,说明MED2大鼠肠道菌群的功能不同于普通大鼠肠道菌群的功能;结合MED2组后期降血糖效果优于其他MED剂量组,可以推测MED中剂量对使糖尿病大鼠的肠道菌群产生了较为积极的影响,这些影响可能更有利于糖尿病大鼠血糖的降低。
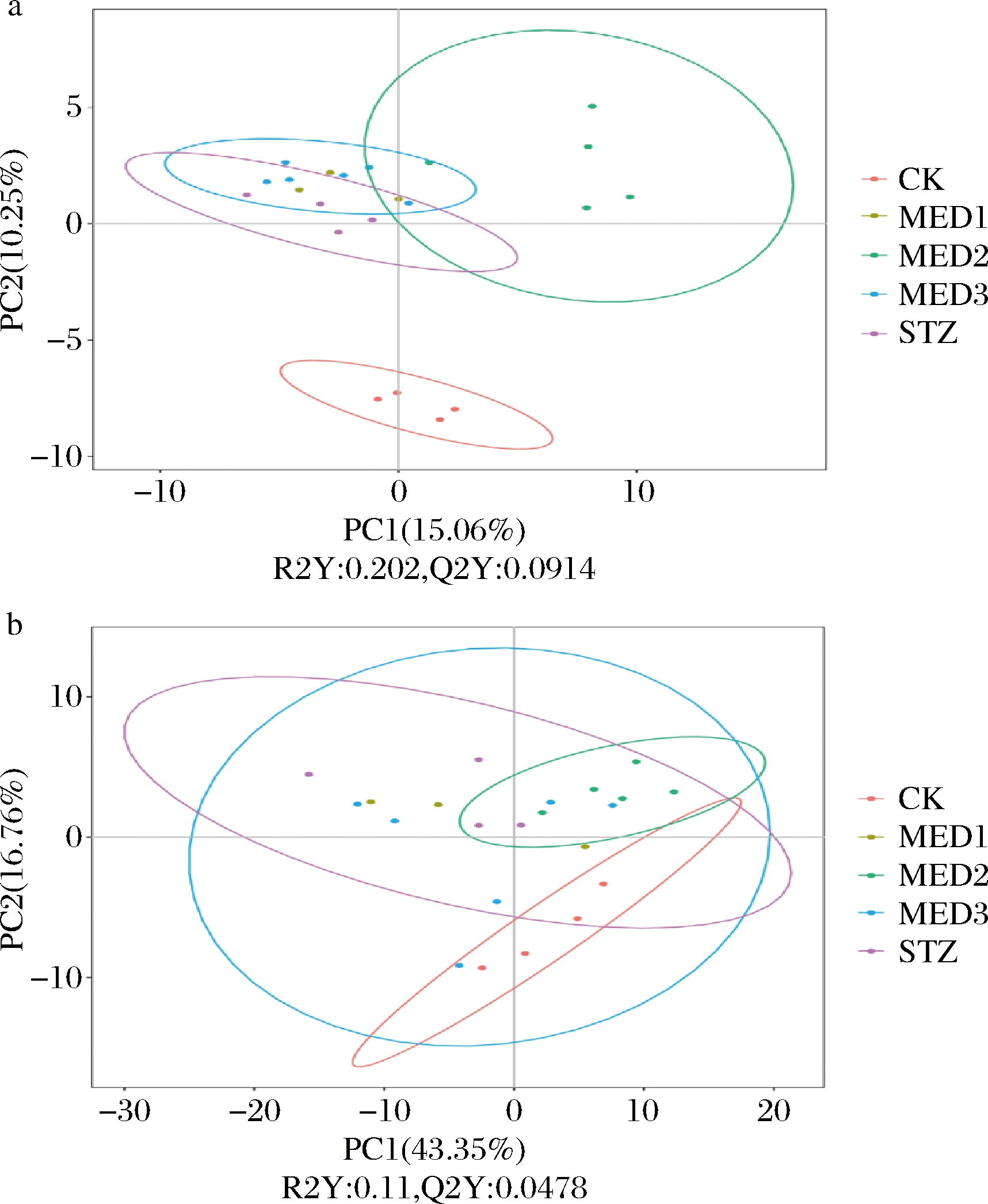
a-基于物种丰度的PLA-DA;b-基于功能丰度的PLS-DA
图7 基于功能丰度和物种丰度的PLS-DA
Fig.7 PLS-DA based on species or functional abundance
2.6 血液有机酸
各处理组血液中丙酸、丁酸、正戊酸、异戊酸、新戊酸含量见图8,各有计算含量均无显著差异(P<0.05),甲酸、乙酸、酒石酸未检出。关于丙酸,STZ组、MED1组、MED2组的浓度相较于CK组均有升高趋势,MED3 组未检测出丙酸含量,MED2组相较于STZ组有下降趋势,说明糖尿病可导致血液中丙酸含量的上升,而中剂量MED对此有缓解趋势。丁酸仅在STZ组和MED2组中检测出,其余组未检出,说明糖尿病可引起丁酸含量的升高,而MED可缓解此趋势。相较于CK组,STZ 组异戊酸浓度均有降低趋势,相较于STZ组,MED组异戊酸均有升高趋势,说明糖尿病可降低异戊酸含量而MED具有改善作用。各处理组正戊酸的变化趋势和异戊酸相似,MED可阻止糖尿病引起的正戊酸变化。新戊酸仅在STZ组、MED1组和MED2组中检测出含有新戊酸,且MED2组新戊酸浓度增高趋势明显,其余组未检出。糖尿病具有改变大鼠血液中的有机酸如丙酸、丁酸、异戊酸和正戊酸的趋势,而MED可改善糖尿病大鼠血液中有机酸的变化。
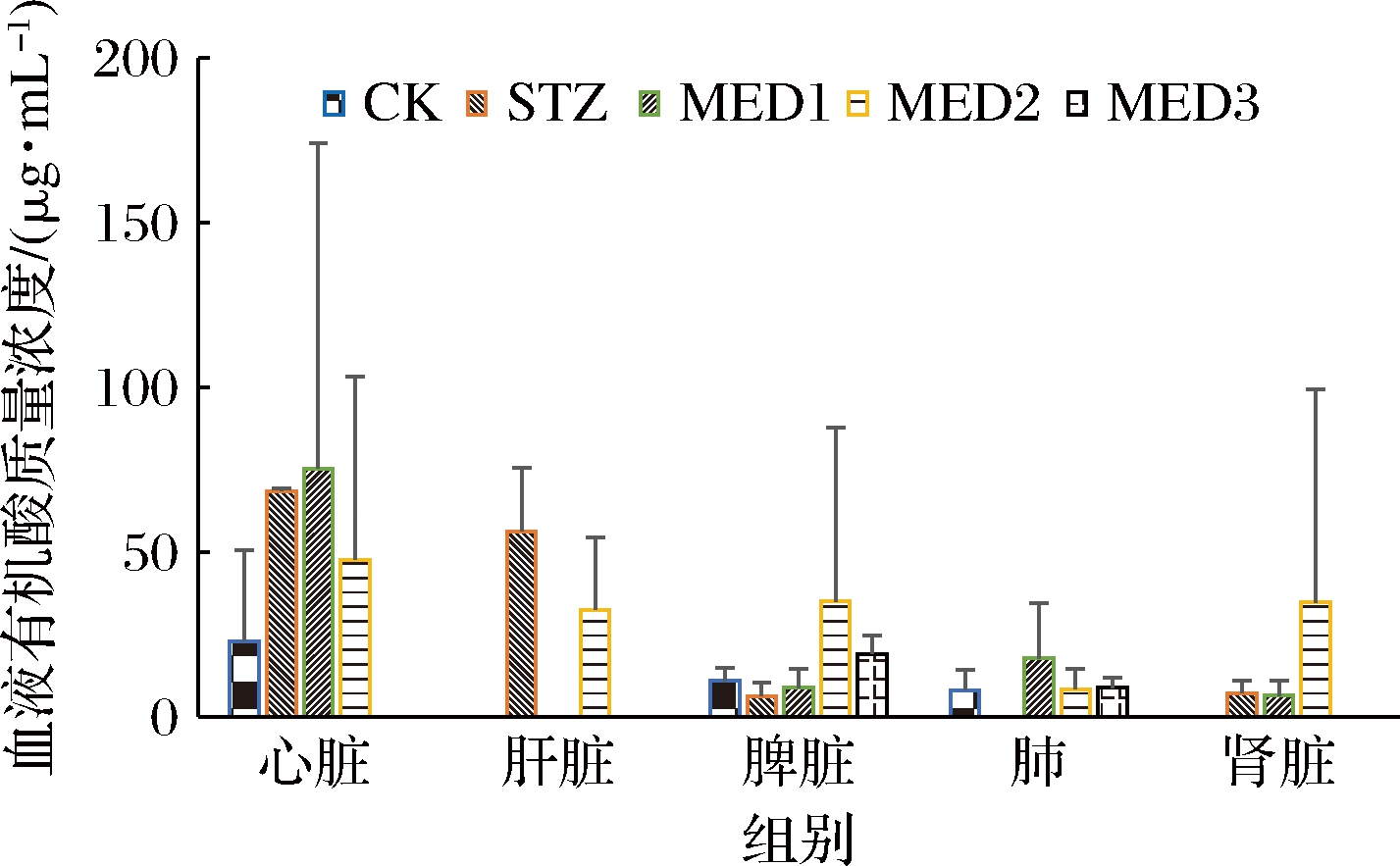
图8 各处理组血液中有机酸的含量
Fig.8 Blood levels of organic acid in each treatment group
3 结论
本文研究发现,MED灌胃对糖尿病引起的多饮症状有一定的缓解作用,低剂量和高剂量MED在短时间内对血糖升高有缓解趋势,但后期效果不明显;MED中剂量后期降血糖趋势较其他MED剂量组好。MED对于糖尿病引起的肝脏系数和肾脏系数增大有一定的缓解作用;尤其中剂量MED对于降低糖尿病导致的大鼠各器官脏器系数的增大有较好的改善趋势,但是会引起脂类在心脏、肝脏、脾脏、肺、肾脏中的蓄积。
糖尿病对大鼠体内肠道菌群有一定影响,中高MED可改善糖尿病引起的肠道菌群物种数量的降低;MED可以有效改善糖尿病大鼠双歧杆菌属的相对丰度至正常水平,但仅MED中低剂量组在一定程度上改善糖尿病大鼠Muribaculaceae的相对丰度,并且中剂量对使糖尿病大鼠的肠道菌群产生了较为积极的影响。同时糖尿病会对大鼠血液的有机酸浓度产生影响,而MED可以一定程度上调节糖尿病大鼠血液中有机酸如丙酸、丁酸、异戊酸和正戊酸的含量。本文初步研究了MED对糖尿病大鼠多饮症、空腹血糖、脏器系数、脂类分布、肠道菌群以及血液中有机酸的影响,为MED在Ⅱ型糖尿病方面的作用提供一定的理论依据。
[1] 刘柳. 二甲双胍联合胰岛素泵强化治疗2型糖尿病合并代谢综合征40例[J].临床荟萃, 2014, 29(9):1 047-1 050.
LIU L.Metformin combined with insulin pump for intensive treatment of 40 cases of type 2 diabetes mellitus complicated with metabolic syndrome[J].Clinical Focus, 2014, 29(9):1 047-1 050.
[2] 王锋, 杨立刚, 孙桂菊.ω-3多不饱和脂肪酸对Ⅱ型糖尿病患者糖脂代谢的影响[J].食品安全质量检测学报, 2015, 6(10):3 907-3 910.
WANG F, YANG L G, SUN G J.Effect of ω-3 polyunsaturated fatty acids on glucose and lipid metabolism in patients with type 2 diabetes[J].Journal of Food Safety and Quality, 2015, 6(10):3 907-3 910.
[3] ANNUZZI G, RIVELLESE A, CAPALDO B, et al.A controlled study on the effects of n-3 fatty acids on lipid and glucose metabolism in non-insulin-dependent diabetic patients[J].Atherosclerosis, 1991, 87(1):65-73.
[4] FRIEDBERG C E, JANSSEN M J, HEINE R J, et al.Fish oil and glycemic control in diabetes.A meta-analysis[J].Diabetes Care, 1998, 21(4):494-500.
[5] MONTORI V M, FARMER A, WOLLAN P C, et al.Fish oil supplementation in type 2 diabetes:A quantitative systematic review[J].Diabetes Care, 2000, 23(9):1 407-1 415.
[6] MOSTAD I L, BJERVE K S, BJORGAAS M R, et al.Effects of n-3 fatty acids in subjects with type 2 diabetes:Reduction of insulin sensitivity and time-dependent alteration from carbohydrate to fat oxidation[J].The American Journal of Clinical Nutrition, 2006, 84(3):540-550.
[7] ASTINA J, SAPWAROBOL S.Resistant maltodextrin and metabolic syndrome:A review[J].Journal of the American College of Nutrition, 2019, 38(4):380-385.
[8] LI S G, GUERIN-DEREMAUX L, POCHAT M, et al.NUTRIOSE dietary fiber supplementation improves insulin resistance and determinants of metabolic syndrome in over weight men:A double-blind, randomized, placebo-controlled study[J].Applied Physiology, Nutrition, and Metabolism, 2010, 35(6):773-782.
[9] ALIASGHARZADEH A, DEHGHAN P, GARGARI B P, et al.Resistant dextrin, as a prebiotic, improves insulin resistance and inflammation in women with type 2 diabetes:A randomised controlled clinical trial[J].The British Journal of Nutrition, 2015, 113(2):321-330.
[10] BAER D J, STOTE K S, HENDERSON T, et al.The metabolizable energy of dietary resistant maltodextrin is variable and alters fecal microbiota composition in adult men-3[J].The Journal of Nutrition, 2014, 144(7):1 023-1 029.
[11] 崔祥, 陶金华, 江曙, 等.肠道菌群与Ⅱ型糖尿病相关性的研究进展[J].中国微生态学杂志, 2017, 29(11):1 346-1 349.
CUI X, TAO J H, JIANG S, et al. Research progress of relationship of gut microbiota and type 2 diabetes mellitus[J]. Chinese Journal of Microecology, 2017, 29(11):1 346-1 349.
[12] FLINT H J, SCOTT K P, LOUIS P, et al.The role of the gut microbiota in nutrition and health[J].Nature Reviews Gastroenterology & Hepatology, 2012, 9(10):577-589.
[13] KUMAR M, PAL N, SHARMA P, et al.Omega-3 fatty acids and their interaction with the gut microbiome in the prevention and amelioration of type-2 diabetes[J].Nutrients, 2022, 14(9):1723.
[14] 克迎迎. 基于蛋白组学技术研究卷柏总黄酮及穗花杉双黄酮降糖作用机制[D].郑州:河南中医学院, 2014.
KE Y Y.The research of total flavonoids of Selaginella tamariscina (Beauv.) spring and amentoflavone on improving insulin resistance by the method of proteomics[D].Zhengzhou:Henan College of Chinese Medicine, 2014.
[15] 康黎, 邹勇, 李宏增, 等.二十碳五烯酸在糖尿病心肌病损伤中的作用及机制[J].心脏杂志, 2019, 31(5):521-525.
KANG L, ZOU Y, LI H Z, et al.Role and mechanism of eicosapentaenoic acid in cardiac injury of diabetic cardiomyopathy[J].Chinese Heart Journal, 2019, 31(5):521-525.
[16] 张敏芳, 钱家麒, TOMINO YASUHIKO.二十碳五烯酸对早期糖尿病肾病小鼠炎症和氧化应激状态的作用[J].中国中西医结合肾病杂志, 2008, 9(8):668-670;754.
ZHANG M F, QIAN J Q, TOMINO Y.Effects of eicosapentaenoic acid on the inflammation and oxidative stress during the early stage of diabetic nephropathy in KKAy /Ta mice[J].Chinese Journal of Integrated Traditional and Western Nephrology, 2008, 9(8):668-670;754.
[17] 胡传水. 2型糖尿病患者血脂水平分析[J].医学检验与临床, 2008, 19(1):55-56.
HU C S.Analysis of blood-lipid level on type 2 diabetes mellitus[J].Medical Laboratory Science and Clinics, 2008, 19(1):55-56.
[18] GRICE E A, KONG H H, CONLAN S, et al.Topographical and temporal diversity of the human skin microbiome[J].Science, 2009, 324(5 931):1 190-1 192.
[19] 于斌, 王敏, 李丹, 等.Ⅱ型糖尿病痰湿热互结证患者肠道菌群特征分析[J].世界中西医结合杂志, 2020, 15(11):2 102-2 107;2 111.
YU B, WANG M, LI D, et al.Analysis the characteristics of intestinal flora characteristics on T2DM with phlegm-dampness-heat syndrome[J].World Journal of Integrated Traditional and Western Medicine, 2020, 15(11):2 102-2 107;2 111.
[20] 李彩凤.Ⅱ型糖尿病胰岛素抵抗患者肠道菌群变化及与炎症因子水平的关系[J].现代实用医学, 2021, 33(5):670-671.
LI C F. Changes of intestinal flora and its relationship with inflammatory factors in patients with type 2 diabetes mellitus and insulin resistance[J]. Modern Practical Medicine, 2021, 33(5):670-671.
[21] ANDREASEN A S, LARSEN N, PEDERSEN-SKOVSGAARD T, et al.Effects of Lactobacillus acidophilus NCFM on insulin sensitivity and the systemic inflammatory response in human subjects[J].The British Journal of Nutrition, 2010, 104(12):1 831-1 838.