阿魏酸(ferulic acid, FA)是植物组织中含量最丰富的酚酸之一,以单体或二聚体的形式通过酯键或醚键与木质素和多糖共价连接[1]。由于FA是具有不饱和侧链的酚酸,使其拥有强大的抗氧化能力,具有很高的商业价值[2]。美国食品药品监督管理局在食品添加剂清单中将FA列为抗氧化剂[3]。除此之外,FA在食品工业中还被用作防腐剂、风味前体、胶凝剂、增稠剂[4]。目前工业上通常采用碱液浸提法制备FA,即在高温下碱液裂解原料的空间结构,使FA释放出来,然后加入有机溶剂进行提取。但是该法生产过程中产生大量废水废渣,造成了大量环境污染[5]。而酶解法反应条件温和且绿色环保,因此受到研究者的广泛关注。
阿魏酸酯酶(E.C.3.1.1.73),又称肉桂酸酯酶,该酶能水解FA与半纤维素或木质素之间的酯键,从植物细胞壁释放FA及其二聚体,通常被用作水解木质纤维素产FA。例如XU等[6]分离到一株阿魏酸酯酶的生产菌,在大肠杆菌中异源表达,纯化的阿魏酸酯酶分解0.2 g脱淀粉麦麸可产生199 μg FA,具有巨大的应用潜力。但是市场上的商用阿魏酸酯酶稀缺,而且游离阿魏酸酯酶易失活,难以回收利用限制了其工业化应用[7]。固定化酶具有可循环利用、快速分离的特点,可以很好的解决这类问题。HE等[8]使用磁性纳米颗粒固定化阿魏酸酯酶生产FA,与游离酶相比,固定化酶明显提高了最适反应温度和热稳定性,但是用于催化脱淀粉麦麸产FA时表现出较低的产物得率,主要是因为固定化酶与不溶性底物的接触性较差。
Eudragit L-100是一种由甲基丙烯酸-甲基丙烯酸甲酯组成的pH响应型聚合物,当溶液pH<4.0时,该聚合物不溶于水;当溶液pH>6.0时该聚合物溶于水[9]。因此,在一定的pH范围内,Eudragit L-100可与游离酶结合形成可溶性固定化酶用于催化反应,反应结束后,通过降低溶液pH值,将固定化酶从反应体系中分离出来[10]。该类型固定化酶用于催化反应尤其是作用于不溶性底物时,表现出较好的催化效果。例如YU等[11]在Eudragit L-100上共固定化3种酶(纤维素酶、葡萄糖氧化酶和过氧化氢酶),降解玉米秸秆中纤维素产葡萄糖酸,葡萄糖酸的产率为61.41%,6次循环后其活性仍保持52.38%。
近年来,随着对FA及其衍生物的研究越来越多,对于阿魏酸酯酶的研究也随之增加。针对固定化阿魏酸酯酶与不溶性的木质纤维素接触较差,难以与残留的固体底物完全分离这一问题,我们拟采用pH响应型聚合物Eudragit L-100固定化阿魏酸酯酶,探究其用于降解脱淀粉麦麸产FA的可行性。首先,对固定化酶的反应条件(交联剂浓度、固定化pH、固定化时间、反应温度等参数)进行优化,确定最佳固定化酶条件。其次,研究固定化后对阿魏酸酯酶酶学性质的影响。最后,采用固定化酶降解脱淀粉麦麸产FA,研究其催化性能。
1 材料与方法
1.1 材料与仪器
阿魏酸酯酶,Megazyme (Bray, Co.Wicklow, Ireland);FA、阿魏酸甲酯(ferulic acid methyl ester, MFA)、Eudragit L-100、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐[1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC],上海麦克林生化有限公司。
安捷伦1260高效液相色谱系统(紫外检测器),美国安捷伦科技有限公司;Nicolet iS 10傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy, FT-IR),赛默飞世尔科技(中国)有限公司;FEI Nova Nano SEM 450扫描电子显微镜,美国FEI公司。
1.2 实验方法
1.2.1 Eudragit L-100固定化酶
称取5 g Eudragit L-100至90 mL蒸馏水中,缓慢滴加3 mol/L NaOH调节pH至11.0,待完全溶解后,再缓慢滴加3 mol/L HCl调节pH至6.0,超声处理10 min,定容至100 mL,4 ℃贮存[11]。取一定浓度的EDC溶解于Eudragit L-100溶液(10 mL)中,搅拌10 min后,将阿魏酸酯酶(6 U)加入上述溶液中,室温搅拌一定时间,用浓度为100 mmol/L醋酸缓冲液调节pH至4.0进行沉淀,然后在4 ℃、10 000 r/min条件下离心10 min,再用pH 4.0的柠檬酸-磷酸盐缓冲液洗涤,最后将沉淀溶于10 mL 0.1 mol/L的PBS缓冲液(pH 6.0)中留作备用。
1.2.2 Eudragit L-100固定化酶形态和结构表征
采用扫描电镜对Eudragit L-100固定化酶前后的形态特征进行表征。采用FT-IR对固定化酶进行结构鉴定。
1.2.3 阿魏酸酯酶活性测定
以1 mmol/L MFA溶液为底物,测定阿魏酸酯酶的酶活力。底物原液(950 μL)在40 ℃保温10 min,加入稀释后的酶液(50 μL)开始反应。将混合物在40 ℃下保温5 min,然后煮沸5 min,终止反应。采用高效液相色谱法测定释放阿魏酸的含量,酶活性单位定义为每分钟释放1 μmol FA所需的量[1]。
1.2.4 固定化阿魏酸酯酶最适反应温度
50 μL固定化阿魏酸酯酶分别与950 μL 1 mmol/L MFA溶液在温度为20、30、40、50、60 ℃条件下反应5 min,100 ℃煮沸5 min,高效液相色谱测定阿魏酸酯酶的催化活性,将固定化阿魏酸酯酶的最高酶活力分别定义为100%,计算不同温度下固定化酶的相对酶活力。
1.2.5 固定化阿魏酸酯酶最适反应pH测定
50 μL固定化阿魏酸酯酶分别与950 μL pH为4.0、5.0、6.0、7.0、8.0、9.0的1 mmol/L MFA溶液反应5 min,100 ℃煮沸5 min,用高效液相色谱测定酶的催化活性,将固定化阿魏酸酯酶的最高酶活力定义为100%,计算不同pH值下固定化酶的相对酶活力。
1.2.6 固定化阿魏酸酯酶热稳定性及pH稳定性测定
测定固定化酶热稳定性,将固定化阿魏酸酯酶在30~70 ℃的PBS缓冲液(pH 6.0)中孵育1 h,然后测定其活性。测定固定化酶pH稳定性,将固定化阿魏酸酯酶置于40 ℃、pH 5.0~9.0的PBS缓冲液中孵育1 h,然后测定阿魏酸酯酶活性。
1.2.7 游离酶与固定化酶动力学参数测定
一定量的游离酶与固定化酶分别添加到一系列不同浓度MFA(0.25~10 mmol/L)的反应液中,在最适温度与最适pH下测定酶活力,使用Lineweaver-Burk双倒数法作曲线计算出Km和Vmax值[12]。
1.2.8 固定化阿魏酸酯酶贮藏稳定性测定
取游离酶与固定化阿魏酸酯酶,4 ℃冰箱放置,每隔7 d取50 μL游离酶与固定化酶测定其活性。
1.2.9 固定化阿魏酸酯酶可重复使用性测定
取10 mg/mL脱淀粉麦麸溶液,加入固定化酶在40 ℃、200 r/min的摇床上进行分解反应,12 h为1个循环。每次循环结束后,以8 000 r/min的速度离心使固定化阿魏酸酯酶与反应残余固体底物分离。然后收集含有固定化酶的上清液,将混合物的pH值调至4.0实现固定化酶的析出,4 ℃、10 000 r/min离心10 min,去掉上清液,pH 4.0的柠檬酸-磷酸盐缓冲液洗涤,进入下一轮反应,以此类推,重复使用5次[13]。
2 结果与分析
2.1 阿魏酸酯酶固定化参数的优化
在制备固定化酶的过程中,固定化时间、交联剂浓度、反应温度和固定化pH等因素都会影响酶的固定化,因此分别对这些参数进行优化。以加入的酶活性为总酶活性,固定化后的酶活性为剩余酶活性计算相对酶活性。
首先,研究了固定化时间对固定化酶活性的影响。如图1-a所示,随着固定化时间的延长,固定化酶的活性逐渐增加,并在固定化时间为1 h时达到峰值,随着固定化时间的延长,酶活性略有下降。
如图1-b所示,低浓度的EDC可能不能有效地激活Eudragit L-100上的羧基,因此使得固定化酶的活性较低。当EDC质量浓度为5 g/L时,固定化酶活性最高,由于基团活化已达到饱和,固定化酶的活性随EDC浓度的继续增加而略有下降。同时研究了固定化温度对固定化酶活性的影响,如图1-c所示,固定化酶活性在25 ℃时达到最大值,随着固定化温度的升高,固定化酶的活性略有下降。阿魏酸酯酶在Eudragit L-100上的固定化受pH的影响很大,如图1-d所示,固定化的阿魏酸酯酶活性随着pH从4.0增加到6.0而增加,并且在pH 6.0时达到最大值。当pH超过6.0时,固定化酶活性降低。原因可能是低pH值和高pH值的反应溶液使酶失活。载体在与交联剂进行交联反应后,会产生大量游离的OH-,使得溶液中pH值升高,而游离酶在高pH值情况下会损失部分酶活性(图5-b),因此会导致固定酶活性损失。

a-固定化时间;b-EDC质量浓度;c-固定化温度;d-固定化pH
图1 固定化阿魏酸酯酶最适参数
Fig.1 Optimization of the feruloyl esterase immobilization parameters
2.2 固定化前后的形态和结构特性
通过与空载体Eudragit L-100的红外光谱对比,证实阿魏酸酯酶成功固定化于载体Eudragit L-100上(图2)。在红外光谱中,在1 725 cm-1处吸收峰是Eudragit L-100的羧基特征吸收峰[14]。而图2(b)在1 725 cm-1吸收峰明显小于图2(a),表明阿魏酸酯酶成功吸附在载体Eudragit L-100上,同时固定化酶[图2(b)]在1 645 cm-1(氨基化合物上的C![]() O键)相比于空载体[图2(a)]新增加吸收峰,与此同时,在1 720~1 750 cm-1处吸收峰明显缩小,这表明酰化发生在N位上并且形成了—NH—CO—键[15]。
O键)相比于空载体[图2(a)]新增加吸收峰,与此同时,在1 720~1 750 cm-1处吸收峰明显缩小,这表明酰化发生在N位上并且形成了—NH—CO—键[15]。

a-Eudragit L-100;b-固定化酶
图2 固定化酶的FT-IR图
Fig.2 FT-IR spectra of immobilized enzyme
进一步采用扫描电子显微镜观察固定化酶形貌变化(图3),未改性Eudragit L-100共聚物的形态排列紧密,分布均匀,共聚物表面圆滑,呈球形(图3-a)。Eudragit L-100载体对阿魏酸酯酶进行共价改性后,共聚物变得高度均一,蛋白膜表面粗糙空洞(图3-b)。这是由于Eudragit L-100载体与蛋白酶分子共价交联,导致共聚物分子与酶分子键合牢固。在冷冻干燥过程中,蛋白质分子相互作用,在蛋白质表面形成膜和孔,共聚物被包埋在蛋白质分子中,分布较为均匀,呈现出新的形态特征[11]。

a-Eudragit L-100;b-固定化酶
图3 固定化酶的扫描电镜图
Fig.3 Scanning electron microscope of immobilized enzyme
2.3 固定化酶最适反应温度与最适反应pH
为确定固定化酶的最适反应温度和pH值,在不同的温度和pH值下进行催化反应。首先研究温度对酶活性的影响,如图4-a所示,游离阿魏酸酯酶和固定化酶在40 ℃下均表现出最佳催化活性。此外,固定化酶在更大范围内保持了比游离阿魏酸酯酶更高的相对活性。游离阿魏酸酯酶活性在40 ℃以上迅速下降,在60 ℃保持83%的残留活性。然而,固定化酶在60 ℃仍保持92%的残余活性。原因可能是载体与酶分子之间的多点共价连接会降低酶的构象灵活性[10,16]。
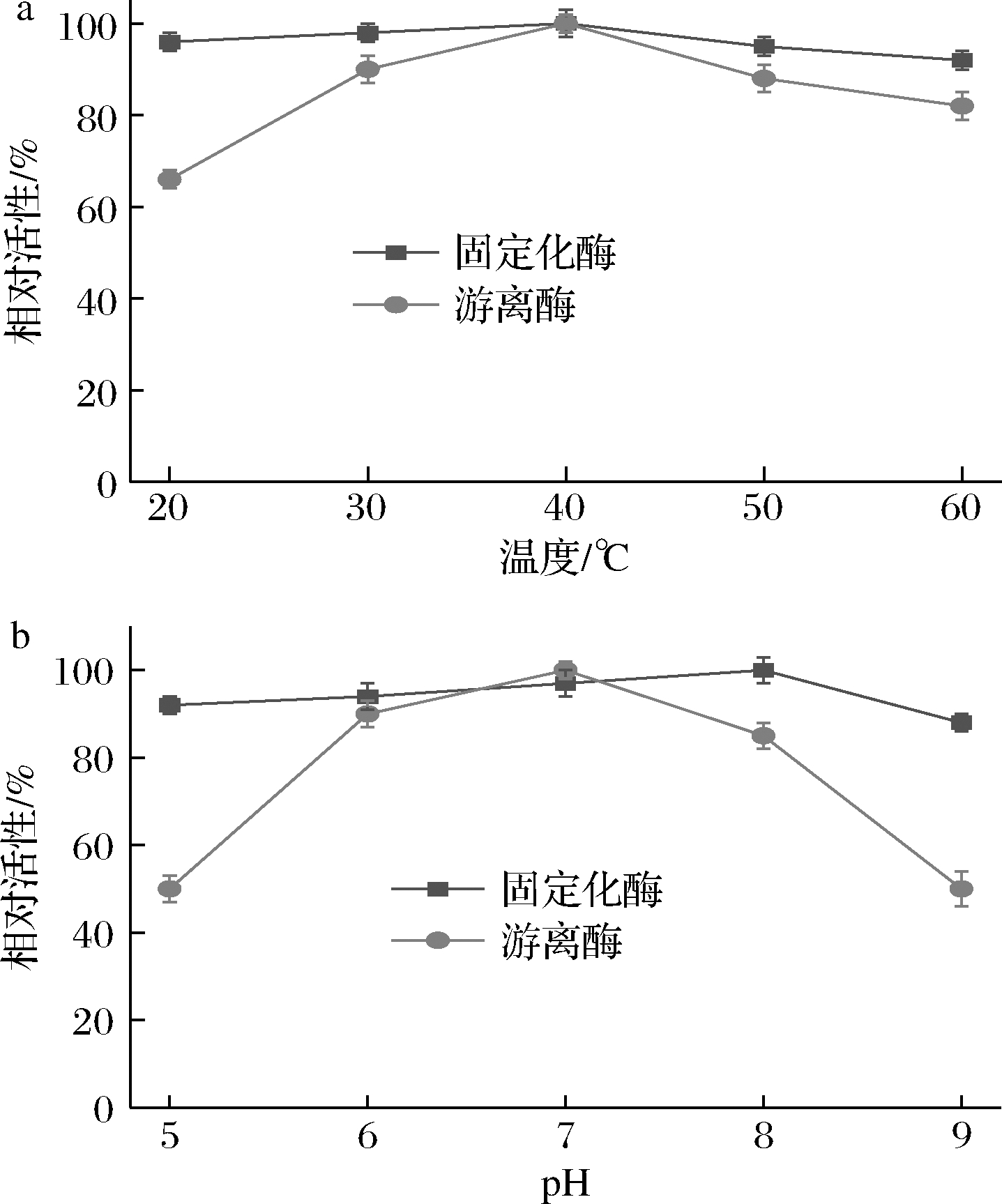
a-最适温度;b-最适pH
图4 固定化酶的最适温度和最适pH
Fig.4 Optimal temperature and pH of immobilized enzyme
在pH为5.0~9.0,温度为40 ℃条件下,研究pH对酶活性的影响,如图4-b所示,游离阿魏酸酯酶和固定化酶的最适反应pH值分别为7.0和8.0。此外与游离酶相比,固定化酶在更大pH范围内表现出更高的相对活性。根据文献报道,有些酶在固定化后最适反应pH发生了改变[17-18]。此外通过共价结合固定酶的pH值范围更广。
2.4 固定化酶热稳定性与pH稳定性
因为酶分子容易失活,因此考察固定化酶的稳定性非常重要。如图5-a所示,在30~70 ℃研究固定化酶的热稳定性。50 ℃保温1 h后,固定化酶的残留活性为50%。而游离阿魏酸酯酶在相同条件下只有30%的残留活性。经相同时间的70 ℃热处理后,固定化酶和游离酶的残余活性分别约为28%和2%。结果表明,固定化酶的热稳定性优于游离酶。这可能是由于载体与酶分子之间的多点共价键连接使酶的构象灵活性降低所致[19]。

a-热稳定性;b-pH稳定性
图5 固定化酶的热稳定性和pH稳定性
Fig.5 Temperature stability and pH stability of immobilized esterase
同时本文还研究了pH对固定化酶稳定性的影响,如图5-b所示,40 ℃保温1 h后,游离酶和固定化酶均能在pH 8.0时保持最大活性,残余活性分别为52%和61%。然而固定化酶在pH 5.0~9.0具有更高的稳定性,在pH 9.0时残留的酶活性保持近56%,而游离酶活性保持了28%。原因很可能是载体对酶分子的活性位点进行了保护[20]。
2.5 固定化酶动力学参数
如表1所示,固定化酶的Km值与Vmax值是游离酶的1.6倍与8.9倍,固定化酶的kcat值则是游离酶的14.5倍,酶的催化活性以kcat/Km表示,游离酶为0.125 L/(mmol·min),固定化酶为1.13 L/(mmol·min),与游离酶相比,固定化酶的Vmax值增大,Km也有所增加,kcat/Km值增加了9.04倍,动力学参数的这些变化说明固定化后,酶的催化反应效率提升。这是因为Eudragit L-100分子附着在酶蛋白上,使得固定化酶分子具有高的生物相容性以及亲水性,可能会影响到酶表面的水合度,反应条件为均相反应,没有阻碍底物与酶分子的接触,同时还抵御了外界环境的变化,对酶蛋白起保护作用,进而使得催化效率提高[21]。
表1 游离阿魏酸酯酶与固定化阿魏酸酯酶动力学参数
Table 1 Kinetic constants of ree and immobilized esterase

酶kcat/min-1Km/(mmol·L-1)kcat/Km/[L·(mmol·min)-1]游离酶0.070.560.125固定化酶1.020.901.13
2.6 固定化阿魏酸酯酶贮藏稳定性
如图6所示,贮存1周时,游离酶与固定化酶的酶活性降低都不明显,在贮存3周后,游离阿魏酸酯酶仅剩53%活性,而固定化阿魏酸酯酶仍能保持80%以上活性,说明经过固定化后,酶的贮存稳定性有所提升,原因可能是(1)固定化后阿魏酸酯酶形成多点共价连接,形成了共价键,有效的保护了酶的催化活性中心;(2)阿魏酸酯酶被固定化后限制了酶分子间的相互作用,增加了其贮藏时间。
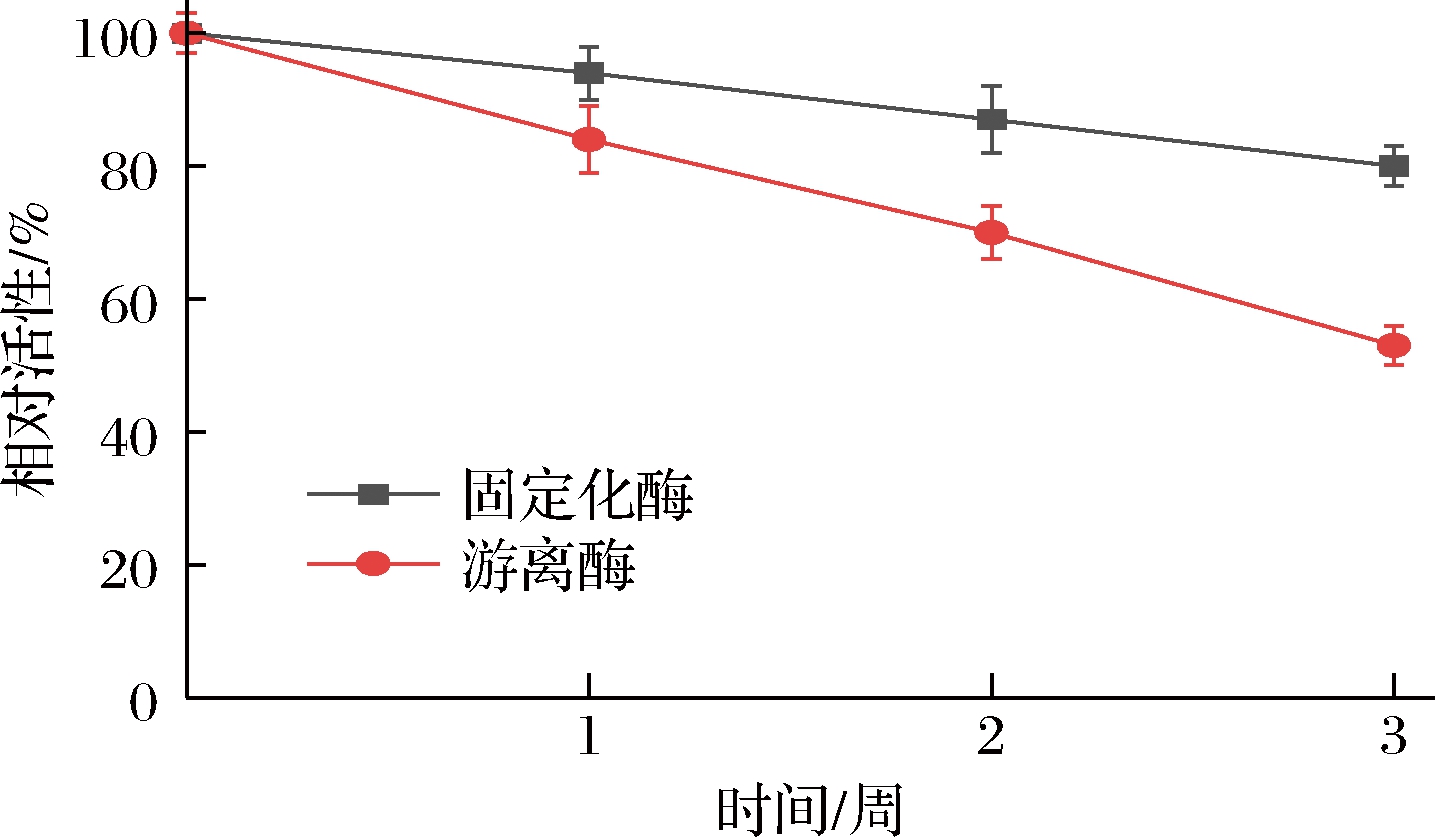
图6 固定化酶贮藏稳定性
Fig.6 Storage stability of immobilized enzyme
2.7 固定化酶的重复使用性
为研究固定化酶的可重复使用性,对固定化阿魏酸酯酶进行连续水解脱淀粉麦麸实验。利用游离阿魏酸酯酶和固定化阿魏酸酯酶,以脱淀粉麦麸为底物水解制备阿魏酸。如图7所示,固定化酶能产生与游离阿魏酸酯酶几乎相同的阿魏酸(相同酶活性0.52 U,反应时间12 h,0.1 g脱淀粉麦麸)。固定化酶的阿魏酸释放量为总阿魏酸的9.3%,游离阿魏酸酯酶为9.8%。相比ZHANG等[22]固定化纤维素酶5次重复后剩余50%活性,阿魏酸酯酶在5次循环后仍有60%以上活性。重复使用后固定化酶活性的下降可能是(1)洗涤过程中造成了酶的丧失;(2)连续调节溶液pH,影响酶的活性部位,使部分酶失活。

图7 固定化酶的重复使用性能
Fig.7 Reusability of immobilized enzyme
3 结论
综上所述,通过共价结合将阿魏酸酯酶固定在可逆的可溶性载体Eudragit L-100上是可行的。在对固定化阿魏酸酯酶形貌及结构进行表征后,优化固定化条件,研究了交联剂浓度、固定化pH、固定化时间和反应温度对固定化酶活性的影响。固定化的最佳条件为EDC 5 g/L,pH 6.0,固定化时间1 h,固定化温度25 ℃。同时研究了固定化酶的最适温度和pH值,比较后发现,固定化酶相对于游离酶拥有更高的适用范围。而且与游离酶相比,固定化酶具有更好的热稳定性和pH稳定性。同时对固定化酶贮藏稳定性进行了研究,在4 ℃贮藏3周后仍保持80%以上活性。此外,以脱淀粉麦麸为底物制备阿魏酸时,固定化酶5次重复使用后仍保持约64%的残余活性。对于不溶底物的酶解,本文研究的将酶固定化于可逆的可溶载体Eudragit L-100上提供了一个更加简单有效的方法。
[1] DENG H X, JIA P, JIANG J, et al.Expression and characterisation of feruloyl esterases from Lactobacillus fermentum JN248 and release of ferulic acid from wheat bran[J].International Journal of Biological Macromolecules, 2019, 138:272-277.
[2] ![]() K, DANA A, KOLODZIEJCZAK A, et al.Antioxidant properties of ferulic acid and its possible application[J].Skin Pharmacology & Physiology, 2018, 31(6):332-336.
K, DANA A, KOLODZIEJCZAK A, et al.Antioxidant properties of ferulic acid and its possible application[J].Skin Pharmacology & Physiology, 2018, 31(6):332-336.
[3] CHAUDHARY A, JASWAL V S, CHOUDHARY S, et al.Ferulic acid:A promising therapeutic phytochemical and recent patents advances[J].Recent Patents on Inflammation & Allergy Drug Discovery, 2019, 13(2):115-123.
[4] ACOSTA-ESTRADA B A, GUTIERREZ-URIBE J A, SERNA-SALDIVAR S O.Bound phenolics in foods, a review[J].Food Chemistry, 2014, 152:46-55.
[5] 张欣, 高增平.阿魏酸的研究进展[J].中国现代中药, 2020, 22(1):138-147.
ZHANG X, GAO Z P.Research progress In ferulic acid[J].Modern Chinese Medicine, 2020, 22(1):138-147.
[6] XU Z S, WANG T, ZHANG S.Extracellular secretion of feruloyl esterase derived from Lactobacillus crispatus in Escherichia coli and its application for ferulic acid production[J].Bioresource Technology, 2019, 288:121526.
[7] OLIVEIRA D M, MOTA T R, OLIVA B, et al.Feruloyl esterases:Biocatalysts to overcome biomass recalcitrance and for the production of bioactive compounds[J].Bioresource Technology, 2019, 278:408-423.
[8] HE F M, ZHANG S, LIU X.Immobilization of feruloyl esterases on magnetic nanoparticles and its potential in production of ferulic acid[J].Journal of Bioscience and Bioengineering, 2015, 120(3):330-334.
[9] YU Y Y, YUAN J, WANG Q, et al.Cellulase immobilization onto the reversibly soluble methacrylate copolymer for denim washing[J].Carbohydrate Polymers, 2013, 95(2):675-680.
[10] LI L, LI H, YAN B, et al.Preparation of a reversible soluble-insoluble β-D-glucosidase with perfect stability and activity[J].Journal of Biotechnology, 2019, 291:46-51.
[11] YU X X, ZHANG Z, LI J, et al.Co-immobilization of multi-enzyme on reversibly soluble polymers in cascade catalysis for the one-pot conversion of gluconic acid from corn straw[J].Bioresource Technology, 2021, 321:124509.
[12] GONZALEZ C F, PROUDFOOT M, BROWN G, et al.Molecular basis of formaldehyde detoxification:Characterization of two S-formylglutathione hydrolases from Escherichia coli, FrmB and YeiG[J].Journal of Biological Chemistry, 2006, 281(20):14 514-14 522.
[13] WU H L, LI H, XUE Y, et al.High efficiency co-production of ferulic acid and xylooligosaccharides from wheat bran by recombinant xylanase and feruloyl esterase[J].Biochemical Engineering Journal, 2017, 120:41-48.
[14] HIRSH S L, BILEK M M, NOSWORTHY N J, et al.A comparison of covalent immobilization and physical adsorption of a cellulase enzyme mixture[J].Langmuir the ACS Journal of Surfaces & Colloids, 2010, 26(17):14 380-14 388.
[15] CUI S, ZHOU Q W, WANG X L, et al.Immobilization of lipase onto N-succinyl-chitosan beads and its application in the enrichment of polyunsaturated fatty acids in fish oil[J].Journal of Food Biochemistry, 2017, 41(5):e12395.
[16] KUMAR A, PARK G D, PATEL S K S, et al.SiO2 microparticles with carbon nanotube-derived mesopores as an efficient support for enzyme immobilization[J].Chemical Engineering Journal, 2019, 359:1 252-1 264.
[17] HAN H, ZHOU Y M, LI S S, et al.Immobilization of lipase from Pseudomonas fluorescens on porous polyurea and its application in kinetic resolution of racemic 1-phenylethanol[J].ACS Applied Materials & Interfaces, 2016, 8(39):25 714-25 724.
[18] CHEN T, XU Y H, PENG Z, et al.Simultaneous enhancement of bioactivity and stability of laccase by Cu2+/PAA/PPEGA matrix for efficient biosensing and recyclable decontamination of pyrocatechol[J].Analytical Chemistry, 2017, 89(3):2 065-2 072.
[19] BAYRAMOGLU G, SENKAL B F, ARICA M Y.Preparation of clay-poly (glycidyl methacrylate) composite support for immobilization of cellulase[J].Applied Clay Science, 2013, 85:88-95.
[20] HAN J, WAN J, WANG Y, et al.Recyclable soluble-insoluble upper critical solution temperature-type poly (methacrylamide-co-acrylic acid)-cellulase biocatalyst for hydrolysis of cellulose into glucose[J].ACS Sustainable Chemistry & Engineering, 2018, 6(6):7 779-7 788.
[21] GRAJALES-HERN NDEZ D A, VELASCO-LOZANO S, ARMEND
NDEZ D A, VELASCO-LOZANO S, ARMEND RIZ-RUIZ M A, et al.Carrier-bound and carrier-free immobilization of type A feruloyl esterase from Aspergillus niger:Searching for an operationally stable heterogeneous biocatalyst for the synthesis of butyl hydroxycinnamates[J].Journal of Biotechnology, 2020, 316:6-16.
RIZ-RUIZ M A, et al.Carrier-bound and carrier-free immobilization of type A feruloyl esterase from Aspergillus niger:Searching for an operationally stable heterogeneous biocatalyst for the synthesis of butyl hydroxycinnamates[J].Journal of Biotechnology, 2020, 316:6-16.
[22] ZHANG Y, XU J, YUAN Z, et al.Artificial neural network-genetic algorithm based optimization for the immobilization of cellulase on the smart polymer Eudragit L-100[J].Bioresource Technology, 2010, 101(9):3 153-3 158.