新式茶饮是以各种茶叶通过不同的萃取方式得到的浓缩液为原料,然后加入乳制品或水果混合而成的饮料[1]。随着居民生活水平的提高和健康意识的增强,新式茶饮的市场份额将进一步扩大,人们对茶饮的要求也越来越高。茶饮料生产过程中,浸提是关键程序之一,它影响茶饮料的品质,而且浸提效果的好坏影响原料利用率和后续生产过程[2]。目前茶饮料生产大多采用高温萃取,高温萃取是企业主流生产技术[3]。高温可提高茶多酚、咖啡碱、氨基酸等成分的提取率,但是制得的茶汤苦涩味较重、颜色较深。低温萃取的茶汤清爽甘甜,同时能减少茶乳酪的生成从而使茶汤澄清透明,但是低温条件下萃取率低,需要长时间浸泡茶叶[4]。
乳清蛋白是指牛乳在pH 4.6下沉淀酪蛋白后分离出的蛋白质,约占牛乳蛋白的五分之一,是一种优质天然蛋白[5]。乳清蛋白在食品生产加工中具有广泛应用,因为它既有丰富的营养价值,又有乳化性、持水性等功能性质。茶多酚是茶叶中所有酚类化合物的总称,主要有儿茶素类、黄酮及其衍生物、酚酸和缩酚酸类[6]。儿茶素类是茶多酚的主要物质,主要组成物质有表儿茶素(epicatechin,EC)、表没食子儿茶素(epigallocatechin,EGC)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、表儿茶素没食子酸酯(epicatechin gallate,ECG)等。茶多酚有抗氧化、治疗糖尿病、改善骨质疏松[7]等作用,但它会给人带来苦涩味,因此人们喜欢将茶与牛奶混合饮用。牛奶作为输送茶多酚类物质的有效载体[8],即可以减轻茶多酚的苦涩感,又提高了二者的营养价值。消费者除了关注食品的口感风味,还关注食品的营养与健康,他们更愿意选择天然的食品。茶多酚与蛋白质发生相互作用后,不仅影响食品的功能特性,还可能影响食品的营养效能。牛奶蛋白主要是由酪蛋白和乳清蛋白组成,酪蛋白含量约为乳清蛋白的4倍[9]。HASNI等[10]研究表明,儿茶素与α-酪蛋白、β-酪蛋白均能结合改变酪蛋白的结构,更多的蛋白质去折叠,并推测牛奶对茶多酚抗氧化活性的影响是因为酪蛋白结构的变化。杜淑霞等[6]研究表明,牛奶蛋白与茶多酚混合会降低牛奶蛋白的离体消化率,且茶多酚含量≥2 g/kg 时牛奶蛋白的离体消化率随茶多酚浓度的增加而显著降低。关于不同浸提温度制得的茶汤对乳清蛋白的影响比较少见。本文研究了不同温度浸提的茶汤以及不同浓度的EGC、EGCG与乳清蛋白相互作用对乳清蛋白结构的影响,为含有多酚化合物的乳制品开发提供参考。
1 材料与方法
1.1 材料与试剂
雨前龙井茶,西湖牌;乳清蛋白(纯度>80%),上海源叶生物科技有限公司;水合茚三酮、氯化亚锡二水合物,北京伊诺凯科技有限公司;福林酚,乙腈(色谱纯),上海麦克林生化科技有限公司;蒽酮、碱式乙酸铅、PBS磷酸盐缓冲液片剂,无水碳酸钠、没食子酸,国药集团化学试剂有限公司;EGC、EGCG标准品,南京春秋生物工程有限公司;咖啡因标准品,信阳莱耀生物科技有限公司。
1.2 仪器与设备
恒温水浴锅,巩义市予华仪器有限公司;UV-2800A紫外分光光度计,麦仪科学仪器(上海)有限公司;HP1100 高效液相色谱仪,美国安捷伦科技有限公司;F-7000型荧光分光光度计,日本日立公司;IS10傅里叶红外光谱仪,美国Nicolet公司。
1.3 实验方法
1.3.1 茶汤的制备
取茶叶2 g,按照茶水比1∶50浸提,浸提时间30 min,取茶汤备用。浸提温度分别为45、55、65、75、85 ℃。
1.3.2 茶汤主要物质含量测定
茶多酚含量的测定方法采用福林酚比色法。
EGCG、EGC含量的测定采用HPLC法。流动相A:5%乙腈+95%水;流动相B:纯乙腈;液相色谱柱:C18(250 mm×4.6 mm,5 μm);流动相流速:0.6 mL/min;柱温:30 ℃;紫外检测器:λ=278 nm;进样量:5 μL;梯度条件:0~5 min,0% B相;5~35 min,0%~20% B相;35~45 min,20%~50% B相;45~50 min,50% B相;50~60 min,50%~0% B相;60~66 min,0% B相。
游离氨基酸总量的测定方法参考GB/T 8314—2013《茶 游离氨基酸总量的测定》,采用茚三酮比色法。
总糖含量的测定采用硫酸蒽酮比色法。
咖啡碱含量的测定方法参考GB/T 8312—2013《茶 咖啡碱测定》,采用紫外分光光度法。
1.3.3 溶液的配制
乳清蛋白用pH 7.4 PBS磷酸盐缓冲液配置成5 mg/mL储备液。EGCG和EGC用去离子水配置成1 mg/mL储备液,现用现配。
1.3.4 紫外-可见吸收光谱测定
以相应试剂作为空白对照,测定乳清蛋白加入不同茶汤和不同浓度EGCG、EGC溶液后的紫外-可见吸收图谱。取乳清蛋白储备液(质量浓度为5 mg/mL)10 mL,分别加入0.1 mL不同温度浸提的茶汤,用去离子水定容到20 mL。取乳清蛋白储备液(质量浓度为5 mg/mL)10 mL,分别加入0、0.5、1.0、1.5、2.0、2.5、3.0 mL EGCG、EGC储备液,用去离子水定容到20 mL。将混合溶液于37 ℃水浴反应2 h后取出。紫外吸收光谱波长扫描范围为250~500 nm,采样间隔1 nm。
1.3.5 傅里叶变换红外光谱
取乳清蛋白储备液(质量浓度为5 mg/mL)10 mL,分别加入2 mL不同温度浸提的茶汤,用去离子水定容到20 mL。取乳清蛋白储备液(质量浓度为5 mg/mL)10 mL,分别加入0、0.5、1.0、1.5、2.0、2.5、3.0 mL EGCG、EGC储备液,用去离子水定容到20 mL。将混合溶液于37 ℃水浴反应2 h后取出,然后倒入平皿中进行冷冻干燥。将冻干后的样品与KBr颗粒按照1∶100混合,研磨成粉末后用压片机压成片状固体。记录样品400~4 000 cm-1的光谱。
用PeakFit软件处理酰胺Ⅰ带(1 600~1 700 cm-1)图谱,然后根据峰的积分面积得出乳清蛋白二级结构的相对百分含量。
1.3.6 荧光光谱测定
取5 mg/mL乳清蛋白储备液10 mL,分别加入0、0.5、1.0、1.5、2.0、2.5、3.0 mL EGC、EGCG储备液,用去离子水定容到20 mL。将混合溶液于310 K(37 ℃)水浴反应2 h后进行荧光扫描。设置激发波长280 nm,发射波长290~500 nm,激发和发射的狭缝宽度均为5 nm。荧光光谱扫描条件不变,再次扫描290 K和300 K条件下反应的光谱。
1.4 数据分析
图表中数据均为平均值,数据分析采用Microsoft Office Excel 2016、SPSS 软件,作图采用Origin 2018软件。
2 结果与分析
2.1 茶汤中主要物质含量
不同温度浸提的茶汤中主要物质含量如表1所示。浸提温度影响茶汤主要物质的浸出量,茶汤中主要物质的浸出量随浸提温度的升高而增多。茶多酚是茶饮料中的主要功效成分,茶多酚含量是评判茶饮料品质的重要指标之一[11]。氨基酸是茶饮料鲜爽滋味的贡献物质之一,它除了本身具有鲜味,还可以丰富产品原本的风味。可溶性糖在制茶过程中可以与氨基酸、多酚类等发生化学反应,或在烘焙过程中形成芳香成分以及呈色物质,能够使茶汤甜醇[12]。咖啡碱是茶汤中主要的苦味物质,且易溶于80 ℃以上的热水,所以高温浸提时咖啡碱浸出量显著增加(P<0.05)。茶汤中酯型儿茶素含量最多的是EGCG,非酯型儿茶素含量最多的是EGC[13]。如图1所示,随着浸提温度升高,EGCG含量与EGC含量的比值越来越大。与非酯型儿茶素相比,酯型儿茶素喝起来苦涩味更重,更容易与蛋白质结合发生相互作用。
表1 不同温度浸提的茶汤中主要物质含量
Table 1 The content of main substances in tea soup extracted at different temperatures

注:同列不同字母表示差异显著(P<0.05)
浸提温度/℃茶多酚含量/(mg·mL-1)游离氨基酸总量/(mg·mL-1)总糖含量/(mg·mL-1)咖啡碱含量/(mg·mL-1)451.452±0.062a0.608±0.009a0.679±0.024a0.707±0.028a551.803±0.051b0.690±0.021b0.794±0.012b0.969±0.034b652.146±0.042c0.769±0.012c0.864±0.013c1.153±0.028c752.640±0.042d0.882±0.016d1.092±0.015d1.507±0.033d852.929±0.053e0.934±0.024e1.176±0.018e1.593±0.026e
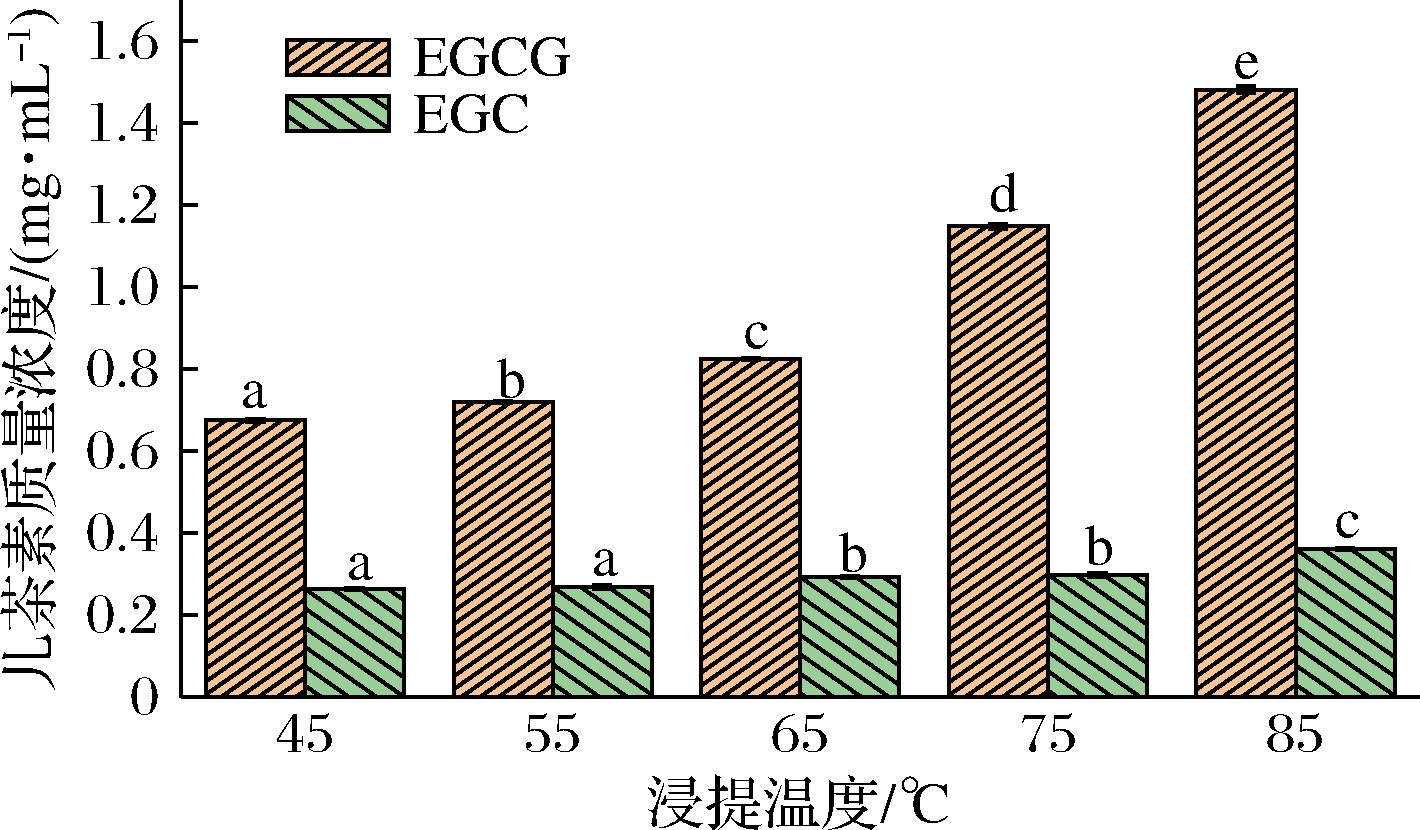
图1 不同温度浸提的茶汤中EGCG、EGC含量
Fig.1 The content of EGCG and EGC in tea soup extracted at different temperatures
注:相同图案不同字母表示差异显著(P<0.05)
2.2 紫外-可见吸收光谱分析
组成蛋白质的部分氨基酸残基具有紫外吸收的性质,因此紫外-可见吸收光谱可通过吸收峰的位置及强度的变化来判断多酚对蛋白质结构的影响。色氨酸、酪氨酸、苯丙氨酸残基对紫外光的吸收导致蛋白质的紫外吸收。蛋白质构象影响氨基酸残基的微环境,构象改变微环境也随之改变,生色基团的紫外吸收光谱就发生变化[14]。本实验测定了茶汤、EGC、EGCG添加前后乳清蛋白的紫外-可见吸收光谱,结果如图2所示。
由图2可知,加入茶汤、EGC、EGCG之前,乳清蛋白在280 nm附近有最大吸收峰。加入茶汤、EGC、EGCG之后,乳清蛋白的吸收峰增强,吸收峰值随着浓度的增大而增大,且吸收峰发生了蓝移。结果显示,茶汤、EGCG、EGC都与乳清蛋白发生相互作用,从而使乳清蛋白结构改变。与EGC相比,EGCG的吸收峰峰值更大,吸收峰形态变化更明显,说明EGCG对乳清蛋白结构的影响大于EGC,两者的相互作用更强。发生相互作用后,乳清蛋白的肽链伸展,氨基酸残基的微环境发生变化。与茶汤、EGC、EGCG反应后乳清蛋白吸光度增强,说明这种构象变化有利于乳清蛋白的色氨酸和酪氨酸残基芳香环的π-π*跃迁[15]。通过紫外-可见吸收光谱的变化可以看出,茶汤、EGC、EGCG对乳清蛋白的猝灭类型是静态猝灭[16]。
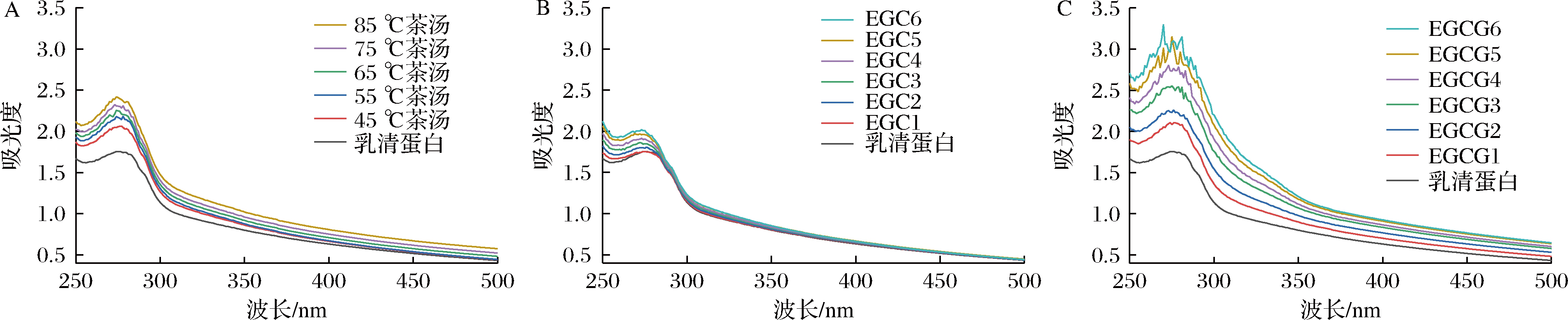
A-茶汤;B-EGC;C-EGCG
图2 茶汤、EGC、EGCG与乳清蛋白相互作用的紫外-可见吸收光谱
Fig.2 Ultraviolet-visible absorption spectra of the interaction between tea soup, EGC, EGCG, and whey protein
注:1~6表示EGC、EGCG储备液的添加量分别为0.5、1.0、1.5、2.0、2.5、3.0 mL
2.3 蛋白质二级结构分析
蛋白质的二级结构主要包括α-螺旋、β-折叠、β-转角、无规则卷曲。傅里叶变换红外光谱是对氢键变化非常敏感的一种检测方法,它可以提供有关多酚-蛋白质复合物中蛋白质链构象和疏水性结合的信息,可以分析蛋白质结构变化。由表2可知,茶汤、EGC、EGCG加入后,乳清蛋白的α-螺旋、β-折叠含量减少,β-转角、无规则卷曲含量增加。随着浸提温度升高,茶汤对乳清蛋白二级结构含量的影响增大,这是因为高温浸提的茶汤中含有更多的茶多酚等物质,更容易与乳清蛋白发生反应。与EGC相比,EGCG对乳清蛋白二级结构含量的影响更大。当EGCG与EGC储备液添加量均为3.0 mL时,乳清蛋白的α-螺旋分别减少了2.70%、1.95%,β-折叠分别减少了3.10%、2.40%,β-转角分别增加了2.58%、2.25%,无规则卷曲分别增加了3.92%、3.14%。结果表明,茶汤、EGC、EGCG均能使乳清蛋白结构发生轻微变化,没有完全破坏乳清蛋白的二级结构。不同儿茶素对乳清蛋白二级结构的影响程度不同,这可能与不同儿茶素与乳清蛋白结合能力不同有关。
表2 加入茶汤、EGC、EGCG前后乳清蛋白二级结构含量
Table 2 The secondary structure content of whey protein before and after adding tea soup, EGC, EGCG
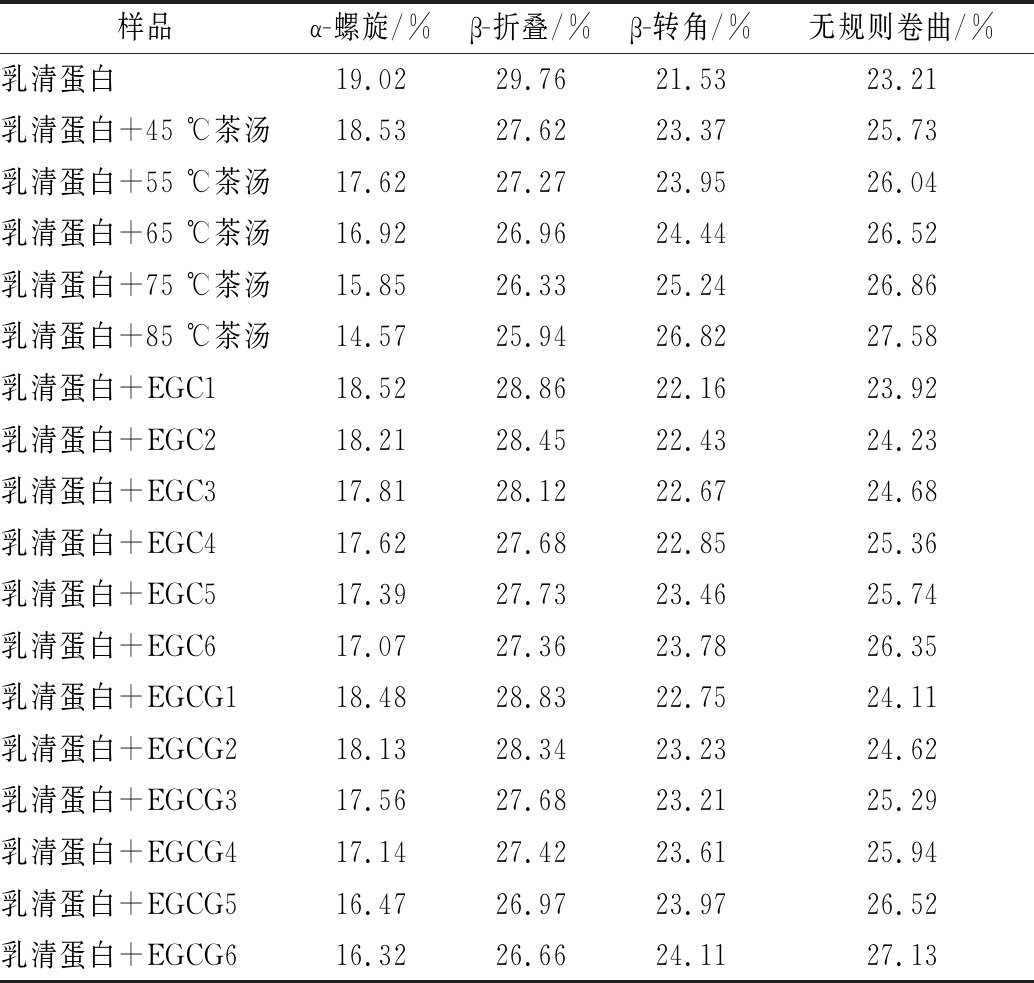
注:1~6表示EGC、EGCG储备液的添加量分别为0.5、1.0、1.5、2.0、2.5、3.0 mL
样品α-螺旋/%β-折叠/%β-转角/%无规则卷曲/%乳清蛋白19.0229.7621.5323.21乳清蛋白+45 ℃茶汤18.5327.6223.3725.73乳清蛋白+55 ℃茶汤17.6227.2723.9526.04乳清蛋白+65 ℃茶汤16.9226.9624.4426.52乳清蛋白+75 ℃茶汤15.8526.3325.2426.86乳清蛋白+85 ℃茶汤14.5725.9426.8227.58乳清蛋白+EGC118.5228.8622.1623.92乳清蛋白+EGC218.2128.4522.4324.23乳清蛋白+EGC317.8128.1222.6724.68乳清蛋白+EGC417.6227.6822.8525.36乳清蛋白+EGC517.3927.7323.4625.74乳清蛋白+EGC617.0727.3623.7826.35乳清蛋白+EGCG118.4828.8322.7524.11乳清蛋白+EGCG218.1328.3423.2324.62乳清蛋白+EGCG317.5627.6823.2125.29乳清蛋白+EGCG417.1427.4223.6125.94乳清蛋白+EGCG516.4726.9723.9726.52乳清蛋白+EGCG616.3226.6624.1127.13
2.4 荧光光谱分析
乳清蛋白中有色氨酸、酪氨酸和苯丙氨酸残基,它们是使蛋白质具有内源性荧光特性的主要基团[17]。当激发波长设置为280 nm时,蛋白质的荧光光谱主要是由色氨酸、酪氨酸产生[18]。由图3可知,随着儿茶素浓度的增大,荧光光谱的峰形基本未发生变化,但是荧光强度减小,最大荧光发射波长有轻微红移。保持乳清蛋白浓度不变,EGC和EGCG都对乳清蛋白有猝灭作用,猝灭效果随浓度的增大而增强,而且可以看出EGCG的猝灭效果强于EGC。蛋白质中荧光发色基团本身及其周围环境发生变化可通过荧光光谱的变化表现出来。EGC、EGCG与乳清蛋白反应后,乳清蛋白的荧光光谱发生变化,说明EGC、EGCG与乳清蛋白发生相互作用,乳清蛋白结构发生变化,色氨酸和酪氨酸的微环境发生变化,疏水性下降,生成不发射荧光的基态配合物[15]。
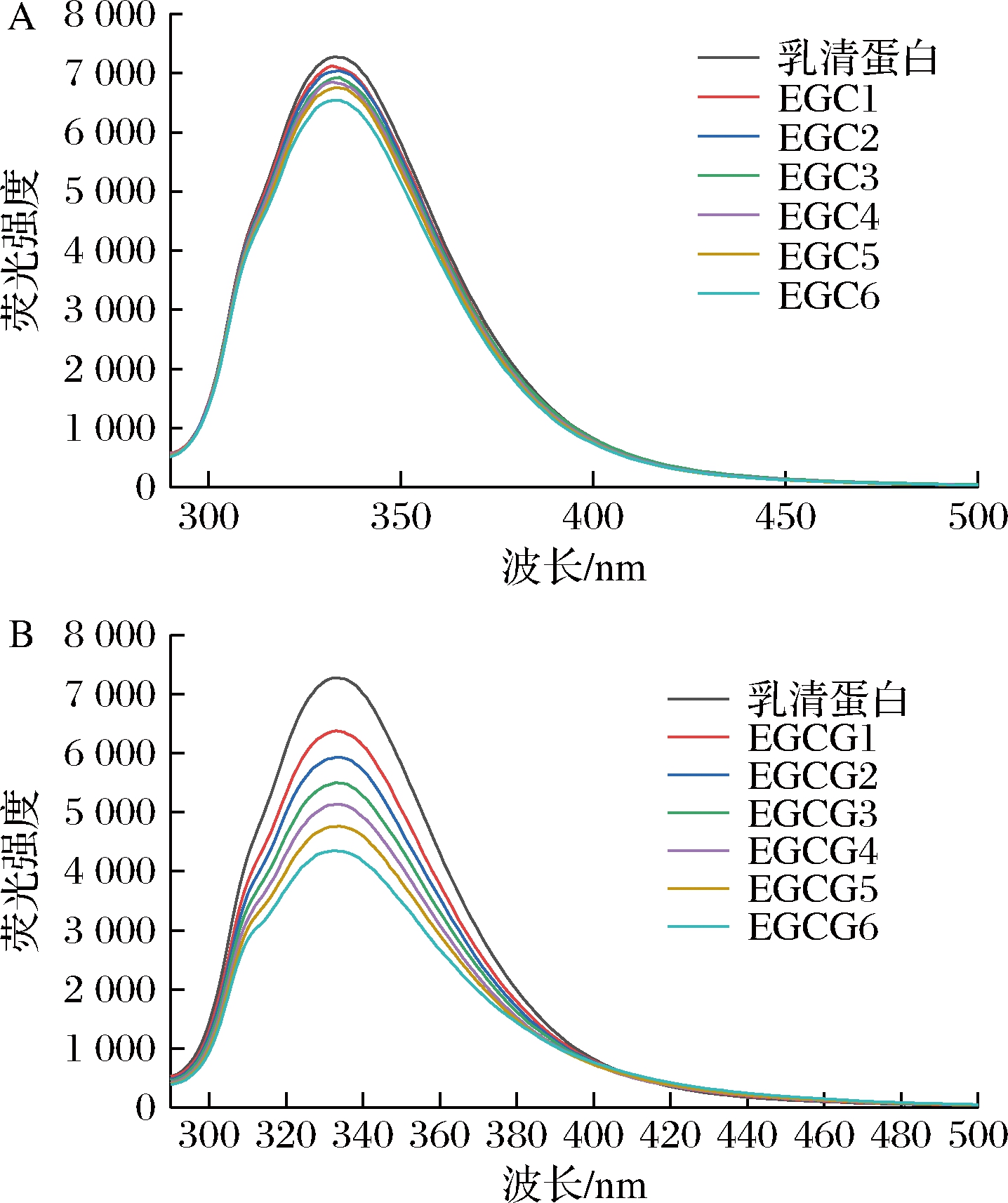
A-EGC;B-EGCG
图3 EGC、EGCG与乳清蛋白相互作用的荧光光谱
Fig.3 Fluorescence spectra of the interaction between EGC, EGCG, and whey protein
注:1~6表示EGC、EGCG储备液的添加量分别为0.5、1.0、1.5、2.0、2.5、3.0 mL
2.5 荧光猝灭机制
乳清蛋白的荧光猝灭机制主要有2种:静态猝灭和动态猝灭。静态猝灭表现为反应温度升高,猝灭常数降低。动态猝灭表现为反应温度升高,猝灭常数也随之升高。在290、300、310 K条件下,EGC、EGCG与乳清蛋白的猝灭机制可通过Stern-Volmer方程(1)来判断:
(1)
式中:F0和F分别为荧光猝灭剂加入前后荧光分子的荧光强度;Kq为动态猝灭速率常数,L/(mol·s);τ0为荧光分子的平均寿命(生物大分子的荧光平均寿命为 10-8 s);[Q]为猝灭剂EGC、EGCG的浓度,mol/L;KSV为动态淬灭常数,L/mol。
根据Stern-Volmer方程,以猝灭剂(EGC、EGCG)浓度[Q]作自变量,以相应的F0/F作因变量进行线性拟合,结果见图4,再进一步计算出猝灭常数KSV和猝灭速率常数Kq,结果见表3。
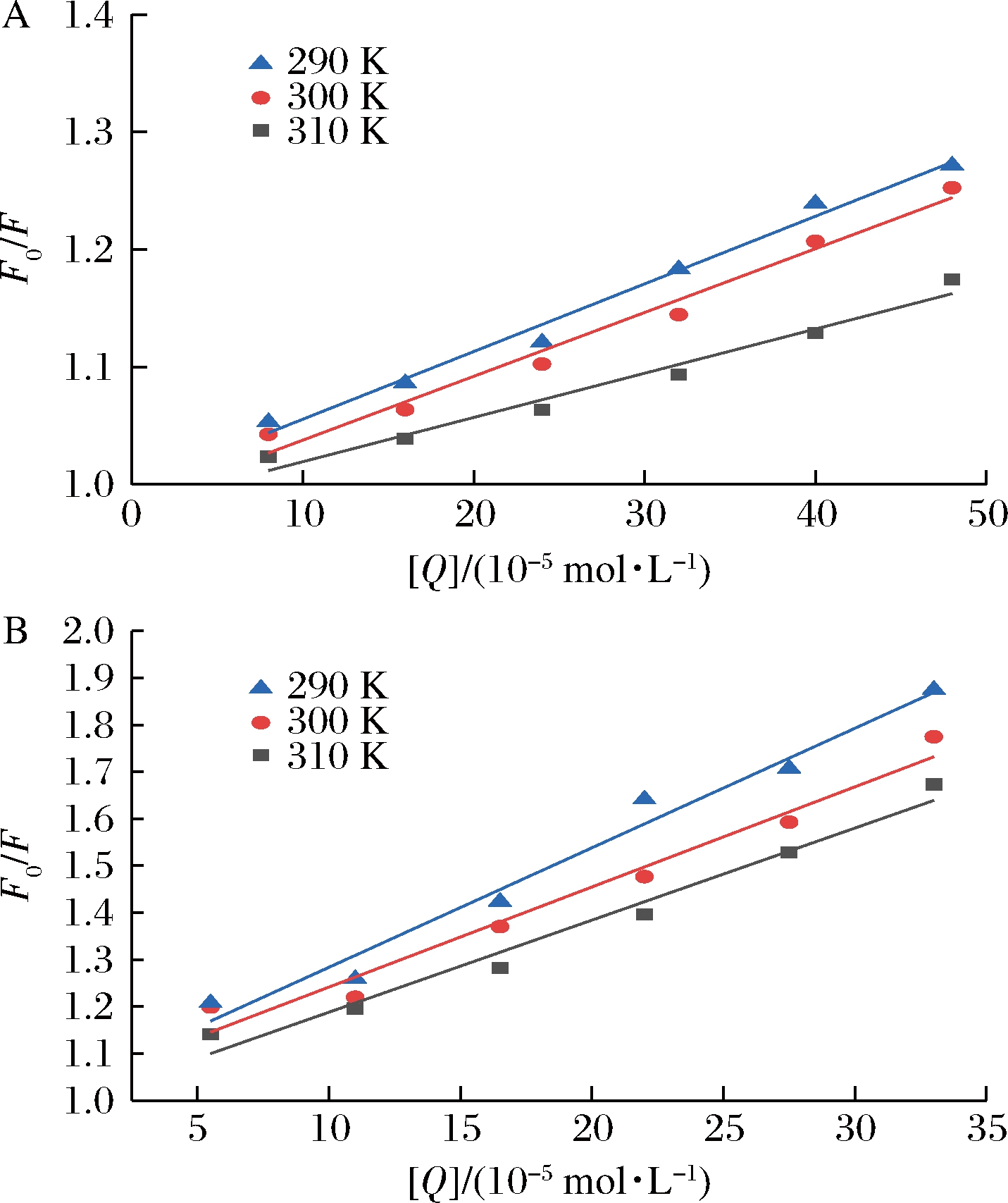
A-EGC;B-EGCG
图4 EGC、EGCG与乳清蛋白相互作用的Stern-Volmer曲线
Fig.4 Stern-Volmer plots of interaction between EGC, EGCG and whey protein at different temperatures
由图4可知,EGC、EGCG与乳清蛋白相互作用的Stern-Volmer曲线并不是完全呈直线关系(R2<0.98),说明EGC、EGCG对乳清蛋白的猝灭都不是主要由动态猝灭导致的,可能是由猝灭剂与荧光体分子间形成超分子复合物的静态猝灭或静态和动态猝灭相结合的猝灭导致[19]。由表3可知,随温度升高EGC、EGCG和乳清蛋白相互作用的猝灭常数KSV变小,并且它们的猝灭速率常数Kq大于各类猝灭剂对生物大分子的最大扩散猝灭常数2.0×1010 L/(mol·s),说明EGC、EGCG与乳清蛋白的反应是静态猝灭。
表3 不同温度下EGC、EGCG与乳清蛋白相互作用的猝灭常数
Table 3 Stern-Volmer constants of interaction between EGC, EGCG, and whey protein at different temperatures

样品温度/KKSV/(×102 L·mol-1)Kq/[×1010 L·(mol·s)-1]R22905.765.760.987 8EGC+乳清蛋白3005.435.430.979 43103.773.770.971 729025.4525.450.977 4EGCG+乳清蛋白30021.3221.320.969 831019.6019.600.976 8
2.6 结合常数和结合位点数
静态猝灭时,荧光强度与结合常数KA、结合位点数n与猝灭剂浓度之间可按照方程(2)来计算:
(2)
式中:KA为猝灭剂(EGC、EGCG)与乳清蛋白间的结合常数,L/mol;n为每个蛋白质分子的结合位点数。
根据方程(2),以lg[Q]为自变量,以lg[(F0-F)/F]为因变量作图,线性拟合后得到图5。根据拟合直线的斜率和截距算出EGC、EGCG与乳清蛋白相互作用的结合位点数n和结合常数KA,计算结果列于表4。结合常数KA越大,说明分子与蛋白质之间的结合力越大。由表4可知,EGCG与乳清蛋白的结合常数大于EGC与乳清蛋白的结合常数,说明EGCG与乳清蛋白之间的结合力大于EGC与乳清蛋白。随温度升高,EGC、EGCG结合常数均增大,说明EGC、EGCG与乳清蛋白之间有共价作用,但还是非离子形式的相互作用占主导[20]。EGCG与乳清蛋白的相互作用力更大,可能和EGCG的分子结构有关。EGCG的分子结构中,酯基相连的苯环上有3个羟基,可能更容易与乳清蛋白形成氢键[21]。
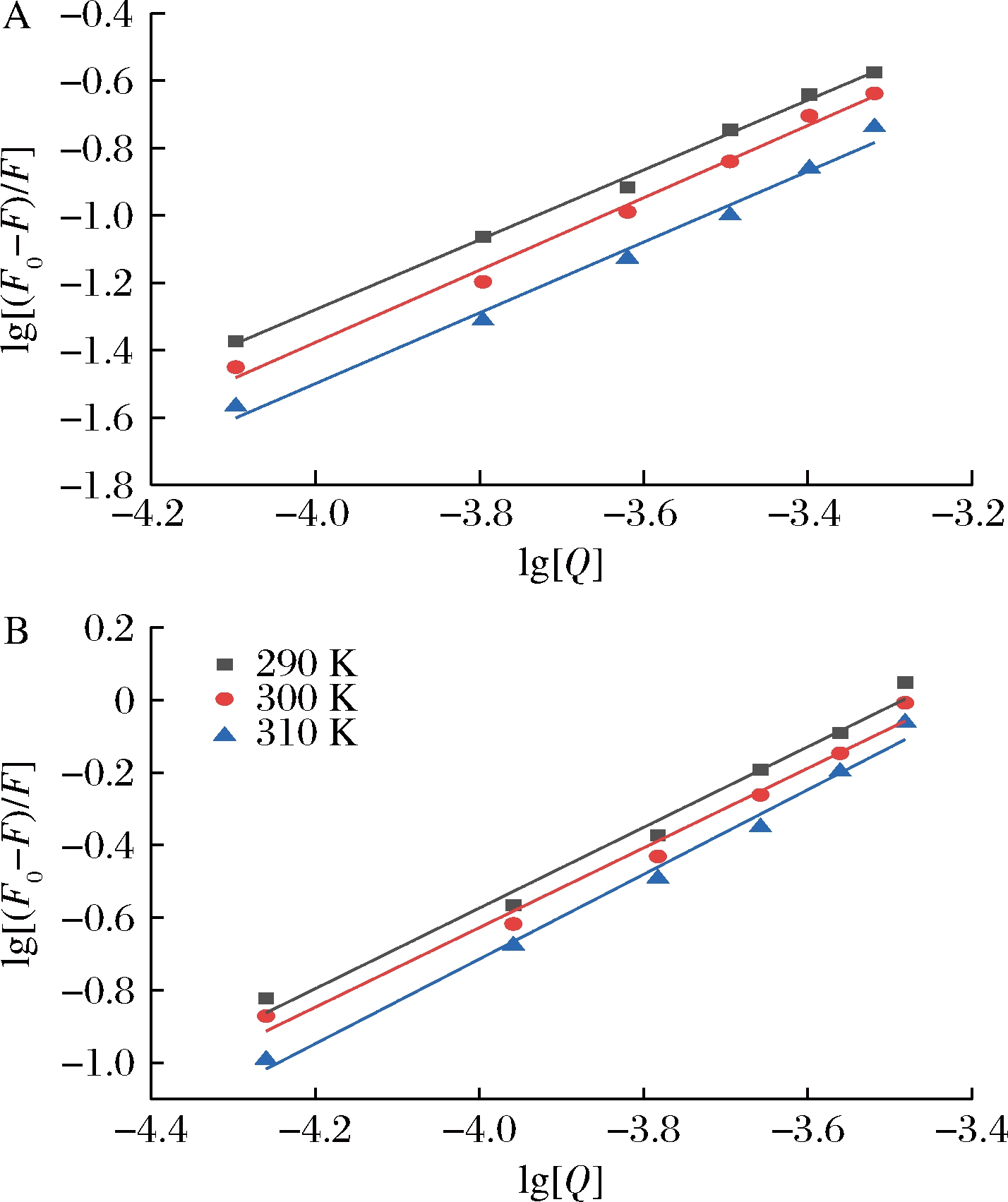
A-EGC;B-EGCG
图5 EGC、EGCG与乳清蛋白相互作用的双对数曲线
Fig.5 Double-log plots of interaction between EGC, EGCG and whey protein at different temperatures
表4 EGC、EGCG与乳清蛋白相互作用的结合常数和结合位点数
Table 4 Apparent binding constants and binding sites numbers of EGC, EGCG, and whey protein
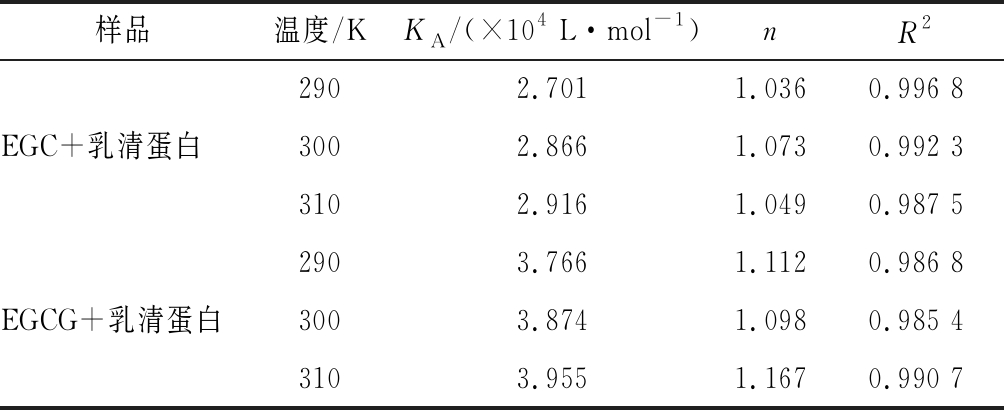
样品温度/KKA/(×104 L·mol-1)nR22902.7011.0360.996 8EGC+乳清蛋白3002.8661.0730.992 33102.9161.0490.987 52903.7661.1120.986 8EGCG+乳清蛋白3003.8741.0980.985 43103.9551.1670.990 7
2.7 热力学参数
小分子与蛋白质分子间主要是静电相互作用、疏水相互作用、氢键和范德华力等。配体与蛋白质间的相互作用力可以通过热力学参数焓变ΔH、熵变ΔS和吉布斯自由能变ΔG来判断。ΔH>0、ΔS>0,主要是疏水相互作用;ΔH<0、ΔS<0,主要是氢键或者范德华力;ΔH>0、ΔS<0,主要是静电相互作用和疏水作用;ΔH<0、ΔS>0,主要是静电作用。焓变ΔH、熵变ΔS和吉布斯自由能变ΔG可通过公式(3)~公式(5)来计算:
ΔG=ΔH-TΔS
(3)
ΔG=-RTlnKA
(4)
(5)
式中:R为气体常数8.314 J/(mol·K);KA代表对应温度T时的结合常数,L/mol;当温度变化不大时,ΔH可认为恒定不变。先根据公式(4)计算ΔG,然后根据公式(5)作lnKA关于1/T的直线,由直线的斜率算出ΔH,最后根据公式(3)计算出ΔS。计算结果见表5所示。由表5可知,EGC、EGCG与乳清蛋白反应的ΔG均小于0,说明两者的反应均是自发进行。EGC、EGCG与乳清蛋白反应的ΔH、ΔS均大于0,说明乳清蛋白与EGC、EGCG之间主要是疏水相互作用。
表5 EGC、EGCG与乳清蛋白相互作用的热力学参数
Table 5 Thermodynamic parameters of interaction between EGC, EGCG, and whey protein

样品温度/KΔG/(kJ·mol-1)ΔH/(kJ·mol-1)ΔS/[kJ·(mol·K)-1]290-23.9528.780.18EGC+乳清蛋白300-26.260.18310-27.580.18290-31.9718.320.17EGCG+乳清蛋白300-33.770.17310-35.430.17
3 结论
本研究通过紫外-可见吸收光谱、傅里叶变换红外光谱、荧光光谱分析了不同浸提温度制得的茶汤、EGC、EGCG对乳清蛋白结构的影响。结果表明,EGC、EGCG均可以与乳清蛋白发生相互作用形成复合物,且EGCG与乳清蛋白之间的相互作用力强于EGC。疏水相互作用是EGC、EGCG与乳清蛋白之间主要作用力,它们之间的反应均为自发进行。茶汤中富含茶多酚,从紫外-可见吸收光谱、傅里叶变换红外光谱可知茶汤会导致乳清蛋白结构的改变,且浸提温度越高,茶汤中茶多酚浓度越高,对乳清蛋白结构的影响越大。
[1] 安图幼. 新中式茶饮的市场空间究竟有多大?[J].茶道, 2017(9):28-32.
AN T Y.How big is the market space for new Chinese tea?[J].Tea Philosophy, 2017(9):28-32.
[2] 代忠波. 茶饮料萃取技术研究现状[J].饮料工业, 2013, 16(9):39-45.
DAI Z B.An overview of tea leaf extraction technologies of RTD tea beverages[J].Beverage Industry, 2013, 16(9):39-45.
[3] 毛晓峰. 我国液体茶饮料的种类及工艺现状[J].饮料工业, 2020, 23(6):71-74.
MAO X F.Product types and technology status of liquid tea drinks in China[J].Beverage Industry, 2020, 23(6):71-74.
[4] 李洁. 白茶饮料加工中浸提工艺技术的研究[D].福州:福建农林大学, 2012.
LI J.A study on extraction techniques for white tea beverage[D].Fuzhou:Fujian Agriculture & Forestry University, 2012.
[5] 赵爱迪.微波加热对牛乳清蛋白结构及功能的影响[D].沈阳:沈阳农业大学, 2017.
ZHAO A D.Effect of microwave treatments on the structure and functional properties of whey protein[D].Shenyang:Shenyang Agriculture University, 2017.
[6] 杜淑霞, 欧仕益, 贝惠玲, 等.茶多酚与牛奶蛋白互作对蛋白质离体消化率的影响[J].食品与发酵工业, 2010, 36(2):76-79.
DU S X, OU S Y, BEI H L, et al.Effects of tea polyphenols on in vitro protein digestibility in milk tea[J].Food and Fermentation Industries, 2010, 36(2):76-79.
[7] DE AMORIM L M N, VAZ S R, CES RIO G, et al.Effect of green tea extract on bone mass and body composition in individuals with diabetes[J].Journal of Functional Foods, 2018, 40:589-594.
RIO G, et al.Effect of green tea extract on bone mass and body composition in individuals with diabetes[J].Journal of Functional Foods, 2018, 40:589-594.
[8] 焦瑶瑶, 张卫兵, 杨敏, 等.茶多酚与牛乳蛋白相互作用对乳制品功能特性和生物学效应影响的研究进展[J].乳业科学与技术, 2018, 41(6):42-47.
JIAO Y Y, ZHANG W B, YANG M, et al.Advances in research on effects of interaction between tea polyphenols and milk proteins on functional properties and bioavailability of dairy products[J].Journal of Dairy Science and Technology, 2018, 41(6):42-47.
[9] YE J H, FAN F Y, XU X Q, et al.Interactions of black and green tea polyphenols with whole milk[J].Food Research International, 2013, 53(1):449-455.
[10] HASNI I, BOURASSA P, HAMDANI S, et al.Interaction of milk α- and β-caseins with tea polyphenols[J].Food Chemistry, 2011, 126(2):630-639.
[11] 路会丽, 李国华, 陈冠荣.茶饮料的冷萃取工艺研究[J].饮料工业, 2018, 21(1):47-51.
LU H L, LI G H, CHEN G R.Study on cold water brewing methods in different teas[J].Beverage Industry, 2018, 21(1):47-51.
[12] 黄亚亚, 梁艳, 邓永亮, 等.茯砖茶茶汤稳定性研究[J].河南农业科学, 2012,41(10):58-61;65.
HUANG Y Y, LIANG Y, DENG Y L, et al.Study on stability of Fu-brick tea infusion[J].Journal of Henan Agricultural Sciences, 2012,41(10):58-61;65.
[13] 许勇泉. 绿茶茶汤及其浓缩汁沉淀形成与调控基础研究[D].杭州:浙江工商大学, 2015.
XU Y Q.Sediment formation and control basis of green tea infusion and its concentrate[D].Hangzhou:Zhejiang Gongshang University, 2015.
[14] 贾晶晶. 多酚类物质与牛乳β-乳球蛋白及β-半乳糖苷酶相互作用的研究[D].济南:山东师范大学, 2018.
JIA J J.Study on interaction mechanism of β-lactoglobulin and β-galactosidase with phenolic compounds[D].Jinan:Shandong Normal University, 2018.
[15] 岳鑫, 包怡红.基于荧光及紫外光谱法对红松种鳞多酚与乳清蛋白相互作用的研究[J].现代食品科技, 2019, 35(7):114-120.
YUE X, BAO Y H.Interaction between the polyphenols from Pinus koraiensis seeds scales and whey protein studied by fluorescence and ultraviolet spectroscopy[J].Modern Food Science and Technology, 2019, 35(7):114-120.
[16] DONG A C, HUANG P, CAUGHEY W S.Protein secondary structures in water from second-derivative amide I infrared spectra[J].Biochemistry, 1990, 29(13):3 303-3 308.
[17] 付珊琳, 钟俊桢, 姚文俊, 等.去折叠态β-乳球蛋白与表没食子儿茶素没食子酸酯的相互作用[J].食品科学, 2019, 40(4):7-13.
FU S L, ZHONG J Z, YAO W J, et al.Interaction between unfolded bovine β-lactoglobulin and epigallocatechin gallate[J].Food Science, 2019, 40(4):7-13.
[18] SAHU A, KASOJU N, BORA U.Fluorescence study of the curcumin-casein micelle complexation and its application as a drug nanocarrier to cancer cells[J].Biomacromolecules, 2008, 9(10):2 905-2 912.
[19] 徐洁琼. 乳蛋白与茶多酚的相互作用及茶多酚生物可及性的研究[D].无锡:江南大学, 2017.
XU J Q.Study on the milk protein-tea polyphenol interactions and tea polyphenol bioaccessibility[D].Wuxi:Jiangnan University, 2017.
[20] WU X L, ZHONG X J, LIU M X, et al.Reduced allergenicity of β-lactoglobulin in vitro by tea catechins binding[J].Food & Agricultural Immunology, 2013, 24(3):305-313.
[21] 刘欣. 几种黄酮类药物小分子与牛血清白蛋白相互作用的研究[D].长沙:中南大学, 2010.
LIU X.Study on the interaction between small flavonoids and bovine serum albumin[D].Changsha:Central South University, 2010.