色彩鲜艳的食品往往能在外观上吸引消费者和提高消费者对食品的信赖感[1]。因此,不法商贩将价格更低廉的合成染料添加到食品和药品中以增强竞争力。其中,酸性染料因其价格便宜、色牢度强,也被使用在食品中。酸性染料一般为含磺酸基偶氮染料,在酸性条件下可对蛋白质纤维染色。据报道,合成染料在食品中过度使用会引起人体的兴奋和过敏反应[2-3]。为了加强食品安全,许多国家颁布了不同的规章制度来限制合成染料在食品中可以使用的种类和剂量,如欧洲委员会颁布的关于食品接触塑料着色剂使用的决议AP(89)1以及中国政府颁布的GB 2760—2014《食品添加剂使用标准》。在规定中,食品均禁止使用酸性染料。不法商家在食品中使用酸性染料将严重威胁人类的健康安全。
我国针对食品添加剂的测定出台了GB/T 5009.35—2016《食品安全国家标准 食品中合成着色剂的测定》对部分染料检测的方法,也有很多学者对其进行了进一步研究。文献中合成染料的分析方法有伏安法[4]、光谱法[5]、薄层色谱法(thin-layer chromatography,TLC)[6]、极谱法[7]、毛细管电泳法(capillary electrophoresis,CE)[8]、HPLC法。其中最常用的方法是HPLC。FENG等[9]改良了一种HPLC-MS/MS,该方法可以同时检测40种合成染料。BONNAN等[10]优化的高效液相色谱法串联二极管阵列检测器(HPLC-diode array detector,HPLC-DAD)对样品进行检测,该方法能同时检测饮料中的17种合成染料。据报道[11-12],HPLC-MS/MS系统具有极高的灵敏度和准确性,但是由于价格高昂、操作复杂。HPLC-DAD系统则可以兼顾灵敏度和成本之间的冲突,而在处理基质较为复杂的样品时,往往表现出色谱分离性较差的现象。
随着HPLC技术的发展,食品中染料检测技术已经应用在了水、饮料以及辣椒制品等产品中[13-15],但对于干果这类机制较为复杂的食品报道较少。部分食品中的凝胶、脂质会干扰色谱柱,因此在测定含有复杂基质的食品时,HPLC方法的灵敏度很差[16]。含有高油脂、高凝胶的干果等食品通过适当的前处理程序减少基质效应对测定结果的影响,是一个研究的方向。目前,常见的食品前处理方法有膜过滤法[17-18]、固相萃取法[10,19]、凝胶色谱柱净化法(gel permeation chromatography,GPC)[20]、液相萃取法[21-22]等。在萃取时也通常采用超声波及微波来辅助提取[23]。
在本研究中,对提取试剂进行了优化,并采用GPC对提取液进一步净化,通过对20种目的酸性染料光谱特性的分析,确定最佳检测波长。在实际样品检测中被证实,一种依托于UPLC-DAD的分析方法被提出,它可以高效、快速地测定干果中的20种酸性染料。
1 材料与方法
1.1 材料与试剂
枸杞、葡萄干均采购于新疆乌鲁木齐当地农产品市场;20种酸性染料标准品:酸性黄23、酸性红18、酸性紫7、酸性橙10、酸性红35、酸性红14、酸性绿5、酸性红73、酸性黑1、酸性橙7、酸性黑24、酸性橙56、酸性紫43、酸性紫17、酸性蓝62、酸性蓝7、酸性黄151、酸性黄79、酸性棕282、酸性绿73(纯度>98%),德国Dr Ehrenstorfer公司。分别称取20种酸性染料标准品,用超纯水稀释至1 000 μg/mL标准储备液,使用前再逐级稀释;乙腈(色谱纯),Fisher公司;乙酸(分析纯),西安化学试剂厂;乙酸铵、乙酸乙酯(色谱纯),德国Merck公司。
1.2 仪器与设备
ACQUITY超高效液相色谱配备二极管阵列检测器,美国Waters公司;AL204-IC电子分析天平,梅特勒-托利多仪器(上海)有限公司;KQ-600B超声波清洗器,昆山市超声仪器公司;隔膜真空泵,天津奥特塞恩斯仪器有限公司;氮吹仪,美国Organomation公司;AccuPrep MPS凝胶净化仪,美国J2 Scientific 公司;0.22 μm有机相滤膜;试验用水均为经Milli-Q公司超纯水器纯化的超纯水。
1.3 样品前处理
将葡萄干、枸杞等样品冻干后研磨成粉末状态,并称取等量的葡萄干、枸杞粉末混匀备用。
准确称取5.0 g破碎后的均匀试样,置于50 mL离心管中,加入20 mL提取液(17 mL乙腈、3 mL超纯水)。超声提取20 min后,以8 000 r/min离心5 min。收集上清液,用氮气吹至近干。再将残渣溶解于10 mL乙酸乙酯-环己烷(体积比1∶1)中,采用GPC净化。
GPC净化条件:聚苯乙烯凝胶(Biobeads S-X3填料,100 g,400 mm×25 mm);以乙酸乙酯-环己烷(体积比1∶1)为淋洗剂;流速为5.0 mL/min;进样体积为5.0 mL;收集22~30 min的洗脱液。将洗脱液于40 ℃下用氮气吹至近干。再将残渣用1.0 mL乙腈-水(体积比1∶1)溶解,过0.22 μm有机相膜待测。
1.4 色谱条件
色谱柱采用ZORBAX SB-C18柱(250 mm×4.6 mm,5 μm);柱温为30 ℃;流动相:A为20 mmol/L乙酸铵溶液,B为甲醇;流速为1.0 mL/min;检测器为二极管阵列检测器,扫描范围为210~750 nm;进样体积为10 μL。UPLC梯度洗脱程序为0~8 min,90% A;8~11 min,70% A;11~20 min,63% A;20~30 min,55% A;30~37 min,30% A;37~40 min,0% A;40~44 min,0% A;44~47 min,90% A;47~49 min,90% A。
2 结果与分析
2.1 样品前处理过程优化
干果之中基质复杂,通常包含大量的脂质、凝胶及碳水化合物,这些物质会影响色谱柱的正常分离从而阻碍色谱的正常分离[13],因此,需对前处理过程进行进一步优化以减轻基质效应。
酸性染料一般含有磺酸基,易溶于水。本实验选取水以及与水极性相近的甲醇和乙腈3种提取溶剂。研究表明,当使用甲醇为提取剂时,样品经溶解后为浆糊状,高速离心后仍分层不明显,从而无法准确测定;当使用乙腈、水为提取溶剂时,所有染料均可检出,但酸性橙10、酸性红73等染料回收率小于32%,未达到检测要求。考虑到乙腈和水的萃取特性,通过不断增加乙腈-水溶液中水的比例,来探求一种合理的萃取溶剂。当乙腈和水的体积比为19∶1、18∶2时,酸性橙10的回收率均低于50%;当乙腈和水的体积比为17∶3时,除酸性蓝7和酸性黄151的回收率为72%左右,其余染料回收率均高于82%,萃取效果良好。因此,本实验选取乙腈-水(体积比17∶3)为提取溶剂。
采用GPC净化方法将干果中的脂质、多糖等干扰杂质去除。实验发现,在22 min前收集液无染料检出,在22~30 min中收集液中开始检出染料,30 min后收集液无染料检出。因此,收集时间为22~30 min。脂质、糖类等干扰分子在10 min前被检出,说明该净化方法有效的避免了基质效应。
2.2 检测波长确定
研究表明,在确定最佳洗脱条件后,将检测波长设定为260、312、300、400、427、500、540、634 nm时,酸性橙10、酸性红14、酸性黑24、酸性紫43、酸性紫7、酸性蓝62,均能达成有效分离,但其他14种并未实现有效分离。为进一步提高方法的定性分析能力,本实验利用DAD对其余14种酸性染料进行光谱信息采集,得到其完整的光谱图,如图1所示。在210~750 nm波长范围内,均有可检测定性的峰出现。该方法确定了16种酸性染料的最佳吸收波长。实验证明,该方法有效的提高了20种酸性染料检测的灵敏度和特异性,减少了共存物质的干扰,使各物质均达到有效分离。利用DAD中特定程序,根据20种酸性染料的出峰顺序,以最佳吸收波长进行检测,所得液相色谱图如图2所示。

图1 14种酸性染料的光谱图
Fig.1 Spectra of 14 acid dyes
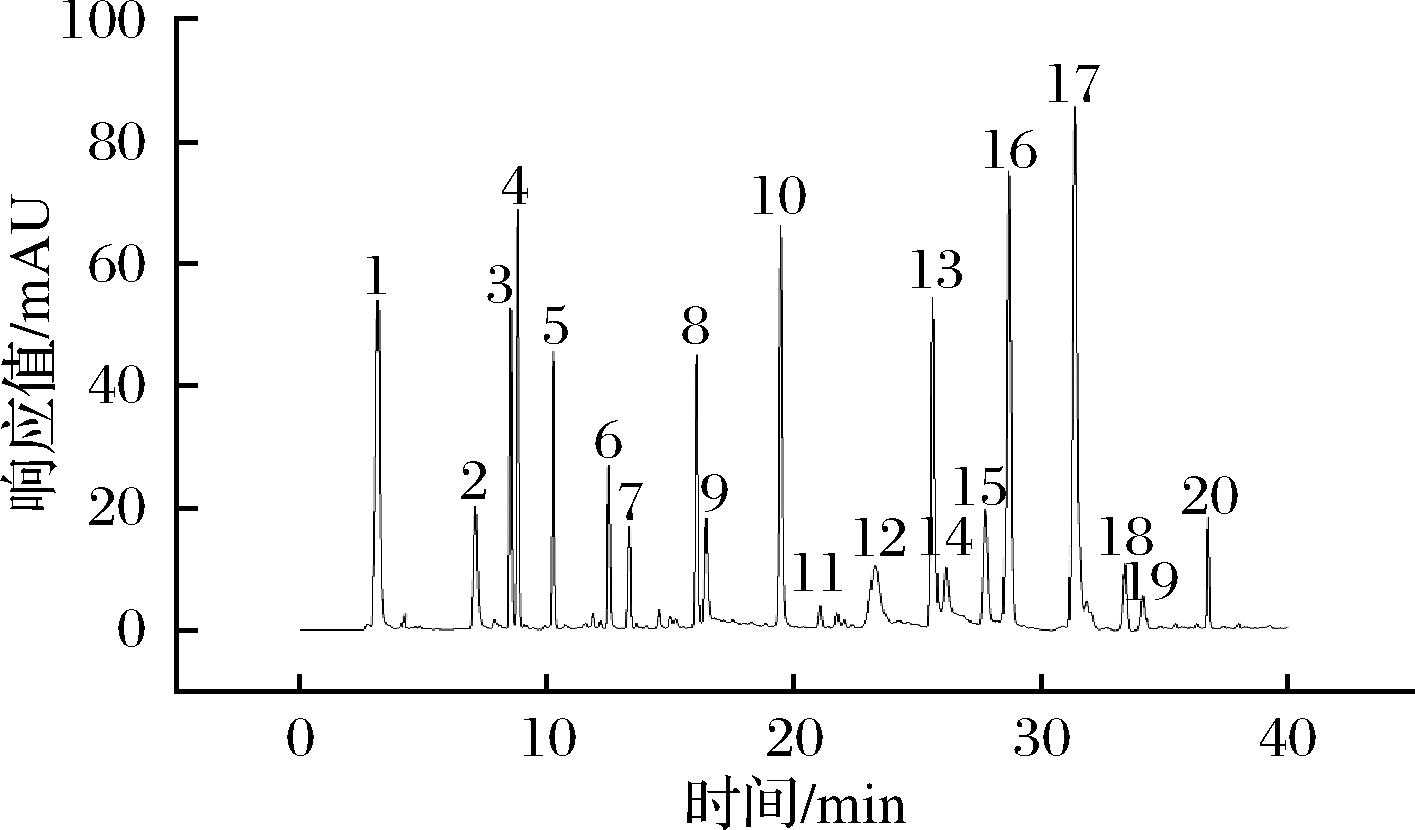
1-酸性黄23;2-酸性红18;3-酸性紫7;4-酸性橙10;5-酸性红35;6-酸性红14;7-酸性绿5;8-酸性红73;9-酸性黑1;10-酸性橙7;11-酸性黑24;12-酸性橙56;13-酸性紫43;14-酸性紫17;15-酸性蓝62;16-酸性蓝7;17-酸性黄151;18-酸性黄79;19-酸性棕282;20-酸性绿73
图2 标准酸性染料的液相色谱图
Fig.2 Liquid chromatograms acidic dye standards
2.3 方法灵敏度(线性范围、检出限、定量限)
配制20种酸性染料系列标准混合液(5.0、10.0、20.0、40.0、80.0 μg/mL)进行测定。以20种染料的质量浓度(μg/mL)为横坐标,峰面积为纵坐标进行拟合,线性结果如表1所示。结果显示除酸性黑24和酸性橙56外,其余18种酸性染料在5~50 μg/mL范围内均具有良好的线性关系,相关系数均大于0.98。酸性黑24和酸性橙56则在10~80 μg/mL和10~60 μg/mL范围内有良好线性关系,相关系数分别为0.999 9 和0.988 3。仪器的检测限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)分别为3倍信噪比和10倍信噪比时的浓度(表1),该方法的LOD和LOQ分别为0.01~0.08 μg/g和0.04~0.25 μg/g。
表1 二十种染料的线性范围和相关系数
Table 1 Linear range, linear regression equation and correlation coefficient of 20 dyes

染料线性范围/(μg·mL-1)线性方程相关系数(r)LOD/(μg·g-1)LOQ/(μg·g-1)酸性黄235^50y=25.055 8x+33.247 80.991 00.030.10酸性红185^50y=11.887 3x-17.048 90.994 70.060.19酸性紫75^50y=21.009 9x-2.797 30.999 90.020.06酸性橙105^50y=19.273 9x-6.333 50.999 80.020.06酸性红355^50y=5.513 5x-2.059 60.999 50.050.15酸性红145^50y=18.947 7x-4.932 20.999 50.050.17酸性绿55^50y=68.144 0x-2.486 30.999 70.060.18酸性红735^50y=28.063 4x+3.866 30.999 60.020.06酸性黑15^50y=20.351 3x-32.190 80.995 30.030.10酸性橙75^50y=39.279 4x+2.415 40.999 80.020.06酸性黑2410^80y=2.089 4x-0.827 00.999 90.260.81酸性橙5610^60y=14.214 9x-26.808 20.988 30.110.35酸性紫435^50y=30.347 9x-5.681 70.999 40.040.12酸性紫175^50y=17.912 4x-0.756 30.999 70.130.40酸性蓝625^50y=44.850 9x-11.589 70.998 40.060.18酸性蓝75^50y=36.145 5x-30.051 50.999 20.030.10酸性黄1515^50y=41.806 4x-30.230 00.998 30.010.04酸性黄795^50y=10.531 7x+3.960 90.999 20.130.41酸性棕2825^50y=11.772 9x-10.179 10.998 50.210.67酸性绿735^50y=5.960 9x-3.002 70.998 90.090.28
2.4 方法精密度与准确度
对干果(枸杞和葡萄干)样品采用外标法进行加标回收实验,加标水平分别为5、10、20 μg/mL,依照优化后的方法平行测定6份。分析结果列于表2,空白加标样本的液相色谱图如图3所示。结果表明,该方法可避免杂质干扰。在添加量为5~20 μg/mL时,干果中20种酸性染料的回收率在71%~114%,相对标准偏差(relative standard deviation,RSD)小于7.5%。因此,本方法对测定干果中的20种酸性染料具有良好的准确性、精密度。
表2 干果中20种染料的回收率和相对标准偏差
Table 2 Recoveries and RSDs of 20 dyes in dried fruits
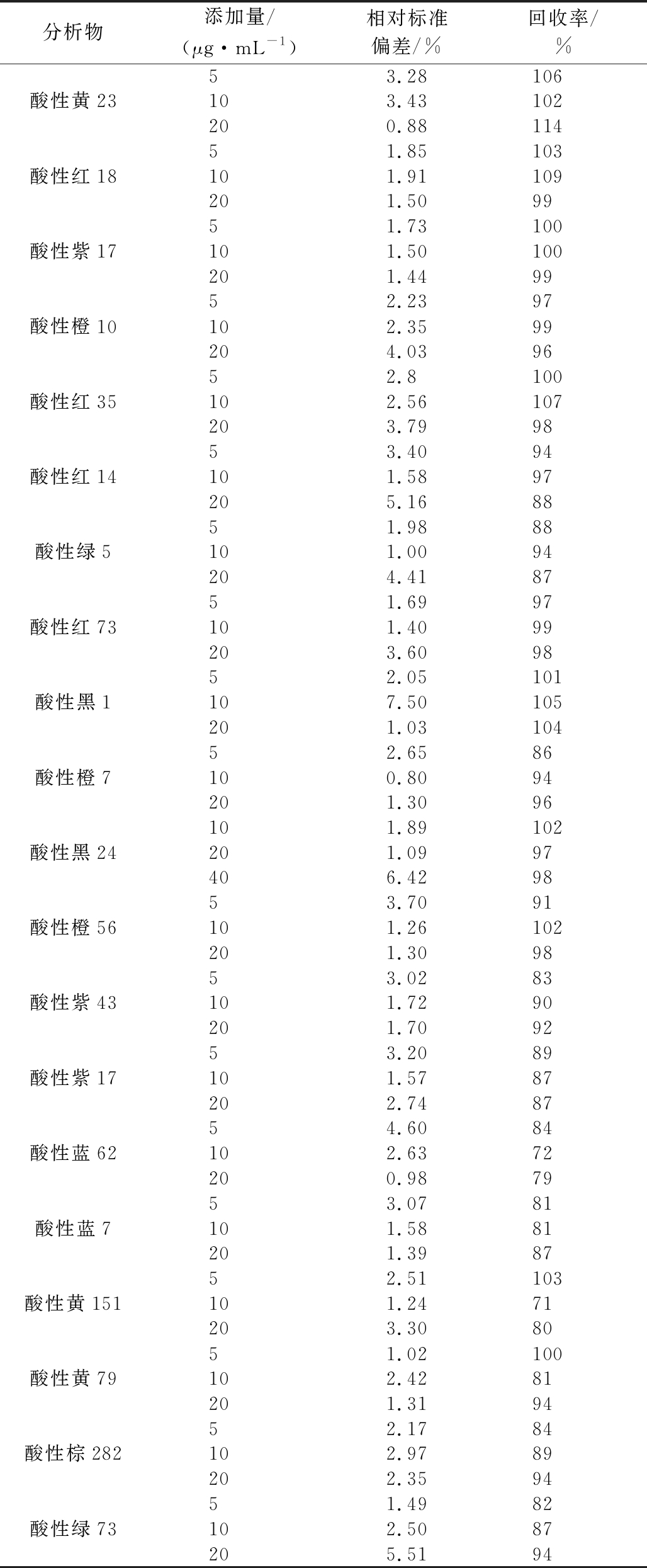
分析物添加量/(μg·mL-1)相对标准偏差/%回收率/%53.28106酸性黄23103.43102200.8811451.85103酸性红18101.91109201.509951.73100酸性紫17101.50100201.449952.2397酸性橙10102.3599204.039652.8100酸性红35102.56107203.799853.4094酸性红14101.5897205.168851.9888酸性绿5101.0094204.418751.6997酸性红73101.4099203.609852.05101酸性黑1107.50105201.0310452.6586酸性橙7100.8094201.3096101.89102酸性黑24201.0997406.429853.7091酸性橙56101.26102201.309853.0283酸性紫43101.7290201.709253.2089酸性紫17101.5787202.748754.6084酸性蓝62102.6372200.987953.0781酸性蓝7101.5881201.398752.51103酸性黄151101.2471203.308051.02100酸性黄79102.4281201.319452.1784酸性棕282102.9789202.359451.4982酸性绿73102.5087205.5194

1-酸性黄23;2-酸性红18;3-酸性紫7;4-酸性橙10;5-酸性红35;6-酸性红14;7-酸性绿5;8-酸性红73;9-酸性黑1;10-酸性橙7;11-酸性黑24;12-酸性橙56;13-酸性紫43;14-酸性紫17;15-酸性蓝62;16-酸性蓝7;17-酸性黄151;18-酸性黄79;19-酸性棕282;20-酸性绿73
图3 干果中酸性染料的液相色谱图
Fig.3 Liquid chromatograms acid dyes in dried fruits
2.5 实际样品测定
为了确认优化方法的可行性,于新疆乌鲁木齐市农产品市场葡萄干、枸杞等各65批次样品,并使用本文优化的方法对20种酸性染料进行测定。结果表明,其中3个批次的枸杞和葡萄干中均检测到酸性红18,最高浓度为1.91 μg/g。其余19种酸性染料均未检出。实验证明,在干果中确有酸性染料存在,但均低于《食品添加剂使用标准》中的使用量。
3 结论
本文建立了一种依托于超高效液相色谱法同时测定干果中的20种酸性染料的方法,该方法使用乙腈-水溶剂提取、使用GPC净化的方法对样品进行前处理,并分析了20种酸性染料的光谱特性,优化了检测条件。经检验,该方法线性范围良好,检测限和定量限较低,具有良好的回收率和准确性。本方法成本低、检测快,适合批量检测干果中的酸性染料的含量。
[1] BERZAS J J, RODR GUEZ FLORES J, VILLASE
GUEZ FLORES J, VILLASE OR LLERENA M J, et al.Spectrophotometric resolution of ternary mixtures of Tartrazine, Patent Blue V and Indigo Carmine in commercial products[J].Analytica Chimica Acta, 1999, 391(3):353-364.
OR LLERENA M J, et al.Spectrophotometric resolution of ternary mixtures of Tartrazine, Patent Blue V and Indigo Carmine in commercial products[J].Analytica Chimica Acta, 1999, 391(3):353-364.
[2] STEVENS L J, KUCZEK T, BURGESS J R, et al.Mechanisms of behavioral, atopic, and other reactions to artificial food colors in children[J].Nutrition Reviews, 2013, 71(5):268-281.
[3] GOLKA K, KOPPS S, MYSLAK Z W.Carcinogenicity of azo colorants:Influence of solubility and bioavailability[J].Toxicology Letters, 2004, 151(1):203-210.
[4] 王丽增, 黎晓琼, 温世祺, 等.食用色素的吸附伏安法分析[J].应用化学, 1990, 7(3):82-84.
WANG L Z, LI X Q, WEN S Q, et al.Determination of food colourant by adsorptive stripping voltammetry[J].Chinese Journal of Applied Chemistry, 1990, 7(3):82-84.
[5] KAUR A, GUPTA U.The review on spectrophotometric determination of synthetic food dyes and lakes[J].Gazi University Journal of Science, 2012, 25:579-588.
[6] DE ANDRADE F I, FLORINDO GUEDES M I, PINTO VIEIRA  G, et al.Determination of synthetic food dyes in commercial soft drinks by TLC and ion-pair HPLC[J].Food Chemistry, 2014, 157:193-198.
G, et al.Determination of synthetic food dyes in commercial soft drinks by TLC and ion-pair HPLC[J].Food Chemistry, 2014, 157:193-198.
[7] 宋新, 纪双利, 杨丽, 等.示波极谱法在食品合成食用色素测定中的应用[J].中国食品卫生杂志, 2009, 21(5):422-423.
SONG X, JI S L, YANG L, et al.Application of oscillopolarography in synthetic food colorants determination[J].Chinese Journal of Food Hygiene, 2009, 21(5):422-423.
[8] 纪静静. 加压毛细管电色谱分离酸性人工合成色素的技术研究[D].福州:福州大学, 2016.
JI J J.Study on the separation of acidic artificial pigments by pressurized capillary electrochromatography[D].Fuzhou:Fuzhou University, 2016.
[9] FENG F, ZHAO Y S, YONG W, et al.Highly sensitive and accurate screening of 40 dyes in soft drinks by liquid chromatography-electrospray tandem mass spectrometry[J].Journal of Chromatography B, 2011, 879(20):1 813-1 818.
[10] BONAN S, FEDRIZZI G, MENOTTA S, et al.Simultaneous determination of synthetic dyes in foodstuffs and beverages by high-performance liquid chromatography coupled with diode-array detector[J].Dyes and Pigments, 2013, 99(1):36-40.
[11] WU H, GUO J B, DU L M, et al.A rapid shaking-based ionic liquid dispersive liquid phase microextraction for the simultaneous determination of six synthetic food colourants in soft drinks, sugar- and gelatin-based confectionery by high-performance liquid chromatography[J].Food Chemistry, 2013, 141(1):182-186.
[12] LIU W G, LIU J, ZHANG Y, et al.Simultaneous determination of 20 disperse dyes in foodstuffs by ultra high performance liquid chromatography-tandem mass spectrometry[J].Food Chemistry, 2019, 300:125183.
[13] ALVES S P, BRUM D M, DE ANDRADE É C B, et al.Determination of synthetic dyes in selected foodstuffs by high performance liquid chromatography with UV-DAD detection[J].Food Chemistry, 2008, 107(1):489-496.
[14] WU, X Z.UPLC detection of acid dyes in sports drinks[J].Chemical Engineering Transactions, 2016, 55:73-78.
[15] 钮怡清. 高效液相色谱法检测辣椒、花椒粉中五种合成色素[J].食品与发酵工业, 2021, 47(24):256-260.
NIU Y Q.Determination of five kinds of synthetic pigments in chili powder and paprika powder by HPLC[J].Food and Fermentation Industries, 2021, 47(24):256-260.
[16] GONZ LEZ M, GALLEGO M, VALC
LEZ M, GALLEGO M, VALC RCEL M.Determination of natural and synthetic colorants in prescreened dairy samples using liquid chromatography-diode array detection[J].Analytical Chemistry, 2003, 75(3):685-693.
RCEL M.Determination of natural and synthetic colorants in prescreened dairy samples using liquid chromatography-diode array detection[J].Analytical Chemistry, 2003, 75(3):685-693.
[17] GOSETTI F, FRASCAROLO P, MAZZUCCO E, et al.Photodegradation of E110 and E122 dyes in a commercial aperitif.A high performance liquid chromatography-diode array-tandem mass spectrometry study[J].Journal of Chromatography A, 2008, 1202(1):58-63.
[18] MINIOTI K S, SAKELLARIOU C F, THOMAIDIS N S.Determination of 13 synthetic food colorants in water-soluble foods by reversed-phase high-performance liquid chromatography coupled with diode-array detector[J].Analytica Chimica Acta, 2007, 583(1):103-110.
[19] CHEN X H, ZHAO Y G, SHEN H Y, et al.Fast determination of seven synthetic pigments from wine and soft drinks using magnetic dispersive solid-phase extraction followed by liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2014, 1346:123-128.
[20] 谢维平, 黄盈煜, 傅晖蓉, 等.凝胶柱净化-高效液相色谱检测食品中的苏丹红[J].色谱, 2005,23(5):542-544.
XIE W P, HUANG Y Y, FU H R, et al.Simultaneous determination of Sudan Red dyes in foods by high performance liquid chromatography with a clean-up procedure by gel column[J].Chinese Journal of Chromatography, 2005,23(5):542-544.
[21] KHANAVI M, HAJIMAHMOODI M, RANJBAR A M,et al.Development of a green chromatographic method for simultaneous determination of food colorants[J].Food Analytical Methods, 2012, 5(3):408-415.
[22] KIRSCHBAUM J, KRAUSE C, BRÜCKNER H.Liquid chromatographic quantification of synthetic colorants in fish roe and caviar[J].European Food Research and Technology, 2006, 222(5):572-579.
[23] SUN H W, SUN N, LI H, et al.Development of multiresidue analysis for 21 synthetic colorants in meat by microwave-assisted extraction-solid-phase extraction-reversed-phase ultrahigh performance liquid chromatography[J].Food Analytical Methods, 2013, 6(5):1 291-1 299.