海胆是一类海洋无脊椎动物[1],属棘皮动物门,海胆中含有多种营养物质,包括维生素、矿物质、蛋白质、多糖[2]和高质量的多不饱和脂肪酸[3],且具有抗癌、抗凝血、抗血栓的形成、抗微生物和抗氧化特性等特性。海胆味道鲜美,营养价值高,但在加工贮运过程中很容易发生自溶[4],极大的影响其食用价值及口感,为了增加海胆的保存期限,目前以盐渍、冰鲜海胆和酒精加工为主[5],但是含盐量较高、仅可作为调味品等问题限制了海胆的销售市场。真空冷冻干燥技术是一种高效的脱水方法,在食品贮运过程中可以最大限度的保持原生鲜食品的色香味及营养成分[6],因此研究不同冻干条件对海胆不同指标的影响对海胆的加工具有重要的实际意义,本试验以冻干温度为变量,研究其对海胆中挥发性有机物质含量的影响。
气相色谱-离子迁移谱(gas chromatography-ion mobility spectrometry,GC-IMS)是一种新型的气相分离技术,检测时间快,无需前处理,检测结果稳定等优点,已被广泛应用于食品中风味物质的分析[7],如杜晓兰等[8]对不同加工方式制作的番鸭肉中的风味物质进行分析,WANG等[9]对比分析了不同年龄下靖远羔羊样品中的挥发性风味物质之间的差异,王帆等[10]利用GC-IMS技术对不同养殖模式下的河蟹中的风味物质进行了研究。风味是评价海胆性腺新鲜程度的一个重要指标[11],TAKAGI等[12]研究了摄食海带对海胆性腺中风味物质的影响,结果表明饲喂海带会减少海胆性腺中不好的气味成分,还增加了海带的香气,对养殖海胆饲料的选择具有很大的意义。ZHAO等[13]研究了温度对海胆性腺产量、颜色和风味的影响,研究表明,高温条件下,海胆性腺的产量值显著升高,低温组海胆性腺的颜色和风味显著优于高温组,综合分析可得高温有利于提高海胆性腺的产量和指标,低温有利于提高海胆性腺的品质。
目前对海胆中风味物质的研究多集中于海胆的养殖方面,对海胆加工过程中以及不同加工条件对海胆风味物质造成的影响方面研究较少。因此本文通过对不同冻干温度下海胆中挥发性风味物质之间的差异进行研究,以期为后续海胆的加工提供一定的理论参考。
1 材料与方法
1.1 材料与设备
虾夷马粪海胆由大连乾日海洋食品有限公司提供,取鲜活海胆,从围口部将海胆打开一个开口,去除内脏,取完整的海胆黄,置于速冻仓中速冻2 h,使海胆中心温度低于-30 ℃。打开真空冷冻干燥机预热30 min,打开压缩机,当冷阱温度达到-40 ℃时将海胆置于托盘中,关闭仓门,打开真空泵,真空度设置为30 Pa,加热板温度分别设置为30、50、70 ℃。冻干时间:30 ℃条件下冻干40 h,50 ℃条件下冻干32 h、70 ℃的条件下冻干20 h,冻干后的海胆水分含量<3%。
LG1.5型真空冷冻干燥试验机,新阳速冻设备制造有限公司;200型电子天平,美国双杰兄弟有限公司;FlavourSpec®风味分析仪(GC-IMS),德国G.A.S公司;MXT-5型色谱柱,美国RESTEK公司。
1.2 GC-IMS进样方法
称取冻干海胆样品各1 g,分别放入20.0 mL顶空进样瓶中,50 ℃孵化20 min,顶空进样后用GC-IMS风味仪对样品挥发性成分进行分析,参考PU等[14]的方法,略作修改。仪器运行实际参数设置如下:顶空孵化温度:50 ℃;孵育时间20 min;转速500 r/min;进样针温度85 ℃;进样体积500.0 μL,不分流模式;载气为高纯N2(纯度≥99.99%);清洗时间0.5 min。
GC条件:色谱柱温度 40 ℃;运行时间 20 min;载气为高纯 N2(纯度≥99.99%);初始流速2.0 mL/min,保持10 min后在15 min内增至150 mL/min。
IMS条件:MXT-5型色谱柱(柱长15 m,内径0.53 mm,厚度1 μm);柱温60 ℃;漂移气(N2,纯度≥99.99%);流速150 mL/min;IMS温度45 ℃;分析时间20 min。
1.3 数据分析
利用风味仪Laboratory Analytical Viewer、Reporter、Gallery Plot 和Dynamic PCA 插件分析数据。与仪器内置的数据库(GC × IMS Library Search NIST数据库和IMS数据库)进行对比分析,对样品中的挥发性风味物质进行定性分析。采用Microsoft Excel 2010对实验数据进行分析,柱状图采用Origin 2019软件绘制。
2 结果与分析
2.1 不同冻干温度海胆GC-IMS风味成分谱图分析
图1是通过GC-IMS技术对不同冻干温度下海胆中的挥发性风味物质进行检测所得到的三维谱图。X轴表示漂移时间,Y轴表示保留时间,Z轴表示峰强度,谱图中的每一个点代表一种化合物,一种化合物可能会有两个或多个斑点,代表二聚体或多聚体。气味成分的含量通过颜色深浅呈现,颜色越深表示该物质含量越高。三维谱图从左到右依次代表在30、50、70 ℃条件下冻干海胆。观察可得,海胆在不同温度下冻干的GC-IMS三维谱图难以用肉眼予以区分。
图1 不同冻干温度海胆中挥发性物质三维谱图
Fig.1 Three-dimensional spectra of volatile substances in sea urchins at different freeze-drying temperatures
为了更好地区分不同冻干温度下海胆中挥发性风味物质的差异,将图1中的三维谱图转化成二维平面图(图2),图3是扣除与30 ℃冻干海胆相同部分得到的差异对比图,进一步区分不同冻干温度海胆中的挥发性风味物质。由图3可知,不同冻干温度下,GC-IMS能够分离海胆中的不同挥发性风味物质,且这些物质的含量有升高或下降的趋势。这可能是由于在冻干过程中,随着温度的变化,风味物质的含量发生变化[15]。于小番等[16]研究不同中心温度对黄颡鱼风味物质的影响,发现较高温度加工条件下,黄颡鱼的香气更浓郁,其中醛类物质对风味贡献较大。
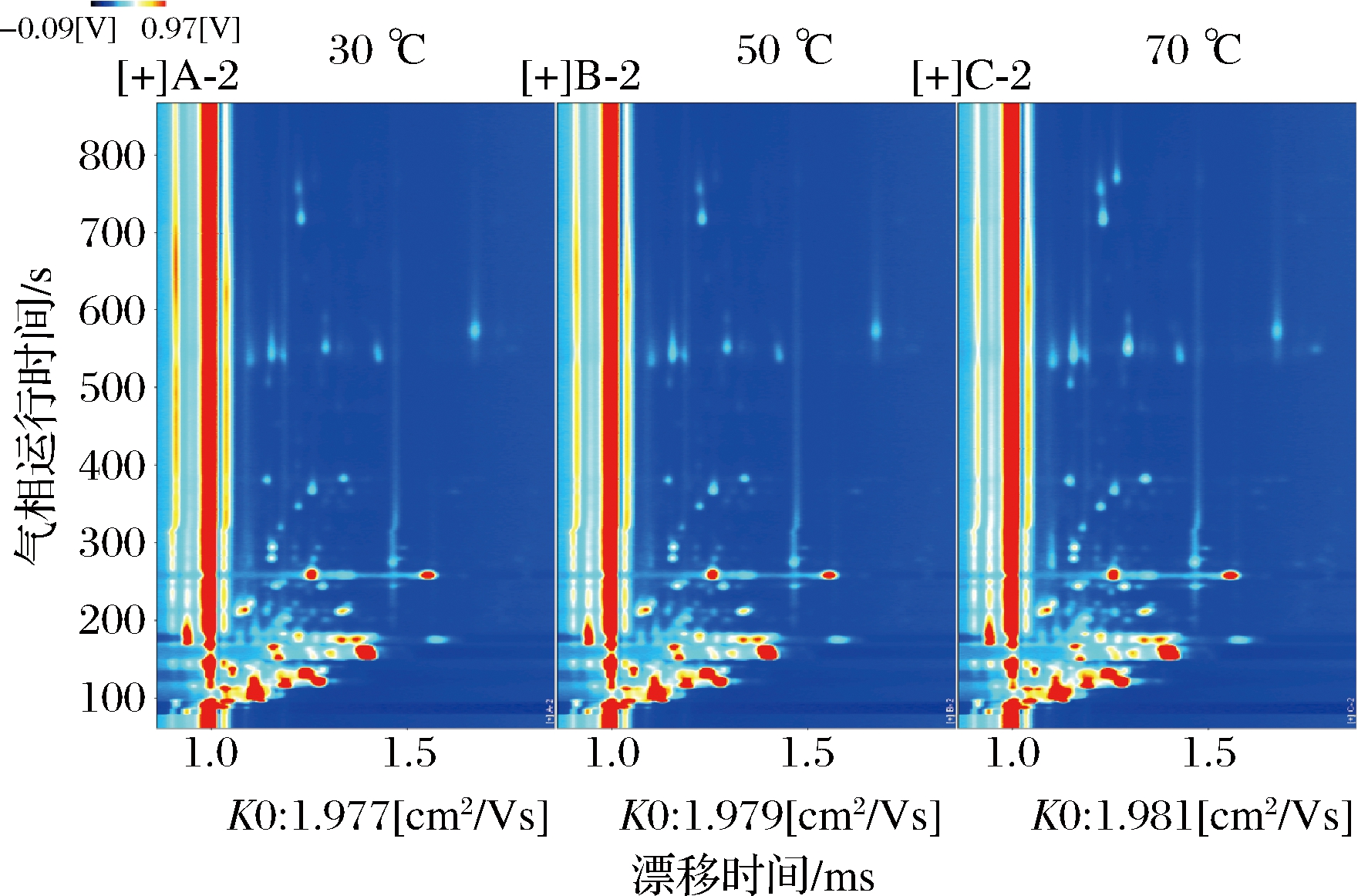
图2 不同冻干温度海胆挥发性物质成分GC-IMS二维图谱
Fig.2 Two dimensional GC-IMS chromatogram of volatile constituents of sea urchin at different freeze-drying temperatures

图3 不同冻干温度海胆挥发性物质成分差异对比
Fig.3 Comparison of volatile components of sea urchins at different freeze-drying temperatures
2.2 不同冻干温度海胆GC-IMS风味成分定性分析
根据挥发性风味物质的迁移时间、保留时间和保留指数,与仪器的数据库对比,实现对挥发性风味物质的定性。如图4所示,每一个数字代表一种挥发性物质,图中的物质编号与表1中的编号一一对应。在不同温度冻干海胆样品的40个信号峰中共鉴定出24种挥发性风味物质,其中醛类物质15种,醇类物质4种,酮类物质4种,吡嗪类物质1种。
表1 不同冻干温度海胆中挥发性风味物质定性分析结果
Table 1 Qualitative analysis results of volatile flavor compounds in sea urchins at different freeze-drying temperatures
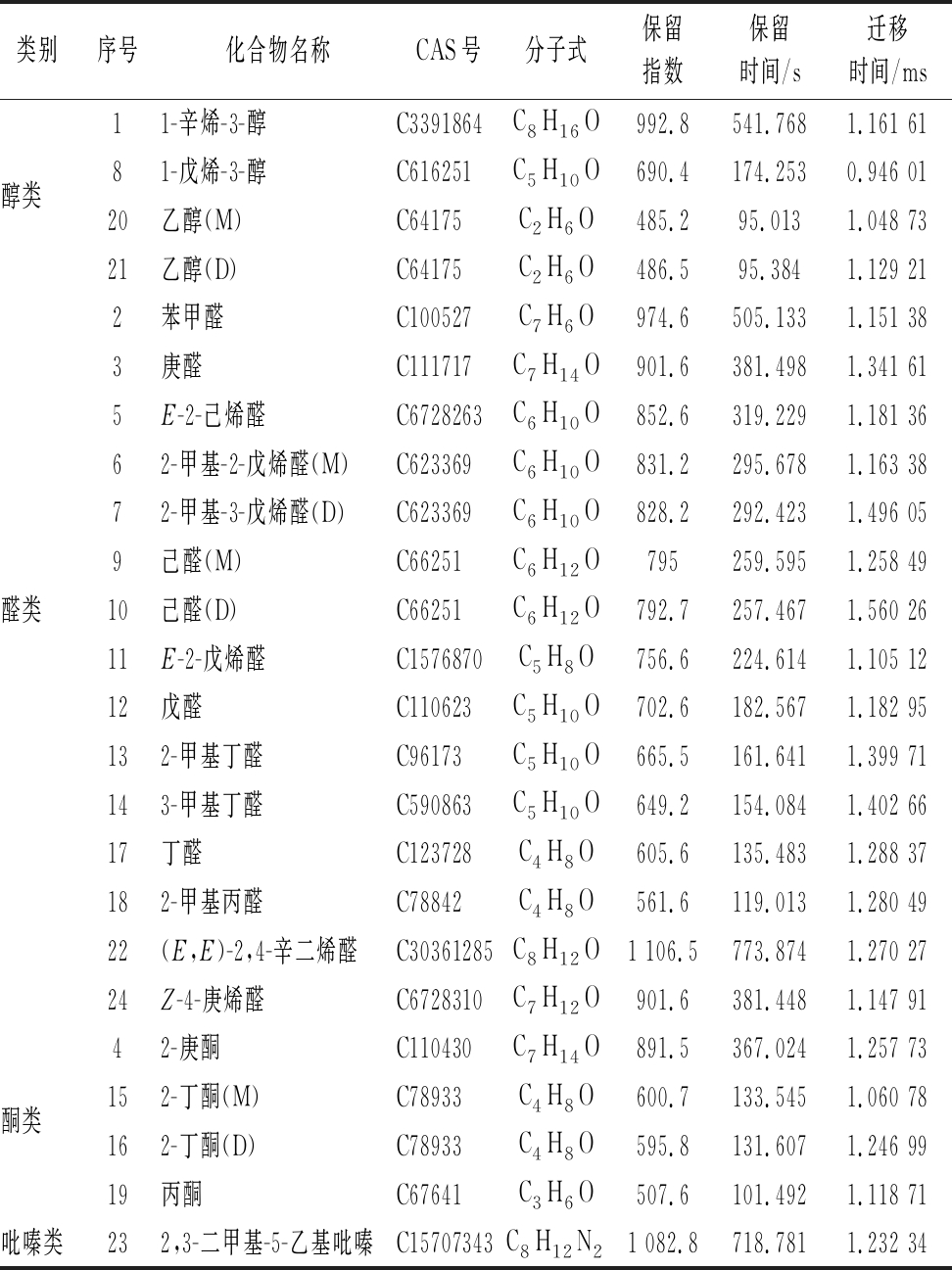
类别序号化合物名称CAS号分子式保留指数保留时间/s迁移时间/ms11-辛烯-3-醇C3391864C8H16O992.8541.7681.161 61醇类81-戊烯-3-醇C616251C5H10O690.4174.2530.946 0120乙醇(M)C64175C2H6O485.295.0131.048 7321乙醇(D)C64175C2H6O486.595.3841.129 212苯甲醛C100527C7H6O974.6505.1331.151 383庚醛C111717C7H14O901.6381.4981.341 615E-2-己烯醛C6728263C6H10O852.6319.2291.181 3662-甲基-2-戊烯醛(M)C623369C6H10O831.2295.6781.163 3872-甲基-3-戊烯醛(D)C623369C6H10O828.2292.4231.496 059己醛(M)C66251C6H12O795259.5951.258 49醛类10己醛(D)C66251C6H12O792.7257.4671.560 2611E-2-戊烯醛C1576870C5H8O756.6224.6141.105 1212戊醛C110623C5H10O702.6182.5671.182 95132-甲基丁醛C96173C5H10O665.5161.6411.399 71143-甲基丁醛C590863C5H10O649.2154.0841.402 6617丁醛C123728C4H8O605.6135.4831.288 37182-甲基丙醛C78842C4H8O561.6119.0131.280 4922(E,E)-2,4-辛二烯醛C30361285C8H12O1 106.5773.8741.270 2724Z-4-庚烯醛C6728310C7H12O901.6381.4481.147 9142-庚酮C110430C7H14O891.5367.0241.257 73酮类152-丁酮(M)C78933C4H8O600.7133.5451.060 78162-丁酮(D)C78933C4H8O595.8131.6071.246 9919丙酮C67641C3H6O507.6101.4921.118 71吡嗪类232,3-二甲基-5-乙基吡嗪C15707343C8H12N21 082.8718.7811.232 34
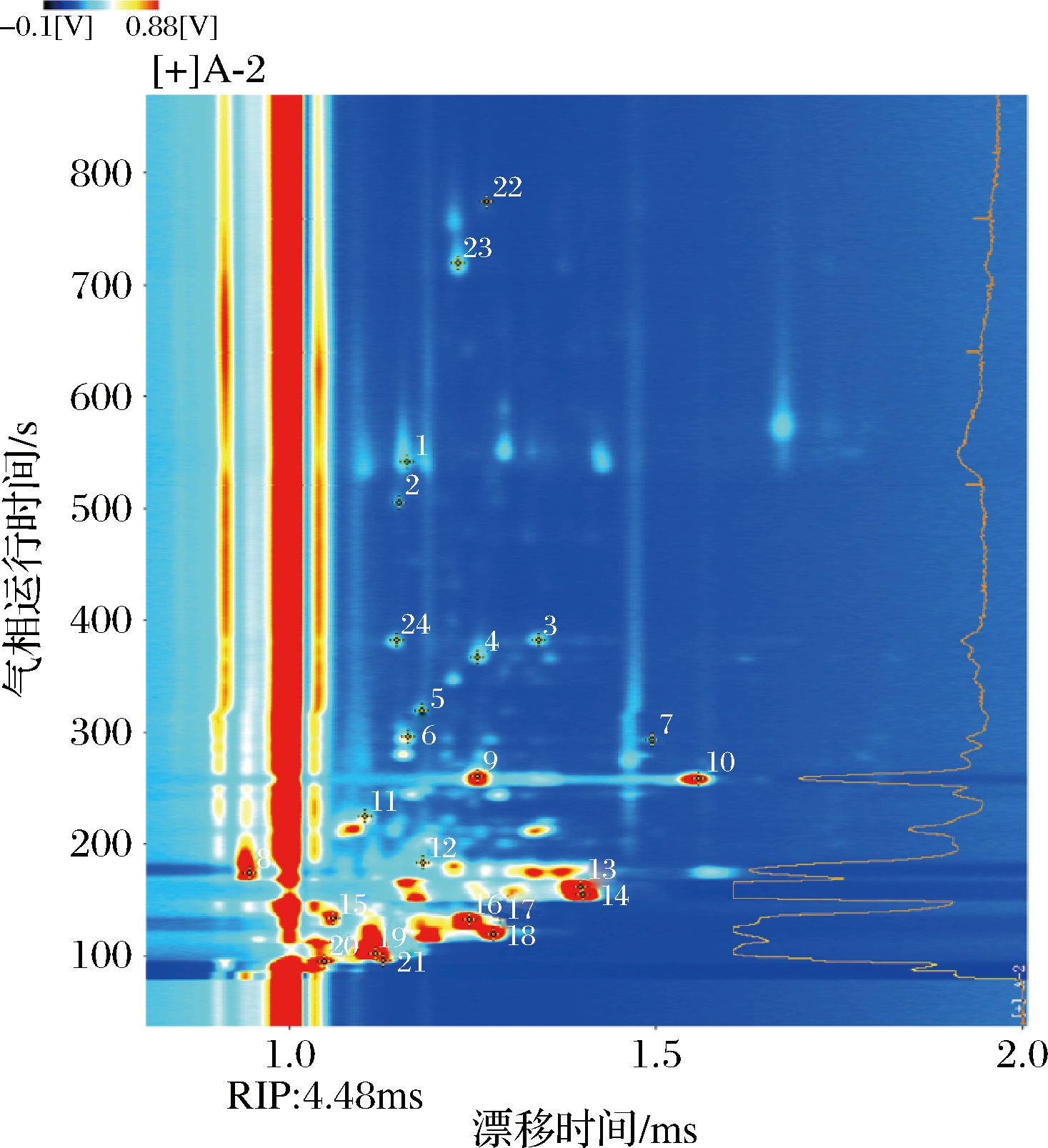
图4 冻干海胆中挥发性物质GC-IMS定性
Fig.4 GC-IMS characterization of volatile compounds of freeze-dried sea urchins
2.3 不同冻干温度海胆挥发性成分指纹图谱
为了更加直观区分不同温度冻干海胆中挥发性风味物质含量的差别,利用Gallery Plot插件生成如图5所示的指纹图谱,其中每一横行代表每一个样品中所有的挥发性风味物质,每一个温度样品平行测定3次,每一纵行代表同一种挥发性风味物质在不同样品中的含量多少,颜色越深表示含量越多,其中数字代表未定性的风味物质。
如图5所示,A区域中的挥发性风味物质随冻干温度的升高,含量先上升后下降,即在50 ℃冻干时含量最高,包括乙醇(单聚体、二聚体)和2-庚酮;B区域中的挥发性风味物质随冻干温度的升高,含量先下降后上升,即在50 ℃冻干时含量最低,包括丁醛和E-2-戊烯醛;C区域中的挥发性风味物质随冻干温度的升高含量逐渐下降,包括丙酮和丁酮(单聚体、二聚体);D区域中的挥发性风味物质随冻干温度的升高含量逐渐升高,包括2-甲基丙醛和1-辛烯-3-醇;E区域中的挥发性风味物质在70 ℃冻干海胆中的含量最高,包括2-甲基丁醛、3-甲基丁醛、己醛(单聚体、二聚体)、戊醛、庚醛、2-甲基-2-戊烯醛(单聚体、二聚体)、2,3-二甲基-5-乙基吡嗪,Z-4-庚烯醛、E-2-己烯醛、苯甲醛和(E,E)-2,4-辛二烯醛,其含量明显高于30、50 ℃冻干海胆中的风味物质,这可能是由于在较高温度条件下,发生了美拉德反应[17],导致3种不同冻干温度条件下海胆中挥发性风味物质的含量不同,其中醛类物质较多,3-甲基丙醛在70 ℃冻干海胆中的相对含量高达11.48%,赋予海胆苹果香气,对海胆的风味贡献有积极作用,此外较高温度冻干有助于减少海胆中的微生物含量[18]。王益强等[19]分析真空冷冻干燥技术对食品质量的影响,与其他干燥方法对比,得出真空冷冻干燥技术在贮藏过程中能够较好的抑制微生物的生长繁殖。

图5 不同冻干温度海胆中挥发性物质指纹图谱
Fig.5 Fingerprint of volatile substances in sea urchins at different freeze-drying temperatures
注:数字表示未定性
为了对海胆中各类挥发性风味物质的含量进行可视化的分析,根据不同风味物质的离子峰体积,按照归一化法换算得到不同冻干温度海胆中挥发性风味物质的相对含量,如图6所示,30 ℃冻干温度下,海胆中醇类物质占比12.59%,醛类物质占比41.04%,酮类物质占比30.67%,吡嗪类占比1.28%;50 ℃冻干温度下,海胆中醇类物质占比13.84%,醛类物质占比41.35%,酮类物质占比28.82%,吡嗪类物质占比1.37%;70 ℃冻干温度下,海胆中醇类物质占比13.75%,醛类物质占比44.72%,酮类物质占比24.42%,吡嗪类物质占比1.47%。
由图6可知,在不同冻干温度下的海胆中,醛类物质在含量方面远远高于其他种类的挥发性风味物质,醛类物质阈值较低,对海胆的挥发性风味物质影响较大。醛类物质的相对含量随着冻干温度的升高,呈现逐渐上升的趋势,其中己醛单聚体(青草、脂肪)、己醛二聚体(青草、脂肪)、2-甲基丁醛(香甜)、3-甲基丁醛(苹果香)和2-甲基丙醛(刺激性气味)的含量在醛类物质中占比较高,说明干燥过程会对醛类挥发性物质造成一定的破坏[20],长时间的干燥处理会使其挥发性风物质损失,且冻干条件下油脂氧化分解因素的影响减少。罗成等[21]对比分析了不同干燥方式对腌腊高原冷水鱼中挥发性风味物质的影响,表明醛类物质是肉制品加工过程中重要的风味成分,且仿天然风干方式优于烘烤干燥方式。
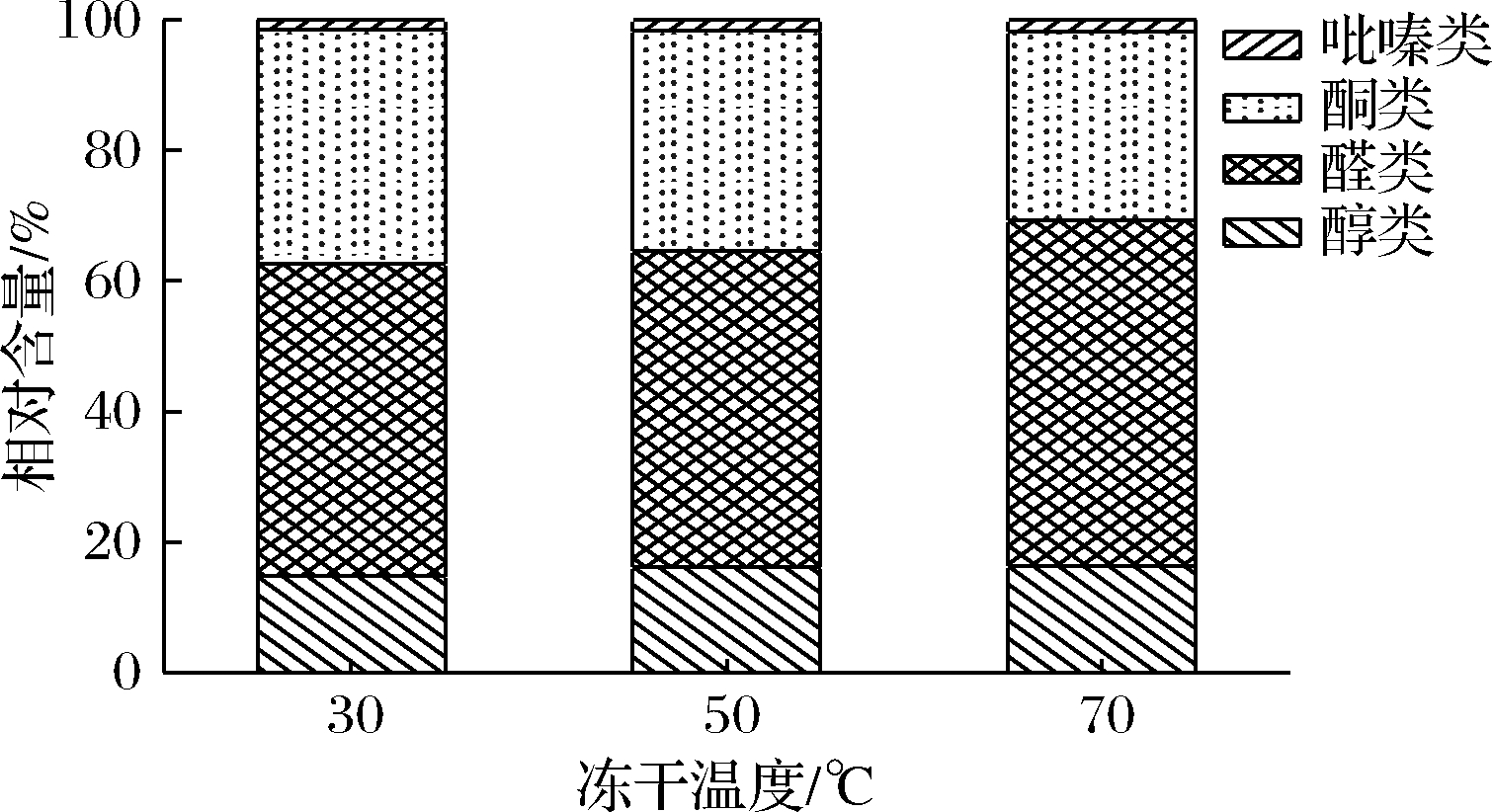
图6 不同冻干温度下海胆中各类挥发性风味物质相对含量
Fig.6 Relative contents of volatile flavor substances in sea urchins at different freeze-drying temperatures
其次含量较多的物质是酮类物质,干燥后酮类化合物有所增强,但真空环境下不易形成酮类化合物[22],相对含量随着冻干温度的升高呈现逐渐下降的趋势。其中丙酮(辛辣甜)的含量最高,2-丁酮(辛辣甜)的含量次之。
醇类物质在海胆风味物质中的占比低于酮类物质,醇类物质主要来源于不饱和脂肪酸的氧化,其阈值较高[23-24],对海胆的整体风味贡献较小。1-戊烯-3-醇(蘑菇味和青草味)和乙醇单聚体(酒香、刺激性辛辣味)的含量相对较高,与水产品风味之间联系密切,随着冻干温度的升高,醇类物质的含量呈现出先上升后下降的趋势,但是波动幅度不大,因此对冻干海胆的风味影响不大。
2.4 不同冻干温度海胆挥发性成分主成分分析
多元统计方法主要是通过降维的方法,将多个指标转化为少数指标,更加直观的区分不同变量对各个指标的影响。对3种不同冻干温度海胆中的挥发性风味物质进行主成分分析,如图7所示,不同冻干温度下,海胆中风味物质图谱之间存在明显差异,30℃与50℃冻干海胆中的风味物质数据相距较近,与70℃冻干海胆相距较远,说明70℃冻干海胆中的风味物质与其他两种温度之间存在较大的差异。由图7可知,主成分1和主成分2累计贡献率达到96%,且同一冻干温度下的海胆样品大致聚在一起,能够较好的反映不同冻干温度下海胆中挥发性风味物质含量之间差异,说明主成分分析能够较好的区分不同温度冻干海胆样品。

图7 不同冻干温度海胆中挥发性物质主成分分析
Fig.7 Principal component analysis of volatile substances in sea urchins at different freeze-drying temperatures
3 结论
本研究采用GC-IMS技术检测海胆在3种不同冻干温度下挥发性风味物质之间存在的差异,共鉴定出24种挥发性风味物质,包括醛类、酮类、醇类和吡嗪类,随着冻干温度的升高,海胆中的醛类物质含量逐渐上升,其中己醛(单聚体、二聚体)、2-甲基丁醛、3-甲基丁醛和2-甲基丙醛的含量在醛类物质中占比较高,对海胆风味贡献较大;酮类物质含量逐渐下降,丙酮和2-丁酮的含量较高;醇类物质含量先上升后下降,1-戊烯-3-醇和乙醇(单聚体)的含量较高,但其对海胆风味物质的整体贡献不大。对不同冻干温度海胆中的挥发性风味物质进行主成分分析,结果表明,两个主成分的累计贡献率达到96%,可以实现对不同冻干温度海胆的区分。该研究对不同冻干温度海胆中挥发性风味物质建立了指纹图谱,可视化的呈现了海胆中挥发性风味物质轮廓,为之后海胆的加工提供了一定的数据支持。
[1] AMIR Y, INSLER M, GILLER A, et al.Senescence and longevity of sea urchins[J].Genes, 2020,11(5):573.
[2] SIBIYA A, JEYAVANI J, SIVAKAMAVALLI J, et al.Bioactive compounds from various types of sea urchin and their therapeutic effects-A review[J].Regional Studies in Marine Science, 2021,44(6):101760.
[3] WANG H, ZHAO W F, DING B C, et al.Comparative lipidomics profiling of the sea urchin, Strongylocentrotus intermedius[J].Comparative biochemistry and physiology.Part D, Genomics & Proteomics, 2021,40:100900.
[4] WANG C, XUE C H, XUE Y, et al.Quality changes in sea urchin (Strongylocentrotus nudus) during storage in artificial seawater saturated with oxygen, nitrogen and air[J].Journal of the Science of Food and Agriculture, 2012,92(1):191-196.
[5] 冯令通.海胆真空冷冻干燥工艺研究及海胆黄固体饮料的开发[D].烟台:烟台大学,2020.
FENG L T. Study on vacuum freeze-drying technology of sea urchin and development of sea urchin gonad solid beverage[D]. Yantai: Yantai University, 2020.
[6] LIU Y, ZHANG Z Y, HU L D.High efficient freeze-drying technology in food industry[J].Critical Reviews in Food Science and Nutrition, 2022,62(12):3 370-3 388.
[7] HE W, REN F, WANG Y Q, et al.Application of GC-IMS in detection of food flavor substances[J].IOP Conference Series:Earth and Environmental Science,2020,545(1):012030.
[8] 杜晓兰,杨文敏,黄永强,等.基于顶空气相离子迁移谱比较3种加工方式对番鸭肉挥发性风味物质的影响[J].食品科学,2021,42(24):269-275.
DU X L, YANG W M, HUANG Y Q, et al. Effects of three processing methods on volatile flavor compounds of Muscovy duck meat as investigated by headspace-gas chromatography-ion mobility spectrometry[J]. Food Science, 2021, 42(24):269-275.
[9] WANG F, GAO Y Q, WANG H B, et al.Analysis of volatile compounds and flavor fingerprint in Jingyuan lamb of different ages using gas chromatography-ion mobility spectrometry (GC-IMS) [J].Meat Science, 2021, 175(1):108449.
[10] 王帆,张亚新,吴寒,等.气相离子迁移谱测定不同养殖模式河蟹风味物质的研究[J].食品安全质量检测学报, 2021,12(20):7 931-7 939.
WANG F, ZHANG Y X, WU H, et al. Study on determination of flavor compounds of river crab(Eriocheir sinensis) in different breeding modes by gas chromatography-ion mobility spectrometry[J]. Journal of Food Safety & Quality, 2021, 12(20):7 931-7 939.
[11] PHILLIPS K, BREMER P, SILCOCK P, et al.Effect of gender, diet and storage time on the physical properties and sensory quality of sea urchin (Evechinus chloroticus) gonads[J].Aquaculture, 2009,288(3-4):205-215.
[12] TAKAGI S, SATO Y, KOKUBUN A, et al.Odor-active compounds from the gonads of Mesocentrotus nudus sea urchins fed Saccharina japonica kelp[J].PloS one, 2020,15(4):e0231673.
[13] ZHAO C, TIAN X F, SUN P, et al.Long-term effects of temperature on gonad production, colour and flavour of the sea urchin Glyptocidaris crenularis[J].Journal of the Marine Biological Association of the United Kingdom, 2014,95(1):139-143.
[14] PU D D, ZHANG H Y, ZHANG Y Y, et al.Characterization of the aroma release and perception of white bread during oral processing by gas chromatography-ion mobility spectrometry and temporal dominance of sensations analysis[J].Food Research International, 2019,123:612-622.
[15] 张毅航,方东路,仲磊,等.热风干燥和真空冷冻干燥对猴头菇不同部位风味物质的影响[J].食品工业科技,2022,43(8):58-67.
ZHANG Y H, FANG D L, ZHONG L, et al.Effects of hot air-drying and vacuum freeze-drying on flavor components in different parts of Hericium erinaceus[J].Science and Technology of Food Industry, 2022,43(8):58-67.
[16] 于小番,夏超,许慧卿,等.加工方式及中心温度对黄颡鱼基础营养成分及风味的影响[J].中国调味品, 2020,45(8):20-23.
YU X F, XIA C, XU H Q, et al. Effects of processing methods and core temperatures on basic nutrients and flavor of Pelteobagrus fulvidraco[J]. China Condiment, 2020, 45(8):20-23.
[17] 周明珠,熊光权,乔宇,等.不同干燥方式下鮰鱼片的干燥特性及风味变化[J].现代食品科技,2021,37(4):242-251.
ZHOU M Z, XIONG G Q, QIAO Y, et al.Drying characteristics and flavor changes of catfish fillets under different drying methods [J].Journal of Modern Food Science and Technology, 2021,37(4):242-251.
[18] 金敬红,孙晓明,陈文华.真空冷冻干燥过程中微生物数量变化规律的初步研究[J].中国野生植物资源,2019,38(4):48-52.
JIN J H, SUN X M, CHEN W H. Preliminary study of microorganism variation in vacuum freeze drying process[J]. Chinese Wild Plant Resources, 2019, 38(4):48-52.
[19] 王益强,孙萍,刘鲁建.真空冷冻干燥对食品质量的影响[J].莱阳农学院学报,2003,20(2):149-153.
WANG Y Q, SUN P, LIU L J. Effect of food quality on condition of the vacuum freezing-dry[J]. Journal of Laiyang Agricultural College, 2003, 20(2):149-153.
[20] LI Q, ZHANG H H, CLAVER I P, et al.Effect of different cooking methods on the flavour constituents of mushroom (Agaricus bisporus (Lange) Sing) soup[J].International Journal of Food Science and Technology, 2011,46(5):1 100-1 108.
[21] 罗成,白婷,张旭,等.干燥方式对腌腊高原冷水鱼产品特性的影响[J].农产品加工,2021(13):53-57.
LUO C, BAI T, ZHANG X, et al. Effects of drying process on product characteristics of cured plateau cold-water fish[J]. Farm Products Processing, 2021(13):53-57.
[22] 唐秋实, 陈智毅, 刘学铭, 等.几种干燥方式对金针菇子实体挥发性风味成分的影响[J].食品工业科技, 2015, 36(10):119-124.
TANG Q S, CHEN Z Y, LIU X M, et al.Influence of drying methods on volatile components of Flammulina velutipe[J].Science and Technology of Food Industry,2015,36(10):119-124.
[23] 刘俊霞, 赵萍, 金晶, 等. 基于气相色谱-离子迁移谱结合化学计量学分析大鲵肉冷藏期间挥发性成分[J]. 食品与发酵工业, 2022, 48(22):269-278.
LIU J X, ZHAO P, JIN J, et al. Analysis of volatile components in giant salamander meat during cold storage based on gas chromatography-ion mobility spectrometer and chemometrics[J]. Food and Fermentation Industries, 2022, 48(22):269-278.
[24] 徐永霞,刘滢,姜程程,等.电子鼻结合气质联用法分析大菱鲆冷藏过程中挥发性成分变化[J].食品与发酵工业,2014,40(1):193-197.
XU Y X, LIU Y, JIANG C C, et al. Study on volatile components of turbot (Psetta maxima) by GC-MS and electronic nose[J]. Food and Fermentation Industries, 2014, 40(1):193-197.