氨基葡萄糖(glucosamine,GlcN)作为D型葡萄糖的重要衍生物之一,由葡萄糖的2号位羟基被氨基取代而形成[1]。GlcN及其多种衍生物是各类多糖的组成成分,在保健品、化妆品、医药等行业都起到重要作用[2]。GlcN和软骨素作为蛋白多糖的合成底物,已经被开发用于治疗骨关节炎,其中结晶硫酸葡萄糖胺被证明可以广泛应用于临床治疗老年人群的关节疾病[3]。其次,以GlcN和(N-acetylglucosamine,GlcNAc)为单体组成的壳寡糖还可以作为化妆品成分起到改善皮肤抗氧化的作用[4]。在分子水平中,GlcN可以通过改变游离核苷酸含量,阻断信号通路等方式实现抗氧化和抗炎活性,从而有效对抗多种癌细胞[5]。GlcNAc还能够在多个生物体中引发形态和胁迫相关刺激的反应[6]。除此之外,GlcN的衍生物GlcNAc在神经系统、免疫耐受和肿瘤转移过程中都具有重要的生物学意义[7]。
由于GlcN和GlcNAc的广泛用途,如何经济、绿色的获取GlcN和GlcNAc被广泛的研究。传统方法包括化学水解法和酶水解法。化学水解法主要是通过对甲壳素或几丁质实现去乙酰化和解聚反应合成产物GlcN和GlcNAc。酶水解法通常是利用内切几丁质酶和β-N-乙酰氨基己糖苷酶分解几丁质而合成GlcNAc单体。这两种方法存在成本较高、不稳定、原材料供应有限和容易被污染等问题[8-9]。利用基因工程改造的微生物合成GlcN和GlcNAc具有高质量和高滴度的优点并有望应用于工业生产[10]。通过对大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)等微生物进行基因工程改造,转入不同的表达质粒,从而筛选出最优的表达体系[11],这类具有代表性的生物合成方法已被广泛研究并取得了一定的研究成果。
GlcN和GlcNAc生物合成前体源于果糖-6-磷酸(fructose-6-phosphate,Fru-6-P),是糖酵解中的关键底物,经过转氨基合成氨基葡萄糖-6-磷酸(glucosamine-6-phosphate,GlcN-6-P),再转乙酰基合成N-乙酰氨基葡萄糖-6-磷酸(N-acetylglucosamine-6-P,GlcNAc-6-P),其大量合成与细胞的生长存在天然的矛盾;与此同时,以E.coli和B.subtilis为底盘菌株存在GlcN和GlcNAc的胞内转运和代谢途径,可将其转化为Fru-6-P进一步被代谢。天然状态下GlcN和GlcNAc的生物合成受到细胞内复杂的调控。目前,GlcN和GlcNAc的生物合成优化主要包括3个思路(图1):(1)GlcN 和GlcNAc合成途径的优化,通过对合成途径酶的筛选、过表达和竞争性代谢途径的抑制提高产量;(2)关键合成酶基因的动态调控,通过GlmS合酶与sRNA实现微生物生长与产物合成的动态调控;(3)菌株、关键酶的适应性进化,将产物合成与细胞生长耦联模拟自然进化方式获得有较高产物合成水平的突变个体。本文将以微生物发酵为背景,通过分析现有研究中典型基因元件的功能,从以上3个方面介绍目前GlcN和GlcNAc生物合成的研究进展,并对生物合成GlcN及GlcNAc的优势和发展前景进行展望。
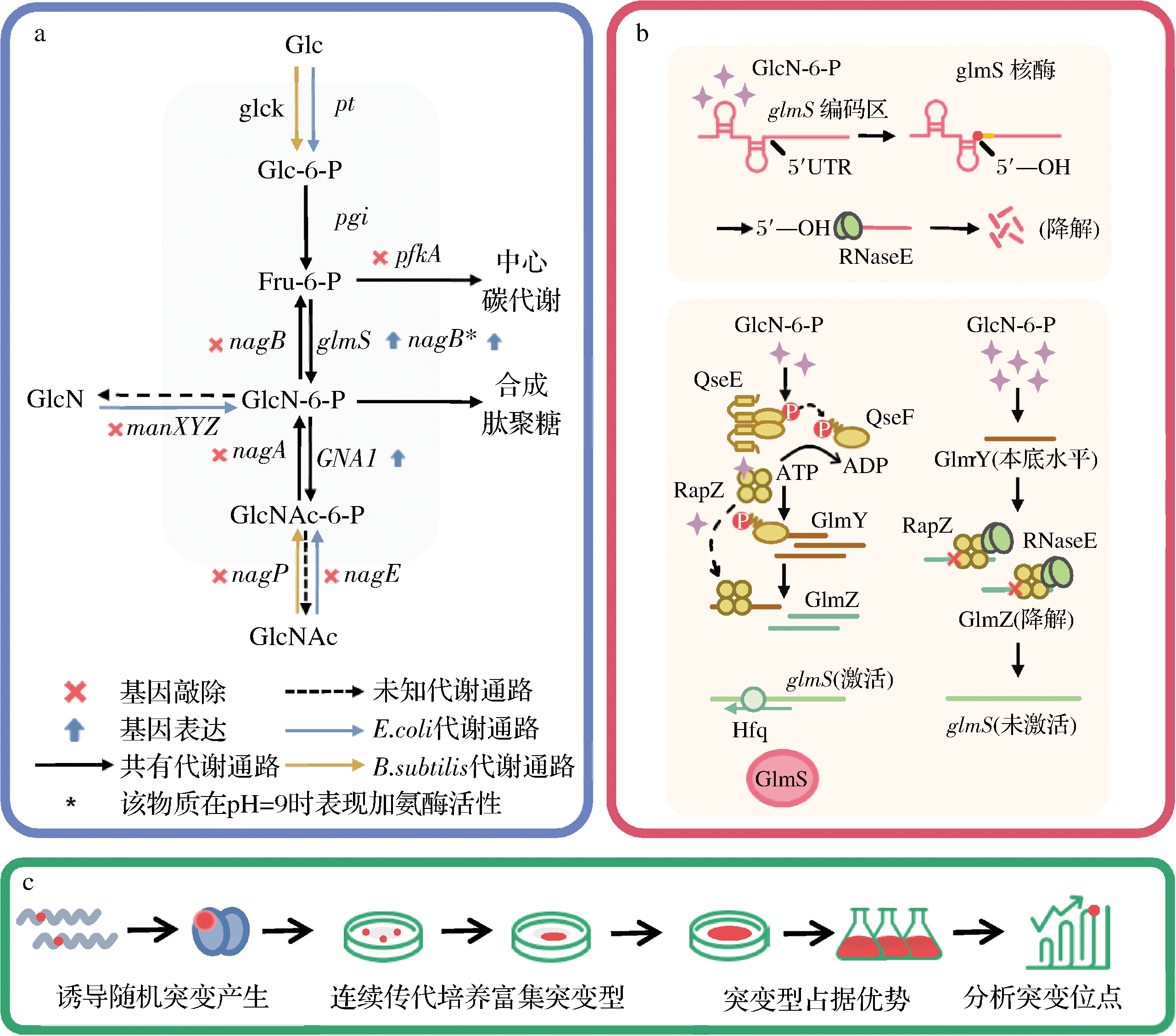
a-加强表达合成途径中的关键基因并敲除相关基因以阻断旁路途径和减少中心代谢分流;b-利用B. subtilis来源glmS核酶对GlmS的反馈调控,sRNA对E. coli的glmS基因mRNA稳定性的影响;c-通过随机突变和高通量筛选获得具有高产性状的菌株
图1 GlcN及GlcN-6-P生物合成改造的主要策略
Fig.1 Biosynthesis of GlcN and GlcN-6-P by engineering the synthetic pathway
1 GlcN合成途径概述
在代谢工程改造中,GlcN和其衍生物GlcNAc的合成通路被人们广泛研究,其中以E.coli和B.subtilis为典型代表[2]。在E.coli天然合成GlcN的通路中,葡萄糖为底物在ptsG的转运作用下利用磷酸化丙酮酸生成葡萄糖-6-磷酸(glucose-6-phosphate,Glc-6-P)。Glc-6-P再经过变构形成GlcN产物前体Fru-6-P。GlcN合成酶由glmS编码,在谷氨酰胺的协助下,可以将Fru-6-P转变为GlcN-6-P[12]。值得注意的是,E.coli胞外空间的磷酸酶可以实现去磷酸化作用,但目标产物GlcN的分泌机制仍待研究。除此之外,在GlcN合成通路中许多中间代谢产物会参与部分糖酵解代谢途径或细胞壁的合成,是维持细胞生命活动的重要组成部分[8]。
B.subtilis天然合成GlcN的通路与E.coli类似,但编码相同作用酶的具体基因略有不同。例如:在B.subtilis中葡萄糖是在glck编码的葡萄糖激酶作用下进行转运和磷酸化,生成葡萄糖-6-磷酸(Glc-6-P)[13]。其次,在E.coli和B.subtilis的GlcNAc合成中,通常都需要人工外源引入GNA1,其编码的乙酰基转移酶可以使GlcN-6-P在乙酰辅酶A作用下生成GlcNAc-6-P,从而达到减轻GlcN对宿主细胞抑制的作用。后续再次利用磷酸酶,实现去磷酸从而生成目标产物GlcNAc[14]。需要注意的是进行工程改造后的B.subtilis以GlcNAc合成为主,其中部分工程菌株发酵合成GlcNAc已经实现了产业化[15]。
2 GlcN和GlcNAc合成途径的优化
2.1 增强GlcN合成途径
目前,研究者已对GlcN代谢途径、代谢过程中涉及的酶及对应的编码基因进行了深入研究[16]。人工改造优化工程菌的GlcN合成途径是目前研究的主要方向。
GlcN在生物体内通过氨基己糖途径合成(图1-a),其中,谷氨酰胺-果糖-6-磷酸转氨酶(glutamine-fructose-6-phosphate aminotransferase,GFPT)所催化的反应是氨基己糖途径的第一步[17]。在原核生物中该转氨酶(以下简称GlmS合酶)由glmS基因编码,能以谷氨酰胺作为氨基供体催化Fru-6-P生成GlcN-6-P,是GlcN合成途径中第一个限速反应[12, 18]。DENG等[19]将含有glmS基因的载体(pT7lac-glmS)转化到E.coli 7101-17中,将GlcN水平提高到75 mg/L,比利用天然GlcN合成途径的野生型E.coli提高了15倍。此外,该反应的逆反应由nagB编码的一种氨基葡萄糖脱氨酶催化,该酶在酸性条件下脱氨反应酶活性较高,负责将GlcN-6-P转化为Fru-6-P,但是NagB在偏碱性条件下转氨酶活性较高,可催化Fru-6-P合成GlcN-6-P[20]。王珊珊等[21]尝试将重组载体pET15B-nagB转化入E.coli Rosetta,pH=9.0的发酵条件下GlcN产量提高至对照菌的2.1倍,证明NagB在特定条件下可以促进GlcN-6-P的合成。
然而,在正常的代谢合成中GlcN-6-P无法大量积累[17]。主要原因是GlcN-6-P是GlmS的有效竞争反馈抑制剂(KI=380 μmol/L,KI/Km=0.6)[12]。在B.subtilis中,由于glmS核酶的存在,GlmS合酶的合成同样受到GlcN-6-P的反馈抑制。为了缓解GlcN-6-P的抑制,DENG等[14]采用易错PCR技术对glmS基因进行筛选,获得了一种抗性glmS基因,降低GlcN-6-P浓度对GlmS酶生产的影响。在异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)诱导下,其中最好的E.coli突变株2123-54过度表达突变glmS基因产生了6 g/L GlcN,比产量为75 mg/L的野生型E.coli 2123-12菌株高20倍。
此外,实验室改造通常将glmS基因与乙酰转移酶基因GNA1共表达。GNA1可以将乙酰辅酶A的乙酰基转移到GlcN-6-P上,催化其转化为GlcNAc-6-P,最终生成GlcN的衍生物GlcNAc[22]。GlcNAc性质稳定,在酸性条件下可水解为GlcN。但E.coli、谷氨酸棒杆菌谷氨酸棒状杆菌(Corynebacterium glutamicum)和B.subtilis均不存在GNA1基因[23]。因此,异源表达GNA1和构建高表达glmS和GNA1通路是目前常见的策略。DENG等[14]将酿酒酵母(ScGNA1)、白色念珠菌(CaGNA1)和拟南芥(AtGNA1)的GNA1基因克隆到表达载体pET24d,转化入E.coli 7107-18中以合成GlcNAc,以葡萄糖为碳源,在补充酵母提取物和核糖的情况下用IPTG诱导,最终表达有ScGNA1的菌株GlcNAc水平达到11.7 g/L[14]。同年,DENG等[19]将含有nagB和GNA1的载体(pT7lac-nagB, PT7lac-GNA1)转化入glmS缺失菌株中,其GlcNAc产生水平与含有glmS(pT7lac-glmS*54)和GNA1(pT7lac-GNA1)菌株一致,证明GNA1的过表达在决定NagB催化反应的方向和效率中起到了关键作用。以葡萄糖为碳源并在乳糖诱导下,GlcNAc产量达到24.0 g/L[19]。陈欣[24]将重组质粒pET28(a)-glmS-GNA1转化入E.coli ATCC 25947 (DE3),在TB培养基中葡萄糖浓度为100 g/L,甘油体积分数为0.4%时,GlcNAc发酵产量为24.15 g/L。丁振中等[25]将pET24(a)-glmS-GNA1表达载体转化入E.coli BL21,通过优化发酵培养基,在葡糖质量浓度为150 g/L,甘油质量浓度为4 g/L时,GlcNAc发酵产量最高达到31.2 g/L。在B.subtilis中,LIU等[10]将pxylA-glmS-GNA1表达载体转化入B.subtilis 168,在木糖的诱导下GlcNAc水平为240 mg/L。
2.2 阻断旁路途径
要实现GlcN的高效合成,需要在强化GlcN合成的同时阻断GlcN降解途径,弱化中心代谢和肽聚糖合成通路,尽最大可能降低旁路对葡萄糖的消耗。在B.subtilis中,NagR作为重要的转录因子之一,由nagP和nagAB调节基因组成。前者负责GlcNAc的吸收转运,后者编码GlcNAc-6-P的脱乙酰基酶和GlcN-6-P的脱氨酶,进而促进生成Fru-6-P。而细胞内的GlcNAc-6-P的含量可以对NagR的抑制活性进行自主调节,从而控制UDP-GlcNAc合成通路的表达[26]。由于UDP-GlcNAc作为底物合成肽聚糖的通路与合成GlcN和GlcNAc通路形成竞争,在工程改造中敲除UDP-GlcNAc合成通路相关基因可以作为提高产量的方式[8]。LIU等[10]敲除重组菌B.subtilis 168-glmS-GNA1中nagP和nagAB,经过补料分批发酵,GlcNAc产量从240 mg/L提高至5.19 g/L。相同的敲除思路可以应用在E.coli的GlcN和GlcNAc的转运系统中。GlcN和GlcNAc可以分别通过由manXYZ编码的甘露糖转运系统和nagE编码的乙酰氨基葡萄糖磷酸转移系统再次进入细胞内,从而影响产物在培养液的积累[27]。陈欣[24]运用Red同源重组技术敲除重组菌E.coli-glmS-GNA1中的nagE与manX,研究其对发酵产GlcN的影响。在敲除nagE与manX后,GlcN产量从24.15 g/L提高至93.0 g/L。这表明nagE与manX基因的敲除可显著降低GlcN与GlcNAc向胞内的转运,提高GlcN 与GlcNAc在胞外的累积量。
由于GlcN的生物合成直接与中心碳代谢竞争前体供应,细胞生长和代谢的葡萄糖消耗严重限制了GlcN的产量。其中Fru-6-P是GlcN合成的关键前体,在糖酵解过程中也起着重要作用。其向代谢中心碳的碳流动是由葡萄糖合成GlcN途径产量低的主要原因。pfkA基因编码酶具有Fru-6-P的激酶活性,负责催化Fru-6-P合成果糖1,6-二磷酸(fructose-1,6-bisphosphate,fbp)[28]。MA等[29]敲除pfkA基因,以甘油/葡萄糖为碳源并引入glpK突变体提高甘油的利用率,以甘油作为碳源供细胞生长,葡萄糖为底物合成目标产物实现了混合碳源合成GlcNAc。所得菌株GLALD-7在5 L生物反应器中使用混合m(甘油)∶m(葡萄糖)=1∶8,碳源生产GlcNAc达到179.7 g/L。
3 GlcN和GlcNAc动态调控的优化
3.1 glmS核酶的动态调控
在B.subtilis中,GlmS酶可催化Fru-6-P形成GlcN-6-P[30],由响应GlcN-6-P浓度的glmS核酶对glmS基因进行顺式调控[31]。glmS核酶是一段小RNA序列,存在于GlmS mRNA的5′UTR中,可以特异性识别GlcN-6-P并与其结合[32],激活内部磷酸酯转移反应,对GlmS mRNA的5′UTR进行切割,在编码区上游暴露出5′—OH从而使mRNA被细胞内RNA酶降解,形成反馈抑制[33]。研究表明由于glmS核酶的作用,在GlcN-6-P不存在的条件下glmS基因的mRNA的自发降解速率比无核酶调控时快1 000倍以上,在GlcN-6-P存在的条件下,glmS核酶对GlcN-6-P浓度的增加呈线性反应,代谢物浓度增加10倍,核酶功能增加10倍[34]。因此,glmS核酶对GlcN-6-P的负反馈抑制是B.subtilis生产GlcN水平较低的原因之一。
为了提高细胞内GlcN-6-P积累,牛腾飞[35]敲除glmS核酶,同时在glmS基因上游整合一段trp终止子和强组成型启动子P43的序列,增强glmS基因表达的同时解除glmS核酶的反馈抑制,使B.subtilis重组菌S-5G的GlcNAc产量由9.2 g/L提升至12.2 g/L,比初始菌株转入相同质粒得到的重组菌株N6-G的产量9.2 g/L提升了3 g/L,转化率由0.106 g/g提高到0.167 g/g[36]。此外,MARTICK等[37]发现核酶引发mRNA自切割的机制不仅存在于原核生物,同样也存在于真核生物中。LEE等[38]使用酿酒酵母(Saccharomyces cerevisiae)作为实验材料,通过改造glmS核酶,将其置于编码胞嘧啶脱氨酶的FCY1基因后,构建人造核糖开关作为筛选高产GlcN-6-P菌株的标志。在氟胞嘧啶存在条件下,高产GlcN-6-P的菌株由于glmS核酶对FCY1基因的抑制体现出生长优势,筛选出的高产GlcN-6-P的菌株比原始菌株生长速率最高相差2倍以上,生物量相差5倍以上。
3.2 sRNA对代谢通路的影响
GlmS合成GlcN-6-P,可以启动细胞外被膜的生物合成[39]。在E.coli中,glmS的表达受到sRNA GlmY和GlmZ的反馈控制(图1-b)[40]。这两个sRNA高度相似,但只有GlmZ是直接激活因子,可以在Hfq蛋白的辅助下与glmS基因进行碱基配对,激活glmS的转录[40]。GlmZ的丰度由RNase的配体蛋白RapZ(原YhbJ)在衰减水平上控制[41]。当GlcN-6-P充足时,GlmZ被RapZ结合,并被RNaseE切割失活[42]。当GlcN-6-P不足时,RapZ通过相互作用刺激双组分系统QseE/QseF的磷酸化,激活glmY的表达[43]。而GlmY则通过保护GlmZ免受RapZ切割而间接激活glmS的表达[40]。GlmY和GlmZ两种RNA的相互作用被认为可以调节GlmS的合成以适应细胞的需要,即实现GlcN-6-P的稳态[42]。
GlmS是E.coli的GlcN合成代谢途径中的关键酶,sRNA对glmS基因表达的转录后调控为增强GlcN 和GlcNAc合成途径提供了新的的思路。KALAMORZ等[44]和URBAN等[45]分别发现,GlmZ和GlmY可以直接或间接调节GlmS的合成,因此过表达其中任何一种RNA都会导致glmS转录本和GlmS蛋白的积累。REICHENBACH等[46]研究表明,在yhbJ(RapZ)突变体中,glmS高效表达。此外,编码多聚(A)聚合酶PAP-I的pcnB的突变可以导致glmS mRNA的大量积累,从而导致GlmS的过量生产。DURICA等[47]观察到GlmZ的5′裂解产物(GlmZ*)在RapZ过量生产时不断积累。由于GlmZ*保留了绑定RapZ所需的所有元素。因此,GlmZ*可以取代全长的GlmZ,来抵消RapZ的切割。用sRNA嵌合体在体内模拟GlmZ*,嵌合体在体内的表达抑制了内源性GlmZ的加工,导致GlmS合成的中度上调。这一机制可能有助于调整一个强大的glmS基础表达水平。由此,可以设计与glmS调控相关的sRNA改造策略,以期为高产GlcN及其广泛应用提供支持。
4 定向进化策略在GlcN合成中的应用
GlcN的生物合成能力偏低、对产物耐受能力较差是影响产量水平提升的主要原因。尽管目前工业生产上使用的菌株已远远突破上述水平,其中大都经过系统的代谢工程技术改造和发酵优化控制。由于GlcN代谢通路的复杂性和基因工程技术的局限性,我们对基因组中能够提高GlcN产量的基因往往是难以预测和改造的,因此采用定向进化的策略来提高GlcN产量也是近年来的新兴热点[48]。研究者们利用易错PCR、定点诱变等方法诱导E.coli的GlcN通路发生随机突变,推动整体培养环境的性状向某一方向改变,进而筛选获得耐受性提升、高产GlcN的E.coli突变株(图1-c)[49-50]。
徐敏[51]以绿色木霉内切几丁质酶基因作为起始材料,利用易错PCR技术构建突变体库,通过定向进化策略和高通量筛选得到有9个碱基突变的菌株MECH118,其酶活力是原始菌株的1.81倍。LEE等[38]利用glmS核酶的切割活性,对编码胞嘧啶脱氨酶的FCY1基因的mRNA进行切割,使高产GlcN-6-P的菌株在氟胞嘧啶存在的条件下有生长优势,而GlcN-6-P产量不足的菌株生长受到抑制,以此来筛选高产GlcN-6-P的菌株。YANG等[11]采用连续易错PCR技术对glmS进行非理性改造,提升了GlmS对于产物的耐受性,通过高通量筛选方法从2 700余株克隆的文库中筛选获得一株高产GlcN的突变株,经三轮突变后,GlcN产量由初始的2.84 g/L提高到3.57 g/L,相比出发菌株提高了19%,为进一步提升E.coli发酵合成GlcN能力奠定基础。马文龙[52]通过基于易错PCR的关键酶CeGNA1在丙酮酸压力下的定向进化协同异源脲酶调控表达,筛选得到突变体CeGNA1-Q155V/C158G,使关键酶CeGNA1在丙酮酸压力下催化性能达到1.25 s-1μM-1,将GlcNAc产量提高到20.6 g/L。同时,结合特异性启动子Phag调控脲酶表达,通过尿素的可控利用缓控胞内pH,使GlcNAc产量达到25.6 g/L[52]。徐小芳等[53]在B.subtilis采用定向进化策略改造CeGNA1,解除底物GlcN-6-P对重组CeGNA1的抑制作用,使GlcN产量明显提高。MENGHIU等[30]开发了一个高通量筛选几丁质酶活性的系统。在E.coli BL21(DE3)细胞中克隆和表达了地衣芽孢杆菌几丁质酶chiA基因,并利用易错PCR方法生成了突变文库,发现了12个突变体,其活性比野生型ChiA提高超过2倍。菌株的定向进化使高产菌株能够在特定环境下存活并不断繁殖,最终成为优势菌种被筛选测序,已成为近年来研究高产菌株的新热点。
5 总结与展望
GlcN是糖蛋白、蛋白多糖和糖胺聚糖的基本氨基单糖成分,是人体内所有氨基糖的生化前体。同时,由于GlcN及其乙酰化衍生物GlcNAc在治疗疾病、生产食品和化妆品等多个领域具有很大潜力,开发其经济高效的工业化生产越来越受到人们的关注。利用生物合成手段获得高产GlcN和GlcNAc的菌株对其工业化规模化生产具有重要意义,具有良好的应用前景。目前,通过合成途径的增强和竞争性途径的阻断,GlcN的生物合成已取得了可喜的进展(表1)。由于GlcN的生物合成涉及葡萄糖摄取、关键底物Fru-6-P在糖酵解与GlcN合成之间的分配、以及细胞氮平衡等多个复杂生理过程,考虑到代谢网络的复杂性和整体性,进一步提高GlcN和GlcNAc的产量存在瓶颈。而转录及翻译水平的动态调控策略以及随机突变和高通量筛选为GlcN的生物合成优化赋予的新的动力。这些策略的应用可以有效平衡细胞生长与产物合成之间的关系,进一步的筛选获得潜在的对GlcN和GlcNAc合成有利的关键靶点。综上,GlcN和GlcNAc合成要充分利用合成生物学的工具,合理利用代谢途径中关键基因和动态调控元件,实现代谢流的有效分配,并结合定向进化的策略,以期望获得高效生产GlcN和GlcNAc的菌株。
表1 微生物发酵产GlcN及GlcNAc的14种合成策略及来源
Table 1 Fourteen biosynthetic strategies for the production of GlcN and GlcNAc by microbial fermentation and related literature resources
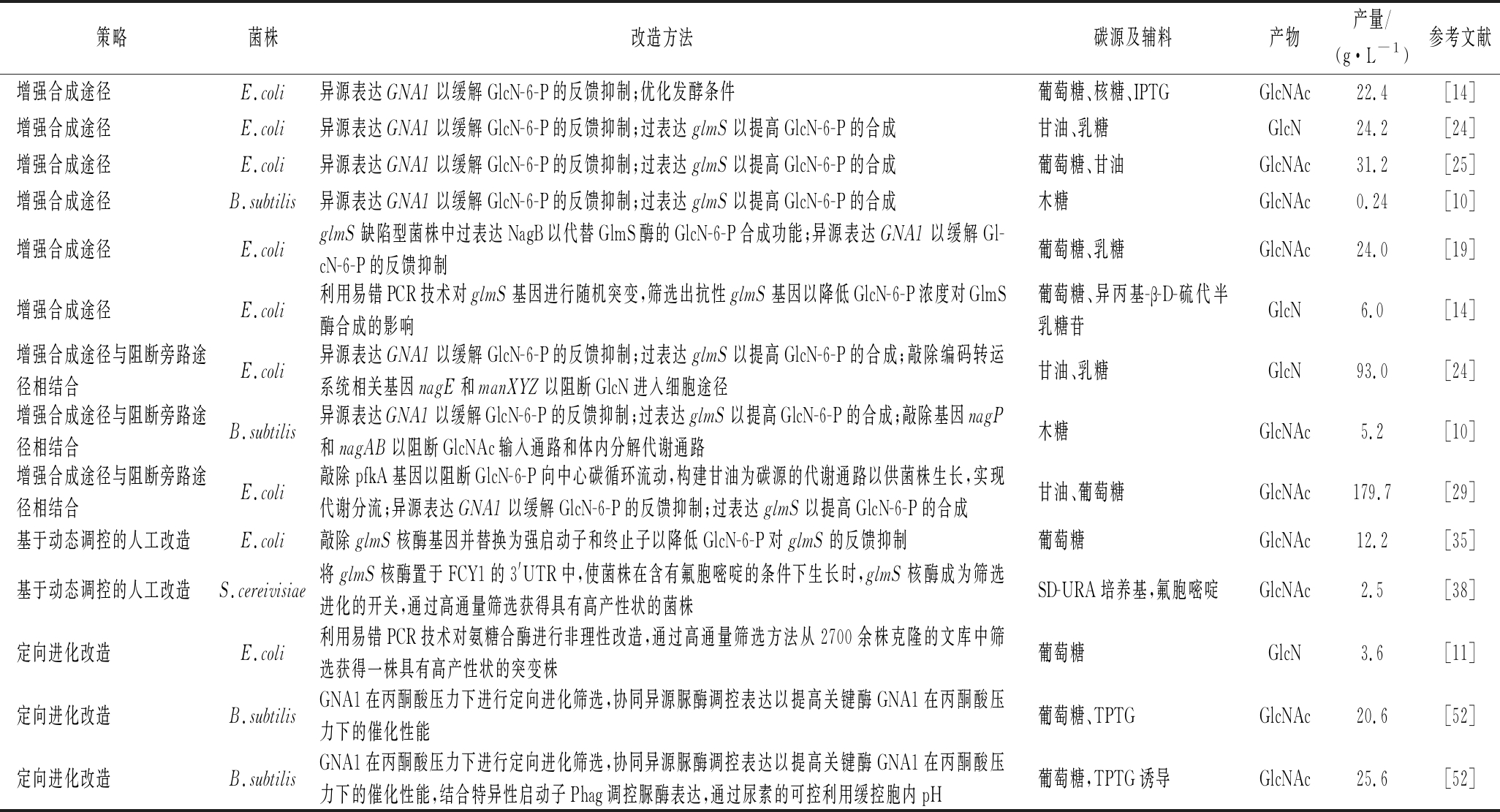
策略菌株改造方法碳源及辅料产物产量/(g·L-1)参考文献增强合成途径E.coli异源表达GNA1以缓解GlcN-6-P的反馈抑制;优化发酵条件葡萄糖、核糖、IPTGGlcNAc22.4[14]增强合成途径E.coli异源表达GNA1以缓解GlcN-6-P的反馈抑制;过表达glmS以提高GlcN-6-P的合成甘油、乳糖GlcN24.2[24]增强合成途径E.coli异源表达GNA1以缓解GlcN-6-P的反馈抑制;过表达glmS以提高GlcN-6-P的合成葡萄糖、甘油GlcNAc31.2[25]增强合成途径B.subtilis异源表达GNA1以缓解GlcN-6-P的反馈抑制;过表达glmS以提高GlcN-6-P的合成木糖GlcNAc0.24[10]增强合成途径E.coliglmS缺陷型菌株中过表达NagB以代替GlmS酶的GlcN-6-P合成功能;异源表达GNA1以缓解Gl-cN-6-P的反馈抑制葡萄糖、乳糖GlcNAc24.0[19]增强合成途径E.coli利用易错PCR技术对glmS基因进行随机突变,筛选出抗性glmS基因以降低GlcN-6-P浓度对GlmS酶合成的影响葡萄糖、异丙基-β-D-硫代半乳糖苷GlcN6.0[14]增强合成途径与阻断旁路途径相结合E.coli异源表达GNA1以缓解GlcN-6-P的反馈抑制;过表达glmS以提高GlcN-6-P的合成;敲除编码转运系统相关基因nagE和manXYZ以阻断GlcN进入细胞途径甘油、乳糖GlcN93.0[24]增强合成途径与阻断旁路途径相结合B.subtilis异源表达GNA1以缓解GlcN-6-P的反馈抑制;过表达glmS以提高GlcN-6-P的合成;敲除基因nagP和nagAB以阻断GlcNAc输入通路和体内分解代谢通路木糖GlcNAc5.2[10]增强合成途径与阻断旁路途径相结合E.coli敲除pfkA基因以阻断GlcN-6-P向中心碳循环流动,构建甘油为碳源的代谢通路以供菌株生长,实现代谢分流;异源表达GNA1以缓解GlcN-6-P的反馈抑制;过表达glmS以提高GlcN-6-P的合成甘油、葡萄糖GlcNAc179.7[29]基于动态调控的人工改造E.coli敲除glmS核酶基因并替换为强启动子和终止子以降低GlcN-6-P对glmS的反馈抑制葡萄糖GlcNAc12.2[35]基于动态调控的人工改造S.cereivisiae将glmS核酶置于FCY1的3'UTR中,使菌株在含有氟胞嘧啶的条件下生长时,glmS核酶成为筛选进化的开关,通过高通量筛选获得具有高产性状的菌株SD-URA培养基,氟胞嘧啶GlcNAc2.5[38]定向进化改造E.coli利用易错PCR技术对氨糖合酶进行非理性改造,通过高通量筛选方法从2700余株克隆的文库中筛选获得一株具有高产性状的突变株葡萄糖GlcN3.6[11]定向进化改造B.subtilisGNA1在丙酮酸压力下进行定向进化筛选,协同异源脲酶调控表达以提高关键酶GNA1在丙酮酸压力下的催化性能葡萄糖、TPTGGlcNAc20.6[52]定向进化改造B.subtilisGNA1在丙酮酸压力下进行定向进化筛选,协同异源脲酶调控表达以提高关键酶GNA1在丙酮酸压力下的催化性能,结合特异性启动子Phag调控脲酶表达,通过尿素的可控利用缓控胞内pH葡萄糖,TPTG诱导GlcNAc25.6[52]
[1] SITANGGANG, LIN S, WU H S.Aspects of glucosamine production using microorganisms[J].International Food Research Journal, 2012, 19(2):393-404.
[2] MA Q Y, GAO X Z.Categories and biomanufacturing methods of glucosamine[J].Applied Microbiology and Biotechnology, 2019, 103(19):7 883-7 889.
[3] BRUY RE O, COOPER C, AL-DAGHRI N M, et al.Inappropriate claims from non-equivalent medications in osteoarthritis:A position paper endorsed by the European society for clinical and economic aspects of osteoporosis, osteoarthritis and musculoskeletal diseases (ESCEO) [J].Aging Clinical Experimental Research, 2018, 30(2):111-117.
RE O, COOPER C, AL-DAGHRI N M, et al.Inappropriate claims from non-equivalent medications in osteoarthritis:A position paper endorsed by the European society for clinical and economic aspects of osteoporosis, osteoarthritis and musculoskeletal diseases (ESCEO) [J].Aging Clinical Experimental Research, 2018, 30(2):111-117.
[4] LIAQAT F, ELTEM R.Chitooligosaccharides and their biological activities:A comprehensive review[J].Carbohydrate Polymers, 2018, 184:243-259.
[5] ZAHEDIPOUR F, DALIRFARDOUEI R, KARIMI G, et al.Molecular mechanisms of anticancer effects of glucosamine[J].Biomedicine Pharmacotherapy, 2017, 95:1 051-1 058.
[6] MIN K, NASEEM S, KONOPKA J B.N-Acetylglucosamine regulates morphogenesis and virulence pathways in fungi[J].Journal of Fungi(Basel,Switzerland), 2019, 6(1):8.
[7] CHEN Q S, TAN Z Q, GUAN F, et al.The essential functions and detection of bisecting GlcNAc in cell biology[J].Frontiers in Chemistry, 2020, 8:511.
[8] LIU L, LIU Y F, SHIN H D, et al.Microbial production of glucosamine and N-acetylglucosamine:Advances and perspectives[J].Applied Microbiology Biotechnology, 2013, 97(14):6 149-6 158.
[9] HSIEH J W, WU H S, WEI Y H, et al.Determination and kinetics of producing glucosamine using fungi[J].Biotechnology Progress, 2007, 23(5):1 009-1 016.
[10] LIU Y F, LIU L, SHIN H D, et al.Pathway engineering of Bacillus subtilis for microbial production of N-acetylglucosamine[J].Metabolic Engineering, 2013, 19:107-115.
[11] YANG B, GONG J S, DING Z Z, et al.Directional modification of glucosamine synthase and its application in glucosamine biosynthesis[J].Genomics Applied Biology, 2018, 37(4):1 511-1 518.
[12] DURAND P, GOLINELLI P B, MOUILLERON S, et al.Highlights of glucosamine-6P synthase catalysis[J].Archives of Biochemistry and Biophysics, 2008, 474(2):302-317.
[13] LIU Y F, ZHU Y Q, LI J H, et al.Modular pathway engineering of Bacillus subtilis for improved N-acetylglucosamine production[J].Metabolic Engineering, 2014, 23:42-52.
[14] DENG M D, SEVERSON D K, GRUND A D, et al.Metabolic engineering of Escherichia coli for industrial production of glucosamine and N-acetylglucosamine[J].Metabolic Engineering, 2005, 7(3):201-214.
[15] GU Y, LYU X, LIU Y, et al.Synthetic redesign of central carbon and redox metabolism for high yield production of N-acetylglucosamine in Bacillus subtilis[J].Metabolic Engineering, 2018, 51:59-69.
[16] 王升, 李丕武, 刘佃磊, 等.利用发酵法生产氨基葡萄糖的研究进展[J].生物技术通报, 2014(1):68-74.
WANG S, LI P W, LIU D L, et al.Review on research progresses in the fermentation methods to produce glucosamine[J].Biotechnology Bulletin, 2014(1):68-74.
[17] TOURIAN A, CALLAHAN M, HUNG W.L-glutamine D-fructose-6-P aminotransferase regulation by glucose-6-P and UDP-N-acetylglucosamine[J].Neurochemical Research, 1983, 8(12):1 589-1 595.
[18] TEPLYAKOV A, OBMOLOVA G, BADET B, et al.Channeling of ammonia in glucosamine-6-phosphate synthase[J].Journal of Molecular Biology, 2001, 313(5):1 093-1 102.
[19] DENG M D, WASSINK S L, GRUND A D.Engineering a new pathway for N-acetylglucosamine production:Coupling a catabolic enzyme, glucosamine-6-phosphate deaminase, with a biosynthetic enzyme, glucosamine-6-phosphate N-acetyltransferase[J].Enzyme Microbial Technology, 2006, 39(4):828-834.
[20] SOLAR T, TURSIC J, LEGISA M.The role of glucosamine-6-phosphate deaminase at the early stages of Aspergillus niger growth in a high-citric-acid-yielding medium[J].Applied Microbiology Biotechnology, 2008, 78(4):613-619.
[21] 王珊珊, 高璐, 严明, 等.过表达氨基葡萄糖脱氨酶对大肠杆菌氨基葡萄糖合成及中心碳代谢的影响[J].生物加工过程, 2013, 11(4):42-48.
WANG S S, GAO L, YAN M, et al.Effects of overexpression glucosamine deaminase on glucosamine synthesis and central carbon metabolism in Escherichia coli[J].Chinese Journal of Bioprocess Engineering, 2013, 11(4):42-48.
[22] PENEFF C, MENGIN L D, BOURNE Y.The crystal structures of Apo and complexed Saccharomyces cerevisiae GNA1 shed light on the catalytic mechanism of an amino-sugar N-acetyltransferase[J].Journal of Biological Chemistry, 2001, 276(19):16 328-16 334.
[23] 牛腾飞, 李江华, 堵国成, 等.微生物法合成N-乙酰氨基葡萄糖及其衍生物的研究进展[J].食品与发酵工业, 2020, 46(1):274-279.
NIU T F,LI J H,DU G C,et al.Research progress on microbiological synthesis of N-acetyl-glucosamine and its derivatives[J].Food and Fermentation Industries, 2020, 46(1):274-279.
[24] 陈欣. 代谢工程改造大肠杆菌发酵生产氨基葡萄糖及过程优化与控制[D].无锡:江南大学, 2012.
CHEN X.Metabolic engineering of Escherichia coli and process optimization for microbial production of glucosamine[D].Wuxi:Jiangnan University, 2012.
[25] 丁振中, 冯小海, 张超, 等.产氨基葡萄糖工程菌的构建与发酵培养基优化[J].化工管理, 2018(3):73-75.
DING Z Z, FENG X M, ZHANG C, et al.Construction of glucosamine producing engineering bacteria and optimization of fermentation medium[J].Chemical Enterprise Management, 2018(3):73-75.
[26] GAUGUÉ I, OBERTO J, PLUMBRIDGE J.Regulation of amino sugar utilization in Bacillus subtilis by the GntR family regulators, NagR and GamR[J].Molecular Microbiology, 2014, 92(1):100-115.
[27] RACZYNSKA J, OLCHOWY J, KONARIEV P V, et al.The crystal and solution studies of glucosamine-6-phosphate synthase from candida albicans[J].Journal of Molecular Biology, 2007, 372(3):672-688.
[28] DALDAL F, FEVZI.Nucleotide sequence of gene pfkB encoding the minor phosphofructokinase of Escherichia coli K-12[J].Gene, 1984, 28(3):337-342.
[29] MA Q, SUN Q W, TAN M, et al.Highly efficient production of N-Acetyl-glucosamine in Escherichia coli by appropriate catabolic division of labor in the utilization of mixed glycerol/glucose carbon sources[J].Journal of Agricultural and Food Chemistry, 2021, 69(21):5 966-5 975.
[30] MENGHIU G, OSTAFE V, ![]() R, et al.A high-throughput screening system based on fluorescence-activated cell sorting for the directed evolution of chitinase A[J].International Journal of Molecular Sciences, 2021, 22(6):3 041.
R, et al.A high-throughput screening system based on fluorescence-activated cell sorting for the directed evolution of chitinase A[J].International Journal of Molecular Sciences, 2021, 22(6):3 041.
[31] 周丁, 王倩, 祁庆生.glmS核糖开关研究进展[J].微生物学报, 2017, 57(8):1 152-1 159.
ZHOU D, WANG Q, QI Q S.Research progress in glmS riboswitch[J].Acta Microbiologica Sinica, 2017, 57(8):1 152-1 159.
[32] COCHRANE J C, LIPCHOCK S V, SMITH K D, et al.Structural and chemical basis for glucosamine 6-phosphate binding and activation of the glmS ribozyme[J].Biochemistry, 2009, 48(15):3 239-3 246.
[33] COLLINS J A, IRNOV I, BAKER S, et al.Mechanism of mRNA destabilization by the glmS ribozyme[J].Genes & Development, 2007, 21(24):3 356-3 368.
[34] WINKLER W C, NAHVI A, ROTH A, et al.Control of gene expression by a natural metabolite-responsive ribozyme[J].Nature, 2004, 428(6 980):281-286.
[35] 牛腾飞. 系统代谢工程改造枯草芽孢杆菌合成N-乙酰氨基葡萄糖[D].无锡:江南大学, 2020.
NIU T F.Systems metabolic engineering of Bacillus subtilis for N-acetylglucosamine production[D].Wuxi:Jiangnan University, 2020.
[36] NIU T F, LIU Y F, LI J H, et al.Engineering a glucosamine-6-phosphate responsive glmS ribozyme switch enables dynamic control of metabolic flux in Bacillus subtilis for overproduction of N-acetylglucosamine[J].ACS Synthetic Biology, 2018, 7(10):2 423-2 435.
[37] MARTICK M, HORAN L H, NOLLER H F, et al.A discontinuous hammerhead ribozyme embedded in a mammalian messenger RNA[J].Nature, 2008, 454(7 206):899-902.
[38] LEE S W, OH M K.A synthetic suicide riboswitch for the high-throughput screening of metabolite production in Saccharomyces cerevisiae[J].Metabolic Engineering, 2015, 28:143-150.
[39] KHAN M A, GÖERKE B.A multifunctional small RNA binding protein for sensing and signaling cell envelope precursor availability in bacteria[J].Microbial Cell(Graz,Austria), 2020, 7(5):139-142.
[40] GÖPEL Y, PAPENFORT K, REICHENBACH B, et al.Targeted decay of a regulatory small RNA by an adaptor protein for RNase E and counteraction by an anti-adaptor RNA[J].Genes & Development, 2013, 27(5):552-564.
[41] GÖPEL Y, KHAN M A, GÖRKE B.MÉnage  trois:Post-transcriptional control of the key enzyme for cell envelope synthesis by a base-pairing small RNA, an RNase adaptor protein, and a small RNA mimic[J].RNA Biology, 2014, 11(5):433-442.
trois:Post-transcriptional control of the key enzyme for cell envelope synthesis by a base-pairing small RNA, an RNase adaptor protein, and a small RNA mimic[J].RNA Biology, 2014, 11(5):433-442.
[42] KHAN M A, GÖPEL Y, MILEWSKI S, et al.Two small RNAs conserved in enterobacteriaceae provide intrinsic resistance to antibiotics targeting the cell wall biosynthesis enzyme glucosamine-6-phosphate synthase[J].Frontiers in Microbiology, 2016, 7:908.
[43] KHAN M A, DURICACMITIC S, GÖPEL Y, et al.Small RNA-binding protein RapZ mediates cell envelope precursor sensing and signaling in Escherichia coli[J].The EMBO Journal, 2020, 39(6):e103848.
[44] KALAMORZ F, REICHENBACH B, M RZ W, et al.Feedback control of glucosamine-6-phosphate synthase GlmS expression depends on the small RNA GlmZ and involves the novel protein YhbJ in Escherichia coli[J].Molecular microbiology, 2007, 65(6):1 518-1 533.
RZ W, et al.Feedback control of glucosamine-6-phosphate synthase GlmS expression depends on the small RNA GlmZ and involves the novel protein YhbJ in Escherichia coli[J].Molecular microbiology, 2007, 65(6):1 518-1 533.
[45] URBAN J H, KAI P, THOMSEN J, et al.A conserved small RNA promotes discoordinate expression of the glmUS operon mRNA to activate GlmS synthesis[J].Journal of Molecular Biology, 2007, 373(3):521-528.
[46] REICHENBACH B, MAES A, KALAMORZ F, et al.The small RNA GlmY acts upstream of the sRNA GlmZ in the activation of glmS expression and is subject to regulation by polyadenylation in Escherichia coli[J].Nucleic Acids Research, 2008, 36(8):2 570-2 580.
[47] DURICA M S, GÖRKE B.Feedback regulation of small RNA processing by the cleavage product[J].RNA Biology, 2019, 16(8):1 055-1 065.
[48] WANG Y J, XUE P, CAO M F, et al.Directed evolution:Methodologies and applications[J].Chemical Reviews, 2021, 121(20):12 384-12 444.
[49] SEN S, VENKATA DASU V, MANDAL B.Developments in directed evolution for improving enzyme functions[J].Applied and Biochemistry Biotechnology, 2007, 143(3):212-223.
[50] CHEN J, HUANG J M, YAN T H, et al.Progress in the construction and screening of random mutation library[J].Chinese Journal of Biotechnology, 2021, 37(1):163-177.
[51] 徐敏. 几丁质酶的体外定向进化研究[D].杭州:浙江工商大学, 2011.
XU M.Direct evolution of endochitinase[D].Hangzhou:Zhejiang Gongshang University, 2011.
[52] 马文龙. 中心代谢优化促进枯草芽孢杆菌积累N-乙酰氨基葡萄糖[D].无锡:江南大学, 2018.
MA W L.Central metabolic pathways optimization to improve GlcNAc production in Bacillus subtilis[D].Wuxi:Jiangnan University, 2018.
[53] 徐小芳, 刘延峰, 李江华, 等.乙酰氨基葡萄糖合成关键酶氨基葡萄糖-6-磷酸乙酰转移酶的筛选及酶学性质分析[J].食品与生物技术学报, 2019, 38(12):73-84.
XU X F, LIU Y F, LI J H, et al.Screening of glucosamine-6-phosphate N-acetyltransferase for N-acetylglucosamine production and enzyme kinetics analysis[J].Journal of Food Science and Biotechnology, 2019, 38(12):73-84.